长链非编码RNARP11‑224O19.2抑制剂的用途的制作方法
本发明属于分子生物学领域,具体涉及一种长链非编码rnarp11-224o19.2抑制剂在制备治疗肿瘤的药物中的用途。
背景技术:
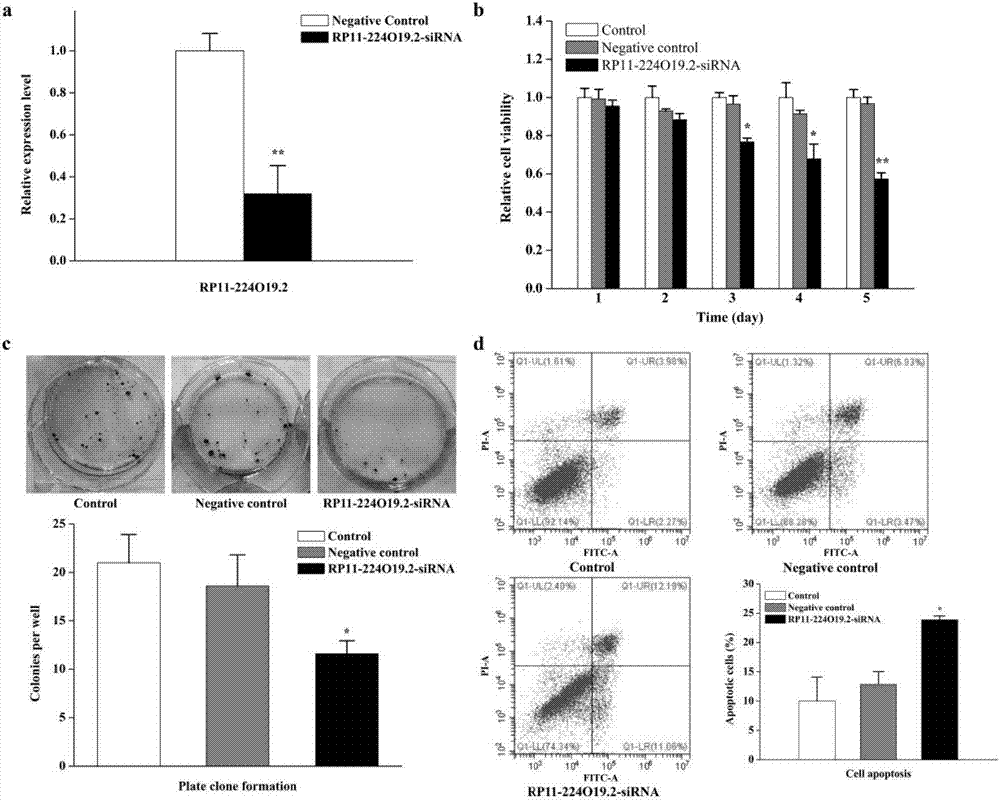
:肝癌是一种具有转移率高、病死率高、预后差的高度恶性肿瘤,对人类健康和生命造成严重威胁。肝癌的病因至今尚不完全明确,一般认为诱因包括慢性乙型和丙型肝炎病毒感染、酒精滥用、毒物污染食物的摄入等。目前,肝癌的主要治疗手段有肝移植、手术切除、放疗、化疗和靶向治疗,肝癌患者的短期存活率有一定增加,但总体死亡率和术后复发率仍然居高不下。长链非编码rna(longnoncodingrna,lncrna)是一类内源性长度超过200个核苷酸的非编码rna分子,起初它被认为是基因组转录的“噪音”,不具有生物学功能。越来越多的证据表明,lncrna是一类具有重要生物学功能的rna,能够在表观遗传、转录和转录后水平通过介导dna甲基化、组蛋白修饰、染色质重塑等生物学过程来发挥调控功能。rp11-224o19.2是一种长链非编码rna,位于第1号染色体chr1:218517538-218519020,hg19,基因序列长度为1483bp,转录本长度为557bp。目前rp11-224o19.2的功能尚未见报道。技术实现要素:本发明的目的在于提供一种长链非编码rnarp11-224o19.2抑制剂在制备治疗肿瘤的药物中的用途及治疗肿瘤的药物。rp11-224o19.2抑制剂:为抑制rp11-224o19.2表达的物质,包括阻断和/或干扰rp11-224o19.2表达的化合物、核苷酸序列等。本发明提供了一种长链非编码rnarp11-224o19.2抑制剂在制备治疗肿瘤的药物中的用途。其中,所述治疗肿瘤的药物为抑制rp11-224o19.2表达的药物。进一步地,所述抑制rp11-224o19.2表达的药物为sirna药物。其中,所述sirna的核苷酸序列如seqidno:1所示。sirna为双链分子,其中,seqidno:1所示的序列为正向序列。seqidno:2所示的序列为反向序列。seqidno:1:gcaugacucugcagccauattseqidno:2:uauggcugcagagucaugctt其中,所述治疗肿瘤的药物为治疗肝癌的药物。本发明还提供了一种治疗肿瘤的药物,它是以rp11-224o19.2抑制剂为活性成分,加上学上可接受的辅料或者辅助性成分制备而成的制剂。其中,所述rp11-224o19.2抑制剂为抑制rp11-224o19.2表达的药物。其中,所述抑制rp11-224o19.2表达的药物为sirna药物。和/或,所述治疗肿瘤的药物为治疗肝癌的药物。其中,所述sirna的核苷酸序列如seqidno:1所示。本发明还提供了一种sirna分子,序列如seqidno:1所示。本发明还提供了检测rp11-224o19.2表达的试剂在制备肝癌筛查和/或肝癌预后诊断的试剂中的用途。本发明还提供了一种肝癌筛查和/或肝癌预后诊断的试剂盒,它包含任选的用于检测rp11-224o19.2表达水平的试剂。本研究发现,抑制rp11-22o19.2表达能够显著抑制肿瘤细胞的增殖、克隆形成、迁移和侵袭并诱导细胞凋亡,降低tgfb2表达水平,从而达到治疗肿瘤的效果,尤其对肝癌治疗效果显著,小分子rp11-224o19.2sirna可以作为靶向肿瘤的药物,应用前景良好。另外,通过检测rp11-224o19.2的表达水平,可以筛查待检人群患肝癌的风险,及对肝癌患者的预后情况做出预测,可用于临床肝癌的辅助诊断及预后判断。显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。附图说明图1下调rp11-224o19.2的表达抑制hepg2细胞的增殖、克隆形成并诱导凋亡。a:转染sirna后显著地下调rp11-224o19.2的表达,b:下调rp11-224o19.2抑制hepg2细胞的增殖,c:下调rp11-224o19.2抑制hepg2细胞的克隆形成,d:下调rp11-224o19.2诱导hepg2细胞的凋亡图2下调rp11-22o19.2的表达抑制hepg2细胞的迁移和侵袭。细胞划痕实验(a)和transwell细胞迁移实验(b)表明hepg2细胞的迁移能力在rp11-224o19.2下调后被抑制了,c:transwell细胞侵袭实验表明下调rp11-224o19.2的表达抑制hepg2细胞的侵袭。图3rp11-224o19.2调控机制的初步研究。a:gse77314数据集的分析结果表明tgfb2在肝癌中上调,b:tcga数据集验证了tgfb2的上调,c:tgfb2的表达量在rp11-224o19.2被干扰后显著地下调了图4rp11-224o19.2在肝癌组织中表达上调并与肿瘤大小密切相关。gse77509(a)和tcga(b)数据集的分析结果表明rp11-224o19.2在肝癌组织中上调,gse77509(c)和tcga(d)数据集的分析结果表明rp11-224o19.2能作为生物标记物将肝癌组织和正常组织区分开,e:根据rp11-224o19.2的相对表达量将50个临床病例分为高表达和低表达组,f:高表达的rp11-224o19.2与更高阶的肿瘤大小分期相关。具体实施方式下面以实施例作进一步说明,但本发明不局限于这些实施例。实施例1靶向于rp11-224o19.2的sirna设计及筛选1、靶向于rp11-224o19.2的sirna设计与合成靶向于rp11-224o19.2的sirna及其相应的对照sirna(negativecontrolsirna)由我们自行设计,序列见表2,然后委托公司合成双链的sirna序列。2、实验分组及细胞转染实验分组:根据不同的处理条件将细胞分为3组,实验组(rp11-224o19.2-sirna组)为转染了干扰效率高的sirna的hepg2细胞;阴性对照组(negativecontrolsirna组)为转染了阴性对照sirna的hepg2细胞;空白组(control组)为不进行任何处理的hepg2细胞。hepg2细胞常规培养操作如下:1)细胞复苏:肝癌hepg2细胞由本实验室保存,从液氮罐中小心地取出冻存的hepg2细胞冻存管,迅速置于37℃的恒温水浴锅(金城国胜实验仪器厂)中,将冻存管缓慢摇晃使其迅速解冻。解冻完成后迅速将细胞转移到含有5ml10%fbs(法国biowest公司)dmem培养基(美国gibco公司)的10ml离心管中,用5ml移液枪(美国thermo公司)轻轻吹打细胞悬液使其充分混匀。将10ml离心管放入高速冷冻离心机(德国hermle公司)中以1200r/min离心5min。离心后小心地将上清液吸弃,用5ml10%fbsdmem培养液重悬沉淀的细胞,转移至10cm的细胞培养板(美国corning公司)中并补齐培养液至10ml,将培养板置于37℃含有5%co2的恒温细胞培养箱(日本panasonic公司)中培养,次日更换细胞培养液,继续培养。2)细胞传代:当在倒置显微镜(日本olympus公司)下观察到hepg2细胞的生长密度达到80%-90%时,细胞需要进行传代,将所有仪器设备准备完毕后,将细胞培养板置于超净工作台。首先将培养板中的旧培养基吸弃,用4ml无菌的pbs洗2次后加入1ml0.25%的胰酶(美国thermo公司)后迅速置于恒温培养箱中进行消化。消化1min后在倒置显微镜下观察细胞形态,当观察到细胞变圆并漂浮流动时,立即用5ml10%fbsdmem培养液终止消化,用5ml移液枪充分吹下细胞并将其转移到10ml离心管中,放入高速冷冻离心机中以1200r/min离心5min。离心后小心地吸弃上清液,用5ml10%fbsdmem培养液重悬沉淀的细胞,将细胞悬液一分为二后转移至10cm的细胞培养板中并补齐培养液至10ml,将培养板置于37℃含有5%co2的恒温细胞培养箱中培养。细胞转染:操作步骤如下:1)将生长状态良好并处于对数生长期的肝癌hepg2细胞消化计数后,按3×105个/孔的接种密度将细胞接种于6孔板中,置于恒温细胞培养箱中培养;2)第二天待细胞密度达到80%左右时,吸弃旧培养基,用pbs洗2次,每孔加入1.5ml无双抗的10%fbsdmem培养基;3)转染试剂配置:对于每一个孔的转染试剂的配置,取两个洁净无菌的1.5mlep管,先用250μl无双抗的dmem培养基稀释5μl浓度为100μm的sirna并轻轻混匀,然后再用250μl无双抗的dmem培养基稀释5μllipofectaminetm6000转染试剂(上海碧云天生物公司)并轻轻混匀,在室温环境下静置5min;4)静置5min后,将sirna稀释后加入到含有lipofectaminetm6000转染试剂的培养基中并轻轻混匀,在室温环境下静置20min;转染时,保证sirna的终浓度为50nm,lipofectamine6000的用量取决于sirna的用量,保证lipofectamine6000的体积和sirna的体积一样;5)静置20min后,将混匀后的混合物均匀地加入到各孔中,轻轻摇晃混匀,放入恒温细胞培养箱中培养;6)培养6h后,先将旧培养基吸弃,用pbs洗2次,每孔加入2ml含双抗的10%fbsdmem培养基,置于恒温细胞培养箱中继续培养48h;7)转染好的细胞用于后续的实验。3、提取各组的总rna并逆转为cdna总rna提取:转染48h后收集细胞。用提前预冷的depc(江苏凯基生物公司)处理的pbs洗2次,之后6孔板中每孔都加入1mltrizol试剂(美国invitrogen公司)并反复吹打充分裂解细胞,随后将细胞裂解液转入无菌无酶的1.5mlep管中。按照trizol试剂的使用说明书进行总rna的提取,提前将高速冷冻离心机预冷至4℃。首先向1.5mlep管中加入200μl氯仿(成都科龙化工),加入后立即上下颠倒并用力摇晃,混匀后将ep管放在冰山静置10min。接下来将ep管放入高速冷冻离心机中以4℃、12000r/min离心15min,离心后ep管中液体分为三层。用移液枪小心地吸取400μl的水相rna到另一无酶的1.5mlep管中,注意枪头不要伸的太下,防止dna污染。以等体积的比例加入异丙醇(成都科龙化工)400μl,上下颠倒几次而充分混匀,冰上放置10min。将1.5mlep管放入高速冷冻离心机中以4℃、12000r/min离心10min。弃上清液,加入提前预冷的1ml75%的乙醇,冰上放置10min,充分洗涤沉淀。将1.5mlep管放入高速冷冻离心机中以4℃、12000r/min离心5min,用枪头将上清液吸弃。敞开ep管,室温晾干后加入30μl的depc处理水,室温下充分溶解沉淀。rna纯度、浓度检测:取1μlrna在酶标仪上进行rna纯度和浓度的检测,本底为depc水,rna纯度以od260/od280=1.8-2.0为合格,将rna纯度和浓度数据保存好。rna完整性检测:提前将制胶模具和梳子用二次蒸馏水洗好并组装好,待模具干燥后组装起来,加入提取制好的1%琼脂糖凝胶(已加核酸染料),待凝胶凝固后放入电泳槽中(北京六一仪器厂),加入0.5×tbe电泳液(北京天根生物公司)没过胶面。取1μlrna和1μl10×loadingbuffer(北京天根生物公司)以及1μldepc水混匀,用移液枪将混匀后的rna加入到样品槽中,用电压80v电泳20min。电泳完成后在genegenius凝胶成像分析系统(美国syngene公司)中观察电泳条带并拍照。rna逆转录:rna逆转录使用美国invitrogen公司的m-mlv第一链合成试剂盒,根据试剂盒的使用说明选择建立20μl的反应体系(可逆转录1ng-5μg总rna),并按照试剂盒使用说明书进行实验操作。将以下组分加入无核酸酶的微量pcr离心管中:各组分加入后立即瞬离混匀,然后将微量pcr管放入pcr仪(美国appliedbiosystems公司)以65℃孵育5min,完成后迅速置于冰上冷却2min以上。之后在每个微量pcr管中加入如下组分:各组分加入后瞬离混匀,在37℃下孵育2min,随后加入1μlm-mlv逆转录酶,再瞬离混匀。将微量pcr管放入pcr仪中并设置好如下程序,先在25℃孵育10min,然后在37℃孵育50min,最后在70℃加热15min以终止反应。将逆转好的cdna放于-80℃冰箱保存。4、荧光定量pcr检测sirna荧光定量pcr引物设计:利用ncbi网站的引物设计软件“primerblast”对rp11-224o19.2以及内参gapdh的引物进行设计,tm值均设定在60℃左右。引物详细信息如表1。表1rp11-224o19.2和gapdh的qrt-pcr引物rp11-224o19.2的相对定量:将转染了不同sirna的各组的cdna模板稀释1倍作为实时荧光定量pcr的cdna模板(三个重复孔),选择三步扩增法进行实验,退火温度均为60℃,设置40个循环,每个样品三次平行重复,荧光定量pcr实验所用的试剂盒为faststartessentialdnagreenmaster(瑞士罗氏公司)。反应体系如下(反应体系为14μl):实时荧光定量pcr的程序设置如下:5、sirna筛选结果在靶向于rp11-224o19.2的sirna的筛选中,我们发现转染了其中一组sirna的rp11-224o19.2的表达量(数值为0.319385312±0.133813761)较阴性对照组(表达数值为1.000000003±0.082696094)显著下降了(下调了70%,见图1a),表明这条sirna对rp11-224o19.2的干扰效率达到70%,干扰效果良好,因此我们将其命名为rp11-224o19.2-sirna(见表2)。表2筛选得到的sirna和相应的对照sirna的序列因此,本发明设计的sirna序列对rp11-224o19.2的干扰效率高,可用于高效抑制rp11-224o19.2表达。实施例2靶向于rp11-224o19.2的sirna用于治疗肝癌本实验采用转染sirna的方式抑制rp11-224o9.2的表达,验证其对肝癌的作用。一、抑制rp11-224o19.2对肝癌细胞增殖、克隆形成和凋亡的影响1、cck8实验检测hepg2细胞增殖实验步骤如下:1)将转染好的实验组和阴性对照组的hepg2细胞以及未处理的空白组的hepg2细胞按照3000个/孔的铺板密度铺板于96孔板中,每个96孔板设置6孔实验组、6孔阴性对照组和6孔空白组,另设6孔只加培养基进行调零,一共接种5个96孔板,铺板完成后将96孔板放入培养箱中培养;2)按照预定的实验计划,细胞分别培养24h、48h、72h、96h和120h后,取出96孔板,吸弃旧培养基,每孔避光加入含有10%cck8的新鲜培养基100μl,放入培养箱中孵育1.5h;3)孵育完成后,使用酶标仪在450nm处检测各孔的吸光度(od450值);4)每组都先用调零孔的平均od450值进行调零,然后计算每组的平均od450值,细胞存活率=实验组(阴性对照组)平均od450值/空白组平均od450值×100%。实验结果见表3和图1b。表3rp11-224o19.2-sirna对hepg2细胞增殖的影响可见,与空白组和阴性对照组相比,转染了rp11-224o19.2-sirna的hepg2细胞的增殖能力在转染铺板后的第3天开始被显著抑制,随着时间的延长,抑制作用更加显著,差异具有统计学意义(p<0.05),说明了hepg2细胞的增殖能力在转染了rp11-224o19.2-sirna后被显著削弱。因此抑制rp11-224o19.2可以显著抑制肝癌细胞的增殖,rp11-224o19.2的抑制剂可以用于治疗肝癌。2、平板克隆形成实验检测hepg2细胞形成克隆的能力实验步骤如下:1)将转染好的实验组和阴性对照组的hepg2细胞以及未处理的空白组的hepg2细胞按照200个/孔的铺板密度分别铺板于不同的6孔板中,每个实验分组接种1个6孔板;2)铺板完成后,每孔补加培养基至5ml,轻轻摇晃培养板使细胞均匀分散,放于培养箱培养2-3周;3)每隔3天观察一次,当每个孔板出现肉眼可见的克隆时终止培养,吸弃旧培养基,用pbs洗2次;4)用4%多聚甲醛固定30min,吸弃固定液;5)每孔加入1ml的0.1%结晶紫进行染色,染色时间为20min;6)染色完成后,吸弃染色液,用pbs冲洗,室温下干燥;7)拍照,对肉眼可见的克隆数目进行统计。实验结果见表4和图1c。表4rp11-224o19.2-sirna对hepg2细胞克隆形成的影响组别克隆数空白对照组control21±2.915475947阴性对照组negativecontrol18.6±3.209361307rp11-224o19.2-sirna组11.6±1.341640786可见,与空白组和阴性对照组相比,转染了rp11-224o19.2-sirna的hepg2细胞所形成的克隆数量显著减少,差异具有统计学意义(p<0.05),这说明hepg2细胞在转染了rp11-224o19.2-sirna后其增殖能力明显减弱。因此抑制rp11-224o19.2可以显著抑制肝癌细胞的克隆形成能力,进而抑制肝癌细胞的增殖,rp11-224o19.2的抑制剂可以用于治疗肝癌。3、细胞凋亡实验检测hepg2细胞凋亡实验步骤如下:细胞凋亡使用流式细胞仪(美国beckmancoulter公司)进行检测,所用的凋亡试剂盒为annexin-v-fluosstainingkit(瑞士roche公司),本次检测由成都里来生物公司协助完成。将处于对数生长期的hepg2细胞以3×105个/孔的密度铺于6孔板中,待细胞长至80%左右时进行细胞转染,空白组不处理,阴性对照组转染negativecontrolsirna,实验组转染rp11-224o19.2-sirna,转染48h后分别收集各组细胞。将各组细胞以1200r/min离心5min,吸弃上清;各组细胞加入500μlpbs洗涤,以1200r/min离心5min,吸弃上清。将annexin-v-fluos、碘化丙啶(pi)、bindingbuffer缓冲液以1:1:48混匀,避光放置,作为工作液;取空白组、阴性对照组和实验组分别加入100μl工作液,避光孵育10min;再加入300μlbindingbuffer重悬,上机检测。实验结果见表5和图1d。表5rp11-224o19.2-sirna对hepg2细胞凋亡的影响组别克隆数空白对照组control10.02333333±4.084242076阴性对照组negativecontrol12.86333333±2.181291666rp11-224o19.2-sirna组23.87333333±0.657292426可见,与空白组和阴性对照组相比,转染了rp11-224o19.2-sirna的hepg2细胞凋亡率显著提高,差异具有统计学意义(p<0.05),这说明rp11-224o19.2表达下调后可促进hepg2细胞凋亡。因此抑制rp11-224o19.2可以显著促进肝癌细胞的凋亡,rp11-224o19.2的抑制剂可以用于治疗肝癌。二、抑制rp11-224o19.2对肝癌细胞迁移和侵袭能力的影响1、细胞划痕实验检测hepg2细胞的体外迁移能力实验步骤如下:将转染好的实验组和阴性对照组的hepg2细胞以及未处理的空白组的hepg2细胞以3×105个/孔的铺板密度铺于6孔板中,每个实验分组铺1个6孔板。待细胞长至90%左右时,用10μl的无菌枪头在每个孔中均匀地划3条直线,用pbs轻轻的洗去划落的细胞,加入2ml不含血清的培养基进行培养。分别在划痕后0h、24h和48h在倒置显微镜(日本olympus公司)下观察并拍照,计算不同细胞分组的相对迁移距离,相对迁移距离=0h划痕的宽度-24h(48h)划痕的宽度。实验结果见表6和图2a。表6细胞划痕实验考察对hepg2细胞体外迁移能力的影响可见,与空白组和阴性对照组相比,rp11-224o19.2表达被抑制后能显著地抑制hepg2细胞的体外迁移能力,差异具有统计学意义(p<0.001),这说明hepg2细胞在转染了rp11-224o19.2-sirna后其迁移能力明显减弱。因此抑制rp11-224o19.2可以显著地抑制hepg2细胞的体外迁移,rp11-224o19.2的抑制剂可以用于治疗肝癌。2、transwell细胞迁移实验检测hepg2细胞的体外迁移能力实验步骤如下:将转染好的实验组和阴性对照组的hepg2细胞以及未处理的空白组的hepg2细胞用无血清的培养基重悬,并将其密度调整为5×104个/ml,取200μl细胞悬液加入到transwell小室(美国corning公司)的上室中,并在下室中加入500μl含20%fbs的培养基,在培养箱中培养24h后取出。先将小室中的旧培养基吸弃,用pbs洗几次,然后用干净棉签轻轻地擦去上室中未迁移的细胞。接下来在室温环境下用4%多聚甲醛固定30min,固定后用0.1%结晶紫染色20min,再用pbs洗几次。最后在倒置显微镜下观察并拍照,计算迁移到下室的细胞个数。实验结果见表7和图2b。表7transwell细胞迁移实验考察对hepg2细胞迁移的影响组别迁移细胞数空白对照组control236±13.11487705阴性对照组negativecontrol232.6666667±11.01514109rp11-224o19.2-sirna组126±6可见,在rp11-224o19.2表达下调后,hepg2细胞的体外迁移能力与空白组和阴性对照组相比被明显地削弱了,差异具有统计学意义(p<0.01),这说明hepg2细胞在rp11-224o19.2表达下调后其体外迁移能力明显减弱了。因此抑制rp11-224o19.2可以显著地抑制hepg2细胞的体外迁移,rp11-224o19.2的抑制剂可以用于治疗肝癌。3、transwell细胞侵袭实验检测hepg2细胞的体外侵袭能力实验步骤如下:提前将基质胶matrigel(美国bd公司)放入4℃冰箱中过夜融化,将matrigel按1:8的比例用dmem稀释,每个transwell小室中加入100μl稀释后的matrigel进行包被,放入培养箱中孵育过夜。将转染好的实验组和阴性对照组的hepg2细胞以及未处理的空白组的hepg2细胞用无血清的培养基重悬,并将其密度调整为5×104个/ml,取200μl细胞悬液加入到transwell小室的上室中,并在下室中加入500μl含20%fbs的培养基,在培养箱中培养24h后取出。先将小室中的旧培养基吸弃,用pbs洗几次,然后用干净棉签轻轻地擦去上室中未迁移的细胞。接下来在室温环境下用4%多聚甲醛固定30min,固定后用0.1%结晶紫染色20min,再用pbs洗几次。最后在倒置显微镜下观察并拍照,计算侵袭到下室的细胞个数。实验结果见表8和图2c。表8transwell细胞侵袭实验考察对hepg2细胞体外侵袭能力的影响组别侵袭细胞数空白对照组control256±14.4222051阴性对照组negativecontrol251±13rp11-224o19.2-sirna组109.3333333±4.163331999可见,实验结果表明与空白组和阴性对照组相比,hepg2细胞的体外侵袭能力在rp11-224o19.2表达下调后被显著地抑制了,差异具有统计学意义(p<0.01),这说明hepg2细胞在rp11-224o19.2表达下调后其侵袭能力明显减弱。因此抑制rp11-224o19.2可以显著地抑制hepg2细胞的体外侵袭,rp11-224o19.2的抑制剂可以用于治疗肝癌。综上,靶向rp11-224o19.2的sirna可以有效抑制rp11-224o19.2表达,进而抑制肝癌细胞的增殖、克隆形成、迁移和侵袭并诱导细胞凋亡,rp11-224o19.2的抑制剂对肝癌的治疗效果显著。三、抑制rp11-224o19.2对tgfb2的表达水平影响1、tgfb2在肝癌中的表达tgfb2的表达量分别提取自数据集gse77314和tcga数据库中肝癌的rna-seq表达量文件。通过对下载的rna-seq表达量文件比较分析发现,tgfb2在肝癌组织中的表达量显著高于正常组织(图3a)。此外,筛选自tcga数据库中肝癌的rna-seq表达量文件的分析结果进一步证实了tgfb2在肝癌组织中表达上调(图3b)。2、荧光定量pcr方法检测rp11-224o19.2表达量下调后的tgfb2表达量取按照实施例1方法提取的rna制备的两种cdna,即转染rp11-224o19.2-sirna的hepg2细胞组和转染了negativecontrolsirna的阴性hepg2细胞对照组。然后荧光定量pcr方法检测tgfb2表达水平。引物设计:利用ncbi网站的引物设计软件“primerblast”对tgfb2以及内参gapdh的引物进行设计,引物详细信息如表9。表9tgfb2和gapdh的qrt-pcr引物tgfb2的相对定量:将不同分组的cdna模板稀释1倍作为实时荧光定量pcr的cdna模板(三个重复孔),选择三步扩增法进行实验,退火温度均为60℃,设置40个循环,每个样品三次平行重复,荧光定量pcr实验所用的试剂盒为faststartessentialdnagreenmaster(瑞士罗氏公司)。反应体系如下(反应体系为14μl):实时荧光定量pcr的程序设置如下:3、rp11-224o19.2抑制后的tgfb2的表达水平结果见图3c。可见,阴性对照组的tgfb2表达量为1±0.052835971,,在rp11-224o19.2表达被抑制后,tgfb2的表达量下调了88%(数值为0.118222992±0.004975651),差异具有统计学意义(p<0.05)。tgfb2基因属于tgfβ超家族,文献报道下调tgfb2的表达能显著地抑制肿瘤细胞的生长、增殖、迁移和转移等生物学功能。本实验结果表明,抑制rp11-224o19.2的表达可以显著下调tgfb2表达,从而抑制肿瘤的发生发展,达到治疗肿瘤的效果。实施例3rp11-224o19.2表达水平与肝癌的关系分析rp11-224o19.2在肝癌中的表达:数据分析方法如下:所有实验数据使用spss19.0软件(ibmspss)进行分析,以student'st-test计算的组间p<0.05作为统计学差异阈值,作图用origin8.0和graphpadprism5软件完成。按照rp11-224o19.2的表达量倍数变化(foldchange)对50个肝癌临床病例进行分类,rp11-224o19.2的表达量倍数变化与临床病理参数的相关性分析由spss19.0软件完成,两个样本间分析采用非参数检验中的mann-whitneyutest方法,三个样本间分析采用非参数检验中的kruskal-wallistest方法,p<0.05作为统计学差异阈值。实验结果:通过对20对肝癌与正常组织样本的rna-seq表达量进行分析,我们发现rp11-224o19.2在肝癌组织中的表达量明显高于正常组织(p=0.0146)(图4a)。对另一项50对肝癌与正常组织样本的rna-seq表达量进行分析,同样证实rp11-224o19.2在肝癌组织中表达上调(p=0.00148,图4b)。另外,通过不同组数据的分析表明,rp11-224o19.2的表达量表现出对肝癌组织较高的诊断准确性(p=0.00065,见图4c;p=0.00034,见图4d)。可见,rp11-224o19.2的表达水平与肝癌呈正相关,rp11-224o19.2的高表达会显著提高患肝癌的可能性,因此,可以通过检测待检人群的rp11-224o19.2的表达水平,将肝癌的易感人群筛查出来,用于临床肝癌的辅助诊断。已知肝癌细胞的迁移、侵袭和转移会导致门静脉血栓(pvtt),并使肝癌患者有差的预后状况。数据分析表明,rp11-224o19.2在pvtt中的表达量高于肿瘤组织,说明rp11-224o19.2与肝癌的侵袭转移正相关(图4a)。为了进一步探究rp11-224o19.2的表达量与肝癌患者的预后关系,我们将50个肝癌临床病例按照rp11-224o19.2的表达量倍数变化分为两类,31个高表达病例是指rp11-224o19.2的foldchange≥2,19个低表达病例是指rp11-224o19.2的foldchange<2,并且高表达组的rp11-224o19.2的表达量倍数变化值显著比低表达组高(p=3.94e-09,mann-whitneyutest)(图4e)。我们将rp11-224o19.2表达量与肝癌的临床病理特征进行相关性分析,得到的结果如表10所示。此外,高表达的rp11-224o19.2与肝癌患者的晚期肿瘤分期密切相关(p=0.029,kruskal-wallistest)(图4f)。可见,rp11-224o19.2的表达量可以用于预测肝癌患者预后状况,rp11-224o19.2表达量越高,肝癌患者的预后情况越差。表10rp11-224o19.2表达量与临床病理特征的相关性备注:有些临床数据缺失,p<0.05作为统计学差异阈值因此,通过检测rp11-224o19.2的表达水平,可以筛查待检人群患肝癌的风险,及对肝癌患者的预后情况做出预测,可用于临床肝癌的辅助诊断及预后判断。综上,抑制rp11-22o19.2表达能够显著抑制肿瘤细胞的增殖、克隆形成、迁移和侵袭并诱导细胞凋亡,降低tgfb2表达水平,从而达到治疗肿瘤的效果。另外,通过检测rp11-224o19.2的表达水平,可以筛查待检人群患肝癌的风险,及对肝癌患者的预后情况做出预测,可用于临床肝癌的辅助诊断及预后判断。sequencelisting<110>西南交通大学<120>长链非编码rnarp11-224o19.2抑制剂的用途<130>gy138-17p1197<160>10<170>patentinversion3.5<210>1<211>21<212>dna<213>rp11-224o19.2-sirna正义链<400>1gcaugacucugcagccauatt21<210>2<211>21<212>dna<213>rp11-224o19.2-sirna反义链<400>2uauggcugcagagucaugctt21<210>3<211>21<212>dna<213>阴性对照sirna正义链<400>3uucuccgaacgugucacgutt21<210>4<211>21<212>dna<213>阴性对照sirna反义链<400>4acgugacacguucggagaatt21<210>5<211>20<212>dna<213>rp11-224o19.2正向引物<400>5cgaaccgttgagggagtgtg20<210>6<211>20<212>dna<213>rp11-224o19.2反向引物<400>6aggccccatacacaactgaa20<210>7<211>19<212>dna<213>gapdh正向引物<400>7gttggtatcgtggaaggac19<210>8<211>18<212>dna<213>gapdh反向引物<400>8aaaggtggaggagtgggt18<210>9<211>20<212>dna<213>tgfb2正向引物<400>9ccaaagggtacaatgccaac20<210>10<211>25<212>dna<213>tgfb2反向引物<400>10cagatgcttctggatttatggtatt25当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1