一种阿托伐他汀钙亚微乳剂及其制备方法与流程
本发明涉及药剂学技术领域,尤其涉及一种阿托伐他汀钙亚微乳剂及其制备方法。
背景技术:
阿托伐他汀钙(atorvastatincalcium,atc)是经典的第三代他汀类降脂药,商品名为立普妥,是由美国辉瑞制药公司于1997年上市上产的,剂型为片剂。阿托伐他汀钙能够抑制肝脏的胆固醇以及hmg-coa还原酶的生物合成,以此来降低血清脂蛋白浓度和血浆中胆固醇浓度,而且还可以增加细胞表面的肝脏低密度脂蛋白(ldl)受体来增加ldl的摄取和分解代谢以此来减少ldl的生成。阿托伐他汀钙能够降低由于脂类代谢功能缺损患者血浆总胆固醇,载脂蛋白,甘油三酯以及ldl胆固醇的水平,同时其能够明显减轻由纯合子和杂合子所致的家族性高胆固醇血症和非家族性胆固醇血症。由于阿托伐他汀钙属于bcsii类药物,其较差的溶解性使得药物在胃肠道内溶出速率较慢导致了其绝对生物利用度仅有12%,hmg-coa还原酶抑制剂活性的生物利用度只有30%。
阿托伐他汀钙较低的生物利用度主要源于较差的溶解性,酸性溶液中易降解为内酯结构以及体内清除速率较快三方面原因。因此有研究人员采用新型技术制备阿托伐他汀钙口服制剂以提高药物的体内生物利用度。专利201110078062.0采用环糊精作为辅料制备了阿托伐他汀钙的包合物并以此压片,专利结果表明该方法可提高药物的溶解度和稳定性。专利201410567515.x公开了一种阿托伐他汀钙固体制剂组合物,该方法采用卡波姆、乙基纤维素、丙烯酸树脂等作为辅料制备了载药固体分散体并以此压片,所得到片剂具有较好的溶解性并降低了给药后胃部的副作用。专利201310725029.1公开了一种阿托伐他汀钙纳米脂质载体及其制备方法,可提高药物水溶性和稳定性。
技术实现要素:
本发明所要解决的技术问题,就是提出一种阿托伐他汀钙亚微乳剂,其亚微乳剂平均粒径小于150nm,能够有效增加药物的溶解度同时提高了药物的体内生物利用度,即改善药物在小肠内的吸收情况。
此外,本发明还提出了上述阿托伐他汀钙亚微乳剂的制备方法,本方法可有效避免使用有机溶媒、具有工艺重现性好、质量稳定、产品生物利用度高等优势,可拓展阿托伐他汀钙的服药形式和改善体内疗效。
为解决上述技术问题,本发明采用以下技术方案予以实现:
一种阿托伐他汀钙亚微乳剂,每100ml亚微乳剂中包括如下组分:
其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在油相溶剂中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
作为优选地,每100ml所述阿托伐他汀钙亚微乳剂中包括如下组分:
作为优选地,所述阿托伐他汀钙磷脂复合物中的磷脂选自豆磷脂、卵磷脂或人工合成磷脂酰胆碱的至少一种。
作为优选地,所述油相溶剂选自大豆油、中链甘油三酯、橄榄油、维生素e及维生素e酯中的至少一种。
作为优选地,所述乳化剂选自卵磷脂、大豆磷脂、氢化磷脂中的至少一种。
作为优选地,所述稳定剂选自吐温80、泊洛沙姆188、胆固醇硫酸酯盐、油酸中的至少一种。
作为优选地,所述电位调节剂选自油酸钠、磷脂酰甘油钠盐、磷脂酸钠盐中的至少一种。电位调节剂的目的是使制得的乳滴表面带负电,这样由于同种电荷的排斥作用使得乳滴不容易聚集,增加乳剂的稳定性,通常是其表面的zeta点位值稳定在-25~-40mv之间可以认为所制备乳剂稳定性良好。
作为优选地,所述阿托伐他汀钙亚微乳剂的ph值范围为4-9,通过加入hcl或naoh调节。
本发明还提出了上述阿托伐他汀钙亚微乳剂的制备方法,包括如下步骤:
(1)称取油相溶剂加热至50-85℃,并加入阿托伐他汀钙磷脂复合物,搅拌使之完全溶解形成溶液,作为油相;
(2)将水加热至50-85℃,再依次加入乳化剂、稳定剂、电位调节剂、甘油,搅拌形成溶液,作为水相;
(3)将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,缓慢滴加油相,在加热保温条件下,以6000-14000rpm高速剪切2~25min得到初乳;
(4)上述初乳中加入hcl或naoh调节ph值为4-9,加水补齐定容至100ml刻度,采用高压均质法在20℃~60℃下经过200~1200bar的压力均质2~10次,得到阿托伐他汀钙亚微乳剂;
(5)将制备的阿托伐他汀钙亚微乳剂灌装熔封后,在121℃下高压灭菌15min得最终成品。
本发明对阿托伐他汀钙亚微乳剂的处方工艺进行了筛选优化,具体是:以离心稳定常数,平均粒径,多分散系数作为指标,对影响亚微乳质量的处方因素(油相种类及用量,乳化剂种类及用量,稳定剂种类及用量、电位调节剂及用量、载药量)进行考察并通过正交实验对进一步优化,获得最优的处方;对影响亚微乳质量的工艺参数(剪切温度、剪切速度、剪切时间、均质温度、均质压力、均质循环次数)进行考察并再通过正交实验对制备工艺进行优化,得出最佳的工艺参数和操作流程。
阿托伐他汀钙属于油水均难溶性药物,本发明采用磷脂复合技术将阿托伐他汀钙制备成磷脂复合物并以此作为药物前体制备亚微乳剂。该亚微乳剂平均粒径小于150nm,能够有效增加药物的溶解度同时提高了药物的体内生物利用度。该方法可有效避免使用有机溶媒、具有工艺重现性好、质量稳定、生物利用度高等优势,可拓展阿托伐他汀钙的服药形式和改善体内疗效。
发明人在研究中发现,将阿托伐他汀钙制备成亚微乳剂之后(水包油型乳剂),其在口服给药后相比市售制剂不仅提高了药物的生物利用度,而且在体内表现出了明显缓慢释放的效果。本发明所制备的阿托伐他汀钙亚微乳剂具有以下特点:
(1)采用了阿托伐他汀钙与磷脂复合的方法改善药物在油相中的溶解度和稳定性,药物具有更长的储存期。
(2)与纳米粒载体、胶束载体、微球载体和自乳化载体等相比,阿托伐他汀钙亚微乳剂避免使用较高浓度的有机溶媒,降低了潜在的毒副作用风险。
(3)阿托伐他汀钙亚微乳剂制备工艺成熟、重现性好、方法稳定,能够进行规模化的批量生产。
(4)本发明制备的阿托伐他汀钙亚微乳剂外观呈乳白色,平均粒径为120nm,ph为6.5,包封率为97.57%,经稳定性考察表明其性质质量良好。
附图说明
图1本发明制得的阿托伐他汀钙亚微乳剂电镜形态图;
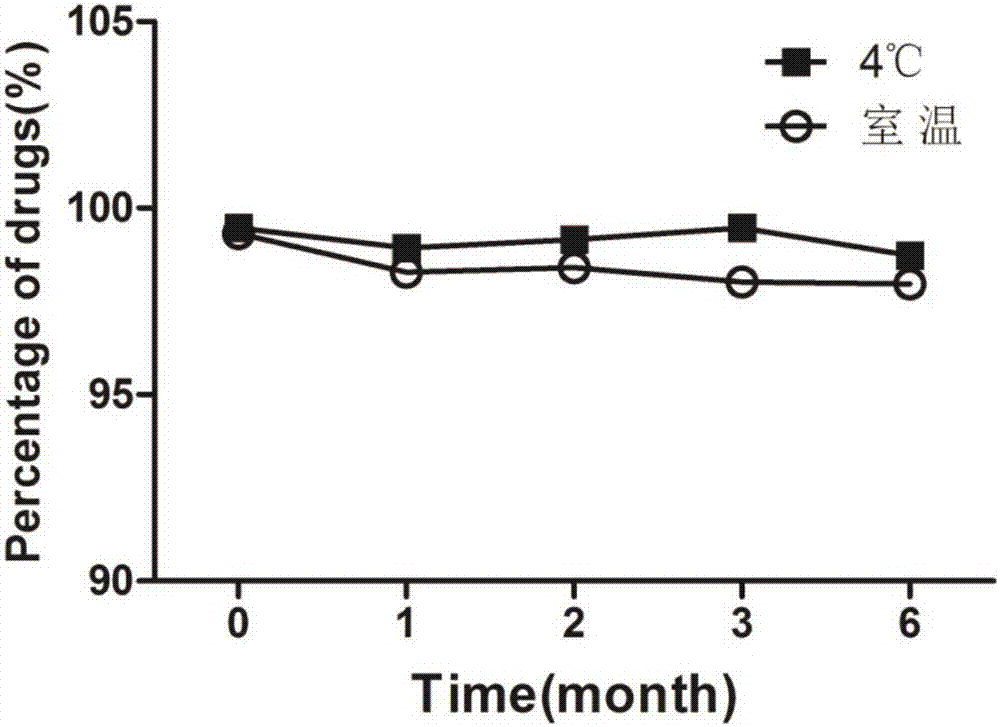
图2本发明阿托伐他汀钙亚微乳剂6个月内的含量变化曲线;
图3本发明阿托伐他汀钙亚微乳剂与市售制剂的血药浓度-时间曲线;
图4本发明阿托伐他汀钙亚微乳剂与市售制剂的不同肠段吸收速率比较。
具体实施方式
为让本领域的技术人员更加清晰直观的了解本发明,下文中将参考附图并结合实施例来详细说明本发明。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。
本发明中考察载药亚微乳剂性质的评价指标:
在进行单因素考察的过程中,以离心稳定常数ke,平均粒径s,多分散系数pdi三个指标来对制备的亚微乳进行评价。
在进行正交优化的过程中,将以上三个指标进行加权评分,评分越小表明所制备亚微乳的质量越优。具体评分规则为:w=(s/smax+pdi/pdimax+ke/kemax)×100,其中s为粒径,smax为所测最大粒径;pdi为分散系数,pdimax为所测最大粒径分散系数;ke为离心稳定常数,kemax为所测最大离心稳定常数。
本发明中所用阿托伐他汀钙纯度>99%,批号:2015123304,市售品立普妥(阿托伐他汀钙片)由辉瑞制药有限公司生产,规格为20m,批号:n08117。
实施例1
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:0.5g阿托伐他汀钙磷脂复合物、5.0g大豆油、0.40g卵磷脂、0.40g泊洛沙姆188、0.20g吐温80、0.024g油酸钠、1.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取0.5g阿托伐他汀钙磷脂复合物加入到5.0g大豆油作为油相,于60℃水浴加热。称取0.40g卵磷脂,0.40g泊洛沙姆188,0.20g吐温80,0.024g油酸钠,1.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。加入盐酸或者氢氧化钠溶液调节终乳ph值至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例2
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:0.5g阿托伐他汀钙磷脂复合物、10.0g大豆油、0.67g卵磷脂、0.67g泊洛沙姆188、0.20g吐温80、0.024g油酸钠、2.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取0.5g阿托伐他汀钙磷脂复合物加入到10.0g大豆油作为油相中,于60℃水浴加热。称取0.67g卵磷脂,0.67g泊洛沙姆188,0.20g吐温80,0.024g油酸钠,2.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。加入盐酸或者氢氧化钠溶液调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例3
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:0.5g阿托伐他汀钙磷脂复合物、5.0g大豆油、0.80g卵磷脂、0.40g泊洛沙姆188、0.20g吐温80、0.024g油酸钠、1.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取0.5g阿托伐他汀钙磷脂复合物加入到5.0g大豆油作为油相,于60℃水浴加热。称取0.80g卵磷脂,0.40g泊洛沙姆188,0.20g吐温80,0.024g油酸钠,1.0g甘油于适量70℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例4
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:1.0g阿托伐他汀钙磷脂复合物、10.0g大豆油、1.6g卵磷脂、1.6g泊洛沙姆188、0.60g吐温80、0.08g油酸钠、2.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取1.0g阿托伐他汀钙磷脂复合物加入到10.0g大豆油作为油相,于60℃水浴加热。称取1.6g卵磷脂,1.6g泊洛沙姆188,0.6g吐温80,0.08g油酸钠,2.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例5
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:1.5g阿托伐他汀钙磷脂复合物、15g大豆油、1.2g卵磷脂、1.8g泊洛沙姆188、0.6g吐温80、0.1g油酸钠、3.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取1.5g阿托伐他汀钙磷脂复合物加入到15g大豆油作为油相,于60℃水浴加热。称取1.2g卵磷脂,1.8g泊洛沙姆188,0.6g吐温80,0.1g油酸钠,3.0g甘油于适量70℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例6
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:2.0g阿托伐他汀钙磷脂复合物、20g大豆油、1.80g卵磷脂、2.40g泊洛沙姆188、3.20g吐温80、0.14g油酸钠、4.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取2.0g阿托伐他汀钙磷脂复合物加入到20g大豆油作为油相,于60℃水浴加热。称取1.8g卵磷脂,2.4g泊洛沙姆188,3.2g吐温80,0.14g油酸钠,4.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例7
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:3.0g阿托伐他汀钙磷脂复合物、30g大豆油、2.4g卵磷脂、3.6g泊洛沙姆188、3.33g吐温80、0.12g油酸钠、5.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取3.0g阿托伐他汀钙磷脂复合物加入到30g大豆油作为油相,于60℃水浴加热。称取2.4g卵磷脂,3.6g泊洛沙姆188,3.33g吐温80,0.12g油酸钠,5.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在10000rpm剪切速度下,缓慢滴加油相,剪切5min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1000bar压力在20℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例8
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:2.5g阿托伐他汀钙磷脂复合物、25g大豆油、0.4g卵磷脂、0.60g泊洛沙姆188、0.8g吐温80、0.03g油酸钠、5.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取2.5g阿托伐他汀钙磷脂复合物加入到25g大豆油作为油相,于60℃水浴加热。称取0.40g卵磷脂,0.60g泊洛沙姆188,0.80g吐温80,0.03g油酸钠,5.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在8000rpm剪切速度下,缓慢滴加油相,剪切7min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用800bar压力在30℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例9
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:1.5g阿托伐他汀钙磷脂复合物、15g大豆油、2.40g卵磷脂、1.8g泊洛沙姆188、2.4g吐温80、0.18g油酸钠、3.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取1.5g阿托伐他汀钙磷脂复合物加入到15g大豆油作为油相,于60℃水浴加热。称取2.40g卵磷脂,1.80g泊洛沙姆188,2.40g吐温80,0.18g油酸钠,3.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在14000rpm剪切速度下,缓慢滴加油相,剪切20min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1200bar压力在40℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例10
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:5g阿托伐他汀钙磷脂复合物、20g大豆油、1.20g卵磷脂、2.4g泊洛沙姆188、4.0g吐温80、0.15g油酸钠、4.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取5g阿托伐他汀钙磷脂复合物加入到20g大豆油作为油相,于60℃水浴加热。称取1.20g卵磷脂,2.40g泊洛沙姆188,4.0g吐温80,0.15g油酸钠,4.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在14000rpm剪切速度下,缓慢滴加油相,剪切20min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1200bar压力在40℃下循环5次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例11
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:0.5g阿托伐他汀钙磷脂复合物、5.0g大豆油、0.80g卵磷脂、0.60g泊洛沙姆188、0.80g吐温80、0.03g油酸钠、1.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取0.5g阿托伐他汀钙磷脂复合物加入到5.0g大豆油作为油相,于60℃水浴加热。称取0.80g卵磷脂,0.60g泊洛沙姆188,0.80g吐温80,0.03g油酸钠,1.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在14000rpm剪切速度下,缓慢滴加油相,剪切20min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1200bar压力在20℃下循环6次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
实例12
本实施例的阿托伐他汀钙亚微乳,每100ml亚微乳剂中包括如下组分:3.0g阿托伐他汀钙磷脂复合物、30g大豆油、4.0g卵磷脂、3.0g泊洛沙姆188、4.0g吐温80、0.15g油酸钠、5.0g甘油以及加至100ml的蒸馏水,其中,所述阿托伐他汀钙磷脂复合物作为前体药物,以增加阿托伐他汀钙在大豆油中的溶解度,阿托伐他汀钙与磷脂的摩尔比为1:1。
制备上述阿托伐他汀钙亚微乳的步骤如下:称取3.0g阿托伐他汀钙磷脂复合物加入到30g大豆油作为油相,于60℃水浴加热。称取4.0g卵磷脂,3.0g泊洛沙姆188,4.0g吐温80,0.15g油酸钠,5.0g甘油于适量60℃的蒸馏水作为水相。将水相加入到100ml塑料离心管中,置于高速分散机,将分散机机探头浸入水相中,在12000rpm剪切速度下,缓慢滴加油相,剪切10min。剪切结束后,补加蒸馏水定容至100ml,搅拌除去气泡冷却至室温得初乳。接着采用1200bar压力在20℃下循环6次,最终得终乳。调节终乳ph至7.5左右,安瓿充氮气灌装,121℃高压灭菌15min得成品。对制备的亚微乳进行粒径,离心稳定常数,多分散系数进行测定。
为了筛选优化本发明中阿托伐他汀钙的制备工艺和处方组成,本发明进行了各项相关实验研究,具体如下。
①处方组成的筛选优化
根据处方考察结果,选择显著性的影响因素,每个因素选取4个不同水平,使用spss软件生成5因素4水平的正交表。评分所得越小,说明其制备的乳剂稳定性良好,粒径小而均匀。正交实验水平因素设计表如表1所示,正交实验结果如表2所示。
表1正交实验水平因素表
表2正交实验方差结果分析
结果显示5个因素中对于亚微乳影响程度的大小顺序为油相溶剂用量>泊洛沙姆188>油酸钠>吐温80>卵磷脂。根据对正交实验的方差分析结果,采用最佳处方制备的阿托伐他汀钙亚微乳外观良好,乳液粘度低,没有挂壁现象。
②制备工艺的筛选优化
根据单因素考察亚微乳制备过程中的各个因素对于乳剂质量的影响,确定了影响显著的因素包括剪切温度,均质压力,均质循环次数和均值温度,设计4因素3水平试验,进行最佳制备工艺的正交优化,因素水平表如表3所示,正交实验结果如表4所示。正交实验结果表明各因素的影响程度分别是a>b>d>c,根据极差结果分析确定的最佳工艺组合为a3b3c1d2,即最佳的制备工艺为剪切温度70℃,高压均质压力1200bar,均质循环次数7次,均质温度30℃,照此工艺条件所制备的亚微乳粒径较小且分布均匀,亚微乳呈乳白色,黏度低,无挂壁现象,灭菌后乳剂稳定性良好。
表3正交实验水平因素表
表4工艺优化正交实验方案
③阿托伐他汀钙亚微乳的最佳处方工艺验证
依据最佳处方工艺制备三批亚微乳(以实施例8为例),观察期外观和形态,并对粒径,电位,ph值,含量和包封率进行测定。结果显示所制备亚微乳其外观乳白,无明显挂壁,伴有淡蓝色乳光,其离心稳定性好,平均粒径为124.7nm,平均包封率可达97.1%。形态和测定如图1和表5所示。
表5三批乳剂评价结果
④阿托伐他汀钙亚微乳的稳定性考察
所制备的亚微乳(以实施例8为例)经高压灭菌后进行长期储存其外观,ph值,粒径,含量和包封率均未发生明显改变,表明制备的亚微乳稳定性良好。结果研究表明无论在4℃还是在室温下储存,体系的ph没有明显变化;在考察期内,乳滴粒径未见明显的变化;自制的三批亚微乳样品的6个月的平均包封率为97.54%,表明药物绝大部分分布于油相中;含量的测定表明亚微乳作为阿托伐他汀钙的载体能够保证其在储存过程中的稳定性,室温和4℃下存放六个月其含量基本没有变化,如图2所示。
表6亚微乳ph考察结果
表7亚微乳粒径考察结果(单位nm)
表8亚微乳包封率考察结果(%)
⑤阿托伐他汀钙亚微乳的体内生物利用度
阿托伐他汀钙亚微乳(以实施例8为例)与市售制剂生物利用度的比较。采用口服灌胃的方法比较阿托伐他汀钙亚微乳和市售制剂立普妥的口服生物利用度,采用hplc法测定不同时间的血药浓度变化,绘制药时曲线,运用das3.0软件对药动学数据进行分析。
结果表明市售制剂达峰时间为0.5h,阿托伐他汀钙亚微乳的达峰时间略有延长至0.75h。二者cmax分别为0.531mg/l和0.801mg/l,亚微乳组比市售制剂组提高1.62倍。亚微乳组的药时曲线下面积(auc)为4.03mg/l·h,较市售组(1.72mg/l·h)提高了2.34倍,且半衰期明显延长,吸收速率常数显著增加,说明阿托伐他汀钙亚微乳可以有效促进药物的体内吸收,改善体循环时间并显著提高生物利用度,相关药动学曲线及参数见图3和表9。
表9体内药动学参数
⑥阿托伐他汀钙亚微乳的在体肠灌流实验
采用大鼠小肠灌流的方法来比较阿托伐他汀钙亚微乳(以实施例8为例)和市售片剂在十二指肠,回肠,空肠,结肠的吸收情况。根据不同时间肠灌流液中的剩余药量,求算出不同肠段的吸收速率常数和表观渗透系数。其中吸收速率常数ka的计算如下:
lnxt=-ka·t+lnx0
lnxt=-ka·t+lnx0
其中xt是时间t是灌流液中剩余的药量,x0是时间t=0时灌流液中的药物量。
图4结果显示阿托伐他汀钙在四个肠段的吸收没明显差异,其在四个肠段的吸收情况为十二指肠>回肠>空肠≈结肠,相对来说阿托伐他汀钙在十二指肠吸收较好。而将阿托伐他汀钙制备成亚微乳后能够促进其在各个肠段的吸收,尤其在结肠吸收改变最明显,表明了阿托伐他汀钙亚微乳能够明显改善其在结肠段的吸收情况,制备成亚微乳后其在各肠段的吸收情况为结肠>十二指肠>空肠>回肠。
需要说明的是,对于前述的方法实施例,其中各组分的选择,可以做相应的更换,并不限于上述实施例公开的选择,具体参照说明书中发明内容公开的为准,只需各组分间比例符合比例即可。
另应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!