阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制作方法
本发明涉及生物医学技术领域一个新型的肾细胞癌治疗靶点,具体涉及阻断ube2m介导的neddylation修饰信号通路在肾细胞癌治疗靶点中的应用。
背景技术:
肾细胞癌(renalcellcarcinoma,rcc)是起源于肾实质泌尿小管上皮系统的恶性肿瘤,占肾脏恶性肿瘤的80%-90%,占成人恶性肿瘤的2%至3%。目前,外科手术(根治性肾切除手术和保留肾单位手术)是局限性肾癌的首选治疗方法,可以达到完全治愈。对于局部进展性肾癌则以手术治疗为主,术后辅助细胞因子或分子靶向治疗的综合治疗。而转移性肾癌尚无统一标准治疗方案,研究表明分子靶向药物可以显著延长患者的生存期。2006年起,nccn和eau将分子靶向药物(索拉菲尼、舒尼替尼、替西罗莫斯等)作为转移性肾癌治疗的一、二线临床治疗用药。它们中的大多数属于激酶抑制剂,通过抑制肿瘤血管的生长,达到抗肿瘤的作用,延长患者的生存期。但分子靶向药物的毒副作用(手足皮肤反应、乏力、白细胞减少、高血压、贫血、口舌炎等)限制其在临床治疗中的广泛应用,部分患者因此需要调整药物剂量,甚至终止治疗。因此,寻找和发现新的肾细胞癌治疗靶点并据此研发新型的分子靶向药物,对于肾细胞癌的治疗具有重要的临床应用价值。
类泛素化修饰neddylation是一种新型的蛋白翻译后修饰方式,通过类泛素样蛋白nedd8(neuralprecursorcell-expresseddevelopmentallydownregulated8)特异性地与底物蛋白共价结合,调控多种蛋白复合体的结构和功能,在细胞正常生理活动的多个关键环节中具有重要的调控作用。然而,neddylation修饰的异常激活与多种恶性肿瘤的发生和发展密切相关。所以靶向针对neddylation修饰信号通路有望成为新型的抗肿瘤靶点。neddylation修饰信号通路的关键酶主要包括nedd8活化酶e1、nedd8结合酶e2和nedd8连接酶e3。nedd8结合酶e2为高度保守的蛋白质,目前研究仅发现有2种,分别是ube2m(ubiquitin-bindingenzymee2m,ubc12)和ube2f(ubiquitin-bindingenzymee2f)。然而,neddylation修饰以及nedd8结合酶e2是否能够作为肾细胞癌治疗靶点及作用机制仍未知。
技术实现要素:
本发明的目的在于提供一种阻断ube2m介导neddylation修饰在肾细胞癌治疗中的应用,为研发新型的分子靶向治疗药物,提供一种阻断ube2m介导的neddylation修饰作为治疗肾细胞癌的新靶点。本发明设计了sh-control、sh-ube2f和sh-ube2m等rna干扰相关质粒,构建稳定敲低ube2m或者ube2f蛋白表达水平的肾癌细胞系,通过实验发现敲低ube2m显著抑制肾癌细胞的增殖。进一步通过neddylation修饰特异性小分子抑制剂mln4924对肾癌细胞的显著杀伤作用,证明了阻断ube2m介导的neddylation修饰在抑制肾癌细胞增殖活力上起着关键作用。因此,阻断ube2m介导的neddylation修饰信号通路是一种潜在的治疗肾细胞癌的新型靶点,具有很强的临床应用价值。
本发明的上述目的通过以下技术方案实现:
阻断ube2m介导的neddylation修饰信号通路作为药物靶点在制备抗肾细胞癌药物中的应用。
阻断ube2m介导的neddylation修饰信号通路作为药物靶点在制备抑制肾细胞癌增殖试剂中的应用。
通过靶向抑制ube2m的表达或功能,实现靶向抑制肾细胞癌的生长。
靶向抑制ube2m表达的方法为:通过慢病毒介导shrna转入肾癌细胞中,敲低肾癌细胞内ube2m的表达。
抑制剂选自靶向于ube2m蛋白编码序列,且能够抑制ube2m基因转录与蛋白表达的shrna。
所述的shrna序列为gcggatccagaaggacataaa。
本发明的有益效果在于:本发明通过实验证实了通过阻断ube2m介导的neddylation修饰信号通路可抑制肾癌细胞的增殖。进一步通过neddylation修饰特异性小分子抑制剂mln4924对肾癌细胞的显著杀伤作用,证明了阻断ube2m介导的neddylation修饰在抑制肾癌细胞增殖活力上起着关键作用。因此,阻断ube2m介导的neddylation修饰信号通路是一种潜在的治疗肾细胞癌的新型靶点,具有很强的临床应用价值。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,本发明的示意性实例及其说明用于解释本发明,并不构成对本发明的不当限定。
图1为本发明的阻断ube2m介导的neddylation修饰可显著抑制肾癌细胞786-0的增殖。(a)构建稳定敲低ube2m或者ube2f蛋白表达水平的肾癌细胞786-0后,通过细胞计数的方法检测肾癌细胞增殖(p<0.001)。(b)通过westernblot分析检测敲低ube2m或ube2f情况。
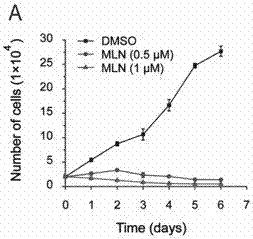
图2为本发明的mln4924显著抑制肾癌细胞786-0的增殖(p<0.001)。
具体实施方式
下面结合附图进一步说明本发明的详细内容及其具体实施方式,通过具体实验来进一步验证本发明。
参见图1及图2所示,本发明的目的是为研发新型的分子靶向治疗药物,提供一种阻断ube2m介导的neddylation修饰作为治疗肾细胞癌的新靶点。
第一方面,本发明提供了阻断ube2m介导的neddylation修饰信号通路作为药物靶点在制备抗肾细胞癌药物中的应用。
第二方面,本发明提供了阻断ube2m介导的neddylation修饰信号通路作为药物靶点在制备抑制肾细胞癌的增殖试剂中的应用。
所述的抑制剂选自靶向于ube2m蛋白编码序列,且能够抑制ube2m基因转录与蛋白表达的shrna。通过慢病毒介导shrna转入肾癌细胞中,敲低肾癌细胞内ube2m的表达,实现靶向抑制肾细胞癌的生长。所述的shrna序列为gcggatccagaaggacataaa。
实施例1:
阻断ube2m介导的neddylation修饰可显著抑制肾癌细胞786-0的增殖
分别将质粒(sh-control、sh-ube2f和sh-ube2m)加入dh5α感受态中,冰上放置20分钟后置于42℃加热模块中,热激90秒。将热激后的感受态置于冰上5分钟。向感受态中加入500μl液体lb培养基,37℃下200rpm摇40分钟。收集菌液300rcf离心5分钟,弃去400μl上清。用剩余的菌液将沉淀重悬,均匀涂布在固体lb培养基中(含氨苄抗生素100μg/ml),倒置放入37℃恒温培养箱中。24小时后挑取清晰的单菌落,加入至液体lb培养基中(含氨苄抗生素100μg/ml),37℃下200rpm摇24小时。24小时后收集菌液,提取质粒。将获得的质粒与prsv-rev、pmdlg/prre和pcmv-vsv-g以3:3:3:1的比例转染至293t细胞中,置于培养箱中培养(培养条件为:5%co2;温度为37℃),6小时后更换培养液,继续培养箱中培养。48小时后收获含假病毒颗粒的上清液,1000rpm离心5分钟,将收获的上清液用0.45μm滤膜过滤。4℃条件下,在20%蔗糖中30000rpm超速离心2小时。将超离后的病毒沉淀用无菌pbs重悬。将4×105个786-0细胞接种至6孔板中,置于培养箱中培养(培养条件为:5%co2;温度为37℃)。24小时后将细胞上清液弃去,加入混有相应病毒的无血清培养基,置于培养箱中培养(培养条件为:5%co2;温度为37℃),6小时后补加含有20%胎牛血清的培养基。感染48小时后,换为含有嘌呤霉素(4ug/ml)的培养基。观察细胞死亡情况,将存活的细胞进行传代。
分别将相应稳定肾癌细胞786-0(sh-control、sh-ube2f、sh-ube2m和sh-ube2f+sh-ube2m)以每孔2×104个细胞接种至24孔板中,置于培养箱中培养(培养条件为:5%co2;温度为37℃),在不同时间段应用胰蛋白酶进行消化,收集细胞悬液并应用细胞计数板进行细胞计数。
通过westernblot分析进行分析。使用针对目标蛋白的一级抗体,包括actin(ab8227,abcam),ube2m(ab109507,abcam)和ube2f(ab185234,abcam)。二级抗体包括抗兔igg和抗小鼠igg(jacksonimmunoresearchlaboratories)。
实施例2:
mln4924显著抑制肾癌细胞786-0的增殖
将肾癌细胞786-0以每孔2×104个细胞接种于24孔板中,置于培养箱中培养(培养条件为:5%co2;温度为37℃),待细胞贴壁后,应用dmso或mln4924(0.5μm和1μm)进行处理,在不同时间段应用胰蛋白酶进行消化,收集细胞悬液并应用细胞计数板进行细胞计数。
综上所述可知,阻断ube2m介导的neddylation修饰信号通路后可抑制肾癌细胞的增殖。并通过mln4924对肾癌细胞的显著杀伤作用,从侧面证明了ube2m介导的neddylation修饰在肾癌细胞增殖活力中的关键作用。因此,阻断ube2m介导的neddylation修饰信号通路是一种潜在的治疗肾细胞癌的新型靶点,具有很强的临床应用价值。
以上所述仅为本发明的优选实例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡对本发明所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!