同轴静电纺丝制备ICA‑SF/PLCL纳米纤维膜的方法及作为GBR膜的应用与流程
本发明涉及一种ica-sf/plcl复合纳米纤维膜的制备,尤其涉及一种采用同轴静电纺丝技术制备ica-sf/plcl纳米纤维膜的方法;本发明同时还涉及该方法制备的ica-sf/plcl复合纳米纤维膜作为gbr膜的应用,属于复合材料技术领域和医药材料技术领域。
背景技术:
牙种植术目前已成为牙列缺损或缺失的首选修复方法;然而,由炎症(如肉芽组织)引起的骨缺损严重影响手术成功率。越来越多研究表明,引导骨再生(gbr)技术可有效恢复牙槽骨的高度和丰满度,其原理是:通过阻碍成纤维细胞和上皮细胞长入骨缺损区而发挥屏障功能,并使成骨细胞附着、增殖增加,促进骨再生。
目前市场应用于gbr的材料,包括生物不可降解的聚四氟乙烯,该材料需二次手术取出,增加感染和膜暴露几率。因此,越来越多学者致力于生物可降解膜。bio-gide®是一种临床常用的生物可降解膜,研究表明,其具有良好的生物相容性,低抗原性,足够的机械性能和适益的降解性。为更好的诱导骨再生,复合性gbr膜(膜材料与骨诱导物质如生长因子相结合)已成为目前研究的热点。
淫羊藿苷(icariin,ica,c33h40o15,分子量:676.67)是从中药总黄酮中提取的主要活性成分,其具有多种重要的生理活性,如促进成骨细胞的增殖和分化以治疗骨代谢疾病,及免疫调节和抗肿瘤活性。研究发现,ica可治疗绝经后妇女的骨量丧失,通过增加opn、bmp表达促进骨髓间充质干细胞分化成成骨细胞,最终恢复骨强度。同时,ica明显抑制破骨细胞形成。因此认为,ica可以作为骨组织工程的成骨诱导剂。我们之前的研究发现,ica可以在体内外显著促进人牙周膜干细胞(hpdlscs)的增殖和成骨分化。
聚l-丙交酯(plla),具有良好的生物相容性和可降解性,使其更适宜在药物控制释放及组织工程等方面中应用。
丝素(sf)是一种天然结构蛋白,具有良好的生物学特性,如良好的细胞粘附性,可控降解率,机械强度,渗透性和抗酶降解性。它已经广泛研究组织工程和控制药物输送系统。
同轴静电纺丝是制备纳米或亚微米纤维支架的简单、有效方法,其在组织工程和药物传递体系得到广泛应用。其具有高的表面积/体积比,可以促进细胞附着,实现药物卸载,并且达到持续和受控的药物局部释放。之前研究已证实,一些生物分子可成功包裹于纳米纤维中,保持生物活性,纤维直径可通过控制同轴静电纺丝过程参数来控制。
因此,本发明采用同轴静电纺丝技术拟制备一种ica-sf/plcl复合纳米纤维膜,并对膜的理化性能、降解、释药及体内和外体对骨再生的作用进行研究,以期成为能持续释放ica,促进骨再生功能的gbr膜。
技术实现要素:
本发明的目的是提供一种采用同轴静电纺丝技术制备ica-sf/plcl复合纳米纤维膜的方法;
本发明的另一目的是提供上述方法制备的ica-sf/plcl复合纳米纤维膜作为诱导骨再生膜(gbr)的应用。
一、ica-sf/plcl复合纳米纤维膜的制备
本发明ica-sf/plcl复合纳米纤维膜的制备,包括以下工艺步骤:
(1)再生丝素蛋白的制备:将蚕茧浸于na2co3溶液中煮沸脱胶,并用蒸馏水洗涤除去丝胶,干燥后在75~85℃下完全溶解于cacl2/ch3ch2oh/h2o的三元溶剂体系中,然后于蒸馏水中室温下透析3~5d,过滤,冷冻干燥,获得再生丝素蛋白。
所述na2co3溶液的质量分数为0.2~0.5%;煮沸脱胶2次,每次0.5~1h;
所述cacl2/ch3ch2oh/h2o三元溶剂体系中,cacl2/ch3ch2oh/h2o的摩尔比为1/2/8。
(2)壳层纺丝液的制备:将上述所得再生丝素蛋白与plcl以1:2.3~1:2.5的质量比溶于六氟异丙醇中,且使再生丝素蛋白与plcl的总质量百分数为5~8%,常温磁力搅拌5~6h,获得壳层纺丝液。plcl的mw在1,000,000以上。
(3)芯层纺丝液的配制:将ica配制成浓度10-5μmol/l的水溶液作为芯层纺丝液;
(4)同轴静电纺丝制备ica-sf/plcl复合纳米纤维膜:将配制好的芯层纺丝液、壳层纺丝液分别装入注射器中,连接同轴电纺双喷头,并与高压静电发生装置相连接;控制同轴电纺喷头与接收板间电压为12~15kv,距离为12~15cm,芯层纺丝液、壳层纺丝溶液推进速度分别为0.1ml/h和1.0ml/h,在温度25±2℃,相对湿度50±6%的环境下进行电纺,获得电纺丝膜;再使电纺丝膜与戊二醛水溶液于密闭环境下交联反应45~50h,真空干燥,得ica-sf/plcl纳米纤维膜样品。
戊二醛溶液的质量百分数为25%。电纺丝膜的大小12mm×15mm,厚0.3~0.4mm时,戊二醛的用量为10ml。
二、ica-sf/plcl纳米纤维膜表征
1、扫描电镜(sem)
将干燥保存备用的样本(3×3mm),真空喷金处理60s,应用jsm-4800型扫描电镜(jeol,tokyo,japan)于10kv电压条件下观察。应用imagej图像处理软件(nationalinstitutesofhealth,md,usa)随机选取纤维(n≧100),计算其平均直径,并绘制纤维直径分布图。
ica-sf/plcl纳米维膜sem图像及纤维直径分布图如图2显示,见纤维表面形貌光滑连续,纤维直径均一形成三维立体网状结构,无串珠样结构形成;纤维平均直径为451.57±80.33nm,分布范围为200~700nm,与天然细胞外基质结构相似,且纳米级直径纤维具有高的比表面积,可为细胞的粘附、生长提供理想的微环境,同时纳米级纤维可携载更多药物。
2、透射电镜(tem)
在纺丝过程中,用碳膜喷涂的铜网在电场中小心接取一定量的纤维丝,真空干燥至有机溶剂充分挥发(约需7d)后,在100kv电压条件下,应用feitecnaif3型透射电镜(fei,usa)观察纤维内部结构。
从ica-sf/plcl纳米维膜的透射电镜图(图3)可以看到,沿纤维长轴走向其内部形成明显的芯壳结构。该芯壳结构形成的机理为:在同轴电纺过程中,壳层与芯层纺丝液在喷口处汇合,由于汇合时间短,加上聚合物扩散系数低,因此,芯壳层溶液固化前不会混合。同时,在高压静电场力作用下,芯壳层溶液的复合液滴表面聚集大量电荷,在电场力的作用下拉伸形成具有芯壳结构的纳米纤维。其中,含原子数相对较多的ica在tem检测过程中由于吸收电子相对较多,因此在tem图像上显示为相对较暗的纤维芯层,相对应的,sf/plcl显示为纤维壳层,这暗示着中药单体ica被成功包裹于纤维内部,形成了有效的药物储库型缓释系统。
3、x射线衍射(xrd)测试
制备的ica-sf/plcl纳米纤维膜(15×15mm)采用d/max-2400型x射线多晶衍射仪(rigaku,tokyo,japan)对膜进行晶体结构的检测。测试条件设置为:扫描速度为6°/min,功率为40kv/150ma,扫描范围10~60°。
x射线衍射通过检测材料衍射峰出现的位置,分析材料内部分子或原子结构以确定材料的结构特征。以往的研究关于丝素蛋白和plcl构象表明,silkⅰ在x射线衍射测试中主要衍射峰接近12.2°、19.7°、24.7°和28.2°,plcl静电纺丝膜在23.6°附近出现明显的衍射峰。silkⅰ结构不稳定,构象规整性差;而silkii由于主要由结构稳定性较好的β折叠构成,其构象规整性相对较好,稳定性好。ica-sf/plcl纳米纤维膜的x射线衍射分析结果如图4所示,图像在17.2°左右出现新的衍射峰,而未检测到其他明显的衍射峰存在,说明芯层药物ica的加入,对材料分子结构未产生明显影响。电纺后的膜经2.5%的戊二醛交联,丝素蛋白晶体结构的α螺旋转变为稳定的β折叠,结晶度增强,材料性能稳定性增加。
4、接触角检测
纳米纤维膜(20×30mm)平整固定于亲水角测试仪,吸取30μl去离子水小心低至膜表面,5s后,拍照并测量水滴切线与膜表面间的夹角,作为样本接触角。需在膜表面5个不同测试点分别测量,计算其平均值及标准差。
材料的润湿性与细胞的粘附、增殖和迁移等行为密切相关。研究证实,纯plcl纤维膜的接触角为139.57°,其疏水性较强,表面不利于细胞的黏附、生长。而本研究的ica-sf/plcl载药纤维膜的接触角检测结果(图5)为125.72±4.93°,其亲水性较纯plcl纤维膜增加,因此,芯层药物的加入可以增加膜的亲水性,从而有利于细胞的黏附、生长。
5、拉伸强度测试
样本(10×50mm)两端宽10mm部分小心夹持于anscmt8102型电子万能力学试验机(hounsfield,uk)的夹具上,中间30mm作为测试区。检测前,需用精密游标卡尺测量样本平均厚度。以10n测试力、1mm/min测试速度进行样本的拉伸强度测试,并绘制相应的应力-应变曲线。
gbr膜需足够的机械强度以抵抗周围软组织压力,以维持有效的骨组织生长空间,避免缺损区塌陷,利于骨细胞的增殖分化。sf结构类似天然细胞外基质结构,为天然的细胞支架材料,但其力学性能较差;而plcl机械性能较好,将plcl与sf共混,可改善sf力学性能差的缺点。ica-sf/plcl纳米纤维膜力学性能检测结果(图6)显示,其拉伸强度为(5.54±0.46)mpa,力学性能良好,能满足临床gbr膜的强度要求。
6、体外释药行为检测
将一定量的ica-sf/plcl纳米纤维膜经紫外线正反面消毒各1h后,浸泡于30ml无菌pbs溶液,置于37℃、100rpm的恒温水浴振荡器震荡,分别于测试的1、2、3、4、5、10、15、20、25、30d的同一时间点,取5ml释放液,同时加入同体积的新鲜pbs溶液。从载药膜释放获得的ica的量,通过应用uv2600型紫外分光光度计(shimadzu,japan)在λmax=270nm处检测不同时间点收集的释放液的吸光度值计算得到,绘制药物的累积释放曲线。
药物缓释系统以稳定速率将药物释放于靶位点,可提供局部有效药物浓度,并避免全身药物副作用。ica-sf/plcl载药纤维膜体外释药结果如图7所示,从该药物累积释放曲线可以看出,整个药物释放过程呈现两个阶段:初期的药物快速释放阶段(最初的5d,药物累积释放率达47.54±0.06%)和之后的药物稳定缓慢释放阶段(最终药物累计释放率为82.09±1.86%)。发生这两个阶段的其原因为:在药物从材料释放的初期,靠近载药纤维表面的少量药物首先快速释放于周围介质,之后由于材料在介质中的逐渐降解,纤维表面形成一些微孔,使得芯层药物进一步以扩散的方式稳定、缓慢的释放出来,从而可延长药物从材料中释放的时间,降低释放速率,从而实现药物的缓释,达到发挥药物最大功效的目的。
7、体外降解性能
样本紫外线消毒,20ml无菌pbs(ph=7.4)为本研究的降解介质,置于37℃、100rpm的恒温振荡器连续震荡,分别于测试的0、1、2、4、6周的同一时间点随机取样,蒸馏水冲洗干净,干燥,用扫描电镜及电子万能力学试验机分别对ica-sf/plcl纳米纤维膜表面形貌及力学性能变化进行观察和检测。
理想的可植入材料的降解应与再生组织的生成同步发生。ica-sf/plcl载药纤维膜体外降解结果如图8所示。扫描电镜图片观察发现,降解开始前,膜纤维表面连续光滑,之后由于降解介质的冲刷作用及芯层药物的不断释放,纤维表面开始变得粗糙,出现明显的蚕蚀状空洞,但纤维膜整体结构尚存。同时,从每个时间点相对应的纤维膜的应力-应变曲线(图9)可以看出,随着降解现象的存在,ica-sf/plcl载药纤维膜中的部分纤维断裂,膜整体力学性能降低。说明该载药纤维膜具有生物可降解性。
三、体外实验
1、bmmscs的分离、培养与鉴定
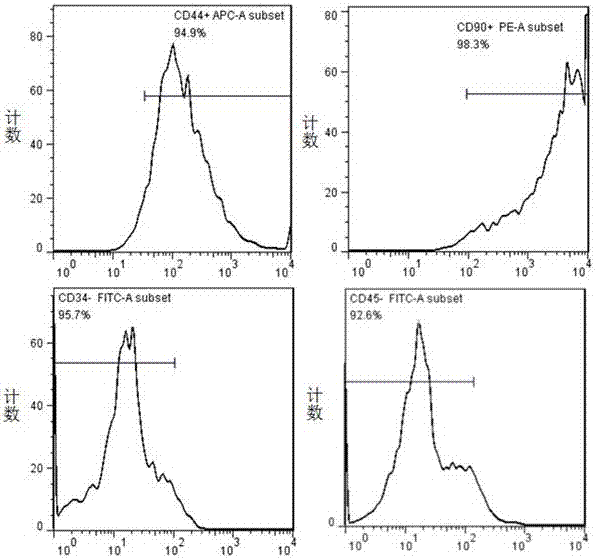
从兰州大学医学实验中心购买3~4周龄雄性生理状况良好的sd大鼠,采用过量麻药(水合氯醛)处死,立即浸泡于盛有体积分数为75%酒精的容器中10min,置于无菌操作台的手术板。严格无菌条件下获得股骨,用含10%双抗的无菌pbs冲洗3~5遍,剪去骨骺端,5ml注射器吸取含1%双抗(gibco)、10%fbs的l-dmem(hyclone,usa)反复冲洗骨髓腔至骨质发白,加入一定量完全培养液,将冲出的骨髓吹打混匀成单细胞悬液,于5%co2、37°c恒温孵箱培养。24h后半量换液,之后每2~3天换液。细胞融合度达80%~90%时传代培养。取第3代细胞进行以下相关实验的研究。应用流式细胞仪(bdfacscanto,usa)检测细胞表面标记,进行细胞鉴定:取p3代生长状态良好的bmmscs,用0.25%胰酶充分消化细胞,1000rpm离心5min,用含1%bsa的pbs清洗细胞3~5次,细胞计数,依次加入单克隆抗体cd34、cd44、cd45和cd90。同时每管设立阴性对照。避光冰上孵育45min,用含1%bsa的pbs再次清洗细胞3~5次,清除未结合抗体,接着,用500μl含1%bsa的pbs将细胞重悬,流式细胞仪进行检测分析。
流式细胞仪检测结果如附图1所示,分离培养的p3代bmmscscd44,cd90阳性表达率较高,阳性率分别为94.9%和98.3%,而cd34,cd45阳性率很低,分别为0.1%和0.7%,综合以上数据,这些细胞是来自骨髓的bmmscs。
2、膜体外成骨性能检测
将制备的ica-sf/plcl纳米纤维膜按100g/l的比例浸泡于含10%胎牛血清的l-dmem培养基内,37℃、5%co2条件下连续浸提72h,离心过滤后获得浸提液。备用。
生长状态良好的p3代bmmscs以1.0×104cells/ml的密度接种于细胞培养皿,加入10ml完全培养液,37℃、5%co2孵箱中孵育;24h后,实验组加入浸提液培养,对照组用普通完全培养液培养,每三天换液。用2%茜素红染液(genmedscientificsinc.,usa)进行钙结节检测。细胞培养14d后,4%多聚甲醛固定,37℃条件下,茜素红染色30min检测钙结节。
生长状态良好的p3代bmmscs胰酶消化后,按1×104个/ml接种于3块96孔板上,37℃、5%co2孵箱中孵育24h后,弃去旧培养液。实验分为2组,每组设6个复孔,实验组加入浸提液,对照组加入普通完全培养液,每3天换液一次。分别于第3、7、14d取一块96孔板,弃培养液,pbs清洗3遍,每孔加入500μl1%的tritonx-100(ambion,bylifetechnologies),37℃培养箱裂解1h,收集细胞裂解液,按碱性磷酸酶试剂盒(南京建成生物工程研究所,南京,中国)说明依次加入各试剂,酶联免疫检测仪(elx800,bio-tek,winooski,vt,usa)于520nm处测定各孔alp值,以均值进行统计分析(应用spss17.0软件进行统计学分析,数据以平均值±标准偏差表示。通过单因素方差分析(anova)评价各组间的统计学差异;p<0.05为差异有统计学意义。)。
3、纤维膜体外诱导骨向分化检测
茜素红染色及alp活性检测通常用来成骨分化标志物的检测。生长状态良好的p3代bmmscs经ica-sf/plcl载药纤维膜的浸提液培养14天后,茜素红染色后可观察到,细胞周围出现明显矿化结节,有橘红色区域呈现(图10a)。生长状态良好的p3代bmmscs经ica-sf/plcl载药纤维膜的浸提液分别培养3,7,14d后检测细胞内alp表达活性。发现第3,7,14d,实验组相比较于对照组,alp活性明显升高(p<0.05)。且在浸提液作用下,3-7d时alp活性增长幅度最大(图10b)。
4、细胞在膜表面形态学观察
ica-sf/plcl纳米纤维膜(10×10mm)紫外线正反面消毒后,用含10%双抗的pbs冲洗3遍,置于无菌24孔板底部,备用。对数生长期的bmmscs经0.25%胰酶消化后,反复吹打成单细胞悬液进行细胞计数,以1×104细胞/孔的密度接种于膜表面,并用消毒钢圈固定,滴加一定量的完全培养液,于37℃、5%co2条件下继续培养,48h全量更换培养液。
细胞接种培养5d后,弃出旧培养基,pbs洗涤3遍,用2.5%的戊二醛固定1h,接着再用pbs冲洗3遍,用已配制好的系列梯度浓度乙醇(30%,50%,70%,90%,95%和100%)进行细胞脱水,细胞脱水结束后进行冷冻干燥6h,喷金处理60s,用扫描电镜(s-3400n;jeol,tokyo,japan)观察细胞在膜表面的黏附情况。
扫描电镜(图11)图像显示,bmmscs接种于ica–sf/plcl载药纤维膜表面5d后,细胞在膜表面粘附、生长良好,细胞突起沿纤维走向广泛伸展,并相互融合。tian报道,细胞在材料表面的粘附随纤维直径的减小而增加(纤维在50nm至10mm范围内)。这种变化可归因于纤维的更大的表面,为细胞粘附提供更多的接触位点。
5、膜细胞毒性检测
采用体外四甲基偶氮唑盐(thiazolylbluetetrazoliumbromide,mtt)法进行ica-sf/plcl载药纤维膜的细胞毒性检测。具体的实验分组包括:实验组、对照组(无ica-sf/plcl载药纤维膜)、空白组(无细胞的培养液),每组均设有6个复孔。分别于接种培养后的1、3、5、7d各取一块24孔培养板,用移液枪每孔加入mtt液(sigma,usa)(质量浓度为5g/l)40μl,继续培养4h后,每孔再滴加dmso400μl,摇床震荡30min,使结晶完全溶解。移液枪按每孔100μl转移至96孔板,用elx800型酶联免疫检测仪(elx800,bio-tek,winooski,vt,usa)在490nm处检测吸光度值。
理想的载药膜应最大化药物治疗作用,同时毒副作用最小。mtt结果(图12)表明,bmmscs接种于ica–sf/plcl载药纤维膜表面培养1、3、5、7d后,实验组和对照组的od值都随时间推移呈增加趋势,说明在有膜和无膜条件下,细胞数量都随时间变化在增多。同时观察发现,各时间点实验组的od值均大于对照组,但差异无统计学意义(p>0.05)。证实该载药纤维膜不具有细胞毒性,适宜细胞的生长。
四、体内实验
1、动物模型的制作和材料植入
27只健康成年雄性sd大鼠(3–4周龄,80–100g)随机分为三组:i)测试组(ica-sf/plcl纳米纤维膜覆盖骨缺陷区域,n=3);ii)阴性对照组(sf/plcl膜覆盖骨缺陷区域,n=3);iii)和空白对照组(骨缺陷区域无膜覆盖,n=3)。无菌手术过程如下:10%水合氯醛(0.35ml/100g体重)腹腔注射麻醉,待麻醉显效后,备皮,局部消毒,颅顶正中作一纵行约2mm切口,分层切开,充分暴露颅骨,在大量生理盐水冲洗冷却下,用打磨机慢速以颅骨正中矢状线为中线,作一直径为8mm的圆形全层骨缺损,勿损伤硬脑膜。分别植入上述三种材料,使其超出骨缺损范围约2mm,软组织复位并逐层严密缝合。生理盐水清洗手术区域,并局部涂布抗生素软膏。术后所有动物在温暖环境中苏醒后,转移至动物房进行术后护理。
2、μ-ct评估骨生成
分别于术后4、8、12周每组分别安乐处死3只动物,获得颅骨,小心剔除附着的软组织,4%多聚甲醛固定24h。应用quantumfx型μ-ct(perkinelmer,hopkinton,ma,usa)进行扫描,其工作条件为:调整电压为90kv、电流为200μa、视野72mm和扫描分辨率为4.5μm。使用μ-ct图像分析软件(skyscan,kontich,belgium)对图像三维重建后进行新骨体积和骨矿物质密度的测量。
为评价ica-sf/plcl纳米纤维膜体内促进成骨作用,本实验制备了大鼠颅骨直径为8mm的完全骨缺损。缺损区植入材料4、8、12周后,通过μ-ct评价新骨生成。实验期间,所有实验动物植入部位均无炎症或坏死。μ-ct三维重建图像(图13)显示,与对照相比,ica-sf/plcl纳米纤维膜组在术后4、8、12周显示更多的新骨生成。
进一步应用μ-ct图像分析软件进行新骨体积和密度的定量分析(图14a,b)。结果显示,术后4周,ica-sf/plcl纳米纤维膜组骨缺损区新骨形成统计结果为:新骨体积和密度分别为1.08±0.48mm3和1.04±0.46%。ica-sf/plcl纳米纤维膜组与sf/plcl组新骨生成量差异无统计学意义(p>0.05),无膜覆盖组几乎观察不到新骨形成。术后8周,所有组均有新骨形成,与sf/plcl组及无膜覆盖组比较,ica-sf/plcl纳米纤维膜组骨缺损愈合显着较快,新骨体积和密度分别为6.09±1.27mm3、6.43±0.17%。sf/plcl组与无膜覆盖组新骨生成体积差异无统计学意义(p>0.05)。术后12周,虽然所有组均显示有新骨生成,但在ica-sf/plcl纳米纤维膜组,新生骨已扩展覆盖大部分缺陷区域,新骨体积和密度分别为约15.95±3.58mm3和14.02±0.93%,显示最快和最多骨形成。而sf/plcl组和无膜覆盖组的新骨形成仅局限于缺损中心或在缺损边缘。因此,我们证实了从ica-sf/plcl纳米纤维膜释放的ica的具有体内成骨分化活性。
3、组织学检测
固定后的样本经脱钙复合液(甲酸12ml、盐酸8ml、甲醛5ml、蒸馏水75ml)脱钙、梯度酒精脱水后,常规石蜡包埋,切片,苏木精和伊红(nanjingjianchengbiotechnologyinstitute)染色,光镜(olympus,ix70,japan)下观察。使用imagej软件(nationalinstitutesofhealth,md,usa)定量分析新骨形成,并计算新骨面积与总缺损面积比。
术后4、8、12周样本进行组织学分析进一步表征新骨形成,并计算新骨面积与总缺损面积的比率(图13)。术后4周,ica-sf/plcl纳米纤维膜组和sf/plcl组均可观察到有新骨生成,但无膜覆盖组其骨缺损区被大量纤维结缔组织填充,几乎无新骨生成。术后8周,ica-sf/plcl纳米纤维膜组显示比sf/plcl组或无膜覆盖组更多的新骨形成。其中无膜覆盖组可观察到大量纤维结缔组织。术后12周,ica-sf/plcl纳米纤维膜组新骨面积显著高于其他组。sf/plcl组是与纤维脂肪组织混合的新骨填充骨缺陷,无膜覆盖组只有一些纤维结缔组织。
综上所述,我们利用同轴静电纺丝成功制备了ica-sf/plcl纳米纤维膜,骨促进生长因子ica可包裹于纤维中而无结构完整性或功能的变化。体外成骨诱导分化和体内应用于骨缺损实验表明,该载药膜可持续、有效地释放ica而显着促进骨生成,且无细胞毒性。因此,应用同轴电纺技术制备的ica-sf/plcl纳米纤维膜是一种有前景的gbr膜。
附图说明
图1为大鼠骨髓间充质干细胞表面标志物的表达。
图2为ica-sf/plcl载药纤维膜sem图(a:×5000,b:×10000)和纤维直径分布图(c)。
图3为ica-sf/plcl载药纤维tem图(×50000)。
图4为ica-sf/plcl载药纤维膜xrd图。
图5为ica–sf/plcl载药纤维膜的亲水角。
图6为ica–sf/plcl纳米纤维膜应力-应变曲线。
图7为ica–sf/plcl纳米纤维膜体外药物释放曲线。
图8为ica–sf/plcl载药纤维膜表面形态(a~e)注:a:降解0周;b:降解1周;c:降解2周;d:降解4周;e:降解6周。
图9为ica–sf/plcl载药纤维膜拉伸强度(a~e)变化。注:a:降解0周;b:降解1周;c:降解2周;d:降解4周;e:降解6周。
图10为bmmscs培养于ica-sf/plcl纳米纤维膜浸提液后的茜素红染色结果(a)及alp分(b)。
图11为观察bmscs与ica-sf/plcl载药纤维膜复合后的细胞形态的sem(左:×1500;右:×3500)
图12为bmscs在ica-sf/plcl载药纤维膜上培养不同时间增殖情况。注:ica代表ica–sf/plcl载药纤维膜组。
图13为颅骨缺损的μ-ct图像。
图14为定量分析骨缺损区的新骨体积(a)j及密度百分比(b)。*与对照相比,骨形成明显增多(注:*p<0.05,**p<0.01。sf表示sf/plcl膜组;ica表示ica-sf/plcl纳米纤维膜组)。
图15为颅骨缺损的新骨形成的组织学分析。(a)颅骨缺损的he染色图像。比例尺=0.2mm。(b)定量分析颅骨缺损中新骨面积百分比。
具体实施方式
下面通过具体实施例对本发明采用同轴静电纺丝技术制备ica-sf/plcl纳米纤维膜的方法作进一步的说明。
(1)再生丝素蛋白的制备:将蚕茧(浙江桐庐,中国)浸于质量分数0.5%的na2co3溶液中煮沸脱胶2次,每次1h;并用蒸馏水洗涤3此除去丝胶,50℃干燥12h后,再在80℃下完全溶解于cacl2/ch3ch2oh/h2o的三元溶剂体系中(cacl2/ch3ch2oh/h2o的摩尔比为1/2/8),然后于蒸馏水中室温下透析4d,过滤,冷冻干燥,获得再生丝素蛋白sf。
(2)壳层纺丝液的制备:将上述所得sf与plcl以1:2.3~1:2.5的质量比溶于六氟异丙醇中,且使sf与plcl(mw=1,000,000;naramedicaluniversity,japan)的总质量百分数为8%,常温磁力搅拌6h,获得壳层纺丝液;
(3)芯层纺丝液的配制:将ica配制成浓度10-5μmol/l的水溶液作为芯层纺丝液;
(4)同轴静电纺丝制备ica-sf/plcl复合纳米纤维膜:将配制好的芯层纺丝液、壳层纺丝液分别装入10ml注射器中,连接同轴电纺双喷头,并与高压静电发生装置(dw-p503-1acdf;北京,中国)相连接;控制同轴电纺喷头与接收板间电压为15kv,距离为15cm,芯层纺丝液、壳层纺丝溶液推进速度分别为0.1ml/h和1.0ml/h,在温度25℃左右,相对湿度50±6%的环境下进行电纺,获得电纺丝膜;再使电纺丝膜用25%的戊二醛(国药化学试剂有限公司,中国)(电纺丝膜的大小12mm×15mm,厚0.3~0.4mm时,戊二醛的用量10ml)作为交联剂置于密闭玻璃干燥皿内交联48h,真空干燥,即得ica-sf/plcl纳米纤维膜样品。
- 还没有人留言评论。精彩留言会获得点赞!