组蛋白去乙酰化酶HDAC6的抑制剂在制备防治急性肾损伤药物中的用途的制作方法
本发明属于药物学领域,涉及一种组蛋白去乙酰化酶hdac6,具体来说是一种组蛋白去乙酰化酶hdac6的抑制剂在制备防治急性肾损伤药物中的用途。
背景技术:
急性肾损伤(acutekidneyinjury,aki)是一种常见的临床综合征,主要表现为肾功能的快速下降及代谢废物的蓄积,其诊断有赖于血清肌酐(serumcreatinine,scr)的升高和尿量的减少。aki概念的提出用于取代使用多年的急性肾衰竭(acuterenalfailure,arf)。aki的发病率高,且呈逐年上升趋势,在住院患者尤其是重症患者中十分常见,重症aki患者病死率高。最近的流行病学资料表明:即使是轻微的、可逆的aki也会造成肾脏组织的持久损伤,严重的aki造成肾功能的不可逆下降,增加死亡的风险。目前尚无治疗aki的特效药物,严重时需进行肾脏替代治疗。aki患者发展成为慢性肾脏病的风险大大增加,有部分患者会直接进展到终末期肾病。如果及时识别、去除危险因素或积极干预,许多aki的肾功能可完全或部分恢复,并脱离透析,因此,早期诊断、早期干预是改善aki预后的关键。
20世纪70年代以来,顺铂已被临床广泛用于治疗多种恶性肿瘤,包括睾丸癌、卵巢癌、膀胱癌、宫颈癌、头颈部恶性肿瘤以及小细胞或非小细胞肺癌等,是治疗实体肿瘤最有效和常用的药物之一,但在正常组织中的严重不良反应常限制其临床应用,顺铂不良反应有耳毒性、胃肠道毒性、骨髓抑制、变态反应及肾毒性,其中肾毒性最常见,顺铂治疗后,约1/3患者出现肾功能障碍导致急性肾衰竭,其剂量相关的肾毒性大大限制了临床应用。目前顺铂致肾损伤机制仍未完全明确,近年研究发现炎症介质、坏死、凋亡、氧化应激、自噬等均可能为顺铂致急性肾损伤原因。
顺铂触发的炎性反应可引起肾组织损伤及功能障碍,出现急性肾损伤。近年研究表明,各种炎症基因包括肿瘤坏死因子α(tumornecrosisfactor,tnf-α)、toll样受体4、白细胞介素18、白细胞介素6、白细胞介素1β、细胞间黏附分子1(intercellularadhesionmolecule-1,icam-1)的表达在顺铂致急性肾损伤中均有增加。核因子κb为顺铂肾损伤中被tnf-α激活的转录因子,其活化导致许多细胞因子、趋化因子、细胞间黏附分子及肾脏疾病相关受体的表达,间接抑制核因子κb能够减弱顺铂肾毒性。
顺铂肾毒性导致肾脏组织形态学改变主要表现为肾小管上皮细胞死亡,包括细胞坏死及凋亡两种形式。最近有关于顺铂肾毒性机制的研究聚焦于肾小管上皮细胞的凋亡,已经证实在顺铂导致肾小管上皮细胞损伤中有一些凋亡途径参与,包括通过死亡受体激活的外源性途径,如肿瘤坏死因子受体或fas途径,内源性线粒体途径及内质网应激途径。1999年baliga等已经证实氧化应激是顺铂肾毒性的重要机制之一,活性氧簇(reactiveoxygenspecies,ros)的产生有如下三种机制,包括膜脂质过氧化及细胞内抗氧化剂耗竭、线粒体功能障碍以及细胞色素p450系统。自噬是真核细胞特有的普遍生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用,广泛参与多种生理和病理过程。近期,takahashi及kaushal等的研究均表明,自噬可防范顺铂导致的急性肾损伤及近端小管凋亡,认为自噬对急性肾损伤引起的肾脏损害具有保护作用。
表观遗传学(epigenetics)是不涉及dna序列改变的可遗传的基因表达变化研究,在其诸多形式中,组蛋白的共价修饰占有重要地位,其与基因的表达调控密切关联,包括磷酸化、乙酰化、甲基化修饰等。组蛋白乙酰化及去乙酰化修饰是最重要的方式,是基因表达调控最主要的驱动力,此可逆的动态修饰由组蛋白乙酰基转移酶(hat)和组蛋白去乙酰化酶(histonedeacetylases,hdacs)共同催化,共同控制染色质各区域核心组蛋白的乙酰化程度。组蛋白的乙酰化程度与转录活性密切相关:转录活动区域核心组蛋白的乙酰化密度高,而不活动区域乙酰化密度低。hat促使染色体的解聚,激活转录;而hdacs则封闭dna,进而抑制转录过程。
在正常生理状态下,hat与hdacs对组蛋白乙酰化作用的调控处于平衡状态。而细胞在发生转化的状态下,hdacs的活性明显增强,使得原有的基因表达平衡状态被打破,导致一些影响细胞增殖和调控细胞周期的分子表达失衡,进而导致细胞恶变。hdacs成为表观遗传学中治疗多种临床疾病的重要和潜力靶点。
hdac家族非常庞大,目前,已有18种被分离出来,根据它们与酵母hdac蛋白的同源性以及大小、在细胞中存在部位和包含的催化位点分为四大类:i型(hdac1,2,3和8)与酵母rpd3最为相似,有着共同的催化位点,全部位于细胞核中;iia型(hdac4,5,7和9)与hdac1有共同的催化位点,在细胞核和细胞质中都有存在,而iib型(hdac6和10)具有两个催化位点,主要分布在细胞质中;iv型由hdac11单独组成,它具有i型和ii型hdac的两个催化位点。
hdac6基因定位于x染色体p11.22-23区带,约21923bp,由位于41~677bp间的28个外显子编码。从蛋白质结构来讲,hdac6含有1216个氨基酸,是目前发现的人类最大的蛋白质。hdac6在心、肝、肾、脑、胰腺等脏器中高表达,是一种胞内酶,具有泛素结合功能和去乙酰化酶活性,它与底物(α-微管蛋白、hsp90和cortactin)相互作用并使之去乙酰化。通过这些相互作用,hdac6调节许多重要的生物过程,包括细胞迁移、微管稳定性、胞内运输、免疫突触形成以及错误折叠蛋白的降解。目前研究认为,hdac6与肿瘤、神经退行性疾病、自身免疫性疾病、腹膜纤维化以及急性肾损伤的发生均有一定关联。
技术实现要素:
针对现有技术中存在的技术问题,本发明提供了一种组蛋白去乙酰化酶hdac6的抑制剂在制备防治急性肾损伤药物中的用途,所述的这种组蛋白去乙酰化酶hdac6的抑制剂在制备防治急性肾损伤药物中的用途解决了现有技术中没有合适的药物用于治疗由于急性肾损伤引起的肾脏结构和功能损害的技术问题。
本发明提供了一种组蛋白去乙酰化酶hdac6的抑制剂在制备防治急性肾损伤药物中的用途。
进一步的,所述的组蛋白去乙酰化酶hdac6的抑制剂为tubastatina。
我们在顺铂诱导的急性肾损伤小鼠模型上使用hdac6选择性抑制剂tubastatina(ta),来探讨靶向抑制hdac6对急性肾损伤的保护作用及其机制。结果发现,对顺铂诱导的急性肾损伤小鼠模型使用hdac6抑制剂ta进行干预治疗,可显著减轻小鼠急性肾损伤肾脏病理损害,改善肾功能。hdac6抑制剂ta可通过调控akt信号通路、nf-κb炎症通路、自噬水平以及e-cadherin的表达来下调炎症因子的释放,减轻氧化应激反应,从而减少肾小管细胞的凋亡和小管扩张坏死,改善肾脏病理损伤和肾功能,起到保护急性肾损伤中肾脏结构和功能的作用。因此,hdac6可成为临床上防治急性肾损伤的重要靶点。
附图说明
图1显示了hdac6抑制剂可改善顺铂诱导急性肾损伤模型中的肾脏损伤和肾功能。
图2显示了在顺铂诱导的急性肾损伤模型中,ta特异性抑制肾脏中hdac6的表达。
图3显示了ta显著上调急性肾损伤模型中乙酰化蛋白h3和acetylα-tubulin水平。
图4显示了hdac6抑制剂下调急性肾损伤模型中ngal和kim-1表达水平。
图5显示了hdac6抑制剂ta改善顺铂诱导的急性肾损伤引起的肾小管细胞凋亡水平。
图6显示了hdac6抑制剂在顺铂处理的人肾小管上皮细胞中的保护作用及机制。
图7显示了抑制hdac6可上调akt磷酸化水平和e-cadherin表达量。
图8显示了在顺铂诱导的急性肾损伤模型中,ta可上调肾脏自噬水平。
图9显示了ta下调急性肾损伤中氧化应激水平。
图10显示了ta可阻断顺铂诱导的急性肾损伤中nf-κb通路并抑制炎症因子il-6的表达。
图11显示了在顺铂诱导的急性肾损伤模型中,hdac6抑制剂显著下调肾脏炎症因子tnf-α表达水平。
具体实施方式
实施例1材料和方法
1)材料和试剂
抑制剂tubastatina购于selleckchem公司。acetyl-histoneh3,hdac6,cleavedcaspase3,p-nf-κb(p65),nf-κb(p65),e-cadherin,totalhistoneh3,p-akt,akt,p-stat3,stat3,atg7抗体均购于cellsignalingtechnology公司。il-6和tnf-α抗体购于santacruz公司。ngal和kim-1抗体购于r&d公司。lc3b/map1lc3b购于novusbiological公司。荧光二抗购于invitrogen公司。mda和sod检测试剂盒购于南京建成生物公司。顺铂,β-actin,westernblot所需二抗以及其他试剂均购于sigma公司
2)细胞培养和处理
人肾小管上皮细胞(hk2)用含5%胎牛血清,0.5%青霉素和链霉素的dmem/f12培养基培养,培养条件为37℃,5%二氧化碳和95%空气。为研究ta对于顺铂引起的肾脏损伤的作用机制,我们将hk2细胞在含0.5%胎牛血清的f12培养基中饥饿24小时后,加入终浓度为20ug/ml的顺铂模拟急性肾损伤诱导的细胞死亡,同时加入0μm、5μm、10μm三个浓度的ta进行干预24h。最后收集细胞进行westernblot检测。
3)急性肾损伤模型和实验分组
小鼠随机分为四组,每组6只。sham空白对照组腹腔注射dmso;sham+ta组腹腔注射70mg/kg的ta,溶于50uldmso中;模型组腹腔注射20mg/kg剂量的顺铂,溶于0.9%的生理盐水中,建立小鼠急性肾损伤模型;模型加药组在顺铂注射后再立即注射ta抑制剂(70mg/kg)。48小时后处死小鼠,收集肾脏标本和血液标本。所有动物实验均遵守中国实验动物管理和使用条例。
4)肾功能检测
小鼠血液标本经离心后收集血清成分,在全自动生化仪(p800,modular,usa)上检测血清肌酐和血清尿素氮指标。
5)氧化应激指标检测
在注射顺铂造模48h后,收集小鼠肾脏标本,研磨为蛋白匀浆后,用mda和sod试剂盒检测小鼠肾脏mda和sod指标含量
6)小管损伤评分
在肾脏pas病理染色中观察小管损伤程度,并根据半定量损伤评分标准进行小管损伤评估,正常肾小管组织为0分,肾小管损伤程度小于30%的为1分,肾小管损伤程度在30%-60%之间的为2分,大于60%的为3分。
7)组织学和免疫荧光染色
肾脏组织经多聚甲醛固定、石蜡包埋、组织切片后进行组织学和免疫荧光染色。hdac6,acetyl-histoneh3,ngal,kim-1等一抗浓度均为1:100,荧光二抗浓度为1:200。dapi染色根据操作说明进行。
8)蛋白质免疫印迹
腹膜组织提取蛋白,按照文献方法操作。蛋白质免疫印迹(westernblot)结果用imagej软件进行灰度分析。
9)统计分析
使用均值±sem表示数据。多组间比较用单因素方差分析(anova),两组间数据比较用t检验。以p<0.05为具有统计学意义。
实施例2hdac6抑制剂改善顺铂诱导急性肾损伤模型中的肾脏损伤和肾功能
为了检测hdac6在急性肾损伤中的作用机制,我们在顺铂诱导的小鼠急性肾损伤模型中注射了70mg/kg的hdac6特异性抑制剂ta。顺铂造模48小时后,血清肌酐和尿素氮指标明显升高,而小管扩张坏死等肾脏病理损伤表现也较为严重,而ta治疗后,其相应肾脏损伤和肾功能指标都显著下降(图1a-c)。此外,肾小管损伤评分也提示ta治疗可改善顺铂引起的肾脏病理损伤(图1d)。因此,hdac6的抑制剂ta不仅可以改善肾功能,还能减轻肾脏病理损伤。这些结果表明hdac6抑制剂ta可以保护急性肾损伤引起的肾脏损害。
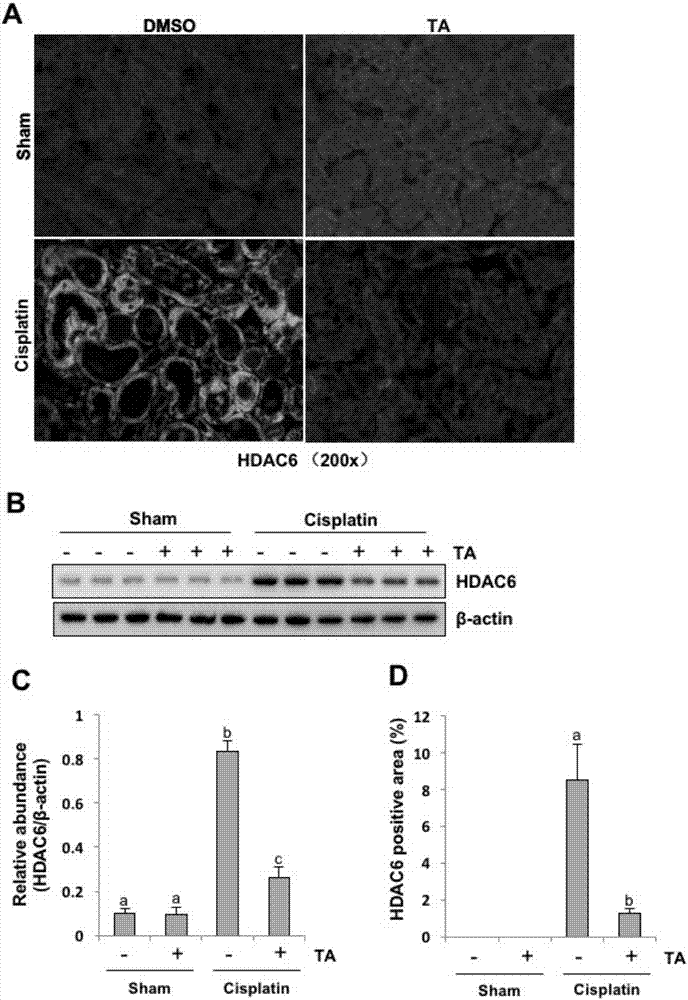
实施例3在顺铂诱导的急性肾损伤模型中,ta特异性抑制肾脏中hdac6的表达。
为证明ta对于hdac6的特异性抑制效果,我们检测了急性肾损伤模型加抑制剂ta各分组中hdac6的表达情况和表达部位。免疫荧光和免疫印迹结果显示,在正常小鼠肾脏中,hdac6表达很低或者不表达,在顺铂诱导的急性肾损伤模型中,hdac6的表达显著升高,而使用ta治疗后,其高表达水平被抑制(图2a-d)。图2c柱形图数据表明在急性肾损伤模型中,ta可抑制近70%的hdac6表达。此外,我们还在免疫荧光中观察到hdac6主要表达在扩张的肾小管上(图2a)。这些结果提示,在顺铂诱导的急性肾损伤模型中,ta特异性抑制肾脏中hdac6的表达。
实施例4ta显著上调急性肾损伤模型中乙酰化蛋白h3和acetylα-tubulin水平。
为了探讨hdac6抑制剂ta对于组蛋白乙酰化水平的影响作用,我们检测了不同实验分组中乙酰化蛋白h3和acetylα-tubulin水平。如图3a-c所示,acetyl-h3和acetylα-tubulin水平在正常肾脏中表达都较低,使用hdac6抑制剂ta后,acetyl-h3和acetylα-tubulin水平都有显著升高。不同的是顺铂诱导的急性肾损伤模型组中acetyl-h3水平高于正常对照组,而急性肾损伤中acetylα-tubulin水平低于正常肾脏表达水平。免疫荧光结果提示,在正常肾脏组织中acetyl-h3几乎不表达,在急性肾损伤的肾脏组织中表达升高,而使用ta治疗后,其表达水平显著上调,且acetyl-h3阳性细胞主要表达在肾小管细胞上(图3d)。这些结果提示,ta显著上调急性肾损伤模型中乙酰化蛋白h3和acetylα-tubulin水平。
实施例5hdac6抑制剂下调急性肾损伤模型中ngal和kim-1表达水平。
为了证明hdac6抑制剂ta对于顺铂诱导的急性肾损伤具有保护作用,我们检测了两个肾脏损伤的早期特异性生物指标,ngal和kim-1。如图4a和4c的免疫印迹结果提示,早期肾脏损伤指标ngal和kim-1在正常肾脏中不表达,在急性肾损伤小鼠的肾脏中高表达,而使用了抑制剂ta后,其表达水平又显著下降,说明hdac6抑制剂ta在急性肾损伤模型中对于肾脏组织有一定的保护作用。相类似的结果在ngal指标的免疫荧光检测中也有体现,ta显著下调ngal的表达水平(图4b和4d)。综合两个肾脏损伤的早期特异性生物指标情况,我们认为hdac6抑制剂ta在急性肾损伤模型中对于肾脏组织有一定的保护作用。
实施例6hdac6抑制剂ta改善顺铂诱导的急性肾损伤引起的肾小管细胞凋亡水平。
细胞凋亡是急性肾损伤发生过程中必不可少的步骤之一,因此我们通过凋亡tunel荧光染色和免疫印迹cleavedcaspase3水平来检测在顺铂诱导的急性肾损伤模型以及hdac6抑制剂治疗中凋亡水平的变化情况。tunel荧光染色结果提示,凋亡阳性细胞在正常肾组织中不表达,在急性肾损伤肾脏中高表达,而ta治疗后,其阳性细胞数又显著下降(图5a和5c)。在cleavedcaspase3的免疫印迹结果中,我们发现在肾损伤组中,ta治疗可下调cleavedcaspase3表达水平(图5b和5d)。综上,我们认为hdac6抑制剂ta可改善顺铂诱导的急性肾损伤引起的肾小管细胞凋亡水平。
实施例7hdac6抑制剂在顺铂处理的人肾小管上皮细胞中的保护作用及机制。
为了进一步验证hdac6抑制剂对于顺铂诱导的急性肾损伤的保护作用及其机制,我们用顺铂处理人肾小管上皮细胞(hk2)来模拟急性肾损伤中的细胞损伤环境。饥饿处理后的hk2细胞加入20ug/ml的顺铂来模拟细胞损伤环境,同时我们使用了三个浓度梯度(0,5,10μm)的ta来观察其作用效果,加药处理24小时后收集细胞做免疫印迹检测。如图6(a-h)所示,在顺铂处理的hk2细胞中,ta可抑制hdac6表达,上调acetyl-h3和acetylα-tubulin水平。在机制方面,我们观察到hdac6抑制剂ta可通过上调e-cadherin水平起到肾脏保护作用。同样的在细胞凋亡方面,我们检测了cleavedcaspase3水平,结果发现ta治疗可下调顺铂导致的hk2细胞的凋亡水平,且呈剂量依赖性。这部分的细胞实验结果证实,hdac6抑制剂对于顺铂处理的人肾小管上皮细胞有一定保护作用,并可能通过上调e-cadherin水平来发挥其肾脏保护机制。
实施例8抑制hdac6可上调akt磷酸化水平和e-cadherin表达量。
有研究发现akt是介导肾小管细胞增殖分化过程中一条重要的信号通路,因此在研究中,我们检测了在急性肾损伤模型中抑制剂ta对于akt通路的影响情况。免疫印迹结果提示当急性肾损伤发生时,磷酸化akt水平高于正常组,模型组中加入ta后其磷酸化水平显著升高,而总蛋白akt水平没有变化(图7a-7c)。另一方面,e-cadherin是一种钙依赖性的跨膜蛋白,主要参与细胞与细胞间的粘附,分布于人和动物的各类上皮细胞,在维持细胞的极性和完整性等方面起重要作用。在正常小鼠肾脏中,e-cadherin高表达。当注射顺铂引起急性肾损伤发生时,小管扩张,细胞坏死脱落,使e-cadherin表达量明显下调。若同时注射具有保护作用的ta后,e-cadherin表达水平升高(图7d和7e),这一结果提示,ta抑制hdac6可通过akt信号通路和e-cadherin机制对肾脏起保护作用。
实施例9在顺铂诱导的急性肾损伤模型中,ta可上调肾脏自噬水平。
目前普遍认为自噬是一种防御和应激调控机制。细胞可以通过自噬和溶酶体,清除、降解和消化受损、变性、衰老和失去功能的细胞、细胞器和变性蛋白质与核酸等生物大分子。为细胞的重建、再生和修复提供必须原料,实现细胞的再循环和再利用。既往研究证实自噬对急性肾损伤中的小管细胞凋亡有一定保护作用。因此,我们选取了两个自噬特异性标志蛋白atg7和lc3来检测在顺铂诱导的小鼠急性肾损伤模型以及hdac6抑制剂ta对于自噬水平的影响情况。图8(a-c)结果提示,当肾损伤发生时,小鼠肾脏自噬水平升高,而使用ta干预治疗后,其自噬水平又显著上升,说明ta对肾脏小管细胞的保护作用与自噬的激活有关。
实施例10ta下调急性肾损伤中氧化应激水平。
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(ros)和活性氮自由基(rns)产生过多,氧化程度超出氧化物的清除,氧化系统和抗氧化系统失衡,导致中性粒细胞炎性浸润,蛋白酶分泌增多,从而介导组织损伤。超氧化物歧化酶(sod)是生物体内重要的抗氧化酶,是清除氧自由基的首要物质。脂质氧化终产物丙二醛(mda)是氧化应激反应重要的氧化产物之一,可在一定程度上反应机体的氧化应激水平。我们分别使用sod和mda生物试剂盒来检测不同分组中小鼠体内的氧化应激水平。如图9(a-b)所示,与对照组相比,损伤组中肾脏sod水平下降,mda含量升高。而使用ta进行干预治疗后,sod和mda指标均有改善。这一结果提示,氧化应激参与了急性肾损伤的病变过程,而hdac6抑制剂可通过下调机体氧化应激水平来保护肾脏功能。
实施例11ta可阻断顺铂诱导的急性肾损伤中nf-κb通路并抑制炎症因子il-6的表达。
炎症反应是急性肾损伤重要的发生机制之一,其中nf-κb是调节多种细胞因子和趋化因子的转录因子。通过免疫印迹结果,我们发现顺铂诱导的急性肾损伤模型中,磷酸化nf-κb水平升高,ta治疗后炎症水平显著下调(图10a和10b)。在炎症因子白细胞介素6(il-6)的免疫组化分析中,我们发现模型组肾脏高表达il-6,而模型加药组其阳性表达区域显著减少(图10c和10d)。因此,nf-κb通路介导的炎症反应和炎症因子浸润可加重顺铂诱导的肾脏损伤程度,而ta可抑制nf-κb磷酸化及炎症因子表达,起到保护肾脏的作用。
实施例12在顺铂诱导的急性肾损伤模型中,hdac6抑制剂显著下调肾脏炎症因子tnf-α表达水平。
肿瘤坏死因子α(tnf-α)是由巨噬细胞/单核细胞活化产生的一种细胞因子,在炎症反应、细胞免疫、肿瘤免疫等多种生理和病理过程中发挥关键作用。其信号传导通路主要包括caspase家族介导的细胞凋亡、衔接蛋白traf介导的转录因子nf-κb和jnk蛋白激酶的活化。在图11(a-b)的tnf-α免疫组化结果中,我们发现正常小鼠肾脏几乎不表达tnf-α,而在急性肾损伤小鼠的肾脏中,tnf-α高表达,加入ta干预治疗后,其阳性表达区域又有明显下降,说明在顺铂诱导的急性肾损伤模型中,hdac6抑制剂显著下调肾脏炎症因子tnf-α表达水平,ta可通过抑制炎症通路来保护肾脏功能。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种含有组氨酸去乙酰化酶抑制剂衍生物的抗肿瘤药物的制造方法与工艺
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 氨甲酰基吡啶酮HIV整合酶抑制剂的方法和中间体与流程
- 一类组蛋白去乙酰化酶抑制剂及其制备方法和用途与流程
- 组蛋白去乙酰化酶抑制剂于改变蜂王浆中MRJP3蛋白质的新颖用途的制造方法与工艺
- 用于治疗疾病的硫酸乙酰肝素生物合成抑制剂的制造方法与工艺
- 酚氧类氮氧化物作为去乙酰化酶抑制剂的抗肿瘤应用的制造方法与工艺
- 作为NADPH氧化酶抑制剂的酰氨基噻二唑衍生物的制造方法与工艺
- 利用组蛋白脱乙酰酶抑制剂治疗白血病的制造方法与工艺
- 组蛋白去乙酰化酶HDAC6的抑制剂在制备防治急性肾损伤药物中的用途的制造方法与工艺
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 一种生产贝利司他中间体的工艺方法
- 组蛋白去乙酰化酶抑制剂治疗β亚科疱疹病毒的新用图
- 一种含有苯甘氨酸的肉桂酰胺类组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基)-n-羟基乙酰胺作为组蛋白去 ...的制作方法
- Hif羟化酶抑制剂的药物制剂的制作方法
- 一种组蛋白去乙酰酶抑制剂2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基-n ...的制作方法
- 一种组蛋白去乙酰酶抑制剂(e)-3-(2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚 ...的制作方法
- 广谱的去乙酰化酶抑制剂及其应用
- 广谱的去乙酰化酶抑制剂乙酰化赖氨酸及其应用
- 一种药物中间体2-芳酰基吲哚衍生物的合成方法
- 双重hdac/brd4抑制剂及其制备方法和应用
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 一种生产贝利司他中间体的工艺方法
- 组蛋白去乙酰化酶抑制剂治疗β亚科疱疹病毒的新用图
- 一种含有苯甘氨酸的肉桂酰胺类组蛋白去乙酰化酶抑制剂及其制备方法和应用
- 2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基)-n-羟基乙酰胺作为组蛋白去 ...的制作方法
- 一种组蛋白去乙酰酶抑制剂2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚-3-基-n ...的制作方法
- 一种组蛋白去乙酰酶抑制剂(e)-3-(2-(1-(4-氯苯甲酰基)-5-甲氧基-2-甲基-1氢-吲哚 ...的制作方法
- 小麦组蛋白去乙酰化酶基因TaHD2C及其应用