(+)-α-二氢丁苯那嗪在治疗运动障碍中的用途的制作方法
本发明涉及低剂量的(+)-α-二氢丁苯那嗪在治疗运动障碍中的用途,如图雷特综合症。
背景技术:
运动障碍一般分为两类:多动型运动障碍和低动型运动障碍。多动型运动障碍是由由肌肉活动增加引起的,可引起异常和/或过度运动,包括震颤、肌张力障碍、舞蹈症、抽动、肌阵挛和行为规癖。
多动型运动障碍通常是心理性的,是由于基底神经节中的胺类神经递质调节不当引起的。
图雷特综合征是一种特殊的高动型运动障碍,是一种遗传性神经系统疾病,以多种生理和发声抽搐为特征。抽搐通常具有重复性,但也有随机性,是身体动作或发声抽动。发声抽搐可以有多种形式,包括重复自己的话、他人的话或其他声音。发病通常发生在儿童时期,并持续到青春期和成年。
虽然能够暂时抑制图雷特综合征相关的抽搐,但受影响的人通常只能在有限的时间内抑制抽搐。目前还没有一种有效的治疗方法覆盖所有患者的所有抽搐类型,但是已经开发出了一些抑制抽搐的药物。
众所周知,多巴胺受体拮抗剂对图雷特综合征患者有抑制抽搐的作用,目前有多种多巴胺受体拮抗剂用于抑制图雷特综合征抽搐,例如氟奋乃静、利司培酮、氟哌啶醇以及匹莫齐特。
2型囊泡单胺转运体(vmat2)是一种将单胺类神经递质(例如多巴胺、5-羟色胺和组胺)从细胞胞浆运输到突触囊泡的膜蛋白。抑制该蛋白能够阻碍突触前神经元释放多巴胺,导致大脑内多巴胺水平耗尽。
vmat2抑制剂可以用于治疗图雷特综合征的症状。
丁苯那嗪(化学名:1,3,4,6,7,11b-六氢-9,10-二甲氧基-3-(2-甲基丙基)-2h-苯并(α)喹嗪-2-酮)自20世纪50年代末开始作为药物使用。最初作为抗精神病药物使用,丁苯那嗪目前用于治疗多动型运动障碍,例如亨廷顿氏病、偏侧投掷症、老年性舞蹈病、抽搐、迟发性运动障碍以及图雷特综合征,详见例如jankovic等,am.j.psychiatry.(1999)8月;156(8):1279-1281和jankovic等,neurology(1997)2月;48(2):358-62。
丁苯那嗪的主要药理作用是通过抑制人囊泡单胺转运体亚型2(hvmat2)来减少中枢神经系统中单胺(如多巴胺、5-羟色胺和去甲肾上腺素)的补给。该药物还能够阻断突触后多巴胺受体。
丁苯那嗪的中枢作用与利血平十分相似,但与利血平不同的是丁苯那嗪缺乏在vmat1转运体上的活性。缺乏vmat1转运体活性意味着丁苯那嗪的外周活性低于利血平,因此不会产生vmat1相关的副作用,如低血压。
丁苯那嗪是一种有效并且安全的药物,用于治疗各种多动型运动障碍,与典型的抗精神病药相比,还没有发现丁苯那嗪能引起迟发性运动障碍。然而,丁苯那嗪确实表现出一些剂量相关的副作用,包括引起抑郁症、帕金森症、嗜睡、紧张或焦虑、失眠以及罕见情况下的抗精神病药恶性综合征,详见例如wo2016/127133(神经内分泌生物学)的导论部分。
丁苯那嗪的化学结构如下。
该化合物在3和11b位的碳原子上具有手性中心,因此,理论上共存在四种异构体形式,如下所示。
每个异构体的立体化学是使用由cahn、ingold和prelog开发的“r-s”命名法进行定义的,详见jerrymarch的《高级有机化学》第4版,johnwiley和sons,纽约,1992年,第109-114页。本专利申请中,名称“r”或“s”是按照碳原子的位置号的顺序列出的。因此,例如,rs是3r,11bs的简化符号。类似地,当存在三个手性中心时,如下文所述的二氢丁苯那嗪,名称“r”或“s”是按照碳原子2、3和11b的顺序列出的。因此,2r,3s,11bs异构体简称为rss等。
市售丁苯那嗪是rr和ss异构体的外消旋混合物,rr和ss似乎是最稳定的热力学异构体。
丁苯那嗪的生物可用度较差,并且具有多变性。丁苯那嗪通过首渡代谢完成广泛性代谢,尿液中通常检测到少量或者没有原型丁苯那嗪。众所周知,丁苯那嗪的代谢产物中至少有一部分是由丁苯那嗪中的2-酮基还原形成的二氢丁苯那嗪。
二氢丁苯那嗪(化学名称:2-羟基-3-(2-甲基丙基)-1,3,4,6,7,11b-六氢-9,10-二甲氧基苯并(a)喹嗪)有三个手性中心,因此能够以以下八种光学异构体中的任何一种形式存在:
sun等人描述了八种二氢丁苯那嗪异构体的合成和表征(eur.j.med.chem.(2011),1841-1848)。
在八种二氢丁苯那嗪异构体中,四种异构体来自母体丁苯那嗪更稳定的rr和ss异构体,即rrr、sss、srr和rss异构体。
rrr和sss异构体通常称为“α”二氢丁苯那嗪,rrr和sss异构体又分别称为(+)-α-二氢丁苯那嗪和(-)-α-二氢丁苯那嗪。α异构体的特征是2-位和3-位的羟基和2-甲基丙基取代基呈反式相对定向-详见例如kilbourn等人,chirality,9:59-62(1997)和brossi等人,helv.chim.acta.,vol.xli,no.193,pp1793-1806(1958)。
srr和rss异构体通常称为“β”二氢丁苯那嗪,srr和rss异构体又分别称为(+)-β-二氢丁苯那嗪和(-)-β-二氢丁苯那嗪。β异构体的特征是2-位和3-位的羟基和2-甲基丙基取代基呈顺式相对定向。
尽管认为二氢丁苯那嗪与所述药物的活性直接相关,但迄今为止还没有研究公开发表,其中包括证明二氢丁苯那嗪的各种立体异构体中的哪一种与其生物学活性相关的证据。更具体地,还没有已发表的研究能够证实哪种立体异构体与丁苯那嗪治疗运动障碍(例如图雷特综合征)的能力相关。
schwartz等人对兔、狗和人类进行了丁苯那嗪代谢的研究(biochem.pharmacol.(1996),15:645-655)。schwartz等人鉴定出九种代谢产物,其中五种未结合,另外四种与葡萄糖醛酸结合。五种未结合的代谢产物是α-和β-二氢丁苯那嗪、它们两种的氧化类似物(2-甲基丙基侧链引入羟基)和氧化丁苯那嗪(2-甲基丙基侧链引入羟基)。四种结合的代谢产物都是由9-甲氧基去甲基化得到的9-羟基化合物。没有对各种代谢物的手性进行研究,特别是没有公开α-和β-异构体各自的手性。
scherman等人证实了外消旋体α-和β-二氢丁苯那嗪与vmat2结合的立体特异性(mol.pharmacol.(1987),33,72-77)。据其报道,体外研究中,α-二氢丁苯那嗪对嗜铬颗粒单胺转运体的亲和力比β-异构体高3-4倍。然而,scherman等人并未说明α-和β-二氢丁苯那嗪的单个对映体的拆分检测。
mehvar等人报道了给予丁苯那嗪或二氢丁苯那嗪后,大鼠脑内丁苯那嗪或二氢丁苯那嗪浓度的研究(j.pharm.sci.(1987),76(6),461-465)。该研究表明,尽管二氢丁苯那嗪极性更强,它还是能够穿过血脑屏障。然而,二氢丁苯那嗪的立体化学研究尚未公开。
mehvar等人报道了四名迟发性运动障碍患者给予丁苯那嗪后,丁苯那嗪和二氢丁苯那嗪的药代动力学研究(drugmetabolismanddisposition(1987),15:2,250-255)。口服丁苯那嗪导致血浆中丁苯那嗪浓度低,但二氢丁苯那嗪浓度相对较高。然而,体内二氢丁苯那嗪的立体化学未见报道。
roberts等人描述了受非自主运动障碍治疗的患者体内,丁苯那嗪及其羟基代谢物的药代动力学研究(eur.j.clin.pharmacol.(1986),29:703-708)。据roberts等人报道,口服给药后,丁苯那嗪被广泛代谢,导致血浆中的丁苯那嗪浓度极低,但其羟基代谢物的浓度则极高。尽管没有描述羟基代谢物的特性,他们仍然认为血浆中的高浓度羟基代谢物可能在治疗中很重要(因为已知该代谢物具有药理学活性),并且,结合schwartz等人的报道(同前),顺反异构体(即β和α异构体)的结合在治疗上可能比其母体药物更重要。
密歇根医学院的michaelkilbourn团队发表了一系列关于二氢丁苯那嗪异构体的研究。因此,kilbourn等人描述了用(+/-)-α-[11c]-二氢丁苯那嗪作为vmat2结合研究的活体显像剂(med.chem.res.(1994),5:113-126)。
kilbourn等人用[3h]-丁苯那嗪进行了竞争性结合研究,探讨了(+)-、(-)-和(+/-)-α-dhtbz的体外结核亲和性(eur.j.pharmacol(1995)278,249-252)。结合研究得出,(+)-α-二氢丁苯那嗪的ki值是0.97nm,(-)-α-二氢丁苯那嗪的ki值是2.2μm,从而表明,较(-)α异构体而言,(+)α异构体与vmat2受体的结合亲和力更强。然而,关于这两种异构体在治疗运动障碍(如图雷特综合征)方面的作用还没有任何研究报道,也没有得出任何结论。
kilbourn等人还确定了(+)-α-二氢丁苯那嗪的绝对构型,由此得出结论,其具有上面所示的2r、3r、11br构型(chirality(1997)9:59-62)。他们还提到了上述schwartz等人和mehvar等人发表的文章,表明α-和β-二氢丁苯那嗪可能是人脑中的药理活性剂,但他们没有对丁苯那嗪的活性代谢物的精确立体化学特性得出明确的结论。
kilbourn等人还提出了在“输注平衡法”中,使用(+)-α-[11c]-二氢丁苯那嗪作为检测vmat受体特异性体内结合的试剂(synapse(2002),43:188-194)。他们发现(-)-α-[11c]-二氢丁苯那嗪产生了均匀的脑分布,这与之前观察到的该对映体具有低vmat亲和力的观察结果一致。
sun等人(同上)研究了所有八种二氢丁苯那嗪异构体的vmat2结合亲和力。他们发现所有的右旋对映体都表现出比相应的左旋对映体更强大的vmat2结合活性,其中(+)-α-异构体的活性最强。然而,sun等人没有对各异构体治疗运动障碍(例如图雷特综合征)的相对疗效进行研究。
wo2015/120110(auspex)描述了可包括多种不同药理剂的缓释制剂,包括丁苯那嗪和二氢丁苯那嗪。wo2015/120110一般性地公开了该制剂可能包括5mg至30mg的丁苯那嗪或二氢丁苯那嗪,更具体地公开了包括7.5mg、12.5mg、15mg、25mg、30mg和50mg量的丁苯那嗪或二氢丁苯那嗪的缓释制剂。然而,并没有具体公开含有(+)-α-二氢丁苯那嗪的制剂。
此外,没有任何二氢丁苯那嗪的工作实例;只有含有丁苯那嗪的制剂。
wo2006/053067(prestwick)描述了氨基三环癸胺和丁苯那嗪化合物(可以是丁苯那嗪或二氢丁苯那嗪)联合治疗多动型运动障碍的应用。wo2006/053067公开了二氢丁苯那嗪的给药量可以是每天10-400mg(尽管没有提供实例证明该范围低值剂量仍然有效),并且还描述了仅含有10mg的药物成分。wo2006/053067没有将二氢丁苯那嗪的任何特定的异构体与这些量特别地联合起来,更具体地,没有披露10mg(+)-α-二氢丁苯那嗪的具体用途。wo2006/053067没有提供实验数据。
wo2011/153157(auspex制药公司)描述了二氢丁苯那嗪的氘化形式。该公开描述了二氢丁苯那嗪的多种氘化形式,但仅提供了允许合成少量所述化合物的信息。尽管其公开了d6-α-二氢丁苯那嗪和d6-β-二氢丁苯那嗪的外消旋混合物,但这些混合物并没有被分解,也没有对各(+)和(-)异构体的性质进行研究。同样地,wo2014/047167(auspex制药公司)描述了丁苯那嗪及其衍生物的一些氘化形式。此外,α-和β-二氢丁苯那嗪的氘化形式的各(+)和(-)异构体还没有被分离或研究。
因此,到目前为止,究竟是哪种二氢丁苯那嗪异构体与丁苯那嗪的治疗效果有关仍不清楚。
到目前为止,还有些不清楚的是,在治疗诸如图雷特综合征等运动障碍时,(+)-α-二氢丁苯那嗪是否会产生有效的治疗效果,并且不会出现诸如上述等副作用。例如,尽管wo2016/127133(神经内分泌生物学)提到kilbourn等人在chirality(同上)发表的文章表明(+)-α-二氢丁苯那嗪是丁苯那嗪的活性代谢物。同时也参考了login等人((1982),ann.neurology12:257-62)和reches等人(j.pharmacol.exp.ther.(1983),225:515-521)的研究报告,表明丁苯那嗪抑制大鼠脑内突触前和突触后多巴胺受体。wo2016/127133中提出,丁苯那嗪的“脱靶”活性可能与观察到的一些丁苯那嗪的副作用有关。
如上所述,已知丁苯那嗪存在许多剂量相关的副作用,包括引起抑郁和帕金森症(详见wo2016/127133)。这些副作用似乎也可能是由vmat2抑制引起的,因此很难将丁苯那嗪的治疗效果与从副作用中得到的丁苯那嗪衍生物区分开来(详见müller,“缬苯那嗪治疗迟发性运动障碍的突破性药物地位”,expertopin.investig.drugs(2015),24(6),pp.737-742)。
为了避免或减少丁苯那嗪相关的副作用,开发了一种(+)-α-二氢丁苯那嗪的缬氨酸酯前体药,其国际非专有药名为缬苯那嗪(valbenazine)。缬苯那嗪的结构如下:
如us8039627所述,在n,n-二环己基碳二亚胺(dcc)存在下,在二氯甲烷和4-二甲氨基吡啶(dmap)中,(+)-α-二氢丁苯那嗪与羧苄氧基-l-缬氨酸反应生成中间体2-苄氧羰基氨基-3-甲基丁酸(2r,3r,1br)-3-异丁基-9,10-二甲氧基-1,3,4,6,7,11b-六氢-2h-吡啶[2,1-α]异喹啉-2-基酯。然后通过钯在中间体的碳位上氢化以去除苄氧羰基保护基,得到缬苯那嗪。
müller(“缬苯那嗪治疗迟发性运动障碍的突破性药物地位”,expertopin.investig.drugs(2015),24(6),pp.737-742)描述了在患有迟发性运动障碍的受试者中进行的缬苯那嗪的iib期临床研究(“kinect1”)。尽管观察到100mg/天剂量的缬苯那嗪(相当于76mg的(+)-α-二氢丁苯那嗪)可以减轻症状,但接受50mg/天缬苯那嗪(相当于38mg的(+)-α-二氢丁苯那嗪)的受试者的异常不自主运动量表(aims)评分没有任何明显的改善迹象。müller得出的结论是该研究或多或少是失败的,可能是由于缬苯那嗪剂量低。
在同一篇文章中,还进行了进一步的研究(“kinect2”),受试者的初始计量是25mg/天,后续剂量范围增加到75mg/天。研究结束进行测量时,给予缬苯那嗪的34名受试者中有21名的剂量达到了75mg/天(o’brien等人,“kinect2:nbi-98854治疗中重度迟发性运动障碍”mov.disord.2014;29(suppl1):829)。该分析没有提供试验结束时接受75mg/天剂量的受试者和试验结束时接受25mg/天或50mg/天剂量的受试者异常非自主运动减少的详细情况。
o’brien等人进一步报道了缬苯那嗪的iii期试验(“kinect3缬苯那嗪(nbi-98854)治疗迟发性运动障碍的随机双盲安慰剂对照3期试验(pl02.003)”neurology(2016),86(16),supplementpl02.003),研究了迟发性运动障碍患者每天服用40mg或80mg缬苯那嗪后异常不自主运动的变化。他们发现80mg/天的缬苯那嗪可显著改善异常非自主运动评分,并得出结论认为80mg/天的缬苯那嗪可显著改善迟发性运动障碍。
wo2015/171802(neurocrine生物科学公司)描述了通过给予治疗剂治疗多动型疾病的方法,该治疗剂能够在血浆中产生(+)-α-二氢丁苯那嗪浓度,并且八小时内的cmax在15ng/ml到60ng/ml之间,cmin至少是15ng/ml。尽管wo2015/171802建议这可以通过给予(+)-α-二氢丁苯那嗪实现,但wo2015/171802中描述的实验仅提供了给予缬苯那嗪后达到的(+)-α-二氢丁苯那嗪水平的数据。wo2015/171802的实例1的结果表明,血浆中30ng/ml的(+)-α-二氢丁苯那嗪是合适的靶点并且低于15ng/ml的暴露在一般的迟发性运动障碍(td)人群中是次优的。在wo2015/171802的实例2中,公开了50mg剂量的缬苯那嗪似乎能维持血浆中所需的的(+)-α-二氢丁苯那嗪水平。
w02016/210180(neurocrine生物)公开了vmat2抑制剂用于治疗多种神经系统疾病的用途。(+)-α-二氢丁苯那嗪作为vmat2抑制剂的实例被提及,并且公开了提供类似于w02015/171802中所述血浆浓度的治疗剂。w02016/210180中具体例示的vmat2抑制化合物是缬苯那嗪和[(2r,3s,11br)-9,10-二甲氧基-3-(2-甲基丙基)-1h,2h,3h,4h,6h,7h,11bh-吡啶[2,1-α]异喹啉-2-基]甲醇。
技术实现要素:
本发明的研究表明(+)-α-二氢丁苯那嗪本身具有化学名称“(r,r,r)-3-异丁基-9,10-二甲基氧基-1,3,4,5,7,11b-六氢-2h-吡啶[2,1-α]异喹啉-2-基酯”,具有式(i),
其在运动障碍的治疗中有效,并且剂量远低于文献(例如wo2015/171802)所预测的剂量,并且其如此低的使用剂量可以避免丁苯那嗪相关的不良作用或将丁苯那嗪相关的不良作用最小化。
更具体地,本公开进行的实验表明给予(+)-α-二氢丁苯那嗪本身能够有效治疗运动障碍(如图雷特综合征),并且(+)-α-二氢丁苯那嗪的剂量远低于wo2015/171802e中所要求的缬苯那嗪剂量。
此外,与wo2015/171802的指导相反,已发现给予一定剂量的(+)-α-二氢丁苯那嗪,使8小时内血浆浓度不超过15ng/ml,可以得到有效结果。
低剂量的使用有望减少丁苯那嗪和丁苯那嗪衍生物相关的生物副作用,包括帕金森症和抑郁症。
与前药缬苯那嗪相比,使用(+)-α-二氢丁苯那嗪本身的一个优点是它避免了从(+)-α-二氢丁苯那嗪到缬苯那嗪生产所需的两个额外的合成步骤和额外的纯化步骤。此外,活性(+)-α-二氢丁苯那嗪在血浆中的释放不受前药降解速率的限制。
使用低剂量(+)-α-二氢丁苯那嗪的另外一个出乎意料的优点是本发明人进行的实验表明,尽管在运动障碍中发现的所述类型的运动障碍会被所述药物减少或抑制,但正常的运动不受影响。这与利培酮相反,利培酮是一种治疗运动障碍的常用药物,使用该药物时,正常和异常运动的水平都会被减少。
在这些结果的基础上,设想低剂量(+)-α-二氢丁苯那嗪可用于预防或治疗尤其是目前使用或提议使用丁苯那嗪的疾病状态和条件。因此,举例来说,并且没有限制,设想低剂量的(+)-α-二氢丁苯那嗪可用于治疗多动型运动障碍,例如亨廷顿氏病、偏侧投掷症、老年性舞蹈病、抽动障碍、迟发性运动障碍、肌张力障碍,特别是图雷特综合征。
根据本公开,受试者最初可被给予极低剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐(例如0.5mg至5mg),并且在必要和可取的情况下,在增加所述剂量之前评价所述初始剂量的治疗效果。因此,从极低的初始剂量开始,可以对受试者进行滴定测量以确定特定运动障碍的最佳剂量。该初始低剂量远低于目前临床应用的丁苯那嗪最低剂量。
因此,在第一方面(实施例1.1),本公开提供了一种治疗有需要的受试者的运动障碍的方法,所述治疗包括以下步骤:
(a)给予所述受试者初始日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,其中所述初始日剂量是与0.5mg至5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
(b)对所述受试者进行临床评价,以了解所述治疗所产生的疗效和副作用;
(c)当所述临床评价(b)已经确定需要增加日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐时,给予增加的日剂量,所述增加的日剂量大于所述初始日剂量,其增加量为与0.5mg至5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量;或者,当所述临床评价已经确定不需要增加日剂量时,维持所述初始日剂量、减少所述剂量或停止所述治疗;
(d)当已经给予增加的日剂量时,对所述受试者进行进一步的临床评价,以了解增加日剂量的治疗所产生的疗效和副作用;
(e)当所述进一步的临床评价(d)已经确定需要进一步增加日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐时,给予进一步增加的日剂量,所述进一步增加的日剂量大于前一天的日剂量,其增加量为与0.5mg至5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量;或者,当所述临床评价已经确定不需要进一步增加日剂量时,维持所述前一天的日剂量、减少所述前一天的日剂量或停止所述治疗;以及
(f)根据需要任选地重复步骤(d)和(e),直到达到最优日剂量。
在上述方法的具体实施例中,提供:
1.2根据实施例1.1所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于0.5mg至3mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.3根据实施例1.2所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于0.5mg至2mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.4根据实施例1.2所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于0.5mg、1mg、1.5mg或2mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.5根据实施例1.4所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于0.5mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.6根据实施例1.4所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于1mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.7根据实施例1.4所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于1.5mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.8根据实施例1.4所述的方法,其中(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述初始日剂量是对应于2mg的(+)-α-二氢丁苯那嗪游离碱的量。
1.9根据实施例1.1至1.8中任一项所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与0.5mg至3mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.10根据实施例1.9所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与0.5mg至2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.11根据实施例1.10所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与0.5mg、1mg、1.5mg或2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.12根据实施例1.11所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与0.5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.13根据实施例1.11所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与1mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.14根据实施例1.11所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与1.5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.15根据实施例1.11所述的方法,其中步骤(c)中所述增加的日剂量与所述初始日剂量相比,其增加量为与2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.16根据实施例1.1至1.15中任一项所述方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与0.5mg至3mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.17根据实施例1.16所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与0.5mg至2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.18根据实施例1.17所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与0.5mg、1mg、1.5mg或2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.19根据实施例1.18所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与0.5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.20根据实施例1.18所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与1mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.21根据实施例1.18所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与1.5mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.22根据实施例1.18所述的方法,其中步骤(e)中所述进一步增加的日剂与前一天的日剂量相比,其增加量为与2mg的(+)-α-二氢丁苯那嗪游离碱相对应的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。
1.23根据实施例1.1至1.22中任一项所述方法,其中所述治疗包括给予最大(例如最优)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于20mg的(+)-α-二氢丁苯那嗪游离碱。
1.24根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于17.5mg的(+)-α-二氢丁苯那嗪游离碱。
1.25根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于15mg的(+)-α-二氢丁苯那嗪游离碱。
1.26根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于12.5mg的(+)-α-二氢丁苯那嗪游离碱。
1.27根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于10mg的(+)-α-二氢丁苯那嗪游离碱。
1.28根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于9mg的(+)-α-二氢丁苯那嗪游离碱。
1.29根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于8mg的(+)-α-二氢丁苯那嗪游离碱。
1.30根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于7.5mg的(+)-α-二氢丁苯那嗪游离碱。
1.31根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于7mg的(+)-α-二氢丁苯那嗪游离碱。
1.32根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于6mg的(+)-α-二氢丁苯那嗪游离碱。
1.33根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于5mg的(+)-α-二氢丁苯那嗪游离碱。
1.34根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于4mg的(+)-α-二氢丁苯那嗪游离碱。
1.35根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于3mg的(+)-α-二氢丁苯那嗪游离碱。
1.36根据实施例1.23所述方法,其中所述治疗包括给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述量对应于不多于2.5mg的(+)-α-二氢丁苯那嗪游离碱。
至少在最初时,先通过确定所述受试者的体重,然后给予适合于所述受试者体重的剂量,来确定给予受试者的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量。因此,在进一步实施例中,本公开提供:1.37根据实施例1.1至1.23中任一项所述方法,其中所述治疗包括确定所述受试者的大概体重以及:
(i)当所述受试者体重为30kg至50kg时,给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量对应于2mg至7.5mg的(+)-α-二氢丁苯那嗪游离碱;
(ii)当所述受试者体重为50kg至75kg时,给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量对应于5mg至10mg的(+)-α-二氢丁苯那嗪游离碱;
(iii)当所述受试者体重为75kg至95kg时,给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量对应于7.5mg至15mg的(+)-α-二氢丁苯那嗪游离碱;或
(iv)当所述受试者体重大于95kg时,给予最大(例如优化的)日剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量对应于15mg至20mg的(+)-α-二氢丁苯那嗪游离碱,每日给予的(+)-α-二氢丁苯那嗪的量是15mg至20mg。
1.38一种治疗有需要的受试者的运动障碍的方法,所述治疗包括给予所述受试者有效量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,其中:
(i)当所述受试者体重为30kg至50kg时,所述有效量是对应于2mg至7.5mg的(+)-α-二氢丁苯那嗪游离碱的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的日剂量;
(ii)当所述受试者体重为50kg至75kg时,所述有效量是对应于5mg至10mg的(+)-α-二氢丁苯那嗪游离碱的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的日剂量;
(iii)当所述受试者体重为75kg至95kg时,所述有效量是对应于7.5mg至15mg的(+)-α-二氢丁苯那嗪游离碱的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的日剂量;或
(iv)当所述受试者体重大于95kg时,所述有效量是对应于15mg至20mg的(+)-α-二氢丁苯那嗪游离碱的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的日剂量,每天的(+)-α-二氢丁苯那嗪的量是15mg至20mg。
1.39一种治疗有需要的受试者的运动障碍的方法,所述治疗包括给予所述受试者有效量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,其中所述有效量对应于每天0.05mg/kg至0.3mg/kg的(+)-α-二氢丁苯那嗪游离碱的量。
1.40根据实施例1.39所述的方法,其中所述有效量对应于每天0.1mg/kg至0.2mg/kg的(+)-α-二氢丁苯那嗪游离碱的量。
给予的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量由所述受试者体内期望达到的(+)-α-二氢丁苯那嗪血浆浓度或期望的vmat2蛋白阻断水平来确定。因此,本公开还提供:
1.41一种治疗有需要的受试者的运动障碍的方法,其中所述治疗包括给予受试者治疗有效量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,其中,在三小时内进行测量时,所述有效量足以使(+)-α-二氢丁苯那嗪的平均血浆cavg浓度在3ng/ml至15ng/ml范围内。
1.42根据实施例1.1至1.40中任一项所述的方法,其中给予所述受试者的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述日剂量、日量或有效量足够引起所述受试者体内50%至85%vmat2蛋白的阻断水平。
1.43根据实施例1.1至1.40中任一项所述的方法,其中给予所述受试者的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述日剂量、日量或有效量足够引起所述受试者体内55%至85%vmat2蛋白的阻断水平。
1.44根据实施例1.42或1.43所述的方法,其中治疗包括给予所述受试者一定剂量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量足够引起所述受试者体内(或视情况而定,所述受试者大脑内)70%至85%vmat2蛋白的阻断水平。
在进一步的实施例中,本公开提供:
1.45根据实施例1.1至1.44中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐给予所述受试者每天一次。
1.46根据实施例1.1至1.44中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐给予所述受试者每天两次。
1.47根据实施例1.1至1.46中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐不与治疗有效量的氨基三环癸胺联合施用。
1.48根据实施例1.47所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐不与任何量的氨基三环癸胺联合施用。
1.49根据实施例1.1至1.48中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐作为非缓释剂型或迟释剂型施用(例如即释单元剂型)。
1.50根据实施例1.1至1.49中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐是口服施用。
1.51根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以片剂、胶囊、溶液、糖浆或悬液的形式施用。
1.51a根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以片剂的形式施用。
1.51b根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以溶液的形式施用。
1.51c根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以糖浆形式施用。
1.51d根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以悬液的形式施用。
1.52根据实施例1.50所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐以胶囊的形式施用。
1.52a(+)-α-二氢丁苯那嗪或其药学上可接受的盐在实施例1.1至1.52中任一项定义的方法中的用途。
1.52b(+)-α-二氢丁苯那嗪或其药学上可接受的盐在实施例1.1至1.52中任一项定义的方法的药物生产中的用途。
本公开还提供了一种创新的低剂量单位剂型,所述剂型含有(+)-α-二氢丁苯那嗪或其药学上可接受的盐。因此,在进一步的实施例中,本公开提供:
1.53一种单位剂型,其包括0.5mg至20mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.54根据实施例1.53所述的单位剂型,其配制用于口服施用。
1.55根据实施例1.54所述的单位剂型,是胶囊或片剂。
1.56根据实施例1.53至1.55中任一项所述的单位剂型,其包括1mg至20mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.57根据实施例1.53至1.55中任一项所述的单位剂型,其包括2mg至20mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.58根据实施例1.53至1.55中任一项所述的单位剂型,其包括0.5mg至10mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.59根据实施例1.53至1.55中任一项所述的单位剂型,其包括0.5mg至7.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.60根据实施例1.53至1.55中任一项所述的单位剂型,其包括1mg至10mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.61根据实施例1.53至1.55中任一项所述的单位剂型,其包括1mg至7.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.62根据实施例1.53至1.55中任一项所述的单位剂型,其包括3mg至20mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.63根据实施例1.53至1.55中任一项所述的单位剂型,其包括2mg至15mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.64根据实施例1.53至1.55中任一项所述的单位剂型,其包括3mg至15mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.65根据实施例1.53至1.55中任一项所述的单位剂型,其包括4mg至15mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.66根据实施例1.53至1.55中任一项所述的单位剂型,其包括5mg至15mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.67根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约0.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.68根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约1mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.69根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约1.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.70根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约2mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.71根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约2.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.72根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约3mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.73根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约3.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.74根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约4mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.75根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约4.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.76根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.77根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约7.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.78根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约10mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.79根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约12.5mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.80根据实施例1.53至1.55中任一项所述的单位剂型,其包括大约15mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.81根据实施例1.53至1.55中任一项所述的单位剂型,其包括0.5mg至3mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.82根据实施例1.53至1.55中任一项所述的单位剂型,其包括0.5mg至2mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.83根据实施例1.53至1.55中任一项所述的单位剂型,其包括1mg至3mg的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,以及药学上可接受的赋形剂。
1.84根据实施例1.1至1.52中任一项所述的方法,其中所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐根据实施例1.53至1.83中任一项作为单位剂型施用。
上述定义和描述的方法和单位剂型通常用于治疗多动型运动障碍,例如亨廷顿氏病、偏侧投掷症、老年性舞蹈病、抽动障碍、迟发性运动障碍、肌张力障碍、肌阵挛和图雷特综合征。
更具体地,上文所述单位剂型用于治疗选自抽动障碍、迟发性运动障碍和图雷特综合征的多动型运动障碍。
在一个特定的实施例中,上文所述单位剂型用于治疗迟发性运动障碍。
在另一个特定的实施例中,上文所述单位剂型用于治疗图雷特综合征。
本文中用于治疗疾病或障碍的术语“治疗”通常涉及达到某种期望治疗效果的治疗和疗法,例如对所述病情发展的抑制,并且包括进展速度的减缓、进展速度的停顿、所述病情的改善、至少一种与正在治疗的病情有关或由其引起的症状的减少或减轻和病情的治愈。当所述治疗的多动型运动障碍是图雷特综合征时,所述障碍的治疗可能与抽动的发生率或严重程度的减缓有关。
因此,在进一步的实施例中,本公开还提供:
1.85根据实施例1.1至1.52以及1.84中任一项所述的方法,其中所述运动障碍选自迟发性运动障碍、图雷特综合征以及亨廷顿氏病。
1.86根据实施例1.85所述的方法,其中所述运动障碍是图雷特综合征。
1.87根据实施例1.85所述的方法,其中所述运动障碍是亨廷顿氏病。
1.88根据实施例1.85所述的方法,其中所述运动障碍是迟发性运动障碍。
如上所述,本发明人发现低剂量的(+)-α-二氢丁苯那嗪治疗有助于在运动障碍的治疗中阻断所述vmat2受体。因此,在进一步的实施例中,本公开提供:
1.89(+)-α-二氢丁苯那嗪治疗运动障碍的方法中的用途,其中所述治疗包括每天给予受试者0.5mg至20mg的量的(+)-α-二氢丁苯那嗪。
1.90一种治疗有需要的受试者(例如哺乳动物类受试者,如人)的运动障碍的方法,所述治疗包括给予所述受试者每天0.5mg至20mg的量的(+)-α-二氢丁苯那嗪。
1.91(+)-α-二氢丁苯那嗪治疗运动障碍的方法中的用途,所述治疗包括给予所述受试者每天0.5mg至20mg的量的(+)-α-二氢丁苯那嗪。
在进一步的实施例中,还提供了:
1.92本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天1mg至20mg的量的(+)-α-二氢丁苯那嗪。
1.93本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天2mg至20mg的量的(+)-α-二氢丁苯那嗪。
1.94本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天3mg至20mg的量的(+)-α-二氢丁苯那嗪。
1.95本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天2mg至15mg的量的(+)-α-二氢丁苯那嗪。
1.96本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天3mg至15mg的量的(+)-α-二氢丁苯那嗪。
1.97本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天5mg至15mg的量的(+)-α-二氢丁苯那嗪。
1.98本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天5mg至10mg的量的(+)-α-二氢丁苯那嗪。
1.99本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天大约5mg的量的(+)-α-二氢丁苯那嗪。
1.100本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天大约7.5mg的量的(+)-α-二氢丁苯那嗪。
1.101本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天大约10mg的量的(+)-α-二氢丁苯那嗪。
1.102本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天大约12.5mg的量的(+)-α-二氢丁苯那嗪。
1.103本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天大约15mg的量的(+)-α-二氢丁苯那嗪。
在每种情况下,除非上下文另有说明,否则规定的(+)-α-二氢丁苯那嗪的量可以每天施用一次或每天施用几次(例如两次)。
一些实施例中,指定的(+)-α-二氢丁苯那嗪的量每天施用一次。
典型的慢性治疗方案的一部分是给予(+)-α-二氢丁苯那嗪。因此,所述(+)-α-二氢丁苯那嗪可以给患者施用持续至少一周的治疗周期,更通常地,至少两周,或至少一个月,通常超过一个月。如果患者对治疗反应良好,所述治疗期可以超过六个月,也可以延长至数年。
慢性治疗方案可能涉及每天给予(+)-α-二氢丁苯那嗪,或者所述治疗方案可能包括不给予(+)-α-二氢丁苯那嗪的天数。
给予所述受试者的剂量在所述治疗期间可能有所不同。例如,所述初始剂量可能会根据所述受试者对所述治疗的反应而增加或减少。例如,可能给予受试者较低的初始剂量来测试受试者对(+)-α-二氢丁苯那嗪的耐受程度,此后的剂量随需要增加至最大日摄入量20mg。或者,可以选择给予所述受试者的初始日剂量,以便给出预计的期望vmat2阻断程度,随后可以在所述治疗期间的剩余时间内给予较低的维持剂量,如果所述受试者对所述治疗的反应表明有必要增加剂量,则可选择增加剂量。
达到所述预期治疗效果所需的(+)-α-二氢丁苯那嗪的量可能取决于接受治疗的所述受试者的体重。给予所述受试者的(+)-α-二氢丁苯那嗪的量可以用mg/kg表示,其中所述kg与接受治疗的所述受试者的体重有关。因此,可以用所述mg/kg的值乘以接受治疗的所述受试者的体重计算出所述适当剂量。因此,本公开还提供:
1.104(+)-α-二氢丁苯那嗪在治疗运动障碍的方法中的用途,其中所述治疗包括每天给予受试者0.01mg/kg至0.5mg/kg剂量的(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.105一种治疗有需要的受试者(例如人等哺乳类动物受试者)的运动障碍的方法,所述治疗包括给予所述受试者每天0.01mg/kg至0.5mg/kg剂量的(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.106(+)-α-二氢丁苯那嗪在制备治疗运动障碍使用的药物的中的用途,所述治疗包括给予所述受试者0.01mg/kg至0.5mg/kg剂量的(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
在进一步的实施例中,还提供了:
1.107本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.01mg/kg至0.3mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.108本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.02mg/kg至0.3mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.109本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.03mg/kg至0.3mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.110本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.04mg/kg至0.3mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.111本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.05mg/kg至0.3mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.112本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.02mg/kg至0.2mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.113本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.03mg/kg至0.2mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.114本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.04mg/kg至0.2mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.115本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.05mg/kg至0.2mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.116本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.02mg/kg至0.1mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.117本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.03mg/kg至0.1mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.118本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.04mg/kg至0.1mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
1.119本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者每天0.05mg/kg至0.1mg/kg(+)-α-二氢丁苯那嗪,使每天施用的(+)-α-二氢丁苯那嗪总量在0.5mg至20mg范围内(例如1mg至20mg)。
在上述各方面和实施例中,可以将(+)-α-二氢丁苯那嗪作为所述游离碱或作为药学上可接受的盐施用。在一个实施例中,所述(+)-α-二氢丁苯那嗪作为药学上可接受的盐施用。在另一个实施例中,所述(+)-α-二氢丁苯那嗪作为游离碱施用。由所述游离碱计算(+)-α-二氢丁苯那嗪的量,或者当所述(+)-α-二氢丁苯那嗪以药学上可接受的盐的形式存在时,(+)-α-二氢丁苯那嗪的量就是所述药学上可接受的盐中存在的(+)-α-二氢丁苯那嗪游离碱的量。
本发明人发现,有效治疗多动型运动障碍所需的(+)-α-二氢丁苯那嗪血浆水平可以大大低于wo2015/171802中所述的通过服用缬苯那嗪所达到的血浆水平。
因此,在另一方面(1.120),本公开提供:
-(+)-α-二氢丁苯那嗪或其药学上可接受的盐在治疗运动障碍的方法中的用途;或
-一种治疗有需要的受试者(例如人等哺乳类动物受试者)的运动障碍的方法;或
-(+)-α-二氢丁苯那嗪在制备治疗运动障碍使用的药物中的用途;
其中,所述治疗包括给予受试者治疗有效量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量足以在五小时内使平均血浆浓度cavg值达到2ng/ml至15ng/ml范围内。
在一个实施例(1.121)中,本公开提供:
-(+)-α-二氢丁苯那嗪或其药学上可接受的盐在治疗运动障碍的方法中的用途;或
-一种治疗有需要的受试者(例如人等哺乳类动物受试者)的运动障碍的方法;或
-(+)-α-二氢丁苯那嗪在制备治疗运动障碍使用的药物中的用途;
其中所述治疗包括给予受试者治疗有效量的(+)-α-二氢丁苯那嗪或其药学上可接受的盐,所述剂量足以在三小时内使平均血浆浓度cavg值达到3ng/ml至15ng/ml范围内。
完全阻断vmat2是不可取的,因为这可能导致不必要的副作用,例如帕金森病。本公开提供的(+)-α-二氢丁苯那嗪血浆浓度足以有效治疗运动障碍,但又不阻断vmat2从而导致帕金森病和类似的副作用。vmat2阻断的水平可以通过使用正电子发射断层扫描(pet)的竞争性结合研究来确定。通过在不同浓度条件下与感兴趣的化合物共同施用放射性配体,确定所占结合位点的比例(详见例如,mattews等人,“药物开发的正电子发射断层分子成像”,br.j.clin.pharmacol.,73:2,175-186)。
因此,本公开提供:
1.122(+)-α-二氢丁苯那嗪在治疗运动障碍的方法中的用途,其中所述治疗包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足以在所述受试者中引起90%的vmat2蛋白阻断。
1.123一种治疗有需要的受试者(例如人等哺乳类动物受试者)的运动障碍的方法,所述方法包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足以在所述受试者中引起90%的vmat2蛋白阻断。
1.124(+)-α-二氢丁苯那嗪在制备治疗运动障碍使用的药物中的用途,所述方法包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足以在所述受试者中引起90%的vmat2蛋白阻断。
在进一步的实施例中,本公开提供:
1.125本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白85%的阻断水平。
1.126本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白80%的阻断水平。
1.127本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白75%的阻断水平。
1.128本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白70%的阻断水平。
1.129本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白25%至85%的阻断水平。
1.130本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白30%至80%的阻断水平。
1.131本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白35%至75%的阻断水平。
1.132本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白35%至70%的阻断水平。
1.133本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予所述受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至75%的阻断水平。
1.134本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白45%至75%的阻断水平。
1.135本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白35%至80%的阻断水平。
1.136本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至80%的阻断水平。
1.137本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白45%至80%的阻断水平。
1.138本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白50%至80%的阻断水平。
1.139本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白55%至80%的阻断水平。
1.140本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白30%至70%的阻断水平。
1.141本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白30%至65%的阻断水平。
1.142本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白30%至60%的阻断水平。
1.143本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至80%的阻断水平。
1.144本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至75%的阻断水平。
1.145本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至70%的阻断水平。
1.146本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至65%的阻断水平。
1.147本文所述的(+)-α-二氢丁苯那嗪的用途、方法或使用,其中所述治疗包括给予有需要的所述受试者,其中所述方法包括给予受试者一定量的(+)-α-二氢丁苯那嗪,所述量足够在所述受试者体内引起所述vmat2蛋白40%至60%的阻断水平。
在本公开进一步的实施例中,特别地,设想低剂量的(+)-α-二氢丁苯那嗪可用于治疗5岁至16岁青少年受试者的多动型运动障碍。
因此,本公开还提供:
1.148(+)-α-二氢丁苯那嗪在治疗5岁至16岁青少年受试者多动型运动障碍的方法中的用途,其中所述治疗包括给予受试者每天0.5mg至12.5mg的(+)-α-二氢丁苯那嗪。
1.149一种治疗有需要的5岁至16岁青少年受试者(例如人等哺乳类动物受试者)多动型运动障碍的方法,其中所述治疗包括给予所述受试者每天0.5mg至12.5mg的(+)-α-二氢丁苯那嗪。
1.150(+)-α-二氢丁苯那嗪在制备治疗运动障碍使用的药物中的用途,所述治疗包括给予5岁至16岁的受试者每天0.5mg至12.5mg的(+)-α-二氢丁苯那嗪。
在进一步的实施例中,提供:
1.151(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至10mg的(+)-α-二氢丁苯那嗪。
1.152(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至8mg的(+)-α-二氢丁苯那嗪。
1.153(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至7.5mg的(+)-α-二氢丁苯那嗪。
1.154(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至7mg的(+)-α-二氢丁苯那嗪。
1.155(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至6mg的(+)-α-二氢丁苯那嗪。
1.156(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天0.5mg至5mg的(+)-α-二氢丁苯那嗪。
1.157(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至12.5mg的(+)-α-二氢丁苯那嗪。
1.158(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至10mg的(+)-α-二氢丁苯那嗪。
1.159(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至8mg的(+)-α-二氢丁苯那嗪。
1.160(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至7.5mg的(+)-α-二氢丁苯那嗪。
1.161(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至7mg的(+)-α-二氢丁苯那嗪。
1.162(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至6mg的(+)-α-二氢丁苯那嗪。
1.163(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天1mg至5mg的(+)-α-二氢丁苯那嗪。
1.164(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天大约2.5mg的(+)-α-二氢丁苯那嗪。
1.165(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天大约5mg的(+)-α-二氢丁苯那嗪。
1.166(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天大约7.5mg的(+)-α-二氢丁苯那嗪。
1.167(+)-α-二氢丁苯那嗪在实施例1.148至1.150中任一项所定义的方法或用途中的用途,其中所述治疗包括给予所述受试者每天大约10mg的(+)-α-二氢丁苯那嗪。
在实施例1.148至1.167的每一项中,所述接受(+)-α-二氢丁苯那嗪治疗的人类受试者是5周岁至16周岁。所述受试者的体重通常不超过80kg,例如体重在17kg至70kg范围之间。
在其他实施例(实施例1.168)中,所述(+)-α-二氢丁苯那嗪给予体重20至65kg的青少年。
在其他实施例(实施例1.169)中,所述(+)-α-二氢丁苯那嗪给予体重20至60kg的青少年。
在一个实施例(实施例1.170)中,所述受试者年龄是5岁至8岁,给予的所述(+)-α-二氢丁苯那嗪的量是每天0.5mg至5mg。
在另一个实施例(实施例1.171)中,所述受试者年龄是9岁至12岁,给予的所述(+)-α-二氢丁苯那嗪的量是每天1mg至8mg。
在进一步的实施例(实施例1.172)中,所述受试者年龄是13岁至16岁,给予的所述(+)-α-二氢丁苯那嗪的量是每天2mg至12.5mg。
在进一步的实施例(实施例1.173)中,所述(+)-α-二氢丁苯那嗪的用途、实施例1.148至1.172中任一项所定义的方法或用途,可能包括步骤(a)、(b)和实施例1.1至1.36中任一项所定义的可选步骤(c)、(d)、(e)以及(f)。
在实施例1.1至1.52b和1.85至1.174中的每一项所述的方法和用途,需要给予受试者的所述(+)-α-二氢丁苯那嗪或其药学上可接受的盐的量在一定程度上取决于所述受试者对所述化合物的代谢速度。
多种药物(约占目前所有处方药的25%)的代谢涉及细胞色素p4502d6(cyp2d6)酶,该酶主要在肝脏中表达。
大约7%的人群具有这种酶的缓慢作用形式,7%的人群有超快作用形式。百分之三十五的人群是非功能性cyp2d6等位基因的携带者。
因此,受试者可以根据以下分类:
·代谢不良人群-很少或没有cyp2d6功能;
·中等代谢人群-以介于代谢不良人群和快速代谢人群之间的速度代谢药物;
·快速代谢人群-具有正常的cyp2d6功能;
·超快速代谢人群-表达所述cyp2d6的多个拷贝,因此比正常cyp2d6的功能更强。
因此,在个体之间产生的cyp2d6酶的效率和量存在相当大的差异。因此,对于由cyp2d6代谢的药物,某些人(超快速代谢人群)会很快消除这些药物,而其他人(代谢不良人群)则会缓慢地消除。如果药物代谢过快,可能会降低所述药物的效力,而如果药物代谢过慢,则可能会导致毒性。
许多商用诊断检测可用于确定受试者属于快速代谢人群还是代谢不良人群,这些检测包括genelexlabsllc(seattle,wa98121,美国)和trimgencorporation(sparks,maryland21152,美国)提供的cyp2d6基因分型检测。
因此,在本文所述的方法和用途中的每一种中,例如在实施例1.1至1.52b和1.85至1.173中,所述用途或方法可能包括一个步骤,所述步骤包括对受试者进行检测以确定所述受试者的所述cyp2d6状态,然后用所述检测结果作为确定给予所述受试者的(+)-α-二氢丁苯那嗪或其药学上可接受的盐的所述量的一个因素。因此,快速代谢人群可能被施用给定的范围的高值的量,而慢速代谢人群则可能被施用较小的量。
在前述实施例1.1至1.173的每一项中,所述单位剂型(或在所述方法中施用的物质)相对于所述(+)-α-二氢丁苯那嗪而言,包括的二氢丁苯那嗪的任何其他异构体的重量不超过20%;相对于所述(+)-α-二氢丁苯那嗪而言,更常用地包括的二氢丁苯那嗪的任何其他异构体的重量不超过10%;相对于所述(+)-α-二氢丁苯那嗪而言,优选地包括的二氢丁苯那嗪的任何其他异构体的重量不超过5%;相对于所述(+)-α-二氢丁苯那嗪而言,更优选地包括的二氢丁苯那嗪的任何其他异构体的重量不超过2%。
因此,所述(+)-α-二氢丁苯那嗪通常具有至少80%的异构体纯度。
本文上下文中的所述术语“异构体纯度”是指相对于所有异构体形式的二氢丁苯那嗪的所述总量或浓度而言的(+)-α-二氢丁苯那嗪的量。例如,如果所述成分中存在的所述总二氢丁苯那嗪的90%是(+)-α-二氢丁苯那嗪,则所述异构体纯度是90%。
本公开的(+)-α-二氢丁苯那嗪的异构体纯度可能大于82%,大于85%,大于87%,大于90%,大于91%,大于92%,大于93%,大于94%,大于95%,大于96%,大于97%,大于98%,大于99%,大于99.5%,或大于99.9%。
盐
所述(+)-α-二氢丁苯那嗪可以以游离碱或盐的形式存在。除非上下文另有说明,本文中提到的所有(+)-α-二氢丁苯那嗪包括游离碱和其盐形式的(+)-α-二氢丁苯那嗪。
在一个实施例(实施例1.174)中,实施例1.1至1.173中任一项所定义的所述(+)-α-二氢丁苯那嗪是游离碱形式。
在另一个实施例(实施例1.175)中,实施例1.1至1.173中任一项所定义的所述(+)-α-二氢丁苯那嗪是盐形式。
这些盐通常是酸加成盐。
所述盐可以通过传统的化学方法从所述母体化合物合成,例如《药物盐:性质、选择和应用》(p.heinrichstahl(主编),camilleg.wermuth(主编),isbn:3-90639-026-8,精装版,388页,2002年8月)中描述的方法。通常,这类盐可以通过在水或有机溶剂或所述二者的混合液中,用所述游离碱形式的所述化合物与所述酸反应来制备;通常使用非水介质,如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。
酸加成盐可以以多种酸(包括无机酸和有机酸)的形式形成。酸加成盐的实例包括由酸形成的盐,所述酸选自下组:乙酸、2,2-二氯乙酸、己二酸、海藻酸、抗坏血酸(例如l-抗坏血酸)、l-天冬氨酸、苯磺酸、苯甲酸、4-乙酰氨基苯甲酸、丁酸、(+)樟脑酸、樟脑磺酸、(+)-(1s)-樟脑酸-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、d-葡萄糖酸、葡萄糖醛酸(如d-葡萄糖醛酸)、谷氨酸(如l-谷氨酸)、α-酮戊二酸、乙醇酸、马尿酸,氢溴酸、盐酸、氢碘酸、羟乙磺酸、(+)-l-乳酸、(±)-dl-乳酸、乳糖酸、马来酸、苹果酸、(-)-l-苹果酸、丙二酸、(±)-dl-扁桃酸、甲磺酸、萘-2-磺酸、萘-1,5-二磺酸、1-羟基-2-萘甲酸、烟酸、硝酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、磷酸、丙酸、l-焦谷氨酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、鞣酸、(+)-l-酒石酸、硫氰酸、对甲苯磺酸、十一碳烯酸和戊酸,以及酰化氨基酸和阳离子交换树脂。
本公开所述化合物的所述盐形式通常是药学上可接受的盐,药学上可接受的盐的实例在berge等人1977年的《药学上可接受的盐》(j.pharm.sci.第66卷,1-19页)中加以讨论。然而,不属于药学上可接受的盐也可以作为中间体形式制备,然后转化成药学上可接受的盐。这类非药学上可接受的盐也可以构成本公开的一部分,例如在本公开所述化合物的所述纯化或分离中可能有用。
同位素
所述(+)-α-二氢丁苯那嗪可能包括一个或多个同位素置换和对特定元素的引入,包括在范围内的所述元素的所有同位素。例如,对氢的引入包括在其范围内的1h、2h(d)和3h(t)。同样,对碳和氧的引入分别包括在其范围内的11c、12c、13c和14c以及16o和18o。
典型地,本公开所述(+)-α-二氢丁苯那嗪不包括高于其自然丰度的同位素(例如11c或3h)。
在一个实施例中,(+)-α-二氢丁苯那嗪中氘原子占所述总氢原子的百分比小于2%,更典型地小于1%,更通常地小于0.1%,优选地小于0.05%,并且最优选地不大于0.02%。
类似地,对特定功能基团的引入也包括在其范围内的同位素变化,除非上下文另有说明。
所述同位素可以是放射性或非放射性的。在本公开的一个实施例中,所述(+)-α-二氢丁苯那嗪不含放射性同位素。所述化合物优选地用于治疗用途。然而,在另一个实施例中,所述(+)-α-二氢丁苯那嗪可能包括一种或多种放射性同位素。
含有这种放射性同位素的化合物在诊断方面可能是有用的。
溶剂化物
(+)-α-二氢丁苯那嗪可形成溶剂化物。
溶剂化物的实例是通过将非毒性的药学上可接受的溶剂分子(以下称为溶剂)与本公开所述化合物的固态结构(例如晶体结构)合并而形成的溶剂化物。这类溶剂的实例包括水、醇(例如乙醇、异丙醇和丁醇)和二甲基亚砜。溶剂化物可以通过用溶剂或含有所述溶剂的溶剂混合物对本公开所述化合物进行再结晶来制备。在任何给定情况下都可以用众所周知的标准技术,例如热重力分析(tge)、差示扫描量热法(dsc)和x射线晶体学,分析所述化合物的晶体,来确定溶剂化物是否已经形成。
所述溶剂化物可以是化学计量溶剂化物或非化学计量溶剂化物。
特定的溶剂化物为水合物,水合物的特定实例包括半水合物、单水合物和二水合物。
有关溶剂化物及制备和表征的方法的更详细讨论,详见bryn等人《药物的固态化学》,第二版,ssci公司(westlafayette,in,美国)出版(1999年,isbn0-967-06710-3)。
另外,本公开所述化合物可以是无水的,而不是以水合物形式存在。因此,在另一实施例中,所述(+)-α-二氢丁苯那嗪是无水形式。
附图说明
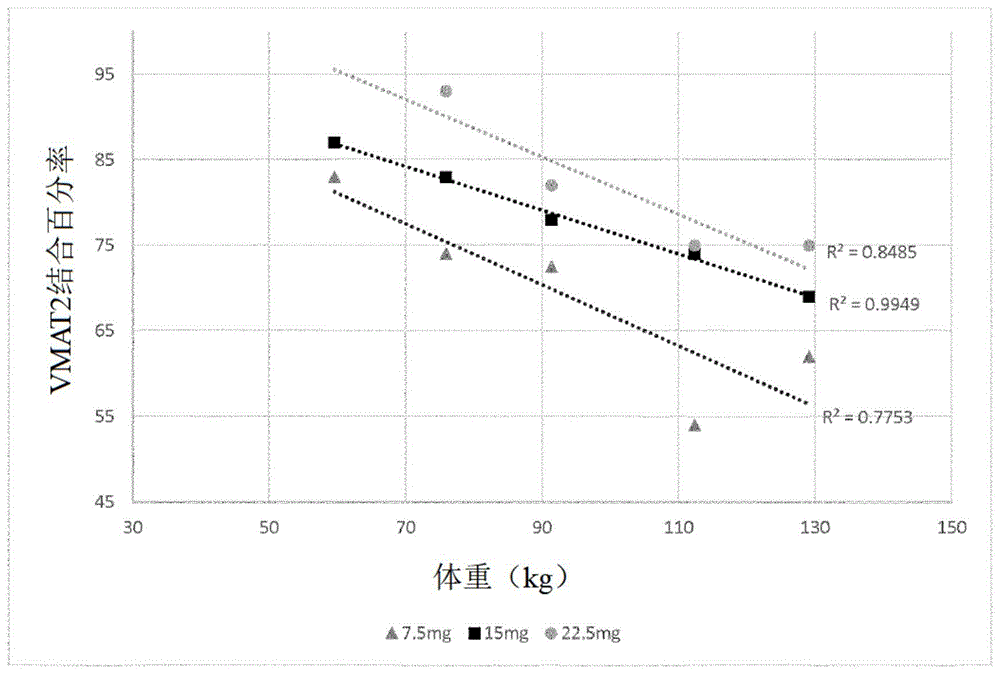
图1是给人类受试者施用7.5mg、15mg和22.5mg剂量的(+)-α-二氢丁苯那嗪后,vmat2结合百分率与体重的关系图。
图2是vmat2结合百分率与以mg/kg体重为单位给人类受试者施用的(+)-α-二氢丁苯那嗪的量的关系图。
图3展示了用安慰剂(有或无苯丙胺诱导)处理大鼠时和用0.5、1、1.5和2mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg剂量的利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总运动距离,如下文研究1的实施例2所述。
图4展示了用安慰剂(有或无苯丙胺诱导)处理大鼠时和用0.5、1、1.5和2mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg剂量的利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总刻板行为,如下文研究1的实施例2所述。
图5展示了安慰剂(有或无苯丙胺诱导)处理大鼠时和用0.1mg/kg和0.25mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总运动距离,如下文研究2的实施例2所述。
图6展示了用安慰剂(有或无苯丙胺诱导)处理大鼠时和用0.1mg/kg和0.25mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总刻板行为,如下文研究2的实施例2所述。
图7展示了用安慰剂、2.5mg/kg或5mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg剂量的利培酮处理非苯丙胺诱导的大鼠时,大鼠的平均总运动距离,如下文研究3的实例2所述。
图8展示了用安慰剂、2.5mg/kg或5mg/kg剂量的(+)-α-二氢丁苯那嗪以及1mg/kg剂量的利培酮处理非苯丙胺诱导的大鼠时,大鼠的平均总刻板行为,如下文研究3的实例2所述。
图9展示了用安慰剂、分别1mg/kg或1.5mg/kg剂量的(+)-α-二氢丁苯那嗪和缬苯那嗪以及1mg/kg剂量的利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总运动距离,如下文研究4的实例2所述。
图10展示了用安慰剂、分别1mg/kg或1.5mg/kg剂量的(+)-α-二氢丁苯那嗪和缬苯那嗪以及1mg/kg剂量的利培酮处理苯丙胺诱导的大鼠时,大鼠的平均总刻板行为,如下文研究4的实例2所述。
具体实施方式
制备(+)-α-二氢丁苯那嗪的方法
以丁苯那嗪为原料,按方案1所示的合成路线,可制备出(+)-α-二氢丁苯那嗪(式(i)的化合物)。
外消旋丁苯那嗪(3-异丁基-9,10-二甲氧基-1,3,4,6,7,11b-六氢-2h-吡啶[2,1-α]异喹啉-2-基酯)含有丁苯那嗪的rr和ss异构体,是用硼氢化钠还原得到四种二氢丁苯那嗪异构体的混合物,所述α-二氢丁苯那嗪的外消旋混合物(rrr和sss异构体)构成主要产物,β-二氢丁苯那嗪的外消旋混合物(srr和rss异构体)构成次要产物。β-二氢丁苯那嗪可以在初始纯化过程中被除去,例如通过色谱法或重结晶,然后所述外消旋α-二氢丁苯那嗪分解(例如通过二对甲苯基-l-酒石酸或(r)-(-)-樟脑磺酸重结晶或通过手性色谱法)得到(+)-α-二氢丁苯那嗪(i)((2r,3r,11br)-3-异丁基-9,10-二甲氧基-1,3,4,6,7,11b-六氢-2h-吡啶[2,1,α]异喹啉-2-醇)。可以确定(+)-α-二氢丁苯那嗪的立体化学结构,例如通过形成结晶形式的盐(如所述甲磺酸盐)以及用x射线晶体学鉴定的结构。
也可以根据yao等人《vmat2抑制剂丁苯那嗪异构体和二氢丁苯那嗪八种异构体的制备和评价》(eur.j.med.chem.,(2011),46,pp.1841-1848)制备(+)-α-二氢丁苯那嗪。
药物制剂
在实施例1.1至1.175中的每一项中,其中所述化合物作为药物单位剂型或其他药物成分施用,本公开所述药物成分可以是任何形式的,所述形式适合于口服、肠外、外用、鼻内、支气管内、眼用、耳用、直肠、阴道内或经皮给药。如果所述成分用于肠外给药,则可配制成静脉、肌肉、腹腔、皮下给药或通过注射、输液或其他方式直接递送到靶器官或组织。
适用于口服给药的药物剂型包括片剂、胶囊、囊片、丸剂、含片、糖浆、溶液、喷剂、粉末、颗粒、酏剂以及悬浮液、舌下片、喷雾剂、薄片或贴剂以及口腔贴片剂。
根据实施例1.1至1.175使用的一组特定药物剂型,包括片剂、胶囊、溶液、糖浆、悬浮液和凝胶。
含有本公开所述二氢丁苯那嗪的药物组合物可根据已知的技术来配制,详见例如《雷明登氏药学全书》,mack出版公司,easton,pa,美国。
因此,片剂组合物可以包括单位剂量的活性化合物以及惰性稀释剂或载体,诸如糖或糖醇,例如乳糖、蔗糖、山梨醇或甘露醇;和/或非糖衍生稀释剂,例如碳酸钠、磷酸钙、滑石粉、碳酸钙,或纤维素或其衍生物,例如甲基纤维素,乙基纤维素,羟丙基甲基纤维素,以及淀粉,例如玉米淀粉。片剂还可以含有作为粘合剂和赋形剂的标准成分,例如聚乙烯吡咯烷酮、崩解剂(例如膨胀交联聚合物,如交联羧甲基纤维素)、润滑剂(如硬脂酸酯)、防腐剂(例如对羟基苯甲酸酯)、抗氧化剂(例如bht)、缓冲液(例如磷酸盐或柠檬酸盐缓冲液)以及起泡剂(例如柠檬酸盐/碳酸氢盐混合物)。这类辅料是众所周知的,不需要在这里详细讨论。
胶囊制剂可以是硬明胶或软明胶品种,并且可以在固体、半固体或液体形式中包括所述活性成分。明胶胶囊可以由动物明胶或其合成物或其植物衍生物制成。
所述固体剂型(例如片剂、胶囊等)可以被包覆或不包覆,但通常具有包覆层,例如保护膜包覆层(例如蜡或清漆)或释放控制包覆层。所述包覆层(例如eudragittm型聚合物)可设计为在胃肠道内的所需位置释放(+)-α-二氢丁苯那嗪。因此,可以选择所述包覆层以便在胃肠道的特定ph条件下进行降解,从而选择性地在所述胃或所述回肠或十二指肠中释放所述化合物。
所述释放控制包覆层可以设计为按照一定速率释放(+)-α-二氢丁苯那嗪,以便在至少2小时内维持治疗有效血浆浓度,更典型地在至少3小时内,例如至少4小时或至少5小时。
所述组合物可能包括多个单个单元,例如丸或迷你片剂,其中每个单元均含有(+)-α-二氢丁苯那嗪,并且每个单元都可包覆释放控制剂。
代替或除了包覆层之外,所述药物还可以在固体基质中存在,所述固体基质包括释放控制剂,例如缓释剂,其可适用于在胃肠道中酸碱度变化的条件下选择性地释放所述化合物。或者,所述基质材料或缓释包覆层可以采用可腐蚀聚合物(例如马来酸酐聚合物)的形式,当所述剂型通过所述胃肠道时,所述可腐蚀聚合物基本上持续地释放。
局部使用的成分包括软膏、乳霜、喷雾、贴片、凝胶、滴液和植入物(例如眼内植入物)。这种成分可以按照已知方法配制。
用于肠外施用的成分通常以无菌水溶液或油性溶液或精细悬浮液的形式存在,或者可以提供精细分割的无菌粉末形式,用于注射用无菌水即用即配。
用于直肠或阴道内给药的制剂的实例包括栓和栓剂,所述栓和栓剂可以以例如由含有所述活性化合物的可成型或蜡状材料构成。
吸入给药的成分可以采用可吸入粉末成分或液体或粉末喷雾的形式,并且可以使用粉末吸入器装置或气溶胶分配装置以标准形式施用。这类装置是众所周知的。对于吸入给药,所述粉末制剂通常包括所述活性化合物和惰性固体粉末稀释剂(例如乳糖)。
本公开的特定药物成分是选自:
·舌下成分;
·鼻内的;
·提供与所述活性化合物零级释放对应的释放动力学的丸或片剂;
·提供所述活性化合物的第一次快速释放后的恒定速率释放(零级)的丸或片剂;
·提供所述活性化合物一级和零级释放的混合物的丸或片剂;以及
·提供所述活性化合物零级和一级释放的组合的丸或片剂;和任选地,从第二、第三和第四级释放及其组合中选择的所述活性化合物的进一步释放级别。
为提供上述类型的释放动力学而制备的丸和片剂可根据技术人员熟知的方法制备;例如《雷明登氏药学全书》(同上)和《雷明登:药学技术与实践》(第21版,2006年,isbn0-7817-4673-6)。
本公开所述化合物通常以单位剂型呈现,因此通常含有足够的化合物来提供所需的生物活性水平。所述量见上文。
所述活性化合物以足够达到所述需要的治疗效果的量施用给有需要的受试者(患者),例如人类或动物患者。
实例
以下非限制性实例说明本公开的(+)-α-二氢丁苯那嗪的合成和性质。
实例1
口服给五名人类志愿者施用固定量的(+)-α-二氢丁苯那嗪。其中四名所述志愿者在给药30、60、120和180分钟后采集血样。第五名志愿者没有采集血样。给药60分钟后,开始进行pet扫描,并在给药120分钟时停止。
本实验以7.5mg、15mg和22.5mg的剂量进行。
结果
表1展示了五名人类受试者在给予7.5mg、15mg和22.5mg剂量后0.5、1、1.5、2和3小时时的(+)-α-二氢丁苯那嗪血浆浓度(以纳克/毫升为单位)。表2展示了给予7.5mg、15mg和22.5mg剂量的(+)-α-二氢丁苯那嗪后,五名受试者的vmat2阻断百分比。
表1
blq-低于定量范围;nd-未检测
表2
尽管在体重较轻的受试者中,在给定剂量下观察到较高的(+)-α-二氢丁苯那嗪血浆浓度,但可以看出,即使在体重较重的个体中,在低至7.5mg的剂量下也能够观察到至少50%的vmat2阻断,而在体重较轻的个体中,vmat2的结合百分比明显较高。还观察到,在pet扫描期间,低于15ng/ml的平均血浆水平导致至少50%的vmat2结合。
所述数据表明,极低剂量的(+)-α-二氢丁苯那嗪(使血浆浓度低于15ng/ml)仍然可以导致较高水平的vmat2阻断。
受试者1至5的数据用于制作在所述三个剂量水平下vmat2结合百分率与体重的曲线图(图1)和vmat2结合百分率与给予的(+)-α-二氢丁苯那嗪的量(以mg/kg体重为单位)的曲线图(图2)。受试者6的数据有些异常,未包括在图1或图2内。
根据上述数据,图1展示了给予每种(+)-α-dhtbz剂量(7.5mg、15mg和22.5mg)时,vmat2结合百分率与体重的关系。看得出来,对于给定的剂量,体重与vmat2结合百分率之间存在良好的相关性。
根据上述数据,图2展示了vmat2结合百分率与给予所述受试者每kg体重的(+)-α-dhtbz的量的关系。看得出来,给予所述受试者每kg体重的(+)-α-dhtbz的量与vmat2结合百分率之间存在良好的相关性。
因此,预计提供给定的vmat2结合水平而需要给予的(+)-α-dhtbz的量很大程度上取决于所述受试者的体重。
实例2-二氢丁苯那嗪与利培酮对苯丙胺诱导的兴奋性运动的影响比较
图雷特综合征的多巴胺能模型使用全身或局部施用多巴胺激动剂,如苯丙胺。注射苯丙胺后,实验动物表现出刻板行为。具体而言,可以用苯丙胺刺激野生型小鼠和大鼠的与图雷特综合征有关的多巴胺能系统,并且所述导致的功能亢进和刻板行为可以用多巴胺拮抗剂(如利培酮和氟哌啶醇)进行逆转(图雷特综合征-动物模型筛选,charlesriverdiscoveryresearchservices,finland)。
苯丙胺使小鼠和其他物种动物脑多巴胺的胞外浓度升高,并出现伴随行为表现。在相对较低剂量(腹腔注射1.2ng/kg)下,苯丙胺会增加运动行为,停止运动,并让位于静止姿势,同时伴有高度重复的快速头部运动。这种刺激后非运动期被称为集中刻板。所述刻板可以持续超过一小时,之后通常会有一段时间的运动刺激(schiorring1997年)。
已知给予多巴胺激动剂(如苯丙胺)会导致行为定型和感觉运动门控中断。此外,多巴胺能、胆碱能(tans)和hdc模型(压力和/或苯丙胺注射后)也显示出刻板行为的增加(yao等人,2016年)。
苯丙胺诱导的刻板行为也被评价为运动障碍状态、迟发性运动障碍的模型(详见rubovitis等人(1972年))。
所述非典型抗精神病药物利培酮通常用于治疗图雷特综合征,并且已经被认为可能是抑制抽搐的最佳非典型抗精神病药(j.d.walkup,《图雷特综合征药物指南》,2008年出版,国家图雷特综合征协会),与氟哌啶醇和氟哌嗪相比,其潜在的运动副作用风险更低。
为了比较二氢丁苯那嗪和利培酮对苯丙胺诱导和非苯丙胺诱导的大鼠兴奋性运动的影响,我们进行了三项研究,基于上述原因,运动研究是图雷特综合征和其他运动障碍的有利模型。
材料和方法
设备
空旷实验场所,medassociates公司
1ml塑料注射器,terumo。参考号:ss-01t1
15g动物喂食针,instechsolomon,类别号:72-4446
sartorius机械电子秤a22101型,sartoriusweightingtechnology,德国
27g针,terumomyjector,0.5ml,参考号:8300010463
3ml塑料注射器,soft-ject,参考号:8300005761
bdmicrotainerk2edta管,参考号:365975
matrix0.75ml,alphanum管,thermoscientific,参考号:4274
微孔板装置,单板24孔,10ml,参考号:734-1217
thermo电子公司heraeusfresco17,低温离心机
实验动物
所有动物实验均按照国家卫生研究所(nih)《实验动物管理和使用指南》进行,并且经芬兰国家动物试验委员会批准。实验用雄性cd(charlesriverlaboratories,德国)体重范围为200-250g(到达时体重165-200g)。动物饲养于标准温度(22±1℃)和光控制的环境中(从早上七点到晚上八点有光),可以任选获取食物和水。
方法
在空旷实验场所对所述大鼠的自主活动进行测试。在所述大鼠光周期内,在正常光均匀分布到所述实验场所条件下进行开放式场地实验。用活动监视器记录所述大鼠的活动路径(med.associates公司)。
在lma试验之前,给予所述安慰剂、安慰剂-苯丙胺、(+)-α-dhtbz或利培酮。将所述大鼠放在所述试验场所的中心,记录其60分钟的路径。
终点、血样本和组织处理
在实验结束后的10分钟内,用过量的co2将所述实验动物安乐死。除安慰剂组大鼠外,各组大鼠均采用心脏穿刺法采集终末血样本,用连接了18g针头的注射器采集0.5ml血液,然后将其移到预冷的k2-edta微管中。将edta微管颠倒混匀几次,使edta和血液混合。然后立即将管放在湿冰上,在收集10-15分钟内进行4℃离心2分钟(heraeusfresco17,9.6×1000g/10×1000rpm),并根据样品图收集200μl血浆放在干冰上的96孔板中(matrixtechnologiesscreenmates,0.75mlalphanumeric圆底储存管,pp)。
采集血样后,颈部在颅底处脱臼。收集脑部并称重。记录脑的重量并将所述脑放在干冰上的24孔板中冻存。
所述血浆和脑样本在-80℃条件下保存,直到送检分析或销毁。
研究1
研究了给予0.5mg/kg至2mg/kg剂量的(+)-α-二氢丁苯那嗪和1mg/kg的利培酮对大鼠刻板行为和运动距离的影响。
动物分组如下:
·组1:10只大鼠,给予安慰剂(t=0min)和安慰剂(t=30min)
·组2:10只大鼠,给予安慰剂(t=0min)和苯丙胺(t=30min)
·组3:10只大鼠,给予0.5mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组4:10只大鼠,给予1mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组5:10只大鼠,给予1.5mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组6:10只大鼠,给予2mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组7:10只大鼠,给予1mg/kg利培酮(t=0min)和苯丙胺(t=30min)
结果
1.运动距离
给予安慰剂、0.5mg/kg(+)-α-dhtbz、1mg/kg(+)-α-dhtbz、1.5mg/kg(+)-α-dhtbz、2mg/kg(+)-α-dhtbz或1mg/kg利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的自主活动进行3min间隔评价及整体评价。图3显示了试验时间内的标准化总运动距离。
与所述安慰剂-安慰剂组相比,所述安慰剂-苯丙胺组有显著差异。与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、0.5mg/kg(+)-α-dhtbz组、1mg/kg(+)-α-dhtbz组、1.5mg/kg(+)-α-dhtbz组、2mg/kg(+)-α-dhtbz组和1mg/kg利培酮组具有显著性差异。
2.刻板行为
给予安慰剂、0.5mg/kg(+)-α-dhtbz、1mg/kg(+)-α-dhtbz、1.5mg/kg(+)-α-dhtbz、2mg/kg(+)-α-dhtbz或1mg/kg利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的刻板活动进行3min间隔评价及整体评价。图4显示了试验时间内的标准化总刻板行为。
与所述安慰剂-安慰剂组相比,所述安慰剂-苯丙胺组、0.5mg/kg(+)-α-dhtbz组和1.5mg/kg(+)-α-dhtbz组有显著差异。与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、0.5mg/kg(+)-α-dhtbz组、1mg/kg(+)-α-dhtbz组、1.5mg/kg(+)-α-dhtbz组、2mg/kg(+)-α-dhtbz组和1mg/kg利培酮组具有显著性差异。
结论
本研究评价了0.5mg/kg、1mg/kg、1.5mg/kg和2mg/kg(+)-α-dhtbz以及1mg/kg利培酮对苯丙胺诱导的雄性cd大鼠自主活动的影响。
与所述安慰剂-苯丙胺组相比,所有所述试验剂量的(+)-α-dhtbz和1mg/kg的利培酮都能导致自主活动降低。与所述安慰剂-苯丙胺组相比,所有所述试验剂量的(+)-α-dhtbz和1mg/kg的利培酮都能导致刻板行为减少。这两个所述检测的参数表明(+)-α-dhtbz与利培酮具有类似的镇静作用。
研究2
研究了给予0.1mg/kg至0.25mg/kg剂量的(+)-α-二氢丁苯那嗪和1mg/kg的利培酮对大鼠刻板行为和运动距离的影响。
动物分组如下:
·组1:10只大鼠,给予安慰剂(t=0min)和安慰剂(t=30min)
·组2:10只大鼠,给予安慰剂(t=0min)和苯丙胺(t=30min)
·组3:10只大鼠,给予0.1mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组4:10只大鼠,给予0.25mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组5:10只大鼠,给予1mg/kg利培酮(t=0min)和苯丙胺(t=30min)
结果
1.运动距离
给予安慰剂、0.1mg/kg(+)-α-dhtbz、0.25mg/kg(+)-α-dhtbz或1mg/kg利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的自主活动进行3min间隔评价及整体评价。图5显示了试验时间内的标准化总运动距离。
与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、0.25mg/kg(+)-α-dhtbz组和1mg/kg利培酮组具有显著性差异。
2.刻板行为
给予安慰剂、0.1mg/kg(+)-α-dhtbz、0.25mg/kg(+)-α-dhtbz或1mg/kg利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的刻板活动进行3min间隔评价及整体评价。图6显示了试验时间内的标准化总刻板行为。
与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、0.1mg/kg(+)-α-dhtbz组、0.25mg/kg(+)-α-dhtbz组和1mg/kg利培酮组具有显著性差异。
结论
本研究评价了0.1mg/kg、0.25mg/kg的(+)-α-dhtbz和1mg/kg利培酮对苯丙胺诱导的雄性cd大鼠自主活动的影响。
与所述安慰剂-苯丙胺组相比,0.25mg/kg(+)-α-dhtbz和1mg/kg的利培酮都能导致自主活动降低。与所述安慰剂-苯丙胺组相比,所有所述试验剂量的(+)-α-dhtbz和1mg/kg的利培酮都能导致刻板行为减少。
研究3
研究了(+)-α-二氢丁苯那嗪和利培酮对非苯丙胺诱导的大鼠的影响。
动物分组如下:
·组1:10只大鼠,给予安慰剂
·组2:10只大鼠,给予2.5mg/kg(+)-α-dhtbz
·组3:10只大鼠,给予5mg/kg(+)-α-dhtbz
·组4:10只大鼠,给予1mg/kg利培酮
结果
在非诱导的大鼠中,用给予所述安慰剂的大鼠的总运动和刻板行为与给予(+)-α-二氢丁苯那嗪的大鼠相当(详见图7和图8)。但是,给予利培酮的大鼠的总运动和总刻板行为均有减少。
研究4
研究了给予1mg/kg和1.5mg/kg剂量的(+)-α-二氢丁苯那嗪和缬苯那嗪以及1mg/kg的利培酮对大鼠刻板行为和所述运动距离的影响。
动物分组如下:
·组1:10只大鼠,给予安慰剂(t=0min)和安慰剂(t=30min)
·组2:10只大鼠,给予安慰剂(t=0min)和苯丙胺(t=30min)
·组3:10只大鼠,给予1mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组4:10只大鼠,给予1.5mg/kg(+)-α-dhtbz(t=0min)和苯丙胺(t=30min)
·组5:10只大鼠,给予1mg/kg缬苯那嗪(t=0min)和苯丙胺(t=30min)
·组6:10只大鼠,给予1.5mg/kg缬苯那嗪(t=0min)和苯丙胺(t=30min)
·组7:10只大鼠,给予1mg/kg利培酮t=0min)和苯丙胺(t=30min)
结果
1.运动距离
给予安慰剂、(+)-α-dhtbz、缬苯那嗪或利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的自主活动进行3min间隔评价及整体评价。图9显示了试验时间内的所述标准化总运动距离。
与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、(+)-α-dhtbz(1mg/kg和1.5mg/kg)组、缬苯那嗪(1mg/kg和1.5mg/kg)组和1mg/kg利培酮组具有显著性差异。
2.刻板行为
给予安慰剂、0.1mg/kg(+)-α-dhtbz、0.25mg/kg(+)-α-dhtbz或1mg/kg利培酮的大鼠首先进行lma试验30分钟,然后在安慰剂或苯丙胺激发后进行第二次lma试验60分钟。在试验期间,对所产生的刻板活动进行3min间隔评价及整体评价。图10显示了试验时间内的标准化总刻板行为。
与安慰剂-苯丙胺组相比,所述安慰剂-安慰剂组、(+)-α-dhtbz(1mg/kg和1.5mg/kg)组、缬苯那嗪(1mg/kg和1.5mg/kg)组和1mg/kg利培酮组具有显著性差异。
结论
本研究评价了1mg/kg和1.5mg/kg的(+)-α-dhtbz和缬苯那嗪以及1mg/kg利培酮对苯丙胺诱导的雄性cd大鼠自主活动的影响。
与安慰剂-苯丙胺组相比,1mg/kg和1.5mg/kg的(+)-α-dhtbz能导致自主活动降低。与所述安慰剂-苯丙胺组和相应的缬苯那嗪剂量相比,所有所述试验剂量的(+)-α-dhtbz都能导致刻板行为减少。
评价
实例2中的研究1和研究2表明,低至0.1mg/kg剂量的(+)-α二氢丁苯那嗪对苯丙胺诱导的大鼠的运动具有减少作用。因此,预计这种低剂量方案也可能有助于治疗人类的多动型运动障碍。
实例2中的研究3表明,在施用低剂量的(+)-α-二氢丁苯那嗪后,虽然运动障碍中发现的异常运动的类型会被药物减少或抑制,但正常运动不受影响。这与利培酮相反,利培酮是一种治疗运动障碍的常用药物,使用所述药物时,正常和异常运动的水平都会被降低。
实例2中的研究4表明,(+)-α-二氢丁苯那嗪的疗效高于缬苯那嗪。
等同原则
显而易见的是,在不脱离本公开的基本原理的情况下,可以对上述本发明的所述具体实施例进行多种修改和改变。所有这些修改和改变都将包括在本应用中。
- 还没有人留言评论。精彩留言会获得点赞!