免疫蛋白酶体抑制剂配制物的制作方法
背景技术:
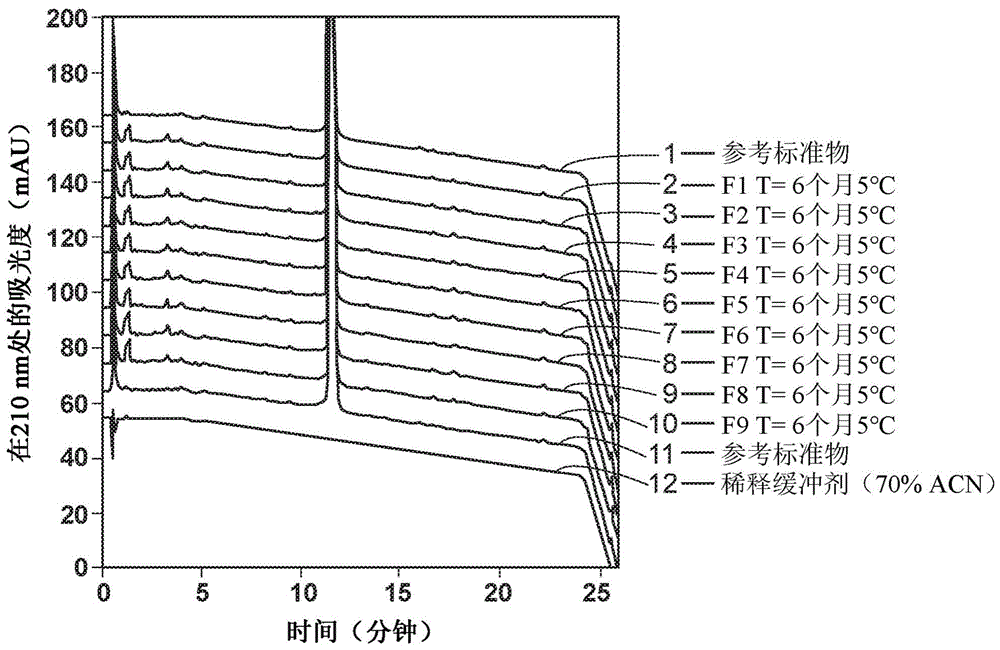
:化合物(2s,3r)-n-[(2s)-3-(环戊-1-烯-1-基)-1-[(2r)-2-甲基环氧乙烷-2-基]-1-氧代丙-2-基]-3-羟基-3-(4-甲氧基苯基)-2-[(2s)-2-[2-(吗啉-4-基)乙酰氨基]丙酰氨基]丙酰胺(“kzr-616”)适用作免疫蛋白酶体抑制剂配制物:在真核生物中,蛋白质降解主要通过泛素路径介导,其中被靶向以进行破坏的蛋白质接合到76氨基酸多肽泛素。一旦被靶向,泛素化蛋白即充当26s蛋白酶体的受质,所述蛋白酶体为一种多催化性蛋白酶,其通过其三个主要蛋白分解活性的作用将蛋白质裂解成短肽。尽管蛋白酶体介导的降解在细胞内蛋白质周转中具有通用功能,但其在如下多个过程中也发挥关键作用:i级主要组织兼容性复合体(majorhistocompatibilitycomplex;mhc)抗原呈递、细胞凋亡、细胞生长调控、nf-κβ活化、抗原加工和促炎性信号的转导。pct公开第wo2014/152134号描述三肽环氧酮蛋白酶体抑制剂配制物和使用这些化合物来治疗与异常免疫蛋白酶体活性相关的疾病和病状的方法。因为例如kzr-616的三肽环氧酮蛋白酶体抑制剂配制物可以用于治疗患者的疾病和病状,所以需要kzr-616的可溶和稳定配制物。技术实现要素:本文提供包含kzr-616或其盐和糖的药学配制物,其中kzr-616具有结构并且所述配制物为冻干配制物。在一些实施例中,kzr-616为马来酸盐。在某些情况下,如在冻干之前所测量,配制物的ph为3.0到4.5。在某些情况下,配制物的ph为3.8到4.3。在某些情况下,配制物的ph为4.2。在实施例中,配制物不含缓冲剂。在实施例中,如在冻干之前所测量,kzr-616或其盐以50到300mg/ml的量存在。在实施例中,kzr-616或其盐以100mg/ml到200mg/ml的量存在。在某些情况下,kzr-616或其盐以kzr-616游离碱的重量计以125mg/ml的量存在。在某些情况下,糖以配制物的总重量计以0.1wt%到5wt%的量存在。在实施例中,糖以1.5wt%到3wt%的量存在。在实施例中,糖以2wt%的量存在。在实施例中,糖包含甘露醇、海藻糖或其组合。在某些情况下,糖包含海藻糖。在实施例中,冻干配制物的水分含量小于1%。在某些情况下,在5℃、25℃或40℃下储存至少六个月之后,配制物的ph为4.1到4.3(如在复原时测量)。在实施例中,在5℃、25℃或40℃下储存至少六个月之后,配制物的kzr-616或其盐的浓度为140mg/ml到150mg/ml(如在复原时测量)。在某些情况下,在5℃、25℃或40℃下储存至少六个月之后,配制物的复原时间少于4.5分钟。在实施例中,在5℃、25℃或40℃下储存至少六个月之后,冻干配制物的水分含量小于1%。在某些情况下,在5℃、25℃或40℃下储存至少六个月之后,kzr-616或其盐纯度至少为93%。本文还提供包含本文公开的配制物和用于复原的溶剂的复原配制物。在实施例中,用于复原的溶剂包含注射用水(waterforinjection,wfi)或5%右旋糖水溶液。在实施例中,复原配制物具有275mosm到325mosm的渗透压度。在实施例中,复原配制物用于皮下注射。在某些情况下,如通过t1/2所测量,复原配制物的吸收速率比包含kzr-616或其盐和聚山梨酯-80的配制物(“ps-80配制物”)快至少50%。在实施例中,复原配制物的cmax为包含kzr-616或其盐和聚山梨酯-80的配制物的cmax的至少150%。本文还提供一种用于制备本文所描述的配制物的方法,所述方法包含将kzr-616或其盐和糖混合以形成水溶液,并且将水溶液冻干以形成冻干配制物。在某些情况下,所述方法进一步包含用溶剂复原冻干配制物以形成复原配制物。在实施例中,溶剂为注射用水或5%右旋糖水溶液。本文进一步提供一种治疗个体的免疫相关疾病的方法,所述方法包含施用本文中的复原配制物。在某些情况下,个体罹患狼疮性肾炎或系统性红斑狼疮(sle)。本文还提供一种治疗个体的炎症的方法,所述方法通过施用本文所描述的复原配制物进行。附图说明图1a展示在5℃下储存6个月之后多种配制物的rp-hplc分析。图1b展示在25℃下储存6个月之后多种配制物的rp-hplc分析。图1c展示在40℃下储存6个月之后多种配制物的rp-hplc分析。图2a展示在5℃下储存6个月之后多种配制物的rp-hplc分析趋势。图2b展示在25℃下储存6个月之后多种配制物的rp-hplc分析趋势。图2c展示在40℃下储存6个月之后多种配制物的rp-hplc分析趋势。具体实施方式本文提供kzr-616或其盐的配制物,所述配制物被冻干并且为稳定的。冻干配制物提供许多益处,包括以下中的一种或多种:存放期更长、容易在冷藏温度下储存以及配制物装运和处置的重量和/或体积减少。还公开冻干配制物的复原配制物、配制物的制备方法和使用所公开的配制物治疗免疫相关疾病和/或炎症的方法。如下文进一步描述,本文中的kzr-616或其盐的药学配制物可以具有若干优点,例如本文公开的配制物在多种温度和/或时间下储存之后,例如在5℃、25℃或40℃下储存至少六个月之后,可以抵抗ph、浓度、复原时间、水分含量和/或纯度的变化。除非另外说明,否则预期配制物、剂量呈现和方法包括有包括下文进一步描述的额外任选的要素、特点和步骤(包括每个表中所示的要素、特点和步骤)中的一者或多者的任何组合的实施例。如本文所用,术语“治疗(treating/treatment)”包括以改善或稳定患者病状的方式逆转、减少或遏制病状的症状、临床征象和潜在病变。除非另有指示,否则术语“一(a/an)”、“所述”和类似提及术语在本文中的公开内容的上下文中(尤其在权利要求书的上下文中)的使用解释为涵盖单数和复数两者。除非本文另外指示,否则本文中数值范围的叙述仅打算充当个别提及属于所述范围内的每个独立值的速记方法,并且每个独立值被并入本说明书中,如同其在本文中被个别地叙述一般。除非另有指示,否则本文提供的任何和所有实例或示例性措辞(例如“例如”)的使用打算更好地说明本文中的公开内容,并且不限制本文中的公开内容的范围。本说明书中的任何措辞均不应解释为指示实践本文中的公开内容所必不可少的任何未主张要素。如本文所用,术语“约(about/approximately)”一般意思指所陈述值加或减10%。举例来说,约0.5将包括0.45和0.55,约10将包括9到11,约1000将包括900到1100。有机化学领域的技术人员应了解,许多有机化合物可以以与溶剂形成复合物,所述有机化合物在所述溶剂中反应或从其中沉淀或结晶。这些复合物称为“溶剂合物”。举例来说,与水的复合物称为“水合物”。本文中的配制物中使用的kzr-616的溶剂合物在本发明的范围内。冻干配制物本文提供包含kzr-616或其盐和糖的药学配制物,其中kzr-616具有结构并且其中配制物为冻干配制物。本文公开的药学配制物可以包含呈任何适合形式的kzr-616。在实施例中,kzr-616以游离碱形式存在。在实施例中,kzr-616以盐形式存在。在某些情况下,kzr-616以选自以下的盐形式存在:马来酸盐、富马酸盐、乙二酸盐、苹果酸盐、硫酸盐、甲烷磺酸盐、2-萘磺酸盐、磷酸盐、卤化物、酒石酸盐、柠檬酸盐、甲苯磺酸盐、丙酸盐、苯甲酸盐和其组合。在某些情况下,kzr-616以溶剂化物,例如水合物形式存在。在实施例中,kzr-616以马来酸盐,例如单马来酸盐形式存在。在一些实施例中,kzr-616以二聚体盐,例如双(kzr-616)单马来酸盐形式存在。本文所描述的配制物可以包含如在冻干之前所测量的任何浓度的kzr-616或其盐。特别涵盖的kzr-616或其盐的浓度包括约10mg/ml到约500mg/ml,或约25mg/ml到约400mg/ml,或约50mg/ml到约400mg/ml,或约50mg/ml到约300mg/ml,或约60mg/ml到约275mg/ml,或约70mg/ml到约250mg/ml,或约80mg/ml到约225mg/ml,或约90mg/ml到约225mg/ml,或约100mg/ml到约200mg/ml,或约110mg/ml到约200mg/ml,或约120mg/ml到约200mg/ml,或约120mg/ml到约220mg/ml,或约120mg/ml到约190mg/ml,或约120mg/ml到约180mg/ml,或约120mg/ml到约170mg/ml,或约120mg/ml到约160mg/ml,或约120mg/ml到约150mg/ml,或约130mg/ml到约150mg/ml,或约140mg/ml到约150mg/ml,或约100mg/ml到约150mg/ml,或约100mg/ml到约140mg/ml,或约100mg/ml到约130mg/ml,或约100mg/ml到约120mg/ml,或约50mg/ml到约100mg/ml,或约60mg/ml到约90mg/ml,或约90mg/ml到约120mg/ml,例如以kzr-616马来酸盐的重量计约150mg/ml或以kzr-616游离碱的重量计约125mg/ml。在实施例中,在冻干配制物已经于例如5℃、25℃或40℃下储存至少六个月之后,在复原冻干配制物时测量kzr-616浓度。本文公开的药学配制物可以包含糖,例如还原糖或非还原糖,或糖醇。具有糖的kzr-616或其盐的配制物在5℃、25℃和40℃下储存至少6个月时稳定。在实施例中,糖可以包含甘露醇、海藻糖、右旋糖、葡萄糖、果糖、甘露糖、半乳糖、木糖、蔗糖、乳糖、山梨醇、右旋糖苷、赤藻糖醇或其组合。在实施例中,糖可以包含甘露醇和/或海藻糖。在实施例中,糖包含海藻糖。在实施例中,配制物包含以配制物的总重量计例如约0.01wt%到约10wt%,或约0.1wt%到约10wt%,或约0.1wt%到约9wt%,或约0.1wt%到约8wt%,或约0.1wt%到约7wt%,或约0.1wt%到约6wt%,或约0.1wt%到约5wt%,或0.1wt%到约4wt%,或约0.5wt%到约5wt%,或约0.5wt%到约4wt%,或约0.5wt%到约3wt%,或约0.5wt%到约2wt%,或约1wt%到约5wt%,或约1wt%到约4wt%,或约1wt%到约3wt%,或约1wt%到约2wt%,或约1.5wt%到约5wt%,或约1.5wt%到约4wt%,或约1.5wt%到约3wt%,或约1.5wt%到约2wt%,或约2wt%到约5wt%,或约3wt%到约5wt%,例如约2wt%的量的糖组分。在实施例中,在冻干配制物已经于例如5℃、25℃或40℃下储存至少六个月之后测量水分含量。在实施例中,本文所描述的配制物可以具有至多5重量%,例如至多4重量%、3重量%、2重量%、1.5重量%、1重量%或0.5重量%的水分含量。在实施例中,本文所描述的配制物在5℃、25℃或40℃下储存既定时间量,例如至少六个月之后,可以具有至多5%、至多4%、3%、2%、1.5%、1%或0.5%的水分含量,例如在5℃、25℃或40℃下储存至少六个月之后小于1%的水分含量。在某些情况下,本文所描述的配制物可以任选地包含缓冲剂。在某些情况下,配制物不包含缓冲剂。如本文所用,术语“缓冲剂”是指除kzr-616的任何盐形式之外的缓冲剂。在实施例中,次级缓冲剂可以包含琥珀酸盐、柠檬酸盐、磷酸盐、组氨酸、乙酸盐、马来酸盐、葡糖酸盐或其组合。在实施例中,缓冲剂包含琥珀酸盐缓冲剂。在实施例中,如在冻干之前所测量,缓冲剂,例如琥珀酸盐缓冲剂的浓度可以为约1mm到约50mm,或约1mm到约40mm,或约1mm到约30mm,或约1mm到约25mm,或约1mm到约20mm,或约1mm到约15mm,或约1mm到约10mm,或约2mm,或约3mm,或约4mm,或约5mm,或约6mm,或约7mm,或约8mm,或约9mm,或约10mm,或约11mm,或约12mm,或约13mm,或约14mm,或约15mm,例如10mm。除糖之外或代替糖,本文所描述的配制物可以任选地进一步包含膨胀剂。所涵盖的添加剂,例如膨胀剂包括甘氨酸、丝氨酸、半胱氨酸或其组合。在每个方面中,本文所描述的配制物可以具有以下优点:(1)冻干物呈现饼状,其在复原时在视觉上澄清和/或不含颗粒;(2)冻干物的水分含量小于或等于1%(以重量或摩尔计);(3)冻干饼的冷冻干燥时间和/或复原时间比其它药学配制物更快,如下文实例中所述;和/或(4)配制物具有期望稳定性,例如在5℃下至少6个月所测定小于0.5%降解(以重量或摩尔计),在25℃下至少6个月所测定小于7%降解(以重量或摩尔计),以及在40℃下至少6个月所测定小于20%降解(以重量或摩尔计)。如在冻干之前所测量,本文公开的配制物可以具有3.0到4.5,例如3.8到4.3的ph。在某些情况下,冻干之前的ph为4.2。在实施例中,当在复原时进行测量时本文所描述的配制物在约25℃温度下可以具有约2到约8或约3到约5的ph。在实施例中,当在复原时进行测量时配制物在约25℃温度下可以具有约3.1到约4.9,或约3.2到约4.8,或约3.3到约4.7,或约3.4到约4.6,或约3.5到约4.5,或约3.6到约4.4,或约3.7到约4.3,或约3.7到约4.3,或约3.8到约4.3,或约3.9到约4.2,例如在约25℃温度下约4.2的ph。在实施例中,在冻干配制物已经于例如5℃、25℃或40℃下储存至少六个月之后,在复原冻干配制物时测量ph。在实施例中,在配制物于5℃、25℃或40℃下储存至少六个月之后,其api(kzr-616或其盐)纯度可以超过70%,例如在于5℃、25℃或40℃下储存至少六个月之后超过75%、超过80%、超过85%、超过90%、超过91%、超过92%、超过93%、超过94%、超过95%、超过96%、超过97%、超过98%或超过99%,例如于5℃、25℃或40℃下储存至少六个月之后超过93%。纯度超过70%意味着在所指示的储存时间和温度之后配制物中的api的量超过储存之前配制物中的api的量的70%(以重量或摩尔计)。在实施例中,本文公开的配制物的复原时间可以少于或等于十分钟,例如少于或等于9分钟、少于或等于8分钟、少于或等于7分钟、少于或等于6分钟、少于或等于5分钟、少于或等于4.5分钟、少于或等于4分钟、少于或等于3.5分钟或少于或等于3分钟。在实施例中,在配制物于5℃、25℃或40℃下储存至少六个月之后,其复原时间少于或等于十分钟,例如少于或等于9分钟、少于或等于8分钟、少于或等于7分钟、少于或等于6分钟、少于或等于5.5分钟、少于或等于5分钟、少于或等于4分钟、少于或等于3.5分钟、少于或等于3分钟,例如在本文中的配制物于5℃、25℃或40℃下储存至少六个月之后,其复原时间少于或等于4.5分钟。如本文所用,术语“复原时间”是指根据以下详述的复原方法完全溶解冻干配制物所花费的时间量。复原配制物本文公开的配制物可以被冻干成饼状、粉末状,或饼和/或粉末可以进一步被加工成凝胶、泡沫、气溶胶、薄膜或其它配制物。在实施例中,配制物可以用溶剂复原以施用有需要的个体。因此,本文提供包含呈冻干组合物形式的配制物和复原溶液的试剂盒。本文提供kzr-616或其盐的复原配制物,其包含本文所述的冻干药学配制物和用于复原的溶剂。用于复原的溶剂可以包含所属领域的一般技术人员认为适合的任何一种或多种溶剂。在实施例中,用于复原的溶剂可以包含注射用水(“wfi”)、盐水溶液或5%右旋糖水溶液。在一些特定实施例中,用于复原的溶剂包含注射用水。在实施例中,用于复原的溶剂不包含氯离子(例如不为盐水)。在实施例中,复原配制物可以用于皮下注射。在实施例中,复原配制物的渗透压度可以为200mosm到400mosm,例如250mosm到400mosm,或275mosm到350mosm,或275mosm到325mosm,例如约300mosm,接近等张渗透压度。在实施例中,如通过t1/2所测量,本文中的复原配制物的吸收速率比包含kzr-616或其盐和聚山梨酯-80(“ps-80”)的配制物(“ps-80配制物”)快至少10%,例如比ps-80配制物快至少20%、快至少30%、快至少40%、快至少50%或快至少60%,例如快至少50%。在实施例中,本文所描述的复原配制物的cmax为ps-80配制物的cmax的至少50%,例如至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%或至少180%,例如为ps-80配制物的至少150%。制备方法本文公开的药学配制物可以通过例如将kzr-616或其盐与糖混合以形成溶液来制备。在实施例中,溶液为水溶液。在实施例中,溶液可以被冻干以形成冻干药学配制物。药学配制物的制备方法可以进一步包含用溶剂复原冻干配制物以形成本文所述的复原配制物。用于形成复原配制物的溶剂可以为所属领域技术人员认为适合复原冻干配制物的任何溶剂,例如溶剂可以包含水或5%右旋糖水溶液。治疗方法本发明的另一个方面提供一种治疗个体的免疫相关疾病的方法,所述方法通过施用如本文所述的复原配制物进行。在某些情况下,疾病为牛皮癣、皮肤炎、系统性硬皮病、硬化症、克罗恩氏病(crohn'sdisease)、溃疡性结肠炎;呼吸窘迫症候群、脑膜炎;脑炎;葡萄膜炎;结肠炎;丝球体肾炎;湿疹、哮喘、慢性炎症;动脉粥样硬化;白细胞黏着缺乏症;类风湿性关节炎;系统性红斑狼疮(sle);糖尿病;多发性硬化症;雷诺氏症候群(reynaud'ssyndrome);自身免疫甲状腺炎;过敏性脑脊髓炎;休格连氏症候群(sjogren'ssyndrome);幼年发作型糖尿病;肺结核、类肉瘤病、多发性肌炎、肉芽肿、血管炎;恶性贫血(阿狄森氏病(addison'sdisease));涉及白细胞血球渗出的疾病、中枢神经系统(cns)发炎病症;多器官损伤症候群;溶血性贫血;重症肌无力;抗原-抗体复合物介导的疾病;抗肾小球基底膜疾病;抗磷脂症候群;过敏性神经炎;格雷夫氏病(graves'disease);兰伯特-伊顿重肌无力症候群(lambert-eatonmyasthenicsyndrome);大疱性类天疱疮;天疱疮;自身免疫多内分泌病变;莱特尔氏病(reiter'sdisease);僵人症候群;贝赫切特疾病(beheetdisease);巨大细胞动脉炎;免疫复合物性肾炎;iga肾病;igm多发性神经病;免疫性血小板减少性紫癜(itp)或自身免疫血小板减少症。在各种情况下,病症为狼疮、狼疮性肾炎、类风湿性关节炎、糖尿病、硬皮病、僵直性脊椎炎、牛皮癣、多发性硬化症、桥本氏病(hashimoto'sdisease)、脑膜炎或发炎性肠病。在实施例中,疾病为狼疮性肾炎或sle。本发明的另一个方面提供一种治疗个体的炎症的方法,所述方法通过施用如本文所公开的复原配制物进行。复原方法如本文所述的冻干药学配制物被放置于小瓶中。将一定量,例如数毫升的经过滤(“mq”)水添加到所述小瓶中。在添加mq水后,开启定时器以测量冻干药学配制物复原和/或完全溶解的时间量。每三十秒轻轻摇动具有mq水和冻干配制物的小瓶直到复原完成。实例实例1在这项冻干配制物研发研究中检查kzr-616在各种配制条件下的稳定性。在这项研究中研究的条件包括具有在不同ph(3.9-4.2)下的各种赋形剂(l-甘氨酸、甘露醇和海藻糖)的缓冲(10mm琥珀酸盐)和未缓冲配制物。在冷藏温度(5℃)、周围温度(25℃)和加速温度(40℃)温度下静态储存长达6个月的条件下检查不同配制物中的150mg/mlkzr-616的稳定性。在这6个月研究的过程中,反相hplc(rp-hplc)分析为用于监测kzr-616稳定性的主要分析方法。冻干饼状物在所有储存温度下储存6个月后展示一致外观。随着时间的推移,尤其在25℃和40℃下,观察到冻干物某种程度上渐渐变黄。在复原之后这种变黄更明显。在复原之后,所有配制物均不含可见颗粒。储存6个月后,配制物的ph和kzr-616浓度值仍与在零时观察到的值相当。经过6个月储存,复原时间也保持一致,少于四分钟三十秒。使用rp-hplc分析评估kzr-616的稳定性。在5℃下储存6个月后,所有配制物的主峰百分比与在零时观察到的主峰百分比相比均略微下降。在25℃下储存后,配制物的主峰百分比下降,而未缓冲的含海藻糖配制物的主峰百分比高于其它配制物的主峰百分比。在40℃下储存6个月后,所有配制物的主峰百分比均显著下降,主要归因于降解产物峰增加,未知rrt=0.1、kzr-59587、未知rrt=0.5、kzr-0214143和未知rrt=2.2。在所测试的配制物当中,具有或不具有甘露醇的未缓冲的含海藻糖配制物展示最高主峰百分比。由于预计在5℃期间不降解,故进行冻干循环优化研究,以判定通过利用冻干循环优化进一步降低残留水分含量是否有可能提高配制物的稳定性。这项水分优化研究通过在10℃、25℃、35℃和50℃的多种二次存放温度下冻干主要配制物来进行。但是,在40℃下储存4周后,无论二次干燥存放温度如何,通过rp-hplc均未观察到外观、ph、浓度、复原时间和峰百分比差异。基于这项研究的结果,冻干150mg/mlkzr-616的主要配制物被鉴别为在ph4.2下含有2%海藻糖并且不含有额外缓冲剂的配制物。材料在这项研究中检测的活性药学成分(api)为kzr-616。这项研究所使用的材料由以下构成:(1)原料药(ds):kzr-616马来酸盐(批次a)(2)原料药(ds):kzr-616马来酸盐(批次b)(3)参考标准物(rs):kzr-616马来酸盐材料在使用之前将原料药储存于2-8℃下。配制参数在加速稳定性研究中,以下参数保持恒定:(1)填充体积:1.0ml(2)缓冲剂浓度:10mm或0mm检查以下配制(f1-f9)参数:(1)api浓度:150mg/ml(2)缓冲剂:琥珀酸盐(3)ph:3.9-4.2(4)张力调节剂:0.2%甘氨酸、1%海藻糖、0.4%甘露醇、0.4%甘氨酸、1%甘露醇、2%海藻糖、0.3%甘氨酸、0.8%甘露醇表1:用于配制物研发研究的配制物基质配制物制备1号冻干循环发展为了确定保守循环的参数,对三种分别含有甘氨酸、甘露醇或海藻糖的代表性配制物f3、f4和f5进行低于周围的差示扫描热量测定(dsc)(perkinelmerpyrisdiamond)。所使用的方法程序如下:等温保持在-60℃下1分钟,并且以5℃/分钟从-60℃加热到25℃。f3、f4和f5分别显示-16℃、-15℃和-33℃的玻璃转移温度(tg),表1。对于f4而言,在-10℃下的反玻化温度(td)下发生结晶,因此添加退火步骤以在初次干燥之前获得更完整的结晶。这份数据是在初始冻干循环中实施,表3。基于来自低于周围的dsc的结果,设计保守冻干循环以产生残余水分浓度<1%的样品。表3描述初始保守循环的参数。使kzr-616马来酸盐溶解于经过滤的(mq)水中,目标浓度为170mg/ml,接着将含kzr-616的mq加热到60℃约2分钟,以使原料药溶解到溶液中。将配制物制备成10×原液,并且外加到1:9(缓冲剂:ds)比率的ds/mq溶液的等分试样中。用naoh将每种配制物的ph滴定到目标ph。在bsc中在无菌条件下,使所有样品通过0.2μm过滤器进行无菌过滤并且以1.0ml填充体积填充到3cc小瓶中。将样品用无菌塞子部分塞住,放置于冻干机中,并且用空瓶包围。使用表3中详述的参数将样品冻干。在初始冻干循环之后,将样品用1ml过滤mq水复原并且进行分析。参照表2制备冻干循环开发配制物。表2:1号冻干循环发展的配制物基质表3:初始保守循环的参数实例2号冻干循环发展使kzr-616溶解于过滤mq水中,目标浓度为170mg/ml。接着将含kzr-616的mq加热到60℃约2分钟,以使原料药溶解到溶液中。将配制物制备成10×原液,并且外加到1:9(缓冲剂:ds)比率的ds/mq溶液的等分试样中。用naoh将每种配制物的ph滴定到目标ph。在bsc中在无菌条件下,使所有样品通过0.2μm过滤器进行无菌过滤并且以1.0ml填充体积填充到3cc小瓶中。表1中概述配制物基质(缓冲剂、膨胀剂浓度、ph)。将样品用无菌塞子部分塞住,放置于冷冻干燥机中,并且用空瓶包围。使用表4中详述的参数将样品冻干。冻干后,将样品用1ml过滤mq水复原,并且按照表8中概述的方法进行分析。表4:第二次冻干循环的参数实例加速稳定性研究一旦ibi鉴别产生水分含量值小于1%的极佳饼状物的冻干循环,那么重复所述循环以确认循环结果并且为加速稳定性研究制备样品。将kzr-616溶解于过滤mq水中作为浓度为170mg/ml的储备溶液。将kzr-616储备溶液加热到60℃约2分钟,以使原料药完全溶解。将配制物缓冲液制成10×储备溶液。每种配制物均用10×缓冲液储备溶液、ds原液(170mg/ml)和mq来制备,最终目标浓度为150mg/ml。用naoh将每种配制物的ph调节到目标ph。在bsc中在无菌条件下,使所有样品通过0.2μm过滤器进行无菌过滤并且以1.0ml填充体积填充到3cc小瓶中。将样品用无菌塞子部分塞住,放置于冷冻干燥机中,并且用空瓶包围。使用表4中详述的参数将样品冻干。冻干后,通过使用表9中列出的分析方法比较冻干前液体样品、冻干饼状物和复原样品来评估产物质量和完整性。水分优化使kzr-616的两种不同批次原料药(kzr-0214142和c15072369-ff1600)分别溶解于mq中达到170mg/ml浓度,并且加热到60℃约2分钟,以使原料药完全溶解。接着将两个170mg/ml制剂用10×目标缓冲液(f5,2%海藻糖,在ph4.2下)稀释到150mg/ml。用naoh将每种配制物的ph滴定到目标ph。在bsc中在无菌条件下,使所有样品通过0.2μm过滤器进行无菌过滤并且以1.0ml填充体积填充到3cc小瓶中。将样品用无菌塞子部分塞住,放置于冷冻干燥机中,并且用空瓶包围以防移动。使用表5中详述的参数将样品冻干。预程序化冻干循环,经历第一个二次干燥温度(10℃)。在第一个二次干燥温度之后,手动进行冻干机的所有后续操作,以适应所有存放温度。每个二次干燥温度最少执行8小时。在每个二次干燥温度结束时,塞住用于所述温度的小瓶,手动停止冻干机,并且吹扫真空。随后,移开被塞住的托盘,并且手动重启冻干机以进行下一个二次干燥温度。对每个二次干燥温度重复最后一步。冻干后,将样品置于稳定性储存条件下,并且用1ml过滤mq水将t=0样品复原并且进行分析。分析方法概述于表8中。表5:用于优化冻干循环的参数实例压力条件加速稳定性在以下表6中描述的条件下研究冻干配制物的稳定性。表6:用于加速稳定性研究的储存条件储存条件时间点2-8℃(冻干)1个月、2个月、3个月和6个月25℃(复原液体)0小时、8小时、24小时25℃(冻干)1个月、2个月、3个月和6个月40℃(冻干)1个月、2个月、3个月和6个月水分优化在以下表7中描述的条件下研究冻干配制物的稳定性。表7:水分优化研究的储存条件储存条件时间点40℃(冻干)批次a0周、1周、2周、4周40℃(冻干)批次b0周和4周分析方法冻干循环发展(1和2)冻干循环1和2后,对样品执行各种分析。表8总结这些针对稳定性研究的分析。表8:分析方法-冻干循环发展分析方法目的目检清晰度、颜色和可见颗粒渗透压度渗透压度phph复原时间测量复原速率低于周围的dsc鉴别温度相关的过渡相卡尔·费休滴定(karlfischertitration)测量水分含量rp-hplc化学改性(疏水性)ft-ir红外光谱-结构完整性加速稳定性研究在每个温度和时间点进行培育后,对冻干样品执行各种分析。在以下每个时间,分析样品之外观、ph、浓度、复原时间、rp-hplc和水分含量。表9总结用于加速稳定性研究的各种分析。表9:分析方法-加速稳定性研究分析方法目的目检清晰度、颜色和可见颗粒渗透压度渗透压度phph分光光度法浓度分析复原时间测量复原速率卡尔·费休滴定测量水分含量rp-hplc化学改性(疏水性)表10:时间点分析方法-加速稳定性研究以下详述针对所有先前所述的研究的分析方法。(1)目检:目检是在白色光源(13w荧光灯管)下对照黑白背景执行的。针对冻干前、冻干后和复原配制物拍摄数字照片。(2)渗透压度:渗透压度是在每个目标研究的零时测量的。(3)ph:用ph计(vwrscientific,目录号sb70p)执行ph分析,用三种ph标准溶液(ph4、7和10)校准,其中校准斜率为95%或更高。在测量之前,使样品平衡到周围温度。(4)吸光度分光光度法:通过beckmancoulter的分光光度计测定kzr-616的浓度。通过生成标准曲线(1mg/ml、0.75mg/ml、0.5mg/ml和0.25mg/ml,在mq中连续稀释)确定消光系数为1.8495(mg/ml)-1cm-1。通过全波长扫描对kzr-616进行分析,并且在272nm处显示最大吸光度。所述波长用于测量浓度。(5)ftir:对冻干前和冻干后的配制物进行分析,以确定含有膨胀剂的配制物的指纹图谱。(执行1号和2号冻干后发展循环)(6)复原时间:用一毫升过滤水复原冻干配制物。加水后,启动定时器以测量kzr-616药学配制物的复原时间量。每隔三十秒轻轻摇动一次复原的小瓶。重复这个程序直到复原完成。(7)卡尔·费休滴定:对冻干后配制物进行分析,以测定冻干产物的水分含量。(8)dsc:对每种配制物以5℃/分钟从-60℃到25℃执行低于周围的dsc分析,以确定在冷冻状态下膨胀剂的结晶、tg和其它重要热转变数据。(9)rp-hplc:这项研究所使用的rp-hplc方法是从kezar转移而来,并且参数如下列出:水分优化研究在每个温度和时间点进行培育后,对冻干样品执行各种分析。在以下每个时间,分析样品之外观、ph、浓度、复原时间、rp-hplc和水分含量。表11总结这些针对稳定性研究的分析。表11:水分优化的分析方法分析方法目的目检清晰度、颜色和可见颗粒phph分光光度法浓度分析复原时间测量复原速率卡尔·费休滴定测量水分含量rp-hplc化学改性(疏水性)结果与讨论冻干循环发展研究执行多个冻干循环以发展产生具有以下属性的饼状物的冻干循环:·极佳饼状物·在规格范围内的水分含量(<1.0%)·冻干饼状物的冷冻干燥时间和复原时间减少·良好产物稳定性在1号和2号冻干发展循环之前和之后执行ft-ir(傅里叶变换红外光谱)。ft-ir显示出冻干前、冻干后和复原后的良好结构稳定性。冻干产生的应力(压力和温度)在各种配制物中均未破坏kzr-616的结构完整性。视觉分析在零时,两个发展循环均显示出极佳饼状物。1号和2号发展循环显示样品外观清晰,无颗粒,并且呈浅黄色。配制物渗透压度在样品制备后,在任何应力暴露之前,测量九(9)种配制物的渗透压度。表2概述1号冻干循环配制物和特定试剂。在确认1号循环配制物的渗透压度(表12)后,降低2号循环的膨胀剂浓度,以达到等渗渗透压度(约300osmo)。2号冻干循环显示冻干前和复原后等渗渗透压度测量值(表12)。表12:渗透压度(1号和2号冻干循环)ph测量冻干循环1和2显示冻干前和复原后可比较的ph值(表13)。然而,复原后,2号冻干循环显示更接近目标值的ph值。表13:ph(1号和2号冻干循环)复原时间测量在冻干循环1和2之后,用一毫升过滤mq复原配制物。添加mq后,启动定时器以测量每种配制物均质化所需的时间量。1号冻干循环的复原时间为4:31分钟或更短,而2号循环显示复原时间为4:12分钟或更短(表14)。表14:复原时间(1号和2号冻干循环)水分含量测量(卡尔·费休)在冻干循环1和2之后,配制物显示彼此相当的水分含量值(表15)。所有冻干配制物均显示小于1%的水分含量值。1号冻干循环的水分含量值为0.28%到0.60%。2号冻干循环的水分含量值为0.21%到0.39%。表15:冻干循环水分含量测量(零时)rp-hplc分析在40℃下培育四(4)周后,与在零时观察到的主峰百分比(97.7%-98.6%)相比,所有复原配制物均显示主峰百分比下降(90.3%-91.7%)。rp-hplc鉴别kzr-616分子中的主要降解物质。峰rrt=0.1、kzr-59587、kzr-0214143和rrt=2.2在受到应力时显示出峰百分比的最大增加。二次干燥温度的变化显示零时主峰稳定性略有不同。在40℃下四周后,所有配制样品显示相当的稳定性(表16-19)。表16:rp-hplc(冻干前)综合表(1号循环)表17:rp-hplc(复原)综合表(1号循环)表18:rp-hplc(冻干前)综合表(2号循环)表19:rp-hplc(复原)综合表(2号循环)加速稳定性研究在加速稳定性研究中,以150mg/ml制备含有不同浓度的ph3.9和ph4.2膨胀剂的九(9)种缓冲(琥珀酸盐)和未缓冲配制物。视觉分析在6个月温度相关应力后,冻干配制物的外观呈现出极佳饼状物。冻干饼状物显示淡黄色,随着温度升高,颜色加深。复原后,配制物澄清,无颗粒,但也显示出淡黄色。培育6个月后,在5℃和25℃下,配制物的颜色与零时相当。在40℃下,与零时相比,配制物显示较深的淡黄色。配制物渗透压度在样品制备后,在任何应力暴露之前,测量九(9)种配制物的渗透压度,如表20所示。膨胀剂的浓度是基于2号冻干循环发展结果,目标为约300mosm的等渗配制物。6个月后,配制物f5显示与在零时观察到的渗透压度值相当的渗透压度值。表20:渗透压度(零时和f5t=6个月)ph测量在温度相关应力之后的每个时间点测量九(9)种配制物的ph。6个月后,配制物的ph与零时相当,如表21所示。表21:ph(零时和6个月)浓度测量6个月后,配制物显示与在零时观察到的浓度测量结果相当的浓度测量结果(表22)。表22:浓度(零时和六个月)复原时间测量在冻干后的每个时间点,用一毫升过滤mq复原配制物。添加mq后,定时器开始测量每种配制物均质化所需的时间量。6个月后,配制物显示与零时相当的复原时间。6个月后,所有配制物均显示少于3分钟30秒的复原时间(表23)。表23:复原时间(零时和6个月)水分含量测量(卡尔·费休)培育6个月后,配制物显示与零时相当的水分含量值(表24)。所示的所有冻干配制物继续显示小于1%的水分含量值。表24:水分含量(零时和六个月)rp-hplc分析与零时观察到的主峰百分比(98.2%-98.4%)相比,在5℃下培育六(6)个月后,所有复原配制物均显示主峰百分比下降(97.9%-98.1%),如图1a所示。在25℃下培育六(6)个月后,与在5℃下储存的配制物相比,所有复原配制物均显示降解物峰增加。配制物f2和f5显示最高百分比的kzr-616(分别为93.4%和93.1%),如图1b中所见。与在5℃下储存相比,在40℃下培育六(6)个月后,所有复原配制物均显示未知rrt=0.1(≤12.5%)、kzr-59587(≤16.1%)、未知rrt=0.5(≤1.4%)、kzr-0214143(≤1.9%)和未知rrt=2.2(≤2.4%)的增加,如图1c中所见。在25℃和40℃下储存后,配制物f2(在ph4.2下,含0.4%甘露醇和1%海藻糖,未缓冲)和f5(在ph4.2下,含2%海藻糖,未缓冲)在所有候选配制物当中显示最高主峰百分比。这份数据表明,在存在糖的情况下,kzr-616在ph4.2的未缓冲配制物中最稳定(表27)。不含糖的配制物f3、f6和f8的趋势进一步支持这种情况,所述配制物显示最差的稳定性结果。rp-hplc数据结果支持配制物f5为kzr-616的主要配制物并且为最好的候选配制物。表25:rp-hplc综合表(在5℃下t=6个月)表26:rp-hplc综合表(在25℃下t=6个月)表27:rp-hplc综合表(在40℃下t=6个月)在5℃下培育六(6)个月后,所有配制物均显示主峰百分比轻微变化。但是,所有配制物仍保持≥97.9%的主峰百分比。在25℃下培育六(6)个月后,所有配制物保持≥90.7%的主峰百分比。配制物f2和f5显示最高主峰百分比和最慢降解速率。在40℃下培育六(6)个月后,除f8之外的所有配制物保持≥70.0%的主峰百分比。配制物f5显示最高主峰百分比和最慢降解速率(80.3%)。水分优化这项研究的目的为判定改良的冻干循环是否可以进一步提高kzr-616在冷藏期间的稳定性。这项冻干循环优化研究聚焦于先前研究的主要配制物(2%海藻糖,ph4.2)。主要配制物f5是用批次a(c15072369-ff16001)和批次b(1605r110)的原料药制备。使用不同的二次干燥温度将各种批次原料药冻干,以实现最佳水分含量(表5)。视觉分析在零时,所有冻干前样品在视觉上均为澄清的,无颗粒并且显示淡黄色。与原料药(批次a)相比,较新鲜的原料药(批次b)显示出较浅颜色。冻干后,所有样品均显示出极佳饼状物。在40℃下4周后,样品显示与零时相当的清晰度和颜色。ph测量在t=4周时所有复原样品显示出相当的ph值(表28)。与零时相比,观察到轻微增加(≤±0.19)。表28:水分优化ph(零时和t=4周)浓度测量在40℃下培育四(4)周后,与零时相比,所有样品显示类似的浓度值(ta)。表29:水分优化浓度(零时和t=4周)复原时间测量在不同二级干燥温度下冻干后,用一毫升过滤mq复原配制物。添加mq后,启动定时器以测量每种配制物均质化所需的时间量。在40℃下培育四(4)周后,所有样品的复原时间均少于4分钟;35a显示2分15秒的最短复原时间;样品10a显示3分35秒的最长复原时间(表30)。表30:水分优化复原时间(零时和4周)水分含量测量(卡尔·费休)培育6个月后,配制物显示出与零时相当的水分含量值(表31)。所有冻干配制物继续显示小于1%的水分含量值。二次干燥温度的差异显示水分含量略有不同;较高温度显示最低水分百分比。表31:水分优化水分含量测量(零时)rp-hplc分析在40℃下培育四(4)周后,与在零时观察到的主峰百分比(97.7%-98.6%)相比,所有复原配制物均显示主峰百分比下降(90.3%-91.7%)。rp-hplc鉴别kzr-616分子中的主要降解物质。峰rrt=0.1、kzr-59587、kzr-0214143和rrt=2.2在受到应力时显示出峰百分比的最大增加。二次干燥温度的差异显示在零时主峰稳定性略有不同。在40℃下四周后,所有样品均显示出相当的稳定性。与相应批次a样品相比,批次b样品的主峰百分比下降幅度更大,其中主峰百分比为90.3%。这是因为除在批次a的样品中未观察到降解物峰之外,观察到kzr-0214142大量增加。表32:水分优化rp-hplc综合表(零时)表33:水分优化rp-hplc综合表(t=4周)rp-hplc显示在40℃下四周后降解物质增加。批次b显示另一个峰(约10分钟),其不存在于批次a样品中。在这项冻干配制物发展研究中检查kzr-616在各种配制条件下的稳定性。在这项研究中研究的条件包括具有在不同ph值(3.9-4.2)下的各种膨胀剂(l-甘氨酸、甘露醇、海藻糖)的缓冲(10mm琥珀酸盐)和未缓冲配制物。检查在冷藏温度(5℃)、周围温度(25℃)和加速温度(40℃)下长达6个月的储存条件下kzr-616在不同配制物中的稳定性,并且通过反相hplc(rp-hplc)进行分析,以评估kzr-616稳定性。在开始加速稳定性研究之前,进行两轮冻干循环发展。这两个发展循环均显示出极佳饼状物和复原后的样品,所述样品在视觉上无颗粒,并且颜色略带黄色。根据rp-hplc,1号冻干循环显示出良好稳定性。但是,在测量ph和渗透压度后,结果显示偏离目标的ph和渗透压度值。用优化膨胀剂对配制物进行2号冻干循环,以实现目标ph和渗透压度。此外,循环2减少负载阶段,提高初次干燥存放温度,并且降低二次干燥存放温度。2号循环产生的样品显示出极佳饼状物,并且根据rp-hplc,显示出良好稳定性。储存6个月后,冻干配制物在所有储存温度下始终显示出极佳饼状物。但是,冻干物显示出黄色加深,尤其在25℃和40℃储存时,并且在复原后变得更加明显。复原后,所有配制物均不含颗粒。随着时间推移,未观察到ph或浓度明显变化。不管储存温度如何,所有配制物在储存6个月后的复原时间始终少于4分钟30秒。使用rp-hplc对所有配制物在所有储存温度下的化学稳定性进行评估。在5℃下储存6个月后,配制物显示出与零时相当的主峰百分比(98.2%-98.4%),保持主峰百分比≤97.9%。在25℃下储存6个月后,与零时(98.2%-98.4%)相比,配制物显示出主峰百分比下降,保持主峰(kzr-616)百分比(90.7%到93.4%)。含海藻糖的配制物f1、f2和f5在25℃下放置6个月后显示出最高主峰百分比(92.8%、93.4%和93.1%)。在40℃下储存6个月后,与零时(98.2%-98.4%)相比,配制物显示出主峰百分比显著下降,保持主峰(kzr-616)百分比(63.8%到80.3%)。对主要配制物f5执行额外水分优化研究,以优化冻干循环,降低水分含量并且进一步提高kzr-616稳定性。水分优化研究在不同二次存放温度10℃、25℃、35℃和50℃下执行冻干循环。在40℃下储存4周后,批次c15072369-ff16001的所有样品显示出相当的外观、ph、浓度、复原时间和根据rp-hplc的峰百分比,以上与二次干燥存放温度无关。在40℃下培育4周后,与零时(97.7%-98.6%)相比,批次c15072369-ff16001的所有复原配制物显示主峰百分比下降(91.5%-91.7%)。利用rp-hplc,鉴别kzr-616分子中的主要降解物质。峰rrt=0.1、kzr-59587、kzr-0214143和rrt=2.2在受到应力时显示出峰百分比的最大增加。与相应批次c15072369-ff16001样品相比,批次1605r110中的样品显示主峰百分比下降幅度更大,其中主峰百分比为90.3%。这是因为除了在批次c15072369-ff16001样品中观察到的降解物峰之外,也观察到kzr-0214142大幅增加。这项研究在4周后产生相当的kzr-616稳定性,并且证实低水分含量值,并且在冻干循环之间没有明显水分差异。二次干燥温度的差异显示在零时主峰的稳定性略有不同。在40℃下放置四周后,所有配制样品均显示出相当的稳定性,表明进一步干燥饼状物无法实现稳定性提高。总之,含海藻糖的配制物f2和f5在40℃下放置6个月后显示出最高主峰百分比(78.7%、80.3%)。所述数据表明在糖存在的情况下,ph4.2的未缓冲配制物中的kzr-616最稳定。无糖配制物f3、f6和f8的趋势显示出最差稳定性结果,进一步证明以上情况。实例2表34-36展示在各种动物中在不同kzr-616配制物情况下观察到的药物动力学(“pk”)与毒物动力学(“tk”)的比较。当用注射用水溶解时,测试配制物包含含如所述的各种浓度的kzr-616的2wt%海藻糖ph4.2。比较配制物包含含如所述的各种浓度的kzr-616的10wt%聚山梨酯-80水溶液(“ps-80”)。表34显示,与比较配制物相比,测试配制物展现出更快的吸收和消除以及高2-3倍的cmax。两种配制物观察到相似auc。表34:猴tk比较结果表35显示观察到测试配制物的更快的吸收和消除以及高1.2-3.7倍的cmax。对于两种配制物,观察到0.7-1.7倍auc差异。表35:大鼠tk比较结果表36的测试配制物制备为上述注射用水(“wfi”)配制物,而比较配制物制备为10wt%聚山梨酯-80水溶液(“ps-80”)配制物。对于测试配制物,观察到更快的吸收和消除以及高1.1-2.4倍的cmax。对于两种配制物,观察到0.6-1.0倍auc差异。表36:兔tk比较结果当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1