用于治疗胰腺癌的方法
简介
本文描述用于治疗有此需要的受试者的胰腺癌的方法,包括向受试者施用有效量的微管蛋白聚合抑制剂化合物。更具体地,本文描述用于治疗有此需要的受试者的胰腺导管腺癌的方法,包括向受试者单独施用有效量的取代的反向嘧啶微管蛋白聚合抑制剂化合物或者向受试者组合施用有效量的取代的反向嘧啶微管蛋白聚合抑制剂化合物与其他化学治疗剂。
背景
估计2018年将有55440名美国人被诊断患有胰腺癌,胰腺癌是癌症相关死亡率的第五大最常见原因。预计这些数据将在未来十年中上升。胰腺导管腺癌(pda)是高化疗抗性癌症,每年造成超过45000人死亡,约占胰腺肿瘤的93%。尽管近年来取得了一些重大进步,但是pda仍然是很难治疗的癌症,中位生存期不足六个月,五年存活率仅为8.7%。
有几个因素导致了这种不良预后。大多数患者(85%)患有晚期疾病,使得他们无法接受唯一有效的干预:手术切除。然而,由于复发率较高,即便在那些已经接受了手术的患有局部局限性疾病的患者中,五年存活率和十年存活率也分别仅为25%和8%(a.richteretal.,worldjsurg27,324,mar2003)。对于这些剩下的85%的患者以及那些疾病复发的患者来说,几乎没有可采用的治疗方法。国家护理标准疗法,吉西他滨适度延长了几周的生存期,该疗法经批准主要用于改善生活质量指标(h.a.burris,3rdetal.,jclinoncol15,2403,jun1997)。fda批准的用于晚期pda的仅有的另一种药剂是特罗凯(tarceva),特罗凯与吉西他滨组合施用时仅平均增加10天的益处。尽管对不同药剂和组合进行了60多次的临床试验(h.q.xiong,k.carr,j.l.abbruzzese,drugs66,1059,2006),但是还未发现其他有效的疗法。
pda最显著的特征之一是存在扩张性促结缔组织增生基质,扩张性促结缔组织增生基质调节局部微环境,产生较高的组织间隙液压、不良的血管分布以及组织灌注和扩散减少。因此,向胰腺肿瘤传递药物的效率要比在正常组织中传递药物的效率要低,导致了这种疾病特有的广谱原发性化疗抗性。pda对细胞毒性疗法的广谱抗性的部分起因在于这种对药物传递的生物物理屏障。
在kpc(kraslsl.g12d/+;p53r172h/+;pdxcretg/+)基因工程化小鼠模型中对化学治疗剂所进行的临床前测试表明,针对pda的药物开发工作应当专注于具有较长半衰期和较高治疗指标(功效和毒性之间的浓度范围)的药剂,以此作为提高药物暴露量的手段。另外,在设计新的pda治疗方案时,还应当考虑药物在肿瘤细胞中的稳定性和滞留。
遗憾的是,大多数的传统细胞毒性剂会很快地从循环中清除,对正常增生组织具有急性毒性,会很快地被代谢掉,或者从肿瘤细胞中主动输出。信息丰富的反例是白蛋白结合型紫杉醇(nab-paclitaxel)(白蛋白结合型紫杉醇(abraxane),新基生物制药(celgene)),这是一种白蛋白结合形式的微管稳定剂紫杉醇,由fda批准与吉西他滨组合施用来治疗转移性胰腺癌患者。白蛋白结合型紫杉醇在循环中的终末半衰期为27小时,并且比未改性的紫杉醇的毒性低。该治疗方案的成功有助于证实药理学在胰腺癌药物开发中的重要性,并且证明了吉西他滨(脱氧胞苷类似物)与微管靶向药剂组合施用的益处。
因此,仍然需要克服pda生物物理屏障以产生肿瘤组织内的有效生物分布、具有必要的药效性质并且与其他化学治疗剂协同联用以治疗胰腺癌的化学治疗剂。
概述
化合物1是一种小分子抗癌剂或其药学上可接受的盐或药物组合物,该小分子抗癌剂可用于抑制微管蛋白聚合以及bmi-1蛋白功能(参见wo2014/081906),被称为5-氟-2-(6-氟-2-甲基-1h-苯并[d]咪唑-1-基)-n4-[4-(三氟甲基)苯基]嘧啶-4,6-二胺,具有式(i)的结构:
化合物1已经显示出药理性质,包括较长的循环半衰期、缺乏p-糖蛋白(pgp)底物活性和肿瘤组织内的有效生物分布。此外,化合物1已被证明在多个pda细胞系中诱导有丝分裂阻滞和细胞凋亡。
通过机理研究,不局限于任何特定的理论,化合物1已经被证明起到了微管聚合抑制剂的作用。此外,化合物1与标准临床治疗方案(诸如吉西他滨和/或白蛋白结合型紫杉醇)协同联用,以提高在患者源性异种移植物模型(pdx)中的药效,产生有效且持久的癌症消退。此外,在高化疗抗性的基因工程化kpcpda小鼠模型中,化合物1与吉西他滨组合施用已显示了功效。
这些数据和临床开发中作为抗癌剂显示的安全性概况证明了化合物1与护理标准化学疗法组合施用来治疗pda的的清晰原理。
详述
本文所述的一个方面包括用于治疗有此需要的受试者的胰腺癌的方法,包括向受试者施用有效量的具有式(i)结构的化合物1,即5-氟-2-(6-氟-2-甲基-1h-苯并[d]咪唑-1-基)-n4-[4-(三氟甲基)苯基]嘧啶-4,6-二胺:
或其药学上可接受的盐或药物组合物。
另一个方面包括用于治疗有此需要的受试者的胰腺导管腺癌的方法,包括向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物。
本文所述的一个方面包括用于治疗有此需要的受试者的胰腺癌的方法,包括向受试者组合施用有效量的化合物1或其药学上可接受的盐或药物组合物和有效量的一种或多种化学治疗剂。
另一个方面包括用于治疗有此需要的受试者的胰腺导管腺癌的方法,包括向受试者组合施用有效量的化合物1或其药学上可接受的盐或药物组合物和有效量的一种或多种化学治疗剂。
本文所述的一个方面包括用于治疗有此需要的受试者的胰腺导管腺癌的方法,包括向受试者组合施用有效量的化合物1或其药学上可接受的盐或药物组合物和有效量的吉西他滨和/或白蛋白结合型紫杉醇。
另一个方面包括用于治疗有此需要的受试者的胰腺导管腺癌的方法,包括向受试者组合施用有效量的化合物1或其药学上可接受的盐或药物组合物和有效量的吉西他滨和/或白蛋白结合型紫杉醇。
附图说明
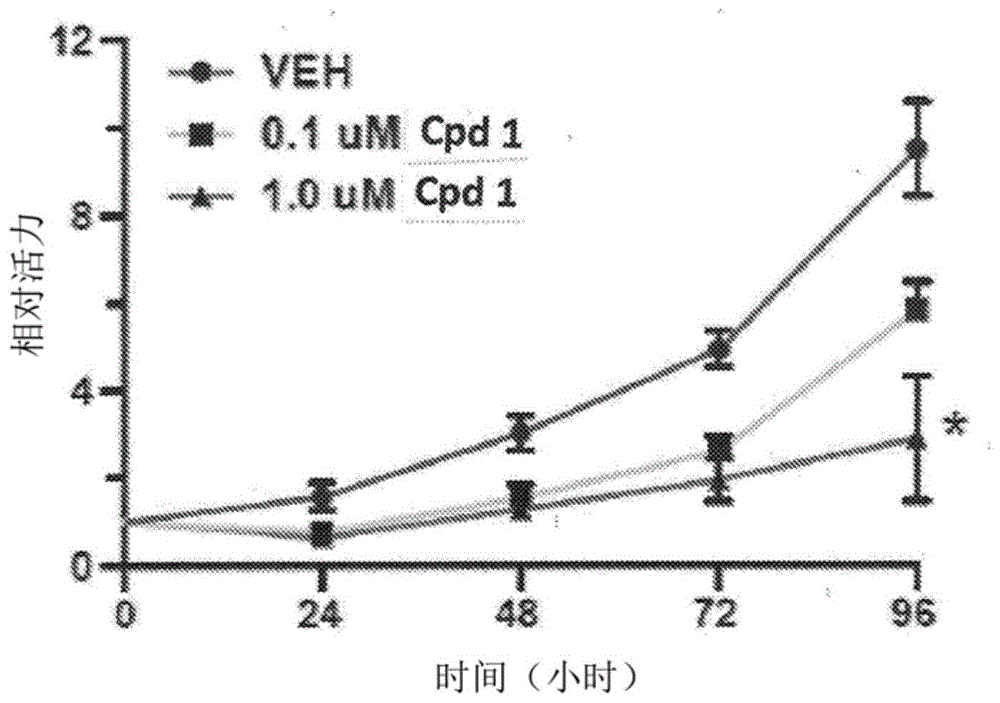
图1a是用媒介物(vehicle)或化合物1(0.1μm或1.0μm)治疗后,相对aspc1细胞活力随时间变化的图。结果表明,相对于媒介物,化合物1表现出人pda细胞活力的剂量和时间依赖性降低。
图1b示出了来自用媒介物或化合物1(0.1μm或1.0μm)治疗的aspc1细胞的dna含量(通过流式细胞术用7-aad荧光测定)的代表性柱状图。
图1c是用媒介物(dmso)、化合物1(0.1μm,1.0μm)或0.1μm诺考达唑(noc,阳性对照)治疗24小时后,处于g0/g1期、s期和g2/m期的aspc1细胞的百分比图。
图1d是用dmso、化合物1(0.1μm或1.0μm)或0.1μm诺考达唑(noc)治疗24小时后,有丝分裂过程中的aspc1细胞(pfi3+/4ndna含量)的百分比图。图1b、1c和1d显示,化合物1在人pda细胞的细胞周期阻滞中表现出剂量和时间依赖性效果。
图2a示出了在用媒介物或化合物1(1.0μm)治疗的aspc1细胞中,在24小时、48小时和72小时时间点通过dapi荧光测定的dna含量的代表性柱状图。
图2b是在用dmso或化合物1(0.1μm或1.0μm)治疗后,在24小时、48小时和72小时时间点dna含量大于4n的aspc1细胞百分比图。图2a和2b显示,化合物1表现出受多倍性影响的人pda细胞数量的剂量和时间依赖性增加。
图3a示出了代表性的流式细胞术散点图,其示出了用dmso治疗24小时后或者用1.0μm化合物1治疗在72小时时,aspc1细胞凋亡的诱导。对未固定的细胞进行活性半胱天冬酶3和dapi染色,以区分活细胞(左下)与早期细胞凋亡(左上)、晚期细胞凋亡(右上)和坏死(右下)。
图3b是相对于dmso或化合物,在24小时、48小时和72小时时间点定量的总凋亡aspc1细胞(活性半胱天冬酶3+)的柱状图。图3a和3b显示,相对于媒介物,化合物1表现出细胞生物标志物的时间依赖性增加,表明细胞凋亡的相应增加。
图4a是化合物1在小鼠中的血浆水平的曲线图,其是在基线处或在口服单剂量的化合物1(10mg/kg)后2、4、7、24或48小时通过质谱分析法测定的。图4a表明,化合物1具有较长的血浆半衰期,并且可穿透cns并分布到脑组织中。
图4b是用化合物1、化合物2、氯丙嗪、嘌呤霉素、长春碱、多柔比星、紫杉醇和长春新碱治疗mdck-p-gp和mdck-wt细胞的cc50值的比值图。图4b显示,与引起细胞周期阻滞的其他化学治疗剂相比,化合物1、化合物2和氯丙嗪没有起到pgp底物的作用。
图5a是单独口服单剂量化合物1(10mg/kg)或组合口服单剂量化合物1(10mg/kg)与吉西他滨24小时后,化合物1在kpc小鼠的血浆、四头肌和pda组织中的浓度图。图5a显示,组合疗效的提高并不归因于药物代谢动力学的药物间的相互作用。
图5b是用10mg/kg化合物1治疗的kpc小鼠肿瘤上的cyclinb1蛋白质印迹。肿瘤活检样本(bx)在第一次给药前48小时采集,并与第三次给药24小时后尸检(nx)时采集的样本进行比较。
图5c是图5b中的cyclinb1(cycb1)的定量图,归一化为黏着斑蛋白(vinculin,vine)。图5a显示,化合物1分布在pda组织中;并且图5b和5c显示,化合物1表现出细胞周期蛋白b1相对于黏着斑蛋白的一致减少,表明细胞周期蛋白b1相对于黏着斑蛋白诱导的细胞凋亡的减少诱导了pda细胞有丝分裂进展的减少。
图6a是用化合物1和吉西他滨组合治疗的kpc小鼠随时间变化的体重图。
图6b是用媒介物(veh)、吉西他滨(gem,100mg/kg,每周两次(b.i.w.))、化合物1(cpd1,17mg/kg,每周两次)或化合物1和吉西他滨的组合(cpd/gem)治疗的kpc小鼠随时间变化的的存活率图。
图6c是根据用媒介物(veh)、吉西他滨(gem)、化合物1(cpd1)或化合物1和吉西他滨的组合(cpd/gem)治疗的kpc小鼠的纵向肿瘤体积计算的肿瘤生长速率图。
图6d是磷酸化组蛋白h3(ph3)细胞的免疫组织化学定量图,示出了在用媒介(veh)、吉西他滨(gem)、化合物1(cpd1)或化合物1和吉西他滨的组合(cpd/gem)治疗的kpc小鼠中,在尸检后,每个肿瘤超过10个视野中每个40倍视野的平均阳性细胞。
图6e是磷酸化裂解的半胱天冬酶-3(cc3)细胞的免疫组织化学定量图,示出了用媒介物(veh)、吉西他滨(gem)、化合物1(cpd1)或化合物1和吉西他滨的组合(cpd1/gem)治疗的kpc小鼠中,在尸检后,每个肿瘤超过10个视野中每个40倍视野的平均阳性细胞。图6a、6b、6c、6d和6e显示,化合物1与吉西他滨组合施用协同增加了kpc小鼠模型的总存活率;其中图6a显示,化合物1与吉西他滨组合施用保持了相对kpc小鼠的体重;图6b显示,相对于单独施用媒介物、吉西他滨或化合物1,化合物1与吉西他滨组合施用同时减小了肿瘤体积,同时相对于单独施用每种药剂,协同增加了总存活率;图6c、6d和6e显示,相对于单独施用媒介物、吉西他滨或化合物1,化合物1与吉西他滨组合施用表现出pda细胞和某些细胞生物标志物的生长速率总体降低。
图7a是用媒介物(veh)或化合物1(cpd1)治疗的kpc小鼠的高分辨率3d超声测量的肿瘤体积图。
图7b是用媒介物(veh)或化合物1和吉西他滨的组合(cpd1/gem)治疗的kpc小鼠的高分辨率3d超声测量的肿瘤体积图。图7a显示,相对于媒介物,化合物1表现出kpc小鼠模型pda肿瘤体积的时间依赖性减小;并且图7b显示,相对于单独施用吉西他滨或化合物1,化合物1与吉西他滨组合施用表现出kpc小鼠pda肿瘤体积的进一步时间依赖性减小。
图8a是用媒介物(veh)、化合物1(cpd1)、吉西他滨(gem)或化合物1和吉西他滨的组合(cpd1/gem)治疗的kpc小鼠在7天内通过体积百分比变化测量的肿瘤生长图。
图8b是用媒介物(v)、化合物1(cpd1+v)、吉西他滨(g)或化合物1和吉西他滨的组合(cpd1+g)治疗的kpc小鼠中有肝转移的小鼠的百分比图。图8a显示,相对于单独施用媒介物、吉西他滨或化合物1,化合物1与吉西他滨组合施用表现出kpc小鼠pda肿瘤生长的下降;并且图8b显示,相对于单独施用媒介物和吉西他滨,化合物1与吉西他滨组合施用表现出kpc小鼠pda驱动的肝转移的减少。
图9a是用吉西他滨(gem)治疗的kpc小鼠的染色肿瘤切片。
图9a是用化合物1和吉西他滨(cpd1/gem)的组合治疗的kpc小鼠的染色肿瘤切片的图像。图9a示出了吉西他滨诱导的凋亡细胞群;图9b示出了化合物1与吉西他滨组合施用诱导的凋亡细胞群;其中化合物1与吉西他滨组合施用表现出凋亡细胞群的显著增加,表明凋亡诱导的协同增加。
图10a是一系列蛋白质印迹,显示了相对于负载有黏着斑蛋白(vinc)的对照,用媒介物(veh)、0.1um诺考达唑(noc)、0.1μm化合物1(0.1)或1.0μm化合物1(1.0)治疗了24小时的aspc1、miapaca-2和panc1细胞中的bmi-1水平。图10a显示,相对于媒介物和黏着斑蛋白表达,化合物1表现出在不同细胞类型中bmi-1蛋白表达的一致减少。
图10b是用媒介物(veh)、0.1μm化合物1(cpd1)或1.0μm化合物1(cpd1)治疗96小时后j1002veh和j1002tam细胞的相对活力图。图10b显示,相对于媒介物和j1002的存在,化合物1表现出依赖于bmi-1蛋白表达的细胞活力的剂量和时间依赖性降低。
图10c是用化合物1治疗72小时的j1002veh和j1002tam细胞的剂量响应曲线图。图10c显示,相对于媒介物治疗的细胞,在j1002存在下,化合物1表现出bmi-1蛋白表达降低的亚-μm活性。
图10d示出了用媒介物(veh)或1.0μm化合物1(cpd1)治疗24小时的j1002veh细胞的代表性dna柱状图。
图10e是用媒介物(veh)或1.0μm化合物1(cpd1)治疗24小时后,处于g0/g1期、s期和g2/m期的j1002veh细胞的百分比图。
图10f示出了用媒介物(veh)或1.0μm化合物1(cpd1)治疗24小时的j1002tam细胞的代表性dna柱状图。
图10g是用媒介物(veh)或1.0μm化合物1(cpd1)治疗24小时后,处于g0/g1期、s期和g2/m期的j1002tam细胞的百分比图。图10d、10e、10f和10g显示,相对于媒介物和j1002的存在,化合物1表现出受多倍性影响的bmi-1依赖性细胞数量的剂量和时间依赖性增加;其中整体数据表明,由于有丝分裂阻滞,化合物1间接诱导了bmi-1过度磷酸化。
图11a是在用dmso或1μm化合物1(cpd1)治疗的aspc1细胞上通过rna-seq测定的差异表达基因图,其在8、16和24小时时间点整合。
图11b是蛋白质印迹,显示了用媒介物(veh)、3.0μm化合物1(cpd1)、1.0μm秋水仙碱(col)或1.0μm紫杉醇(tax)治疗2小时的aspc1细胞的游离微管蛋白。治疗后,通过离心分离出细胞裂解物,以便从微管中分离出游离微管蛋白。lsp=低速颗粒(1000×g,5分钟),hsp=高速颗粒(100000×g,1小时),hss=高速上清液(100000×g,1小时)。图11a和11b显示,相对于媒介物、col(卡铂)和tax(它莫西芬),化合物1在预防微管蛋白形成方面表现出显著的差异倍数提高。
图11c是用媒介物(veh)治疗24小时的aspc1细胞中微管蛋白和dapi的图像。
图11d是用化合物1(cpd1)治疗24小时的aspc1细胞中微管蛋白和dapi的图像。图11c和11d显示,相对于媒介物,化合物1表现出微管蛋白形成的显著减少。
图11e是用媒介物(dms)、它莫西芬(tax)、卡铂(col)和化合物1(0.12μm、0.37μm、1.1μm、3.33μm和10μm)治疗的细胞随时间变化的微管蛋白聚合测定图。
图11f是图11e中示出的荧光单位/分钟图。图11e和11f显示,相对于媒介物、col(卡铂)和tax(它莫西芬),化合物1表现出微管蛋白聚合的剂量依赖性降低;其中整体数据表明,化合物1直接抑制了微管形成。
图12a是源自用媒介物(veh)、吉西他滨(gem)、白蛋白结合型紫杉醇(nabp)、吉西他滨和白蛋白结合型紫杉醇的组合(gm/nabp)、化合物1(cpd1)、化合物1和吉西他滨的组合(cpd1/gem)、化合物1和白蛋白结合型紫杉醇的组合(cpd1/nabp)以及化合物1、吉西他滨和白蛋白结合型紫杉醇的组合(cpd1/gem/nabp)治疗的人pda的皮下患者源异种移植物随时间变化的平均肿瘤体积图。
图12b是用媒介物(veh)、吉西他滨(gem)、白蛋白结合型紫杉醇(nabp)、吉西他滨和白蛋白结合型紫杉醇的组合(gm/nabp)、化合物1(cpd1)、化合物1和吉西他滨的组合(cpd1/gem)、化合物1和白蛋白结合型紫杉醇的组合(cpd1/nabp)以及化合物1、吉西他滨和白蛋白结合型紫杉醇的组合(cpd1/gem/nabp)治疗的小鼠随时间变化的体重图。
图12c示出了用吉西他滨(gem)、白蛋白结合型紫杉醇(nabp)和化合物1(cpd1)治疗的肿瘤的生长和衰退常数。
图12d是用媒介物(veh)、吉西他滨(gem)、白蛋白结合型紫杉醇(nabp)、吉西他滨和白蛋白结合型紫杉醇的组合(gm/nabp)、化合物1(cpd1)、化合物1和吉西他滨的组合(cpd1/gem)、化合物1和白蛋白结合型紫杉醇的组合(cpd1/nabp)、以及化合物1、吉西他滨和白蛋白结合型紫杉醇的组合(cpd1/gem/nabp)治疗的每只小鼠的肿瘤反应图。图12a、12b、12c和12d显示,在pda的人源性异种移植物模型中,化合物1与白蛋白结合型紫杉醇的双重组合以及化合物1与吉西他滨和白蛋白结合型紫杉醇的三重组合中的任一者或两者协同降低了肿瘤体积和总肿瘤生长;其中图12a显示,相对于单独施用媒介物、吉西他滨、化合物1和白蛋白结合型紫杉醇、组合施用吉西他滨与白蛋白结合型紫杉醇以及组合施用吉西他滨与化合物1,化合物1与白蛋白结合型紫杉醇的双重组合以及化合物1与吉西他滨和白蛋白结合型紫杉醇的三重组合中的任一者或两者协同减小了肿瘤体积;图12b显示,相对于单独施用媒介物、吉西他滨、化合物1和白蛋白结合型紫杉醇、组合施用吉西他滨与白蛋白结合型紫杉醇、组合施用吉西他滨与化合物1、组合施用化合物1与白蛋白结合型紫杉醇、以及协同组合施用化合物1与吉西他滨和白蛋白结合型紫杉醇,所有组合施用保持了相对kpc小鼠体重;图12c显示,相对于吉西他滨、化合物1和白蛋白结合型紫杉醇中的任何一种的存在或不存在,化合物1与吉西他滨和/或白蛋白结合型紫杉醇组合施用显著降低了肿瘤生长的总体速率,同时增加了肿瘤体积的衰退速率;图12d显示,相对于吉西他滨、化合物1和白蛋白结合型紫杉醇中的任何一种的存在或不存在,化合物1与吉西他滨和/或白蛋白结合型紫杉醇组合施用显著减小了初始肿瘤体积。
定义
如本文所用,术语“大约”是指一个给定值前后的范围,其中所得的值基本上与明确列举的值相同。在一个方面,“大约”是指在给定值或范围的25%之内。例如,短语“约70wt%”包括至少52wt%至88wt%范围内的所有值。在另一个方面,术语“大约”是指在给定值或范围的10%之内。例如,短语“约70wt%”包括至少63wt%至77wt%范围内的所有值。在另一个方面,术语“大约”是指在给定值或范围的7%之内。例如,短语“约70wt%”包括至少65wt%至75wt%范围内的所有值。
浓度、量、细胞计数、百分比和其他数值在本文中可以以范围形式提供。应当理解的是,使用这种范围形式仅仅是为了方便和简洁,并且应当灵活地理解为不仅包括作为该范围的限值而明确列举的数值,还包括包含在该范围内的所有单个数值或子范围,如同每个数值和子范围都被明确列举一样。
如本文所用,术语“多种疗法(therapies)”和“疗法(therapy)”可以指的是能够用于预防、治疗、控制或改善病状、病症或其一种或多种症状(例如,胰腺癌,或与其相关的一种或多种症状或一种或多种病状)的任何方案、方法、组合物、制剂和/或药剂。
在某些方面,术语“多种疗法”和“疗法”指的是能够用于治疗、控制、预防或改善病状、病症或其一种或多种症状(例如,胰腺癌,或与其相关的一种或多种症状或一种或多种的病状)的药物疗法(比如化学疗法)、辅助疗法、放射、手术、生物疗法、支持疗法、抗病毒疗法和/或其他疗法。在某些方面,术语“疗法”指的是除化合物1或其药学上可接受的盐或药物组合物之外的疗法。在特定的方面,“额外疗法(additionaltherapy)”和“多种额外疗法(additionaltherapies)”指的是除了使用化合物1或其药学上可接受的盐或药物组合物的治疗之外的疗法。在特定的方面,疗法包括使用化合物1作为辅助疗法。例如,将化合物1与能够用于治疗、控制、预防或改善病状、病症或其一种或多种症状(例如,胰腺癌,或与其相关的一种或多种症状或一种或多种病状)的药物疗法(比如化学疗法)、生物疗法、手术、支持疗法、抗病毒疗法和/或其他疗法)结合使用。
如本文所用,术语“人类婴儿”指的是新生至1岁的人类。
如本文所用,术语“人类幼儿”指的是1岁至3岁的人类。
如本文所用,术语“人类儿童”指的是1岁至18岁的人类。
如本文所用,术语“人类成人”指的是18岁或以上的人类。
如本文所用,术语“中年人”指的是30岁至64岁之间的人类。
如本文所用,术语“老年人”指的是65岁或以上的人类。
如本文所用,术语“受试者”指的被施用如本文所述的疗法的个体。在特定的方面,个体是人。
如本文所用,术语“胰腺癌”通常指的是如本文所述的胰腺癌。在特定的方面,一般术语胰腺癌可以指的是胰腺导管腺癌(pda),而不具体使用该术语。
如本文所用,在向患有胰腺癌的受试者施用化合物1的上下文中,术语“有效量”指的是导致有益或治疗效果的化合物1的剂量。在特定的方面,化合物1的“有效量”指的是足以实现至少一种、两种、三种、四种或更多种下列有益或治疗效果的化合物1的量:(i)抑制胰腺癌;(ii)胰腺癌消退;(iii)根除、去除或完全缓解了胰腺癌;(iv)预防与胰腺癌相关的一种或多种症状的发展或发作;(v)降低或改善与胰腺癌相关的一种或多种症状的严重性;(vi)减少与胰腺癌相关的一种或多种症状的数量;(vii)改善与胰腺癌相关的一种或多种症状的严重性;(viii)减少与胰腺癌相关的一种或多种症状的持续时间;(ix)预防与胰腺癌相关的增殖或一种或多种症状的复发;(x)降低死亡率;(xi)提高受试者的存活率;(xii)提高无复发存活率;(xiii)增加缓解期的胰腺癌受试者的数量;(xiv)减少受试者的住院治疗;(xv)减少住院治疗的时长;(xvi)降低住院治疗率;(xvii)提高受试者的存活率;(xviii)提高胰腺癌受试者的无症状存活率;(xix)延长受试者的胰腺癌缓解缓解期;(xx)改善经本领域公知的方法(例如,qol问卷等)评估的生活质量(qol);(xxi)在用另一种化学治疗剂治疗之前,施用化合物1而减少了增殖;(xxii)在用另一种化学治疗剂治疗之后,施用化合物1而减少了增殖;(xxiii)在组合疗法中组合施用化合物1和另一种化学治疗剂而减少了增殖;(xxiv)在组合疗法中组合施用化合物1和另一种化学治疗剂而实现了附加的抗增殖效果;(xxv)在组合疗法中组合施用化合物1和另一种化学治疗剂而实现了协同抗增殖效果;(xxvi)在放射治疗之前,施用化合物1而减少了增殖;(xxvii)在放射治疗之后,施用化合物1而减少了增殖;(xxviii)在放射组合疗法中施用化合物1而减少了增殖;(xxix)在手术治疗之前,施用化合物1而减少了增殖;(xxx)在手术组合治疗中施用化合物1而减少了增殖;(xxxi)在姑息疗法中施用化合物1而增强或改善了治疗效果;(xxxii)降低患有胰腺癌的受试者体内的bmi-1的血浆浓度;(xxxiii)减少患有胰腺癌的受试者的血浆中的循环增殖细胞;(xxxiv)改变(例如,降低或提高)患有胰腺癌的受试者的胰腺癌生物标志物(例如,bmi-1、微管蛋白聚合、凋亡标志物或组织等)的血浆浓度;(xxxv)降低来自患有胰腺癌的受试者的生物标本(例如,血浆、血清、尿液或其他任何生物流体)中的bmi-1浓度;(xxxvi)通过本领域技术人员可用的常规方法(比如,磁共振成像(mri)、动态对比增强磁共振成像(dce-mri)、x射线、计算机断层扫描(ct)、正电子发射计算机断层扫描(pet)、7-aad荧光或者dapi荧光)测量,在施用了如本文所述的疗法之后保持增殖细胞计数;(xxxvii)通过本领域技术人员可用的常规方法(比如,磁共振成像(mri)、动态对比增强磁共振成像(dce-mri)、x射线、计算机断层扫描(ct)、正电子发射计算机断层扫描(pet)、7-aad荧光或者dapi荧光)测量,在施用了如本文所述的疗法之后减少了增殖细胞计数;或者(xxxviii)通过本领域技术人员可用的常规方法(比如,磁共振成像(mri)、动态对比增强磁共振成像(dce-mri)、x射线、计算机断层扫描(ct)、正电子发射计算机断层扫描(pet)、7-aad荧光或者dapi荧光)测量,在施用了如本文所述的疗法之后,增殖细胞计数没有增加或者增加的比预期要少。
如本文所使用的,术语“在24小时的时间段内”指的是保持一种状态的一段时间;例如,当达到并保持化合物1的平均血浆浓度达多个24小时的时间段时,则确定了化合物1的有效量。换句话说,可以在合适的时间内达到化合物1的平均血浆浓度,该时间可以大于或小于24小时。
如本文所用,术语“如本文所述的疗法”指的是使用化合物1或其药学上可接受的盐或药物组合物作为bmi-1功能抑制剂,通过靶向抑制微管蛋白聚合来治疗或改善有此需要的受试者的胰腺癌的方法,包括向受试者施用有效量的化合物1。
在一个方面,胰腺癌是胰腺导管腺癌。在本文所述疗法的另一个方面,该化合物1或其药学上可接受的盐或药物组合物的使用方法包括与具有协同抗增殖活性的其他化学治疗剂组合施用。在一个方面,该另一种化学治疗剂抑制bmi-1功能活性。在另一个方面,该另一种化学治疗剂抑制微管蛋白聚合。
如本文所用,术语“药学上可接受的盐”指的是由药学上可接受的无毒酸或碱(包括无机酸和碱以及有机酸和碱)制备的盐;参见,例如,remington’spharmaceuticalsciences,18theds.,mackpublishing,eastonpa(1990)orremington:thescienceandpracticeofpharmacy,19theds.,mackpublishing,eastonpa(1995)。
如本文所用,术语“化合物1”通常指5-氟-2-(6-氟-2-甲基-1h-苯并[d]咪唑-1-基)-n4-[4-(三氟甲基)苯基]嘧啶-4,6-二胺化合物及其药学上可接受的盐。“化合物1”可以基本上是纯的(例如,纯度为约90%、约95%、约98%、约99%或约99.9%)。在各个方面,术语“化合物1”指的是国际公布号wo2014/081906中公开的化合物109,其全部内容通过引用并入本文。
使用方法
如本文所述,化合物1或其药学上可接受的盐或药物组合物是微管蛋白聚合和bmi-1功能的抑制剂,用于治疗或改善有此需要的受试者的胰腺癌,包括向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物。
在一个方面,胰腺癌是胰腺导管腺癌。
在另一个方面,化合物1或其药学上可接受的盐或药物组合物的使用方法包括:组合施用化合物1或其药学上可接受的盐或药物组合物与一种或多种其他化学治疗剂,其中该组合施用表现出协同抗增殖活性。在一个方面,该另一种化学治疗剂抑制bmi-1功能活性。在另一个方面,该另一种化学治疗剂抑制微管蛋白聚合。然而,目前还没有已知或批准的bmi-1功能活性和/或微管蛋白聚合的抑制剂用于治疗胰腺癌。因此,有效和选择性的活性、有利的药物性质和广泛的临床经验表明,化合物1是治疗胰腺癌的有用药剂。
在一个方面,本文描述了用于抑制或减少微管蛋白聚合和bmi-1功能以诱导增殖细胞或细胞系中的细胞周期阻滞的方法。
在另一个方面,用于抑制或减少微管蛋白聚合和bmi-1功能以诱导增殖细胞或细胞系中的细胞周期阻滞的方法包括:将化合物1或其药学上可接受的盐或药物组合物与增殖细胞或细胞系接触,其中增殖细胞或细胞系可以是初始细胞(
在另一个方面,此类细胞或细胞系的非限制性实例选自hl-60、hela、ht1080、hct116、hek293、ncih460、u-87mg、aspc-1、pl-45、hpaf-2、pc-3、mda-mb-231、mda-mb-468、a431、snu-1、ags、katoiii、a549、calu-6、a375、sy5y、skov3、capan-1、snf96.2、tive-l1、tive-l2、lncap细胞等。在一个更特定的方面,细胞或细胞系可以是胰腺癌细胞。
在一个方面,用于抑制或减少有此需要的患有胰腺癌的受试者体内的微管蛋白聚合和bmi-1功能的方法,包括:向如本文所述的受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物。
在特定的方面,受试者被诊断患有能够通过抑制或减少微管蛋白聚合和bmi-1功能来治疗的胰腺癌。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的微管蛋白聚合和bmi-1功能,如本文所述的用于抑制或减少微管蛋白聚合和bmi-1功能的方法将微管蛋白聚合和bmi-1功能抑制或减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、80%、85%、90%、95%或100%。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的微管蛋白聚合和bmi-1功能,如本文所述的用于抑制或减少微管蛋白聚合和bmi-1功能的方法将微管蛋白聚合和bmi-1功能抑制或减少约5%至约20%、10%至30%、15%至40%、15%至50%、20%至30%、20%至40%、20%至50%、30%至60%、30%至70%、30%至80%、30%至90%、30%至95%、30%至99%、或约40%至约100%或其间的任何范围。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的体外或体内增殖细胞或细胞系群,如本文所述的用于抑制或减少微管蛋白聚合和bmi-1功能的方法使体外或体内增殖细胞或细胞系群的增殖抑制或使其减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、80%、85%、90%、95%或100%。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的体外或体内增殖细胞或细胞系群,如本文所述的用于抑制或减少微管蛋白聚合和bmi-1功能的方法使体外或体内增殖细胞或细胞系群增殖的抑制或使其减少约5%至约20%、10%至30%、15%至40%、15%至50%、20%至30%、20%至40%、20%至50%、30%至60%、30%至70%、30%至80%、30%至90%、30%至95%、30%至99%、或约40%至约100%或其间的任何范围。
在各个方面,通过本领域公知的方法(例如,elisa)评估,如本文所述的用于抑制或减少微管蛋白聚合和bmi-1功能的方法降低了受试者体内bmi-1的血浆浓度。
在一个方面,本文描述了用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,包括施用有效抑制或减少受试者体内的微管蛋白聚合和bmi-1功能的量的化合物1。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的微管蛋白聚合和bmi-1功能,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法将微管蛋白聚合和bmi-1功能抑制或减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、80%、85%、90%、95%或100%。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的微管蛋白聚合和bmi-1功能,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法将微管蛋白聚合和bmi-1功能抑制或减少约5%至约20%、10%至30%、15%至40%、15%至50%、20%至30%、20%至40%、20%至50%、30%至60%、30%至70%、30%至80%、30%至90%、30%至95%、30%至99%、或约40%至约100%或其间的任何范围。
在各个方面,通过本领域公知的方法(例如,elisa)评估,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法降低了受试者体内的bmi-1浓度。
在一个方面,本文描述了用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,包括施用有效抑制受试者中的增殖或减少体外或体内增殖细胞或细胞系群的量的化合物1。
在一个特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的受试者体内的增殖或体外或体内增殖细胞或细胞系群,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法在受试者体内抑制了增殖或减少了体外或体内增殖细胞或细胞系群约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、80%、85%、90%、95%或100%。
在特定的方面,通过本领域公知的方法评估,相对于在向受试者施用化合物1之前的受试者体内的增殖或体外或体内增殖细胞或细胞系群,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法在受试者体内抑制了增殖或减少了体外或体内增殖细胞或细胞系群约5%至约20%、10%至30%、15%至40%、15%至50%、20%至30%、20%至40%、20%至50%、30%至60%、30%至70%、30%至80%、30%至90%、30%至95%、30%至99%、或约40%至约100%或其间的任何范围。
在各个方面,通过本领域公知的方法(例如,elisa)评估,如本文所述的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法在受试者体内抑制了增殖或减少了体外或体内增殖细胞或细胞系群。
在一个方面,本文描述了用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,包括向有此需要的受试者组合施用有效抑制受试者体内的增殖或减少体外或体内增殖细胞或细胞系群的量的化合物1和另一种疗法(例如,不包括化合物1或者包括不同的抗增殖药剂的一种或多种额外疗法)。
这些方法可以包括:在施用额外治疗之前、同时或之后施用化合物1。在某些方面,这些方法具有额外的或协同的效果。
在特定的方面,本文提供了用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,包括向有此需要的受试者施用有效量的化合物1和有效量的另一种疗法。
在根据本文提供的方法中,可以预防、治疗或改善的癌症的具体实例包括但不限于胰腺癌,比如但不限于胰腺导管腺癌。
在某些方面,根据本文提供的方法,可以预防、治疗或改善的胰腺癌选自胰腺导管腺癌。
在一个方面,本文提供了用于预防、治疗或改善胰腺癌的方法,包括:(a)向有此需要的受试者施用一个或多个剂量的化合物1或其药学上可接受的盐或药物组合物或其药物组合物;以及(b)在步骤(a)之前和/或之后监测某些生物标志物的浓度。
在特定的方面,在一定数量的剂量(例如,1、2、4、6、8、10、12、14、15、29或更多个剂量;2至4、2至8、2至20或2至30个剂量)或施用化合物1或其药学上可接受的盐或药物组合物的某段时间(例如,1、2、3、4、5、6或7天;或1、2、3、4、5、10、15、20、30、40、45、48或50周)之前和/或之后进行监测步骤(b)。
在特定的方面,在向受试者施用化合物1或其药学上可接受的盐或药物组合物之前,检测这些监测参数中的一个或多个。
在特定的方面,在施用化合物1或其药学上可接受的盐或药物组合物之后,体外或体内增殖细胞或细胞系群增殖的减少表明,治疗过程对于预防、治疗或改善胰腺癌是有效的。
在特定的方面,在施用化合物1或其药学上可接受的盐或药物组合物之后,体外或体内增殖细胞或细胞系群增殖的改变可能表明,可以调节(例如,增加、减少或保持)化合物1或其药学上可接受的盐或药物组合物的施用剂量、频率和/或时长。
在特定的方面,在包括向受试者施用化合物1或其药学上可接受的盐或药物组合物的胰腺癌治疗过程之前、期间和/或之后,监测受试者的生物标本中某些生物标志物的浓度。
向受试者施用化合物1或其药学上可接受的盐或药物组合物的剂量、频率和/或时长可以根据体外或体内增殖细胞或细胞系群的增殖来改变。可选地,这些监测参数(例如,某些生物标志物的浓度)的变化可能表明,包括施用化合物1或其药学上可接受的盐或药物组合物的治疗过程在预防、治疗或改善胰腺癌方面是有效的。
受试者的某些生物标志物的浓度可以通过本领域技术人员已知的任何技术来检测。在某些方面,用于检测受试者的某些生物标志物的浓度的方法包括:从受试者获得生物样本(例如,组织或流体样本),并检测该生物样本(例如,来自血浆、血清、尿液或任何其他生物流体)中生物标志物的浓度,该生物样本已经经过某些类型的处理(例如,离心),并通过采用免疫学技术(比如,elisa)进行检测。
在特定的方面,如本文所述,elisa测定可以用于检测已经进行了某些类型的处理(例如,离心)的生物样本(例如,来自血浆、血清、尿液或任何其他生物流体)中的生物标志物的浓度。本领域已知的可用于检测生物样本中的生物标志物浓度的其他技术包括多重或蛋白质组测定。
在特定的方面,本文提供的用于预防、治疗或改善胰腺癌的方法减轻或控制了与胰腺癌相关的一种、两种或多种症状。缓解或控制胰腺癌的一种、两种或多种症状可以用作化合物1或其药学上可接受的盐或药物组合物用于预防、治疗或改善胰腺癌的疗效的临床终点。在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法减少了与胰腺癌相关的一种或多种症状的持续时间和/或严重性。在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法抑制了与胰腺癌相关的一种或多种症状的发作、进展和/或复发。在一些方面,本文提供的用于治疗胰腺癌的方法减少了与胰腺癌相关的症状的数量。
在某些方面,本文提供的用于预防、治疗或改善胰腺癌的方法延长或延迟了细胞周期的g1/s期或晚g1/s期(即,在晚检查点(静止期或dna合成前期)和早dna合成期之间的时期)。在其他方面,本文提供的用于预防、治疗或改善胰腺癌的方法延长或延迟了细胞周期的s期或g2/m期(即,在dna合成和早分裂期之间的时期)。
在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法降低、改善或减轻了胰腺癌和/或其一种或多种症状的严重性。在其他方面,本文提供的用于预防、治疗或改善胰腺癌的方法减少了被诊断患有胰腺癌的受试者的住院治疗(例如,住院治疗的频率或持续时间)。
在某些方面,本文提供的方法提高了被诊断患有胰腺癌的受试者的存活率。在特定的方面,本文提供的方法将被诊断患有胰腺癌的受试者的存活率提高了约6个月或以上、约7个月或以上、约8个月或以上、约9个月或以上或约12个月或以上。
在特定的方面,本文提供的用于预防、治疗或改善胰腺癌的方法抑制或减少了胰腺癌的进展或与其相关的一种或多种症状。在特定的方面,本文提供的用于预防、治疗或改善胰腺癌的方法增强或提高了另一种疗法(例如,抗癌剂、放射、药物疗法(比如,化学疗法)、抗雄性激素疗法或手术)的治疗效果。在某些方面,本文提供的用于预防、治疗或改善胰腺癌的方法包括使用化合物1或其药学上可接受的盐或药物组合物作为辅助疗法。
在特定的方面,本文提供的用于预防、治疗或改善胰腺癌的方法降低了被诊断患有胰腺癌的受试者的死亡率。在某些方面,本文提供的用于预防、治疗或改善胰腺癌的方法增加了缓解期的受试者的数量或降低了住院率。在其他方面,本文提供的用于预防、治疗或改善胰腺癌的方法预防了与胰腺癌相关的一种或多种症状的发展、发作或进展。
在特定的方面,本文提供的用于预防、治疗或改善胰腺癌的方法提高了胰腺癌受试者的无症状存活率。在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法不能治愈受试者的胰腺癌,但能预防疾病的进展或恶化。在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法提高了受试者的生活质量。
在某些方面,本文提供的用于预防、治疗或改善胰腺癌的方法提高了被诊断患有癌症的受试者的无癌存活率。在一些方面,本文提供的用于预防、治疗或改善胰腺癌的方法提高了无复发存活率。在某些方面,本文提供的用于预防、治疗或改善胰腺癌的方法增加了缓解期的受试者的数量。在其他方面,本文提供的用于预防、治疗或改善胰腺癌的方法增加了受试者的缓解时长。
治疗人群
在一些方面,根据本文提供的方法治疗胰腺癌的受试者是患有或被诊断患有胰腺癌的人。在其他方面,根据本文提供的方法治疗胰腺癌的受试者是易患胰腺癌或易受患胰腺癌影响的人。在一些方面,根据本文提供的方法治疗胰腺癌的受试者是有患胰腺癌风险的人。
在一个方面,根据本文提供的方法治疗胰腺癌的受试者是人类婴儿。在另一个方面,根据本文提供的方法治疗胰腺癌的受试者是人类幼儿。在另一个方面,根据本文提供的方法治疗胰腺癌的受试者是人类儿童。在另一个方面,根据本文提供的方法治疗胰腺癌的受试者是人类成人。在另一个方面,根据本文提供的方法治疗胰腺癌的受试者是中年人。在另一个方面,根据本文提供的方法治疗胰腺癌的受试者是老年人。
在某些方面,根据本文提供的方法治疗癌症的受试者的胰腺癌已经转移到身体的其他区域,比如:骨、肺和肝。在某些方面,根据本文提供的方法治疗胰腺癌的受试者处于胰腺癌的缓解期。在一些方面,根据本文提供的方法治疗胰腺癌的受试者的胰腺癌复发。在某些方面,根据本文提供的方法治疗的受试者正在经历与胰腺癌相关的一种或多种症状的复发。
在某些方面,根据本文提供的方法治疗胰腺癌的受试者是约1至约5岁、约5至约10岁、约10至约18岁、约18至约30岁、约25至约35岁、约35至约45岁、约40至约55岁、约50至约65岁、约60至约75岁、约70至约85岁、约80至约90岁、约90至约95岁、约95至约100岁或其间的任何年龄的人。
在特定的方面,根据本文提供的方法治疗胰腺癌的受试者是18岁或以上的人。在特定的方面,根据本文提供的方法治疗胰腺癌的受试者是1岁至18岁的人类儿童。在某个方面,根据本文提供的方法治疗胰腺癌的受试者是12岁至18岁的人。在某个方面,受试者是男人。在另一个方面,受试者是女人。在一个方面,受试者是未怀孕或未哺乳的女人。在一个方面,受试者是已怀孕、将要/可能要怀孕或正在哺乳的女人。
在特定的方面,根据本文提供的方法治疗胰腺癌的受试者是处于免疫系统受损状态或免疫系统受抑制状态的人。在某些方面,根据本文提供的方法治疗胰腺癌的受试者是接受免疫抑制疗法或从免疫抑制疗法中恢复的人。在某些方面,根据本文提供的方法治疗胰腺癌的受试者是患有胰腺癌或有患胰腺癌风险的人。在某些方面,根据本文提供的方法治疗胰腺癌的受试者是正在、将要或已经接受手术或药物疗法(比如,化学疗法)激素疗法和/或放射疗法的人。
在一些方面,在对除化合物1之外的疗法产生任何副作用或不耐性之前,向根据本文提供的方法治疗胰腺癌的受试者施用化合物1或其药学上可接受的盐或药物组合物或组合疗法。在一些方面,根据本文提供的方法治疗胰腺癌的受试者是难治的受试者。在某些方面,难治的受试者是标准疗法(例如,手术、放射和/或药物疗法(比如,化学疗法))难以治疗的受试者。在某些方面,当胰腺癌还没有被显著根除和/或一种或多种症状还没有被显著缓解时,疗法难以治疗患有胰腺癌的受试者。可以通过本领域已知的任何用于测定胰腺癌治疗有效性的方法来在体内或体外确定受试者是否是难治疗的,在这种情况下采用本领域认可的“难治疗”的含义。
在一些方面,根据本文提供的方法治疗胰腺癌的受试者是已证明除采用化合物1或其药学上可接受的盐或药物组合物的治疗之外的疗法难以治疗但已不在接受这些疗法的人。在某些方面,根据本文提供的方法治疗胰腺癌的受试者是已经接受一种或多种常规抗癌疗法(比如,手术、药物疗法(比如,化学疗法)、抗雄性激素疗法或放射)的人。这些受试者包括难治的受试者、年纪太小而无法接受常规疗法的受试者和已采用现有疗法治疗过但胰腺癌复发的受试者。
在一些方面,根据本文提供的方法治疗胰腺癌的受试者是易对常规疗法产生不良反应的人。在一些方面,根据本文提供的方法治疗胰腺癌的受试者是在施用化合物1或其药学上可接受的盐或药物组合物之前未接受疗法(例如,药物疗法(比如,化学疗法)、手术、抗雄性激素疗法或放射疗法)的人。在其他方面,根据本文提供的方法治疗胰腺癌的受试者是在施用化合物1或其药学上可接受的盐或药物组合物之前已接受疗法的人。在一些方面,根据本文提供的方法治疗胰腺癌的受试者是经历了先前疗法的副作用或先前疗法由于人无法接受的毒性水平而中断的人。
剂量与施用
根据本文提供的用于预防、治疗或改善胰腺癌的方法,可以通过各种途径以产生有益或治疗效果的量向有此需要的受试者施用化合物1或其药学上可接受的盐或药物组合物。根据本文提供的用于预防、治疗或改善胰腺癌的方法,可以向有此需要的受试者口服施用化合物1或其药学上可接受的盐或药物组合物。口服施用化合物1或其药学上可接受的盐或药物组合物可以有助于需要这种治疗的受试者遵守服用化合物1或其药学上可接受的盐或药物组合物的治疗方案。因此,在特定的方面,向有此需要的受试者口服施用化合物1或其药学上可接受的盐或药物组合物。在另一个方面,本文提供的化合物1或其药学上可接受的盐或药物组合物可以与食物或水一起口服施用或不与食物或水一起口服施用。
其他的施用途径包括但不限于静脉内、真皮内、鞘内、肌内、皮下、鼻内、吸入、经皮、经局部、经粘膜、颅内、硬膜外和滑膜内。在一个方面,以全身方式(例如,肠胃外)向有此需要的受试者施用化合物1或其药学上可接受的盐或药物组合物。在一个方面,化合物1或其药学上可接受的盐或药物组合物通过允许化合物1或其药学上可接受的盐或药物组合物穿过血脑屏障的途径(例如,口服)施用。
根据本文提供的包括组合施用化合物1或其药学上可接受的盐或药物组合物与一种或多种额外疗法的用于预防、治疗或改善胰腺癌的方法,可以通过相同或不同的施用途径施用化合物1或其药学上可接受的盐或药物组合物和一种或多种额外疗法。
根据本文提供的用于预防、治疗或改善胰腺癌的方法,向有此需要的受试者施用化合物1或其药学上可接受的盐或药物组合物的施用剂量和频率将是有效的,同时将任何副作用降到最低。化合物1或其药学上可接受的盐或药物组合物的确切施用剂量和频率可以由医生根据与需要治疗的受试者相关的因素来确定。
可以考虑的因素包括疾病状态的严重性、受试者的总体健康状况、受试者的年龄、体重和性别、饮食、施用的时间和频率、药物组合、反应敏感度和对治疗的耐受性/反应。化合物1或其药学上可接受的盐或药物组合物的施用剂量和频率可以随时间调整,以提供有效量的化合物1或其药学上可接受的盐或药物组合物,以维持所需的效果。
如本文所述,本文提出的用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括:向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物,其中该有效量为在不同的日期每周两次向受试者施用的剂量,其中一周中的第二次剂量在施用第一次剂量三天之后施用,并且其中下一周中的第一次剂量在施用前一周中的第二次剂量四天之后施用。
在特定的方面,有效量是施用至受试者的剂量,该剂量可以根据受试者的反应来增加或减少。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物,其中该有效量为选自约50mg至约200mg、约100mg至约200mg、约150mg至约200mg等范围或其间的任何范围的剂量,每周口服施用两次。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物,其中该有效量为选自约50mg、约100mg、约150mg、约200mg等或其间的任何范围的剂量,每周口服施用两次。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药学上可接受的盐或药物组合物,其中该有效量为约50mg的剂量,每周口服施用两次。
在一些方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为以每平方米毫克(mg/m2)表示的剂量。例如,可以通过将动物的换算因子乘以以每千克毫克(mg/kg)计的动物剂量来确定化合物1的剂量(mg/m2),以获得人类剂量当量的以mg/m2计的剂量。出于监管目的,可以使用以下换算因子:小鼠=3,仓鼠=4.1,大鼠=6,豚鼠=7.7。(根据freireichetal.,cancerchemother.rep.50(4):219-244(1966))。人的身高和体重可以用于应用博伊德的体表面积公式(boyd'sformulaofbodysurfacearea)计算人体表面积。在特定方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在约0.1mg/m2至约1000mg/m2的范围或其间的任何范围内的量。
在一个方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在患有胰腺癌的受试者或具有预先建立的胰腺癌的动物模型中达到化合物1的目标平均血浆浓度的剂量。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在24小时的时间段内在患有胰腺癌的受试者或具有预先建立的胰腺癌的动物模型中达到在约3h·μg/ml至约70h·μg/ml、约3h·μg/ml至约60h·μg/ml、约3h·μg/ml至约50h·μg/ml、约3h·μg/ml至约40h·μg/ml、约3h·μg/ml至约30h·μg/ml、约3h·μg/ml至约20h·μg/ml、约3h·μg/ml至约10h.μg/ml等范围或其间的任何范围内的化合物1的平均血浆浓度的剂量。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在24小时的时间段内在患有胰腺癌的受试者或具有预先建立的胰腺癌的动物模型中达到约3h·μg/ml、约10h·μg/ml、约20h·μg/ml、约30h·μg/ml、约40h·μg/ml、约50h·μg/ml、约60h·μg/ml、约70h·μg/ml等或其间的任何范围的化合物1的平均血浆浓度的剂量。
为了达到这些血浆浓度,可以施用本文所述剂量的化合物1或其药物组合物。在某些方面,可以基于向受试者施用一定剂量的化合物1或其药物组合物所获得的化合物1的平均血浆浓度来相应调整化合物1或其药物组合物的后续剂量。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在患有胰腺癌的受试者或具有预先建立的胰腺癌的动物模型中实现一种或多种生物标志物的降低的目标平均血浆浓度的剂量。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中该有效量为在患有胰腺癌的受试者或具有预先建立的胰腺癌的动物模型中达到化合物1或其药物组合物的所需组织与平均血浆浓度比率的剂量,该比率例如通过本领域已知的任何成像技术来确定。
在一些方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括向受试者施用有效量的化合物1或其药物组合物,其中对于每个剂量来说,该有效量可以是相同的或不同的。在特定的方面,在第一时间段向有此需要的受试者施用第一(即,初始)剂量的化合物1或其药物组合物,随后在第二时间段向该受试者施用第二(即,负荷(loading))剂量的化合物1或其药物组合物,接着在第二时间段向该受试者施用第三(即,维持)剂量的化合物1或其药物组合物。该第一剂量可以大于该第二剂量,或者该第一剂量可以小于该第二剂量。以类似的方式,化合物1或其药物组合物的第三剂量可以大于或小于第二剂量且大于或小于第一剂量。
在一些方面,本文所述的剂量指的是施用的总量;即,如果施用一种以上的化合物,则在某些方面,剂量对应于施用的总量。在特定的方面,口服组合物含有约5wt%至约95wt%的化合物1。
根据用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,向有此需要的受试者施用化合物1或其药物组合物的时长将是根据无癌症存活或无症状确定的时间段。在某些方面,本文提出的用于治疗胰腺癌的方法包括施用化合物1或其药物组合物一段时间,直到与胰腺癌相关的一种或多种症状的严重性和/或数量降低。
在一些方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括施用化合物1或其药物组合物至多48周。在其他方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括施用化合物1或其药物组合物至多4周、8周、12周、16周、20周、24周、26周(0.5年)、52周(1年)、78周(1.5年)、104周(2年)、130周(2.5年)或更长时间。
在某些方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括施用化合物1或其药物组合物一段不确定的时间。在一些方面,本文提出的用于治疗胰腺癌的方法包括施用化合物1或其药物组合物一段时间,随后在恢复施用化合物1或其药物组合物之前停止一段时间(即,其中不施用化合物1或其药物组合物的时间段)。
在特定的方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括:在多个周期(例如,1周的周期、2周的周期、3周的周期、4周的周期、5周的周期、6周的周期、8周的周期、9周的周期、10周的周期、11周的周期或12周的周期)内施用化合物1或其药物组合物。在这些周期内,可以每周施用一次或两次化合物1或其药物组合物。在一个按周计的周期的特定方面,可以每周施用两次化合物1或其药物组合物。在这种按周计的周期的特定方面,可以每天施用一次化合物1或其药物组合物。
在特定的方面,施用化合物1或其药物组合物的时间段可以根据一个或多个监测参数(例如,某些生物标志物的浓度)来决定。
在特定的方面,施用化合物1或其药物组合物的时间段可以根据一个或多个监测参数(例如,生物标志物的浓度)来调整。
在某些方面,根据用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,在用餐(例如,早餐、午餐或晚餐)之前、同时或之后,向有此需要的受试者施用化合物1或其药物组合物。在特定方面,根据本文提出的用于治疗胰腺癌的方法,在早上(例如,上午5点至下午12点)向有此需要的受试者施用化合物1或其药物组合物。
在某些方面,根据用于预防、治疗或改善有此需要的受试者的胰腺癌的方法,在中午(即,下午12点)向有此需要的受试者施用化合物1或其药物组合物。在特定方面,根据本文提出的用于治疗胰腺癌的方法,在下午(例如,在下午12点和下午5点之间)、晚上(例如,在下午5点和就寝时间之间)和/或就寝时间之前向有此需要的受试者施用化合物1或其药物组合物。
在特定的方面,每天一次和每周两次向受试者施用一定剂量的化合物1或其药物组合物。
组合疗法
本文提出了用于治疗胰腺癌的组合疗法,包括向有此需要的受试者组合施用化合物1或其药物组合物和一种或多种额外疗法。在特定的方面,本文提出了用于治疗胰腺癌的组合疗法,包括向有此需要的受试者组合施用有效量的化合物1或其药物组合物和有效量的另一种疗法。
如本文所用在施用化合物1或其药物组合物的情况下,术语“组合”指的是在施用用于治疗胰腺癌的一种或多种额外疗法(例如,药剂、手术或放射)之前、同时或之后施用化合物1或其药物组合物。术语“组合”的使用并不限制向受试者施用一种或多种治疗剂和一种或多种额外疗法的顺序。在特定的方面,施用化合物1或其药物组合物与施用一种或多种额外疗法之间的时间间隔可以是约1-5分钟、1-30分钟、30至60分钟、1小时、1-2小时、2-6小时、2-12小时、12-24小时、1-2天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、5周、6周、7周,8周、9周、10周、15周、20周、26周、52周、11-15周、15-20周、20-30周、30-40周、40-50周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年或其间的任何时间段。在某些方面,化合物1或其药物组合物和一种或多种额外疗法的施用间隔小于1天、1周、2周、3周、4周、1个月、2个月、3个月、6个月、1年、2年或5年。
在一些方面,本文提供的组合疗法包括每天施用化合物1或其药物组合物,并且每周一次、每2周一次、每3周一次、每4周一次、每月一次、每2个月一次(例如,约8周)、每3个月一次(例如,约12周)或每4个月一次(例如,约16周)施用一种或多种额外疗法。在某些方面,周期性地向受试者施用化合物1或其药物组合物和一种或多种额外疗法。循环疗法包括在一段时间内施用化合物1或其药物组合物,随后在一段时间内施用一种或多种额外疗法,并重复这种顺序施用。在某些方面,循环疗法还可以包括一段停止时间,其间在一段时间(例如,2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、5周、10周、20周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、2年或3年)内不施用化合物1或其药物组合物或额外疗法。在一方面,施用的周期数为1至12个周期、2至10个周期或2至8个周期。
在一些方面,用于预防、治疗或改善有此需要的受试者的胰腺癌的方法包括在组合施用化合物1或其药物组合物与额外疗法之前,将化合物1或其药物组合物作为单一药剂施用一段时间。在某些方面,本文提供的用于治疗胰腺癌的方法包括在组合施用化合物1或其药物组合物与额外疗法之前,单独施用额外疗法一段时间。
在一些方面,相对于单独施用化合物1或其药物组合物或所述一种或多种额外疗法,根据本文提出的方法施用化合物1或其药物组合物和一种或多种额外疗法具有叠加效果。在一些方面,相对于单独施用化合物1或其药物组合物或所述一种或多种额外疗法,根据本文提出的方法施用化合物1或其药物组合物和一种或多种额外疗法具有协同效果。
如本文所用,术语“协同”指的是组合施用化合物1或其药物组合物与一种或多种额外疗法(例如,药剂)的效果,其中组合施用比任何两种或两种以上的单一疗法(例如,药剂)的叠加效果更有效。
在特定的方面,组合疗法的协同作用允许使用较低剂量(即,次优剂量)的化合物1或其药物组合物或额外治疗和/或较少频率地向受试者施用化合物1或其药物组合物或额外疗法。
在某些方面,由于能使用较低剂量的化合物1或其药物组合物或额外疗法和/或较少频率地施用化合物1或其药物组合物或所述额外加疗法,因此分别降低了与施用化合物1或其药物组合物或所述额外疗法相关的对受试者的毒性,而又不分别降低化合物1或其药物组合物或所述额外疗法在胰腺癌治疗中的功效。
在一些方面,协同效果提高了化合物1或其药物组合物以及每种所述额外疗法在治疗胰腺癌中的功效。在一些方面,化合物1或其药物组合物与一种或多种额外疗法的组合的协同效果避免或减少了与使用任何单一疗法相关的不利或不希望的副作用。
可以在相同的药物组合物中向受试者施用化合物1或其药物组合物和一种或多种额外疗法的组合。可选地,可以在不同的药物组合物中同时向受试者施用化合物1或其药物组合物和一种或多种额外疗法。可以在不同的药物组合物中依次向受试者施用化合物1或其药物组合物和一种或多种额外疗法。也可以通过相同或不同的施用途径向受试者施用化合物1或其药物组合物以及一种或多种额外疗法。
本文提供的组合疗法包括向有此需要的受试者组合施用化合物1或其药物组合物与用于治疗胰腺癌的常规或已知疗法。针对胰腺癌或与其相关的病症的其他疗法旨在控制或缓解一种或多种症状。因此,在一些方面,本文提供的组合疗法包括向有此需要的受试者施用止痛药或者旨在减轻或控制与胰腺癌或与其相关的病症相关的一种或多种症状的其他疗法。
可以与化合物1或其药物组合物组合使用以用于治疗胰腺癌的抗癌剂的具体实例包括:激素剂(例如,芳香化酶抑制剂、选择性雌激素受体调节剂(serm)和雌激素受体拮抗剂)、化学治疗剂(例如,微管拆散阻断剂、抗代谢药、拓扑异构酶抑制剂和dna交联剂或破坏剂(damagingagent))、抗血管生成剂(例如,vegf拮抗剂、受体拮抗剂、整合蛋白拮抗剂、血管靶向剂(vta)/血管破坏剂(vda))、放射疗法和常规手术。
可以与化合物1或其药物组合物组合使用以用于治疗胰腺癌的激素剂的非限制性实例包括:芳香化酶抑制剂、serm和雌激素受体拮抗剂。作为芳香化酶抑制剂的激素剂可以是甾类的或非甾类的。非甾类激素剂的非限制性实例包括来曲唑、阿那曲唑、氨鲁米特、法倔唑和伏氯唑。甾类激素剂的非限制性实例包括阿诺新(依西美坦)、福美司坦和睾内酯。作为serm的激素剂的非限制性实例包括它莫西芬(品牌名/市售名为
可以与化合物1或其药物组合物组合使用以用于治疗癌症的化学治疗剂的非限制性实例包括微管拆分阻断剂、抗代谢药、拓扑异构酶抑制剂和dna交联剂或破坏剂。
作为微管拆散阻断剂的化学治疗剂包括但不限于紫杉烷类(taxenes)(例如,紫杉醇(品牌名/市售名为
作为抗代谢药的化学治疗剂包括但不限于叶酸类抗代谢药(例如,氨甲叶酸、氨蝶呤、培美曲塞和雷替曲塞);嘌呤类抗代谢药(例如,克拉屈滨、氯法拉滨、氟达拉滨、巯嘌呤、喷司他丁和硫鸟嘌呤);嘧啶类抗代谢药(例如,5-氟尿嘧啶、卡培他滨、吉西他滨(
作为拓扑异构酶抑制剂的化学治疗剂包括但不限于i类(喜树属(camptotheca))拓扑异构酶抑制剂(例如,拓扑替康(品牌名/市售名为
作为dna交联剂(或dna破坏剂)的化学治疗剂包括但不限于烷化剂(例如,环磷酰胺、氮芥、异环磷酰胺(品牌名/市售名为
可以与化合物1或其药物组合物组合使用以用于治疗胰腺癌的抗血管生成剂的非限制性实例包括vegf拮抗剂、受体拮抗剂、整合蛋白拮抗剂(例如,维他辛(vitaxin)、西仑吉肽和s247)和vta/vda(例如,福他布林(fosbretabulin))。vegf拮抗剂包括但不限于抗vegf抗体(例如,贝伐单抗(品牌名/市售名为
可以与化合物1或其药物组合物组合施用至受试者以用于治疗胰腺癌的其他疗法的非限制性实例包括:
(1)他汀类,比如洛伐他汀(例如,品牌名/市售名为
(2)mtor抑制剂,比如西罗莫司(也被称为雷帕霉素(例如,品牌名/市售名为
(3)法尼基转移酶抑制剂,比如替吡法尼(例如,品牌名/市售名为
(4)抗纤维化剂,比如吡非尼酮;
(5)聚乙二醇干扰素,比如peg干扰素α-2b;
(6)cns兴奋剂,比如哌醋甲酯(品牌名/市售名
(7)her-2拮抗剂,比如抗her-2抗体(例如,曲妥珠单抗)和激酶抑制剂(例如,拉帕替尼);
(8)igf-1拮抗剂,比如抗igf-1抗体(例如,ave1642和imc-a11)或igf-1激酶抑制剂;
(9)egfr/fier-1拮抗剂,比如抗egfr抗体(例如,西妥昔单抗和帕尼单抗)或egfr激酶抑制剂(例如,埃罗替尼(例如,品牌名/市售名为
(10)src拮抗剂,比如博舒替尼;
(11)细胞周期蛋白依赖性激酶(cdk)抑制剂,比如塞利西利(seliciclib);
(12)janus激酶2抑制剂,比如来他替尼;
(13)蛋白酶体抑制剂,比如硼替佐米;
(14)磷酸二酯酶抑制剂,比如阿那格雷;
(15)肌苷单磷酸脱氢酶抑制剂,比如噻唑呋林;
(16)脂肪氧合酶抑制剂,比如马索罗酚;
(17)内皮拮抗剂;
(18)类维生素a受体拮抗剂,比如维甲酸或阿利维a酸;
(19)免疫调节剂,比如来那度胺、泊马度胺或沙利度胺(例如,品牌名/市售名为
(20)激酶(例如,酪氨酸激酶)抑制剂,比如伊马替尼(例如,品牌名/市售名为
(21)非甾类抗炎药剂,比如塞来昔布(品牌名/市售名为
(22)人粒细胞集落刺激因子(g-csf),比如非格司亭(品牌名/市售名为
(23)亚叶酸或甲酰四氢叶酸钙;
(24)整合蛋白拮抗剂,比如整合蛋白α5β1拮抗剂(例如,jsm6427);
(25)核因子κβ(nf-κβ)拮抗剂,比如,ot-551,也是抗氧化剂;
(26)刺猬(hedgehog)抑制剂,比如:cur61414、环巴胺、gdc-0449或抗刺猬抗体;
(27)组蛋白去乙酰化酶(hdac)抑制剂,比如saha(也称为伏立诺他(品牌名/市售名为
(28)类维生素a,比如异维a酸(例如,品牌名/市售名为
(29)肝细胞生长因子/分散因子(hgf/sf)拮抗剂,比如hgf/sf单克隆抗体(例如:amg102);
(30)合成化学药品,比如抗瘤酮;
(31)抗糖尿病药,比如马来酸罗格列酮(rosiglitazonemaleate)(例如,品牌名/市售名为
(32)抗疟药和杀阿米巴药,比如氯喹(例如,品牌名/市售名为
(33)合成缓激肽,比如rmp-7;
(34)血小板衍生生长因子受体抑制剂,比如su-101;
(35)flk-1/kdr/vegfr2、fgfr1和pdgfrβ的受体酪氨酸激酶抑制剂,比如su5416和su6668;
(36)抗炎剂,比如柳氮磺胺吡啶(例如,品牌名/市售名为
(37)tgf-β反义疗法。
可以与化合物1或其药物组合物组合施用至受试者以用于治疗胰腺癌的其他疗法的非限制性实例包括:天然促性腺激素释放激素的的合成九肽类似物(比如,醋酸亮丙瑞林(品牌名/市售名为
可以与化合物1或其药物组合物组合使用以用于治疗胰腺癌的疗法的其他特定实例包括但不限于与癌症免疫疗法相关的试剂(例如,细胞因子、白介素和癌症疫苗)。
可以与化合物1或其药物组合物组合用作疗法的缓解与胰腺癌相关的副作用的药剂的具体实例包括但不限于:止吐剂(例如,盐酸昂丹司琼(品牌名/市售名为
在某些方面,本文提供的用于治疗胰腺癌的组合疗法包括组合施用化合物1或其药物组合物与一种或多种用于治疗和/或控制副作用的药剂,该副作用为,比如,出血(通常为短暂的轻度鼻出血)、动脉和静脉血栓形成、高血压、伤口愈合延迟、无症状性蛋白尿、鼻中隔穿孔、与高血压相关的可逆性后部白质脑病综合征、轻度头痛、共济失调、头痛、声音嘶哑、恶心、呕吐、腹泻、皮疹、指甲下出血、骨髓增生异常综合征、骨髓抑制、疲劳、甲状腺功能减退、qt间期延长或心力衰竭。
在某些方面,化合物1或其药物组合物不与主要由cyp2d6代谢的药物(比如,抗抑郁药(例如,三环抗抑郁药、选择性血清素再摄取抑制剂等)、抗精神病药、β-肾上腺素能受体阻断剂或某些类型的抗心律失常药)组合施用来治疗胰腺癌。
药物盒(kits)
本文提供了一种药物包或药物盒,包括一个或多个填充有化合物1或其药物组合物的容器。此外,用于治疗胰腺癌的一种或多种其他疗法或其他相关药剂也可以包含在该药物包或药物盒中。本文还提供了一种药物包或药物盒,包括一个或多个填充有本文所述的药物组合物的一种或多种成分的容器。可选地,药物盒还可以附有由监管药物或生物产品的制造、使用或销售的政府机构规定的形式的公告,该公告反映了该机构对针对人类用药的制造、使用或销售的批准。
不管本文所引用的文件是否明确地且单独地指明为通过引用并入,出于任何和所有目的,本文所引用的所有文件都通过引用并入到本申请中,并入程度如同每一个参考文献都在本文中被完全阐述一样。
现在已经完全描述了权利要求书的主题后,本领域的普通技术人员将会理解的是,在不影响本文所述的主题或方面的范围的情况下,可以在广泛的等同物范围内执行相同的操作。旨在于将所附权利要求书理解为包括所有这些等同物。
实施例
以下实施例旨在说明本发明的各种方法,但绝非限制本发明的范围。
在以下实施例中采用的材料和方法可以从商业来源获得或者通过本领域的技术人员已知的方法根据已知的程序或在所示参考文献中描述的程序而获得。
根据国际公布号wo2014/081906中描述的程序制备化合物1。
化合物2指的是6-(5,6-二氟-2-甲基-1h-苯并[d]咪唑-1-基)-n-(4-(三氟甲基)苯基)吡嗪-2-胺,一种已知的bmi-1功能抑制剂,根据国际公布号wo2015/076800中描述的程序制备。
细胞系、细胞培养和活力测定
经鉴定的人类细胞系购自atcc,在最初购买的30次累积传代内使用。产生鼠kpc系并在30次累积传代内使用。j1002细胞由kpbbr小鼠产生,并在15次累积传代内使用。在整个实验期间,使用mycoalert支原体检测试剂盒(lonza;lt07-318)对所有细胞系持续进行的支原体检测均为阴性。在标准条件下,在37℃和5%co2下维持细胞,并且在增补有青霉素和链霉素(corning,30-003-ci)和10%fbs(生命技术公司(lifetechnologies),10438-034)的dmem(生命技术公司,12430-054)中生长。
对于增殖曲线,将细胞平铺在96孔板(corning,3603)中,并使其接种整夜。由于活力测量是一个终点程序,因此在每个时间点对重复板进行平铺。第二天,用指定浓度的化合物处理细胞,并用最高使用浓度(始终低于0.003%)的dmso处理。将细胞处理96小时,并且每24小时用阿尔玛蓝(alamarblue)试剂(biorad,buf012b)测定活力。简而言之,向每个孔(100μl)加入10μl的阿尔玛蓝,短暂混合,并让其在37℃和5%co2下孵育4小时。孵育后,在promega多模式微板读取仪(microplatereader)上测量荧光。为了进行分析,从原始结果中减去背景水平,然后将其归一化,表示为与第0天经dmso处理的细胞相比的倍数变化。每次实验每个治疗组的所有测定均以至少一式三份进行4至8次技术重复。(图1a和图10b)
对于剂量反应曲线,将细胞平铺在96孔板(corning,3603)中,并使其接种整夜。第二天,用化合物1处理细胞。剂量反应曲线从10μm开始,以3倍的增量减少,并以最高使用浓度(始终低于0.03%)的dmso结束。将细胞处理72小时,然后用阿尔玛蓝试剂(biorad,buf012b)测定活力。简而言之,向每个孔(100μl)加入10μl的阿尔玛蓝,短暂混合,并让其在37℃和5%co2下孵育4小时。孵育后,在promega多模式微板读取仪上测量荧光。为了进行分析,从原始结果中减去背景水平,然后将其归一化,表示为经dmso处理的细胞的百分比。每次实验的所有测定均以至少一式三份中进行4至8次技术重复。(图10c)
细胞周期分析
将细胞接种到12孔或6孔板中,使得16小时后,其将铺满约30%至50%。然后用dmso(低于0.003%)、化合物1(100nm或1μm)或100nm诺考达唑(sigma,m1404)处理细胞24小时。处理后,收获细胞并将其固定在冰冷的70%乙醇中至少1小时。固定后,将细胞重悬在pbs+2%fbs+3μmdapi(biolegend,422801)或0.25μg7-aad(bdpharmingen,559925)中,并在
细胞内蛋白质的流式细胞术
对于磷酸化组蛋白h3(ph3)染色,将细胞固定并根据制造商的说明书使用ebiosciencefoxp3/转录因子染色缓冲液组(thermofisher,00-5523-00)进行透化。采用fcblock(bdbiosciences,564220)来封闭细胞,并采用ph3(ser10)抗体(biolegend,650805)以每百万个细胞5ul的量对细胞进行染色(45分钟,室温,避光)。在bdfortessatm上分析样本,并通过flowjo软件分析样本。(图1d以及图3a)
对于活性半胱天冬酶-3(actcasp3)染色,根据制造商的说明书使用半胱天冬酶3(活性)fitc染色试剂盒(abcam,ab65613)。将细胞接种到12孔中,使得约16小时后,其将铺满约50%至60%。然后用指定浓度的药物或dmso媒介物处理细胞24小时,此时收获细胞,用fitc-devd-fmk染色(1μl/样品,1小时,室温,避光),洗涤,然后采用dapi染色,以进行分析。在bdlsriitm上分析样本,并通过flowjo软件分析样本。(图3a和图3b)
蛋白质印迹
对从处理后的细胞分离的裂解物进行蛋白质印迹。使用增补有completetm不含edta的蛋白酶抑制剂混合物(sigma,11836170001)和halttm磷酸酶抑制剂混合物(thermofisher,78420)的ripa缓冲液(50mmtris,ph7.4,150mmnacl,1%nonidetp-40,0.1%sds,0.5%脱氧胆酸盐)裂解细胞。使用piercebca蛋白分析试剂盒(thermofisher,23227)对裂解物进行定量,在sds样本缓冲液稀释,通过sds-page(15-30μg/样本)进行解析,然后转移到pvdf膜上。在tbs-t(0.1%吐温20)中用5%w/v脱脂奶粉封闭膜,并将一级抗体在4℃下培养过夜,在指定浓度的tbs-t中用5%bsa稀释。在采用superdigital-ecltm底物溶液(kindlebiosciences,r1002)进行检测之前,在室温下将hrp缀合的二级抗体在封闭缓冲液中孵育1小时。(图5b,图10a和图11b)
蛋白质印迹抗体:
bmi1:细胞信号传导,#5856,1:1000
黏着斑蛋白:细胞信号传导,#4650s,1:1000
β-微管蛋白:细胞信号传导,#2146s,1:1000。
p-糖蛋白底物活性实验
mdckii-mdr1和mdckii-wt细胞购自荷兰癌症研究所(netherlandscancerinstitute),nki-avl。在增补有10%fbs和1%penn-strep的杜伯克氏(dulbecco’s)改良必需培养基(dmem)中培养细胞,且第3至第9代之间使用。将细胞以3×103个细胞/孔的密度接种在96孔组织培养处理板中。让细胞附着4小时后,在存在或不存在p-糖蛋白抑制剂valspodar的情况下,用试验化合物处理细胞。将孔板在37℃和5%co2下培养72小时,并使用
rna测序
对每个样本约1.75μg的总rna进行多-a(poly-a)下拉以进行mrna富集,然后将其用作illuminatruseqrna制备试剂盒的输入。使用beckmann-coulterroboter和spriworks片段文库试剂盒i为illuminahiseq4000平台制备样本。使用kapapcr扩增试剂盒进行pcr。然后,哥伦比亚基因组中心(columbiagenomecenter)对文库进行测序,以产生3000万个长度为100bp的单端读段。(图11a)。
rna-seq分析
使用star比对器(2.4.2版)将读段映射至人类参考基因组(ncbi/build37.2)(dobina,davisca,schlesingerf,etal.star:ultrafastuniversalrna-seqaligner,bioinformatics2013;29:15-21),并使用r包‘基因组比对(genomicalignments)’的summarizeoverlaps函数(lawrencem,huberw,pagesh,etal.softwareforcomputingandannotatinggenomicranges,ploscomputationalbiology2013;9:e1003118)以及r包txdb.hsapiens.ucsc.hg19.knowngene’的基因注释的信息(carlsonm,maintainerbp.txdb.hsapiens.ucsc.hg19.knowngene:annotationpackagefortxdbobject(s).2015)在基因水平上进行定量。将rna-seq数据存入geo(id:gse118441)。(图11a)
差异基因表达(deg)
使用执行r包‘limma’的voom-limma框架进行指定条件之间的差异基因表达分析(ritchieme,phipsonb,wud,etal.limmapowersdifferentialexpressionanalysesforrna-sequencingandmicroarraystudies,nucleicacidsresearch2015;43:e47)。采用同时考虑了治疗和时间点的多变量设计来评估相较于dmso的化合物1治疗的总体效果。
基因集富集
采用带有默认参数的单个样本gsea:基因集变异分析的r执行(hanzelmanns,castelor,guinneyj.gsva:genesetvariationanalysisformicroarrayandrna-seqdata,bmcbioinformatics2013;14:7)。对来自rna测序的原始计数进行归一化,以说明不同的文库大小,并且通过将离差拟合至deseq2r包中所执行的负二项分布来稳定方差(loveml,huberw,anderss.moderatedestimationoffoldchangeanddispersionforrna-seqdatawithdeseq2,genomebiol2014;15:550)。从msigdbv6.0模块hallmark、c2经典路途和c6致癌印迹(signatures)检索基因集(subramaniana,tamayop,moothavk,etal.genesetenrichmentanalysis:aknowledge-basedapproachforinterpretinggenome-wideexpressionprofiles,procnatlacadsciusa2005;102:15545-50andliberzona,subramaniana,pinchbackr,etal.molecularsignaturesdatabase(msigdb)3.0,bioinformatics2011;27:1739-40)。采用limmar包对dmso和化合物1治疗之间的这些基因集进行差异富集分析(ritchieme,phipsonb,wud,etal.limmapowersdifferentialexpressionanalysesforrna-sequencingandmicroarraystudies,nucleicacidsres2015;43:e47),并且错误发现率(fdr)<0.1则视为显著。采用pheatmapr包将所选路径的单个样本富集结果描绘在热图中(http://cranr-projectorg/package=pheatmaprpackageversion2017;1:2)。(图11a)。
基因集印迹:
无细胞微管蛋白聚合测定
根据制造商的建议,采用来自cytoskeleton的基于荧光的微管蛋白聚合测定试剂盒(#bk011p)进行测定,该试剂盒使用纯度高于99%的来自猪脑的微管蛋白。将所用的所有药物溶于dmso中,然后用超纯水稀释至10x最终浓度。所有样本的dmso最终百分比保持不变。通过以2mg/ml重悬于80mmpipes(ph6.9)、2.0mmmgcl2、0.5mmegta、1.0mmgtp、15%甘油和10μm荧光报告物中来制备微管蛋白。将所有药物样本(10x)以一式两份加入到已预热的半区96孔板(corningcostar,3686)中,然后加热至37℃1分钟。然后向所有孔中加入微管蛋白(50μl/孔),并将孔板放到预热至37℃的读板仪(platereader)中。将板用培养基混合,轨道振荡5秒钟,并在bioteksynergy2读板仪中每60秒钟测量荧光90分钟(ex:340-360+/-20nm,em:410-460nm+/-20nm)。通过测量聚合曲线的生长阶段线性部分的最大斜率(通过线性回归)来测定聚合速率(荧光单位/分钟)。(图11e以及图11f)
游离微管蛋白含量分析
根据制造商的建议,使用微管/微管蛋白体内测定生化试剂盒(cytoskeleton,#bk038),从混入微管的微管蛋白中分离出游离异质二聚体微管蛋白。将细胞接种到12孔板中,使得约16小时后,其将铺满约50%至60%。用指定浓度的药物或dmso媒介物处理细胞2小时,此时用pbs洗涤细胞一次,并收获细胞。在37℃下进行该测定的所有步骤,以保存微管团块。将细胞溶解于増充有0.1mmgtp、1.0mmatp和1x蛋白酶抑制剂混合物(#pic02)的细胞骨架的(cytoskeleton’s)溶解和微管稳定缓冲液(lms01)。在37℃下以1000×g离心样本5分钟。小心收集上清液以进行超速离心,并将低速颗粒(lsp)悬浮在sds样品缓冲液(sds01)中,并在-20℃下冷冻,以便稍后通过蛋白质印迹进行分析。在37℃下以100,000×g离心低速上清液60分钟。小心收集上清液(高速上清液,hss),将其重悬在sds样本缓冲液中,并在-20℃下冷冻,以便稍后通过蛋白质印迹进行分析。首先将颗粒(高速颗粒,hsp)溶于1x微管解聚缓冲液(buf01)中15分钟,然后重悬于sds样本缓冲液中,并在-20℃下冷冻,以便稍后通过蛋白质印迹进行分析。(图11b)。
免疫细胞化学
将细胞接种到12孔板中的玻璃盖玻片上。根据制造商的说明书,通过在1nhci(60℃,6小时)中浸泡、在70%乙醇中洗涤并用多聚-l-赖氨酸(sigma,p5899)涂覆来制备盖玻片。接种细胞,使得在第二天,其将铺满约50%。然后用媒介物(dmso,<0.003%)或1μm化合物1处理细胞,并孵育24小时。处理后,用tbs洗涤细胞,并用增充有4mmegta和0.5%triton-x的布林克利缓冲液1980(brinkleybuffer1980)(80mmpipesph6.8,1mmmgcl2,1mmegta)提取游离微管蛋白(30秒钟)。提取后,将细胞固定在用增补有0.32m蔗糖的细胞骨架缓冲液(cytoskeletonbuffer)(10mmmesph6.1,138mmkcl,3mmmgcl2,2mmegta)稀释的4%甲醛中20分钟。固定后,用tbs洗涤细胞,然后在tbs-t(0.1%triton-x)+2%bsa+22.52mg/ml甘氨酸中封闭30分钟。在4℃下,将β-微管蛋白抗体孵育一整夜(abcaml79513,1:1000),然后在室温下采用山羊抗兔594二级抗体(生命技术公司,a11012)以1:500的比例与二级抗体一起孵育1小时。所有洗涤均使用tbs-t进行,并且所有封闭和抗体孵育均在tbs-t(0.1%triton-x)+2%bsa+22.52img/rml甘氨酸中进行。染色后,将细胞与300nm的dapi(biolegend,422801)孵育5分钟,洗涤,并用prolongdiamond抗褪色封固剂(invitrogen,p36965)固定。将载玻片在室温下干燥24小时,然后在4℃下避光保存,直至采集图像。
使用附接在eclipseti显微镜架上的激光扫描共焦,使用60x/1.49apotirf油浸物镜和标准激光器及滤光片组(nikoninstruments,melville,ny)进行共焦成像。针孔直径设为1艾里(airy)单位,在细胞基面附近采集单个光学切面,以最大限度地检测微管。所有成像条件保持不变。采用imagej的fiji分布对图像进行可视化、分析和准备公布(schindelinj,arganda-carrerasi,frisee,etal.fiji:anopen-sourceplatformforbiological-imageanalysis.naturemethods2012;9:676-682)。(图10d以及图10f)。
动物育种和基因分型
通过将以下混合遗传背景的工程化菌株杂交来产生遗传工程化模型:
kraslsl.g12d—在tuvesonda,shawat,willisna,etal.endogenousoncogenick-ras(g12d)stimulatesproliferationandwidespreadneoplasticanddevelopmentaldefects,cancercell2004;5:375-87中报道。
tp53lsl.r172h—在olivekp,tuvesonda,ruhezc,etal.mutantp53gainoffunctionintwomousemodelsofli-fraumenisyndrome,cell2004;119:847-60中报道。
pdx1-cretg—在hingoranisr,petricoinef,maitraa,etal.preinvasiveandinvasiveductalpancreaticcanceranditsearlydetectioninthemouse,cancercell2003;4:437-50中报道。
tp53flox—在jonkersj,meuwissenr,vanderguldenh,etal.synergistictumorsuppressoractivityofbrca2andp53inaconditionalmousemodelforbreastcancer,natgenet2001;29:418-25中报道。
krasfsf.g12d—jacksonlaboratory,stockno.008653.
tp53r172h—通过将tp53lsl.r172h菌株与deleter-cre杂交以诱导种系重组,然后剔除cre等位基因,从而产生该菌株。这诱导了tp53lsl.r172h等位基因中lox-stop-lox盒的重组,导致在内含子1中有具有单个外源loxp位点的种系tp53r172h等位基因。
pdx1-flpotg—将pdx1-cre转基因的近端6kb启动子与哺乳动物密码子优化的热稳定flp重组酶(flpo)的起始密码子融合,随后将flpo开放阅读框的5’端与hgh多聚腺苷酸化信号序列融合。
bmi1flox—在michjk,signerra,nakadad,etal.prospectiveidentificationoffunctionallydistinctstemcellsandneurosphere-initiatingcellsinadultmouseforebrain,elife2014;3:e02669中描述。
rosa26cre-ert2—在venturaa,kirschdg,mclaughlinme,etal.restorationofp53functionleadstotumourregressioninvivo,nature2007;445:661-5中描述。
如hingoranisr,wangl,multanias,etal.trp53r172handkrasg12dcooperatetopromotechromosomalinstabilityandwidelymetastaticpancreaticductaladenocarcinomainmice,cancercell2005;7:469-83中所述,采用kraslsl.g12d/+;p53lsl.g12d/+;pdx1-cretg/+(kpc)小鼠和相关模型。j1002细胞源自krasfsf.g12d/+;p53r172h/+;pdx1-flpotg/+;bmi1fl/fl;rosa26creert2/+(kpfbr)小鼠中的原发性胰腺肿瘤,该原发性胰腺肿瘤在cerulean治疗(以加速肿瘤发展)后但在使用它莫西芬治疗前出现。由transnetyx(cordova,tn)进行基因分型。研究采用了雄性和雌性动物。向动物提供标准食物,并在12小时明/暗循环下圈养。
kpfbr原代肿瘤细胞系的产生
采用无菌剪刀剪碎,在冰冷的肿瘤消化缓冲液(5ml/样本)中机械解离一小块肿瘤(约30mg)至少5分钟。肿瘤消化缓冲液由在无菌pbs中稀释的75μg/mldnasei(thermoscientific,en0521)、80ug/ml分散酶(dispase)ii(thermofisher,17105041)和1mg/ml胶原酶v(sigmaaldrich,c9263)组成。剪碎后,在37℃下,使解离的肿瘤在消化缓冲液中孵育20分钟。消化后,用40ml冰冷的pbs稀释消化的肿瘤,并用70μm无菌筛网过滤器过滤全部45ml。使单细胞悬液旋转沉降(300×g,5分钟),用pbs洗涤一次,重悬于无血清导管培养基(sfdm,配方如下)中,并平铺于胶原涂覆的6孔板(corning,354400)的1-2孔中。使细胞在胶原涂覆的板上的sfdm中扩增,且转移至标准dmem(10%fbs,1%pen-strep,1%l-谷氨酰胺)和标准组织培养孔板(无胶原)中。
sfdm配方:
dmem/f-12培养基(thermofisher,12634010)
1.22mg/ml烟酰胺(sigma,n3376)
5mg/ml葡萄糖(sigma,g6152)
5%its+(bdbiosciences,354352)
2.5ug/ml两性霉素b(thermofisher,15290018)
5%nu-serumiv(corning,392-0321)
25ug/ml牛垂体提取物(sigma,1476)
20ng/mlegf(thermofisher,pmg8041)
50nm3,3’5-三碘-l-甲状腺原氨酸(sigma,564605)
1um地塞米松(sigma,d1756)
100ng/ml霍乱毒素(quadratech,100)。
bmi1缺失评估
为了评估j1002细胞中条件性bmi1等位基因的重组,对通过苯酚-氯仿-异戊醇提取分离的dna进行pcr。在55℃下,用增充有1mg/ml蛋白酶k(newenglandbiolabs,p8107s)的裂解缓冲液(10mmtrisph7.5,10mmedta,10mmnacl和0.5%十二烷基肌氨酸钠)消化细胞一整夜。第二天,通过将裂解物与50%苯酚、48%氯仿和2%异戊醇的混合物合并,并在16,000×g下离心30分钟来分离dna。除去含有dna的顶层,沉淀,并用2.5体积的100%乙醇洗涤。使用thermoscientifictmnanodrop2000分光亮度计测量dna浓度。用
引物:
dn437:gctagcattcctggttttgc
dn438:ggcacagtgatgaggtgttg
dn946:cacgaggtgcttctttcctc
循环条件:
1.95℃,2分钟
2.95℃,15秒钟
3.51.4℃,15秒钟
4.68℃,45秒钟
(重复步骤2至4,30次)
5.68℃,5分钟
6.4℃,一直保持
预期扩增子:
野生型bmi1(bmi1wt)=400bp
floxedbmi1(bmi1fl/fl)=500bp
重组bmi1(bmi1δ)=300bp
pdx模型干预研究
将来自champions模型ctg-1462的早期传代肿瘤片段皮下植入nu/nu小鼠中,然后在肿瘤达到150-300mm3时随机分配到治疗臂(arm)。用七个臂中的其中一个臂治疗小鼠(n=5只/组):媒介物、吉西他滨(50mg/kg,q.w.,ip)、白蛋白结合型紫杉醇(10mg/kg,iv,q.w.×3)、化合物1(12.5mg/kg,b.i.w.×4,po)或吉西他滨+白蛋白结合型紫杉醇、吉西他滨+化合物1、白蛋白结合型紫杉醇+化合物1或吉西他滨+白蛋白结合型紫杉醇+化合物1的全剂量组合。终点为研究中肿瘤达到1500mm3的时候或90天后。使用数显卡尺测量肿瘤的长度(l)和宽度(w)直径,每周给小鼠称重两次。肿瘤体积按(l×w2)/2计算。(图12a和图12b)。
kpc干预/存活率研究
通过每周触诊监测kpc小鼠中的肿瘤形成,直至检测到团块。触诊呈阳性时,每周超声监测团块两次,直至肿瘤达到平均直径为4mm至7mm的可入选尺寸。一旦入选,则将kpc小鼠随机入选到干预研究的治疗臂中。用媒介物、化合物1(17mg/kg,po,b.i.w.)、单独的吉西他滨(100mg/kg,ip,b.i.w.)或化合物1+吉西他滨治疗小鼠。接受化合物1的小鼠还接受体积(μl)为50×体重(g)的吉西他滨媒介物(生理盐水、ip、b.i.w.)。接受吉西他滨的小鼠还接受体积(μl)为5.7×体重(g)的化合物1媒介物(含0.1%吐温80的0.5%羟丙基甲基纤维素(w/v),po,b.i.w.)。所有药物和媒介物组合均同时施用。
血浆和组织样本中化合物1水平的测量
在干冰上立即冷冻待用于分析的血浆和组织样本,并在-80℃下储存,直至进行分析。采用高效液相色谱-串联质谱法(lc-ms/ms)对样本中的化合物1浓度进行定量。通过蛋白质沉淀提取从样本中回收化合物1及其内标物(氘化化合物1)。
对于血浆药代动力学时程研究,绘制标准曲线,以涵盖0.001ug/ml和3.0μg/ml之间的浓度。血浆中化合物1(任一版本)的定量下限(lloq)为0.001μg/ml(图4a)。
对于评估化合物1单次给药后血浆、股四头肌和肿瘤组织的药代动力学研究,测定条件如下(图5a):
血浆:绘制标准曲线,以涵盖0.002ug/ml和6.0ug/ml之间的浓度。血浆中化合物1(任一版本)的lloq为0.001μg/ml。
股四头肌:绘制标准曲线,以涵盖0.001μg/g湿组织和3.0μg/g湿组织之间的浓度。化合物1(任一版本)的lloq为0.01μg/g湿组织。
肿瘤组织:绘制标准曲线,以涵盖0.001μg/g湿组织和3.0μg/g湿组织之间的浓度。化合物1(任一版本)的lloq为0.02μg/g湿组织。
超声
如sastrasa,olivekp,quantificationofmurinepancreatictumorsbyhigh-resolutionultrasound,methodsmolbiol2013;980:249-66中所述进行肿瘤超声检查和体积定量(图7a和图7b)。
免疫组织化学
为了制备用于免疫组织化学的样本,首先将组织固定在10%磷酸盐缓冲的福尔马林中一整夜,然后在70%乙醇中长期存放。然后对固定组织进行标准脱水方案,并将其包埋在石蜡块中。使用leicarm2235切片机将组织切片至5μm厚,置于带正电电荷的载玻片上,并在60℃下烘烤30分钟。为了准备染色,首先在二甲苯中对载玻片进行脱蜡,然后在一系列乙醇步骤中重新补充水分,然后在蒸馏水中冲洗。接下来,在实验确定的抗体特异性抗原修复缓冲液(通常为10mm柠檬酸盐,ph6.0或10mmtris,ph10.0)中修复抗原。在高压锅中将抗原修复缓冲液加热至沸腾,此时引入载玻片5分钟。冷却至室温后,将载玻片浸入pbs中的3%过氧化氢浸20分钟,以淬灭内源性过氧化物酶。
然后在室温下将载玻片在tbs-t(0.1%吐温20)+1.5%正常马血清(vectorlaboratories,s-2000)+2%无动物阻断剂(vectorlaboratories,sp-5030)中封闭1小时。在封闭溶液中稀释一级抗体,并在4℃下以指定浓度孵育一整夜。第二天,使用immpresshrp抗兔igg(过氧化物酶)聚合物检测试剂盒(vectorlaboratories,mp-7401)在室温下孵育二级抗体30分钟。使用immpactdab过氧化物酶(hrp)底物(vectorlaboratories,sk-4105)进行检测,然后用苏木精复染载玻片,脱水至二甲苯,并用permount盖玻片(fisher,s70104)覆盖。(图6d以及图6e)。
ihc抗体:
ph3:细胞信号传导,#9701,1:100
cc3:细胞信号传导,#9664s,1:100。
- 还没有人留言评论。精彩留言会获得点赞!