带有可膨胀壳的可摄入装置的制作方法
相关申请的交叉引用
本申请要求2018年9月25日提交的名为“带有可膨胀壳的可摄入装置”的美国临时专利申请62/736,263的权益和优先权,其内容通过引用且出于所有目的以其整体并入本文。
背景技术:
医学的进步已经确认了许多慢性疾病,如银屑病、克罗恩病、类风湿性关节炎、糖尿病和血友病等等。许多用于治疗慢性病的治疗剂主要或仅通过注射的方式递送,这可能是痛苦和不方便的,因此遵守包括注射在内的治疗方案可能不如遵守口服给药方案(如果有的话)好。然而,许多历史上的口服可注射治疗剂的方法尚未成功。因此,需要口服先前以可注射形式递送的治疗剂的新方法。
技术实现要素:
实施方案提供了可摄入装置和口服制剂(例如,一种或多种治疗剂和/或其他化合物)的相关方法。在许多实施方案中,可膨胀壳(例如,气囊)原位膨胀以在胃肠(gi)道中的递送位置处递送一种或多种制剂。构造可膨胀壳,以使得在其膨胀时可膨胀壳的一部分形成一个或多个保护凹部。当在胃肠道内膨胀时,保护凹部可由胃肠道界定以形成保护体积,以使得设置在保护凹部内的制剂在保护体积内暴露于胃肠道。在膨胀之前,可膨胀壳作为递送装置的一部分包括在可摄入装置的外壳内。在一个或多个实施方案中,可摄入装置被构造成被吞咽并穿过胃肠道到达目标递送位置。
附图说明
图1a、图1b、图1c、图1d、图1e和图1f示出了被示为处于穿过胃肠道前进到体内递送位置期间的可摄入装置的实施方案。
图2示出了可摄入装置的外壳的实施方案。
图3a、图3b、图3c、图3d、图3e、图3f和图3g示出了可摄入装置的可膨胀壳的实施方案。
图4a示出了由不同厚度的材料构造的可膨胀壳的实施方案。
图4b示出了可膨胀壳的实施方案和被定位以限制可膨胀壳膨胀的多个约束结构。
图4c示出了包括约束结构之一的图4b的一部分的实施方案的放大截面图。
图5a示出了递送机构的隔离屏障的实施方案。
图5b为包括隔离屏障的图5a的一部分的实施方案的放大截面图。
图6a示出了递送机构的密封件的实施方案
图6b是包括密封件的图6a的一部分的实施方案的放大截面图。
图6c示出了具有多个密封件的递送机构的实施方案。
图7a、图7b和图7c示出了密封件的实施方案,每个密封件都以塞子的形式封闭可膨胀壳的各个开口。
图8a、图8b、图8c、图8d和图8e示出成型组合物的实施方案。
图9a和图9b示出了可膨胀壳的保持区处的成型组合物的布置的实施方案。
图9c示出了图9b中的布置的实施方案的放大截面图。
图10a、图10b、图10c、图10d和图10e示出了可摄入装置的实施方案的原型。
图11a、图11b、图11c和图11d示出了可摄入装置的另一实施方案的原型。
图12a、图12b、图12c和图12d示出了可摄入装置的另一实施方案的原型。
图13示出了用于制造可摄入装置的方法的实施方案。
图14示出了用于口服包括治疗制剂的可摄入装置的方法的实施方案。
下面结合本发明的附图以示例而非限制的方式描述这些和其他实施方案。本发明涵盖了将从附图和描述中变得明显的其它实施方案。此外,本发明还包括来自不同实施方案的特征的组合。
为了便于描述,在本文的多个附图中,通过垂直于y轴的x轴来指示x-y平面。另外,垂直于x-y平面的z轴(关于横截面视图示出)与x-y平面的组合定义了三维x-y-z空间。
在任何图示中,部件表示的相对位置和相对尺寸并不旨在表示或限制实际部件的相对位置或相对尺寸。
具体实施方式
当在本发明中使用时,术语“例如”或术语“如”表示一个或多个非限制性示例的列表紧随其后;应当理解,未列出的其他示例也在本发明的范围内。
术语“降解(degrade)”、“降解的(degrading)”、“被降解的(degraded)”和“降解(degradation)”在本文中是指弱化、部分降解或完全降解,如通过溶解、化学降解、分解、化学改性、机械降解或崩解。
术语“设计(design)”、“设计的(designing)”和“被设计的(designed)”是指基于与设计相关的公差估计(例如,部件公差和/或制造公差)和设计预期遇到的环境条件估计(例如,温度、湿度、外部或内部环境压力、外部或内部机械压力或应力、产品年龄、生理学、身体化学、液体和组织的生物成分和/或化学成分、ph值、物种、饮食、健康、性别、年龄、血统、疾病、组织损伤或其组合);应理解,摄入之前和/或之后的实际公差和环境条件可影响此类设计特性,使得具有相同设计的不同可摄入装置可具有关于这些设计特性的不同实际值。本文中术语“设计(design)”、“设计的(designing)”和“被设计的(designed)”的使用还包括对设计的改变或修改、根据设计构造的部件(定义见下文)以及在部件制造(定义见下文)后对其实施的设计修改。
术语“消化物质”在本文中是指生物物质,如血液、组织、流体、酶和身体的沿胃肠道的其他分泌物,还包括穿过胃肠道的其他物质(例如,未消化或已消化形式的食物)。
术语“流体”指气体或液体或其组合。
术语“摄入(ingest)”、“摄入的(ingesting)”和“被摄入的(ingested)”在本文中是指通过吞咽或通过其他方式(例如,通过内窥镜沉积到胃中或通过端口沉积到胃中)摄入到胃中。
与部件相关的术语“制造(manufacture)”、“制造的(manufacturing)”和“被制造的(manufactured)”是指制造部件,无论是全部或部分手工制造,还是全部或部分以自动化方式制造。
术语“构造”在本文中是指根据构思或设计或其变化或修改(无论此类变化或修改发生在制造之前、期间或之后)制造的部件或系统,无论此类构思或设计是否以书面形式记录。
随着生物技术的进步,已开发出多种生物衍生治疗剂(本文称为生物制剂),可用于改善多种高患病率慢性疾病的治疗,如糖尿病和其他葡萄糖调节障碍、多发性硬化症,银屑病和其他自身免疫性疾病、嗜酸性粒细胞相关疾病、血友病和其他凝血疾病。这类生物制剂包括抗体、胰岛素、因子viii和抗嗜酸性粒细胞抗体等。由于这些生物制剂的大尺寸和/或精细结构,它们无法口服。这些分子可能吸收不良,或在吸收前在胃肠道被分解。因此,迄今为止,生物制剂的施用需要肠胃外注射(例如,肌肉内、皮下或静脉注射)。然而,这些注射是痛苦的,不方便的(通常需要去医疗机构),并不是没有风险,包括组织部位反应和感染。因此,对注射治疗方案的依从性可能不如对口服给药方案(如果有的话)的依从性好。虽然已经对口服生物制剂和相关化合物进行了许多尝试,但由于胃肠道中的分子分解和/或吸收不良或不可预测,以及由此产生的低生物利用度,这些尝试基本上没有成功。因此,需要一种新的方法来口服生物制剂和其他治疗药物,这些药物以前只能通过肠胃外注射来递送。
如下文详细讨论的,实施方案提供了一种可摄入装置,用于在身体(例如,哺乳动物身体,例如人体)的胃肠道内递送治疗制剂。根据实施方案,可摄入装置包括外壳和设置在限定于外壳内的空间中的递送机构。递送机构包括可膨胀壳。外壳原位降解(例如,在目标递送位置处或附近),从而使递送机构暴露于消化物质。递送机构能够在暴露于消化物质的情况下被触发,以使可膨胀壳的多个区域膨胀至膨胀的状态。多个区域可包括头部区、尾部区和保持区。膨胀时的保持区的尺寸小于膨胀时的头部区的尺寸且小于膨胀时的尾部区的尺寸,使得头部区和尾部区一起限定保持区所在的保护凹部。在原位,头部区和/或尾部区抵靠胃肠道壁而膨胀,并且保护凹部在原位由头部区、尾部区和壁界定,形成部分或完全密封的胃肠道段,以最小化或避免消化物质进入保护凹部。一个或多个成型组合物可设置在保持区中,以便在保护凹部内暴露于胃肠道。
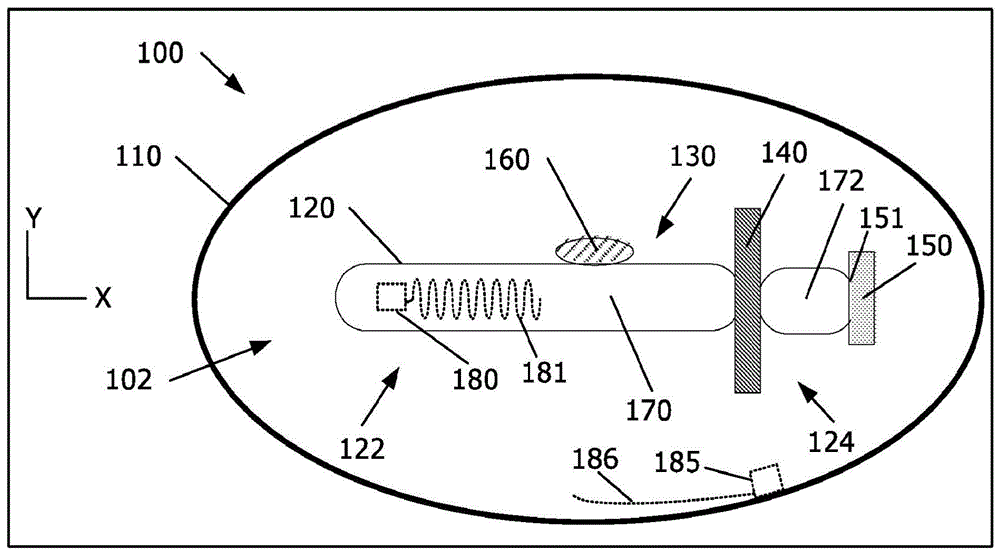
图1a-1f示出了可摄入装置100的实施方案,该可摄入装置100在穿过胃肠道(例如,到身体内的目标递送位置)期间经过各种状态或阶段。
在图1a中,可摄入装置100包括外壳110和递送机构102。外壳110包住(例如,封装、包围或覆盖)递送机构102。在图1a中,在沿可摄入装置100的长度的横截面中示出外壳110以暴露出递送机构102。
在一个或多个实施方案中,外壳110可包括一个或多个具有材料组合物的层,所述材料组合物对沿胃肠道不同部分的消化物质的不同预期特性反应,使得外壳110可在摄入后穿过胃肠道的一部分留存,同时保持阻止消化物质进入可摄入装置100的流体屏障,然后流体屏障在递送位置(例如,在目标递送位置处或附近)受损。例如,外壳110可被构造为在外壳110将驻留在胃中的预期持续时间内提供流体屏障。例如,外壳110可被构造为在与下胃区域相关联的ph值下耐受降解,在该下胃区域中,预期可摄入装置100将被保留一段时间(例如,外壳110的结构包括在位于1.5-3.5的范围内的ph值下耐受降解的肠溶衣),然后在与小肠相关的ph值(例如,ph>7)下降解。
在一个或多个实施方案中,外壳110的一层是胶囊,递送机构102被设置在胶囊内,并且外壳110可选地进一步包括在胶囊上的一层或多层。
在一个或多个实施方案中,可摄入装置100不包括胶囊。例如,外壳110可直接设置在递送机构102上,如通过将材料喷涂或滴到递送机构102上以形成外壳110的一层或几层,或将递送机构102浸入材料中以形成外壳110的一层或几层。下面参照图2示出和描述外壳110的实施方案。
仍然参考图1a,递送机构102可包括具有头部区122、尾部区124和保持区130的可膨胀壳120。为便于解释,使用术语“头部”和“尾部”,其不一定表示在可摄入装置100穿过胃肠道期间可摄入装置100的取向。
递送机构102可分为多个部分。在图1a的图示中,接合的隔离屏障140将可膨胀壳120分为体积部分170和体积部分172。隔离屏障140可对应于其接合以封闭可膨胀壳120的任何结构。在一个或多个实施方案中,体积部分170包含第一化学反应物,体积部分172包含第二化学反应物;隔离屏障140最小化或防止在隔离屏障140接合时混合第一化学反应物与第二化学反应物,并且当隔离屏障140分离时(例如,由于降解),第一化学反应物和第二化学反应物混合以产生期望的膨胀效果。例如,隔离屏障140的分离可允许碳酸氢钾和柠檬酸混合并形成气体,从而引起期望的膨胀效果。尽管在图1a中示出了递送机构102包括一个隔离屏障140,但可以有多个隔离屏障,包括将可膨胀壳120划分成多个体积部分170、172和一个或多个其他体积部分的隔离屏障140。
递送机构102可包括一个或多个用于封闭(例如,夹紧、堵塞或以其他方式密封)可膨胀壳120中的开口的机构,从而在可膨胀壳120的内部和可膨胀壳120的外部之间提供了流体屏障。在图1a-1e的图示中,密封件150封闭在尾部区124中的可膨胀壳120的开口。在接合密封件150之前,可膨胀壳120中的开口151可提供进入可膨胀壳120的内部区域的通道,以便在递送机构102的组装期间,可膨胀壳120可接受膨胀机构(例如,第一和第二化学反应物,它们在混合时引起可膨胀壳120的期望膨胀效果)。然后,接合后的密封件150保持可膨胀壳120的内容物(例如,体积部分172的内容物)。在摄入之后,密封件150可被构造为在目标递送位置处分离(例如,通过降解),以允许可膨胀壳120的内容物(例如,气体)通过开口151逸出。
尽管为了便于说明,密封件150被图示为封闭可膨胀壳120的端部的开口151,但应理解的是,该开口可以被构造在可膨胀壳120的任何部分上,并通过诸如密封件150的机构来封闭,并且多个开口可以分别通过诸如密封件150的密封件来封闭。
隔离屏障140和密封件150的设计接合时间可以通过结构来实现。本文的接合时间是指在递送位置处暴露于各状况后各个隔离屏障140或密封件150仍保持接合并保持各自屏障或密封的时间段。设计接合时间是在目标递送位置处的预期接合时间。设计接合时间包括结构方面的设计和材料的选择。例如,可以通过改变结构的设计尺寸和/或改变结构各部分相对于彼此的相对尺寸来调整设计接合时间。例如,可以通过改变材料的厚度、选择不同的材料和/或使用不同的材料组合来调整设计的接合时间。当在目标递送位置处暴露于预期的环境状况时,可基于已知或预测的降解特性来选择一种或多种材料。
在一个或多个实施方案中,密封件150被构造为在目标递送位置处的接合时间比隔离屏障140的接合时间长。例如,隔离屏障140的接合时间可以小于或等于5分钟(例如,大约1分钟,在1到5分钟的范围内,大于5秒,等等),密封件150的接合时间可以小于或等于30分钟(例如,大于5分钟,在1分钟到10分钟的范围内,大于1分钟,在10分钟到20分钟的范围内,等等)。
可摄入装置100可包括被定位于一个或多个保持区的一个或多个成型组合物。为便于讨论,图1a-1d示出了在单个保持区130处的单个成型组合物160。应理解,除非另有规定,否则对成型组合物160的参考适用于实施方案的多个成型组合物160中的每一个。
成型组合物160可附着在可膨胀壳120上,以保持成型组合物160定位在保持区130处。在一个或多个实施方案中,使用包括糖、麦芽糖、聚乳酸(pla)、聚氧化乙烯(peo)或其他可生物降解材料中的一种或多种的材料将成型组合物160附接到可膨胀壳120上。在一个或多个实施方案中,使用不可生物降解材料将成型组合物160附接到可膨胀壳120。
成型组合物160可以包括多层。如下文更详细地描述,在一个或多个实施方案中,成型组合物160可包括一层或多层以耐受过早降解(例如,在目标递送位置处的预期降解之前)。
现对由可摄入装置100的一个或多个实施方案递送的治疗制剂进行讨论。治疗制剂可包括一种或多种治疗剂,成型组合物160可包括一种或多种治疗制剂。治疗剂在递送位置释放时可赋予身体治疗或其它生物益处。治疗剂可以是各种物质中的任何一种,如用于治疗疾病或身体其他状况的药理学活性剂、疫苗、细胞(例如,由或从活生物体产生或含活生物体的成分)、维生素、矿物质或其他营养或草药补充剂或dna或sirna转录物(例如,用于修饰基因异常、条件或紊乱)。
药理活性剂的示例包括但不限于肽、蛋白质、免疫球蛋白(例如抗体)、大分子、小分子、激素以及上述任何一种的生物活性变体和衍生物。
治疗剂可以是一类抗体,如免疫球蛋白g(例如,诸如阿达木单抗(adalimumab)的tnf-α抗体,诸如布罗达单抗(brodalumab)、苏金单抗(secukinumab)或依克珠单抗(ixekizumab)的白介素-17家族中的白介素)、抗嗜酸性粒细胞抗体或任何其他类别,并且可以是人源化的或非人源化的。
维生素、矿物质或其他营养或草药补充剂的示例包括但不限于维生素a、硫胺素、烟酸、核黄素、维生素b-6、维生素b-12、其他b-维生素、维生素c(抗坏血酸)、维生素d、维生素e、叶酸、磷、铁、钙和镁。
细胞的示例包括但不限于干细胞、红细胞、白细胞、神经元和其他活细胞。
疫苗的示例包括但不限于针对各种细菌和病毒或其蛋白质(例如流感、脑膜炎、人乳头瘤病毒(hpv)或水痘)的疫苗。在针对病毒的疫苗的各种实施方案中,疫苗可对应于各种减毒病毒。
治疗制剂还可包括一种或多种赋形剂,以便为成型组合物160的实施方案中包括的一种或多种治疗剂提供合适的介质(例如,用于辅助制造),或保持一种或多种其他治疗剂的完整性(例如,在制造期间、储存期间,或摄入后在体内扩散之前)。
赋形剂的示例包括但不限于粘合剂、崩解剂和超级崩解剂、缓冲剂、抗氧化剂和防腐剂。
如上所述,每个治疗制剂可包括一种或多种治疗剂,成型组合物160可包括一种或多种治疗制剂。因此,成型组合物160的实施方案可包括一种治疗剂或多种治疗剂。
现对由可摄入装置100的一个或多个实施方案递送的增强制剂进行讨论。增强制剂可包括一种或多种递送增强剂,并且成型组合物160可包括一种或多种增强制剂。例如,递送增强剂可以用作递送一种或多种治疗剂的递送介质,或者用于改善一种或多种治疗剂进入身体的吸收(例如,渗透增强剂、酶阻滞剂、渗透穿过粘膜的肽、抗病毒药物,例如蛋白酶抑制剂,崩解剂或超级崩解剂或ph调节剂。)在一个或多个实施方案中,递送增强剂引发肠上皮(例如,使细胞外层液化)以提高在递送位置处或附近递送时包含在成型组合物160中的一种或多种其他治疗剂的吸收和/或生物利用度。
递送增强剂的示例包括但不限于表面活性剂、胆盐、脂肪酸、螯合剂、壳聚糖和前述任何一种的衍生物。递送增强剂的具体示例包括但不限于十二烷基硫酸钠、十二烷基硫酸钠、琥珀酸二辛酯磺酸钠、聚山梨酸、甘胆酸钠、脱氧胆酸钠、牛磺胆酸钠、二氢呋喃酸钠、乙二氢呋喃酸钠、油酸、辛酸、月桂酸、壬基酚氧基聚氧乙烯、
增强制剂可进一步包括赋形剂,所述赋形剂用于为增强制剂的实施方案中包括的一种或多种递送增强剂提供合适的介质(例如,用于辅助制造),或保护增强制剂的实施方案中包括的一种或多种递送增强剂的完整性(例如,在制造期间、储存期间或在摄入之后体内分散之前)。赋形剂如上所述。
在一个或多个实施方案中,治疗制剂和/或增强制剂可包括一种或多种血管舒张剂,例如l-精氨酸、西地那非或硝酸盐(例如,硝酸甘油)。
如上所述,每个增强制剂可包括一种或多种递送增强剂,并且成型组合物160可包括一种或多种增强制剂。因此,成型组合物160的实施方案可包括一种递送增强剂或多种递送增强剂。
综上所述,成型组合物160可包括:任何一种或多种治疗剂,如选自任意组合的上述示例的治疗剂;任意一种或多种递送增强剂,如选自任意组合的上述示例的递送增强剂;任意一种或多种治疗制剂,包括一种或多种治疗剂;任意一种或多种增强制剂,包括一种或多种递送增强剂;结合治疗剂和递送增强剂的任何一种或多种制剂;一种或多种赋形剂;或前述任何制剂的任何组合。
回到图1a的描述,可摄入装置100任选地包括检测流体何时突破外壳110并到达递送机构102的能力,和/或检测可膨胀壳120何时膨胀的能力。例如,在一个或多个实施方案中,电子电路检测流体,或检测可膨胀壳120的膨胀,并且通过可摄入装置100中或其上的天线将相应的信号无线地发送到可摄入装置100外部的装置。这种外部装置可以是植入体内的电子装置,或者可以是身体外部的装置。例如,电子电路可以将信号发送到植入装置,该植入装置可以将信息中继到身体外部的装置,或者可以存储关于信号的信息(例如,时间戳、信号标识符、信号强度、可摄入装置100的标识符和其他相关信息),以便稍后下载到身体外部的装置。又例如,电子电路可以将信号直接发送到身体外部的装置。直接或间接在身体外部传输的信息可以在身体外部的装置处接收,并安排在图形用户界面(gui)处显示。例如,可以在外部装置的gui处显示信息,例如供受试者、护理者或医生查看。通过检测流体的进入和/或可膨胀壳120的膨胀并发出信号,可在可摄入装置100穿过身体时监测外壳110和/或可膨胀壳120的状态。
用于检测流体的电子电路的一个示例包括两个彼此非常接近的电极,以使得存在于两个电极之间的流体引起变化(例如,电阻、电容、电感、阻抗或电抗),该变化可由电子电路中的其他元件检测。用于检测流体的电子电路的另一示例包括由可降解材料分隔的两个触点,使得当可降解材料暴露于流体时,其降解并允许两个触点接触并由此完成电路,该电路可由电子电路的其它部件检测。
用于检测可膨胀壳120的膨胀的电子电路的示例包括沿着可膨胀壳120的一部分延伸的薄导体,以使得当可膨胀壳120膨胀时,薄导体断裂从而断开电路,该电路可由电子电路的其他组件检测。用于检测可膨胀壳120的膨胀的电子电路的另一示例包括位于可膨胀壳120上的流体检测器,以使得在膨胀之前,流体检测器被可膨胀壳120覆盖和保护,这是由于在制造时可膨胀壳120被设置在外壳110内时被折叠;当可膨胀壳120膨胀时,流体检测器暴露于已经突破外壳110的流体中。用于检测可膨胀壳120的膨胀的电子电路的又一示例包括位于隔离屏障140的部分之间的流体检测器(例如,在图5b的实施方案中的第一隔离屏障部分542和第二隔离屏障部分544)之间,所述流体检测器在隔离屏障140部分或全部降解之后暴露于流体中,从而指示可膨胀壳120的膨胀已经开始或即将开始。
在图1a中,提供了电子电路布置的两个示例。如显而易见的,电子电路的放置可以在可摄入装置100内的许多其他位置。例如,可以基于易于制造、避免对可摄入装置100的操作的干扰、检测器的类型和/或要检测的事件来确定放置。在图1a中,示出了电子电路180的示例位于可膨胀壳180上来检测流体和/或检测可膨胀壳180的膨胀。天线181电连接到电子电路180。天线181定位在可膨胀壳180上,以使得其能够随着可膨胀壳120的膨胀而拉伸但不断裂(例如,在图示的弓形序列中,该序列能够在其极限处拉伸到近似直线)。同样在图1a中,示出了位于外壳110的内层或内表面以检测流体进入的电子电路185的示例。天线186电连接到电子电路185。天线186例如是直线天线、多臂天线或线圈天线。天线186可以设置在外壳110的内层或表面上,或者设置在外壳110的层之间。
现在继续讨论图1b-1f,示出了在通过胃肠道到人体中的递送位置(例如,到目标递送位置)的持续遍历期间可摄入装置100通过各种状态或阶段的进展。
图1b示出了在外壳110不再对消化物质提供屏障的状态下的可摄入装置100。因此,在该状态下,外壳110将可摄入装置100的剩余部件暴露于消化物质。隔离屏障140、密封件150和成型组合物160可被构造为在该暴露时开始降解,或在该暴露后在各自的设计时间量(例如,以各自的降解速率)内耐受降解,如下所述。
在一个或多个实施方案中,在制造期间设置在可摄入装置100内的可膨胀壳120的部分可折叠或以其他方式屏蔽成型组合物160。例如,屏蔽成型组合物160可以预防或减缓成型组合物160的降解,直到可膨胀壳120已经膨胀。
在图1c所示的实施方案中,隔离屏障140已经分离(例如,由于暴露于消化物质而降解),使得隔离屏障140不再起到分割头部区122和尾部区124的作用。因此,在通过化学反应实现膨胀机制的实施方案中,将包含在头部区122和尾部区124内的化学反应物混合并化学反应,生成溶液(例如,泡腾溶液),该溶液可产生气体(例如,包括二氧化碳)。
在图1d所示的实施方案中,化学反应产生的气体使可膨胀壳120膨胀。如果可膨胀壳120被认为沿x轴对齐(例如,如图1a-1f所示),可膨胀壳120(例如,图1d和图1e)的膨胀可以垂直于x轴(在x-y-z空间内的y-z方向上)和/或沿x轴。
如图1d所示,可膨胀壳120的不同区域膨胀时可具有不同的尺寸,如不同的横截面积、不同的周长、垂直于x轴的不同直径或垂直于x轴的不同半径。在一个或多个实施方案中,当三维观察时,膨胀的可膨胀壳120使人想起举重运动员的哑铃或杠铃。
在一个或多个实施方案中,可膨胀壳120的材料在膨胀期间拉伸,并且在可膨胀壳120的不同部分控制拉伸量以获得所需的合成形状。参照图4a-4c来说明和描述这些实施方案的示例。在其他实施方案中,可膨胀壳120由抗拉伸材料形成,可膨胀壳120在制造过程中以所需形状形成,并且该形状基本上被保留,使得该形状在膨胀前后相似。在又一实施方案中,可膨胀壳120由可拉伸材料形成,并且膨胀后的可膨胀壳120的形状使人想起膨胀前的可膨胀壳120的形状,但是该形状通过材料的拉伸而改变。
在一个或多个实施方案中,头部区122和尾部区124中的至少一个膨胀以接触胃肠道内的表面,从而将可膨胀壳120临时锚定在递送位置(例如,在目标递送位置处或附近)。头部区122和/或尾部区124可按压表面,并可在接触处延伸表面,以改进锚定,和/或提供屏障来预防或最小化消化物质流过,从而屏蔽治疗组合物160。
在一个或多个实施方案中,头部区122和尾部区124都膨胀以接触胃肠道内的表面,如图1d所示,以虚线125表示胃肠道中三维表面的一部分。这样,可膨胀壳120在膨胀时在膨胀的头部区122和膨胀的尾部区124之间形成保护凹部,由胃肠道内的表面原位界定。保护凹部是周向围绕头部区122和尾部区124之间的可膨胀壳120的体积,如周向围绕保持区130的体积。例如,如图1d所示,当可膨胀壳120原位膨胀并沿x轴对齐时,该体积可以从可膨胀壳120的外部沿着保持区130开始,并且在x-y-z空间中沿y-z方向向外延伸。然后,原位的保护凹部由头部区122、尾部区124、可膨胀壳120的保持区130和与保持区130相对的胃肠道表面界定。例如,图1d示出了由限定保护体积的虚线125表示的表面界定的保护凹部135。保护凹部135内的成型组合物160可被屏蔽足够的时间以将成型组合物160中的治疗剂输送通过胃肠道表面。例如,如果可膨胀壳120在空肠内膨胀,则成型组合物160中的治疗剂可被屏蔽足够的时间,以将治疗剂输送通过空肠内壁,到达空肠壁的血管化区域(和腹膜中潜在的血管化区域或腹膜内含有腹膜腔内淋巴管的区域)。
在图1e所示的实施方案中,成型组合物160已经降解。在结合时间内,密封件150在可膨胀壳120的内部和可膨胀壳120的外部之间连续提供流体屏障。因此,在一个或多个实施方案中,密封件150通过预防由化学反应产生的气体逸出可膨胀壳120来保持可膨胀壳120内的压力。此外,可设计密封件150的降解速率以使得密封件150足以耐受降解来维持其完整性,进而维持可膨胀壳120在其膨胀状态下一段时间,直到成型组合物160已经降解,并且持续此后一段时间以允许从成型组合物160中释放出来的治疗剂和/或递送增强剂发挥其所期望的功能。
在图1f所示的实施方案中,示出了密封件150被分离(例如,由于暴露于消化物质而降解),以允许化学反应产生的气体从可膨胀壳120的内部逸出进入身体。因此,可膨胀壳120放气并继续穿过身体。
图2示出了可摄入装置100的外壳210(图1a中外壳110的实施方案)的示例。在沿外壳210的长度的横截面中示出外壳210。在图2中的虚线示出了表示设置在外壳210内(例如,在折叠、卷绕、扭转等之后)的递送装置102的实施方案的轮廓。
在一个或多个实施方案中,外壳210可被构造为包括多层,如图2所示的多层。外壳210的层以图示的方式呈现,并且可以将更多或更少的层设计在外壳110的其他实施方案中。
在一个或多个实施方案中,可摄入装置100可被构造为口服摄入。根据这些实施方案,外壳210可包括最外层212以改善可吞咽性(例如,光滑的溶衣)。此外,最外层212可被构造为鼓励遵守规定的治疗方案或阻止可摄入装置100的摄入(例如,由儿童),例如通过结合与可摄入装置100的口服摄入的感觉(例如,味道或气味)。在摄入之后,最外层212可能不再有用或不需要,并且因此可以被构造为在摄入之后快速降解。
在一个或多个实施方案中,可摄入装置100可将治疗剂递送至胃肠道的肠。因此,外壳210的结构和尺寸可被设计为穿过胃肠道到达目标递送位置(例如,到空肠或进入空肠)。
外壳210可包括保护层214,该保护层提供针对消化物质的流体屏障,并防止外壳210由于暴露于身体某些区域的消化物质而降解(或最小化或延缓降解)。在一个或多个实施方案中,用于递送治疗剂的目标递送位置在小肠内。在这些实施方案中,保护层214可被构造为穿过胃留存(例如,保护层214是肠溶衣)。例如,保护层214可被以化学方式构造为对下胃期望的ph值(例如,ph<7或ph<6.5)具有保护作用,但可在对小肠期望的ph值(例如,ph≥7或6.5<ph<7.5)下降解,并且在可摄入装置100穿过胃之后,保护层214开始在小肠中降解或加速降解。作为此类实施方案的补充或替代方案,在给定保护层214的预期降解率的情况下,保护层214的厚度可以被构造成在可摄入装置100将驻留在胃中的预期持续时间内留存。
外壳210可进一步包括最内层216,该最内层被构造为当暴露于目标递送位置处或附近的状况时开始降解。例如,由保护层214提供的流体屏障可被构造为在可摄入装置100进入小肠的十二指肠后迅速受损,而最内层216可被构造为在暴露于小肠中的消化物质后的一段时间内降解,以使得可摄入装置100可到达空肠。在一个或多个实施方案中,最内层216是胶囊(例如,尺寸000或更小的胶囊)或包溶衣的胶囊以在暴露于消化物质后延迟或减缓胶囊降解。在其它实施方案中,最内层216是涂覆在递送机构102上的溶衣。
外壳210的层被选择和构造成使可摄入装置100穿过到达特定的目标递送位置(例如,胃、十二指肠、空肠、髂骨或结肠)并且在目标递送位置处或附近递送治疗组合物160。
在一个或多个实施方案中,外壳210可包括一个或多个结构性机构,该结构性机构可使外壳210以受控方式降解。例如,外壳210的结构可包括部分延伸穿过保护层214以促进外壳210在外壳210的特定区域处的降解的一个或多个断裂部218(例如,切割线或针孔),和/或被定位为抑制外壳210在外壳210的特定区域的降解的一个或多个控制段220(图示为覆盖保护层214的区域的控制段220a、覆盖最内层216的区域的控制段220b和覆盖最外层212的区域的控制段220c的实施方案)。用于控制段220的材料的示例是蜡。
例如,尽管保护层214的设计厚度可以是均匀的,但是所制造的保护层214的实际厚度可能不均匀,使得所制造的外壳210的某些区域的保护层214趋向于更厚。对于此类可摄入装置100,一个或多个断裂部218可并入外壳210的设计中以促进保护层214的较厚区域中的降解,和/或一个或多个控制段220可并入外壳210的设计中以抑制保护层214的较薄区域中的降解。
对于另一个示例,可期望外壳210以特定方式降解,使得当递送机构102由于外壳210的降解而暴露于消化物质时,允许在外壳210的部分不阻碍膨胀的情况下进行可膨胀壳120的膨胀(例如,在外壳210完全降解之前)。在此类可摄入装置100的一个或多个实施方案中,一个或多个断裂部218和/或一个或多个控制段220可并入外壳210以限定外壳210的降解顺序。一个这样的降解顺序是外壳210的中心部分的降解和外壳210的端部的延迟或抑制的降解,以使得在可膨胀壳120膨胀之前进行外壳210的中心部分的降解,以及可膨胀壳120的膨胀在远离可膨胀壳120的方向上(例如,沿着x轴)推动外壳210的完整或半完整部分。在释放成型组合物160中的药剂期间,可希望避免一个或多个完整的控制段220留在由可膨胀壳120形成的保护凹部内;在此类实施方案中,控制段220可由比保护层214降解速度慢的材料构成但在设计时间内仍然会降解。
在一个或多个实施方案中,最外层212、保护层214或附加层(未示出)可包含使外壳210变得不透明的物质(例如,乳浊剂)。附加层(未示出)或附加物质可并入外壳210中以实现其它期望的设计特性。此外,可以省略一个或多个层。
层212、214、216相对于彼此以及相对于可摄入装置100的其它特征的相对尺寸可以不同于图2中所示,并且断裂部218和/或控制段220相对于彼此以及相对于可摄入装置100的其他特征的相对尺寸和定位可以不同于图2中所示。
图3a-3g示出了处于膨胀状态的可膨胀壳120的实施方案。可膨胀壳120中可使用各种材料,如天然聚合物、合成聚合物、无机聚合物、有机聚合物、硅酮或前述的组合。天然聚合物的示例包括但不限于淀粉、海藻酸钠、树脂、透明质酸钠、黄原胶、明胶、结冷胶、瓜尔胶、胶原蛋白、壳聚糖、纤维素、橡胶和白蛋白。合成聚合物的示例包括但不限于羟丙基甲基纤维素、羟丙基纤维素、聚丙烯酸、卡波姆、透明质酸钠、壳聚糖、环糊精、聚半乳糖酸、尼龙、聚氨酯、木聚糖、黄原胶、结冷胶、聚正交酯、羟乙基纤维素、聚乙烯醇(pva),聚乙醇酸(pga)、聚乳酸(pla)、聚己内酯(pcl)和聚四氟乙烯(ptfe)。
在一个或多个实施方案中,可膨胀壳120可以被构造成多层,以将所需特性赋予可膨胀壳120。例如,可将网(例如,金属或聚合物网)作为层并入可膨胀壳120的一部分以获得强度和抗拉伸性,而其它层可并入网或围绕网并入以提供流体屏障和/或允许将可膨胀壳120的边缘密封在一起。
可以设计膨胀的可膨胀壳120的形状,如通过设计用于创建可膨胀壳120的材料模板的形状;通过基于所选材料在膨胀时预期拉伸的量为可膨胀壳120的不同部分选择材料;通过改变可膨胀壳120的不同部分中的材料的厚度来控制不同部分中的材料相对于彼此的拉伸;通过在可膨胀壳120的区域内或周围结合约束机构来抑制这些区域中的膨胀;或通过其他技术;或通过上述任何组合。因而,可膨胀壳120中使用的材料可以基于拉伸度量以及其他特性来选择。在一个或多个实施方案中,材料选择中预期的其他特征可包括顺从性度量、描述材料可承受的压力量(例如,由于可膨胀壳120膨胀期间或可膨胀壳120膨胀之后的压力)的度量、描述如何将材料密封以形成可膨胀壳120的度量或材料所需的其他特性。
在一个或多个实施方案中,膨胀前可膨胀壳120的一部分的周长与膨胀后可膨胀壳120的该部分的周长大致相同;在其他实施方案中,膨胀前的周长可以通过膨胀而增加。在一个或多个实施方案中,膨胀前可膨胀壳120的区域的长度与膨胀后可膨胀壳120的该部分的长度大致相同;在其他实施方案中,膨胀前的长度可以通过膨胀而增加。
在图3a的实施方案中,可膨胀壳120通过设计来构造,以使得在膨胀时,保持区130具有近似长度l1和非均匀高度(例如,范围在高度h1和高度h2之间的高度)。
如图3a中的实施方案所示,可膨胀壳120可以是对称的,使得在可膨胀壳120膨胀时,头部区122的形状可以相对于中心轴线a-a′镜像尾部区124的形状;在其他实施方案中,可膨胀壳120可以在膨胀之前和/或之后是不对称的。此外,在一个或多个实施方案中,可膨胀壳120可以围绕x轴对称或不对称。
在图3b的实施方案中,可膨胀壳120包括在头部区322和尾部区324之间具有近似长度l2的保持区330。图3b中的保持区330的长度l2比图3a中的保持区130的长度l1长。保持区330的较长的长度可提供更大的区域,在该区域中设置有更多的成型组合物(例如,用于每个可摄入装置100的更高递送剂量),或提供更大尺寸的成型组合物,或暴露于成型组合物的递送位置的较大表面积(例如,用于提高治疗剂转运的速率或功效)。
在一个或多个其他实施方案中,保持区330的设计长度可以缩短,以使得可膨胀壳120的更多材料可以用于在头部区322和/或尾部区324处沿x轴膨胀和/或沿y-z方向膨胀(例如,在目标递送位置处适应胃肠道的一系列直径,或改进可膨胀壳120与目标递送位置处胃肠道内壁的配合,以改进对消化物质的屏障)。
在图3c的实施方案中,可膨胀壳120被构造成使得头部区332和尾部区334之间的保持区340在膨胀时具有均匀的设计高度h3。保持区340的均匀高度可以提供更稳定的表面,在组装过程中在该表面上附着有或以其他方式附着有成型组合物,如果适用的话,以及其他优点。
在图3d的实施方案中,可膨胀壳120被构造成使得保持区350的一部分膨胀到高度h4,该高度h4小于尾部区344的高度h5但大于图3a所示实施方案的高度h1。以这种方式,在相对于图1a中的实施方案使可膨胀壳120膨胀时,保持区350可更接近递送位置(例如,小肠壁),从而使成型组合物160更接近递送位置,这有助于在一个或多个实施方案中递送成型组合物160。
在图3e的实施方案中,可膨胀壳120被构造成使得当可膨胀壳120膨胀时,头部区352和尾部区354相对于保持区360中的轴线b-b'不对称。在一个或多个实施方案中,另外或替代地,头部区352和/或尾部区354可以相对于x轴不对称。
在图3f的实施方案中,可膨胀壳120被构造成包括头部区362和尾部区364之间的中间区域366。保持区370位于限定在头部区362和中部区域366之间的保护凹部中,并且保持区371位于限定在中部区域366和尾部区364之间的保护凹部中。
在图3g的实施方案中,可膨胀壳120被构造成包括头部区372、尾部区374以及位于头部区372和尾部区374之间的两个中间区376、378。头部区372、两个中间区376、378和尾部区374共同限定了三个保护凹部,其中三个保持区380、381、382位于其中。
多个保持区(例如,多个保持区370、371或多个保持区380、381、382)可用于同时递送多个治疗剂。例如,第一保持区可以包括具有第一治疗剂的成型组合物,第二保持区可以包括具有第二治疗剂的成型组合物,等等。又例如,不同的保持区可包括具有类似或不同形式的相同治疗剂。多个保持区可提供分阶段给药,如通过提供在不同保持区中具有不同降解速率的成型组合物。由于可摄入装置100内可包含的成型组合物的数量增加,多个保持区可用于递送更高剂量的成型组合物。多个保持区可用于递送在不同保持区域内的不同类型的成型组合物或在不同区域内的成型组合物的不同组合。
多个区域(例如,多个保持区370、371或多个保持区380、381、382)可提供对递送装置通过胃肠道的运动的适应,以响应胃肠道内的蠕动动作。例如,第一制剂可设置在第一保持区中以在递送位置处(其可以是可摄入装置100通过蠕动作用移动时胃肠道的一段)准备胃肠道,并且第二制剂可设置在第二保持区中,其通过蠕动,随后到达递送位置,使得胃肠道可由第一制剂制备并且治疗剂在第二制剂中递送。可选地或另外地,可连续摄入多个可摄入装置(例如,两个可摄入装置100)。例如,当第一可摄入装置通过蠕动移动时,第一可摄入装置沿着胃肠道的第一段递送第一制剂;当第二可摄入装置通过蠕动移动时,第二可摄入装置沿着胃肠道的第二段递送第二制剂;第二段与第一段重叠。在使用多个可摄入装置的此类治疗方案中,任何可摄入装置的制剂可以是治疗制剂、增强制剂或治疗制剂与增强制剂的组合。
图4a和图4b示出了当可膨胀壳120中使用的材料可拉伸时可用于控制可膨胀壳120的膨胀形状的技术的实施方案。
在图4a的实施方案中,可膨胀壳120被构造为在不同区域中具有不同厚度。在沿可膨胀壳120的长度的横截面中示出了可膨胀壳120,以暴露不同的厚度。截面厚度越大,该截面的刚度越大,因此拉伸阻力越大。
在图4a中,保持区130包括厚度t1。保持区130的厚度t1大于头部区122和尾部区124的厚度t2。因此,在本实施方案中,保持区130的更大厚度使得保持区130比头部区122和尾部区124更刚硬,进而使得头部区122和尾部区124在可膨胀壳120膨胀期间拉伸得更多。此外,可膨胀壳120可包括在隔离屏障140处或附近的厚度t3,以及在密封件150处或附近的厚度t4。将可膨胀壳120构造成包括在隔离屏障140和/或密封件150处或其附近的更大厚度可以起到在膨胀期间或在膨胀状态下限制在各个隔离屏障140和/或密封件150处经历的应变的作用。
在一个或多个实施方案中,可在可膨胀壳120的不同侧向(沿x轴)部分向基材周向地添加材料,其中添加的材料通过厚度或材料各自的拉伸特性来增加刚度。在一个或多个实施方案中,不同的材料可以沿着可膨胀壳120的不同侧向部分形成可膨胀壳120,并连接在一起(例如,通过粘合剂、热连接或振动连接),其中一种或多种材料的厚度或拉伸性能与其他材料不同。在一个或多个实施方案中,通过沿可膨胀壳120改变单个材料的厚度来控制膨胀。还设想到其它实施方案,如前述两个或更多个的组合。
在一个或多个实施方案中,可膨胀壳120的厚度可以通过例如注射模具的设计来改变,或者通过以受控的方式增加厚度,例如通过沿可膨胀壳120在所需位置浸渍、滴落或喷涂材料至所需厚度来改变,或前述的组合。
如上所述,除了通过材料厚度来控制膨胀之外或替代地,还可以在需要的位置使用约束结构来限制可膨胀壳120的膨胀。
在图4b的实施方案中,递送机构102包括约束结构436,以防止或限制保持区430在可膨胀壳120膨胀期间相对于头部区422和尾部区424的膨胀,并且还包括邻近隔离屏障140(在一侧或两侧)和/或在隔离屏障140下方的约束结构438和邻近密封件150(在一侧或两侧)和/或在密封件150下方的约束结构439。约束结构436、438或439可由任何类型的合成或天然材料形成,其可穿过人体并提供对可膨胀壳120膨胀的阻力(例如,聚合物)。可膨胀壳120的膨胀量可由若干因素来调控。例如,可膨胀壳120的膨胀量可由约束结构436、438或439相对于可膨胀壳120的尺寸(例如,相应约束结构436、438或439的内圆周相对于可膨胀壳120的外圆周)和相应约束结构436、438、439的机械性能(例如,刚性)来调控。图4b的约束结构436、约束结构438和约束结构439可以分别执行与图4a的厚度t1、厚度t3和厚度t4相同或类似的功能。
在一个或多个实施方案中,约束结构436、438或439可附接或以其他方式附接至可膨胀壳120(例如,通过粘合剂)。
在一个或多个其他实施方案中,约束结构(例如,约束结构436、438或439)嵌入在形成可膨胀壳120的材料内(或材料层之间)。
在一个或多个实施方案中,约束结构可以是成型组合物,该成型组合物的形状被构造为围绕可膨胀壳120(例如,参见图4c中的图示和相关讨论)。这种成型组合物约束结构可附加地或替代地用于其它形式的成型组合物。
可以使用多个成型组合物约束结构或一个或多个成型组合物约束结构以及一个或多个其他类型的约束结构组合形成多个保持区(例如,图3f中的多个保持区370、371或图3g中的多个保持区380、381、382),其中成型组合物约束结构可附加地或替代地用于其它形式的成型组合物(例如,成型组合物160、860、870、880、890、895或其它成型组合物)。
图4c是根据一个实施方案的沿着图4b中的线c-c'指示的平面的可膨胀壳120的放大截面图。在图4c所示的实施方案中,约束结构436在包围可膨胀壳120的横截面中具有环形形状。设想到用于约束结构436、438或439的其他横截面形状(例如,矩形横截面,或横截面中具有多个对称或不对称侧的其他形状)。约束结构可以具有沿其长度的基本上均匀的横截面形状和尺寸,或者可以具有沿其长度变化的横截面形状和/或尺寸。
在一个或多个实施方案中,可膨胀壳120的一部分或全部被制造为沿着片材具有不同材料和/或不同厚度的片材;然后片材在相对侧上接合,并且任选地接合到附加组件以形成可膨胀壳120。在其它实施方案中,材料被设置在形成结构周围,以使得材料内部具有中空区域,并且该材料可以是可膨胀壳120,或者该材料可以连接到附加组件,或者可以被包覆,以形成可膨胀壳120。在又一实施方案中,可膨胀壳120是管,该管可在制造时封闭一端,或者在制造期间密封,或者由诸如密封件150的机构封闭。在这样的实施方案中,例如,递送装置102的制造可以通过切割一段管子到所需的尺寸开始,任选地在一端密封管子的切割部分,并且任选地增加材料厚度或约束结构来控制膨胀。
现在讨论回到关于图1a介绍的其他特征的实施方案。
图5a示出了图1a的递送机构102。如上所述,隔离屏障140充当可膨胀壳120的相邻分割部分之间的屏障。在一个或多个实施方案中,隔离屏障140通过夹紧可膨胀壳120的壁或以其他方式将可膨胀壳120的壁压缩在一起来充当屏障,以在分割部分之间形成密封。这种隔离屏障140可以包括单个隔离屏障主体或多个隔离屏障部。
图5b是沿图5a中的线d-d'指示的平面的隔离屏障140的实施方案的放大截面图。如图5b的实施方案所示,隔离屏障140包括多个隔离屏障部,即第一隔离屏障部542和第二隔离屏障部544。第一分离障壁部542和第二分离障壁部544可以相对彼此确定尺寸和定位,以夹紧或以其他方式压缩可膨胀壳120的外壁,从而使可膨胀壳的内壁在可膨胀壳120壳内的分离区域之间产生和形成密封。
隔离屏障140可被构造为在暴露于消化物质时降解。在摄入可摄入装置100之后,但在外壳110充分降解以允许消化物质突破外壳110的内部区域之前,隔离屏障140被构造为维持其完整性并维持分离区域(例如,含有化学反应物,如适用的话)之间的密封。在外壳110充分降解以允许消化物质突破外壳110的内部区域之后,可摄入装置100的部件(包括隔离屏障140)暴露于消化物质。因此,隔离屏障140可在暴露于消化物质时开始降解。
在隔离屏障140的一个或多个部件完全降解之前,隔离屏障140形成的密封可能会受损。例如,隔离屏障140可减弱,并且一旦减弱,隔离屏障的一个或多个部件可不再保持密封,从而导致可膨胀壳120内的一个或多个化学反应物(例如,碳酸氢钾和柠檬酸)混合并发生化学反应以在可膨胀壳120内产生溶液(例如,泡腾溶液)。
图6a再次示出了作为讨论密封件150的实施方案的基础的图1a的递送机构102。如上所述,密封件150在可膨胀壳120的内部和外部之间提供屏障,以防止可膨胀壳120内的气体逸出,和/或防止消化物质进入可膨胀壳120的内部。密封件150的实施方案包括但不限于夹持结构(例如,如图6b所示)和塞结构(例如,如图7a-7c所示)。在将密封件150与递送机构102结合之前,可膨胀壳120的开口可提供进入可膨胀壳120的内部区域的通道,例如向内部区域提供递送机构(例如,引起所需膨胀效果的化学反应物)。
图6b是沿图6a中的线e-e'所指示的平面的密封件150的一个实施方案的放大截面图。在图6b所示的实施方案中,密封件150通过夹紧或以其他方式压缩可膨胀壳120的外壁来提供屏障,以使可膨胀壳120的内壁在可膨胀壳120的开口处或其附近形成密封。
如图6b的实施方案所示,密封件150包括多个密封部,即第一密封部652和第二密封部654。第一密封部652和第二密封部654可相对彼此地确定尺寸和定位,以夹紧或以其他方式压缩可膨胀壳120的外壁,从而使可膨胀壳120的内壁在可膨胀壳120的开口处或其附近在可膨胀壳120的内部和外部之间提供屏障。
密封件150可被构造为在暴露于消化物质时降解。在摄入可摄入装置100之后,但在外壳110充分降解以允许消化物质突破外壳110的内部区域之前,密封件150被构造为保持其完整性并保持可膨胀壳120的内部和外部之间的屏障。在外壳110充分降解以允许消化物质突破外壳110的内部区域之后,可摄入装置的部件(包括密封件150)暴露于消化物质。因此,密封件150可在暴露于消化物质时开始降解。
密封件150的降解速率可以慢于隔离屏障140的降解速率。在一个或多个实施方案中,可以选择性地构造密封件150和隔离屏障140之间的降解速率之间的差异以实现期望的结果。例如,在一个或多个实施方案中,隔离屏障140首先分离(例如,由于降解),以使得由隔离屏障140分离的化学反应物可以相遇并发生化学反应,并且密封件150随后可以分离(例如,由于降解)以从可膨胀壳120释放气体。为了延长可膨胀壳120的膨胀状态来促进递送成型组合物160中的治疗剂,密封件150可被构造为在隔离屏障140的完整性已被破坏并且成型组合物160降解之后在一段时间内保持可膨胀壳120内的压力。
在密封件150的一个或多个部件完全降解之前,由密封件150形成的密封可能受损。例如,密封件150可能减弱,并且一旦减弱,密封件150的一个或多个部件可能不再充分接合以维持可膨胀壳120的内部和外部之间的屏障,从而在一个或多个实施方案中允许化学反应的副产物(例如,气体)从可膨胀壳120的开口释放,从而使可膨胀壳120放气。
图6c示出了带有多个密封件的递送机构102的实施方案,这些密封件封闭可膨胀壳120中的多个相应开口。在图6c所示的实施方案中,密封件150封闭位于尾部区624中的可膨胀壳120的端部的开口151以形成体积部分670,密封件660封闭位于头部区622中的可膨胀壳120的开口661以形成体积部分672。
图7a、图7b和图7c示出了在横截面上分别呈塞子700、塞子710和塞子720的形式的用于可膨胀壳120的密封件150的各种实施方案。
在图7a的实施方案中,塞子700插入可膨胀壳120的开口中,并通过压缩配合保持在适当位置。在图7b的实施方案中,塞子710包括部分围绕塞子710的周界延伸或完全围绕塞子710的周界延伸的保持特征712(例如,凸缘)。保持特征712提供额外的支撑以抵抗当处于膨胀状态时由可膨胀壳120内的压力施加在塞710上的力。在图7b的图示中,保持特征712与可膨胀壳120中的相应凹口对齐;在实施方式中,保持特征712与制造公差内的相应凹口对齐。在一个或多个实施方案中,可膨胀壳120不包括相应的凹口,并且保持特征712被构造为抵靠可膨胀壳120配合,或者被构造为在可膨胀壳120内折叠以进行压缩配合。在图7c的实施方案中,塞子720包括切口722。切口722的尺寸可以被设计为调节暴露于消化物质的塞子720的表面积的量,这可以减少塞子720暴露于消化物质之后被接合的设计时间。
在图7a-7c的每个实施方案和密封件150的其他塞子实施方案中,塞子在可膨胀壳120的开口中提供流体屏障并持续设计时间。
在一个或多个实施方案中,密封件150可以组合包括一个或多个夹紧阀(例如,如图6b所示)和一个或多个塞子(例如,图7a、7b或7c所示的一个或多个)。
如上所述,可摄入装置100可包括附接到可膨胀壳120的保持区130的一个或多个成型组合物160。在可摄入装置100的外壳110充分降解以允许消化物质突破外壳110的内部之后,可摄入装置100的部件(包括成型组合物160)暴露于消化物质。
图8a-8e在横截面中示出了成型组合物160的许多实施方案中的一些。在图8a-8e的图示中,示出并讨论了成型组合物160包括单个治疗剂或治疗制剂(为简单起见,关于这些图指示为治疗剂862)和/或单个递送增强剂或增强制剂(为简单起见,,关于这些图指示为递送增强剂864),以便于说明和讨论。如上所述,成型组合物160可包括一种或多种治疗剂和/或一种或多种递送增强剂,每种被单独地设置或包括在治疗制剂或增强制剂(如适用的话)中,或组合地设置(例如,在预混合制剂中,或在设置后允许混合),和/或成型组合物160可包括一种或多种治疗制剂和/或一种或多种增强制剂。以上提供了治疗剂和递送增强剂的示例。
图8a示出了包括治疗剂862、递送增强剂864和可降解溶衣866的成型组合物860的实施方案。
在一个或多个实施方案中,可摄入装置100将成型组合物860递送到肠道(例如小肠)。在这些实施方案中,递送增强剂864可包括渗透增强剂以提高治疗剂862在肠道壁处的生物利用度。例如,渗透增强剂可通过在递送位置处或附近使肠道上皮的细胞(例如,质膜)表面液化或脱落来提高治疗剂862在肠道壁处的生物利用度。在一个或多个实施方案中,递送增强剂864包括由渗透增强剂层覆盖的酶阻断层。
可降解溶衣866可完全或部分包裹递送增强剂864。可降解溶衣866可包括一层以减少或防止成型组合物860在目标递送位置以外的环境中的降解(例如,肠溶衣);该层可被构造为通过选择该层的化学成分和/或通过选择该层的厚度来减少或防止降解。另外或可替代地,例如通过选择可降解溶衣866的化学成分或厚度,可针对目标递送位置的预期环境设计可降解溶衣866的降解速率。
在一个或多个实施方案中,可降解溶衣866在设计的时间段后或以设计的降解率降解,使得当可膨胀壳120膨胀和/或可膨胀壳120位于递送位置(例如,目标递送位置)或其附近时,递送增强剂864和治疗剂862可被释放。例如,在这些实施方案中,设计的时间段可以大于可降解溶衣866开始暴露于消化物质的时间与可膨胀壳120的头部区122和尾部区124膨胀的时间之间的预期时间段。在一个或多个实施方案中,设计的时间可以高达约一分钟,尽管可以选择更短或更长的时间以适应相关联的可摄入设备100的特性。
图8a示出了治疗剂862、递送增强剂864和可降解溶衣866彼此的同心结构。也可采用其他实施方案,包括图8b-8e所示的实施方案。
在图8b中,成型组合物870包括治疗剂862和递送增强剂864作为共驻物(例如,组合或混合)并由可降解溶衣867包裹。
在图8c中,成型组合物880包括由可降解溶衣868包裹的治疗剂862,但不包括递送增强剂864。在图8d中,成型组合物890包括由可降解溶衣869包裹的递送增强剂864,但不包括治疗剂862。
在一个或多个实施方案中,递送增强剂864被设计为在治疗剂862之前释放,以便增强肠壁的膜渗透性和治疗剂862的最终生物利用度。在一个或多个实施方案中,可摄入装置100包括一个或多个成型组合物880(图8c)和一个或多个成型组合物890(图8d),其中成型组合物890的可降解溶衣869可被构造为以比成型组合物880的可降解溶衣868更快的速率降解。此外,成型组合物880的可降解溶衣868可被构造为在从成型组合物890的递送增强剂864降解开始的选定时间段之后降解。在这样的示例中,所选择的时间段可以包括大约1到5分钟的范围,尽管更短或更长的时间也在本发明的范围内。
在成型组合物(例如,成型组合物860、870、880、890)的一个或多个实施方案中,可以省略可降解溶衣(例如,分别为可降解溶衣866、867、868、869)。
在图8e中,成型组合物895包括邻近递送增强剂864设置的治疗剂862,以及至少在治疗剂862上的溶衣896,以与递送增强剂864相比延迟释放治疗剂862。在一个或多个实施方案中,溶衣896是可降解的,以在成型组合物895暴露于目标递送位置处的环境后于设计时间段后释放治疗剂862;在其它实施方案中,溶衣896被构造为抵抗降解,以使得必须在治疗剂862暴露于目标递送位置处的环境之前部分或大部分地从成型组合物895中释放递送增强剂864。在成型组合物(例如,成型组合物895)的一个或多个实施方案中,可添加可降解溶衣。
从图8a-8e的示例中可以看出,对于成型组合物有许多可能的构造,并且成型组合物的期望特性可通过设计并入,例如:溶衣厚度;治疗剂(或治疗制剂)、递送增强剂(或增强制剂)以及溶衣相对于彼此的相对位置;包含治疗剂或治疗制剂、递送增强剂或增强制剂和溶衣的更多或更少实例;选择一层或多层可降解溶衣,每层具有选择的特性;选择可降解溶衣或其层的化学成分;选择增强制剂中包含的药剂;选择作为治疗制剂的一部分被包含的赋形剂;和/或选择治疗剂的体积或质量;以及许多其他属性。
可摄入装置100可包括多个成型组合物(例如,成型组合物860、870、880、890和/或895中的一个或多个)。在包括多种成型组合物的实施方案中,可摄入装置100可包括任意数量和任意组合的成型组合物。例如,可摄入装置100可包括任意数目和任意组合的成型组合物860、870、880、890和/或895或其它成型组合物。
成型组合物可以是颗粒的形式。例如,成型组合物860、870、880、890或895中的一个或多个可以描述颗粒,并且多个这样的颗粒可以单独包括在可摄入装置100内,或者多个这样的颗粒可以被可降解溶衣包裹以形成填充颗粒的成型组合物。
尽管成型组合物860、870、880、890和895在相应的图8a-8e中被示为相对于彼此具有相似的形状和尺寸,但这样的说明是非限制性的,并且不同成型组合物可以具有不同的形状、不同的尺寸和/或不同的组成剂。另外,治疗剂(或治疗制剂)与递送增强剂(或增强制剂)的体积比或质量比可在不同成型组合物之间变化,治疗剂(或治疗制剂)与可降解溶衣的体积比或质量比可在不同成型组合物之间变化,且递送增强剂(或增强制剂)与可降解溶衣的体积比或质量比可在不同成型组合物之间变化。
图9a、图9b和图9c示出了附接或以其他方式附着到保持区130的多种成型组合物160(例如,成型组合物860、870、880、890或895)的构造。例如,成型组合物160可在保持区130上以并排配置布置(例如,图9a),和/或成型组合物160可围绕保持区130的周长径向地附接或以其他方式附着(例如,图9b)。图9c是根据一实施方案的沿图9b中的线f-f′指示的平面的放大截面图,示出了围绕保持区130的四个成型组合物160的径向布置的示例。
图10a-10e、图11a-11d和图12a-12d中示出了符合本发明所述构思的三种原型设计。
在图10a中,管1010(可膨胀壳的实施方案)由柔性和可拉伸材料制成,如硅酮或含硅酮的材料。管1010包括开口1020。
在图10b中,第一化学反应物1030被设置到管1010中(通过开口1020),并且通过隔离屏障1040(例如,如上关于隔离屏障140所述)与管1010的其余部分隔离。在一个或多个实施方案中,第一化学反应物1030为柠檬酸。细长环形的成型组合物1050被定位于管1010周围。成型组合物1050包含由一层或多层其它材料覆盖的治疗制剂。在一个或多个实施方案中,成型组合物1050包含被渗透增强剂覆盖的治疗制剂,渗透增强剂又被酶阻断剂覆盖。如果预期到管1010的膨胀(例如,图10d)将在成型组合物1050的内表面和管1010的材料之间形成防止流体进入的密封,则成型组合物1050的治疗制剂可以沿着环形的成型组合物1050的内表面暴露于管1010。否则,治疗制剂可由一层覆盖,如渗透增强剂层和酶阻滞剂层中的一者或两者,或例如保护层,其最小化、减少或防止治疗制剂的降解,直到其从渗透增强剂层和酶阻断剂层暴露。
在图10c中,第二化学反应物1060被设置到管1010中(通过开口1020),并且管1010被塞子1070封闭和密封(例如,密封件150的实施方案,例如但不限于比如分别在图7a、7b、7c中的塞子700、710、720)。在一个或多个实施方案中,第二化学反应物1060为碳酸氢钾。将管1010(具有塞子1070、隔离屏障1040、成型组合物1050、第一化学反应物1030和第二化学反应物1060)折叠并沉积在外壳(例如外壳110)(未示出)中以形成可摄入装置。在一个或多个实施方案中,外壳包括胶囊。在一个或多个实施方案中,外壳是涂覆在管1010、塞子1070、隔离屏障1040和成型组合物1050上的溶衣。
在图10d中,示出了在外壳已经充分降解以使流体到达隔离屏障1040之后以及在隔离屏障1040已经充分降解以使第一化学反应物1030绕过先前由隔离屏障1040形成的密封并且与第二化学反应物1060结合以在管1010内形成气体(例如,包括二氧化碳)并且由此膨胀管1010之后,管1010处于第一膨胀状态。管1010在膨胀时限定了保护凹部1080。在原位,保护凹部1080由胃肠道壁界定,如由指示递送位置处的胃肠道壁的内表面的虚线1090所示。
在图10e中,示出了在成型组合物1050已基本降解后管1010处于第二膨胀状态。塞子1070尚未被充分降解到足以允许管1010内的气体绕过塞子1070进入胃肠道。塞子1070被设计为在成型组合物1050已经基本降解之后降解。例如,成型组合物1050可被设计为在初始暴露于流体后在少于5分钟的时间内降解,而塞子1070可被设计为在10到20分钟内保持塞子1070提供的密封的完整性。在塞子1070降解到不再保持密封的点之后,管1010能够放气并穿过和离开胃肠道。
在图11a中,气囊1110(可膨胀壳的一个实施方案)由柔性和不可拉伸或相当不可拉伸的材料制成,例如聚乙烯,以使得当气囊1110充气时其周长增加很少(例如,小于15%、小于10%或小于5%)。气囊1110由围绕气囊1110周界的一部分密封在一起的两个形状相似的材料层形成,例如密封在一起的两个不同的材料片(并且在密封之前、期间或之后切割成形),或者折叠并密封的一个材料片(并且在密封之前、期间或之后切割成形)。在一个或多个实施方案中,通过使用热刀切割气囊1110的形状的周界来执行层的一起密封。在一个或多个其它实施方案中,通过使用热和压缩将材料密封在一起来执行材料的密封。在其它实施方案中,粘合剂被定位于材料层之间以实现密封。气囊1110限定开口1120。
在图11b中,第一化学反应物被设置(通过开口1120)到由气囊1110限定的袋1130中,并且通过隔离屏障1140(例如,如上关于隔离屏障140所述)与气囊1110的其余部分隔离。在一个或多个实施方案中,第一化学反应物为柠檬酸。圆柱形的成型组合物1150在保护凹部1180中被定位于气囊1110上。成型组合物1150包括由一层或多层其它材料覆盖的治疗制剂。在一个或多个实施方案中,成型组合物1150包含由渗透增强剂覆盖的治疗制剂,渗透增强剂又由酶阻断剂覆盖。酶阻断剂层可被保护层覆盖。将第二化学反应物(通过开口1120)设置到气囊1110中,气囊1110由塞子1170(例如,密封件150的实施方案,例如但不限于比如分别在图7a、7b、7c中的塞子700、710、720)闭合和密封。在一个或多个实施方案中,第二化学反应物为碳酸氢钾。将气囊1110(具有塞子1170、隔离屏障1140、成型组合物1150、第一化学反应物和第二化学反应物)折叠并沉积在外壳(例如,外壳110)(未示出)中以形成可摄入装置。在一个或多个实施方案中,外壳包括胶囊。在一个或多个实施方案中,外壳是涂覆在气囊1110、塞子1120、隔离屏障1140和成型组合物1150上的溶衣。在外壳已经充分降解以使流体到达隔离屏障1140之后,并且在隔离屏障1140已经充分降解以使第一化学反应物绕过先前由隔离屏障1140形成的密封并且与第二化学反应物结合以在气囊1110内部形成气体(例如,包括二氧化碳)之后,气囊1110膨胀。因为用于形成气囊1110的材料相对不可拉伸,所以当气囊1110膨胀时,气囊1110的周长几乎没有膨胀。在原位,保护凹部1180由胃肠道壁限定,例如由指示递送位置处的胃肠道壁的内表面的虚线1190所示。
在图11c中,从端视图示出了气囊1100膨胀之前的气囊1110的实施方案和成型组合物1150的实施方案(从由线g-g'指示的视角)。在本实施方案中,成型组合物1150为圆柱形。
在图11d中,从端视图(从线g-g'指示的视角)示出了在气囊1100膨胀之后的气囊1110。成型组合物1150不再可见,因为气囊1100已膨胀以接触胃肠道壁的内表面(由虚线1190指示)以形成保护凹部1180。
塞子1170被设计成在成型组合物1150已经基本降解之后降解。例如,成型组合物1150可被设计成在初始暴露于流体后十分钟内降解,而塞子1170可被设计成在十五到二十分钟内保持塞子1170提供的密封的完整性。在塞子1170降解到不再保持密封的点之后,气囊1110能够放气并穿过和离开胃肠道。
在图12a中,气囊1210(可膨胀壳的一个实施方案)由柔性和不可拉伸或相当不可拉伸的材料制成,例如聚乙烯,以使得在气囊1210充气时气囊1210的周长增加很少(例如,小于15%、小于10%,或小于5%)。气囊1210由围绕气囊1210的周界的一部分密封在一起的两个形状相似的材料层形成,例如密封在一起的两个不同的材料片(并且在密封之前、期间或之后切割成形),或者折叠并密封的一个材料片(并且在密封之前、期间或之后切割成形)。在一个或多个实施方案中,通过使用热刀切割气囊1210的形状的周界来将层密封在一起。在一个或多个其它实施方案中,通过使用热和压缩将材料密封在一起来执行材料的密封。在其它实施方案中,粘合剂被定位于材料层之间以实现密封。气囊1210限定开口1220。
在图12b中,第一化学反应物(通过开口1220)被设置到由气囊1210限定的袋1230中,并且通过隔离屏障1240(例如,如上关于隔离屏障140所述)与气囊1210的其余部分隔离。在一个或多个实施方案中,第一化学反应物为柠檬酸。环形形状的成型组合物1250在保护凹部1280中被定位在气囊1210周围。成型组合物1250包含由一层或多层其它材料覆盖的治疗制剂。在一个或多个实施方案中,成型组合物1250包含被渗透增强剂覆盖的治疗制剂,渗透增强剂又被酶阻断剂覆盖。酶阻断剂层可被保护层覆盖。将第二化学反应物(通过开口1220)设置到气囊1210中,并且气囊1210由塞子1270(例如,密封件150的实施方案,例如但不限于比如分别在图7a、7b、7c中的塞子700、710、720)封闭和密封。在一个或多个实施方案中,第二化学反应物为碳酸氢钾。将气囊1210(具有塞子1270、隔离屏障1240、成型组合物1250、第一化学反应物和第二化学反应物)折叠并沉积在外壳(例如,外壳110)(未示出)中以形成可摄入装置。在一个或多个实施方案中,外壳包括胶囊。在一个或多个实施方案中,外壳是涂覆在气囊1210、塞子1270、隔离屏障1240和成型组合物1250上的溶衣。在外壳已经充分降解以使流体到达隔离屏障1240,并且在隔离屏障1240已经充分降解以使第一化学反应物绕过先前由隔离屏障1240形成的密封并且与第二化学反应物结合以在气囊1210内部形成气体(例如,包括二氧化碳)之后,气囊1210膨胀。因为用于形成气囊1210的材料相对不可拉伸,所以如上所述,当气囊1210膨胀时,气囊1210的周长几乎没有膨胀。在原位,保护凹部1280由胃肠道壁限定,例如由指示递送位置处的胃肠道壁的内表面的虚线1290所示。
在图12c中,从端视图(从由线h-h'指示的视角)示出了气囊1200膨胀之前的气囊1210的实施方案和成型组合物1250的实施方案。
在图12d中,从端视图(从由线h-h'指示的视角)示出了气囊1200膨胀之后的气囊1210。成型组合物1250不再可见,因为气囊1200已膨胀以接触胃肠道壁的内表面(由虚线1290指示)以形成保护凹部1280。
塞子1270被设计成在成型组合物1250已经基本降解之后降解。例如,成型组合物1250可被设计成在初始暴露于流体后十分钟内降解,而塞子1270可被设计成在十五到二十分钟内保持塞子1270提供的密封的完整性。当塞子1270降解到不再保持密封的点后,气囊1210能够放气并通过和离开胃肠道。
管1010、气囊1110或气囊1210内的压力足以将管1010、气囊1110或气囊1210压在胃肠道壁上。
在一个或多个实施方案中,可膨胀壳内的压力被设计为峰值为每平方英寸20磅(psi)或更小。试验表明,可膨胀壳内的压力保持在20psi以下,外壳的周长略微膨胀(例如,小于百分之五十,小于百分之二十,小于百分之十五,或小于百分之十)大于胃肠道内周长,大型哺乳动物(例如狗、猪、人)对此感觉不到。在各种原型中,压力保持在大约2psi,直到可膨胀壳放气。
气囊1110(图11a-11d)和气囊1210(图12a-12d)可使用比管1010(图10a-10e)更小体积或质量的第一化学反应物和第二化学反应物,因为管1010的可拉伸性质可导致管1010比气囊1110和气囊1210的内部体积大的内部体积。因此,为了保持期望的压力,在管1010中可能需要相对更多的反应物。
在各种原型中,可膨胀壳的周长在膨胀时约为8厘米。在其他原型中,可膨胀壳的周长小于约10厘米、小于约9厘米或小于约8厘米。
图13是用于制造可摄入装置的方法的实施方案,如上述可摄入装置的示例。
在1300处,可摄入装置(例如,可摄入装置100)的可膨胀壳(例如,可膨胀壳120)可被构造为可原位触发,以使可膨胀壳的头部区(例如,头部区122)和尾部区(例如,尾部区124)中的每一个膨胀到膨胀状态。可膨胀壳可包括至少一个开口。可膨胀壳的开口可提供进入可膨胀壳内部的通道,通过该通道可向可膨胀壳的内部供应一个或多个膨胀机构(例如,化学反应物)。例如,第一化学反应物(例如碳酸氢钾)可以通过开口供应到可膨胀壳的内部。隔离屏障(例如,隔离屏障140)可封闭可膨胀壳以容纳第一化学反应物。然后,第二化学反应物(例如柠檬酸)可以通过开口供应到可膨胀壳的内部。实际上,隔离屏障将可膨胀壳的内部划分为多个部分(例如,体积部分),并且充当部分之间的屏障,直到可摄入装置接近递送位置。密封件(例如,密封件150)可在开口处或其附近封闭可膨胀壳,并充当可膨胀壳的内部和外部之间的屏障,以防止消化物质进入可膨胀壳的内部,并防止可膨胀壳120的内容物逸出。
隔离屏障和密封件可被构造成在暴露于目标递送位置处的消化物质时降解。在一个或多个实施方案中,隔离屏障可被构造成以比用于密封件的设计降解速率更快的速率降解。例如,当隔离屏障因暴露于消化物质而降解时,隔离屏障不再充当可膨胀壳的相邻部分之间的屏障。因此,每个部分中包含的化学反应物进行化学反应以产生溶液(例如,起泡溶液),其副产品(例如,气体)提供所需的膨胀效果。为了保持可膨胀壳内的压力,密封件保持其结构完整性,以便化学反应的副产物不会从可膨胀壳释放,并且可膨胀壳在一段时间内保持膨胀状态。
可膨胀壳在膨胀时在可膨胀壳的头部区和尾部区之间的保护凹部中包括保持区(例如,保持区130),该保护凹部可保护保持区不受消化物质流的影响。通过设计可膨胀壳的结构或通过在可膨胀壳的内部或外部结合约束结构,可将保持区构造成在处于膨胀状态的情况下具有小于头部区的周长和尾部区的周长的周长。
例如,在设计可膨胀壳的结构时,保持区中的可膨胀壳的厚度可以大于头部区和尾部区中的可膨胀壳的厚度,从而为保持区中的可膨胀壳的拉伸提供更大的阻力。或者,在可膨胀壳的内部或外部结合约束结构时,可膨胀壳可装配有管(例如,圆形、矩形或其他横截面形状,包括沿管的长度横截面不均匀的管)或其他结构(或多个其他结构),以防止或限制保持区内的膨胀。
在1310处,一个或多个成型组合物(例如,成型组合物160)可附接到保持区域。每个成型组合物可以包括一个或多个药剂,如相对于图8a-8e所示和描述的药剂。
成型组合物可以各种布置方式附接或以其他方式附着至保持区。例如,成型组合物可以并排布置(例如,如图9a所示)、径向地围绕保持区130布置(例如,如图9b所示)、堆叠或通过任何其他布置结构或布置结构的组合来布置。
在1320处,作为递送机构(例如,递送机构102)的一部分的可膨胀壳可放置在外壳(例如,外壳110)内。外壳可被构造为包括保护层(例如,肠溶衣),保护层被设计成穿过胃肠道的一部分(例如胃)而留存。此外,外壳可以包括导致外壳以特定方式或顺序降解的一个或多个结构性机构(例如,断裂部218、控制段220等)。
图14是使用诸如上述示例的可摄入装置将治疗剂递送到身体内的方法的实施方案。
在1400处,将可摄入装置(例如,可摄入装置100)提供给受试者(例如,人或其他动物)。在一个或多个实施方案中,可摄入装置由医生提供给受试者,或可摄入装置通过随后被填充的处方提供给受试者;在任一情况下,可摄入装置根据医生指定的指定治疗方案提供。在其他实施方案中,通过非处方购买的方式向受试者提供可摄入装置,且标签上指示有治疗方案。
一旦提供给受试者,可摄入装置可被受试者摄入。在一个或多个实施方案中,可摄入装置被构造为口服摄入并穿过身体的胃肠道。根据调查,由于可摄入装置可口服,因此预期对特定治疗剂的相关治疗方案的依从性将远高于目前对注射形式的相同或类似治疗剂的依从性。
可摄入装置包括一个或多个成型组合物(例如,成型组合物160)和递送机构(例如,递送机构102),该递送机构包括具有头部区、尾部区和位于头部区和尾部区之间的至少一个保持区的可膨胀壳(例如,可膨胀壳120包括头部区122、尾部区124和保持区130)。成型组合物与保持区相邻而设置,并且可以附接到保持区。成型组合物包括一种或多种治疗剂(例如,治疗剂862)和/或一种或多种递送增强剂(例如,递送增强剂864)。
在穿过胃肠道到达递送位置(例如,目标递送位置)期间,可摄入装置在设计上保持基本完整。在一个或多个实施方案中,目标递送位置在小肠内。在一个或多个实施方案中,目标递送位置在空肠内;在此类实施方案中,可摄入装置通过设计保持基本完整,直到进入小肠,其中在可摄入装置到达小肠的空肠部分的设计延迟之后,可摄入装置将所述成型组合物释放到空肠中,如下在1410、1420和1430处所述。
在1410处,相关治疗方案的可摄入装置的结构提供了在目标递送位置处可膨胀壳的膨胀。在一个或多个实施方案中,可膨胀壳被构造成可响应于胃肠道中的状况通过膨胀机构进行膨胀。例如,胃肠道中的状况可包括小肠中的ph值(例如,ph值<7,或ph值在6.5到7.5范围内)。在一个或多个实施方案中,膨胀机制是当通过释放分离化学品的屏障(例如,隔离屏障140)而允许化学品混合时,设置在可膨胀壳中的两个或多个化学品之间的化学反应。
当可膨胀壳膨胀时,头部区和尾部区膨胀以接触递送位置的表面(例如小肠内壁),以最小化或防止消化物质流入在头部区和尾部区之间形成的保护凹部,从而促进成型组合物的释放和有效性。
在一个或多个实施方案中,成型组合物的可降解溶衣(例如,可降解溶衣866、867、868、869或896)被构造为在成型组合物暴露于目标递送位置处的消化物质后,如在可摄入装置的外壳(例如外壳110)充分降解以允许消化物质突破外壳时,在设计的时间段(例如,1分钟、5分钟等)降解并且因此递送治疗剂。这种延迟可允许在治疗剂和/或递送增强剂从成型组合物释放到递送位置之前,完成可膨胀壳的膨胀并由可膨胀壳形成保护凹部。
在1420处,将递送增强剂释放到保护凹部中,在那里它可以保留以增强治疗剂的输送,如上文所述。
在1430处,将治疗剂释放到保护凹部中,在那里它可以保留,直到输送穿过肠壁。
成型组合物可被构造为在治疗剂递送之前、同时或之后释放递送增强剂。此外,可以设计释放顺序(例如,如关于图8a-8e所讨论的)以实现多种治疗剂和/或多种递送增强剂的任何期望的释放顺序。例如,成型组合物可被设计成在释放第一治疗剂之前释放第一递送增强剂,并且在释放第一治疗剂或第二治疗剂之后释放第二递送增强剂。又例如,成型组合物可被设计成释放第一剂量的治疗剂,并且在一定延迟之后释放第二剂量的相同或类似的治疗剂。对于另一示例,成型组合物可被设计成释放第一治疗剂,且在一定延迟后释放不同于第一治疗剂的第二治疗剂。在一个或多个实施方案中,可将多个成型组合物并入可摄入装置中以递送比单个可摄入装置可能更大剂量的治疗剂和/或递送增强剂,或递送不同的治疗剂,或者实现治疗剂和促释剂释放的特定顺序。
在一方面,实施方案提供了一种用于递送治疗制剂的可摄入装置,该可摄入装置包括可吞咽外壳和位于外壳内的递送机构。递送机构包括可膨胀壳。递送机构可在身体的胃肠道内原位触发,以在身体内的递送位置处使可膨胀壳的多个区域膨胀。可膨胀壳的多个区域包括头部区、尾部区和保持区,头部区和尾部区一起限定位于头部区和尾部区之间的保护凹部,且保持区位于保护凹部内。膨胀时的保持区的尺寸小于膨胀时的头部区的尺寸和膨胀时的尾部区的尺寸。该可摄入装置包括设置在保持区处的成型组合物。
在一方面,实施方案提供了一种使用可摄入装置将治疗剂递送到受试者的肠道(或胃肠道的其他部分)的方法。可摄入装置包括成型组合物和递送机构。递送机构包括具有头部区和尾部区的可膨胀壳。成型组合物包括治疗剂和递送增强剂,递送增强剂被选择成用于增强治疗剂输送穿过肠壁。该方法还包括指示或使受试者摄入可摄入装置,从而启动可摄入装置穿过肠,并且随后引发药剂输送穿过肠壁。开始输送是通过递送机构来实现的,递送机构被构造为响应于肠内的状况而使可膨胀壳膨胀,使得可膨胀壳的头部区和尾部区抵靠肠壁膨胀以限定由肠壁原位界定的保护凹部。成型组合物设置在保护凹部内,并且在保护凹部内暴露于肠。将成型组合物暴露于肠引发了将递送增强剂从成型组合物释放到保护凹部中,以增强治疗剂输送穿过肠壁。将成型组合物暴露于肠也引发将治疗剂释放到保护凹部中以输送通过肠壁。
在一方面,实施方案提供了一种用于提供包括治疗剂的成型组合物的方法。该方法包括构造能够在胃肠道的选定部分内触发的递送机构,以使可膨胀壳的头部区和可膨胀壳的尾部区中的每一个膨胀到完全膨胀状态。可膨胀壳包括保持区,该保持区被构造为原位膨胀到小于头部区的相应尺寸和小于尾部区的相应尺寸的尺寸。该方法还包括将成型组合物附接到保持区并将可膨胀壳放置在外壳内。
在一个方面,实施方案提供了用于受试者口服治疗剂的方法。该方法包括摄入包括成型组合物和递送机构的可摄入装置,并提供将治疗剂输送穿过肠壁。递送机构包括具有头部区和尾部区的可膨胀壳。成型组合物包括治疗剂和递送增强剂,递送增强剂用于增强治疗剂输送穿过肠壁。治疗剂输送穿过肠壁是通过以下方式提供的:响应于小肠中的状况使头部区和尾部区膨胀,使得头部区和尾部区抵靠肠壁膨胀以形成用于递送治疗剂的密封的肠段;释放递送增强剂进入密封的肠段,递送增强剂保留在密封的肠段中以增强治疗剂的输送;并将治疗剂释放到密封的肠段,治疗剂保留在密封的肠段中直到治疗剂输送穿过肠壁。
在一个方面,实施方案提供了一种用于患者口服治疗剂的方法,该治疗剂被胃肠道分泌物降解,其中该方法包括吞咽含有成型组合物并进一步包含具有头部和尾部区的可膨胀壳的可摄入装置,成型组合物包括治疗剂和递送增强剂,递送增强剂被构造成增强治疗剂输送穿过肠壁。该方法还包括:响应于肠内的状况使头部区和尾部区膨胀,使得头部区和尾部区形成用于递送治疗剂的密封的肠段;将递送增强剂释放到密封的肠段中,递送增强剂保留在密封的肠段中以增强治疗剂的输送;将治疗剂释放到密封的肠段中,治疗剂保留在密封的肠段中直至输送穿过肠壁;以及将治疗剂输送穿过密封的肠段中的肠壁,其中通过递送增强剂增强输送。
在前述任一方面中,可吞咽外壳可被构造成在目标递送位置存在消化物质时或者在穿过身体到达目标递送位置期间原位降解。
在前述任一方面中,可吞咽外壳的结构可被构造成承受身体的胃内的降解,或在超过可摄入装置进入胃和穿过胃的时间段的时间段内降解。
在前述任一方面中,可吞咽外壳可被构造为在处于6.5和7.5之间的范围内ph值下或在大于7的ph值下降解。
在前述任一方面中,可摄入装置可包括包裹成型组合物的可降解溶衣,且可降解溶衣可被构造为至少在设计时间段内抵抗存在于目标递送位置处的消化物质。
在前述任一方面中,可摄入装置可包括设置在可膨胀壳内的至少一个膨胀机构。
在前述任一方面中,可摄入装置可包括隔离屏障,其中膨胀机构包括第一化学反应物和第二化学反应物,并且第一化学反应物通过隔离屏障与第二化学反应物隔离,并且第一化学反应物和第二化学反应物化学反应物相互反应而生成气体以使可膨胀壳膨胀。隔离屏障可被构造为在暴露于消化物质时原位降解,随后可吞咽外壳的降解足以允许消化物质突破可吞咽外壳的内部区域。第一化学反应物可以包括碳酸氢钾,第二化学反应物可以包括柠檬酸。可摄入装置还可包括密封件,密封件封闭可膨胀壳中的开口,其中,密封件可被构造为在可吞咽外壳降解而足以允许消化物质突破可吞咽外壳的内部区域之后在暴露于消化物质时原位降解,并且密封件的降解速率被设计为低于隔离屏障的降解速率。
在前述任一方面中,可膨胀壳可被构造为与头部区的膨胀或尾部区的膨胀相比,使保持区的膨胀较小。
在前述任一方面中,在可膨胀壳的膨胀状态下,头部区、尾部区和至少一个中部区域一起可限定多个保护凹部。可摄入装置可包括布置在一个或多个保护凹部中的多个成型组合物。多个成型组合物中的每一个可包括一种或多种药剂。多个成型组合物中的至少一个可包括与多个成型组合物中的另一个不同的组合或不同体积或质量的药剂。多个成型组合物中的每种药剂可以是药物、赋形剂或递送增强剂中的一种。
在前述任一方面中,可摄入装置可响应于状况操作以递送制剂。这种状况可以是小肠的ph值。例如,ph值可在约6.5至7.5的范围内。
在前述任一方面中,递送增强剂可包括蛋白酶抑制剂。
在前述任一方面中,递送增强剂可包括渗透增强剂,该渗透增强剂增强小肠壁对治疗剂的渗透性。
在前述任一方面中,递送增强剂可使小肠的上皮层中的细胞质膜液化。
在前述任一方面中,渗透增强剂可包括基于mcfa的癸酸钠、辛酸钠、辛酸钠衍生物、酰基肉碱或edta。
在前述任一方面中,递送增强剂可诱导肠壁的上皮层的细胞脱落。
在前述任一方面中,成型组合物可包括溶衣,该溶衣被构造为在设计时间段后在小肠中降解以使得递送增强剂和治疗剂在设计的时间段后释放到可膨胀壳的保护凹部中。设计的时间段可以大于用于可膨胀壳的头部区和尾部区膨胀的设计时间。
在前述任一方面中,在开始释放递送增强剂后开始释放治疗剂。
在前述任一方面中,递送机构通过化学反应使头部区和尾部区膨胀。
在前述任一方面中,多个成型组合物可置于可摄入装置中,且第一成型组合物中的治疗剂质量为第一质量。成型组合物中的至少第二成型组合物可包含与第一质量不同质量的治疗剂。成型组合物可至少包括第一治疗剂和不同于第一治疗剂的第二治疗剂。成型组合物可包括包含治疗剂的第二成型组合物,其中第一成型组合物可被设计成在暴露于肠之后的第一时间段后释放治疗剂,第二成型组合物可被设计成在暴露于肠之后的第二时间段后释放治疗剂,并且第二时间段可被设计成长于第一时间段。成型组合物可包括一种或多种递送增强剂。
在前述任一方面中,可摄入装置可包括肠溶衣,该肠溶衣被构造为可在暴露于胃中的内容物时耐受降解,且肠溶衣可被构造成在肠中降解。
在前述任一方面中,成型组合物可包括崩解剂或超级崩解剂。
在前述任一方面中,治疗剂可包括免疫球蛋白。免疫球蛋白可以是免疫球蛋白g。免疫球蛋白可以是tnf-α抗体。tnf-α抗体可以是阿达木单抗。免疫球蛋白可以是白介素-17家族中白介素的抗体(ai17抗体)。ai17抗体可以是布罗达单抗、苏金单抗或依克珠单抗。
在前述任一方面中,成型组合物可以是置于保持区的多个成型组合物中的一个。
在前述任一方面中,成型组合物可被构造为限定延伸穿过成型组合物的开口,并且可膨胀壳可被设置成穿过该开口,以使得可膨胀壳的部分在开口的任一侧延伸。在这些实施方案中,成型组合物可以限制可膨胀壳的膨胀;或者,可膨胀壳被构造为沿着限定保持区的可膨胀壳的长度进行最小膨胀,并且成型组合物沿着该长度定位;在任何一种情况下,可另外并入约束结构或其它技术(例如,增加可膨胀壳的一部分的材料厚度)以限制可膨胀壳的膨胀。
结论
从本文的图示和描述可以看出,可摄入装置的实施方案可以提供多种制剂递送选项。例如,在一个或多个实施方案中,根据本发明的构思,可通过可摄入装置递送多达二十毫克的治疗制剂。在其他实施方案中,根据本发明的构思,可通过可摄入装置递送20毫克以上的治疗制剂。在一个或多个实施方案中,成型组合物中存在的治疗制剂的百分比被有效递送,并且剩余的治疗制剂被排出体外。因此,可增加用于可摄入装置中的成型组合物的类型和数量的设计来导致有效的递送。例如,如果希望有效递送二十毫克的治疗制剂,则可摄入装置可被设计为向胃肠道提供一百到两百毫克的治疗制剂,这取决于通过胃肠道壁进入身体的血管化区域的预期吸收率。
如本文所用,术语“基本上”和“大约”用于描述和说明小的变化。例如,当与数值一起使用时,这些术语可指小于或等于±10%的值的变化,例如小于或等于±5%、小于或等于±4%、小于或等于±3%、小于或等于±2%、小于或等于±1%、小于或等于±0.5%、小于或等于±0.1%,或小于或等于±0.05%。
如本文所用,数字范围包括该范围内的任何数字,或者如果子范围中的最小数字和最大数字落在该范围内,则包括任何子范围。因此,例如,“<9”可指小于9的任何数字,或其中子范围的最小值大于或等于零且子范围的最大值小于9的数字的任何子范围。
虽然已经参考本发明的具体实施方案对本发明进行了描述和说明,但这些描述和说明并不限制本发明。可以清楚地理解,可以进行各种改变,并且可以在不脱离由所附权利要求所限定的本发明的真正精神和范围的情况下在实施方案内替换等效部件。此外,来自一个实施方案的元件、特征或动作可以容易地用来自其他实施方案的一个或多个元件、特征或动作来重组或替换,以形成本发明范围内的许多附加实施方案。此外,在各种实施方案中,被示出或描述为与其他元件组合的元件可以作为独立元件存在。此外,对于元件、特性、组成部分、特征、步骤等的任何肯定叙述,本发明的实施方案具体地设想到排除该元件、值、特性、组成部分、特征、步骤等。图示不一定按比例绘制。由于制造过程中的变量等,本公开中的艺术化表现形式与实际装置之间可能存在区别。可能存在未具体说明的本发明的其他实施方案。说明书和附图应视为说明性的,而不是限制性的。可以进行修改以使特定情况、材料、物质组成、方法或过程适应本公开的目的、精神和范围。所有这些修改旨在在所附权利要求的范围内。虽然本文公开的方法已经参考以特定顺序执行的特定操作进行描述,但是可以理解,这些操作可以被组合、细分或重新排序以形成等效的方法,而不脱离本公开的教导。因此,除非在此特别指出,否则操作的顺序和分组不是对本公开的限制。
- 还没有人留言评论。精彩留言会获得点赞!