黏膜粘附性凝胶组合物的制作方法
本发明涉及生物粘附性制剂,更具体来说涉及被配制成用于颊、鼻、阴道和直肠给药的药物。
背景技术:
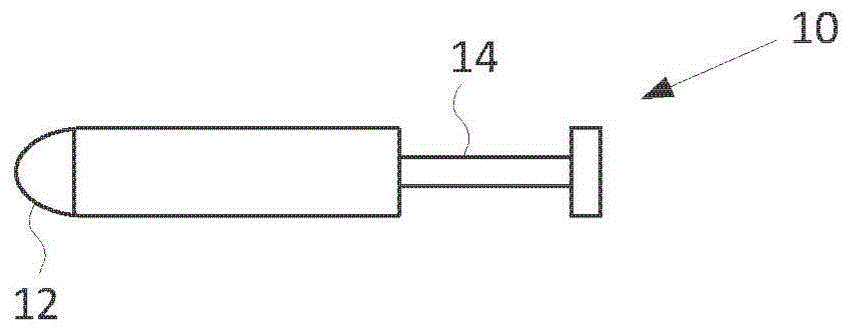
:对于提供安全有效地给药生理活性成分的方法,一直存在着需求。由于方案相对简单,口服给药是一种通常使用的给药方案。然而,大量药物由于它们的低溶解度和对肝脏中首过代谢的敏感性,对于口服递送来说是有问题的。对于此类药物,替代性进入端口是令人关注的,并且由于黏膜组织易于接近且具有较大的表面积,因此黏膜粘附性药物递送系统已成为许多研究和产品开发的主题。经由黏膜组织的药物递送具有优点,例如克服了常规给药途径的缺点,例如药物直接进入系统循环中避免了肝脏首过效应。另外,黏膜药物递送通常是非侵入性的,从而避免了静脉内、肌肉内或皮下递送手段的令人不适的方面。此外,活性物质可以被容易地给药,并且如果需要,可以被容易地从施用部位移除。因此,黏膜药物递送系统在越来越多的药物递送中具有价值。黏膜粘附性药物递送系统在本领域中是已知的,并包括原位形成的水凝胶、糊剂、片剂和薄膜。然而,这些已知的黏膜粘附性药物递送系统主要利用水溶性/水性载体媒介物,因此所述系统具有缺点,即天然体液倾向于从给药部位清除所施用的制剂。例如在口腔中,唾液、黏膜组织的自然置换、进食、饮水和说话运动是限制颊黏膜粘附性药物递送系统的有效性和保留时间的一些问题。因此,已知的产品缺少有效且商业上可接受的药物递送装置的一个或几个优选特征。生物粘附性载体的使用者优选的一些特征包括受控的水蚀性、易于操作和施用到递送/治疗部位以及易于舒适且异物感最小。用于向黏膜表面给药的有效且用户友好的产品的其他优选特征包括在施用后瞬时粘附到黏膜表面,以及增加了用于递送药物组分和/或用于增强吸收的保留时间。因此,对于能够克服本领域中已知的挑战的改进的生物粘附性制剂,仍存在着需求。技术实现要素:因此,本发明的第一方面是提供一种黏膜粘附性凝胶组合物,其可以长期且以高生物利用度提供活性成分的系统性递送,并且其中所述凝胶不是原位形成的。本发明的第二方面是提供一种黏膜粘附性凝胶组合物,其被设置成用于以基本上零级释放曲线提供活性成分的持续递送。本发明的第三方面是提供一种黏膜粘附性凝胶组合物,其基本上不含并且优选地完全不含挥发性药剂、表面活性剂和/或已知引起黏膜刺激的物质。本发明的第四方面是提供一种用于给药所述黏膜粘附性凝胶组合物的给药器,所述给药器易于使用并确保所需量的凝胶组合物被施用到给药部位。根据本发明,这些和其他方面通过提供一种黏膜粘附性凝胶组合物得以实现,所述凝胶组合物包含:-媒介物,所述媒介物包含胶凝剂和生物粘附剂,其中所述胶凝剂占所述凝胶组合物的0.5-30重量%,并且所述生物粘附剂占所述凝胶组合物的1-40重量%;-治疗剂,所述治疗剂占所述凝胶组合物的1-20重量%,并且其中所述治疗剂分散或悬浮在所述媒介物中。已知组合物在黏膜组织上的粘附可以被黏膜纤毛清除系统这种人体对抗杂质在黏膜上的沉积的天然防御机制削弱,并且所述清除可在所需量的药物/治疗剂被递送之前除去所述施用的组合物。由于根据本发明所述的黏膜粘附性凝胶组合物包含生物粘附剂,因此所述凝胶组合物会保留在施用部位处,从而延长了在吸收部位处的保留时间。这将确保所需/足够量的治疗剂在给药部位处被递送,并且相应地减少了药物给药的频率并增加了患者的依从性。所述黏膜粘附性凝胶组合物被设计成施用到颊、鼻、阴道和直肠黏膜并直接透黏膜吸收到系统循环中,从而避免了肝首过代谢。给药部位取决于所述治疗剂。例如,作为在月经周期和维持妊娠中发挥至关重要作用的一种内源性类固醇性激素,孕酮可以优选地通过颊黏膜施用。除了孕酮作为激素的天然作用之外,孕酮还被用作药物。孕酮有时被称为“妊娠激素”,因为它在妊娠的准备和维持中具有许多作用。其中,孕酮将子宫内膜转变到其分泌阶段,使子宫准备好用于植入。但是,子宫内膜向分泌阶段的转化需要高系统性水平的孕酮,这对于不孕治疗来说至关重要,在所述治疗中使子宫内膜准备好用于胚胎植入。治疗雌激素受体/孕酮受体“双阳性”乳腺癌也需要高系统性水平的孕酮。孕酮给药的常规递送途径是口服、肌肉内(im)注射和阴道凝胶施用。口服给药孕酮的主要问题之一是在其首次通过肝脏时经历的快速且广泛的代谢。口服给药的孕酮中有90%以上在其首次通过肝脏时被代谢,因此它在血清中的半衰期仅为约5分钟。因此,对于需要用高且持续的血液孕酮水平进行治疗的医学病症来说,不能通过口服给药达到足够的治疗水平。此外,孕酮代谢物可引起不良副作用例如头晕和嗜睡。im注射孕酮是一种有效的替代方案。然而,由于注射可能疼痛,因此这种途径具有较低的患者接受度。孕酮的阴道凝胶制剂可用于局部给药到阴道中。然而,这种给药途径仅达到低血浆水平,并且对子宫内膜的治疗功效实际上是局部、直接的阴道到子宫转运的结果。参见fanchin等,“孕酮的经阴道给药”(transvaginaladministrationofprogesterone)(1997),obstetrics&gynecology90(3):396-401。因此,阴道凝胶制剂在需要系统循环中存在持续高水平孕酮进行治疗的情况下无效。以类似的方式,其他治疗剂可能或会具有最佳给药途径。另一方面,本发明涉及一种药用产品,其包含单次使用的一次性给药器。在所述一次性给药器中含有本发明的黏膜粘附性药用凝胶组合物。在所述一次性给药器中提供的治疗剂的量可以随着其在所述凝胶组合物中的浓度以及所述一次性给药器中包含的凝胶组合物的量而变。在某些实施方式中,所述一次性给药器含有30-150mg所述治疗剂,并被设置成根据给药部位递送量在0.4–1.5克之间的所述黏膜粘附性凝胶组合物。在某些实施方式中,所述一次性给药器被提供为多个相同的一次性给药器的包装的一部分。所述包装中一次性给药器的数目可以随着目标使用时长和频率而变。在某些实施方式中,每个所述给药器包装含有15-60个一次性给药器。另一方面,本发明涉及一种药用产品,其包含用于分发凝胶组合物、即半固体材料的计量型剂量分发器(例如与用于雾化药物的计量型剂量吸入器相反)。在所述计量型剂量分发器中含有本发明的药用凝胶组合物。在所述计量型剂量分发器中提供的治疗剂的量可以随着其在所述凝胶组合物中的浓度、所述分发器中包含的凝胶组合物的量及其目标使用时长和频率而变。在某些实施方式中,所述计量型剂量分发器含有5至100克之间的根据本发明所述的凝胶组合物,并且其中所述组合物相应地含有500mg–8克之间的所述治疗剂。通过所述计量型剂量分发器的每次激活所提供的治疗剂的量将随着其在所述凝胶组合物中的浓度和每次激活所分发的凝胶组合物的量而变。在某些实施方式中,所述计量型剂量分发器的每次激活分发至少0.3克,并且在某些情况下0.4–1.5克的所述药用凝胶组合物。在某些实施方式中,所述凝胶组合物的每个剂量包含30–150mg的所述治疗剂。另一方面,本发明涉及一种在女性患者中诱导子宫内膜的分泌转化的方法。所述方法包括将本发明的药用凝胶组合物施用到所期望的黏膜例如患者口腔中的颊黏膜或舌下部位上并使所述药用凝胶组合物粘附于其上。所述治疗剂通过经黏膜吸收直接递送到系统循环中,从而避免了通过肝脏的首过代谢。这在系统循环中产生足够高的治疗剂水平。在某些实施方式中,所述方法在血浆或血清中实现至少5ng/ml,在某些情况下至少8ng/ml,在某些情况下至少11ng/ml,并且在某些情况下至少15ng/ml的治疗剂的量。这种治疗剂的高水平可以维持足够长的时间以获得治疗效果。在某些情况下,这种治疗剂的高水平在给药后维持至少6小时时长,并且在某些情况下在给药后维持至少12小时时长。本发明也可被当作是一种通过颊递送来给药治疗剂的方法或一种治疗医学病症的方法。正如下文进一步解释的,通过本发明可以治疗各种不同类型的医学病症。具体实施方式所述药用凝胶组合物包含含有胶凝剂和生物粘附剂的媒介物以及分散在所述媒介物中的治疗剂。当在本文中使用时,以重量百分率表示的量是相对于所述凝胶组合物的总重量(w/w)。媒介物在本发明的情形中,术语“媒介物”是指“运载”所述也被称为活性药物成分api的治疗剂的制剂。在本发明的情形中,所述媒介物包含所述胶凝剂和生物粘附剂两者。媒介物的选择将取决于所述api的性质和治疗的黏膜部位。例如,亲水性api按惯例在亲水性媒介物例如水凝胶(水性凝胶)中递送。然而,尽管水凝胶具有良好的患者依从性,但水凝胶在用于生物粘附性制剂时的主要问题在于所述制剂具有被给药部位处的天然体液溶解和/或侵蚀的倾向,从而使所述制剂的可靠性和有效性受损。因此优选地,在根据本发明所述的黏膜粘附性凝胶组合物中使用的媒介物是油凝胶,即通过用所述胶凝剂将至少一种油组合物胶凝而获得的凝胶,并且所述生物粘附剂被溶解、分散或悬浮在所述油凝胶中。然而,所述生物粘附剂也可以在凝胶形成之前添加到所述油组合物,因为这可以提供更加均质的媒介物。由于油凝胶的疏水性质,油凝胶媒介物将不会像水性媒介物那样容易地被体液溶解/洗掉,并因此提供了在给药部位处保留时间增加的优点,从而提供了更可靠的药物递送系统。用于制备所述油凝胶的油组合物可以与欧洲专利公布号1083880和/或2120865中公开的相同,并且优选地选自合成、半合成和天然来源的甘油单酯、甘油二酯和甘油三酯及其混合物,例如癸酸/辛酸甘油三酯的混合物。在优选实施方式中,所述媒介物通过将液体石蜡与凡士林混合,并使用适合的胶凝剂例如羧甲基纤维素将所述混合物胶凝来制备。由于作为油凝胶媒介物的水不溶性媒介物可能迟滞某些api从所述生物粘附性凝胶组合物的释放,因此在某些实施方式中提供包含低浓度水溶性材料的媒介物可能是优选的,从而加快所述特定api的释放。在一个实施方式中,所述媒介物可以优选地包含水凝胶(水性凝胶)和油凝胶两者,例如采取双相凝胶的形式。双相凝胶是一种均匀的半固体分散体系,其看起来像是单一凝胶,但其中油凝胶和水性凝胶通过例如施加高剪切速率而混合在一起。双相凝胶不是乳液,并且双相凝胶的主要优点之一是与乳液(油包水和水包油)、乳胶剂、水性凝胶和油凝胶相比提高的稳定性,这使得双相凝胶成为用于治疗剂的强效媒介物。所述双相凝胶的增强的物理化学稳定性可以归因于极细胶体状分散系的形成,这是由一种凝胶(例如水性凝胶)在另一种凝胶(例如油凝胶)的三维凝胶网络中的固定造成的。在室温储存后,所述双相凝胶的两种组分不分离,因此所述双相凝胶保持稳定。此外,当将双相凝胶施用到黏膜时,没有检测到所述水性凝胶与油凝胶的分离。因此,通过将油凝胶和水性凝胶转变成双相凝胶,提供了良好的患者依从性,并且不损害单独的水相和油相的有益效果,因为此类双相凝胶可以包含亲水性和疏水性api两者。还已显示,由于存在亲水和亲脂性质两者,两种凝胶的合并可能具有协同效应,导致改善药物在上皮上的渗透性,即双相凝胶中的成分可能更容易透过黏膜组织。双相凝胶通常通过分别制备水性凝胶和油凝胶,然后将所述两种凝胶通过例如施加高剪切速率混合在一起来获得。用于配制此类双相凝胶的方法的实例被例如公开在欧洲专利公布号1083880和2120865中,并且在本申请中将不会进一步详细讨论。所述生物粘附剂优选地在胶凝之前添加到所述油凝胶的油组合物。由于在根据本发明所述的凝胶组合物中优选地只包括相对少量的水溶性材料,因此所述媒介物中水性凝胶的量优选地低于所述媒介物总重量的20重量%,更优选地低于所述媒介物总重量的10重量%,甚至更优选地低于所述媒介物总重量的5重量%。然而,优选地从根据本发明所述的黏膜粘附性凝胶组合物中排除水溶性材料,并且如果添加此类材料的话,确保所述水溶性材料仅为所述凝胶组合物的相对低浓度的部分,例如低于所述最终黏膜粘附性凝胶组合物的5重量%,优选地低于所述最终黏膜粘附性凝胶组合物的2.5重量%,甚至更优选地低于所述最终黏膜粘附性凝胶组合物的1重量%。还优选地是提供一种基本上不含并优选地完全不含挥发性药剂的黏膜粘附性凝胶组合物,因为此类挥发性药剂可能由于提高所述凝胶组合物的水蚀性而损害所述组合物保留在给药部位处的能力。此外优选地,所述凝胶组合物不包含任何表面活性剂和/或已知引起黏膜刺激的物质。生物粘附剂根据本发明所述的黏膜粘附性药用凝胶组合物还包含一种或多种生物粘附剂。所述生物粘附剂能够使所述药用凝胶粘附到施用的黏膜部位,由此延长在给药部位处的保留时间,例如粘附到颊、鼻、阴道和直肠黏膜组织,以提高所述治疗剂(api)通过黏膜的透过性,控制所述药用凝胶组合物的侵蚀从而控制所述治疗剂的释放,或控制所述治疗剂在例如被口中的唾液润湿时的溶解动力学。此外,通过提供与所述施用部位的牢固粘附,所述生物粘附剂提高患者接受性。所述凝胶组合物中生物粘附剂的量占0.1–40重量%,并且在某些情况下占25–35重量%。存在各种不同的可用作所述生物粘附剂的聚合物材料。所述生物粘附剂可以优选地包含大量形成氢键的基团(例如羟基、硫醇、羧基或胺基),其有利于与所述凝胶组合物应该粘附的特定黏膜层的粘附。这些相互作用也依赖于黏膜微环境中的ph和离子组成,并且本领域技术人员会理解,所述生物粘附剂可以根据给药部位来选择,即一种生物粘附剂可能对于颊给药来说是优选的,例如不被α-淀粉酶分解的生物粘附剂,而对于阴道给药来说可以选择不同的生物粘附剂。所述生物粘附剂也可充当药物粘合剂,以提供所述凝胶制剂中的成分必需的粘合。所述生物粘附剂可以包含各种不同类型的天然、合成或生物聚合物、脂类、磷脂等中的任一者。可以用作所述药用凝胶组合物中的生物粘附剂的聚合物材料包括下述材料:纤维素衍生物,例如甲基纤维素、乙基纤维素、甲基乙基纤维素、羟甲基纤维素、羟乙基纤维素、羟丙基纤维素(hpc)、羟乙基甲基纤维素、羟丙基甲基纤维素(hpmc)、乙基羟乙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯或羧化的纤维素衍生物例如羧甲基纤维素(cmc)。天然树胶材料,例如卡拉牙胶、阿拉伯胶、黄蓍胶、瓜尔胶或黄原胶。蛋白质,例如明胶、胶原蛋白或凝集素类。多糖,例如壳聚糖、果胶、藻酸钠、透明质酸、琼脂糖、葡聚糖或淀粉。合成聚合物,例如乙烯基醚聚合物和共聚物,聚(氧化乙烯)、聚(乙烯吡咯烷酮)、聚(乙二醇)、聚(乙烯醇)、甲基丙烯酸酯聚合物例如聚(甲基丙烯酸羟乙基酯)和作为基于氧化乙烯和氧化丙烯的非离子性嵌段共聚物的泊洛沙姆(例如产品系列)。在可以用作所述生物粘附剂的各种不同的聚合物材料中,含有聚(丙烯酸)的丙烯酸聚合物可能特别适合于根据本发明所述的药用凝胶组合物。由于羧酸基团与黏膜和组织表面上的寡糖链形成强氢键,含有聚(丙烯酸)的聚合物具有出色的生物粘附特征。含有聚(丙烯酸)的聚合物可以以广泛的分子量获得,是无毒的,并且通常被认为是安全的。存在各种不同类型的可用作所述生物粘附剂的含有聚(丙烯酸)的聚合物。例如,所述含有聚(丙烯酸)的聚合物可以是丙烯酸的均聚物或者与以下交联剂交联:例如季戊四醇的烯丙基醚、蔗糖的烯丙基醚、戊烯的烯丙基醚、聚烯基醚或二乙烯乙二醇;交联的聚(丙烯酸)聚合物有时被称为卡波姆(例如产品系列)或聚卡波非(例如产品系列)。可能特别适合用作所述生物粘附剂的另一种聚合物材料是聚(甲基乙烯基醚-共-马来酸酐)(pvm/ma),例如pvm/ma的单烷基酯的gantreztm产品系列。可以使用的生物粘附剂的其他实例包括在义齿固定剂或粘附剂中使用的粘附性材料,例如在美国专利号5,302,628(richardlim等)、5,696,181(tiang-shingchang等)、6,350,794(michaelborja)和7,517,920(akihirosudo)中所描述的。在本发明中用作所述生物粘附剂的材料可以被交联,并且交联密度可以随着具体情况而变。根据本发明所述的药用凝胶可以含有一种或采取任何组合的多种不同生物粘附剂。胶凝剂所述药用黏膜粘附性凝胶组合物的媒介物还包含一种或多种胶凝剂。当在本文中使用时,术语“胶凝剂”意味着当暴露于水性介质时能够形成凝胶的材料。凝胶是溶胀或可溶胀的聚合物基质,其可能是交联的。所述凝胶组合物中胶凝剂的量占0.5–30重量%,并且在某些情况下占15–25重量%。因此,所述凝胶在施用到给药部位之前形成,即所述凝胶不是原位形成的。所述凝胶基质可用于物理截留所述api,即所述治疗剂分子,用于随后通过扩散或侵蚀缓慢释放。这使得所述药用凝胶组合物可以以近零级动力学的速率释放所述治疗剂。这样,在某些实施方式中,所述凝胶组合物被设置成在至少6小时的时长,并且在某些情况下至少10小时的时长内,以零级或近零级动力学释放所述治疗剂。在某些实施方式中,在所述凝胶组合物中包含的治疗剂的至少30%的质量、并且在某些情况下至少50%的质量的释放过程中,所述凝胶组合物以零级或近零级动力学释放所述治疗剂。当在本文中使用时,术语“零级动力学”意味着当在ph7.4的水性介质中在约23℃下测试时,在一段时间内从所述凝胶组合物释放恒定量的所述治疗剂(例如每单位时间x毫克,与剩余量的恒定百分率相反)。所述释放速率与零级动力学的符合程度可以通过用随时间释放的量的图对直线qt=q0+kt进行最小二乘法最佳拟合来评估,其中qt是在时间t释放的治疗剂的累积量,q0是在时间t=0时释放的治疗剂的初始量,而k是释放动力学常数。术语“近零级动力学”意味着最小二乘法最佳拟合线中的相关系数的值为至少0.7。相关系数的计算是用于评估最小二乘法拟合到数据的质量的一种常规统计技术。所述胶凝剂可以是上文为生物粘附性鉴定的那些材料中的任一者。可用于所述胶凝剂的其他材料是无机材料例如胶体硅酸镁铝或硅胶。根据本发明所述的药用凝胶组合物可以含有一种胶凝剂或采取任何组合的多种不同胶凝剂。在优选实施方式中,特别是如果所述媒介物是双相凝胶的话,则所述胶凝剂包含相对比例分别为8:2:90重量%(wt%)的乙基纤维素、异硬脂酸丙二酯和月桂酸丙二酯的组合。这种制剂的实例是可以从gattefosse获得的在某些实施方式中,所述胶凝剂是c1-c4烷基纤维素衍生物(例如乙基纤维素、甲基纤维素或羟丙基纤维素,包括其盐)。在某些实施方式中,所述胶凝剂是c1-c4羧基烷基纤维素衍生物(例如羧甲基纤维素)。在某些实施方式中,所述c1-c4羧基烷基纤维素衍生物是不含盐的羧基烷基纤维素,即其中盐被移除的采取游离酸形式的羧基烷基纤维素。采取游离酸形式的c1-c4羧基烷基纤维素具有水溶性低,从而形成更高黏度的凝胶,形成更强三维网络结构的优点。这种黏度的提高可以支持所述治疗剂的更持久且受控的释放。优选地,根据本发明所述的凝胶组合物具有在约139.5pa·s(帕斯卡秒)至约418.5pa·s范围内,例如约280pa·s的黏度(当通过rheomatrm100测量系统ms-r4在0.37s-1的剪切速率和21℃下测量时),因为这确保所述组合物可以被容易地施用/分配/铺展在相关黏膜组织上,同时也确保所述组合物足够坚硬,以防止所述组合物在施用后泄漏/滴落和/或移位。其他性质和成分在可以选择为所述生物粘附剂和胶凝剂的材料之间存在一定重叠。也就是说,某些材料可以被选择作为生物粘附剂或胶凝剂中的任一者。然而,在优选实施方式中,所述生物粘附剂不同于所述胶凝剂。在某些实施方式中,所述生物粘附剂具有比所述胶凝剂更高的粘附强度。各种不同的机械测试已被用于比较生物粘附性材料的粘附强度。参见peppas等,“作为生物粘附剂和生物粘附性材料的水凝胶:综述”(hydrogelsasbioadhesiveandbioadhesivematerials:areview)(1996),biomaterials17:1553-1561。此类测试中的任一者可用于比较所选生物粘附剂与所选胶凝剂的粘附强度。高凝胶强度确保了根据本发明所述的凝胶组合物在给药部位处保留所需/必需的治疗时长,即直至所需量的api例如所述给药的剂量中包含的至少50重量%的api已进入系统循环。所述媒介物和/或药用凝胶组合物也可以含有适合用于颊药物制剂的其他成分。例如,如果根据本发明所述的药用凝胶组合物打算用于颊给药,则所述凝胶可以例如包含调味剂例如胡椒薄荷油、冬青油、留兰香油、肉桂醛、鲸蜡基氯化吡啶鎓、薄荷醇、糖精钠、甘草甜素、麦芽糖浆、柠檬酸、酒石酸、柠檬油、柑橘香精等。治疗剂能够跨过黏膜例如颊、鼻、阴道和直肠黏膜并且已知被肝脏代谢的任何治疗剂,均可能适合于使用在根据本发明所述的药用黏膜粘附性凝胶组合物中。术语“治疗剂”是指一种或多种活性药物成分,并且在本申请中可以与术语活性药物成分互换使用,并涵盖其任何可药用盐。在某些实施方式中,所述治疗剂占所述凝胶组合物的1–30重量%,在某些情况下占1–15重量%。所述治疗剂可以以颗粒形式提供。例如,所述治疗剂可以被微粉化或纳米化(制成纳米尺寸的粒子),优选地平均尺寸在约0.001nm至约500μm的范围内,更优选地平均尺寸为约0.01nm至约100μm,甚至更优选地平均尺寸为约0.05nm至约40μm。更加亲脂的治疗剂可能更容易横穿颊黏膜。就此而言,在某些实施方式中,所述治疗剂具有在25℃低于50mg/l,在某些情况下在25℃低于30mg/l,在某些情况下在25℃低于20mg/l的水溶性。具有相对高效力(在低剂量下的治疗功效)的治疗剂可能特别适合用于本发明。就此而言,在某些实施方式中,所述治疗剂是在单剂中在1,000μg或更低剂量下,在某些情况下在单剂中在500μg或更低剂量下,并且在某些情况下在单剂中在100μg或更低剂量下具有治疗有效性的治疗剂。可以在本发明中使用的高效力治疗剂的实例是是醋酸去氨加压素(例如用于治疗儿童夜间尿床)。这种凝胶组合物的单位剂量的重量优选为约0.1g,并且优选地包含0.1mg至1.5mg之间的醋酸去氨加压素,并且优选被设置成用于颊给药。当用作药物时,类固醇激素既相对亲脂又具有相对高的效力。因此,在某些实施方式中,所述治疗剂是类固醇激素。可以使用的类固醇激素的实例包括睾酮、二氢睾酮(dht)、雌二醇、乙炔雌二醇、雌酮、硫酸雌酮、孕酮、左炔诺孕酮、去氧孕烯(一种合成孕酮)、达那唑、性类固醇激素的组合、sepranolol和选择性孕酮修饰物等。当在本文中使用时,术语“类固醇”意味着具有键合成四个“稠合”环(六元环a、b和c以及五元环d)的十七个碳原子的公知类固醇核心结构的化合物。在某些实施方式中,所述治疗剂是孕酮,并占所述凝胶组合物的1–20重量%,在某些情况下占1–15重量%。在某些实施方式中,所述治疗剂是雌二醇,并占所述凝胶组合物的0.01–5重量%。在某些实施方式中,所述治疗剂是睾酮,并占所述凝胶组合物的0.1–12重量%。口服给药的药物会因酸或酶而经历胃肠道降解。因此,本发明的给药的药用凝胶组合物可能特别适合于易受胃肠道降解影响的治疗剂,例如蛋白质或肽治疗剂。因此,在某些实施方式中,所述治疗剂是蛋白质或肽。可以在所述凝胶组合物中使用的治疗剂的实例示出在下面的表a中。表a剂型根据本发明所述的药用黏膜粘附性凝胶组合物可以以任何适合的单位剂量或多剂量形式提供。在某些实施方式中,本发明涉及一种包含单次使用的一次性给药器的药用产品,所述给药器被设置成容易将所述凝胶组合物给药到相关的黏膜组织,例如鼻、阴道、颊和直肠组织。在这种一次性给药器中含有本发明的药用凝胶组合物。每个单次使用的给药器至少含有单次剂量所述药用凝胶组合物所需的量;但优选地,所述给药器含有单位剂量的所述凝胶组合物。在本发明的情形中,术语“单位剂量”意味着递送到给药部位的剂量,并且由于必须预期一部分根据本发明所述的凝胶组合物被天然体液清除/移除,因此所述单位剂量可能优选地包含比所有治疗剂均被递送到系统循环所必需的量更大量的治疗剂,即单位剂量是单次剂量的量加上所述单次剂量的量的5–50%的备用量,以确保提供所述治疗剂的足够的血浆浓度。例如,所述单次使用的给药器可以含有单位剂量,其包含约0.4至1.5克之间的所述药用凝胶组合物,含有约40–225mg之间的所述治疗剂,其中所需的血浆剂量,即假使在治疗剂被静脉内给药时获得所述api的所需血浆浓度所需的量,在30–150mg的范围内。在某些实施方式中,所述单次使用的给药器含有高于血浆剂量所需的治疗剂的量,但低于两个剂量所需的量。在某些实施方式中,所述剂型是含有多剂所述凝胶组合物的计量型剂量分发器。所述计量型剂量分发器含有多剂所述凝胶组合物所需的量。所述计量型剂量分发器的每次激活分发单位剂量的所述凝胶组合物以备用户施用,例如约0.4至1.5g。医学病症本发明的药物制剂可用于治疗常规通过所选治疗剂治疗的任何医学病症。在孕酮的情况下,本发明的药物制剂可用于治疗常规使用孕酮治疗的任何医学病症。当在本文中使用时,术语“用于女性不育障碍的治疗”包括用于女性不育、黄体功能不全、胎儿成熟、维持妊娠的支持以及作为辅助生殖或不育程序的一部分的治疗。在某些实施方式中,本发明的药用黏膜粘附性凝胶组合物被用于在患者中诱导分泌性子宫内膜。诱导分泌性子宫内膜可有效治疗女性不育障碍或治疗癌症例如宫颈癌或乳腺癌,或在经历绝经后激素替代疗法的患者中预防子宫内膜癌。在某些实施方式中,所述医学病症是乳腺癌,在某些情况下,所述乳腺癌是雌激素受体阳性乳腺癌,在某些情况下,所述乳腺癌是雌激素受体阳性且孕酮受体阳性的乳腺癌。在某些实施方式中,所述医学病症是与激素有关的妇科病症。此类病症的实例包括绝经期症状(例如在绝经后激素替代疗法中)、经前综合征(pms)、子宫内膜异位、低性激素、低睾酮或多囊卵巢综合征(pcos)。现有的药物颊制剂已被用于口腔中的局部病状,例如溃疡或感染。然而优选情况下,本发明的药用凝胶组合物不用于局部治疗口腔中的医学病症。使用方法所述药用黏膜粘附性凝胶组合物可以被施用到任何适合的黏膜表面,例如口腔中的颊表面,例如牙龈袋(在解剖学上被称为孔室)。在某些实施方式中,所述药用凝胶被施用到牙龈袋(上侧或下侧)。所述药用凝胶可以任何适合的方式给药以达到治疗效果。所述患者可以接受间歇给药。在某些实施方式中,给药频率是一天两次,例如每约12小时一次。在优选实施方式中,根据本发明所述的凝胶组合物通过贴片或薄膜给药,所述贴片或薄膜优选地由在被给药部位处的体液接触时降解和/或溶解的材料制成。这具有使用者总是将正确量例如0.5克的凝胶组合物施用到给药部位的优点。给药方案应在系统循环中产生足够高水平的所述治疗剂。如果所述治疗剂是孕酮,则所述药用凝胶将被给药以使血浆或血清中治疗剂的量达到至少5ng/ml,在某些情况下至少8ng/ml,在某些情况下至少11ng/ml,在某些情况下至少15ng/ml。这种高水平的孕酮可以维持足够长的时间以获得治疗有效性。在某些情况下,这种高剂量的孕酮在给药后持续至少6小时的时长,在某些情况下在给药后持续至少12小时的时长。由于所述药用凝胶粘附于黏膜表面并且只含有少量挥发性溶剂和/或水溶性材料(如果有的话),因此它在施用部位处例如在口腔中具有延长的保留时间。在某些实施方式中,所述药用凝胶在施用部位处维持至少4小时的时长,在某些情况下至少6小时的时长。由于所述药用凝胶粘附于黏膜表面,因此它可能用于过夜给药。在某些实施方式中,所述药用凝胶在患者睡着时维持在例如口腔中。在某些实施方式中,所述药用凝胶在患者就寝时间或之前60分钟内施用(例如按指示在就寝时间前30分钟施用)。用于颊给药的黏膜粘附性凝胶组合物的优选实施方式在优选实施方式中,所述媒介物是油凝胶,其包含占所述最终凝胶组合物的15–25重量%的量的凡士林和占所述最终凝胶组合物的15–25重量%的量的液体石蜡。所述凝胶组合物包含占所述最终凝胶组合物的25–35重量%的量的作为生物粘附剂的gantreztmms955聚合物产品(pvm/ma共聚物的混合的钠盐和钙盐),占所述最终凝胶组合物的15–25重量%的量的作为凝胶剂的羧甲基纤维素(cmc),和任选的占所述最终凝胶组合物的0.1–1重量%的量的二氧化硅(作为胶凝剂)。所述凝胶组合物可以例如包含量在所述最终凝胶组合物的8至20重量%之间的微粉化孕酮。附图说明图1示出了装填有本发明的凝胶组合物的单次使用的一次性给药器的实例。图2示出了装填有本发明的凝胶组合物的计量型剂量分发器的实例。图3示出了8%孕酮凝胶批次#1的体外药物释放曲线。图4示出了通过向下牙龈腔施用741mg8%孕酮凝胶批次#2而给药59mg孕酮的对象中的孕酮体内血清水平。图5示出了孕酮凝胶批次#3、#4、#5和#6的体外药物释放曲线。图6示出了20%孕酮凝胶批次#7的体外药物释放曲线。图7示出了20%孕酮凝胶批次#8的体外药物释放曲线。图8示出了通过向上牙龈腔施用300mg20%孕酮凝胶批次#9而给药60mg孕酮的对象中的孕酮体内血清水平。图9示出了8%孕酮凝胶批次#10的体外药物释放曲线。图10示出了通过向上牙龈腔施用2×375mg8%孕酮凝胶批次#10而给药60mg孕酮的对象中的孕酮体内血清水平。在下文中假定根据本发明所述的给药器旨在用于颊给药来描述本发明。然而,在本发明的范围内也设想了所述给药器的修改,例如不同形状的尖头,以便于给药到例如阴道、直肠或鼻腔。优选地,所述装置具有便于通过单手给药的尺寸。图1示出了单次使用的一次性给药器10的实例。给药器10装填有所述凝胶组合物。在给药器10的尖头处存在盖子12。按压活塞14以从给药器10的尖头分发所述凝胶组合物。使用者取下盖子12并将给药器10的尖头放置在口腔中的靶部位上。使用者推动活塞14,以将单位剂量的所述药用凝胶分发到所述靶部位。图2示出了装填有多剂量的所述药用凝胶组合物的计量型剂量分发器20的实例。分发器20具有泵头22和长分发嘴24。使用者将嘴24的尖头放置在口腔中的靶部位上。使用者推下泵头22,这将从所述嘴分发出预先设定量的所述药用凝胶。实验性实施例用于制造所述微粉化孕酮凝胶的批次的通用程序如下。通过将在40℃下获得的液体石蜡与在40℃下获得的凡士林(和任选的在40℃下获得的薄荷油)在磁力搅拌下混合来制备所述媒介物。添加在35℃下获得的生物粘附剂gantreztmms-955产品(pvm/ma共聚物的混合的钠盐和钙盐),并使用电动搅拌器在所述混合物中在300至1100rpm之间分散15min。任选地,向所述制备物添加在35-40℃下获得的二氧化硅,使用电动搅拌器在1000rpm下混合5min。向所述制备物添加胶凝剂羧甲基纤维素(cmc,blanosetm产品,在35-40℃下获得)并进一步混合10min,以便制备用于运载治疗剂孕酮的媒介物。导入在室温下获得的微粉化孕酮并混合,以彻底分散在所述混合物中。制造了10批次的黏膜粘附性孕酮凝胶组合物。表1示出了所述批次的组成。表2示出了在体内测试的所选批次的根据百分率的组成。表1批次(以克为单位的量)*对于批次#1-3来说,将1.2g微粉化孕酮混合在13.8g媒介物中以产生8%混合物。对于批次#4来说,将1.8g微粉化孕酮混合在13.2g媒介物中以产生12%混合物,对于批次#5来说,将2.3g微粉化孕酮混合在12.8g媒介物中以产生15%混合物。对于批次#6-9来说,将3.0g微粉化孕酮混合在12.0g媒介物中以产生20%混合物。对于批次#10来说,将1.2g微粉化孕酮混合在13.8g媒介物中以产生8%混合物。表2#2#9#10pvm/ma共聚物30.1%26.1%26.0%凡士林20.1%17.4%22.1%液体石蜡21.6%18.7%24.8%cmc20.1%17.4%18.9%薄荷油0.40%二氧化硅0.25%0.18%微粉化孕酮8%20%8%在体外测试了药物从批次#1、#3、#4、#5、#6、#7、#8和#10的释放速率。凝胶样品如下制备:将0.40克所选批次倾倒在125ml玻璃瓶中。向所述瓶添加100ml0.5%sds(十二烷基硫酸钠)预热溶液,然后保持在37℃。以2小时的时间间隔取出测试样品(5ml)。然后使用uv分光光度法在251nm处测定所述溶液的孕酮浓度。批次#1的结果示出在图3中。图3中还示出了一条虚线作为通过图获得的最小二乘法最佳拟合线的假设实例,其表现出近零级动力学,并且最佳拟合线的相关系数为至少0.7。批次#3、#4、#5和#6的结果示出在图5中。批次#7的结果示出在图6中。批次#8的结果示出在图7中。批次#10的结果示出在图9中。对批次#2进行了体内测试。将741mg所述凝胶(含有59mg孕酮)施用到测试对象的下牙龈腔中。每2小时获取血样并使用电化学发光免疫测定法测量血清孕酮浓度。结果示出在图4中。对批次#9进行了体内测试。将300mg所述凝胶(含有60mg孕酮)施用到测试对象的上牙龈腔中。每2小时获取血样并使用电化学发光免疫测定法测量血清孕酮浓度。结果示出在图8中。对批次#10进行了体内测试。将2×375mg所述凝胶(各含有30mg孕酮)施用到测试志愿者的上牙龈腔中。每2小时获取血样共10小时,并使用电化学发光免疫测定法测量血清孕酮浓度。结果示出在图10中。此外,还收集了最大量的残留凝胶并测定孕酮的量。回收到25%的所述凝胶组合物,表明不超过45.6mg孕酮被吸收。此外,由于25%的所述凝胶组合物在10小时后仍存在于口腔中,因此显然在口腔中的保留时间是显著的,这可能是由于在根据本发明所述的凝胶组合物中缺少水溶性材料和挥发性药剂,由此提供了与已知凝胶组合物相比改进的凝胶组合物。结论:上面的描述和实施例仅仅是为了说明本发明而阐述,并且不打算是限制性的。本发明的每个公开的方面和实施方式可以被单独地或与本发明的其他方面、实施方式和变化形式相组合考虑。此外,除非另有说明,否则本发明的方法的步骤不局限于任何特定的执行顺序。本领域技术人员可以对所公开的实施方式做出并入有本发明的精神和实质的修改,并且这样的修改被认为是在本发明的范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1