雌激素受体β(ERβ)阳性乳腺肿瘤的药物治疗的制作方法
发明领域
本发明涉及医学领域,并涉及作为前体药物用于治疗患有雌激素受体β(erβ)阳性乳腺肿瘤患者的类固醇化合物4-羟基雄甾-4-烯-3,17-二酮(4-oha)。本发明还涉及一种用于局部使用的包含所述类固醇化合物的药物组合物,以及所述类固醇化合物在erβ阳性乳腺癌组织术前局部治疗中的应用。
背景技术:
描述
在西方世界,乳腺癌是继结直肠癌之后最常见的癌症,尽管事实上它几乎只影响女性。在德国,乳腺癌约占所有女性确诊癌症类型的20%。
目前为止,大多数病例的治疗方法包括手术切除肿瘤(肿块切除术)或如果肿瘤尺寸妨碍了保乳治疗,则完全切除患病乳房。在这两种情况下,手术(手术切除)之后都是药物治疗。乳腺癌的一个特殊并发症是转移到其他器官的可能性很高,特别是肝、脑、骨骼和皮肤。因此,手术后会进行药物治疗(辅助疗法)。这种疗法的目的还在于防止疾病局部复发。如果切除的肿瘤表达雌激素受体,则使用抗雌激素药(他莫昔芬或芳香化酶抑制剂)进行术后药物治疗。缺乏雌激素受体则使用细胞抑制药物进行术后药物治疗。
他莫昔芬与雌激素受体(er)结合并阻断雌激素的生长促进作用。芳香化酶抑制剂阻断了由雄激素前体(c-19-类固醇)产生雌激素的最后一步。它们要么不可逆地结合至酶的活性部位(芳香化酶灭活剂,即类固醇芳香化酶抑制剂:4-羟基雄烯二酮(福美司坦=lentaron®),或依西美坦(aromasin®)),要么竞争性地抑制酶的细胞色素p450部分(非类固醇芳香化酶抑制剂:阿那曲唑(arimidex®)和来曲唑(femara®)。如果乳腺癌表现出her2neu基因的过度表达,则静脉注射针对这种细胞表面蛋白的抗体,例如曲妥珠单抗(herceptin®)。
基础和临床数据表明,雄激素的芳香化代谢产物,即雌激素,参与了与一些激素依赖性的癌症(如乳腺癌、子宫内膜癌和卵巢癌)的生长有关的致病性细胞变化。芳香化酶最近被认为是一种能够在肿瘤中直接合成雌二醇的酶。
内源性雌激素最终由雄烯二酮或睾酮作为直接前体形成。在乳房组织中,特别是在肿瘤细胞本身,局部产生的雌激素一直被认为对这种疾病的治疗非常重要。在此背景下,芳香化酶对类固醇环a的芳构化作用及其抑制作用被认为在抗乳腺癌研究中发挥了重要作用。
因此,除了其他基于雌激素受体拮抗剂或治疗性抗体的概念外,解决女性乳腺癌的传统治疗方法专注于芳香化酶抑制作用本身。因此,现有技术描述了据报告具有芳香化酶抑制作用的类固醇物质,例如∆1-睾酮内酯[u.s.pat.2,744,120]、4-羟基雄甾-4-烯-3,17-二酮及其酯[见,例如,u.s.pat.4,235,893]、10-(1,2-丙二烯基)-雌甾-4-烯-3,17-二酮[u.s.pat.4,289,762]、10-(2-丙炔基)-雌甾-4-烯-3,17-二酮[j.amer.chem.soc.,103,3221(1981)和u.s.pat4,322,416]、19-硫雄烯衍生物(europ.pat.appl.100566)、雄甾-4,6-二烯-3,17-二酮、雄甾-1,4,6-三烯-3,17-二酮[g.b.patappl.2,100,601a]和雄甾-1,4-二烯-3,17-二酮[cancerres.(suppl.)42,3327(1982)]。
然而,用雌激素受体(er)拮抗剂和芳香化酶抑制剂进行的临床研究表明,这些化合物不能对肿瘤增殖和/或生长发挥显著和充分的抑制作用。例如,以tamoxifen®为基础的治疗存在一些缺点,如快速耐受(治疗失败),并且事实上它在某些细胞中的作用是雌激素样的(例如形成血栓和子宫内膜癌的风险),这是tamoxifen®使用周期不能超过3-5年的原因。像芳香化酶抑制剂这样的新药,原则上只能用于绝经后的妇女,并且只对er阳性肿瘤有效。
已有报道(j.szeleietal.,“androgen-inducedinhibitionofproliferationinhumanbreastcancermcf7cellstransfectedwithandrogenreceptor”,endocrinol.,138,no.4,1406-1412,1997)表明,表达雄激素受体(ar)的稳定转染细胞通过诱导细胞增殖的终止来获得对雄激素的应答能力。最近的一份报告(j.ortmannetal.,“testosteroneand5α-dihydrotestosteroneinhibitinvitrogrowthofhumanbreastcancercelllines”,gynecol.endocrinol.2002;16:113-120)显示,睾酮和5α-双氢睾酮(dht)能抑制某些细胞系的细胞增殖。睾酮本身也有类似的作用。然而,它的临床用途受到其会快速代谢为雌二醇或二氢睾酮(dht)的阻碍。乳腺癌中睾酮通过局部芳香化酶活性局部生成雌二醇,促进肿瘤生长。
另一方面,ar本身被认为是参与分化、内环境稳定和雄性第二性征发育过程的调节因子。因此,针对ar的治疗方案集中于男性雄激素相关疾病,包括性腺功能减退、男性不育、前列腺癌、青春期延迟、多毛症、雄激素缺乏性疾病、老年男性雄激素替代疗法和男性型秃发。在这种情况下,us2,762,818a仅揭露基于4-羟基睾酮及其酯类的雄激素和合成代谢特性来治疗雄激素缺乏状态。然而,没有一个目的或发现可以表明其对乳腺癌细胞的活性,或能推导出针对这种疾病状况的疗效。此外,us2003/0229063a解决了男性雄激素与雌激素比率低(导致内分泌失调)的问题,并且仅为此目的,试图仅基于已证实的芳香化酶抑制作用而使用4-羟基睾酮。
wo2007/131737主要关注乳腺癌的治疗,在此背景下,指的是用类固醇化合物靶向雄激素受体(ar)。
如上所述,一些乳腺癌肿瘤对雌激素敏感。雌激素通过特定的核蛋白受体,即雌激素受体α(erα)和雌激素受体β(erβ)发挥作用。
因此,人们进行了大量的研究来阐明erα和erβ的作用和性质。在这点上,在大多数乳腺癌病例中可以证明,erα的表达高于erβ的表达。在疾病的发展过程中,erβ的表达减少,与恶性的获得同步。
基于细胞培养系统的研究表明,这两种雌激素受体亚型调节雌激素的行为,而乳腺癌中erβ和erα的相对水平可能会影响细胞增殖和不同信号通路的活性及其对er配体的反应(endocrinology,volume147,issue10,1october2006,pages4831–4842)。此外,这可能表明erβ作为组织特异性肿瘤抑制因子具有抗增殖特性(clin.pharmacol.ther.2011jan;89(1):44-55)。同时,erβ的激活可以通过由erα和erβ组成的异二聚体(erα:erβ异二聚体)的产生,导致erα介导的信号通路的中断。在正常的(即非病变)乳腺组织中,erα的表达占主导地位;而在病变组织,即乳腺癌组织中,erβ的表达占主导地位。目前认为,erα驱动雌激素介导的增殖,而erβ则限制甚至完全阻止雌激素介导的erα的增殖(mol.endocrinol.2003,feb;17(2):pages203-8;lindbergetal.)。
综上所述,在乳腺癌领域中,目前已知的治疗概念或仅关注芳香化酶抑制,或仅关注雄激素受体(ar)的结合。此外,除了通过芳香化酶抑制或雄激素受体结合来治疗乳腺癌之外,在大多数情况下,治疗还包括手术切除肿瘤,或在肿瘤尺寸妨碍保乳治疗时完全切除患病乳房。
这种治疗,特别是部分甚至完全切除患病乳房,对患者的身心都是巨大的负担。
因此,提供一种有效的治疗方法来治疗患有某种类型乳腺癌的患者,特别是erβ阳性乳腺癌患者是有必要的,这也是本发明的目的。具体而言,本发明的目的是提供减小肿瘤尺寸的有效治疗方法从而允许保乳治疗的进行,也就是说,是一种预防完全手术切除患病乳房的疗法。
发明概述
由下列单独或组合项目总结的本发明的各个方面、优势特征和优选实施例促成了本发明的目标的实现。
1.式i的类固醇化合物4-羟基雄甾-4-烯-3,17-二酮(4-oha)或其酯
式i
作为前体药物在治疗患有雌激素受体β(erβ)阳性并且任选地雄激素受体(ar)阳性乳腺肿瘤患者的方法的应用,其中所述前体药物被局部施用于患者。
在优选的实施方式中,患者患有erβ阳性和ar阳性乳腺肿瘤。
在进一步优选的实施方式中,患者患有erβ阳性和ar阴性乳腺肿瘤。erβ阳性且ar阴性乳腺癌的一个例子是三阴性乳腺癌("tnbc")。
tnbc被定义为雌激素受体α(erα)阴性、孕激素受体阴性(pr)、her2受体阴性。erβ已被发现在tnbc中表达。
在本发明中,术语“前体药物”定义为在给药后被代谢(即在体内转化)为药理活性物质的药物或化合物。
关于术语“酯”,参考以下定义。
2.根据第1项的类固醇化合物4-oha或其酯的用途,其中erβ阳性乳腺癌是三阴性乳腺癌(tnbc)。
3.根据第1项或第2项的类固醇化合物4-oha或其酯的用途,其中所述治疗在计划手术切除乳腺肿瘤组织之前进行,和/或所述治疗是为了减少乳腺肿瘤组织。
4.根据第1至3项中的任何一项的类固醇化合物4-oha或其酯的用途,其中所述前体药物4-oha被代谢为至少在c4位和c17位具有一个羟基的药理活性物质。
5.根据1至4中任何一项所述的类固醇化合物4-oha或其酯的用途,其中前体药物4-oha被代谢为相比其对雌激素受体α(erα)的结合亲和力,对雌激素受体β(erβ)具有更高的结合亲和力的药理活性物质,二者均由乳腺肿瘤组织表达,或仅erβ由乳腺肿瘤组织表达,其中所述治疗导致erβ的激动性结合,优选地,其中所述药理活性物质与erβ的结合亲和力比对erα的结合亲和力高至少3倍,优选至少4、5或6倍,更优选至少9倍,最优选至少10倍。
如果乳腺肿瘤组织表达了雄激素受体,还优选的是,该药理活性物质与乳腺肿瘤组织(除表达erβ外)表达的雄激素受体具有结合亲和力。
也有可能乳腺肿瘤组织不表达雄激素受体,只表达erβ。例如,如果乳腺肿瘤组织为tnbc,则没有雄激素受体表达。
6.使用根据第1至5项中任何一项的类固醇化合物4-oha或其酯的用途,其中该药理活性物质包含,优选地该药理活性物质是,4-羟基-5-α-雄甾-3-β,17-β二醇(4-ohba)或4-羟基睾酮(4-oht),优选地,该药理活性物质为4-ohba。
在类似的优选实施方式中,该药理活性物质包含,优选地该药理活性物质是,4-羟基睾酮(4-oht)或其羟基酯。作为选择或此外,该药理活性物质包含,优选地该药理活性物质是,4-羟基-5-α-雄甾-3-β,17-β二醇(4-ohba)或其羟基酯。
7.4-羟基睾酮(4-oht)或其羟基酯在治疗患有雌激素受体β(erβ)阳性并且任选地雄激素受体(ar)阳性乳腺肿瘤的患者的方法中的用途,其中4-oht或其羟基酯被局部施用于患者。
8.4-羟基-5-α-雄甾-3-β,17-β二醇(4-ohba)或其羟基酯在治疗患有雌激素受体β(erβ)阳性并且任选地雄激素受体(ar)阳性乳腺肿瘤的患者的方法中的用途,其中4-ohba或其羟基酯被局部施用于患者。
9.根据第7或8项中任何一项的所述的4-oht或4-ohba或其各自的羟基酯在方法中的用途,其中所述患者患有tnbc。
10.根据第7至9项中任何一项所述的4-oht在方法中的用途,其中所述治疗在计划外科切除乳腺肿瘤组织之前进行,和/或所述治疗是为了减少乳腺肿瘤组织。
11.一种适于局部施用的药物组合物在治疗患有雌激素受体β(erβ)阳性乳腺肿瘤和任选地雄激素受体(ar)阳性乳腺肿瘤的患者中的用途,所述药物组合物包含式i的作为前体药物的类固醇化合物4-羟基雄甾-4-烯-3,17-二酮(4-oha)或其酯,以及药学上可接受的载体和/或赋形剂,
式i
其中所述治疗在计划手术切除乳腺肿瘤组织之前进行。
在优选的实施方式中,患者患有erβ阳性和ar阳性乳腺肿瘤。
在进一步优选的实施防止中,患者患有erβ阳性和ar阴性乳腺肿瘤,如tnbc。
12.根据第11项的药物组合物的用途,其中erβ阳性乳腺癌为三阴性乳腺癌(tnbc)。
13.根据上述任何一项的药物组合物的用途,其中术前治疗包括以有效减少乳腺肿瘤组织的量局部施用该药物组合物。
14.根据上述任何一项的药物组合物的用途,其中术前治疗进行足以将乳腺肿瘤组织缩小到允许进行保乳手术切除的尺寸的一段时间。
在优选的实施方式中,术前治疗进行了至多6个月或至多5、4、3或2个月的时间。
也有可能在11周或10、9、8、7、6、5、4、3或2周的术前治疗之后,就可以将乳腺肿瘤组织缩小到允许进行保乳手术切除的尺寸。
15.根据上述任何一项的药物组合物的用途,其中肿瘤组织在治疗完成后显著减少,优选地,通过超声波、x光或乳房x光摄影检查确定,与治疗开始时乳腺肿瘤组织的尺寸相比,肿瘤组织减少至少13vol.-%,或至少14vol.-%,或15vol.-%,或至少20vol.-%,优选至少30vol.-%,更优选至少13vol.-%或14vol.-%,或至少40vol.-%,甚至更优选减少至少50vol.-%,至少60vol.-%或70vol.-%。
在优选的实施方式中,乳腺肿瘤组织的尺寸通过乳房x光摄影来确定。
如果该乳腺癌的特征是erβ的表达,但无(或无显著)erα表达并且没有ar表达,例如tnbc,通过超声波、x光或乳房x光摄影检查确定,与治疗开始时的乳腺肿瘤组织尺寸相比,肿瘤组织减少至少15vol.-%。
16.根据上述任何一项的药物组合物的用途,其中术前治疗不迟于计划手术(即乳腺肿瘤组织的保乳手术切除)前6个月开始,或不迟于计划手术前5、4、3或2个月开始。
术前治疗也可能不迟于计划手术前11周或10、9、8、7、6、5、4、3或2周时开始。
术前治疗也可能不迟于计划手术前8周开始,优选不迟于手术前6周或5周开始
17.根据上述任何一项的药物组合物的用途,其中所述前体药物4-oha或其酯在药物组合物中约药物组合物的量的约1.5wt.-%至约4wt.-%,优选为约2.0wt.-%至约3.0wt.-%,更优选为约2.0wt.-%至约2.5wt.-%。
在优选的实施方式中,所述药物组合物呈可局部施用的组合物的形式,例如乳霜、凝胶、乳液或软膏。更优选地,所述药物组合物是乳霜。
18.根据上述任何一项的药物组合物的用途,其中所述药物组合物每天局部使用一次或两次。
19.一种适于局部施用的药物组合物在治疗患有雌激素受体β(erβ)阳性乳腺肿瘤和任选地雄激素受体(ar)阳性乳腺肿瘤的患者中的用途,所述药物组合物包含4-羟基睾酮(4-oht)和/或4-羟基-5-α-雄甾-3-β,17-β二醇(4-ohba),或4-oht或4-ohba的羟基酯和药学上可接受的载体和/或赋形剂,其中所述治疗在计划外科切除乳腺肿瘤组织之前进行。
在进一步优选的实施方式中,患者患有erβ阳性且ar阳性乳腺肿瘤。
在进一步优选的实施方式中,患者患有erβ阳性且ar阴性乳腺肿瘤,如tnbc。
20.根据第19项的药物组合物的用途,其中erβ阳性乳腺癌为三阴性乳腺癌(tnbc)。
21.根据第19和20项的药物组合物的用途,其中术前治疗包括以有效减少乳腺肿瘤组织的量局部施用所述药物组合物。
在优选的实施方式中,术前治疗进行了至多6个月或至多5、4、3或2个月的时间。
也有可能在11周或10、9、8、7、6、5、4、3或2周的术前治疗之后,就可以将乳腺肿瘤组织缩小到允许进行保乳手术切除的尺寸。
22.根据上述任何一项的药物组合物的用途,其中肿瘤组织在治疗完成后显著减少,优选地,通过超声波、x光或乳房x光摄影检查确定,与治疗开始时乳腺肿瘤组织的尺寸相比,肿瘤组织减少至少13vol.-%或14vol.-%,或至少15vol.-%,或至少20vol.-%,优选至少30vol.-%,更优选至少40vol.-%,甚至更优选至少50vol.-%,至少60vol.-%或至少70vol.-%。
在优选的实施方式中,减少量以体积大小的减少来衡量,乳腺肿瘤组织的尺寸通过乳房x光摄影来确定。
如果该乳腺癌的特征是erβ的表达,但无(或无显著)erα表达,例如tnbc,通过超声波、x光或乳房x光摄影检查确定,与治疗开始时的乳腺肿瘤组织尺寸相比,肿瘤组织减少至少15vol.-%。
23.根据上述任何一项的药物组合物的用途,术前治疗不迟于计划手术(即乳腺肿瘤组织的保乳手术切除)前6个月,或不迟于计划手术前5、4、3或2个月开始。
术前治疗也可能不迟于计划手术前11周或10、9、8、7、6、5、4、3或2周时开始。
术前治疗也可能不迟于计划手术前8周开始,优选不迟于手术前6周或5周开始。
24.根据上述任何一项的药物组合物的用途,其中所述前体药物4-oha和/或4-ohba在药物组合物中为所述药物组合物的量的约1.5wt.-%至约4wt.-%,优选约2.0wt.-%至约3.0wt.-%,更优选约2.0wt.-%至约2.5wt.-%。
在优选的实施方式中,所述药物组合物呈可局部施用的组合物的形式,例如乳霜、凝胶、乳液或软膏。更优选地,所述药物组合物是乳霜。
25.根据上述任何一项的药物组合物的用途,所述药物组合物每天局部使用一次或两次。
26.4-oha或其酯作为前体药物在erβ阳性乳腺癌组织的术前局部治疗中的用途。
在优选的实施方式中,患者患有erβ阳性且雄激素受体(ar)阳性乳腺肿瘤。
在进一步优选的实施方式中,患者患有erβ阳性且雄激素受体(ar)阴性乳腺肿瘤,如tnbc。
27.4-羟基睾酮(4-oht)在erβ阳性且任选地加之雄激素受体(ar)阳性的乳腺肿瘤组织的术前局部治疗中的用途。
在优选是实施方式中,患者患有erβ阳性且ar阳性乳腺肿瘤。
在进一步优选的实施方式中,患者患有erβ阳性且ar阴性乳腺肿瘤,如tnbc。
28.根据上述任何一项的药物组合物的用途,其中erβ阳性乳腺癌为三阴性乳腺癌(tnbc),所述药物组合物除了前药4-oha或其酯和/或从4-oht、4-ohba及其各自的酯中选出的化合物外,还包含与erβ结合从而激活erβ的另外活性成分,该另外活性成分与前体药物4-oha和从4-oht、4-ohba及其酯中选择的化合物不同。
29.根据第28项的药物组合物的用途,其中所述另外活性成分选自抗雌激素和抗癌吲哚化合物。
在优选的实施方式中,抗雌激素是例如氟维司群或他莫昔芬。抗癌吲哚化合物优选为一种改变雌激素代谢,或有效地抑制癌细胞的生长的吲哚衍生物。抗癌吲哚化合物的一个例子是吲哚-3-甲醇。
术语定义
在本发明中,术语“酯”,在任何提及它的情况下,指合适的酯基,如取代或未取代的烃基(任选地,烃基的碳原子也可被1-3个杂原子(o、s、n)取代)。具体而言,酯基可以是或包含直链、支链、环状和/或芳香族烃基或例如酰基或芳酰基的酰基,例如甲酰基、乙酰基、丙酰基、丁酰基、戊酰基、己酰基、庚酰基和苯酰基,但不限于此。烃基可以有1-12个碳原子,并且可被如卤素的取代基取代或不取代。烃基的碳原子也可以被1-3个杂原子(o、s、n)取代,例如形成杂芳基。
在式i的化合物的情况下,可与4-oh(羟基)形成酯。每当在本发明中提及4-oha时,该术语也包括其酯。在4-oht的情况下,可与4-oh和/或17-oh基形成酯。在4-ohba的情况下,可与选自4-ohba结构的3-oh、4-oh和17-oh基的羟基形成酯。
上述任何一种定义的酯都可以用作前体药物,给药后,酯基可被代谢,留下各自未偶联的羟基。
本发明的详细描述
现在通过优选实施例和示例来更详细地描述本发明,然而,这些实施例和示例仅用于说明目的,不应理解为以任何方式限制本发明的范围。
在erβ阳性乳腺癌的背景下,本申请的发明人意外发现,通过局部使用作为前体药物的类固醇化合物可显著减小肿瘤尺寸,该前体药物在代谢后对erβ表现出高选择性,同时对erα则没有或只有极小的选择性,并且还与任选地由乳腺癌组织表达的雄激素受体(ar)结合。
如果上述前体药物局部应用于患病的erβ阳性癌组织(乳腺癌组织)上,则药理活性物质是由式i的4-羟基雄甾-4-烯-3,17-二酮(4-oha)或其酯代谢而产生的。
前体药物4-oha代谢产生的药理活性物质,主要通过激活由乳腺癌组织表达的erβ发挥作用,乳腺癌组织除了是erβ阳性外,也可能但不必然是ar阳性。在本发明中已经发现,前体药物4-oha(或由前体药物代谢产生的药理活性物质,例如4-羟基睾酮4-oht)因此也可用于治疗ar阴性的erβ阳性乳腺癌。这样的erβ阳性且ar阴性乳腺癌的一个高度相关的例子是三阴性乳腺癌(tnbc)。
本申请的发明人现已发现,在局部施用4-oha(或其酯)时,4-oha的代谢发生在乳腺的脂肪组织和肿瘤组织中。例如,代谢是由醛酮还原酶介导的,减少了前体药物中存在的酮基。如本申请发明人所发现的,将4-oha还原为4-oht的酶是akr1c3(醛酮还原酶族1成员c3)。由于(仅)存在一个oh基团(与代谢产物的至少两个oh基团相比),4-oha或其酯的经皮渗透性比代谢产物本身的经皮渗透性更好。代谢产物的实例为4-ohepi(4-β-羟基表雄酮)、4-ohba或4-oht。
通过在erβ阳性且任选为ar阳性乳腺癌组织局部施用所述前体药物(类固醇化合物)或其酯,和/或局部施用4-oht或4-ohba或其各自的酯(尤其是4-oht或其酯),可以实现肿瘤尺寸的缩小。由于这种尺寸的缩小,乳腺肿瘤组织进行可以手术切除,同时比不进行治疗时更大程度地保留患病乳房。换句话说,通过使用前体药物,或者4-oht或4-ohba或其各自的酯(尤其是4-oht或其酯),通常可以避免患病乳房的完全切除。相反,可以进行保乳手术。因此,在本发明中,应在计划外科切除乳腺肿瘤组织之前施用该前体药物。
此外,由于与药理活性物质的oh基团数目相比,前体药物的oh基团数目较少,因此前体药物(或其酯)的经皮渗透性更强,在患处(乳房)局部使用前体药物4-oha(或其酯)比局部使用药理活性物质更好。
具体而言,本申请的发明人已经发现,式i的前体药物或其酯的代谢产物在c4位置和c17位置的羟基,在实现本发明的目的中发挥重要作用:
相比于例如在c4位上没有羟基的β-二醇,代谢的类固醇化合物c4位上的羟基可使所得的药理活性物质更精确地区分乳腺肿瘤组织表达的erα和erβ。如所发现的,在c4位上显示羟基的本发明的代谢产物,相较于对erα的结合亲和力,其对erβ的结合亲和力明显更高。例如,代谢产物4-ohba对erβ的亲和力比其对erα的亲和力高约10倍。此外,研究发现通过与erβ结合,会增强erβ在乳腺癌肿瘤组织中的表达。这种增强的erβ表达反过来会导致肿瘤抑制的增强。
除了上述c4位置的oh基对增强erβ(而不是erα)亲和力的有益作用外,根据式i的类固醇化合物中oh基的该特定位置,还有进一步的有益特性:由于类固醇化合物4-oha不是催化睾酮转化为二氢睾酮(dht)的5α-还原酶的底物,所以强烈促进了新陈代谢,从而增强了对雄激素受体(ar)的亲和力;并抑制与shbg(性激素结合球蛋白)的结合。
已发现不仅是与erβ的结合,与雄激素受体(ar)的结合也会导致erβ表达的增加。此外,与ar结合可导致细胞增殖的减少,甚至抑制细胞增殖。如果ar由肿瘤细胞(例如乳腺癌肿瘤细胞)表达,则是非常有益的。
本发明的类固醇化合物与ar的结合是通过位于c17位置的oh基介导的。也就是说,c17位置的羟基还具有使类固醇化合物具有结合雄激素受体(ar)的能力的效果。这继而会导致ar介导的信号通路的激活,从而最终引起细胞增殖的终止(或至少是减少)。
然而,更令人惊讶的是,在本发明中发现,4-oha在治疗不表达ar的erβ阳性乳腺癌患者时也发挥有益的作用。tnbc是此类乳腺癌非常重要的一个例子。令人惊讶的是,在本发明中发现,在前体药物4-oha或4-oht的治疗后,tnbc的肿瘤体积可以被减小。这是令人惊讶和值得注意的,特别是tnbc被认为是一种非常具有侵袭性的乳腺癌:由于缺乏erα、pr和her2/neu的表达,迄今已知的治疗效果并不理想。因此,有必要改进erα阴性乳腺癌,特别是tnbc的治疗。
4-ohba应是遵循同样的原则发挥作用。这些化合物的酯也可以同样使用,因为这样的酯分别被代谢成各自的化合物,4-oha、4-oht和4-ohba。
因此,本发明涉及式i的类固醇化合物4-羟基雄甾-4-烯-3,17-二酮(4-oha)或其酯
式i
作为前体药物在治疗患有雌激素受体β(erβ)阳性和/或雄激素受体(ar)阳性乳腺癌,或erβ阳性且ar阴性乳腺癌患者的方法中的用途,其中所述前体药物局部施用于患者。优选地,治疗在计划手术切除乳腺肿瘤组织之前进行(术前治疗)。
如在本发明中另外发现的,在如本文公开的治疗方法中也可以使用4-oht代替前体药物4-oha。同样可以使用4-ohba以及4-oha的酯,4-oht的酯和4-ohba的酯。
所述前体药物被认为代谢为至少在c4位和c17位具有羟基的药理活性化合物,例如4-羟基睾酮:
(4-oht),和
(4-ohba)。
通过使用所述前体药物或选自4-oht、4-ohba、4-oha的酯、4-oht的酯和4-ohba的酯(特别是4-oht及其酯)的药物治疗患有erβ阳性并且优选(但不必须)也具有ar阳性的乳腺癌患者,在治疗结束后肿瘤组织显著减少。其结果是,与治疗开始时的肿瘤组织相比,肿瘤组织的尺寸减少到使后续手术能够以保乳手术的方式进行。换句话说,可以避免完全切除患病乳房。
因此,在一个实施方式中,术前治疗包括术前缩小乳腺肿瘤组织。
如果不能从其他信息或数据得知,可以通过本领域技术人员已知的标准方法确定(并且,如果需要的话,量化)靶细胞或靶组织的ar和/或erβ(以及erα)的受体状态。此类标准方法包括涉及ar和/或er特异性抗体的免疫分析、dna和/或rna杂交分析或涉及ar和/或er特异性核酸探针的pcr扩增检测。
在优选的实施方式中,与治疗初期乳腺肿瘤组织的尺寸相比,患病乳房的肿瘤组织减少至少13vol.-%、至少14vol.-%、至少15vol.-%,或至少20vol.-%,优选至少30vol.-%,更优选至少40vol.-%,甚至更优选至少50vol.-%、至少60vol.-%或至少70vol.-%。肿瘤组织的尺寸可以通过任何本领域技术人员已知的合适方法来确定,如超声波、x光或乳房x光摄影检查。在一个实施方式中,可在治疗40天后达到上述肿瘤体积的减小。
另一方面,根据本发明的代谢的类固醇化合物4-oha,在比较其对雌激素受体β(erβ)的结合亲和力和对雌激素受体α(erα)的结合亲和力时,对乳腺肿瘤组织表达的雌激素受体β(erβ)表现出更高的结合亲和力。在优选的实施方式中,该药理活性物质表现出对erβ的结合亲和力至少是对erα的结合亲和力的3倍,优选至少4倍、5倍或6倍,更优选至少9倍甚至10倍。
因此,本发明式i的代谢的类固醇化合物表现出由c4-oh基团介导的对erβ的结合亲和力,和由c17-oh基团介导的对ar的结合亲和力。
在一个实施例中,对ar的特异性结合亲和力为ic50≤500nm的范围内,例如ic50≤100nm或ic50≤50nm,其中ic50定义为降低参考化合物5α-二氢睾酮(dht)50%特异性结合所需的化合物浓度。ic50的值可以通过已知的方法来确定,使用放射性标记的dht作为参考化合物,例如raynaudetal.,j.steroidbiochem.6,615-622(1975)描述的标准葡聚糖木炭吸附法,使用放射性标记的[3h]-dht的1nm参考浓度,或采用文献中描述的类似的ic50测定方法。因为靶细胞中ar的浓度非常低,通常约在纳摩尔范围内,所以结合常数与本发明所设想的级别(order)的差异是显著的。
本发明的类固醇化合物在代谢成药理活性物质后,还任选地表现出雄激素受体(ar)结合亲和力。在ar阳性的乳腺癌细胞中,这种结合导致erβ表达的增加,同时细胞增殖被抑制或至少减少,优选为显著地减少。
此外,优选地,本发明的化合物不是5α-还原酶的底物。由于这些物质不像例如睾酮那样容易代谢,因此它们对肿瘤细胞的抑制作用大大增强,而且它们还会对肿瘤细胞本身产生凋亡作用。
由于本发明的化合物是ar特异性化合物,但不被芳香化酶代谢,它们可以通过ar充分发挥其与具体定义的治疗用途相关的作用和效果。然而,正如本发明中发现的,肿瘤组织中ar的表达(存在)并不是前体药物及其代谢产物如4-ohba或4-oht发挥积极作用的必要条件。相反,正如本发明所示,前体药物及其代谢产物主要通过激活肿瘤组织上表达的erβ来发挥其有利作用。因此,肿瘤组织不必除表达erβ外还表达ar。
在优选的实施方式中,该药理活性物质选自4-羟基-5-α-雄甾-3-β,17-β二醇(4-ohba)和4-羟基睾酮(4-oht)。
在用本发明化合物进行的实验中,可表明根据式i的类固醇化合物(4-oha)或其酯具有优异的经皮渗透能力,因此可通过对病人需要治疗的区域进行简单地局部施用例如软膏、乳液或乳霜来实现充分的肿瘤抑制或减小肿瘤尺寸,这些软膏、乳液或乳霜包含治疗有效量的或预防有效量的(优选使治疗有效量的)根据本发明的类固醇化合物。局部给药后,化合物会穿透皮肤并集中于脂肪组织。
因此,在另一方面,本发明涉及一种适用于局部施用的药物组合物在治疗患有雌激素受体β(erβ)阳性且任选地雄激素受体(ar)阳性乳腺肿瘤的患者中的用途,所述药物组合物包含作为前体药物的式i的类固醇化合物4-羟基雄甾-4-烯-3,17-二酮(4-oha)或其酯,
式i
以及药学上可接受的载体和/或赋形剂,或所述药物组合物包含选自4-oht、4-ohba、4-oht的酯和4-ohba的酯的化合物以及药学上可接受的载体和/或赋形剂,其中所述治疗在计划手术切除乳腺肿瘤组织之前进行。
在优选的实施方式中,其中术前治疗包括以有效减少乳腺肿瘤组织的量局部施用所述药物组合物。根据治疗开始时肿瘤的尺寸,用量可以根据患者的情况单独调整。
在另一实施方式中,前体药物4-oha或其酯,或选自4-oht、4-ohba和它们的酯(特别是4-oht)的化合物,在药物组合物中的存在量占药物组合物的量的约1.5wt.-%至约4wt.-%,优选约2.0wt.-%至约3.0wt.-%,更优选约2.0wt.-%至约2.5wt.-%。
如本文其他地方所公开的,将前体药物4-oha局部施用于需要的患者可导致肿瘤尺寸的减小,从而能以保乳方式切除乳腺癌组织,也就是说,可以避免患病乳房的完全切除。因此,这种术前治疗应进行足以将乳腺肿瘤组织缩小到允许进行保乳手术切除的尺寸的一段时间。
在优选的实施方式中,术前治疗进行了达6个月或达5、4、3或2个月的时间。
乳腺肿瘤组织也可能在11周或10、9、8、7、6、5、4、3或2周的术前治疗之后缩小到允许进行保乳手术切除的尺寸。
在另一实施方式中,术前治疗不迟于计划手术(即乳腺肿瘤组织的保乳手术切除)前6个月,或不迟于计划手术前5、4、3或2个月开始。
术前治疗也可能不迟于计划手术前11周或10、9、8、7、6、5、4、3或2周时开始。
术前治疗也可能不迟于计划手术前8周开始,优选不迟于手术前6周或5周开始。
通过将前体药物(或分别包含前体药物的药物组合物)或其代谢物(例如4-oht和/或4-ohba或其酯)局部施用于皮肤,所述前体药物或代谢物经皮吸收,从而被局部带到预期作用部位。这种药理活性物质集中在导管周的脂肪组织中。在长期治疗中,受治疗乳房的脂肪物质明显减少。这种减少导致具有雌激素形成能力的雌激素形成细胞的数量的减少。该药理活性物质的亲脂性和疏水性导致该药理活性物质仅局部集中在脂肪组织中,因此不能显示任何显著的全身作用。
在本发明中,将药物组合物或药物分别局部施用于预期作用部位或其附近。根据本发明,所获得的结果是,在病变组织(治疗中)中局部有足够的药理活性物质水平,而在血液循环中没有发生对药理活性物质的明显吸收。因此,本实施例的益处不仅在于局部施用本身,而且在于此方式使得活性化合物立即集中在有患病风险的组织和/或病变组织中,而不是通过血液循环间接地集中。
为进行局部给药,该药物组合物或药物优选地配制成软膏、乳霜、凝胶、乳剂或乳液。也可以考虑配置成粉末或油。来自化妆品和医药行业的技术人员熟悉配方基础,在此无需更详细地解释。例如,植物油和脂肪,如杏仁油、花生油、橄榄油、桃仁油、蓖麻油、植物浸出液、精油;植物蜡、合成油和动物油、脂肪或蜡;卵磷脂、羊毛脂醇、胡萝卜素、香料、一元或多元醇、尿素、防腐剂和着色剂等都可以使用。优选配方是水包油或油包水乳液。
本发明前体药物的适当药物含量可以为0.0001到20wt%之间,优选0.6wt%到10wt%之间,更优选1wt%到5wt%之间。通常的范围是0.6wt%到5wt%之间。
如果将物质混合以促进经皮渗透,例如当使用透明质酸酶时,它们的含量可以是0.01到1wt%之间,优选为0.05到0.2wt%之间。当使用二甲基山梨醇或dmso时,含量可以是1到25wt%之间,优选为5到10wt%之间。
由于上述治疗的主要目标疾病,尽管同样的治疗原则也适用于男性乳腺癌,但局部针对性治疗主要针对女性患者,尤其是女性患者的胸部皮肤。
另一方面,本发明还涉及4-oha或其酯作为前体药物在erβ阳性乳腺癌组织的术前局部治疗中的用途。
本发明还涉及选自4-oht、4-ohba及它们的酯(特别是4-oht)的化合物在erβ阳性且任选地另加ar阳性乳腺癌组织的术前局部治疗的用途。在本发明中令人惊奇地发现,当用于治疗表达erβ而不表达ar的乳腺癌组织时,前体药物4-oha或代谢物4-oht也显示出它们的有益作用。因此,在优选的实施方式中,前体药物4-oha或其酯或代谢物4-oht被用于患有erβ阳性且ar阴性乳腺癌的患者的术前治疗。4-ohba被认为基于同样的原则是有效的。可以相应地使用这些化合物的酯,因为这样的酯分别代谢成相应的化合物4-oha、4-oht和4-ohba。
最后,本发明还涉及如本文所述的药物组合物的所述用途,其中erβ阳性乳腺癌是三阴性乳腺癌(tnbc),其中所述药物组合物除了所述前体药物4-oha或其酯和/或选自4-oht、4-ohba及其酯的化合物之外,还包含结合并激活erβ的另一活性成分,其不同于前体药物4-oha,也不同于选自4-oht、4-ohba及其酯类的化合物。
在优选的实施方式中,所述另一活性成分是抗雌激素和/或抗癌吲哚化合物。在另一优选的实施方式中,抗雌激素是例如氟维司群或他莫昔芬。抗癌剂吲哚化合物优选为改变雌激素代谢或有效抑制癌细胞的生长的吲哚衍生物。抗癌吲哚化合物的一个例子是吲哚-3-甲醇。
附图
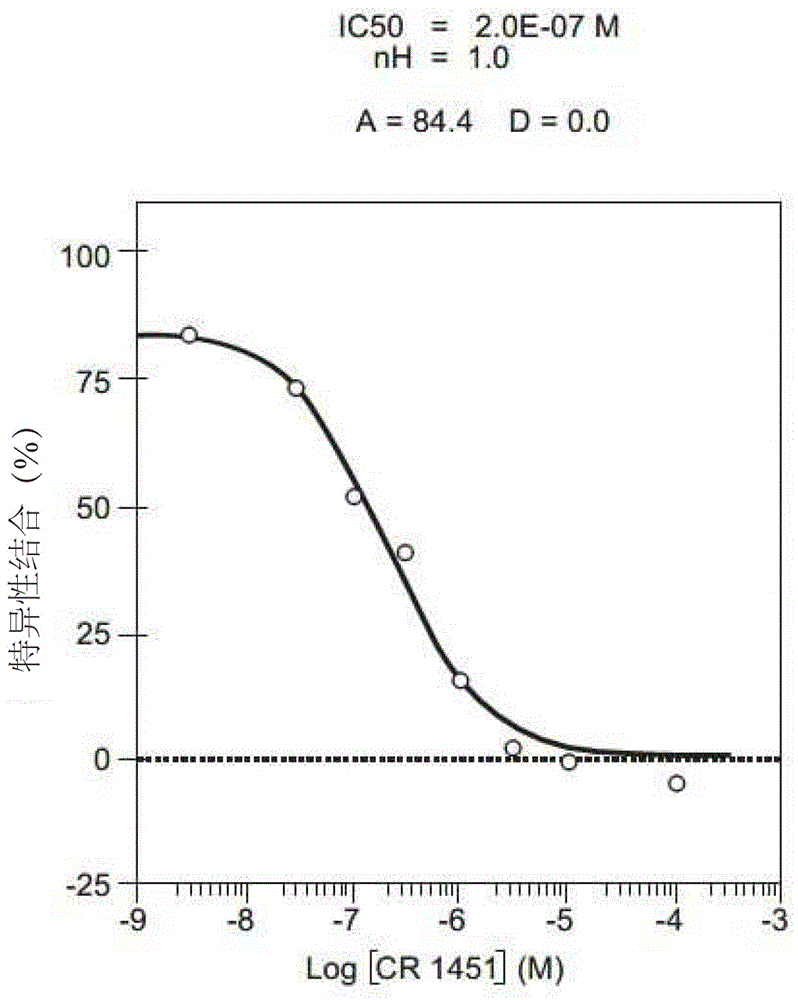
图1所示为根据本发明以[%]显示特异性结合。
图2所示为两种不同浓度的mdamb-231细胞与浓度逐渐增加的4-oht(k+)的孵育。
图3显示2.0%save乳膏治疗前后的平均肿瘤体积。
以下实施例说明但不限制本发明。
实施例
1.乳腺肿瘤组织萎缩的观察
1.1(通过乳房x光检查)诊断为erβ阳性乳腺癌肿瘤(最大尺寸为2厘米)的患者,使用包含本发明前体药物的药物组合物进行治疗:前体药物局部施用于患病乳房。
在经过三周的治疗后,可以观察到肿瘤尺寸的缩小。
1.2将4ml含2.5wt.-%4-oha的乳霜(每天2次)涂在患有er阳性乳腺癌的乳房上。3-5周后,肿瘤的大小已明显减少。
2.阿那曲唑(anastrozol)和来曲唑(letrozol)与本发明前体药物治疗成功率的比较
研究在患有erβ阳性乳腺癌的患者上进行。
首先,患者按照各自现行治疗指南,接受非类固醇芳香化酶抑制剂阿那曲唑或来曲唑的治疗。然而,各自的治疗都不成功。
然后,使用包含本发明前体药物的药物组合物治疗所述患者,即,将前体药物(4-oha)局部施用于患病乳房。
据观察,采用这种方法治疗的患者中有50%病情可以达到稳定6个月。
3.在与4-oht孵育期间对mdamb-231细胞增殖的抑制
mda-mb-231细胞系是一种高攻击性、高侵入性、低分化的人乳腺癌上皮细胞系。它缺乏雌激素受体α(erα)和孕激素受体(pr)的表达,以及her2(人表皮生长因子2)的扩增。mda-mb-231细胞系是erβ阳性。它酯呈erβ阳性的三阴性乳腺癌(tnbc)的模型细胞系。
将两种不同浓度(1.0e3and2.5e3)的mda-mb-231细胞与浓度逐渐增加(k+;0.5µm;1µm;5µm;10µm;20µm)的4-oht孵育。将细胞孵育6天。然后测量492nm处的吸收。
图2的图表显示,从至少5µm/l4-oht的浓度开始,细胞的生长被显著抑制。5µm/l的4-oht对细胞生长的抑制作用约为50%(细胞浓度为1.0e3),而20µm/l浓度的4-oht对细胞生长的抑制作用约为75%至80%。
4.三阴性乳腺肿瘤组织(tnbc)萎缩的观察
已经有16例患有erα阳性和erβ阳性乳腺癌(“er+”)的乳腺癌患者和6例患有erβ阳性且患tnbc(“er-”:ar阴性;her2/neu阴性;erα阴性)的乳腺癌患者,以在典型的非活性乳霜基质中含有4-oha作为活性成分的乳霜(“save乳霜”)进行治疗。
肿瘤已用4-oha治疗约3周(平均疗程21.2天)。给药剂量如下:每天每乳在乳霜基质(“save乳霜”)中的2x2或2x4g2.0wt.-%4-oht。
在使用含4-oht的乳膏治疗前后评估平均肿瘤体积。可以看出,在er+患者的肿瘤体积(mm3)缩小75%,而在er-患者肿瘤体积缩小14%。这是令人惊讶和值得注意的,因为tnbc被认为是一种非常具有侵袭性的乳腺癌:由于缺乏erα、pr和her2/neu的表达,目前已知的治疗效果并不令人满意。然而,如所显示的,用含4-oht的乳霜治疗后,肿瘤体积可缩小14%。
- 还没有人留言评论。精彩留言会获得点赞!