有关耳用治疗剂的药物组合物及方法与流程
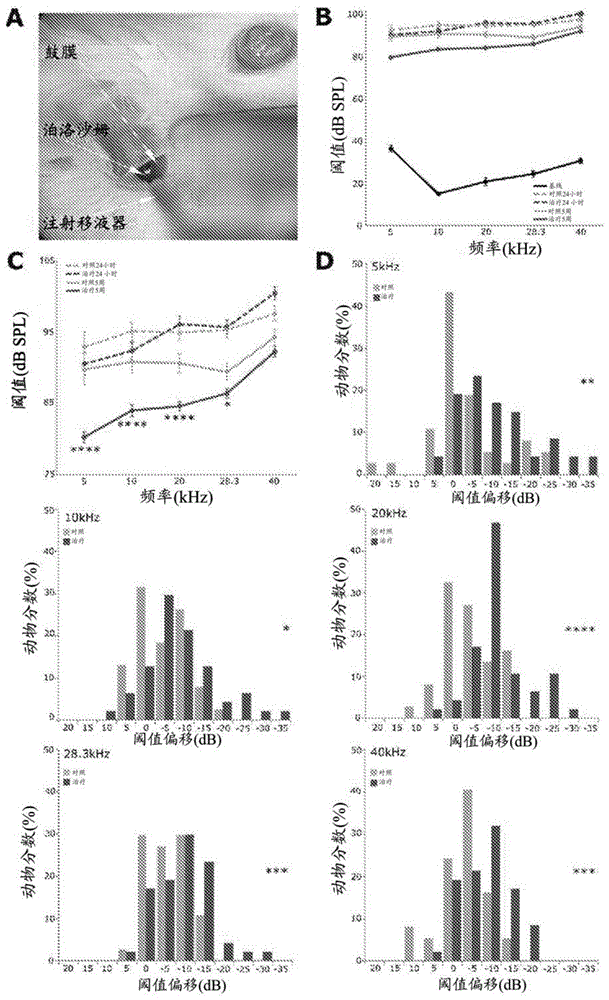
本申请要求2018年10月2日申请的美国临时专利申请序号62/739,933的优先权;其整体以引用方式并入本文。现有技术干细胞在体内呈现产生多种细胞类型的非凡能力。除了胚胎干细胞外,组织特异性干细胞在发育以及成人体内的恒定和损伤修复中也起着至关重要的角色。干细胞通过增殖来更新自身,并通过分化产生组织特异性细胞类型。不同干细胞的特征随组织的不同而不同,并由其固有的遗传和表观遗传状态决定。然而,均严格控制自我更新和不同干细胞分化之间的平衡。不受控制的自我更新可能导致干细胞过度生长并可能形成肿瘤,而不受控制的分化可能耗尽干细胞库,从而导致维持组织恒定的能力受损。因此,干细胞不断感知其环境,并适当地反应增殖、分化或细胞凋亡。希望通过控制干细胞增殖和分化的时机和程度来驱动再生。用随时间清除的小分子控制增殖将允许控制干细胞增殖和分化的时机与程度。值得注意的是,尽管以非常依赖于背景的方式,来自不同组织的组织干细胞共享有限数量的信号传导路径来调节其自我更新和分化。这些路径中的一些是wnt和gsk3-β路径。lgr5在广泛范围的组织中表达并且已被鉴定为多种组织(诸如肠上皮(barker等人2007)、肾脏、毛囊及胃(barker等人,2010;haegebarth&clevers,2009))中的成体干细胞的生物标记。例如,2011年首次发布,哺乳动物的内耳发细胞衍生自lgr5+细胞(chai等人,2011,shi等人2012)。lgr5是wnt/β-连环蛋白路径的已知组分,已显示在分化、增殖和诱导干细胞特征中扮演主要角色(barker等人2007)。内耳发细胞的永久性损伤导致感觉神经性听觉损失,造成很大比例的人群的沟通困难。发细胞是转导听觉刺激的受体细胞。受损发细胞的再生将为治疗目前除了人工装置以外没有疗法的病症提供一条路径。尽管发细胞不会在哺乳动物的耳蜗中再生,但低阶脊椎动物中新发细胞从围绕发细胞的上皮细胞(称为支持细胞)产生。因此,仍然需要新颖药物组合物以在损伤前保护听觉细胞并在损伤后保持/促进现有细胞的功能。仍然需要新颖药物组合物以在损伤后再生耳蜗支持细胞或发细胞。除了上述需要新颖药物组合物以在损伤后再生耳蜗支持细胞或发细胞的理由外,仍然需要能够以有效促进其预期使用的方式提供新颖药物组合物。例如,制造和储存药物组合物直到需要时,提出许多挑战,诸如那些与药物活性成分的稳定性有关的挑战。例如,凝胶制剂可能提出与稳定性相关的特定挑战且干燥的组合物可能不容易重构以形成凝胶制剂。技术实现要素:在一些方面中,本公开提供包含胶凝剂的冻干药物组合物。在一些方面中,本公开提供包含一种或多种耳用治疗剂的凝胶药物组合物,例如,热可逆凝胶。在一些方面中,本文所公开的冻干药物组合物经重构以形成凝胶药物组合物,例如,本文所公开的热可逆凝胶。在一些方面中,本公开提供尤其包含一种或多种耳用治疗剂及胶凝剂的冻干药物组合物。在一些方面中,本公开提供冻干药物组合物,其包含约50至约500mg的泊洛沙姆(poloxamer)及约50至约500mg的式(i)的化合物,例如,丙戊酸(valproicacid)或其药学上可接受的盐。在一些方面中,本公开提供药物组合物,其包含一种或多种耳用治疗剂及胶凝剂。例如,药物组合物可包含纯化的泊洛沙姆及增加浓度的丙戊酸或其药学上可接受的盐,同时保持适合的胶凝特性。在进一步的例子中,药物组合物可包含增加浓度的丙戊酸或其药学上可接受的盐及chir99021或其药学上可接受的盐,其中,增加浓度的丙戊酸或其药学上可接受的盐增加在内耳chir99021或其药学上可接受的盐的量。在一些方面中,本公开提供包含胶凝剂及式(i)的化合物:或其药学上可接受的盐。在一些方面中,本公开提供包含胶凝剂、大于约70mg/ml的浓度的丙戊酸或其药学上可接受的盐及一种或多种耳用治疗剂的药物组合物。在一些方面中,本公开提供适于鼓室内注射的组合物。在一些方面中,本公开提供包含泊洛沙姆的药物组合物,其中,按照wt.%为至少85%的泊洛沙姆具有大于约7250da的平均分子量,且丙戊酸或其药学上可接受的盐以大于70mg/ml的浓度存在。在一些方面中,本公开提供包含泊洛沙姆的药物组合物,其中,按照wt.%为少于20%的泊洛沙姆具有小于约7250da的平均分子量,且丙戊酸或其药学上可接受的盐浓度大于70mg/ml。在一些方面中,本公开提供制备药物组合物的方法,包括下述步骤:(a)具有包含胶凝剂的水溶液;以及(b)添加一种或多种耳用治疗剂或其药学上可接受的盐的溶液。在一些方面中,本公开提供包含胶凝剂及一种或多种耳用治疗剂的冻干药物组合物,其中,组合物不包含额外的增积剂。在一些方面中,本公开提供包含泊洛沙姆及一种或多种耳用剂的冻干药物组合物,其中,组合物不包含抗氧化剂。在一些方面中,本公开提供冻干药物组合物的方法。在一些方面中,本公开提供重构冻干药物组合物的方法。在一些方面中,本公开提供重构的药物组合物。在一些实施方案中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。在一些实施方案中,一种或多种耳用治疗剂为一种或多种与听觉损失相关的生物路径与生物标靶的调节剂。在一些实施方案中,一种或多种耳用治疗剂为发细胞再生剂及/或耳保护剂。在一些实施方案中,一种或多种耳用治疗剂选自由下列组成的组:表1至13中所述的剂及其药物盐。在一些实施方案中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。在一些实施方案中,组合物包含chir99021或其药学上可接受的盐、丙戊酸或其药学上可接受的盐及胶凝剂。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。在一些实施方案中,胶凝剂为热可逆胶凝剂(例如,泊洛沙姆)。在一些实施方案中,泊洛沙姆为泊洛沙姆407。在一些实施方案中,泊洛沙姆为纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。在一些方面中,本公开提供治疗听觉损失的方法,包括向有其需要的受试者施用药学上可接受量的重构溶液,其中,重构溶液通过重构方法使用前述权利要求书中任一项所述的冻干药物组合物制备。在一些方面中,本公开提供药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些方面中,本公开提供药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些方面中,本公开提供药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些方面中,本公开提供处理本公开的药物组合物以形成冻干药物组合物的方法。在一些方面中,本公开提供冻干药物组合物,通过冻干本公开的药物组合物而制备。在一些方面中,本公开提供冻干药物组合物,通过本公开的方法而制备。在一些方面中,本公开提供重构溶液,通过添加稀释剂至本公开的冻干药物组合物而制备。在一些方面中,本公开提供重构溶液,通过添加稀释剂至通过冻干本公开的药物组合物所制备的冻干药物组合物而制备。在一些方面中,本公开提供重构溶液,通过添加稀释剂至通过本公开的方法所制备的冻干药物组合物而制备。在一些方面中,本公开提供重构溶液,通过添加稀释剂至包含一种或多种耳用治疗剂及胶凝剂的冻干药物组合物而制备。在一些方面中,本公开提供促进产生组织及/或细胞的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液到组织及/或细胞。在一些方面中,本公开提供治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的方法,包括向受试者施用药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液。在一些方面中,本公开提供增加在前庭组织中的前庭细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液。在一些方面中,本公开提供治疗患有前庭病症或有发展前庭病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液的冻干药物组合物。在一些方面中,本公开提供增加耳蜗组织中的耳蜗细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液。在一些方面中,本公开提供治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液。在一些方面中,本公开提供增加柯蒂氏器中发现的细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的发细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的内发细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的外发细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的神经元细胞群的方法,包括递送药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液至所述群。在一些方面中,本公开提供治疗患有听觉病症或有发展听觉病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的冻干药物组合物、药物组合物或重构溶液。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于促进产生组织及/或细胞。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加在前庭组织中的前庭细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于治疗患有前庭病症或有发展前庭病症的风险的受试者。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加耳蜗组织中的耳蜗细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加柯蒂氏器中发现的细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加柯蒂氏器中发现的发细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加柯蒂氏器中发现的内发细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加柯蒂氏器中发现的外发细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于增加柯蒂氏器中发现的神经元细胞群。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液,用于治疗患有听觉病症或有发展听觉病症的风险的受试者。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造促进产生组织及/或细胞的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加在前庭组织中的前庭细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造治疗患有前庭病症或有发展前庭病症的风险的受试者的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加耳蜗组织中的耳蜗细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加柯蒂氏器中发现的细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加柯蒂氏器中发现的发细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加柯蒂氏器中发现的内发细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加柯蒂氏器中发现的外发细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造增加柯蒂氏器中发现的神经元细胞群的药剂。在一些方面中,本公开提供本公开的冻干药物组合物、药物组合物或重构溶液的用途,其用于制造治疗患有听觉病症或有发展听觉病症的风险的受试者的药剂。除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开所属领域中具有通常知识者通常所理解的相同含义。在说明书中,单数形式也包括复数,除非上下文另外明确指出。尽管类似于或等同于本文描述的那些的方法和材料可以用于本公开的实践或测试中,但是下面描述适合的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献出于所有目的以引用方式并入。不承认本文引用的参考文献为要求保护的发明的现有技术。在冲突的情况下,以本说明书(包括定义)为准。此外,材料、方法和实施例仅是说明性,并不意图是限制性。在化学结构和本文所公开的化合物的名称之间发生冲突的情况下,以化学结构为准。根据以下的具体实施方式和权利要求书,本公开的其他特征和优点将显而易见。附图说明图1:显示针对在对诱发的听觉损失的噪音损伤模型中治疗的听觉脑干反应(abr)的分析。在体内噪音损伤模型中,以chir99021+vpa治疗导致听力改善。(a)注射过程的图像,经鼓室注射泊洛沙姆到小鼠的中耳。(b)与暴露前的基线相比,指定为对照组和治疗组的动物在噪音暴露后24小时和5周阈值升高。对照n=37只动物,治疗n=47只动物。(c)在注射后5周,相对于对照动物而言,在所测试的5种频率中的4种,经治疗动物的听力阈值显著较低。(d)分析个体听觉恢复的分布。值表示引发abr反应所需的db变化,正值表示阈值进一步增加(进一步听觉损失),而负值表示阈值减少(改善听觉)。对于每个测试频率,显示具有给定abr变化从24小时到5周的动物比例。治疗组具有较高动物听觉改善发生率和个体康复最高。值表示为平均值±se;*=p<0.05,**=p<0.01,***=p<0.001,****=p<0.0001。图2显示针对在对诱发的听觉损失的噪音损伤模型中治疗的发细胞计数的分析。(a)健康分离的耳蜗切片的低放大倍率视图,显示完整的内部发细胞(ihc)和外部发细胞(ohc)行。(b)a)中强调的区域的高放大倍率视图,显示中频区域中完整的ihc和ohc。(c)注射媒介物的动物的耳蜗在整个耳蜗中显示出广泛的发细胞损失(显示顶点和中部区域)。(d)在(c)中强调的区域的高放大倍率视图,显示中频区域中基本上没有发细胞,其中在视野中可以看到单个ihc(实心箭头)。(e)与经媒介物处理的动物相比,经cv(chir99021和navpa)处理的动物的耳蜗显示更大的发细胞整体群(显示顶点和中部区域)。(f)在(e)中强调的区域的高放大倍率视图,显示完整的ihc行(实心箭头)和ohc群(空心箭头)。(g)经cv处理的耳蜗(蓝色)相对于经媒介物处理的耳蜗(灰色)显示显著更多的总发细胞、ihc和ohc。(h)发细胞数,以相对于未受损的健康耳蜗的百分比描述。经cv处理的耳蜗(蓝色)相对于经媒介物处理的耳蜗(灰色)显示显著较高百分比的总发细胞、ihc和ohc。比例尺,100μm低放大倍率,20μm高放大倍率。值以箱须图呈现;每组n=7只动物,*=p<0.05,**=p<0.01。图3.动物模型数据:在20khz和28.3khz处看到的阈值显著改进。图4.动物模型数据:在所有频率下看到的阈值都有显著改进。图5动物模型数据:在所有频率下看到的阈值都有显著改进。图6:navpa对数平均浓度。图7:chir99021的对数平均浓度。图8:不使用适当的冻干循环的冻干测试组合物。图9:使用经发展的冻干循环制造的冻干测试组合物。图10.测试组合物时间过程的稳定性。图11.时间t后测试组合物的溶液。图12.在冷藏注射器内的重构navpa和chir99021测定量。图13:纯化前(红色迹线)和纯化后(蓝色迹线)的色谱图p407批次gnac17521c。图14:高分子量(hwm)杂质对应于非常小重量百分比。若存在,在所需mw峰之前,观察到高分子量杂质为小肩峰洗脱。色谱图说明两批未纯化的p407的hmw含量。图15:图12的部分放大。图16:通过sec分析的peg标准品的分子量校准曲线。图17:累积分子量分布。图18:空白h2o注射与1%p407样品相比的典型cad色谱图。图19:具有杂质的p407的rplc-cad色谱图在色谱图中分“区域”。图20:冻干测试组合物a(表35项目2)。图21:冻干测试组合物b(表35项目3)。图22:冻干测试组合物c(表35项目4)。图23:冻干测试组合物d(表35项目5)。图24:冻干测试组合物e(表35项目6)。图25:来自表35的重构组合物a(a1)、b(b-1)、c(c-1)、d(f-1)及e(g-1)。图26:冻干前后液体安慰剂中的醛含量。具体实施方式在一些方面中,本公开提供,尤其,包含一种或多种耳用治疗剂(例如,chir99021及丙戊酸钠)与胶凝剂(例如,泊洛沙姆407)的冻干药物组合物。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐及丙戊酸钠或其药学上可接受的盐)与胶凝剂(例如,泊洛沙姆)的冻干药物组合物。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,ly2090314或其药学上可接受的盐及丙戊酸钠或其药学上可接受的盐)与胶凝剂(例如,泊洛沙姆)的冻干药物组合物。在一些方面中,本公开提供包含胶凝剂(例如,泊洛沙姆)及式(i)的化合物(例如,hdac抑制剂,诸如丙戊酸或其药学上可接受的盐)的冻干药物组合物。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐)的药物组合物,其中,增加浓度的一种或多种耳用治疗剂(例如,丙戊酸或其药学上可接受的盐)之一增加另一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐)在内耳的量。在一些方面中,本公开提供包含某些纯度的胶凝剂(例如,泊洛沙姆)与某些浓度的一种或多种耳用治疗剂(例如,丙戊酸或其药学上可接受的盐)的药物组合物。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐)与胶凝剂(例如,泊洛沙姆)的冻干药物组合物,其中组合物不包含额外的增积剂。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐)与胶凝剂(例如,泊洛沙姆)的冻干药物组合物,其中组合物不包含抗氧化剂。在一些方面中,本公开提供制备本公开的药物组合物的方法。在一些方面中,本公开提供制备药物组合物的方法,包括下述步骤:(a)具有包含胶凝剂(例如,泊洛沙姆)及一种或多种耳用治疗剂(例如,丙戊酸或其药学上可接受的盐)的溶液;以及(b)添加一种或多种耳用治疗剂(例如,chir99021或其药学上可接受的盐)的溶液。在一些方面中,本公开提供冻干药物组合物的方法。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021及丙戊酸钠)与胶凝(例如,泊洛沙姆407及其他聚环氧乙烷-聚环氧丙烷嵌段共聚物,包括三嵌段聚合物)或其他热可逆(也称“热固性”胶凝剂)诸如聚乳酸(pla)-聚环氧乙烷嵌段共聚物(包括peo-pla-peo三嵌段共聚物)的药物组合物(例如,预冻干药物组合物)。在一些方面中,本公开提供处理本公开的药物组合物以形成冻干药物组合物(例如,本公开的药物组合物)的方法。在一些方面中,本公开提供包含一种或多种耳用治疗剂(例如,chir99021及丙戊酸钠)与胶凝(例如,泊洛沙姆407)的重构溶液。在一些方面中,本公开提供包含泊洛沙姆407、chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、chir99021或其药学上可接受的盐及2-己基-5-戊炔酸或其药学上可接受的盐(例如,2-己基-5-戊炔酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、chir99021或其药学上可接受的盐及亚麻油酸或其药学上可接受的盐(例如,亚麻油酸钠(sodiumlineolate))的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、ly2090314或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、azd1080或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、gsk3xxii或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、化合物i-7或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、化合物i-1或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、化合物i-3或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供包含泊洛沙姆407及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的冻干药物组合物。在一些方面中,本公开提供适于鼓室内注射包含泊洛沙姆407、为至少约120mg/ml的浓度的丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的药物组合物。在一些方面中,本公开提供包含至少85wt%.%具有平均分子量大于约7250的泊洛沙姆407及浓度大于120mg/ml的丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的药物组合物。在一些方面中,本公开提供包含泊洛沙姆407、丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的冻干药物组合物,其中,在组合物中不包含额外的增积剂。在一些方面中,本公开提供包含泊洛沙姆407、丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的冻干药物组合物,其中,在组合物中不包含抗氧化剂。在一些方面中,本公开提供制备药物组合物的方法,包括下述步骤:(a)具有包含泊洛沙姆407及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)的水溶液;以及(b)添加包含dmso及chir99021或其药学上可接受的盐的溶液。在一些方面中,本公开提供冻干包含泊洛沙姆407、丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的药物组合物的方法,其中,方法包括:(a)提供药物组合物;(b)通过下述冻干组合物:(i)以每分钟0.5℃的速率降低冻干器中的温度到-45℃,之后保持在-45℃达3小时;(ii)施加80毫托的真空;(iii)增加温度至-30℃(以每分钟0.5℃的速率)并在80毫托的真空下保持在-30℃达15小时;(iv)增加温度至15℃(以每分钟0.5℃的速率);及/或(v)在80毫托的真空下保持温度在15℃达20小时;以及(c)获得冻干药物组合物。在一些方面中,本公开提供冻干包含泊洛沙姆407、丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)及chir99021或其药学上可接受的盐的药物组合物的方法,其中,方法包括:(a)提供药物组合物;(b)通过下述冻干组合物:(i)以每分钟约0.5℃的速率在冻干器中降低温度到约-45℃,之后保持其在约-45℃达约3小时;(ii)施加约80毫托的真空;(iii)增加温度至约-30℃(以每分钟约0.5℃的速率)并在约80毫托的真空下保持在约-30℃达约15小时;(iv)增加温度至约15℃(以每分钟约0.5℃的速率);及/或(v)在约80毫托的真空下保持温度在约15℃达约20小时;以及(c)获得冻干药物组合物。改进的重构时间提供药物组合物的方式为呈干燥或非水合形式,例如作为片剂,因为这典型使组合物中的药物活性成分稳定一段有用时间段(可能历时所制造的组合物至施用组合物时间之间)。药物活性成分通常在干燥组合物中在其可经受的时间段内在变化的条件(温度,湿度等)下稳定。然而,对于以溶液或凝胶形式施用的药物组合物,制造到施用之间的时间提出了重大挑战,因为组合物中的药物活性成分在溶液中延长时间段可能不稳定,并开始降解,从而产生降解问题。发明人通过冻干药物组合物以改进稳定性,达例如在制造和施用之间的有用时间段,而解决此降解问题。当组合物的组分缓慢溶解到溶液中(即,具有差溶解度)时,降解问题会进一步加剧。例如,随着溶解溶液中的组分所花费的延长时间段,会发生降解。此外,随着时间段的流逝,组分可能从溶液中沉淀出来。在这种情况(其中因为组合物具有两种情况,一种是在制造组合物时,而另一种是在重构组合物时,因此组分也具有差的溶解性)下,组合物的冻干并不一定解决降解问题,其中组合物在延长时间段以溶液形式存在,可能导致组分降解。尽管制备组合物的长时间段是可能可接受(因为此可以在受控制的环境中完成),但是重构冻干药物组合物所花费的长时间段并不总是可行,因为这典型会在可能变化且无法控制的环境下施用组合物之前立即发生,例如在医疗环境中。因此,仍然需要能够制造稳定并在可接受的时间尺度上重构的冻干组合物。本公开对上述问题提供解决方案。令人惊讶地,已经发现,包含胶凝剂和有机酸的盐的冻干组合物比冻干之前溶解其组成部分所花费的时间更快地重构(即,溶解到溶液中)。这意味着可以制造组合物,冻干以产生稳定的组合物,储存,然后在施用之前快速地被重构。也显示,与呈溶液形式的组合物不同,冻干组合物的组分在延长时间段是稳定的。因此,本公开提供例如相对于冻干之前其组成部分而言具有改进的重构时间的组合物。在一个实施方案中,本公开提供相对于没有冻干的其组成部分(例如,作为非冻干粉末、晶体或其他形式)而言具有改进的重构时间的组合物。将通过非限制性例子来说明问题的解决方案。例如,包含泊洛沙姆及丙戊酸或其药学上可接受的盐的冻干组合物可以比单独的冻干泊洛沙姆或粉末化泊洛沙姆(即,非冻干泊洛沙姆)快约三倍地重构。此结果是出乎意料的,并且使得能够快速重构药物组合物。快速的重构时间特别有用于当快速制备组合物是不可实施或组合物等待长时间段重构是不可实施,例如,因为此导致组合物的成分的降解。耳用治疗剂的渗透增加药物组合物向内耳,特别是耳蜗,的递送通常依赖于药物组合物向耳蜗(且特别是向柯蒂氏器)的扩散及/或渗透。因此,期望增加渗透到耳蜗及/或柯蒂氏器中,并且还期望在此之前避免组合物分解,及/或在递送到耳蜗或柯蒂氏器之前耳用治疗剂从溶液中沉淀出来。因此,需要一种药物组合物,其中耳用剂更有效地扩散及/或渗透到耳蜗(和柯蒂氏器)。本发明提供上述问题的解决方案。令人惊讶地,已经发现包含高浓度的如本文由式(i)所定义的有机酸(例如,丙戊酸或其药学上可接受的盐)的药物组合物增加耳蜗内耳用治疗剂的量。将通过非限制性例子来说明问题的解决方案。例如,包含ch99021或其药学上可接受的盐和增加量的丙戊酸或其药学上可接受的盐(例如,大于100mg/ml)的药物组合物导致施用后耳蜗内发现的ch99021量非线性增加。例如,组合物中丙戊酸或其药学上可接受的盐的量增加~50%可导致耳蜗中chir99021远超过50%增加。耳蜗中chir99021的增加可能在4至14倍区域中。因此,组合物中增加浓度的丙戊酸或其药学上可接受的盐可以使耳蜗中丙戊酸或其药学上可接受的盐的浓度增加至少一个数量级。此结果是出乎意料的,并且能够改善药物活性剂向难以靶向且难以接近的耳朵部分递送。纯化的泊洛沙姆在一些情况下,本发明描述呈溶液形式的药物组合物,其包含泊洛沙姆。当泊洛沙姆以某浓度溶解在组合物中时,其可以赋予组合物多种性质,诸如某种粘度及/或某种胶凝温度。在一些情况下,本发明需要具有一定粘度的药物组合物,当加热至约体温时,形成不动凝胶。在组合物中以特定浓度包含进一步组分可能以使得当加热至约体温时形成不动凝胶的能力减弱(例如,其中凝胶为热可逆凝胶)的方式干扰组合物的粘度及/或胶凝。因此,组合物可以耐受进一步组分,例如治疗组分,的浓度有上限,同时保留适合使用的物理性质。因此,需要提供一种药物组合物,其具有增加量的进一步组分,例如,治疗组分,同时维持胶凝特性以制造药物组合物。本发明提供上述问题的解决方案。令人惊讶地,已经发现在制造药物组合物之前纯化泊洛沙姆能够使增加浓度的其他组分经耐受,同时维持组合物的胶凝特性。例如,包含纯化的泊洛沙姆的组合物可以耐受增加浓度的离子组分,例如,有机酸的盐。通过纯化泊洛沙姆允许的组分浓度的增加可以允许达到治疗组分浓度的增加而不会不利地影响组合物的其他性质。纯化的泊洛沙姆可以通过本文列出的方法及/或措施任一者,以任何组合,包括在编号的实施方案和实施例中公开的那些方法及/或措施来制备或表征。将通过非限制性例子来说明问题的解决方案。例如,包含泊洛沙姆407的药物组合物将具有某个胶凝温度。在一些情况下,组合物理想地在约体温时形成凝胶。然而,组合物中的其他组分可干扰组合物形成凝胶的温度。对于包含泊洛沙姆407的特定组合物(其中泊洛沙姆407尚未纯化),可以达到约80mg/ml的丙戊酸钠浓度。在高于80mg/ml的浓度下,胶凝温度可能会受到干扰,并且组合物的理想特性(诸如胶凝温度)会减弱。出乎意料的是,对于包含纯化的泊洛沙姆407的药物组合物,在维持所需的胶凝温度的同时,可以达到大于约80mg/ml的丙戊酸钠浓度。由于凝胶组合物通常不适合储存或分布,因此可以如本文所述冻干凝胶组合物。因此,那些冻干的组合物将具有比否则可能的(例如,未纯化的泊洛沙姆)具有更高浓度的进一步组分,诸如治疗组分,同时在重构时保持有利的凝胶性质。例如,在凝胶包含给定量的水的情况下,由所述凝胶制造的冻干组合物提供许多益处。例如,此冻干组合物可以例如用相同或相似的给定量的水重构,以提供尽管增加进一步组分的量,但仍保持其凝胶性质的本文所公开的组合物。因此,本发明的一个方面包含如本文所公开的具有增加量的vpa或其药学上可接受的盐的泊洛沙姆的组合物。在此实施方案中,达到增加vpa或其药学上可接受的盐量的一种方法是纯化本文所公开的泊洛沙姆。在这些方面中,组合物可以例如被冻干或用水重构。没有额外的增积剂典型将额外的增积剂,例如多糖,在冻干之前添加到药物组合物中,以帮助控制冻干的组合物的形态。可以在冻干之前将额外的增积剂,诸如多糖,加入组合物中,以赋予冻干产品改进的特性。例如,特性可以是呈饼的形式的冻干产品的改进形态。如果冻干饼是多孔的,具有大体积及/或蓬松的饼,则也是有利的。与提供适合的冻干药物组合物的需求相平衡,由于组合物被施用至有其需要的受试者,因此需要提供具有最少组分的药物组合物。本发明提供上述问题的解决方案。令人惊讶地,已发现即使组合物不包含额外的增积剂,本发明的冻干组合物也可以成功地冻干。无抗氧化剂许多药物组合物包含抗氧化剂,以在延长时间段增加组合物的稳定性。典型地,在组合物包含或随时间降解以产生可与其他组分进一步反应从而影响组合物稳定性的反应性物时,需要抗氧化剂。包含醛官能团的组合物中的物可以是反应性物,例如通过不期望的氧化还原路径反应,这可能导致其他组分的降解。因此,包含抗氧化剂可以通过抑制氧化还原路径来增加组合物的稳定性。与提供稳定药物组合物的需求相平衡,由于组合物被施用至有其需要的受试者,因此需要提供具有最少组分的药物组合物。本发明提供上述问题的解决方案。令人惊讶地,已经发现即使泊洛沙姆组分可降解产生醛,包含泊洛沙姆的本公开的冻干组合物在组合物不包含抗氧化剂时是稳定的。将通过非限制性例子来说明问题的解决方案。例如,本公开的组合物包含泊洛沙姆,其可降解产生醛。出乎意料的是,当冻干本公开的冻干组合物时,发现冻干除去基本上来自组合物的所有醛及/或造成一旦冻干不产生进一步醛的组合物。此结果意味着组合物中不需要抗氧化剂。成分添加的顺序作为溶液或凝胶适于施用的药物组合物典型包含水性组分,诸如水。对于许多药学上可接受的剂而言,这带来问题,因为它们可微溶于水溶液。再者,活性物可能花费延长的时间段来溶解,从溶液中沉淀及/或在溶液中不稳定。因此,仍然需要提供在较短的时间内制造药物组合物作为水溶液,同时维持组分完整性的进一步方法。本公开提供上述问题的解决方案。令人惊讶地,已经发现以极性非质子性溶剂的浓缩溶液形式将药学上可接受的活性物加入到水性组分中造成药物组合物,其中药学上可接受的剂已经溶解在水溶液中。至关重要的是,与替代的添加顺序相比,减少形成组合物所花费的时间,并且将任何潜在不稳定组分在溶液中的时间减至最小。将通过非限制性例子来说明问题的解决方案。例如,chir99021在水溶液中可呈现低溶解度,且在溶解chir99021或其盐所需的大量水溶液和长时间持续时间下,制造尤其成问题。然而,预溶解chir99021在极性非质子性溶剂中并将所述溶液添加至组合物的水性组分中成功地将chir99021溶剂合物在水性体系中。此结果是出乎意料的,因为它发生在相对较短的时序表,不会导致chir99021沉淀,可以按比例放大并为可重复性。此结果是有用的,因为其允许形成之前难以获得的组合物。冻干将药物组合物冻干以产生可接受形式的冻干产品,例如多孔饼,可能具有挑战性。许多因素都会影响所述方法的结果,并且这些因素可存在大范围的变化。例如,温度、温度变化率、压力以及在各种温度及/或压力下的持续时间都需要仔细考虑。因此,从方法获得适合的冻干产品是不小的努力,并且仍然需要提供更多的冻干方法。本公开提供上述问题的解决方案。令人惊讶地,已经发现特定方法提供呈冻干饼的形式的适合的冻干组合物。例如,本公开的冻干方法是特别有利的,因为其需要在商业冻干器上可达到的温和条件,这造成具有良好特性的冻干产品,例如产品饼是多孔的。耳用治疗剂如本文所用,术语“耳用治疗剂”是指能够治疗或预防与耳朵有关的疾病(例如,梅尼埃病(meniere’sdisease)、听觉损失、前庭系统疾病、眩晕、耳朵发炎或耳朵感染)或与疾病相关(例如,造成或由其引起)的病症的剂。在一些实施方案中,耳用治疗剂为听觉损失治疗剂。如本文所用,术语“听觉损失治疗剂”是指能够治疗或预防听觉损失或与听觉损失有关(例如,引起或发展为听觉损失或由其引起)的病症的剂。在一些实施方案中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)是与听觉损失有关的一种或多种生物路径及/或生物标靶的调节剂。每个调节剂可以独立地是一种或多种生物路径及/或生物标靶的激动剂(例如,活化剂)或拮抗剂(例如,抑制剂)。在一些实施方案中,一种或多种调节剂是增加或活化一种或多种生物路径及/或生物标靶的活性的剂。在一些实施方案中,一种或多种调节剂是降低或消除一种或多种生物路径及/或生物标靶的活性的剂。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)选自由下列组成的组:wnt路径激动剂、组蛋白去乙酰酶(hdac)抑制剂、dkk1抑制剂、axin抑制剂、sfrp1抑制剂、骨形态发生蛋白(bmp)抑制剂、β-连环蛋白激动剂、周期蛋白d1活化剂、rest辅阻遏物1(corest)抑制剂、notch激动剂、tgf-β抑制剂、camp反应元件结合蛋白质(creb)活化剂、周期蛋白依赖型激酶(cdk)活化剂、cdk抑制剂、pi3k-akt活化剂、pi3k-akt抑制剂、pten抑制剂、atoh1激动剂、atoh1拮抗剂、pou4f3激动剂、pou4f3拮抗剂、gfi1激动剂、gfi1拮抗剂、erk/mapk激动剂、erk/mapk拮抗剂、fgf激动剂、fgf拮抗剂、γ-氨基丁酸(gabas)、电位闸控na+通道拮抗剂、肌醇、pkc激动剂、pkc拮抗剂、foxo抑制剂、foxo激动剂、kv3通道拮抗剂、p27kip1抑制剂、il-1β、n-甲基-d-天门冬氨酸盐(nmda)受体拮抗剂、nadph醌氧化还原酶1、γ分泌酶抑制剂、γ分泌酶活化剂、nk1受体拮抗剂、nk1受体激动剂、ampa受体激动剂、ampa受体拮抗剂、toll样受体(tlr)激动剂、toll样受体(tlr)拮抗剂、组织胺h4受体激动剂、h4受体拮抗剂、5-ht3受体激动剂、5-ht3受体拮抗剂、oct4活化剂、sox2活化剂、sox17诱导物、klf4诱导物、cmyc活化剂、音猬因子(sonichedgehog)激动剂、音猬因子拮抗剂、表皮生长因子(egf)、胰岛素样生长因子(igf)、血管内皮生长因子(vegf)、内皮氧化氮合成酶(enos)、前列腺素e(pge)、脑源性神经营养因子(bdnf)、smad抑制剂、sall4诱导物、gata4诱导物、gata6诱导物、蛋白酶体抑制剂、视黄酸受体激动剂、mtor抑制剂、mtor活化剂、抗坏血酸、2-磷酸-l-抗坏血酸、kdm抑制剂、ttnpb、神经营养素3、dna-修饰酶、lsd-1抑制剂、烟酰胺(nicotinomide)、sirtuin、组蛋白甲基转移酶抑制剂、组蛋白去甲基化酶抑制剂、组蛋白赖氨酸甲基转移酶抑制剂、dnmt抑制剂、p53抑制剂、p21抑制剂、ampk活化剂、hippo活化剂、hippo抑制剂、yap/taz抑制剂、mst1/2抑制剂、ck1活化剂、ck1抑制剂、头发生素(noggin)、r-spondin1、bet活化剂、sirt1活化剂、sirt1抑制剂、sirt2活化剂、sirt2抑制剂、sirt3活化剂、sirt3抑制剂、jmjd3抑制剂、dmnt抑制剂、stat3抑制剂、lsd1抑制剂、活性前列腺素、camp活化剂、氧化磷酸化解偶联剂、精氨酸甲基转移酶抑制剂、alk4抑制剂、过氧化物酶体增殖物活化受体γ活化剂、egfr抑制剂、shh抑制剂、vitd活化剂、dot1l抑制剂、甲状腺激素、e盒依赖性转录活化剂及蛋白质降解抑制剂。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)为发细胞再生剂及/或耳保护剂。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)选自由下列组成的组:表1至13中所述的剂及其药物盐。表1表2表3表4表5表6表7化合物标靶delta/serrate/lag-2肽notch受体表8表9表10表11化合物标靶ac102(6-氟-9-甲基-β-咔啉;6f9mβccreb表12表13发细胞再生剂在任何所公开的实施方案中的一种或多种耳用治疗剂可以是以下发细胞再生剂中的一种或多种。发细胞再生剂是促进发细胞再生的剂。可以将单一剂用作发细胞再生剂,或者试剂的组合可提供发细胞再生功能。因此,在一些实施方案中,发细胞再生剂是单一剂。在其他实施方案中,发细胞再生剂是剂的组合。在某些这些实施方案中,剂的组合可以在单个组合物中混合在一起。在其他实施方案中,可以将剂的组合分别提供给患者。发细胞再生剂可通过刺激耳蜗感觉上皮内的支持细胞转分化为替代性发细胞来促进发细胞的再生。或者或额外地,发细胞再生剂可以活化耳蜗的感觉上皮中的增殖反应,从而提供新的细胞群,其可以随后分化成支持细胞。在一些实施方案中,发细胞再生剂刺激耳蜗支持细胞的增殖,其中刺激增殖表达lgr5(含富集亮氨酸的重复的g蛋白偶联受体5)。然而,发细胞再生剂也可以刺激具有很少或没有lgr5表达的支持细胞增殖。在一些实施方案中,发细胞再生剂产生扩增的耳蜗细胞群。在一些实施方案中,使扩增的细胞富集lgr5表达(即,与起始细胞群相比,更大百分比的扩增细胞群表达lgr5)。lgr5是gpcr类别a受体蛋白质的成员,其在多种组织中表达,诸如在肌肉、胎盘、脊髓和脑,并且特别是在某些组织中作为成体干细胞的生物标记。lgr5+干细胞是耳蜗中存在的感觉发细胞的前驱物。因此,增加lgr5+耳蜗细胞群是有益的,因为其增加可能分化为感觉发细胞的前驱物细胞群。在一些实施方案中,发细胞再生剂是wnt激动剂和表观遗传调节剂。可以使用本文所述的任何wnt激动剂和表观遗传调节剂。在一些实施方案中,发细胞再生剂是wnt激动剂和两种或更多种表观遗传调节剂。可以使用本文所述的任何wnt激动剂和表观遗传调节剂。在一些实施方案中,发细胞再生剂是单独的wnt激动剂。根据本文所公开的与wnt激动剂及/或表观遗传调节剂相关的任何治疗(其中wnt激动剂和表观遗传调节剂均被施用至患者),wnt激动剂可以单独使用。在这些实施方案中,不包括表观遗传调节剂。可以使用本文所述的任何wnt激动剂。在某些这些实施方案中,发细胞再生剂是gsk3抑制剂。可以使用本文所述的任何gsk3抑制剂。在一些实施方案中,发细胞再生剂为γ分泌酶抑制剂。适合的γ分泌酶抑制剂描述于wo2018007331a1;wo2018111926a2;wo2018065340a1;wo2018060300a1;wo2018011164a1;wo2018087018a1;wo2018001918a1;wo2018118791a2;wo2018118782a2及wo2014045156a1,其各者以引用方式并入。可以使用本文所述的任何γ分泌酶抑制剂。在一些实施方案中,发细胞再生剂为atoh1活化剂。适合的atoh1活化剂描述于us20160030445a1;wo2018172997a1;wo2016022776a2;wo2014145205a2及wo2009100438a2,其各者以引用方式并入。在一些实施方案中,发细胞再生剂为notch抑制剂。适合的notch抑制剂描述于wo2017007702-a1;wo2016056999-a1;wo2014039781a1;wo2014047369a1;wo2014047372a1;wo2014047390a1;wo2014047391a1;wo2014047397a1;wo2014047392a1;wo2014047370a1;wo2014047374a1;wo2013093885a1;wo2013178821a1及wo2013016081a1,其各者以引用方式并入。在一些实施方案中,发细胞再生剂为wnt激动剂及notch抑制剂。可使用任何wnt激动剂及notch抑制剂如本文所述。在某些这些实施方案中,wnt激动剂为gsk3抑制剂。可以使用本文所述的任何gsk3抑制剂。在一些实施方案中,发细胞再生剂为wnt激动剂及γ分泌酶抑制剂。可使用任何wnt激动剂及γ分泌酶抑制剂如本文所述。在某些这些实施方案中,wnt激动剂为gsk抑制剂。可以使用本文所述的任何gsk3抑制剂。wnt激动剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述wnt激动剂的一种或多种。提供一方面为用于治疗人患者的感觉神经性听觉损失的wnt激动剂及/或表观遗传调节剂,其中,所述wnt激动剂和所述表观遗传调节剂被施用至人患者。还提供治疗人患者的感觉神经性听觉损失的方法,其包括向患者施用wnt激动剂和表观遗传调节剂。wnt激动剂及/或表观遗传调节剂可用于治疗患者,如本文其他地方所述。wnt激动剂是指增加在细胞中,例如耳蜗细胞中,wnt基因、蛋白质或信号传导路径(例如,tcf/lef、卷曲受体家族、wif1、lef1、axin2、β-连环蛋白)的表达、量及/或活性的剂。wnt激动剂包括gsk3抑制剂,诸如gsk3-α或gsk3-β抑制剂。在一些实施方案中,wnt激动剂是抑制gsk3-α和gsk3-β二者的gsk抑制剂。tcf/lef家族是一组转录因子,其通过高速泳动群结构域与dna结合,并且参与wnt信号传导路径,其中其招募共活化子β-连环蛋白到标靶基因的增强子元件。卷曲是g蛋白质偶联受体蛋白家族,在wnt信号传导路径中作为受体。卷曲受体抑制细胞内β-连环蛋白降解并活化tcf/lef介导的转录。在一些实施方案中,相对于对照,例如,相对于活性的基线量,wnt激动剂增加耳蜗细胞中wnt信号传导约或至少约10、20、30、40、50、60、70、80、90、100、200、300、400或500%或更多(或至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多)。在一些实施方案中,相对于对照,例如,相对于活性的基线量,wnt激动剂增加耳蜗细胞中tcf/lef介导的转录,例如,约或至少约10、20、30、40、50、60、70、80、90、100、200、300、400或500%或更多(或至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多)。在一些实施方案中,相对于对照,例如,相对于活性的基线量,wnt激动剂结合并活化卷曲受体家族成员,例如,约或至少约10、20、30、40、50、60、70、80、90、100、200、300、400或500%或更多(或至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多)。在一些实施方案中,相对于对照,例如,相对于活性的基线量,wnt激动剂抑制gsk3,例如,约或至少约10、20、30、40、50、60、70、80、90、100、200、300、400或500%或更多(或至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多)。在一些实施方案中,比起wnt激动剂上调节hes或hey,wnt激动剂优先上调节jag-1、deltex-1或ghif-1。在一些实施方案中,比起wnt激动剂增加hes及hey的表达或活性,wnt激动剂增加jag-1、deltex-1及/或hif-1的表达10%、25%、50%、75%、100%、125%、150%、175%、200%、250%或更多。下表14和15中提供具有作为wnt激动剂活性的例示性剂,包括其药学上可接受的盐。表14表15在一些实施方案中,具有作为wnt激动剂活性的剂为gsk3抑制剂。优选地,gsk3抑制剂为azd1080、gsk3抑制剂xxii、chir99021或ly2090314。在一个优选的实施方案中,wnt激动剂为chir99021。在其他优选实施方案中,wnt激动剂及/或gsk3抑制剂是经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂环庚烯并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮。(式a。)wnt激动剂可以选自wo2018/125746中的任一种,其特此以引用方式并入。在一些实施方案中,wnt激动剂可为wo2018/125746的权利要求1所定义的化合物。在一些实施方案中,wnt激动剂可为wo2018/125746的权利要求12所定义的化合物。例示性经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂环庚烯并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮包括:3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(9-乙炔基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氨基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;1-(9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2-羰基)哌啶-4-甲醛;3-(9-氟-2-(4-(羟基甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4,4-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(苯并[d]异噁唑-3-基)-4-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;n-(7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-基)乙酰胺;3-(9-(二氟甲基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(3,3-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-((1r,4r)-2,5-二氮杂双环[2.2.1]庚烷-2-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;2-(3,3-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;2-(4,4-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(2-(4,4-二氟哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(氨基甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(羟基甲基)哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;2-(4-(羟基甲基)哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(9-氟-2-(3,3,4,4,5,5-六氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(3,3,5,5-四氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(2,2,6,6-四氟吗福林-4-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4,4-二氟-3-羟基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(二氟(羟基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧杂氮杂环庚烷(oxazepane)-4-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-([1,2,4]三唑并[4,3-a]吡啶-3-基)-4-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基-d10)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基-3,3,4,4-d4)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(4-(2,2,2-三氟-1-羟基乙基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(4-((甲基氨基)甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-((二甲基氨基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-氨基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(4-(甲基氨基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(二甲基氨基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-n-(哌啶-4-基甲基)-3,4-二氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2(1h)-甲酰胺;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-n-甲基-n-(哌啶-4-基甲基)-3,4-二氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2(1h)-甲酰胺;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-n-甲基-n-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2(1h)-甲酰胺;3-(9-氟-2-((1r,4r)-5-甲基-2,5-二氮杂双环[2.2.1]庚烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(2-甲基-2,8-二氮杂螺[4.5]癸烷-8-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(8-甲基-2,8-二氮杂螺[4.5]癸烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(2,2,6,6-四氟吗福林-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧杂氮杂环庚烷-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;2-(4-(二甲基氨基)哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;9-氰基-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-n-甲基-n-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2(1h)-甲酰胺;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-2-(8-甲基-2,8-二氮杂螺[4.5]癸烷-2-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(8,9-二氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;或3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮(ly20900314)。优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂环庚烯并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮为:3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(9-乙炔基-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(4-(羟基甲基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4,4-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-(二氟甲基)-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(3,3-二氟哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;2-(4,4-二氟哌啶-1-羰基)-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-9-甲腈;3-(2-(8-氧杂-3-氮杂双环[3.2.1]辛烷-3-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(羟基甲基)哌啶-1-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(3,3,4,4,5,5-六氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(3,3,5,5-四氟哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(2,2,6,6-四氟吗福林-4-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4,4-二氟-3-羟基哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(二氟(羟基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧杂氮杂环庚烷-4-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基-d10)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基-3,3,4,4-d4)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(9-氟-2-(4-(2,2,2-三氟-1-羟基乙基)哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-((二甲基氨基)甲基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(2-(4-(二甲基氨基)哌啶-1-羰基)-9-氟-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;9-氟-7-(4-(咪唑并[1,2-a]吡啶-3-基)-2,5-二氧代-2,5-二氢-1h-吡咯-3-基)-n-甲基-n-((1-甲基哌啶-4-基)甲基)-3,4-二氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-2(1h)-甲酰胺;3-(咪唑并[1,2-a]吡啶-3-基)-4-(2-(2,2,6,6-四氟吗福林-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-1h-吡咯-2,5-二酮;3-(2-(6,6-二氟-1,4-氧杂氮杂环庚烷-4-羰基)-9-(三氟甲基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;3-(8,9-二氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮;或3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮(ly2090314)。更优选地,经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂环庚烯并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮为3-(9-氟-2-(哌啶-1-羰基)-1,2,3,4-四氢-[1,4]二氮杂环庚烯并[6,7,1-hi]吲哚-7-基)-4-(咪唑并[1,2-a]吡啶-3-基)-1h-吡咯-2,5-二酮。(ly2090314)。经取代的3-咪唑并[1,2-a]吡啶-3-基-4-(1,2,3,4-四氢-[1,4]二氮杂环庚烯并-[6,7,1-hi]吲哚-7-基)吡咯-2,5-二酮的结构显示于下表16中。表16在其他实施方案中,wnt激动剂及/或gsk3抑制剂描述于wo2018/125746、us20180214458及ussn62/608,663,出于所有目的其内容各者整体以引用方式并入。表观遗传调节剂在所公开的任何实施方案中的一种或多种耳用治疗剂可以是下列表观遗传调节剂中的一种或多种。表观遗传调节剂包括表观遗传修饰剂、介体和调节剂。表观遗传修饰剂是基因,其产物直接通过dna甲基化、染色质的翻译后修饰或染色质结构改变修饰表观基因组(epigenome)。尽管其自身很少突变,表观遗传介体通常是表观遗传修饰的标靶。表观遗传介体与干细胞重编程中涉及的基因大部分重叠,且其在癌症中的角色直接源于其重编程角色的发现。表观遗传介体是其产物是表观遗传修饰剂的标靶的那些基因。表观遗传调节剂是位于信号传导和代谢路径中修饰剂和介体上游的基因。在一些实施方案中,具有作为表观遗传调节剂活性的剂是hdac抑制剂、lsd-1抑制剂、ezh2抑制剂、dot1l抑制剂及kdm抑制剂。hdac抑制剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述hdac抑制剂的一种或多种。组蛋白脱乙酰基酶(hdac)是一类酶,其从组蛋白上的ε-n-乙酰基赖氨酸氨基酸中去除乙酰基(o=c-ch3),使组蛋白更紧密地缠绕dna。这很重要,因为dna缠绕在组蛋白周围,并且dna表达受乙酰基化和脱乙酰基化的调节。hdac根据与酵母原始酶的序列同源性和结构域组织分为四类。hdac类包括hdaci、hdaciia、hdaciib、hdaciii及hdaciv。组蛋白脱乙酰基酶(hdac)抑制剂(hdaci,hdi)是抑制组蛋白脱乙酰基酶的化学化合物。因此,“hdac抑制剂”是指能够降低hdac的表达或酶活性的剂。例如,用hdac抑制剂治疗导致细胞中标靶基因的组蛋白脱乙酰基化降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂降低hdac的表达或酶活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂降低标靶基因的组蛋白脱乙酰基化至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂增加标靶基因的表达或活性至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂降低hdac的表达或酶活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂降低标靶基因的组蛋白脱乙酰基化至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,hdac抑制剂增加标靶基因的表达或活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。表4[1]在各种实施方案中,本文所公开的治疗包括使用hdac抑制剂。表17提供例示性hdac抑制剂。表17在一些实施方案中,hdac抑制剂是i类hdac抑制剂。在这些实施方案中,i类hdac抑制剂可为短链羧酸。在优选的实施方案中,hdac抑制剂是丙戊酸(vpa)、2-己基-4-戊炔酸或苯基丁酸na。更优选地,hdac抑制剂是丙戊酸(vpa)。在某些这些实施方案中,hdac抑制剂是丙戊酸钠。如本文所用,术语“丙戊酸”和“vpa”可互换使用以指相同的化合物。再者,如本文所用,术语“丙戊酸”和“vpa”也指其任何药学上可接受的盐。lsd1抑制剂本文所公开的任何实施方案中的一种或多种耳用治疗剂可为下述lsd1抑制剂的一种或多种。lsd1介导的h3k4去甲基化可导致沉默基因表达的阻遏性染色质环境。在各种情况下,lsd1已显示在发育中扮演角色。lsd1可以与人胚胎干细胞中的多能因子相互作用,且对于使干细胞分化中的增强子退役很重要。除胚胎环境外,lsd1对造血分化也至关重要。lsd1在多种癌症类型中过度表达,且最近的研究表明lsd1的抑制会重新活化急性骨髓性白血病(aml)中的全反式视黄酸受体路径。这些研究暗示lsd1作为表观基因组的关键调节因子,其通过组蛋白的翻译后修饰和通过其在转录复合物中的存在来调节基因表达。因此,“lsd1抑制剂”是指能够降低lsd1的表达或酶活性的剂。例如,lsd1抑制剂导致细胞(例如,耳蜗细胞或前庭细胞)中标靶基因的h3k4去甲基化降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,lsd1抑制剂降低lsd1的表达或酶活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,lsd1抑制剂降低h3k4去甲基化至少5、10、20、30、40、50、60、70、80、90或100%。在一些情况下,相对于对照,例如,相对于活性的基线量,lsd1抑制剂降低h3k4去甲基化至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500或1000倍或更多。在一些情况下,相对于对照,例如,相对于活性的基线量,lsd1抑制剂调节(即,增加或减少)标靶基因的表达或活性至少5、10、20、30、40、50、60、70、80、90或100%。在一些情况下,相对于对照,例如,相对于活性的基线量,lsd1抑制剂调节(即,增加或减少)lsd1的表达或酶活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些情况下,lsd1抑制剂为可逆。在其他情况下,lsd1抑制剂为不可逆。在下表18中提供具有作为lsd1抑制剂活性的例示性剂,包括其药学上可接受的盐。在一些实施方案中,具有作为lsd1抑制剂的活性的剂是gsk-2879552、gsk-lsd1、奥希替尼(osimertinib)(azd9291)、硫酸苯乙肼、反苯环丙胺(tranylcypromine)(tcp)、ory-1001、塞利德司他(seclidemstat)(sp-2577)、伐地司他(vafidemstat)(ory-2001)、cc-90011、img-7289或、incb059872。优选地,lsd1抑制剂是gsk-2879552、gsk-lsd1、硫酸苯乙肼或反苯环丙胺(tcp)。更优选地,lsd1抑制剂是gsk-2879552、gsk-lsd-1或反苯环丙胺(tcp)。ezh2抑制剂在本文所公开的任何实施方案中的一种或多种耳用治疗剂可为下述ezh2抑制剂的一种或多种。zeste同源物2(ezh2)的增强子是由ezh2基因所编码的组蛋白-赖氨酸n-甲基转移酶酶,其参与组蛋白甲基化,并最终转录阻遏。ezh2通过使用辅助因子s-腺苷-l-蛋氨酸催化在组蛋白h3的赖氨酸27处添加甲基。ezh2的甲基化活性促进异染色质形成,从而使基因功能沉默。在细胞有丝分裂过程中还需要通过ezh2对染色体异染色质进行重塑。ezh2是多梳抑制复合物2(prc2)的功能性酶组分,其通过负责调节发育和分化的基因的表观遗传维持而负责健康的胚胎发育。ezh2负责prc2的甲基化活性,并且复合物还包含最佳功能所需的蛋白质(eed、suz12、jarid2、aebp2、rbap46/48及pcl)。ezh2抑制剂是抑制由ezh2基因所编码的组蛋白-赖氨酸n-甲基转移酶酶的化学化合物。因此,“ezh2抑制剂”是指能够降低ezh2的表达或酶活性的剂。例如,ezh2抑制剂导致细胞中标靶基因的组蛋白甲基化降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂降低ezh2的表达或酶活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂降低标靶基因的组蛋白甲基化至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂增加标靶基因的表达或活性至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂降低ezh2的表达或酶活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂降低标靶基因的组蛋白甲基化至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,ezh2抑制剂增加标靶基因的表达或活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。表19提供例示性ezh2抑制剂。在一些实施方案中,ezh2抑制剂是pf-06821497、cpi-120、伐米司他(valemetostat)、他泽司他(tazemetostat)或el1。dot1l抑制剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述dot1l抑制剂的一种或多种。组蛋白h3k79甲基转移酶(酿酒酵母菌)的dot1样(端粒沉默1样的干扰物),也已知为dot1l,是在人以及其他真核生物中发现的蛋白质。dot1l对组蛋白h3赖氨酸79(h3k79)的甲基化是许多真核表观基因组中的保守表观遗传标记,随着衰老过程逐渐增加。dot1l抑制剂是抑制组蛋白h3k79甲基转移酶的化学化合物。因此,“dot1l抑制剂”是指能够降低dot1l的表达或酶活性的剂。例如,ezh2抑制剂导致细胞中标靶基因的组蛋白甲基化降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂降低dot1l的表达或酶活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂降低标靶基因的组蛋白甲基化至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂增加标靶基因的表达或活性至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂降低dot1l的表达或酶活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂降低标靶基因的组蛋白甲基化至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,dot1l抑制剂增加标靶基因的表达或活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。表20提供例示性dot1l抑制剂。表20在一些实施方案中,dot1l抑制剂是epz004777、匹美司他(pinometostat)或sgc0946。kdm抑制剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述kdm抑制剂的一种或多种。在人基因组中已经鉴定出约30个含jmjc结构域的蛋白质为赖氨酸去甲基化酶。基于组蛋白赖氨酸位点和去甲基化状态,包含jmjc结构域的蛋白质家族分为六个子家族:kdm2、kdm3、kdm4、kdm5、kdm6及phf。包含jmjc结构域的蛋白质属于fe(ii)和2-氧代戊二酸酯(2-og)依赖性二氧酶,其去甲基化多种标靶,包括组蛋白(h3k4、h3k9、h3k27、h3k36以及h1k26)和非组蛋白蛋白质。与lsd家族不同,包含jmjc结构域的组蛋白去甲基化酶(jhdm)能够消除所有三种组蛋白赖氨酸甲基化状态,因为jhdm对去甲基化不需要质子化氮。kdm2(也称为fbxl)子家族包括两个成员:kdm2a和kdm2b。首先在计算机模拟鉴定的kdm4基因家族由六个成员组成,包括kdm4a、kdm4b、kdm4c、kdm4d、kdm4e及kdm4f。kdm5子家族包含四种酶:kdm5a、kdm5b、kdm5c和kdm5d,其从h3k4me2/3特异性去除甲基标记。在人基因组中,kdm6子家族由kdm6a、kdm6b和uty包含,其共有一个保守良好的jmjc组蛋白催化结构域。kdm抑制剂是抑制赖氨酸去甲基化酶的化学化合物。因此,“kdm抑制剂”是指能够降低kdm的表达或酶活性的剂。例如,kdm抑制剂导致细胞中标靶基因的组蛋白去甲基化降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂降低kdm的表达或酶活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂降低标靶基因的组蛋白去甲基化至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂增加标靶基因的表达或活性至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂降低kdm的表达或酶活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂降低标靶基因的组蛋白去甲基化至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,kdm抑制剂增加标靶基因的表达或活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。表21提供例示性kdm抑制剂。在一些实施方案中,kdm抑制剂是as8351或tc-e5002。taz活化剂在本文所公开的任何实施方案中的一种或多种耳用治疗剂可为下述taz活化剂的一种或多种。具有pdz结合的转录共活化因子taz基序(也称wwtr1)被鉴定为14-3-3-结合蛋白质。其在其分子结构中类似于yes相关蛋白质1(yap1),其由n端tead结合结构域、一或两个ww结构域和转录活化结构域所组成。taz在四个位点被大肿瘤抑制因子激酶1(lats1)和lats2磷酸化,其是hippo路径的核心激酶。磷酸化的taz被14-3-3捕获,从细胞核招募到细胞质,并进行蛋白质降解。以这种方式,hippo路径负调节taz。除hippo路径外,taz还受细胞连结蛋白质,诸如zo-1、zo-2和血管动蛋白(angiomotin)的调节。最近的研究表明,taz受肌动蛋白细胞骨架和机械拉伸的控制。再者,wnt信号传导稳定。相反地,细胞质taz结合-链蛋白和disheveled(dvl)并抑制-链蛋白核定位和dvl磷酸化,从而负调节wnt路径。taz活化剂是稳定和增加未磷酸化的taz量的化学化合物。因此,“taz活化剂”是指能够增加taz的稳定性或活性的剂。例如,taz活化剂导致taz磷酸化及/或taz蛋白质降解的降低。在某些实施方案中,相对于对照,例如,相对于活性的基线量,taz活化剂增加taz的稳定性或活性至少5、10、20、30、40、50、60、70、80、90或100%。在某些实施方案中,相对于对照,例如,相对于活性的基线量,taz活化剂增加标靶基因的表达至少5、10、20、30、40、50、60、70、80、90或100%。在一些实施方案中,相对于对照,例如,相对于活性的基线量,taz活化剂增加taz的稳定性或活性至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。在一些实施方案中,相对于对照,例如,相对于活性的基线量,增加标靶基因的表达至少约1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、90、100、200、500、1000倍或更多。表22中提供例示性taz活化剂。在一些实施方案中,taz活化剂是ibs008738、tm-25659或tt10。在一些实施方案中,剂是γ-分泌酶抑制剂,taz活化剂、notch抑制剂或erbb3/her3抑制剂。γ分泌酶抑制剂在本文所公开的任何实施方案中的一种或多种耳用治疗剂可为下述γ分泌酶抑制剂的一种或多种。γ分泌酶是一种内部蛋白酶,其在包括类淀粉前驱物蛋白质(app)和notch的其基质蛋白质的跨膜结构域内切割。通过β-和γ-分泌酶的app的顺序切割产生aβ。首先,app由β-分泌酶(bace1)进行蛋白分解处理,并生成app的12kdac端残株(stub)(c99);其次,c99被γ-分泌酶切割以产生两种主要aβ种,终止于残基40(aβ40)或残基42(aβ42)。γ分泌酶抑制剂可靶向γ-分泌酶并减少aβ产生。表23提供例示性γ分泌酶抑制剂。表23notch抑制剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述notch抑制剂的一种或多种。表24提供例示性notch抑制剂。表24erbb3/her3抑制剂在所公开的任何实施方案中的一种或多种耳用治疗剂可为下述erbb3/her3抑制剂的一种或多种。表25提供例示性erbb3/her3抑制剂。在一些实施方案中,erbb3/her3抑制剂是ws3或ws6。在一些实施方案中,至少一种听觉损失治疗剂是chir99021:或其药学上可接受的盐。药学上可接受的盐包括,例如通过使本文所述的任何弱碱活性剂(诸如chir99021)与本领域已知的药学上可接受的酸反应而形成的盐。适合的酸盐的非限制性列表包括盐酸盐、氢溴酸盐、柠檬酸盐、苹果酸盐、甲磺酸盐、磷酸盐、酒石酸盐、盐酸盐、甲苯磺酸盐、葡萄糖醛酸盐、乙磺酸盐、富马酸盐、硫酸盐、萘-2-磺酸盐、抗坏血酸盐、草酸盐、萘-1,5-二磺酸盐、丙二酸盐、氨基水杨酸盐、苯磺酸盐、羟乙基磺酸盐(isethionate)、genistate、1-羟基-2-萘酸盐(napthoate)、二氯乙酸盐、环己胺磺酸盐和乙烷-1,2-二磺酸盐。在一些实施方案中,本公开的组合物可包含式(i)的化合物或其药学上可接受的盐。在一些实施方案中,式(i)的化合物也可为耳用治疗剂。在一些实施方案中,其中,式(i)的化合物为耳用治疗剂,其可包括在包含一种或多种耳用治疗剂的本公开的组合物。在一些实施方案中,式(i)的化合物也可为听觉损失治疗剂。在一些实施方案中,式(i)的化合物可为hdac抑制剂。在一些实施方案中,式(i)的化合物或其药学上可接受的盐包括在本公开的冻干药物组合物。在一些实施方案中,式(i)的化合物或其药学上可接受的盐包括在本公开的重构药物组合物。式(i)的化合物或药学上可接受的盐具有下述结构:其中:r1选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r2a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r2b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;x选自及或不存在;r3a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r3b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r4选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r5a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r5b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;y选自及或不存在;r6a选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r6b选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;各r7独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r8a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r8b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;z选自及或不存在;r10a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r10b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r11a选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r11b选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;na选自0、1、2、3、4、5、6、7及8;nb选自0、1、2、3及4;nc选自0、1及2;nd选自0、1及2;以及;ne选自0、1、2、3、4、5及6。在一些实施方案中,r1为h。在一些实施方案中,r1为烷基。在一些实施方案中,r1为烷氧基。在一些实施方案中,r1为卤基。在一些实施方案中,r1为环烷基。在一些实施方案中,r1为烯基。在一些实施方案中,r1为炔基。在一些实施方案中,r1为碳环基。在一些实施方案中,r1为芳基。在一些实施方案中,r2a为h。在一些实施方案中,r2a为烷基。在一些实施方案中,r2a为烷氧基。在一些实施方案中,r2a为卤基。在一些实施方案中,r2a为环烷基。在一些实施方案中,r2a为烯基。在一些实施方案中,r2a为炔基。在一些实施方案中,r2a为碳环基。在一些实施方案中,r2a为芳基。在一些实施方案中,r2b为h。在一些实施方案中,r2b为烷基。在一些实施方案中,r2b为烷氧基。在一些实施方案中,r2b为卤基。在一些实施方案中,r2b为环烷基。在一些实施方案中,r2b为烯基。在一些实施方案中,r2b为炔基。在一些实施方案中,r2b为碳环基。在一些实施方案中,r2b为芳基。在一些实施方案中,r3a为h。在一些实施方案中,r3a为烷基。在一些实施方案中,r3a为烷氧基。在一些实施方案中,r3a为卤基。在一些实施方案中,r3a为环烷基。在一些实施方案中,r3a为烯基。在一些实施方案中,r3a为炔基。在一些实施方案中,r3a为碳环基。在一些实施方案中,r3a为芳基。在一些实施方案中,r3b为h。在一些实施方案中,r3b为烷基。在一些实施方案中,r3b为烷氧基。在一些实施方案中,r3b为卤基。在一些实施方案中,r3b为环烷基。在一些实施方案中,r3b为烯基。在一些实施方案中,r3b为炔基。在一些实施方案中,r3b为碳环基。在一些实施方案中,r3b为芳基。在一些实施方案中,r4为h。在一些实施方案中,r4为烷基。在一些实施方案中,r4为烷氧基。在一些实施方案中,r4为卤基。在一些实施方案中,r4为环烷基。在一些实施方案中,r4为烯基。在一些实施方案中,r4为炔基。在一些实施方案中,r4为碳环基。在一些实施方案中,r4为芳基。在一些实施方案中,r5a为h。在一些实施方案中,r5a为烷基。在一些实施方案中,r5a为烷氧基。在一些实施方案中,r5a为卤基。在一些实施方案中,r5a为环烷基。在一些实施方案中,r5a为烯基。在一些实施方案中,r5a为炔基。在一些实施方案中,r5a为碳环基。在一些实施方案中,r5a为芳基。在一些实施方案中,r5b为h。在一些实施方案中,r5b为烷基。在一些实施方案中,r5b为烷氧基。在一些实施方案中,r5b为卤基。在一些实施方案中,r5b为环烷基。在一些实施方案中,r5b为烯基。在一些实施方案中,r5b为炔基。在一些实施方案中,r5b为碳环基。在一些实施方案中,r5b为芳基。在一些实施方案中,r6a为h。在一些实施方案中,r6a为烷基。在一些实施方案中,r6a为烷氧基。在一些实施方案中,r6a为卤基。在一些实施方案中,r6a为环烷基。在一些实施方案中,r6a为烯基。在一些实施方案中,r6a为炔基。在一些实施方案中,r6a为碳环基。在一些实施方案中,r6a为芳基。在一些实施方案中,r6b为h。在一些实施方案中,r6b为烷基。在一些实施方案中,r6b为烷氧基。在一些实施方案中,r6b为卤基。在一些实施方案中,r6b为环烷基。在一些实施方案中,r6b为烯基。在一些实施方案中,r6b为炔基。在一些实施方案中,r6b为碳环基。在一些实施方案中,r6b为芳基。在一些实施方案中,r7为h。在一些实施方案中,r7为烷基。在一些实施方案中,r7为烷氧基。在一些实施方案中,r7为卤基。在一些实施方案中,r7为环烷基。在一些实施方案中,r7为烯基。在一些实施方案中,r7为炔基。在一些实施方案中,r7为碳环基。在一些实施方案中,r7为芳基。在一些实施方案中,x为在一些实施方案中,x为在一些实施方案中,x为在一些实施方案中,x为在一些实施方案中,x不存在。在一些实施方案中,y为在一些实施方案中,y为在一些实施方案中,y为在一些实施方案中,y为在一些实施方案中,y不存在。在一些实施方案中,r8a为h。在一些实施方案中,r8a为烷基。在一些实施方案中,r8a为烷氧基。在一些实施方案中,r8a为卤基。在一些实施方案中,r8a为环烷基。在一些实施方案中,r8a为烯基。在一些实施方案中,r8a为炔基。在一些实施方案中,r8a为碳环基。在一些实施方案中,r8a为芳基。在一些实施方案中,r8b为h。在一些实施方案中,r8b为烷基。在一些实施方案中,r8b为烷氧基。在一些实施方案中,r8b为卤基。在一些实施方案中,r8b为环烷基。在一些实施方案中,r8b为烯基。在一些实施方案中,r8b为炔基。在一些实施方案中,r8b为碳环基。在一些实施方案中,r8b为芳基。在一些实施方案中,r9a为h。在一些实施方案中,r9a为烷基。在一些实施方案中,r9a为烷氧基。在一些实施方案中,r9a为卤基。在一些实施方案中,r9a为环烷基。在一些实施方案中,r9a为烯基。在一些实施方案中,r9a为炔基。在一些实施方案中,r9a为碳环基。在一些实施方案中,r9a为芳基。在一些实施方案中,r9b为h。在一些实施方案中,r9b为烷基。在一些实施方案中,r9b为烷氧基。在一些实施方案中,r9b为卤基。在一些实施方案中,r9b为环烷基。在一些实施方案中,r9b为烯基。在一些实施方案中,r9b为炔基。在一些实施方案中,r9b为碳环基。在一些实施方案中,r9b为芳基。在一些实施方案中,z为在一些实施方案中,z为在一些实施方案中,z为在一些实施方案中,z为在一些实施方案中,z不存在。在一些实施方案中,r10a为h。在一些实施方案中,r10a为烷基。在一些实施方案中,r10a为烷氧基。在一些实施方案中,r10a为卤基。在一些实施方案中,r10a为环烷基。在一些实施方案中,r10a为烯基。在一些实施方案中,r10a为炔基。在一些实施方案中,r10a为碳环基。在一些实施方案中,r10a为芳基。在一些实施方案中,r10b为h。在一些实施方案中,r10b为烷基。在一些实施方案中,r10b为烷氧基。在一些实施方案中,r10b为卤基。在一些实施方案中,r10b为环烷基。在一些实施方案中,r10b为烯基。在一些实施方案中,r10b为炔基。在一些实施方案中,r10b为碳环基。在一些实施方案中,r10b为芳基。在一些实施方案中,r11a为h。在一些实施方案中,r11b为烷基。在一些实施方案中,r11a为烷氧基。在一些实施方案中,r11a为卤基。在一些实施方案中,r11a为环烷基。在一些实施方案中,r11a为烯基。在一些实施方案中,r11a为炔基。在一些实施方案中,r11a为碳环基。在一些实施方案中,r11a为芳基。在一些实施方案中,r11b为h。在一些实施方案中,r11b为烷基。在一些实施方案中,r11b为烷氧基。在一些实施方案中,r11b为卤基。在一些实施方案中,r11b为环烷基。在一些实施方案中,r11b为烯基。在一些实施方案中,r11b为炔基。在一些实施方案中,r11b为碳环基。在一些实施方案中,r11b为芳基。在一些实施方案中,na为0。在一些实施方案中,na为1。在一些实施方案中,na为2。在一些实施方案中,na为3。在一些实施方案中,na为4。在一些实施方案中,na为5。在一些实施方案中,na为6。在一些实施方案中,na为7。在一些实施方案中,na为8。在一些实施方案中,nb为0。在一些实施方案中,nb为1。在一些实施方案中,nb为2。在一些实施方案中,nb为3。在一些实施方案中,nb为4。在一些实施方案中,nc为0。在一些实施方案中,nc为1。在一些实施方案中,nc为2。在一些实施方案中,nd为0。在一些实施方案中,nd为1。在一些实施方案中,nd为2。在一些实施方案中,ne为0。在一些实施方案中,ne为1。在一些实施方案中,ne为2。在一些实施方案中,ne为3。在一些实施方案中,ne为4。在一些实施方案中,ne为5。在一些实施方案中,ne为6。在一些实施方案中,r1为me。在一些实施方案中,r2a为me。在一些实施方案中,r2b为me。在一些实施方案中,r3a为me。在一些实施方案中,r3b为me。在一些实施方案中,r4为me。在一些实施方案中,r5a为me。在一些实施方案中,r5b为me。在一些实施方案中,r6a为me。在一些实施方案中,r6b为me。在一些实施方案中,r7为me。在一些实施方案中,r8a为me。在一些实施方案中,r8b为me。在一些实施方案中,r9a为me。在一些实施方案中,r9b为me。在一些实施方案中,r10a为me。在一些实施方案中,r10b为me。在一些实施方案中,r11a为me。在一些实施方案中,r11b为me。在一些实施方案中,r1为f。在一些实施方案中,r2a为f。在一些实施方案中,r2b为f。在一些实施方案中,r3a为f。在一些实施方案中,r3b为f。在一些实施方案中,r4为f。在一些实施方案中,r5a为f。在一些实施方案中,r5b为f。在一些实施方案中,r6a为f。在一些实施方案中,r6b为f。在一些实施方案中,r7为f。在一些实施方案中,r8a为f。在一些实施方案中,r8b为f。在一些实施方案中,r9a为f。在一些实施方案中,r9b为f。在一些实施方案中,r10a为f。在一些实施方案中,r10b为f。在一些实施方案中,r11a为f。在一些实施方案中,r11b为f。在一些实施方案中,r1为烷基。在一些实施方案中,r2a为烷基。在一些实施方案中,r2b为烷基。在一些实施方案中,r3a为烷基。在一些实施方案中,r3b为烷基。在一些实施方案中,r4为烷基。在一些实施方案中,r5a为烷基。在一些实施方案中,r5b为烷基。在一些实施方案中,r6a为烷基。在一些实施方案中,r6b为烷基。在一些实施方案中,r7为烷基。在一些实施方案中,r8a为烷基。在一些实施方案中,r8b为烷基。在一些实施方案中,r9a为烷基。在一些实施方案中,r9b为烷基。在一些实施方案中,r10a为烷基。在一些实施方案中,r10b为烷基。在一些实施方案中,r11a为烷基。在一些实施方案中,r11b为烷基。在一些实施方案中,烷基为甲基。在一些实施方案中,烷基为乙基。在一些实施方案中,烷基为正丙基。在一些实施方案中,烷基为异丙基。在一些实施方案中,烷基为正丁基。在一些实施方案中,烷基为仲丁基。在一些实施方案中,烷基为异丁基。在一些实施方案中,烷基为叔丁基。在一些实施方案中,烷氧基为甲氧基。在一些实施方案中,烷氧基为乙氧基。在一些实施方案中,烷氧基为正丙氧基。在一些实施方案中,烷氧基为异丙氧基。在一些实施方案中,烷氧基为正丁氧基。在一些实施方案中,烷氧基为仲丁氧基。在一些实施方案中,烷氧基为异丁氧基。在一些实施方案中,烷氧基为叔丁氧基。在一些实施方案中,卤基为f。在一些实施方案中,卤基为cl。在一些实施方案中,卤基为br。在一些实施方案中,卤基为i。在一些实施方案中,环烷基为环丙基。在一些实施方案中,环烷基为环丁基。在一些实施方案中,环烷基为环戊基。在一些实施方案中,环烷基为环己基。在一些实施方案中,芳基为苯基。在一些实施方案中,芳基为甲苯基。在一些实施方案中,芳基为二甲苯基。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被甲基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被乙基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丙基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丙基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丁基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被仲丁基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丁基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被叔丁基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被甲氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被乙氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丙氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丙氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丁氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被仲丁氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丁氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被叔丁氧基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被f取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被cl取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被br取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被i取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被环烷基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被烯基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被炔基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被碳环基取代。在一些实施方案中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被芳基取代。在一些实施方案中,式(i)的化合物为丙戊酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物为2-(丙-2-炔-1-基)-辛酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物为亚麻油酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物为苯基丁酸或其药学上可接受的盐。在一些实施方案中,至少一种听觉损失治疗剂为丙戊酸:或其药学上可接受的盐(例如,丙戊酸钠)。其他适合的丙戊酸盐的非限制性列表包括丙戊酸钾、丙戊酸锂等。其他适合的丙戊酸盐的进一步非限制性列表包括丙戊酸钠、丙戊酸半钠、二丙戊酸镁(丙戊酸镁)、二丙戊酸钙(丙戊酸钙)。丙戊酸也称为vpa。丙戊酸钠也称为navpa。在一些实施方案中,至少一种听觉损失治疗剂为chir99021或其药学上可接受的盐,且至少一种听觉损失治疗剂为丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)。在一些实施方案中,丙戊酸的药学上可接受的盐为丙戊酸钠。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)为chir99021及丙戊酸钠。在一些实施方案中,至少一耳用治疗剂为ly2090314或其药学上可接受的盐。在一些实施方案中,至少一种听觉损失治疗剂为ly2090314或其药学上可接受的盐。在一些实施方案中,至少一种听觉损失治疗剂为ly2090314或其药学上可接受的盐,且至少一种听觉损失治疗剂为丙戊酸或其药学上可接受的盐(例如,丙戊酸钠)。在一些实施方案中,一种或多种耳用治疗剂(例如,听觉损失治疗剂)为ly2090314及丙戊酸钠。胶凝剂如本文所用,术语“胶凝剂”是指在经受胶凝条件(例如,特定温度或温度范围,离子的存在,ph值或范围,或使胶凝剂经历从低粘度到高粘度或相反的变化或转变的胶凝剂浓度)能够赋予本公开的药物组合物或重构溶液似凝胶或增稠特性的剂。在一些实施方案中,胶凝条件是特定温度(例如,约26℃、约27℃、约28℃、约29℃、约30℃、约31℃、约32℃、约33℃、约34℃、约35℃、约36℃、约37℃、约38℃、约39℃或约40℃)。在一些实施方案中,胶凝条件是特定温度范围(例如,约26℃或更高、约27℃或更高、约28℃或更高、约29℃或更高、约30℃或更高、约31℃或更高、约32℃或更高、约33℃或更高、约34℃或更高、约35℃或更高、约36℃或更高、约37℃或更高、约38℃或更高、约39℃或更高或约40℃或更高)。在一些实施方案中,胶凝剂对本公开的药物组合物或重构溶液提供介于约1,000至10,000,000厘泊、介于约5,000至5,000,000厘泊或介于约100,000至4,000,000厘泊的粘度。在一些实施方案中,胶凝剂对本公开的药物组合物或重构溶液提供介于约50,000至2,000,000厘泊的粘度。在一些实施方案中,胶凝前(在环境温度(例如,介于约20℃至约26℃)),胶凝剂对本公开的药物组合物或重构溶液提供少于约100,000厘泊、少于约50,000厘泊、20,000厘泊、少于约10,000厘泊、少于约8,000厘泊、少于约7,000厘泊、少于约6,000厘泊、少于约5,000厘泊、少于约4,000厘泊、少于约3,000厘泊、少于约2,000厘泊或少于约1,000厘泊的粘度。在一些实施方案中,在胶凝时(例如,在人体温度下(例如,介于约35℃至约39℃、介于约36℃至约38℃或约37℃)),胶凝剂提供大于约1,000厘泊、大于约5,000厘泊、大于约10,000厘泊、大于约20,000厘泊、大于约50,000厘泊、大于约60,000厘泊、大于约70,000厘泊、大于约80,000厘泊、大于约90,000厘泊或大于约100,000厘泊的粘度。在一些实施方案中,相较于胶凝前(例如,在环境温度(例如,约25℃))药物组合物或重构溶液的粘度,在胶凝时(例如,在人体温度下(例如,介于约36℃至约39℃或在约37℃)),本公开的药物组合物或重构溶液的粘度,如以厘泊为单位测量,为约2倍或更高、约5倍或更高、约10倍或更高、约20倍或更高、约50倍或更高、约60倍或更高、约7倍或更高、约80倍或更高、约90倍或更高、约100倍或更高。应所述理解的是,本公开的药物组合物或重构溶液的胶凝条件(例如,胶凝温度)可以用本领域中的多种技术来测量。在一些实施方案中,使用可商购的具有平行板几何形状(例如,板距离范围为0.5mm至1.0mm)的流变仪来测定胶凝温度。在一些实施方案中,在连续的温度范围(例如,5℃至40℃)以恒定的速率(例如,2至3℃/min)和0.74hz至1hz的变形频率进行分析。在使剪切储能模量(g′)和剪切损耗模量(g″)相等的温度下测定胶凝温度。在一些实施方案中,胶凝剂包括阿拉伯树胶、藻酸、膨润土、聚(丙烯酸)(卡波姆(carbomer))、羧甲基纤维素、乙基纤维素、明胶、羟基乙基纤维素、羟基丙基纤维素、硅酸铝镁(veegum)、甲基纤维素、泊洛沙姆、透明质酸钠、聚乳酸乙醇酸钠、聚葡萄胺糖、聚乙烯基醇、藻酸钠、西黄蓍胶、黄原胶或其任何组合。在一些实施方案中,胶凝剂包括泊洛沙姆。在一些实施方案中,胶凝剂包括透明质酸。在一些实施方案中,胶凝剂是透明质酸。在一些实施例中,透明质酸具有mw平均为介于7.0×10^5道尔顿至8.510^5道尔顿。在一些实施方案中,透明质酸具有mw平均为8.23×10^5道尔顿。在一些实施方案中,透明质酸是lifecorebio提供的“ha1m”。在一些实施方案中,透明质酸为0.5-5%水溶液。在一些实施方案中,透明质酸是1-3%水溶液。在一些实施方案中,透明质酸具有平均为mw为8.23×10^5道尔顿,并且被制备为1-3%水溶液。在一些实施方案中,胶凝剂包含阿拉伯树胶。在一些实施方案中,胶凝剂包含藻酸。在一些实施方案中,胶凝剂包含膨润土。在一些实施方案中,胶凝剂包含聚(丙烯酸)(卡波姆)。在一些实施方案中,胶凝剂包含羧甲基纤维素。在一些实施方案中,胶凝剂包含乙基纤维素。在一些实施方案中,胶凝剂包含明胶。在一些实施方案中,胶凝剂包含羟基乙基纤维素。在一些实施方案中,胶凝剂包含羟基丙基纤维素。在一些实施方案中,胶凝剂包含硅酸铝镁。在一些实施方案中,胶凝剂包含甲基纤维素。在一些实施方案中,胶凝剂包含泊洛沙姆。在一些实施方案中,胶凝剂包含透明质酸钠。在一些实施方案中,胶凝剂包含透明质酸。在一些实施方案中,胶凝剂包含聚乳酸乙醇酸钠。在一些实施方案中,胶凝剂包含聚葡萄胺糖。在一些实施方案中,胶凝剂包含聚乙烯基醇。在一些实施方案中,胶凝剂包含藻酸钠。在一些实施方案中,胶凝剂包含西黄蓍胶。在一些实施方案中,胶凝剂包含黄原胶。在一些实施方案中,胶凝剂包含纤维素衍生物(例如,羧甲基纤维素钠、粉末化纤维素、羟基甲基纤维素、羟基丙基纤维素、羟基丙基甲基纤维素及/或甲基纤维素)。在一些实施方案中,胶凝剂为热可逆胶凝剂。如本文所用,术语“热可逆”是指通过施加热而可逆的能力。“热可逆胶凝剂”是指在施加热时能够可逆地赋予本公开的药物组合物或重构溶液似凝胶或增稠特性的剂。在一些实施方案中,热可逆胶凝剂包含泊洛沙姆。在一些实施方案中,泊洛沙姆形成热可逆凝胶。例如,通过对泊洛沙姆溶液施加热,溶液的粘度增加。溶液的粘度可以增加到溶液形成凝胶的程度。在一些实施方案中,泊洛沙姆溶液在约体温(37℃)下形成凝胶。在一些实施方案中,泊洛沙姆溶液在约体温下形成不动凝胶。在优选的这些实施方案中,泊洛沙姆溶液是包含进一步组分的组合物,诸如一种或多种耳用治疗剂及/或丙戊酸或其药学上可接受的盐。在某些实施方案中,本文所公开的热可逆胶凝剂在体温时为凝胶而在体温以下时为液体是有用的。例如,其可以是液体,以便被注射到耳(例如中耳)。热可逆胶凝剂在本领域中已知,例如在shalaby等人water-solublepolymers,acssymposiumseries,americanchemicalsocietry,1991(chapter33)所公开的当施加热时,可逆地赋予似凝胶或增稠特性的那些聚合物。那些包括具有那些性质的那些聚合物,也公开在molyneaux,p."water-solublepolymers:propertiesandbehavior",crcpress,vol.i,p.58,vol.ii,p.86,newyork,1982;prasad,k.n.,luong,t.t.,florence,a.t.,paris,j.,vaution,c.,seiller,m.andpuisieux,f.,j.colloidinterfacesci.,69,225(1979);a.v.kabanov等人/journalofcontrolledrelease82(2002)189-212;peppasandkhare,advanceddrugdeliveryreviews,11(1993)1-35;us6316011b1;us4474751;us4478822;us6346272及us4188373。这些参考文献中公开的任何热可逆胶凝剂,且特别是那些在体温时为凝胶而在体温以下时为液体者,可以在本文所公开的所有方面和选择中用作胶凝剂。可以理解的是,胶凝剂(例如,热可逆胶凝剂)也可以是本公开的药物组合物或重构溶液的增积剂。在一些实施方案中,泊洛沙姆(例如泊洛沙姆407)是本公开的药物组合物或重构溶液的胶凝剂及/或增积剂。泊洛沙姆是一般类别可商购并且药学上可接受的聚环氧乙烷-聚环氧丙烷-聚环氧乙烷的三嵌段共聚物,其在低温(例如室温或更低)下呈现相对低的粘度,但是在高温下(例如,大约37℃的体温下)呈现很高的粘度,从而使含有此热可逆胶凝剂的组合物在正确的地方有效地固化。其他热可逆胶凝剂,诸如聚环氧乙烷-聚乳酸-聚环氧乙烷聚合物也适用于本发明的各种实施方案。泊洛沙姆是可商购的三嵌段共聚物的一般类别,其在某些实施方案中可以用作胶凝剂。更具体地,此泊洛沙姆可包含聚氧丙烯(聚(环氧丙烯)或ppo)的中央疏水链,其侧接聚氧乙烯(聚(环氧乙烷)或peg)的两个亲水链。这形成a-b-a结构,如下所示:其中a=2至130且b=15至70。在一些实施方案中,a为10至120。在一些实施方案中,a为20至120。在一些实施方案中,a为30至120。在一些实施方案中,a为40至120。在一些实施方案中,a为50至120。在一些实施方案中,a为60至120。在一些实施方案中,a为70至120。在一些实施方案中,a为80至120。在一些实施方案中,a为90至120。在一些实施方案中,a为100至120。在一些实施方案中,a为110至120。在一些实施方案中,a为10至110。在一些实施方案中,a为20至110。在一些实施方案中,a为30至110。在一些实施方案中,a为40至110。在一些实施方案中,a为50至110。在一些实施方案中,a为60至110。在一些实施方案中,a为70至110。在一些实施方案中,a为80至110。在一些实施方案中,a为90至110。在一些实施方案中,a为100至110。在一些实施方案中,a为10至100。在一些实施方案中,a为20至100。在一些实施方案中,a为30至100。在一些实施方案中,a为40至100。在一些实施方案中,a为50至100。在一些实施方案中,a为60至100。在一些实施方案中,a为70至100。在一些实施方案中,a为80至100。在一些实施方案中,a为90至100。在一些实施方案中,a为95至105。在一些实施方案中,a为95至115。在一些实施方案中,a为85至105。在一些实施方案中,a为85至115。在一些实施方案中,b为25至70。在一些实施方案中,b为35至70。在一些实施方案中,b为45至70。在一些实施方案中,b为55至70。在一些实施方案中,b为60至70。在一些实施方案中,b为65至70。在一些实施方案中,b为56+/-10%,且各a为101+/-10%。在一些实施方案中,b为61+/-15%,且各a为101+/-10%。在一些实施方案中,b为70+/-20%,且各a为101+/-20%。在一些实施方案中,b为56+/-10%,且各a为100+/-10%。在一些实施方案中,b为61+/-15%,且各a为100+/-10%。在一些实施方案中,b为70+/-20%,且各a为100+/-10%。在某些实施方案中,泊洛沙姆还以以下商品名已知:synperonics、pluronics及kolliphor。对于通用术语泊洛沙姆,这些共聚物通常以字母p(对于泊洛沙姆)命名,后跟三个数字:前两个数字乘以100给出聚氧丙烯核心的近似分子量,而最后一个数字乘以10给出百分比聚氧乙烯含量(例如,p407=具有聚氧丙烯分子质量为4000g/mol及聚氧乙烯含量为70%的泊洛沙姆)。对于pluronic和synperonic商品名,这些共聚物的编码以字母开头,以定义其在室温下的物理形式(l=液体,p=糊剂,f=片(固体)),接着是两位或三位数字。数字名称中的第一位数字(三位数数字中的两位数字)乘以300,表示疏水物的近似分子量;以及最后一个数字x10给出百分比聚氧乙烯含量(例如,l61表示聚氧丙烯分子质量为1800g/mol及10%聚氧乙烯含量)。在给出的例子中,泊洛沙姆181(p181)=pluronicl61及synperonicpe/l61。对于泊洛沙姆407(p407),两个peg嵌段的近似长度为约100个重复单元,而丙二醇嵌段的近似长度为约56至67个重复单元(其中约为+/-10%)。p407也以basf的商品名pluronicf127或croda的商品名synperonicpe/f127已知。泊洛沙姆还可以由聚氧乙烯(聚(环氧乙烷)或peg)的中心亲水链,其侧接聚氧丙烯(聚(环氧丙烯)的两个疏水链构成。这形成类似b-a-b结构。存在其他ppo-peg嵌段共聚物,诸如包含四个ppo-peo链者,其从胺端中心链(例如,n-ch2-ch2-n)向外延伸,并且在某些实施方案中,所公开的组合物可包含此四种嵌段聚合物的一种或多种。(除本文所公开的泊洛沙姆以外或代替泊洛沙姆)。在一些实施方案中,泊洛沙姆(例如,泊洛沙姆407)是本公开的药物组合物或重构溶液的胶凝剂和增积剂。在一些实施方案中,在药物组合物(例如,冻干药物组合物)中泊洛沙姆(例如,泊洛沙姆407)的存在减轻对任何其他赋形剂(例如,额外的增积剂)的需求。这种减轻可以为药物组合物提供一个或多个优点(例如,增强的稳定性及/或减少的重构时间)。在一些实施方案中,本公开的药物组合物不包含额外的增积剂。在一些实施方案中,本公开的冻干药物组合物不包含额外的增积剂。在一些实施方案中,本公开的重构冻干药物组合物不包含额外的增积剂。若干参数可以被用于表征泊洛沙姆在本公开的组合物的特征,诸如在聚合物中的百分比peo及/或平均分子量及/或纯度水平。应当理解,这些参数可以是可组合的,并且可以使用任何数量的不同参数来描述泊洛沙姆。在一些实施方案中,泊洛沙姆经纯化。在一些实施方案中,泊洛沙姆未经纯化。在一些实施方案中,泊洛沙姆(例如,泊洛沙姆407)具有平均分子量为约7.25kda或更大、约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。在一些实施方案中,泊洛沙姆包含按分子质量计至少50%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少55%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含通过分子质量至少60%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少65%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少66%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少67%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少68%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少69%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计至少70%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计60至80%聚环氧乙烷。在一些实施方案中,泊洛沙姆包含按分子质量计65至75%聚环氧乙烷。在一些实施方案中,泊洛沙姆具有平均分子量为约7250至约17350道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约8000至约17000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约8000至约16000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约9000至约16000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约9000至约15000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约9800至约14600道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约10000至约14000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约10500至约14000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约10500至约13500道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约11000至约14000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约11000至约13500道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约11500至约14000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约11500至约13000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约12000至约14000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约12000至约13000道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约10500至约12500道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约10500至约11500道尔顿。在一些实施方案中,泊洛沙姆具有平均分子量为约11500至约12500道尔顿。在一些实施方案中,至少85重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少86重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少87重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少88重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少89重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少90重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少91重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少92重量%的泊洛沙姆具有平均分子量为约7250至约17350da。在一些实施方案中,至少86重量%的泊洛沙姆具有大于约7250da的平均分子量。在一些实施方案中,至少87重量%的泊洛沙姆具有大于约7250da的平均分子量。在一些实施方案中,至少88重量%的泊洛沙姆具有大于约7250da的平均分子量。在一些实施方案中,至少89重量%的泊洛沙姆具有大于约7250da的平均分子量。在一些实施方案中,至少90重量%的泊洛沙姆具有大于约7250da的平均分子量。在一些实施方案中,至少91重量%的泊洛沙姆具有大于约7250da的平均分子量。与此段落的实施方案相关,泊洛沙姆可具有下述特性。在一些实施方案中,泊洛沙姆具有约12,000至约12,500da的峰分子量。在一些实施方案中,泊洛沙姆具有约11,500至约12,000da的数量平均分子量。在一些实施方案中,泊洛沙姆具有约11,750至约12,250da的重量平均分子量。在一些实施方案中,泊洛沙姆具有约1.02的多分散性指数。在一些实施方案中,少于19重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于18重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于17重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于16重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于15重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于14重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于13重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于12重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于11重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于10重量%的泊洛沙姆具有小于约7250da的平均分子量。在一些实施方案中,少于9重量%的泊洛沙姆具有小于约7250da的平均分子量与此段落的实施方案相关,泊洛沙姆可具有下述特性。在一些实施方案中,泊洛沙姆具有约5,000至约5,500da的峰分子量。在一些实施方案中,泊洛沙姆具有约5,000至约5,500da的数量平均分子量。在一些实施方案中,泊洛沙姆具有约5,000至约5,500da的重量平均分子量。在一些实施方案中,泊洛沙姆具有约1.02的多分散性指数。在一些实施方案中,整个泊洛沙姆分布具有约10,800至约11,200da的数量平均分子量。在一些实施方案中,泊洛沙姆分布具有约11,500至约11,700da的重量平均分子量。在一些实施方案中,泊洛沙姆分布为从0至约16,600da。在一些实施方案中,泊洛沙姆具有多分散性指数为约少于1.07。在一些实施方案中,泊洛沙姆选自由下列组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403及泊洛沙姆407。在一些实施方案中,泊洛沙姆为泊洛沙姆188或泊洛沙姆407。在一些实施方案中,泊洛沙姆为泊洛沙姆407。在一些实施方案中,泊洛沙姆包含泊洛沙姆407。在一些实施方案中,泊洛沙姆407为至少10重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少20重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少30重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少40重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少50重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少60重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少70重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少75重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少80重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆407为至少90重量%的泊洛沙姆。在一些实施方案中,泊洛沙姆为泊洛沙姆407。在一些实施方案中,泊洛沙姆为纯化的泊洛沙姆407。在一些实施方案中,泊洛沙姆为纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。在这些实施方案中,耳用剂的溶解度通常可增加。在一些实施方案中,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)具有平均分子量为约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。在一些实施方案中,相较于未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407),纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)具有分子量低于9kda的降低的聚合物链量。在一些实施方案中,分子量低于7250da的聚合物链可被视为杂质。在一些实施方案中,相较于未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407),纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)具有约99%或更少、约98%或更少、约95%或更少、约90%或更少、约80%或更少、约70%或更少、约60%或更少、约50%或更少、约40%或更少、约30%或更少、约20%或更少或约10%或更少的分子量低于9kda的聚合物链。在一些实施方案中,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)包含少于约15重量%的具有分子量低于约9kda的聚合物(例如,peo均聚合物或peo-ppo共聚物),例如,少于约15%、少于约14%、少于约13%、少于约12%、少于约11%、少于约10%、少于约5%、少于约4%、少于约3%、少于约2%、少于约1%、少于约0.9%、少于约0.8%、少于约0.7%、少于约0.6%、少于约0.5%、少于约0.4%、少于约0.3%、少于约0.2%或少于约0.1%(重量计)的具有分子量低于约9kda的聚合物,包括介于这些值任一者之间的所有范围。在一些实施方案中,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)通过液液萃取或尺寸排阻色谱法制备。可获得纯化聚合物的通用指南,例如,在美国专利第6,977,045号、fakhari等人(heliyon3:e00390(2017))及pct申请公布第wo/2017/108457号,其各者以引用方式并入本文。液液萃取程序涉及在包含不同盐浓度的两个水相之间分馏泊洛沙姆(例如,泊洛沙姆407)。在一些实施方案中,一种或多种杂质优先分配到具有高盐浓度的水相,而纯化的泊洛沙姆(例如,泊洛沙姆407)保持在具有低盐浓度的水相。尺寸排阻色谱法提供基于流体动力学半径的分离。收集含有具有所需分子量范围的纯化的泊洛沙姆(例如,泊洛沙姆407)的馏分。在一些实施方案中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆(例如,泊洛沙姆407)移除。在一些实施方案中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种二嵌段共聚物(例如,peo-ppo)、单嵌段聚合物(例如,peo)及/或醛在纯化期间自泊洛沙姆(例如,泊洛沙姆407)移除。在一些实施方案中,约10重量%或更多、约20重量%或更多、约30重量%或更多、约40重量%或更多、约50重量%或更多、约60重量%或更多、约70重量%或更多、约80重量%或更多、约90重量%或更多、约95重量%或更多、约98重量%或更多或约99重量%或更多的一种或多种二嵌段共聚物(例如,peo-ppo)、单嵌段聚合物(均聚合物)(例如,peo)及/或醛在纯化期间自泊洛沙姆(例如,泊洛沙姆407)移除。冻干药物组合物的其他方面在一些实施方案中,冻干药物组合物呈冻干饼的形式。在一些实施方案中,本公开的药物组合物的冻干可从组合物中基本上除去所有挥发性组分。例如,可以通过冻干基本上除去水。例如,可以通过冻干基本上除去dmso。在一些实施方案中,冻干组合物基本上无水及/或dmso。在一些实施方案中,冻干组合物包含少于约5重量%的水及/或dmso。在一些实施方案中,冻干组合物包含少于约4重量%的水及/或dmso。在一些实施方案中,冻干组合物包含少于约3重量%的水及/或dmso。在一些实施方案中,冻干组合物包含少于约2重量%的水及/或dmso。在一些实施方案中,冻干组合物包含少于约1重量%的水及/或dmso。在一些实施方案中,冻干药物组合物相较于包含一种或多种溶剂的可比拟的药物组合物对氧及/或光具有较高稳定性。通常,在将具有性质的组合物与具有或不具有特征的组合物进行比较来证实所述性质的情况下,可比拟的组合物是在其他方面相同的组合物。这适用于整个公开。例如,以上段落可以理解为:与包含一种或多种溶剂的其他方面相同的药物组合物相比,冻干药物组合物对氧及/或光具有较高稳定性。在一些实施方案中,冻干组合物包含至少约1重量%的chir99021或其药学上可接受的盐。在一些实施方案中,冻干组合物包含约1重量%至约2重量%的chir99021。在一些实施方案中,冻干组合物包含至少约30重量%的丙戊酸或其药学上可接受的盐。在一些实施方案中,冻干组合物包含至少约40重量%的丙戊酸或其药学上可接受的盐。在一些实施方案中,冻干组合物包含约30重量%至约50重量%的丙戊酸或其药学上可接受的盐。在一些实施方案中,冻干组合物包含至少约50重量%的泊洛沙姆。在一些实施方案中,冻干组合物包含至少约60重量%的泊洛沙姆。在一些实施方案中,冻干组合物包含约50重量%至约70重量%的泊洛沙姆。在一些实施方案中,冻干组合物包含约1.5%至约2重量%的chir99021、约42.5重量%至约47.5重量%的丙戊酸钠、且剩余百分比为泊洛沙姆407。在一些实施方案中,存在于冻干药物组合物中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。在一些实施方案中,存在于冻干药物组合物中的所有杂质总量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。在一些实施方案中,杂质为残余溶剂。在一些实施方案中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸点为约220℃或更少的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。在一些实施方案中,冻干药物组合物包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂(例如,听觉损失治疗剂)的量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,冻干药物组合物包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的其他相同冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂(例如,听觉损失治疗剂)的溶解浓度为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高。在一些实施方案中,其他相同冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,冻干药物组合物包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物,冻干药物组合物具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异(batch-to-batchvariability)。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,冻干药物组合物包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物,冻干药物组合物具有较低胶凝温度、较窄胶凝温度范围及/或较高粘度。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,冻干药物组合物包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物,冻干药物组合物具有降低的降解率。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,冻干药物组合物包含增积剂的一种或多种(例如,纯化的泊洛沙姆407);稳定剂;张力调节剂;以及舒缓剂。在一些实施方案中,通过冻干本公开的药物组合物制备冻干药物组合物。在一些实施方案中,通过本公开的方法制备冻干药物组合物。在一些实施方案中,通过重构方法冻干药物组合物适于制备重构溶液。在一些实施方案中,重构方法为少于约1小时。在一些实施方案中,重构方法为少于约30分钟。在一些实施方案中,重构溶液适于注射(例如,鼓室内注射)。在一些实施方案中,重构溶液维持用于制备冻干药物组合物的预冻干溶液的一种或多种流变性质。在一些实施方案中,相较于从不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物制备的重构溶液,重构溶液具有降低的降解率。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,当以与预冻干溶液相同的固体含量制备重构溶液时,重构溶液维持用于制备冻干药物组合物的预冻干溶液的一种或多种流变性质。药物组合物的其他方面在一些实施方案中,药物组合物为预冻干药物组合物。在一些实施方案中,可以通过重构本文所公开的冻干组合物来形成药物组合物,例如,以形成水性组合物,例如热可逆凝胶。应当理解的是,当组合物是水性时(例如,在冻干之前),组合物的组分将具有一定浓度,当冻干组合物时将改变,因为例如去除水。然而,为简便起见,通过参考其在水性时的浓度来提及冻干形式的组分可能是方便的,因为这可能是最初如何产生组合物。冻干组合物的重构可以基本上使组分的浓度恢复到冻干之前的组合物中的浓度。在一些实施方案中,组合物包含胶凝剂及式(i)的化合物(如上所述和在编号的实施方案中所述)。在一些实施方案中,药物组合物包含胶凝剂、大于约70mg/ml的浓度的丙戊酸或其药学上可接受的盐及一种或多种耳用治疗剂。在一些实施方案中,包含泊洛沙姆的药物组合物,其中,至少85重量%的泊洛沙姆具有大于约7250da的平均分子量及大于70mg/ml的丙戊酸或其药学上可接受的盐。在一些实施方案中,药物组合物包含泊洛沙姆,其中,少于按照wt.%为20%的泊洛沙姆具有小于约7250da的平均分子量及大于70mg/ml的丙戊酸或其药学上可接受的盐。在一些实施方案中,组合物适于鼓室内注射。在一些实施方案中,胶凝剂为泊洛沙姆(如上所述和在编号的实施方案中所述)。在一些实施方案中,泊洛沙姆包含纯化的泊洛沙姆。在一些实施方案中,泊洛沙姆包含纯化的泊洛沙姆泊洛沙姆为纯化的泊洛沙姆。在一些实施方案中,泊洛沙姆如上述所定义(如上所述和在编号的实施方案中所定义)。在一些实施方案中,组合物包含一种或多种耳用治疗剂(如上所述和在编号的实施方案中所定义)。在其他实施方案中,组合物胶凝剂包含透明质酸。在其他实施方案中,组合物胶凝剂包含纤维素衍生物。在一些实施方案中,一种或多种耳用治疗剂包括gsk3抑制剂。在一些实施方案中,一种或多种耳用治疗剂包括hdac抑制剂。在一些实施方案中,一种或多种耳用治疗剂选自上表。在一些实施方案中,一种或多种耳用治疗剂包括chir99021或其药学上可接受的盐。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为少于约10mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为少于约7.5mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约3至约7mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约4至约6mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约1至约5mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约2至约4mg/ml。在一些实施方案中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。在一些实施方案中,一种或多种耳用治疗剂包括丙戊酸或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括丙戊酸或其药学上可接受的盐及chir99021或其药学上可接受的盐。在一些实施方案中,组合物包含式(i)的化合物(如上所述和在编号的实施方案中所述)。在一些实施方案中,式(i)的化合物及/或一种或多种耳用治疗剂为丙戊酸或其药学上可接受的盐。在一些实施方案中,丙戊酸的药学上可接受的盐为丙戊酸钠。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度大于约100mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约100至约500mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约100至约350mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约110至约160mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约130至约140mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约125至约145mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约128至约138mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约133mg/ml。然而,在其他实施方案中,式(i)的化合物及/或一种或多种耳用治疗剂不为丙戊酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物及/或一种或多种耳用治疗剂包括2-(丙-2-炔-1-基)-辛酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物及/或一种或多种耳用治疗剂包括苯基丁酸或其药学上可接受的盐。在一些实施方案中,式(i)的化合物及/或一种或多种耳用治疗剂包括亚麻油酸或其药学上可接受的盐。在其他实施方案中,一种或多种耳用治疗剂可为不同。在其他实施方案中,一种或多种耳用治疗剂不包括chir99021或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括ly2090314或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括azd1080或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括gsk3xxii或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括化合物i-7或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂包括化合物i-1或其药学上可接受的盐。如上所述,组合物可包含泊洛沙姆。于泊洛沙姆可变化(peo含量、纯度、分子量范围)同时,泊洛沙姆可包含下述重量百分比的组成。在一些实施方案中,泊洛沙姆的浓度为约2%至约50%w/v。在一些实施方案中,泊洛沙姆的浓度为约2%至约40%w/v。在一些实施方案中,泊洛沙姆的浓度为约2%至约30%w/v。在一些实施方案中,泊洛沙姆的浓度为约2%至约20%w/v。在一些实施方案中,泊洛沙姆的浓度为约10%至约20%w/v。在一些实施方案中,泊洛沙姆的浓度为约12.5%至约17.5%w/v。在一些实施方案中,泊洛沙姆的浓度为约13%至约17.5%w/v。在一些实施方案中,泊洛沙姆的浓度为约13%至约17%w/v。在一些实施方案中,泊洛沙姆的浓度为约13.5%至约17%w/v。在一些实施方案中,泊洛沙姆的浓度为约13.5%至约16.5%w/v。在一些实施方案中,泊洛沙姆的浓度为约14%至约16.5%w/v。在一些实施方案中,泊洛沙姆的浓度为约14%至约16%w/v。在一些实施方案中,泊洛沙姆的浓度为约15%至约17.5%w/v。在一些实施方案中,本公开涉及制备药物组合物(例如,如上所述或通过编号的实施方案所述的组合物)的方法包括下述步骤:(a)具有水溶液包含的胶凝剂;以及(b)添加一种或多种耳用治疗剂或其药学上可接受的盐的溶液。在一些实施方案中,水溶液进一步包含到第一溶液的丙戊酸或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐。在一些实施方案中,一种或多种耳用治疗剂为ly2090314或其药学上可接受的盐。在一些实施方案中,在步骤(b)中,溶液包含极性非质子性溶剂。在一些实施方案中,在步骤(b)中,极性非质子性溶剂包含dmso。在一些实施方案中,在步骤(b)中,极性非质子性溶剂为dmso。在一些实施方案中,在步骤(b)中,极性非质子性溶剂包含二甲基甲酰胺。在一些实施方案中,在步骤(b)中,极性非质子性溶剂包含二甲基乙酰胺。在一些实施方案中,在步骤(b)中,极性非质子性溶剂包含n-甲基-2-吡咯烷酮。如任一前述实施方案所述的方法,其中,胶凝剂包含泊洛沙姆。在一些实施方案中,药物组合物适于制备本公开的冻干药物组合物(例如,通过本文所公开的冻干方法)。在一些实施方案中,预冻干药物组合物包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些实施方案中,预冻干药物组合物包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于20wt%存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。在一些实施方案中,描述于“药物组合物的其他方面”的预冻干药物组合物(或上述任何实施方案),丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。组合物的任何个别组分可以以给定的浓度存在。浓度可以具有每体积的百分比重量(w/v)的单位,其也可以表示为g/ml。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约1.45mg/ml至约1.65mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。在一些实施方案中,在预冻干药物组合物中的丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约43mg/ml至约46mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml。在一些实施方案中,在预冻干药物组合物中的泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%。在一些实施方案中,泊洛沙姆407的浓度为约8wt%。在一些实施方案中,在预冻干药物组合物中的dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%。在一些实施方案中,dmso的浓度为约2.5wt%。在一些实施方案中,如上所述,在组合物中的dmso的浓度为约少于5wt%。然而,在其他实施方案中,应了解dmso的浓度可少于约25wt%。在一些实施方案中,dmso的浓度为约少于25wt%。在一些实施方案中,dmso的浓度为约少于20wt%。在一些实施方案中,dmso的浓度为约少于15wt%。在一些实施方案中,dmso的浓度为约少于10wt%。在一些实施方案中,dmso的浓度为约少于5wt%。在一些实施方案中,其中,dmso的浓度为约25至约15wt%。在一些实施方案中,其中,dmso的浓度为约20至约10wt%。在一些实施方案中,其中,dmso的浓度为约15至约5wt%。在一些实施方案中,其中,dmso的浓度为约10至约5wt%。在一些实施方案中,在预冻干药物组合物中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。发明所属
技术领域:
中具有通常知识者将理解,chir99012和丙戊酸(或其药学上可接受的盐)的重量比在冻干和重构的药物组合物中将基本上不变。在一些实施方案中,在预冻干药物组合物中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1。在一些实施方案中,介于泊洛沙姆407及dmso之间的重量比为约3:1。在一些实施方案中,在预冻干药物组合物中介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度范围从约1.45mg/ml至约1.65mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约43mg/ml至约46mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度为约1.55mg/ml;丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml;泊洛沙姆407的浓度为约8wt%;以及dmso的浓度为约2.5wt%。在一些实施方案中,预冻干药物组合物包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约10mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml、从约0.85mg/ml至约1.15mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约1.05mg/ml。在一些实施方案中,在预冻干药物组合物中的丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml、从约28mg/ml至约31mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml。在一些实施方案中,在预冻干药物组合物中的泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约11wt%至约10wt%、从约7wt%至约8.5wt%。在一些实施方案中,泊洛沙姆407的浓度为约7.5wt%。在一些实施方案中,在预冻干药物组合物中的dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%、从约2wt%至约3wt%。在一些实施方案中,dmso的浓度为约2.5wt%。在一些实施方案中,在预冻干药物组合物中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。发明所属
技术领域:
中具有通常知识者将理解,chir99012和丙戊酸(或其药学上可接受的盐)的重量比在冻干和重构的药物组合物中将基本上不变。在一些实施方案中,在预冻干药物组合物中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。在一些实施方案中,介于泊洛沙姆407及dmso之间的重量比为约3:1。在一些实施方案中,在预冻干药物组合物中介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。在一些实施方案中,在预冻干药物组合物中,chir99021或其药学上可接受的盐的浓度范围从约0.95mg/ml至约1.15mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约28mg/ml至约31mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度为约1.05mg/ml;丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。在一些实施方案中,预冻干药物组合物包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约0.6mg/ml至约0.75mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度范围为约0.7mg/ml。在一些实施方案中,在预冻干药物组合物中的丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约18mg/ml至约21mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml。在一些实施方案中,在预冻干药物组合物中的泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%。在一些实施方案中,泊洛沙姆407的浓度为约7.5wt%。在一些实施方案中,在预冻干药物组合物中的dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%。在一些实施方案中,dmso的浓度为约5wt%。在一些实施方案中,在预冻干药物组合物中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。发明所属
技术领域:
中具有通常知识者将理解,chir99012和丙戊酸(或其药学上可接受的盐)的重量比在冻干和重构的药物组合物中将基本上不变。在一些实施方案中,在预冻干药物组合物中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。在一些实施方案中,在预冻干药物组合物中介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度范围从约0.6mg/ml至约0.75mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约18mg/ml至约21mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。在一些实施方案中,在预冻干药物组合物中的chir99021或其药学上可接受的盐的浓度为约0.7mg/ml;丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。在一些实施方案中,预冻干药物组合物包含一种或多种的水或缓冲剂;增积剂;稳定剂(例如,纯化的泊洛沙姆407);张力调节剂;以及舒缓剂。制备冻干药物组合物的方法在一些方面中,本公开提供制备本公开的冻干药物组合物的方法。在一些方面中,本公开提供处理本公开的药物组合物以形成冻干药物组合物(例如,本公开的药物组合物)的方法。在实施方案中,方法涉及冻干方法。在实施方案中,本公开涉及冻干如上述药物组合物及编号的实施方案所述的药物组合物的方法,其中,方法包括:(a)提供药物组合物;(b)通过下述冻干组合物:(i)以每分钟0.5℃的速率降低冻干器中的温度到-45℃,之后保持在-45℃达3小时;(ii)施加80毫托的真空;(iii)增加温度至-30℃(以每分钟0.5℃的速率)并在80毫托的真空下保持在-30℃达15小时;(iv)增加温度至15℃(以每分钟0.5℃的速率);及/或(v)在80毫托的真空下保持温度在15℃达20小时;以及(d)获得冻干药物组合物。在一些实施方案中,组合物在冻干之前经过至少-50℃的温度。在一些实施方案中,方法可以通过以下编号的实施方案的任一个或多个来改变。在实施方案中,本公开涉及冻干如上述药物组合物及编号的实施方案所述的药物组合物的方法,其中,方法包括:(a)提供药物组合物;(b)通过下述冻干组合物:(i)以每分钟约0.5℃的速率在冻干器中降低温度到约-45℃,之后保持其在约-45℃达约3小时;(ii)施加约80毫托的真空;(iii)增加温度至约-30℃(以每分钟约0.5℃的速率)并在约80毫托的真空下保持在约-30℃达约15小时;(iv)增加温度至约15℃(以每分钟约0.5℃的速率);及/或(v)在约80毫托的真空下保持温度在约15℃达约20小时;以及(d)获得冻干药物组合物。在一些实施方案中,组合物在冻干之前经过至少约-50℃的温度。在一些实施方案中,方法可以通过以下编号的实施方案的任一个或多个来改变。在一些实施方案中,在冻干方法之前将药物组合物灭菌。在一些实施方案中,药物组合物通过使用过滤器,例如,微孔膜的过滤(例如,无菌过滤)来灭菌。在一些实施例中,过滤器包括尼龙、聚碳酸酯、乙酸纤维素、聚偏二氟乙烯(pvdf)、聚四氟乙烯(ptfe)、聚醚砜(pes)或其任何组合。在一些实施例中,过滤器是聚醚砜(pes)膜过滤器或聚四氟乙烯(ptfe)膜过滤器。在一些实施方案中,过滤器具有孔径为约0.01μm、约0.02μm、约0.05μm、约0.08μm、约0.1μm、约0.2μm、约0.3μm、约0.4μm、约0.5μm或约1μm。在一些实施方案中,通过过滤基本上从药物组合物中除去一种或多种微生物(例如,细菌、霉菌或酵母菌)和粒子。在一些实施方案中,方法包括下述步骤:i)在低于0℃的第一温度冷却药物组合物达第一时间段;ii)在低于0℃的第二温度并在低于760托的减压下自步骤(i)的所得混合物移除一种或多种溶剂达第二时间段。在一些实施方案中,方法包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以从每分钟约0.1℃至每分钟约5℃的速率冷却药物组合物到范围从约-20℃至约-80℃的第一温度;ib)在第一温度保持药物组合物达范围从约1小时至约6小时的第一时间段;iia)将药物组合物经范围从约1毫托至1000毫托的减压且以从每分钟约0.1℃至每分钟约5℃的速率使药物组合物温热到范围从约-10℃至-50℃的第二温度;iib)在第二温度下且在减压下保持药物组合物或范围从约10小时至约30小时的第二时间段;iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。在一些实施方案中,药物组合物包含一种或多种耳用治疗剂(例如,听觉损失治疗剂)与泊洛沙姆。在一些实施方案中,药物组合物包含一种或多种耳用治疗剂(例如,听觉损失治疗剂)与泊洛沙姆407。在一些实施方案中,药物组合物包含一种或多种耳用治疗剂(例如,听觉损失治疗剂)与纯化的泊洛沙姆407。在一些实施方案中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆、dmso及水。在一些实施方案中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆407、dmso及水。在一些实施方案中,药物组合物包含chir99021、丙戊酸钠盐、纯化的泊洛沙姆407、dmso及水。在一些实施方案中,方法包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以每分钟约0.5℃的速率冷却药物组合物到约-45℃的第一温度;ib)在第一温度保持药物组合物达约3小时的第一时间段;iia)将药物组合物经约80毫托至1000毫托的减压且以每分钟约0.5℃的速率使药物组合物温热至约-30℃的第二温度;iib)在第二温度下且在减压下保持药物组合物达范围从约10小时至约15小时的第二时间段;iic)以每分钟约0.5℃的速率使药物组合物温热到20℃;iid)在20℃且在减压下保持药物组合物达20小时,iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。重构溶液的其他方面在一些实施方案中,通过添加稀释剂至本公开的冻干药物组合物制备重构溶液。在一些实施方案中,本公开涉及重构冻干药物组合物(如上述或在编号的实施方案中所述)的方法,方法包括:(a)提供如任一前述实施方案所述的冻干药物组合物;(b)以药学上可接受的稀释剂重构冻干药物组合物;以及(c)获得重构的药物组合物。在一些实施方案中,重构冻干药物组合物包含溶解冻干药物组合物于药学上可接受的稀释剂。在一些实施方案中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约1小时。在一些实施方案中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约45分钟。在一些实施方案中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约30分钟。在一些实施方案中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约15分钟。在一些实施方案中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约10分钟。在一些实施方案中,重构的药物组合物可通过重构冻干药物组合物的方法获得。在一些实施方案中,重构的药物组合物包含冻干本公开的组合物及稀释剂。在一些实施方案中,组合物重构在少于约1小时。在一些实施方案中,组合物重构在少于约45分钟。在一些实施方案中,组合物重构在少于约30分钟。在一些实施方案中,组合物重构在少于约15分钟。在一些实施方案中,组合物重构在少于约10分钟。在一些实施方案中,通过冻干本公开的药物组合物而制备冻干药物组合物。在一些实施方案中,通过本公开的方法而制备冻干药物组合物。在一些实施方案中,冻干药物组合物包含一种或多种耳用治疗剂(例如,听觉损失治疗剂)与胶凝剂。在一些实施方案中,稀释剂包含水及二甲基亚砜(dmso)。在一些实施方案中,在稀释剂中dmso的浓度范围从约1%w/w至约15%w/w、从约2%w/w至约12%w/w、从约3%w/w至约10%w/w、从约4%w/w至约9%w/w、从约5%w/w至约8%w/w、从约5.5%w/w至约7.5%w/w、从约5.8%w/w至约7%w/w、从约6%w/w至约6.8%w/w或从约6.2%w/w至约6.6%w/w。在一些实施方案中,在稀释剂中dmso的浓度为约6.4%w/w。在一些实施方案中,稀释剂为于水中的6.4w/w%dmso。在一些实施方案中,在重构期间中添加的稀释剂的量范围从约1μl至约6μl、从约2μl至约5μl、从约2.5μl至约4.5μl、从约2.8μl至约4μl、从约3μl至约3.8μl或从约3.2μl至约3.6μl/mg的冻干药物组合物。在一些实施方案中,在重构期间中添加的稀释剂的量为约3.4μl/mg的冻干药物组合物。在一些实施方案中,在重构期间中添加的稀释剂的量为约20克、约30克、约40克、约50克、约60克、约70克、约80克、约90克、约100克、约120克、约150克、约200克、约300克、约500克、约800克或约1000克。在一些实施方案中,在重构期间中添加的稀释剂的量为约0.1ml-约1.5ml、约0.3ml-约1.3ml、约0.5ml-约1.1ml或约0.7ml-约0.9ml。在一些实施方案中,在重构期间中添加的稀释剂的量为约0.85ml。在一些实施方案中,在添加到冻干药物组合物之前,用氮引入稀释剂达约10秒至约30分钟、从约20秒至约20分钟、从约30秒至约10分钟、从约40秒至约5分钟、从约50秒至约3分钟或从约1分钟至约2分钟。在一些实施方案中,在添加到冻干药物组合物之前,稀释剂经无菌过滤(例如,使用pes0.2μm过滤器及/或10ml注射器)。在一些实施方案中,添加后,将冻干药物组合物和稀释剂的混合物在低于环境温度的温度下保持一段时间,从而形成重构溶液。在各种实施方案中,在不对冻干药物组合物和稀释剂的混合物进行任何搅拌的情况下进行重构方法(例如,摇动、声波处理或涡旋)。在一些实施方案中,重构方法包括轻轻旋转容器(例如,小瓶)以混合冻干药物组合物和稀释剂,及/或轻轻敲打容器(例如,小瓶),直到冻干药物组合物和稀释剂形成均匀溶液。在一些实施方案中,冻干药物组合物和稀释剂的混合物保持在温度范围从约-10℃至约2℃、从约-5℃至约15℃、从约℃至约10℃、从约1℃至约9℃或从约2℃至约8℃。在一些实施方案中,冻干药物组合物和稀释剂的混合物保持在温度范围从约5至8℃。在一些实施方案中,冻干药物组合物和稀释剂的混合物保持达为约6小时或更少、约3小时或更少、约2小时或更少、约1小时或更少、约50分钟或更少、约40分钟或更少、约30分钟或更少、约20分钟或更少或约10分钟或更少的时间段(例如,重构时间)。在某些实施方案中,冻干药物组合物和稀释剂的混合物保持达20分钟。在一些实施方案中,重构方法包括添加稀释剂到冻干药物组合物并储存小瓶在2至8℃。在一些实施方案中,重构方法包括添加稀释剂到冻干药物组合物并储存小瓶在2至8℃且轻轻敲打容器(例如,小瓶),直到冻干药物组合物和稀释剂形成均匀溶液。在一些实施方案中,重构方法包括添加稀释剂到冻干药物组合物并储存小瓶在2至8℃且轻轻敲打容器(例如,小瓶),直到冻干药物组合物和稀释剂形成均匀溶液而不需声波处理或涡旋(例如,以避免泊洛沙姆降解或药物沉淀)。在一些实施方案中,重构方法包括添加约0.85ml的稀释剂到冻干药物组合物并在2至8℃储存在小瓶且轻轻敲打容器(例如,小瓶),直到冻干药物组合物和稀释剂形成均匀溶液而不需声波处理或涡旋。在一些实施方案中,重构方法包括添加约0.85ml的稀释剂到冻干药物组合物并在2至8℃储存在小瓶且轻轻敲打容器(例如,小瓶),直到冻干药物组合物和稀释剂形成均匀溶液,而不需声波处理或涡旋,其中稀释剂为在水中的6.4w/w%dmso。在一些实施方案中,任何重构方法可用于测量改进的重构时间,例如,例如相对于非冻干固体形式,本文所讨论的改进。在某些实施方案中,本文公开的重构时间的改进是使用重构方法具体测量,其中将约0.85ml的稀释剂添加至冻干药物组合物中,将小瓶储存在2至8℃并轻轻敲打直到冻干的冻干药物组合物和稀释剂形成均匀溶液,而不需声波处理或涡旋,其中稀释剂是在水中的6.4w/w%dmso。在固定重构时间(例如20分钟)后可以观察到改进。在一些实施方案中,重构溶液在环境温度(例如,介于20℃至26℃)为澄清溶液。在一些实施方案中,重构溶液在环境温度(例如,介于20℃至26℃)适于注射。在一些实施方案中,重构溶液具有高于环境温度(例如,介于20℃至26℃;优选地25℃)且低于人体温度(例如,介于36℃至39℃;优选地37℃)的胶凝温度。在一些实施方案中,重构溶液具有为约2℃或约3℃的胶凝温度范围。在一些实施方案中,重构溶液当储存在温度范围从约-10℃至约20℃、从约-5℃至约15℃、从约0℃至约10℃、从约1℃至约9℃或从约2℃至约8℃为稳定。在一些实施方案中,在使用前,重构溶液储存达约10分钟或更长、约20分钟或更长、约30分钟或更长、约40分钟或更长、约50分钟或更长、约1小时或更长、约2小时或更长、约3小时或更长、约4小时或更长、约5小时或更长,或约6小时或更长。在一些实施方案中,约0.1%或更少、约0.09%或更少、约0.08%或更少、约0.07%或更少、约0.06%或更少、约0.05%或更少、约0.04%或更少、约0.03%或更少、约0.02%或更少,或约0.01%或更少的一种或多种耳用治疗剂(例如,chir99021及/或丙戊酸钠)在储存期间降解。在一些实施方案中,重构溶液具有ph值范围从约4至约13、从约5至约12、从约6至约11、从约6.5至约10.5或从约7至约10。在一些实施方案中,重构溶液适于在环境温度(例如,介于20℃至26℃)通过针(例如,具有内径为约3.81mm或更小、约3.43mm或更小、约3.00mm或更小、约2.69mm或更小、约2.39mm或更小、约2.16mm或更小、约1.80mm或更小、约160mm或更小、约1.37mm或更小、约1.19mm或更小、约1.07mm或更小、约0.84mm或更小、约0.69mm或更小、约0.60mm或更小、约0.51mm或更小、约0.41mm或更小、约0.34mm或更小、约0.31mm或更小或约0.26mm或更小的针)注射。在一些实施方案中,配制注射用的重构溶液于体积为约1ml或更少、约900μl或更少、约800μl或更少、约700μl或更少、约600μl或更少、约500μl或更少、约400μl或更少、约300μl或更少、约200μl或更少或约100或更少。在一些实施方案中,重构溶液包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐。在一些实施方案中,丙戊酸的药学上可接受的盐为丙戊酸钠。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约2.9mg/ml至约3.3mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约3.1mg/ml。在一些实施方案中,在重构溶液中的丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约86mg/ml至约92mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约89mg/ml。在一些实施方案中,在重构溶液中的泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%。在一些实施方案中,泊洛沙姆407的浓度为约16wt%。在一些实施方案中,在重构溶液中的dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%。在一些实施方案中,dmso的浓度为约5wt%。在一些实施方案中,在重构溶液中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。在一些实施方案中,在重构溶液中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1。在一些实施方案中,介于泊洛沙姆407及dmso之间的重量比为约3:1。在一些实施方案中,在重构溶液中介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约2.9mg/ml至约3.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约86mg/ml至约92mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约3.2mg/ml至约3.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约87mg/ml至约90mg/ml;泊洛沙姆407的浓度范围从约14wt%至约16wt%;以及dmso的浓度范围从约4wt%至约5wt%。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度为约3.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约89mg/ml;泊洛沙姆407的浓度为约16wt%;以及dmso的浓度为约5wt%。在一些实施方案中,重构溶液包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐。在一些实施方案中,丙戊酸的药学上可接受的盐为丙戊酸钠。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml、从约1.9mg/ml至约2.3mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度为约2.1mg/ml。在一些实施方案中,在重构溶液中的丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml、从约56mg/ml至约62mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约59mg/ml。在一些实施方案中,在重构溶液中的泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%、从约14wt%至约17wt%。在一些实施方案中,泊洛沙姆407的浓度为约15wt%。在一些实施方案中,在重构溶液中的dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%、从约4wt%至约6wt%。在一些实施方案中,dmso的浓度为约5wt%。在一些实施方案中,在重构溶液中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。在一些实施方案中,在重构溶液中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。在一些实施方案中,介于泊洛沙姆407及dmso之间的重量比为约3:1。在一些实施方案中,在重构溶液中介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约1.9mg/ml至约2.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约56mg/ml至约62mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度为约2.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约59mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。在一些实施方案中,重构溶液包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。在一些实施方案中,丙戊酸的药学上可接受的盐为钠盐(例如,丙戊酸钠)。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约1.2mg/ml至约1.5mg/ml。在一些实施方案中,chir99021或其药学上可接受的盐的浓度范围为约1.4mg/ml。在一些实施方案中,在重构溶液中的丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约36mg/ml至约42mg/ml。在一些实施方案中,丙戊酸或其药学上可接受的盐的浓度为约39mg/ml。在一些实施方案中,在重构溶液中的泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%。在一些实施方案中,泊洛沙姆407的浓度为约15wt%。在一些实施方案中,在重构溶液中的dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%。在一些实施方案中,dmso的浓度为约5wt%。在一些实施方案中,在重构溶液中介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。在一些实施方案中,在重构溶液中介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。在一些实施方案中,在重构溶液中介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度范围从约1.2mg/ml至约1.5mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约36mg/ml至约42mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。在一些实施方案中,在重构溶液中的chir99021或其药学上可接受的盐的浓度为约1.4mg/ml;丙戊酸或其药学上可接受的盐的浓度为约39mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。在一些实施方案中,重构溶液包含,除了活性剂以外,一种或多种的水或缓冲剂;增积剂(例如,纯化的泊洛沙姆407);稳定剂;张力调节剂;以及舒缓剂。在一些实施方案中,重构溶液包含,除了活性剂以外,纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于无(例如,纯化的泊洛沙姆407)的可比拟的重构溶液,重构溶液对氧及/或光具有较高稳定性。在一些实施方案中,可比拟的重构溶液包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,存在于重构溶液中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。在一些实施方案中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。在一些实施方案中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸点为约220℃或更少的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。在一些实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于无纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂(例如,听觉损失治疗剂)量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高。在一些实施方案中,可比拟的重构溶液包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于无纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的重构溶液,重构溶液具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异。在一些实施方案中,可比拟的重构溶液包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于无纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的重构溶液,重构溶液具有较低胶凝温度、较窄胶凝温度范围、更持续释放听觉损失治疗剂及/或较高粘度。在一些实施方案中,可比拟的重构溶液包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,重构溶液具有比有未纯化的泊洛沙姆而非纯化的泊洛沙姆的其他相同组合物的胶凝温度较低的胶凝温度,其中,温度为比有未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)而非本文所述的纯化的泊洛沙姆的其他相同重构溶液的胶凝温度约1℃更低、约2℃更低、约3℃更低、约4℃更低、约5℃更低、约6℃更低、约7℃更低、约8℃更低、约9℃更低、约10℃更低、约11℃更低、约12℃更低或约13℃更低。在其他实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,重构溶液相较于有未纯化的泊洛沙姆而非纯化的泊洛沙姆的其他相同组合物的胶凝温度范围具有较窄胶凝温度范围。凝胶温度范围是制剂从流体转变成凝胶的温度范围。有未纯化的泊洛沙姆的组合物通常在约10℃的范围内从流体转变成凝胶,而有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的其他相同组合物则在约2℃至约3℃的范围内从流体转变成凝胶。在一些实施方案中,重构溶液包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407),且其中,相较于无纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的重构溶液,重构溶液具有降低的降解率。在一些实施方案中,可比拟的重构溶液包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,重构溶液适于注射(例如,鼓室内注射)。在一些实施方案中,重构溶液维持用于制备冻干药物组合物的药物组合物的一种或多种流变性质。在一些实施方案中,相较于从不含有纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的可比拟的冻干药物组合物所制备的重构溶液,重构溶液具有降低的降解率。在一些实施方案中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,重构溶液包含一种或多种的水或缓冲剂;增积剂(例如,纯化的泊洛沙姆407);稳定剂;张力调节剂;以及舒缓剂。其他组份在一些实施方案中,本公开的药物组合物或重构溶液包含水。在一些实施方案中,本公开的药物组合物或重构溶液包含缓冲剂。缓冲控制重构溶液的ph到范围从约4至约13、从约5至约12、从约6至约11、从约6.5至约10.5或从约7至约10。缓冲剂的例子包括,但不限于,柠檬酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、氯化铵、碳酸钙、氯化钙、柠檬酸钙、葡乳醛酸钙、葡庚糖酸钙、葡萄糖酸钙、d-葡萄糖酸、甘油磷酸钙、乳酸钙、乳糖酸钙、丙酸、乙酰丙酸钙、戊酸、磷酸氢钙、磷酸、磷酸三钙、氢氧化磷酸钙、乙酸钾、氯化钾、葡萄糖酸钾、钾混合物、磷酸氢二钾、磷酸二氢钾、磷酸钾混合物、乙酸钠、碳酸氢钠、氯化钠、柠檬酸钠、乳酸钠、磷酸氢二钠、磷酸二氢钠、磷酸钠混合物、胺丁三醇、氨基磺酸盐缓冲剂(例如,hepes)、氢氧化镁、氢氧化铝、藻酸、无热原水、等渗盐水、林格氏溶液、乙醇及/或其组合。润滑剂可以选自下述所组成的非限制性组:硬脂酸镁、硬脂酸钙、硬脂酸、氧化硅、滑石、麦芽、二十二酸甘油酯、氢化植物油、聚乙二醇、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、十二基硫酸镁、十二基硫酸钠及其组合。在一些实施方案中,缓冲剂包括磷酸盐缓冲盐水、tris、三乙酸盐、trishcl-65、柠檬酸钠、组氨酸、精氨酸、磷酸钠、trisbase-65、羟基乙基淀粉或其任何组合。如上所讨论,泊洛沙姆在某些实施方案中可以用作胶凝剂。醛是包含具有结构-cho的官能团的化合物,其由与氧双键连接的碳和也与氢原子键合的碳组成。醛,包括甲醛、乙醛和丙醛,是泊洛沙姆的潜在杂质和降解产物,且例如,当在凝胶中存在泊洛沙姆时可能形成。冻干有益地除去测试组合物中存在的醛。本文所公开的冻干组合物也可比凝胶形式更稳定,例如,就醛量随时间的存在而言。在一些实施方案中,冻干从本公开的组合物中除去醛。在一些实施方案中,例如,由于存在低量的醛,因此在本公开的冻干组合物中不需要防腐剂,诸如抗氧化剂。在冻干药物组合物的一些实施方案中,醛的浓度为少于约1、约2、约3、约4、约5或约10ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约10ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约5ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约4ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约3ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约2ppm(μg/g)。在冻干药物组合物的一些实施方案中,醛的浓度为少于约1ppm(μg/g)。在一些实施方案中,醛为挥发性醛。在一些实施方案中,醛包含其中各个别的分子具有小于300da的分子量的分子。在一些实施方案中,醛包含其中各个别的分子具有小于200da的分子量的分子。在一些实施方案中,醛包含其中各个别的分子具有小于100da的分子量的分子。在一些实施方案中,醛包含甲醛、乙醛及/或丙醛。抗氧化剂的一些例子包括,但不限于,rrr-α-生育酚,d-α生育酚;d-α生育酚乙酸酯;dl-α生育酚乙酸酯;d-α生育酚酸琥珀酸酯;dl-α生育酚酸琥珀酸酯;β-生育酚;δ生育酚;γ生育酚;生育酚赋形剂,抗坏血酸;棕榈酸抗坏血酸酯;异抗坏血酸;抗坏血酸钠;异抗坏血酸钠;丁基化羟基甲苯;丁基化羟基大茴香醚;无水柠檬酸;富马酸;苹果酸;柠檬酸钠;二水合物;酒石酸;柠檬酸一水合物;依地酸;依地酸二钾;依地酸二钠;依地酸钙二钠;依地酸钠;依地酸三钠;五倍子酸丙酯;蛋氨酸;一硫甘油;戊酸;焦亚硫酸钾;亚硫酸氢钾;焦亚硫酸钠;丙酸;丙酸钙;丙酸钠;五倍子酸十二酯;五倍子酸乙酯;五倍子酸辛酯;甲醛次硫酸钠;无水亚硫酸钠;硫代硫酸钠;二氧化硫;维生素e聚乙二醇琥珀酸酯。在一些实施方案中,本公开的药物组合物不包含抗氧化剂。在一些实施方案中,本公开的冻干药物组合物不包含抗氧化剂。在一些实施方案中,本公开的重构冻干药物组合物不包含抗氧化剂。在一些实施方案中,本公开的药物组合物不包含抗氧化剂且具有为少于约1、约2、约3、约4、约5或约10ppm(μg/g)的醛的浓度。在一些实施方案中,本公开的冻干药物组合物不包含抗氧化剂且具有为少于约1、约2、约3、约4、约5或约10ppm(μg/g)的醛的浓度。在一些实施方案中,本公开的重构药物组合物不包含抗氧化剂且具有为少于约1、约2、约3、约4、约5或约10ppm(μg/g)的醛的浓度。在一些实施方案中,本公开的药物组合物或重构溶液包含增积剂。在一些实施方案中,增积剂包含泊洛沙姆(例如,poloxamer407)、甘露醇、蔗糖、麦芽糖、海藻糖、右旋糖、山梨糖醇、葡萄糖、棉子糖、甘氨酸、组氨酸、聚乙烯基吡咯烷酮(例如、聚乙烯基吡咯烷酮k12或聚乙烯基吡咯烷酮k17)、乳糖或其任何组合。在一些实施方案中,泊洛沙姆(例如,泊洛沙姆407)为胶凝剂及/或增积剂。在一些实施方案中,泊洛沙姆(例如,泊洛沙姆407)为胶凝剂及增积剂。一些实施方案中,当组合物包含胶凝剂(诸如泊洛沙姆,例如,泊洛沙姆407)时,组合物不包含额外的增积剂(例如,甘露醇、蔗糖、麦芽糖、海藻糖、右旋糖、山梨糖醇、葡萄糖、棉子糖、甘氨酸、组氨酸、聚乙烯基吡咯烷酮(例如、聚乙烯基吡咯烷酮k12或聚乙烯基吡咯烷酮k17)、乳糖或其任何组合)。增积剂可以积极地增强冻干方法,导致就外观和特性而言改进的干燥/冻干产品。然而,泊洛沙姆407的溶液可以在没有增积剂的情况下冻干以形成大量的多孔饼(例如,见图9),而不是干燥物质的平片(例如,见图10)。当将分子诸如丙戊酸钠(navpa)添加到泊洛沙姆407溶液中时,也观察到相同效果。以这种方式生产的聚合性冻干饼块(例如,见实施例10的步骤7)很好地重构,并保持与预冻干溶液相似的流变性质。在一些实施方案中,本公开的药物组合物除了胶凝剂以外不包含增积剂。在一些实施方案中,本公开的冻干药物组合物除了胶凝剂以外不包含增积剂。在一些实施方案中,本公开的重构冻干药物组合物除了胶凝剂以外不包含增积剂。在一些实施方案中,本公开的药物组合物或重构溶液包含稳定剂。在一些实施方案中,稳定剂包括聚乙二醇、糖、抗坏血酸、乙酰半胱氨酸、亚硫酸氢盐、偏亚硫酸氢盐、一硫甘油、肌醇、油酸或其任意组合。在一些实施方案中,稳定剂包括低温保护剂。在一些实施方案中,低温保护剂是多元醇(例如,二醇或三元醇、诸如丙二醇(即、1,2-丙二醇)、1,3-丙二醇、甘油、(+/-)-2-甲基-2,4-戊二醇、1,6-己二醇、1,2-丁二醇、2,3-丁二醇、乙二醇或二乙二醇)、非洗涤剂磺基甜菜碱(例如,ndsb-201(3-(1-吡啶并))-1-丙烷磺酸酯)、渗透物(osmolyte)(例如l-脯氨酸或三甲基胺n-氧化物二水合物)、聚合物(例如,聚乙二醇200(peg200)、peg400、peg600、peg1000、peg3350、peg4000、peg8000、peg10000、peg20000、聚乙二醇单甲醚550(mpeg550)、mpeg600、mpeg2000、mpeg3350、mpeg4000、mpeg5000、聚乙烯基吡咯烷酮(例如聚乙烯基吡咯烷酮k15)、新戊四醇丙氧化物或聚丙二醇p400)、有机溶剂(例如,二甲亚砜(dmso)或乙醇)、糖(例如d-(+)-蔗糖、d-山梨糖醇、海藻糖、d-(+)-麦芽糖一水合物、中赤藓糖醇、木糖醇、myo-肌醇、d-(+)-棉子糖五水合物、d-(+)-海藻糖二水合物或d-(+)-葡萄糖一水合物)或盐(例如,乙酸锂、氯化锂、甲酸锂、硝酸锂、硫酸锂、乙酸镁、氯化钠、甲酸钠、丙二酸钠、硝酸钠、钠硫酸盐或其任何水合物)或其任何组合。在一些实施方案中,稳定剂包括盐。在一些实施方案中,盐选自由下列组成的组:锂盐(例如,乙酸锂、氯化锂、甲酸锂、硝酸锂、硫酸锂或其任何水合物)、镁盐(例如,乙酸镁或其水合物)和钠盐(例如,氯化钠、甲酸钠、丙二酸钠、硝酸钠、硫酸钠或其任何水合物)。再例如,制剂包含一种或多种钠盐。又例如,制剂包含氯化钠。在一些实施方案中,稳定剂包括表面活性剂。在一些实施方案中,表面活性剂包含一种或多种阴离子表面活性剂(例如2-丙烯酰氨基-2-甲基丙磺酸、十二基硫酸铵、全氟壬酸铵、多库酯(docusate)、椰油酰基二乙酸二钠、十二烷基硫酸镁(magnesiumlaurethsulfate)、全氟丁烷磺酸、全氟壬酸、全氟辛烷磺酸、全氟辛酸、十二基硫酸钾、烷基硫酸钠、十二基硫酸钠、十二基苯磺酸钠、月桂酸钠、十二烷基硫酸钠、月桂酰基肌氨酸钠、肉豆蔻醇聚醚硫酸钠、壬酰氧基苯磺酸钠、烷基聚氧乙稀醚硫酸钠(sodiumparethsulfate)、硬脂酸钠或硫脂)、一个或多个阳离子表面活性剂(例如、氯化山萮基三甲基铵、氯化苄烷铵、氯化苯索宁、溴化苄烷铵、溴尼多斯(bronidox)、carbethopendecinium溴化物、西他氯铵、溴化鲸蜡基三甲基铵(cetrimoniumbromide)、氯化鲸蜡基三甲基铵(cetrimoniumchloride)、十六烷基吡啶鎓氯化物、二癸基二甲基氯化铵、甲基二十八烷基溴化铵、甲基二十八烷基氯化铵、多米芬溴化物(domiphenbromide)、十二基甲基格洛思-10羟基丙基二甲基氯化铵、奥替尼啶(octenidine)二盐酸盐、奥拉氟醚(olaflur)、正油基-1,3-丙二胺、pahutoxin、司拉氯铵(stearalkoniumchloride)、氢氧化四甲基铵或通佐溴铵(thonzoniumbromide))、一种或多种两性离子表面活性剂(例如,椰油酰胺丙基甜菜碱、椰油酰胺丙基羟基磺酸甜菜碱、二棕榈酰卵磷脂、蛋卵磷脂、羟基磺酸甜菜碱、卵磷脂、肉豆蔻氧化物、peptitergents或月桂酰两性基乙酸钠)及/或一种或多种非离子表面活性剂(例如,烷基聚糖苷、cetomacrogol1000、鲸蜡硬脂醇、鲸蜡醇、椰油酰胺dea、椰油酰胺mea、癸基葡萄糖苷、癸基聚葡萄糖、甘油单硬脂酸酯、igepalca-630、isoceteth-20、十二基葡萄糖苷、麦芽糖苷、单月桂酸甘油酯、抗霉枯草菌素(mycosubtilin)、缩小范围的乙氧基化物、nonidetp-40、壬苯醇醚-9、壬苯醇醚、np-40、八乙二醇单十二烷基醚、正辛基β-d-硫代葡萄吡喃糖苷、辛基葡萄糖苷、油醇、peg-10向日葵甘油酯、五乙二醇单十二烷基醚、聚多卡醇(polidocanol)、α-生育酚聚乙二醇琥珀酸酯(tpgs)、泊洛沙姆(例如,泊洛沙姆407)、聚乙氧基化牛脂胺、聚甘油聚蓖麻油酸酯、聚山梨醇酯(例如,聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60或聚山梨醇酯80)、山梨糖醇酐、山梨糖醇酐单月桂酸酯、山梨糖醇酐单硬脂酸酯、山梨糖醇酐三硬脂酸酯、硬脂醇、表面活性素、tritonx-100)。在一些实施方案中,本公开的药物组合物或重构溶液包含张力调节剂。在一些实施方案中,张力调节剂包含nacl、右旋糖、聚葡萄糖、ficoll、明胶、甘露醇、蔗糖、甘氨酸、甘油或其任何组合。在一些实施方案中,本公开的药物组合物或重构溶液包含舒缓剂。在一些实施方案中,舒缓剂包含利多卡因。除了这些组分之外,本公开的药物组合物或重构溶液可包括在药物组合物中有用的任何物质。在一些实施方案中,本公开的药物组合物或重构溶液可包括一种或多种药学上可接受的赋形剂或辅助成分,诸如但不限于,一种或多种溶剂、分散介质、稀释剂、分散助剂、助悬剂、造粒助剂、崩解剂、填充剂、助流剂、液体媒介物、粘合剂、表面活性剂、等渗剂、增稠剂或乳化剂、缓冲剂、润滑剂、油、防腐剂和其他物质。也可以包括例如蜡、黄油、着色剂、涂布剂、调味剂和加香剂的赋形剂。药学上可接受的赋形剂是本领域中已知的(见,例如,remington’sthescienceandpracticeofpharmacy,第21版,a.r.gennaro;lippincott,williams&wilkins,baltimore,md,2006)。稀释剂的例子可包括,但不限于,碳酸钙、碳酸钠、磷酸钙、磷酸二钙、硫酸钙、磷酸氢钙、磷酸钠乳糖、蔗糖、纤维素、微晶纤维素、高岭土、甘露醇、山梨糖醇、肌醇、氯化钠、干淀粉、玉米淀粉、糖粉及/或其组合。造粒剂和分散剂可以选自下述所组成的非限制性列表:马铃薯淀粉、玉米淀粉、木薯淀粉、羟乙酸淀粉钠、粘土、海藻酸、瓜尔胶、柑橘渣、琼脂、膨润土、纤维素和木制品、天然海绵、阳离子交换树脂、碳酸钙、硅酸盐、碳酸钠、交联聚(乙烯基-吡咯烷酮)(交联维酮(crospovidone))、羧甲基淀粉钠(淀粉羟乙酸钠)、羧甲基纤维素、交联的羧甲基纤维素钠(交联羧甲基纤维素(croscarmellose))、甲基纤维素、预糊化淀粉(淀粉1500)、微晶淀粉、水不溶性淀粉、羧甲基纤维素钙、硅酸铝镁十二基硫酸钠、季铵化合物及/或其组合。表面活性剂及/或乳化剂可包括,但不限于,天然乳化剂(例如,阿拉伯树胶、琼脂、藻酸、藻酸钠、西黄蓍胶、软骨泥(chondrux)、胆固醇、黄原胶、果胶、明胶、蛋黄、酪蛋白、羊毛脂、胆固醇、蜡和卵磷脂)、胶体粘土(例如,膨润土[硅酸铝]和[硅酸铝镁])、长链氨基酸衍生物、高分子量醇(例如,硬脂醇、鲸蜡醇、油醇、三乙酰甘油单硬脂酸酯、乙二醇二硬脂酸酯、甘油单硬脂酸酯和丙二醇单硬脂酸酯、聚乙烯基醇)、卡波姆(例如羧基聚亚甲基、聚丙烯酸、丙烯酸聚合物和羧乙烯基聚合物)、角叉菜胶、纤维素衍生物(例如,羧甲基纤维素钠、粉末化纤维素、羟基甲基纤维素、羟基丙基纤维素、羟基丙基甲基纤维素、甲基纤维素)、山梨糖醇酐脂肪酸酯(例如,聚氧乙烯山梨糖醇酐单月桂酸酯聚氧乙烯山梨糖醇酐聚氧乙烯山梨糖醇酐单油酸酯山梨糖醇酐单棕榈酸酯山梨糖醇酐单硬脂酸酯山梨糖醇酐三硬脂酸酯甘油单油酸酯、山梨糖醇酐单油酸酯)、聚氧乙烯酯(例如、聚氧乙烯单硬脂酸酯聚氧乙烯氢化蓖麻油、聚乙氧基化蓖麻油、聚甲醛硬脂酸酯和)、蔗糖脂肪酸酯、聚乙二醇脂肪酸酯(例如,)、聚氧乙烯醚(例如,聚氧乙烯十二基醚)、聚(乙烯基-吡咯烷酮)、二乙二醇单月桂酸酯、三乙醇胺油酸酯、油酸钠、油酸钾、油酸乙酯、油酸、月桂酸乙酯、十二基硫酸钠、68、188、溴化十六烷基三甲铵、鲸蜡基吡啶鎓氯化物、氯化苄烷铵、多库酯钠及/或其组合。粘合剂可以是淀粉(例如,玉米淀粉和淀粉糊);明胶;糖(例如,蔗糖、葡萄糖、右旋糖、糊精、糖蜜、乳糖、乳糖醇、甘露醇);天然和合成胶(例如,阿拉伯树胶、藻酸钠、爱尔兰苔藓萃取物、潘瓦尔胶(panwargum)、茄替胶(ghattigum)、伊萨波尔豆壳的粘液、羧甲基纤维素、甲基纤维素、乙基纤维素、羟基乙基纤维素、羟基丙基纤维素、羟基丙基甲基纤维素、微晶纤维素、乙酸纤维素、聚(乙烯基-吡咯烷酮)、硅酸铝镁和落叶松阿拉伯半乳聚糖(larcharabogalactan));藻酸盐;聚环氧乙烷;聚乙二醇;无机钙盐;硅酸;聚甲基丙烯酸酯;蜡;水;醇;及其组合或任何其他适合的粘合剂。防腐剂的例子可以包括,但不限于,抗氧化剂、螯合剂、抗微生物防腐剂、抗真菌防腐剂、醇防腐剂、酸性防腐剂及/或其他防腐剂。抗氧化剂的例子包括,但不限于,α生育酚、抗坏血酸、抗坏血酸棕榈酸酯、丁基化羟基大茴香醚、丁基化羟基甲苯、单硫甘油、焦亚硫酸氢钾、丙酸、五倍子酸丙酯、抗坏血酸钠、亚硫酸氢钠、焦亚硫酸钠及/或亚硫酸钠。螯合剂的例子包括乙二胺四乙酸(edta)、柠檬酸一水合物、依地酸二钠、依地酸二钾、依地酸、富马酸、苹果酸、磷酸、依地酸钠、酒石酸及/或依地酸三钠。抗微生物防腐剂的例子包括,但不限于,氯化苄烷铵、氯化苯索宁、苄醇、溴硝醇(bronopol)、西曲溴胺(cetrimide)、鲸蜡基吡啶鎓氯化物、氯己定(chlorhexidine)、氯丁醇、氯甲酚、氯二甲酚、甲酚、乙醇、甘油、海克替啶(hexetidine)、咪唑烷基脲(imidurea)、酚、苯氧基乙醇、苯基乙基醇、硝酸苯汞、丙二醇及/或乙汞硫柳酸钠。抗真菌防腐剂的例子包括,但不限于,对羟基苯甲酸丁酯、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、苯甲酸、羟基苯甲酸、苯甲酸钾、山梨酸钾、苯甲酸钠、丙酸钠及/或山梨酸。醇防腐剂的例子包括,但不限于,乙醇、聚乙二醇、苯甲醇、酚、酚系化合物、双酚、氯丁醇、羟基苯甲酸酯及/或苯基乙基醇。酸性防腐剂的例子包括,但不限于,维生素a、维生素c、维生素e、β-胡萝卜素、柠檬酸、乙酸、脱氢抗坏血酸、抗坏血酸、山梨酸及/或植酸。其他防腐剂包括,但不限于,生育酚、乙酸生育酚、甲磺酸去铁胺(deteroximemesylate)、溴化十六基三甲铵、丁基化羟基大茴香醚(bha)、丁基化羟基甲苯(bht)、乙二胺、十二基硫酸钠(sls)、十二基醚硫酸钠(sles)、亚硫酸氢钠、焦亚硫酸氢钠、亚硫酸钾、焦亚硫酸氢钾、glydant对羟苯甲酸甲酯、115、neolonetm、kathontm及/或缓冲剂的例子包括,但不限于,柠檬酸盐缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、氯化铵、碳酸钙、氯化钙、柠檬酸钙、葡乳醛酸钙、葡庚糖酸钙、葡萄糖酸钙、d-葡萄糖酸、甘油磷酸钙、乳酸钙、乳糖酸钙、丙酸、乙酰丙酸钙、戊酸、磷酸氢钙、磷酸、磷酸三钙、氢氧化磷酸钙、乙酸钾、氯化钾、葡萄糖酸钾、钾混合物、磷酸氢二钾、磷酸二氢钾、磷酸钾混合物、乙酸钠、碳酸氢钠、氯化钠、柠檬酸钠、乳酸钠、磷酸氢二钠、磷酸二氢钠、磷酸钠混合物、胺丁三醇、氨基-磺酸缓冲液(例如,hepes)、氢氧化镁、氢氧化铝、藻酸、无热原水、等渗盐水、林格氏溶液、乙基醇及/或其组合。润滑剂可以选自下述所组成的非限制性组:硬脂酸镁、硬脂酸钙、硬脂酸、氧化硅、滑石、麦芽、二十二酸甘油酯、氢化植物油、聚乙二醇、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、十二基硫酸镁、十二基硫酸钠及其组合。油的例子包括,但不限于,杏仁(almond)、杏仁(apricotkernel)、酪梨、巴巴苏、佛手柑、黑当前种子(blackcurrentseed)、琉璃苣、杜松、甘菊、油菜籽、香菜、巴西棕榈、蓖麻、肉桂、可可脂、椰子、鱼肝、咖啡、玉米、棉籽、鸸鹋、案树、月见草、鱼、亚麻籽、香叶草醇、葫芦、葡萄籽、榛子、牛膝草、肉豆蔻酸异丙酯、荷荷巴油、夏威夷核果、熏衣草、熏衣草、柠檬、山胡椒、澳洲坚果(macademianut)、锦葵、芒果种子、菊苣种子、貂皮、肉豆蔻、橄榄、橘子、橘棘鲷鱼(orangeroughy)、棕榈、棕榈仁、桃仁、花生、罂粟籽、南瓜籽、油菜籽、米糠、迷迭香、红花、檀香、山茶(sasquana)、香薄荷(savoury)、沙棘、芝麻、牛油树油脂、聚硅氧、大豆、向日葵、茶树、蓟、椿、香根草、核桃和小麦胚芽油以及硬脂酸丁酯、辛酸甘油三酯、癸酸甘油三酯、环甲聚硅氧烷(cyclomethicone)、癸二酸二乙酯、二甲聚硅氧烷360、聚二甲基硅氧烷(simethicone)、肉豆蔻酸异丙酯、矿物油、辛基十二烷醇、油基醇、硅油及/或。如本文所用,术语“药学上可接受的盐”具有其在本领域中的正常含义。在某些实施方案中,其是指在合理的医学判断范围内适合与受试者的组织接触而没有过度的毒性、刺激性、过敏反应等,并且与合理的益处/风险比相称的那些盐。药学上可接受的盐是本领域众所周知的。例如,berge等人在j.pharmaceuticalsciences(1977)66:1-19中详细描述药学上可接受的盐。本文提供的化合物的药学上可接受的盐包括衍生自适合的无机和有机酸和碱者。药学上可接受、无毒酸加成盐的例子是与无机酸(例如盐酸、氢溴酸、磷酸、硫酸和过氯酸)或有机酸(例如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸)形成的氨基盐或通过使用本领域中所用的其他方法,诸如离子交换。其他药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天门冬氨酸盐、苯磺酸盐(benzenesulfonate)、苯磺酸盐(besylate)、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡萄糖酸盐、十二基硫酸盐、乙烷磺酸盐、甲酸盐、富马酸盐、葡萄糖酸盐(glucoheptonate)、甘油磷酸、葡萄糖酸盐、半硫酸盐(hemisulfate)、庚酸盐、己酸盐、氢碘酸、2-羟基乙烷磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、十二硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲烷磺酸盐、2-萘磺酸盐、烟碱酸盐、硝酸盐、油酸、草酸、棕榈酸盐、双羟萘酸盐(pamoate)、果冻酸盐、过氧硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、特戊酸盐(pivalate)、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸酯盐等。在一些实施方案中,盐可从之衍生的有机酸包括,例如,乙酸、丙酸、羟乙酸、丙酮酸、草酸、乳酸、三氟乙酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、苦杏仁酸、甲烷磺酸、乙烷磺酸、对甲苯磺酸、水杨酸等。盐可以在所公开的化合物的分离和纯化过程中原位制备,或分开地制备,例如通过使母体化合物的游离碱或游离酸分别与适合的碱或酸反应。衍生自适当碱的药学上可接受的盐包括碱金属和碱土金属。代表性碱金属或碱土金属盐包括钠、锂、钾、钙、镁、铁、锌、铜、锰、铝等。当合适时,进一步药学上可接受的盐包括钾、钠、钙和镁盐。“烷基”是指直链或支链的烃链基团,其仅由碳原子和氢原子组成,不包含不饱和度,具有1至10个碳原子(例如,c1-10烷基)。每当其出现于本文,诸如“1至10”的数字范围是指给定范围内的各整数;例如,“1至10个碳原子”是指烷基可以由1个碳原子、2个碳原子、3个碳原子等组成,至多并包括10个碳原子,尽管本定义也涵盖没有指定数值范围的术语“烷基”。在一些实施方案中,“烷基”可以是c1-6烷基。在一些实施方案中,烷基具有1至10、1至8、1至6或1至3个碳原子。代表性的饱和直链烷基包括,但不限于,-甲基、-乙基、-正丙基、-正丁基、-正戊基和-正己基;而饱和的支链烷基包括,但不限于,-异丙基、-仲丁基、-异丁基、-叔丁基、-异戊基、2-甲基丁基、3-甲基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2-甲基己基、3-甲基己基、4-甲基己基、5-甲基己基、2,3-二甲基丁基等。烷基通过单键连接至母体分子。除非说明书中另有说明,否则烷基任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基或卤基。在非限制性实施方案中,经取代的烷基可以选自氟甲基、二氟甲基、三氟甲基、2-氟乙基、3-氟丙基、羟基甲基、2-羟基乙基、3-羟基丙基、苄基和苯乙基。“烯基”是指仅由碳和氢原子组成的直链或支链烃基基团,其含有至少一个双键并且具有2至10个碳原子(即,c2-10烯基)。每当其出现于本文,诸如“2到10”的数值范围是指给定范围内的各整数;例如,“2至10个碳原子”是指烯基可以由2个碳原子、3个碳原子等组成,至多并包括10个碳原子。在某些实施方案中,烯基包含2至8个碳原子。在其他实施方案中,烯基包含2至6个碳原子(例如,c2-6烯基)。烯基通过单键连接至母体分子结构,例如,乙烯基(ethenyl)(即,乙烯基(vinyl)),丙-1-烯基(即,烯丙基),丁-1-烯基,戊-1-烯基,戊-1,4-二烯基等。一个或多个碳-碳双键可以是内部(诸如,在2-丁烯基中)或末端(例如在1-丁烯基中)。c2-4烯基的例子包括乙烯基(c2)、1-丙烯基(c3)、2-丙烯基(c3)、1-丁烯基(c4)、2-丁烯基(c4)、2-甲基丙-2-烯基(c4)、丁二烯基(c4)等等。c2-6烯基的例子包括上述的c2-4烯基以及戊烯基(c5)、戊二烯基(c5)、己烯基(c6)、2,3-二甲基-2-丁烯基(c6)等。烯基的额外例子包括庚烯基(c7)、辛烯基(c8)、辛三烯(c8)等。除非说明书中另有说明,否则烯基可任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基或卤基。“炔基”是指仅由碳和氢原子组成的直链或支链烃基基团,其包含至少1个三键,具有2至10个碳原子(即,c2-10炔基)。每当其出现于本文,例如“2到10”的数值范围是指给定范围内的各整数;例如,“2至10个碳原子”是指炔基可以由2个碳原子、3个碳原子等组成,至多且包括10个碳原子。在某些实施方案中,炔基包含2至8个碳原子。在其他实施方案中,炔基具有2至6个碳原子(例如,c2-6炔基)。炔基通过单键连接至母体分子结构,例如,乙炔基、丙炔基、丁炔基、戊炔基、3-甲基-4-戊烯基、己炔基等。除非说明书中另有说明、否则炔基可以任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基和卤基。“烷氧基”是指基团-o-烷基,包括通过氧与母体分子结构连接的直链、支链、饱和环状构型的1至10个碳原子及其组合。例子包括甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、叔丁氧基、戊氧基、环丙氧基、环己氧基等。“低级烷氧基”是指含有1至6个碳的烷氧基。在一些实施方案中,c1-4烷氧基是涵盖1至4个碳原子的直链和支链烷基的烷氧基。除非说明书中另有说明、否则烷氧基可任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基和卤基。“芳基”是指具有6至14个环原子的基团(例如,c6-14芳族或c6-14芳基),其具有至少一个具有为碳环的共轭π电子系统的环(例如,苯基、芴基和萘基)。在一些实施方案中,芳基是c6-10芳基。例如,由经取代的苯衍生物形成并且在环原子上具有自由价的二价基团被称为经取代的伸苯基基团。在其他实施方案中,通过在相应的单价基团的名称上添加“-亚基(-idene)”来命名通过从有自由价的碳原子上去除一个氢原子而得名以“-基”结尾的单价多环状烃基团所衍生的二价基团,例如,具有二连接点的萘基被称为亚二氢萘基。每当其出现于本文,数值范围诸如“6至14芳基”是指给定范围内的各整数;例如,“6至14个环原子”是指芳基可以由6个环原子、7个环原子等组成,至多并包括14个环原子。术语包括单环状或稠合环多环状(即,共享相邻的环原子对的环)基团。多环状芳基包括双环、三环、四环等。在多环基团中,仅需要一个环为芳族,因此基团诸如茚满基涵盖于芳基定义中。芳基的非限制性例子包括苯基、萉基、萘基、四氢萘基、菲基、蒽基、芴基、吲哚基、茚满基等。除非说明书中另有说明,否则芳基部分可以任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基和卤基。当“芳基”为“甲苯基”时,这术语包括邻甲苯基、间甲苯基和对甲苯基中的任何一个。换句话说,“甲苯基”包括衍生自甲苯的三个异构的单价芳族基团中的任何一个。当“芳基”为“二甲苯基”时,这术语包括式(ch3)2c6h3-的单价基团,其衍生自二甲苯的三种异构体:邻、间和对-(二甲基苯)。“环烷基”和“碳环基”各自是指仅包含碳和氢并且可以是饱和或部分不饱和的单环或多环状基团。如果碳环包含至少一个双键,则部分不饱和的环烷基可被称为“环烯基”,或如果碳环包含至少一个三键,则可被称为“环炔基”。环烷基包括具有3至13个环原子的基团(即,c3-13环烷基)。每当其出现于本文,诸如“3至10”的数值范围是指给定范围内的各整数;例如,“3至13个碳原子”是指环烷基可以由3个碳原子、4个碳原子、5个碳原子等组成,至多且包括13个碳原子。术语“环烷基”还包括不包含杂原子的桥联和螺-稠合的环状结构。术语也包括单环状或稠合环多环状(即,共享相邻的环原子对的环)基团。多环状芳基包括双环、三环、四环等。在一些实施方案中,“环烷基”可以是c3-8环烷基。在一些实施方案中,“环烷基”可以是c3-5环烷基。环烷基的说明性例子包括,但不限于,以下部分:c3-6碳环基包括,但不限于,环丙基(c3)、环丁基(c4)、环戊基(c5)、环戊烯基(c5)、环己基(c6)、环己烯基(c6)、环己二烯基(c6)等。c3-7碳环基的例子包括降冰片基(c7)。c3-8碳环基的例子包括上述的c3-7碳环基以及环庚基(c7)、环庚二烯基(c7)、环庚三烯基(c7)、环辛基(c8)、双环[2.2.1]庚基、双环[2.2.2]辛基等。c3-13碳环基的例子包括上述的c3-8碳环基以及八氢-1h茚基、十氢萘基、螺[4.5]癸基等。除非说明书中另有说明、否则环烷基可任选地被一个或多个取代基取代,取代基独立地包括:烷基、烯基、炔基、烷氧基、环烷基、芳基和卤基。术语“环烯基”和“环炔基”反映对“环烷基”的上述描述,其中前缀“烷”分别被“烯”或“炔”代替,及母体“烯基”或“炔基”术语如本文所述。例如,环烯基可具有3至13个环原子,诸如5至8个环原子。在一些实施方案中,环炔基可具有5至13个环原子。如本文所用,“共价键”或“直接键”是指连接二基团的单键。“卤基”、“卤化物”或者“卤素”是指氟、氯、溴或碘。术语“卤烷基”、“卤烯基”、“卤炔基”和“卤烷氧基”包括经一个或多个卤基团或其组合取代的烷基、烯基、炔基和烷氧基结构。例如,术语“氟烷基”和“氟烷氧基”分别包括其中卤基为氟的卤烷基和卤烷氧基,例如,但不限于,三氟甲基、二氟甲基、2,2,2-三氟乙基、1-氟甲基-2-氟乙基等。烷基、烯基、炔基和烷氧基各者如本文所定义,并且可以任选地如本文所定义进一步被取代。使用方法在某些实施方案中,本公开涉及通过使用本文公开的组合物诱导、促进或增强内耳组织,特别是内耳支持细胞和发细胞的生长、增殖或再生。一些实施方案涉及用于控制干细胞增殖的方法,其包含诱导干性同时抑制分化的初始阶段和随后的干细胞分化成组织细胞的阶段。当根据本公开的方法用发细胞再生剂处理耳蜗支持细胞或前庭支持细胞群时,无论所述体是体内或体外,经处理的支持细胞均呈现出干样行为,其中经处理的支持细胞具有增殖和分化的能力,且更具体地说,分化为耳蜗发细胞或前庭发细胞。在一些情况下,剂诱导并维持支持细胞以产生子代干细胞,所述子代干细胞可以分裂许多代并维持使高比例的所得细胞分化为发细胞的能力。在某些实施方案中,增殖的干细胞表达选自下述的一者或多者的干细胞标记:lgr5、sox2、opeml、phex、lin28、lgr6、周期蛋白d1、msx1、myb、kit、gdnf3、zic3、dppa3、dppa4、dppa5、nanog、esrrb、rex1、dnmt3a、dnmt3b、dnmt3l、utf1、tcl1,℃t4、klf4、pax6、six2、zic1、zic2、otx2、bmi1、cdx2、stat3、smad1、smad2、smad2/3、smad4、smad5及smad7。优选地,增殖的干细胞表达选自lgr5中的一者或多者的干细胞标记。在一些实施方案中,方法可用于在显著的发细胞形成之前维持或甚至暂时增加先前存在的支持细胞群的干性(即,自我更新)。在一些实施方案中,先前存在的支持细胞群包括内支柱细胞、外支柱细胞、内指状细胞、deiter细胞,hensen细胞、boettcher细胞及/或claudius细胞。可以使用代表性显微样品以免疫染色(包括细胞计数)和谱系追踪的形态学分析来确认这些细胞类型中一种或多种的扩增。在一些实施方案中,先前存在的支持细胞包括lgr5+细胞。可使用以免疫染色(包括细胞计数)及qpcr和rna杂交的形态学分析来确认细胞群中lgr5的上调。有利地,本文描述的方法可以在不使用遗传操纵下达到这些目标。许多学术研究中使用的生殖系操纵并不是治疗听觉损失的理想方法。通常,疗法优选地涉及不伴有基因疗法的小分子、肽、抗体或其他非核酸分子或核酸递送载体的施用。在某些实施方案中,疗法涉及小有机分子的施用。在一些情况下,通过使用(非遗传的)治疗剂(被注入中耳并扩散到耳蜗)来达到听觉保护或恢复。耳蜗严重依赖于目前存在的所有细胞类型,而这些细胞的组织对其功能很重要。支持细胞在神经传递质循环和耳蜗力学的扮演重要角色。因此,在柯蒂氏器内维持玫瑰花结图案可能对功能很重要。基底膜的耳蜗力学活化发细胞转导。由于耳蜗力学的高灵敏度,还希望避免细胞团块。总而言之,即使在增殖后,沿基底膜保持发细胞和支持细胞的适当分布和关系,很可能是听觉的理想特征,因为支持细胞功能和适当力学对正常听觉是必须的。在一些实施方案中,使用如本文所公开的组合物处理的听觉损失是感觉神经听觉损失或隐藏的听觉损失。感觉神经性听觉损失约占听觉损失的大约90%,且通常是由于耳蜗中发细胞的损坏或损失而引起。发细胞损坏和损失的原因很多,本文所述的剂和治疗可用于因发细胞损坏或损失的任何原因引起的感觉神经性听觉损失的情况。例如,发细胞可能受到损害,并且噪音暴露可能诱导损失,从而导致噪音诱导的感觉神经性听觉损失。因此,在一些实施方案中,感觉神经性听觉损失是噪音诱导的感觉神经性听觉损失。噪音诱导的感觉神经性听觉损失可能是慢性噪音暴露或急性噪音暴露的结果。耳毒性药物,例如顺铂及其类似物,氨基糖苷类抗生素、水杨酸盐及其类似物或环管利尿剂,也会引起感觉神经性听觉损失。在一些实施方案中,感觉神经性听觉损失是药物诱导的感觉神经性听觉损失。感染可能会损坏耳蜗发细胞,并且可能是突然的感觉神经性听觉损失的原因。在一些实施方案中,感觉神经性听觉损失是突然的感觉神经性听觉损失(ssnhl)。突然的感觉神经性听觉损失也可能是特发性的。作为人衰老过程的一部分,随着时间,发细胞也可能会损失或损坏。在一些实施方案中,感觉神经性听觉损失是与年龄有关的感觉神经性听觉损失(也称为老年失聪)。在一些方面中,本公开提供促进组织及/或细胞的再生的方法,包括递送药物有效量的本公开的药物组合物或重构溶液到组织及/或细胞。在一些方面中,本公开提供治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的方法,包括向受试者施用药物有效量的本公开的药物组合物或重构溶液。在一些方面中,本公开提供增加在前庭组织中的前庭细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供治疗患有前庭病症或有发展前庭病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的药物组合物或重构溶液。在一些方面中,本公开提供增加耳蜗组织中的耳蜗细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的药物组合物或重构溶液。在一些方面中,本公开提供增加柯蒂氏器中发现的细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的发细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的内发细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的外发细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供增加柯蒂氏器中发现的神经元细胞群的方法,包括递送药物有效量的本公开的药物组合物或重构溶液至所述群。在一些方面中,本公开提供治疗患有听觉病症或有发展听觉病症的风险的受试者的方法,包括向受试者施用药物有效量的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于促进产生组织及/或细胞的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加在前庭组织中的前庭细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于治疗患有前庭病症或有发展前庭病症的风险的受试者的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加耳蜗组织中的耳蜗细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加柯蒂氏器中发现的细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加柯蒂氏器中发现的发细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加柯蒂氏器中发现的内发细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加柯蒂氏器中发现的外发细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于增加柯蒂氏器中发现的神经元细胞群的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于治疗患有听觉病症或有发展听觉病症的风险的受试者的本公开的药物组合物或重构溶液。在一些方面中,本公开提供用于制造促进产生组织及/或细胞的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加在前庭组织中的前庭细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造治疗患有前庭病症或有发展前庭病症的风险的受试者的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加耳蜗组织中的耳蜗细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加柯蒂氏器中发现的细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加柯蒂氏器中发现的发细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加柯蒂氏器中发现的内发细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加柯蒂氏器中发现的外发细胞群的药剂的本公开的药物组合物或重构溶液的用途。在一些方面中,本公开提供用于制造增加柯蒂氏器中发现的神经元细胞群的药剂的本公开的药物组合物或重构溶液的用途。本公开的冻干药物组合物或重构溶液的用途,于制造治疗患有听觉病症或有发展听觉病症的风险的受试者的药剂。在一些实施方案中,本公开的药物组合物或重构溶液鼓膜外递送(即,到鼓膜上)。在一些实施方案中,本公开的药物组合物或重构溶液鼓室内递送(即,到中耳)。在一些实施方案中,本公开的药物组合物或重构溶液连续递送。在一些实施方案中,本公开的药物组合物或重构溶液作为单次快速注射递送。在一些实施方案中,注射约约1ml或更少、约900μl或更少、约800μl或更少、约700μl或更少、约600μl或更少、约500μl或更少、约400μl或更少、约300μl或更少、约200μl或更少或约100或更少的药物组合物或重构溶液。在一些实施方案中,本公开的药物组合物或重构溶液在给定剂量中可能以足以递送从约0.0001mg/kg至约10mg/kg、从约0.001mg/kg至约10mg/kg、从约0.005mg/kg至约10mg/kg、从约0.01mg/kg至约10mg/kg、从约0.05mg/kg至约10mg/kg、从约0.1mg/kg至约10mg/kg、从约1mg/kg至约10mg/kg、从约2mg/kg至约10mg/kg、从约5mg/kg至约10mg/kg、从约0.0001mg/kg至约5mg/kg、从约0.001mg/kg至约5mg/kg、从约0.005mg/kg至约5mg/kg、从约0.01mg/kg至约5mg/kg、从约0.05mg/kg至约5mg/kg、从约0.1mg/kg至约5mg/kg、从约1mg/kg至约5mg/kg、从约2mg/kg至约5mg/kg、从约0.0001mg/kg至约2.5mg/kg、从约0.001mg/kg至约2.5mg/kg、从约0.005mg/kg至约2.5mg/kg、从约0.01mg/kg至约2.5mg/kg、从约0.05mg/kg至约2.5mg/kg、从约0.1mg/kg至约2.5mg/kg、从约1mg/kg至约2.5mg/kg、从约2mg/kg至约2.5mg/kg、从约0.0001mg/kg至约1mg/kg、从约0.001mg/kg至约1mg/kg、从约0.005mg/kg至约1mg/kg、从约0.01mg/kg至约1mg/kg、从约0.05mg/kg至约1mg/kg、从约0.1mg/kg至约1mg/kg、从约0.0001mg/kg至约0.25mg/kg、从约0.001mg/kg至约0.25mg/kg、从约0.005mg/kg至约0.25mg/kg、从约0.01mg/kg至约0.25mg/kg、从约0.05mg/kg至约0.25mg/kg或从约0.1mg/kg至约0.25mg/kg的治疗剂及/或预防剂(例如,mrna)的剂量施用,其中1mg/kg(mpk)的剂量提供1mg的治疗剂及/或预防剂/1kg的受试者体重。在一些实施方案中,可施用lnp的治疗剂及/或预防剂(例如,mrna)的约0.001mg/kg至约10mg/kg的剂量。在一些实施方案中,可施用剂量为约0.005mg/kg至约2.5mg/kg的治疗剂及/或预防剂。在一些实施方案中,可施用剂量为约0.1mg/kg至约1mg/kg。在一些实施方案中,可施用剂量为约0.05mg/kg至约0.25mg/kg。可以每天以相同或不同的量一次或多次施用剂量,以获得所需mrna表达及/或治疗、诊断、预防或成像效果的量。所需剂量可以例如每天三次、每天两次、一天一次、隔天一次、每三天一次、每周一次、每两周一次、每三周一次或每四周一次来递送。在一些实施方案中、可以使用多次施用(例如,两次、三次、四次、五次、六次、七次、八次、九次、十次、十一次、十二次、十三次、十四次或更多次施用)来递送所需剂量。在一些实施方案中,可以例如在外科手术之前或之后或在急性疾病、失调或病症的情况下施用单剂。在一些实施方案中,药物组合物或重构溶液的施用导致一种或多种耳用治疗剂(例如,chir99021和丙戊酸钠)的血浆浓度在从10分钟至约3小时、从约20分钟至约2小时或从约30分钟至约1小时的时间范围具有最大血浆浓度。定义诸如“一(a)”、“一(an)”和“所述”的冠词可以表示一或多于一,除非有相反说明或从上下文可以明显看出。如果在给定的产品或过程中存在、使用或与之相关的一、多于一或所有组成员,则在组的一个或多个成员之间包括“或”的要求或描述将被认为是满足,除非有相反说明或从上下文可以明显看出。本公开包括实施方案,其中恰好组的一个成员存在于、使用于给定产品或过程中或与给定产品或过程相关。本公开包括实施方案,其中多于一或所有组成员存在于、使用于给定产品或过程中或与给定产品或过程相关。如本文所用,术语“大约”和“约”,应用于一个或多个关注值,是指类似于规定的参考值的值。在一些实施方案中,术语“大约”或“约”是指落入规定的参考值的任一方向(大于或小于)的25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少,除非有相反说明或从上下文可以明显看出(除了此数字超过可能值的100%)。在一些实施方案中,术语“大约”或“约”是指所述值的+/-10%。在一些实施方案中,当用于在lnp的脂质组分中一定量的给定化合物的上下文中时,“约”可以意指所述值的+/-10%。在如本文中使用,表达“a、b或c中的一个或多个”、“a、b或c中的一个或多个”、“a、b及c中的一个或多个”、“一个或多个a、b及c”、“选自a、b及c所组成的组”、“选自a、b及c”等可以互换使用,并且均指从a、b及/或c所组成的组中的选择,除非另有说明,否则即为一个或多个a、一个或多个b、一个或多个c或其任何组合。如本文所用,术语“增积剂”是指增加药物组合物的体积及/或修饰药物组合物的一种或多种性质(例如,饼的外观、孔隙率、药物稳定性及/或重构时间)。如本文所使用的,术语“包含”旨在是开放的并且允许但不要求包括附加元件或步骤。当在本文中使用术语“包含”时,因此也涵盖和公开术语“基本上由......组成”和“由......组成”。在整个说明书中,组合物被描述为具有、包括或包含特定组分的情况下,预期组合物也基本上由所列举的组分组成或由所列举的组分组成。同样地,在将方法或过程描述为具有,包括或包含特定处理步骤的情况下,这些过程也基本上由所列举的处理步骤组成或由所列举的处理步骤组成。此外,应当理解,只要本发明保持可操作,步骤的顺序或执行某些动作的顺序就无关紧要。而且,可以同时进行两个或更多个步骤或动作。如本文所用,术语“可比拟的药物组合物”是指与被比较的药物组合物(例如,一种或多种耳用治疗剂(例如,本文的听觉损失治疗剂)和胶凝剂,及/或一种或多种耳用治疗剂(例如,听觉损失治疗剂)和胶凝剂的浓度)相比具有可比拟的参数的药物组合物。在一些实施方案中,“可比拟的药物组合物”包含相较于所比较的药物组合物具有较低纯度的泊洛沙姆(例如,泊洛沙姆407)。在一些实施方案中,“可比拟的药物组合物”不包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。在一些实施方案中,“可比拟的药物组合物”包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。如本文所用,术语“可比拟的重构溶液”是指具有与被比较的重构溶液相比具有可比拟的参数的重构溶液(例如,本文的一种或多种耳用治疗剂(例如,听觉损失治疗剂)和胶凝剂及/或一种或多种耳用治疗剂(例如,听觉损失治疗剂)和胶凝剂的浓度)。在一些实施方案中,“可比拟的重构溶液”包含相较于所比较的重构溶液具有较低纯度的泊洛沙姆(例如,泊洛沙姆407)。在一些实施方案中,“可比拟的重构溶液”不包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)。在一些实施方案中,“可比拟的重构溶液”包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)。在一些实施方案中,“可比拟的重构溶液”由包含泊洛沙姆(例如,泊洛沙姆407)的药物组合物制备,其相较于用于制备被比较的重构溶液的药物组合物具有较低纯度。在一些实施方案中,“可比拟的重构溶液”由不包含纯化的泊洛沙姆(例如,纯化的泊洛沙姆407)的药物组合物制备。在一些实施方案中,“可比拟的重构溶液”由包含未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)的药物组合物制备。如本文所用,术语“杂质”是指药物组合物不期望的化合物。在一些实施方案中,杂质选自溶剂、1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛、丙醛、低mw泊洛沙姆和来自chir99021和丙戊酸的降解物。如本文所用,术语“舒缓剂”是指能够减轻因将制剂施用到患者而引起的不适的剂。如本文所用,术语“稳定剂”是指能够维持药物组合物的一种或多种期望性质(例如,降低对因热、光或空气而引起的易降解性)的剂。如本文所用,术语“未纯化的泊洛沙姆”是指未被纯化的泊洛沙姆(例如,通过本文公开的方法)。在一些实施方案中,未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)具有平均分子量为约12kda或更小、约11kda或更小、约10kda或更小、约9kda或更小、约8kda或更小或约7kda或更小。在一些实施方案中,未纯化的泊洛沙姆(例如,未纯化的泊洛沙姆407)未通过任何液液萃取或尺寸排阻色谱法纯化。如本文所用,术语“纯化的泊洛沙姆”在一些实施方案中可以指泊洛沙姆,其为具有分子量为至少7250da的至少85重量%的泊洛沙姆。在一些实施方案中,可以通过以下方法制备纯化的泊洛沙姆:a.fakhari,mcorcoran,aschwarz,thermogellingpropertiesofpurifiedpoloxamer407,heliyon(2017),3(8),e00390。本文阐述如何定义纯化的泊洛沙姆的许多进一步选择,包括在所编号的子句和实施方案中。应理解,本公开提供用于制备本文所述的任何药物组合物和重构溶液的方法。本公开还提供按照实施例中描述的程序制备各种药物组合物和重构溶液的详细方法。应当理解,在整个说明书中,当组合物被描述为具有、包括或包含特定组分时,可以预期组合物也基本上由所列举的组分组成或由所列举的组分组成。同样地,在将方法或过程描述为具有、包括或包含特定处理步骤的情况下,这些过程也基本上由所列举的处理步骤组成或由所列举的处理步骤组成。此外,应当理解,只要本发明保持可操作,步骤的顺序或执行某些动作的顺序就无关紧要。而且,可以同时进行两个或更多个步骤或动作。应当理解,除非另有说明,否则对治疗方法的任何描述均包括使用化合物以提供本文所述的治疗或预防,以及使用化合物以制备用于治疗或防止此病症的药剂。治疗包括对人或非人动物(包括啮齿动物和其他疾病模型)的治疗。如本文所用,术语“无菌”是指被处理及/或处置为不含细菌或其他活微生物的溶液、产品、设备或玻璃器皿。如本文所用,术语“受试者”可与术语“有其需要的受试者”互换,两者均指患有疾病或具有发展疾病的增加风险的受试者。“受试者”包括哺乳动物。哺乳动物可以是例如人或适当的非人哺乳动物,诸如灵长类动物、小鼠、大鼠、狗、猫、牛、马、山羊、骆驼、绵羊或猪。受试者也可以是鸟或禽。在一实施方案中、哺乳动物是人。有其需要的受试者可以是先前已经被诊断或鉴定为患有印记疾病(imprintingdisorder)的受试者。有其需要的受试者也可以是患有(例如正遭受)印记疾病的受试者。或者,有其需要的受试者可以是相对于广大群体具有发展此失调的增加风险的受试者(即,相对于广大群体倾向于发展此失调的受试者)。有其需要的受试者可以患有难治性或抗性印记疾病(即,对治疗无反应或尚未反应的印记疾病)。受试者在治疗开始时可能具有抗性,或者在治疗期间可能变得抗性。在一些实施方案中,有其需要的受试者对所有已知的针对印记疾病的有效疗法接受并失败。在一些实施方案中,有其需要的受试者接受至少一种先前疗法。在一优选的实施方案中,受试者患有印记疾病。如本文所用,术语“灭菌”是指使用例如0.2微米的过滤器确保除去不期望的污染(包括细菌、霉菌和酵母菌以及粒子)的方法。用于液体灭菌的过滤器材料包括但不限于尼龙、聚碳酸酯、乙酸纤维素、聚偏二氟乙烯(pvdf)和聚醚砜(pes)。如本文所用,术语“张力”是指有效渗透性的测量量。在一些实施方案中,张力是指有效渗透压梯度的测量量,如通过由半透性膜分开的两种溶液的水势所定义。如本文所用,术语“张力调节剂”是指能够将药物组合物或溶液的张力改变为期望量的剂。如本文所用,术语“治疗(treating)或(treat)”描述为了对抗疾病、病状或失调的目的对患者的管理和照护,并且包括施用本公开化合物或其药学上可接受的盐、多晶形物或溶剂合物,以减轻疾病、病症或失调的症状或并发症,或消除疾病、病症或失调。术语“治疗”还可包括体外处理细胞或动物模型。应当理解,本公开的化合物或其药学上可接受的盐、多晶形物或溶剂合物可以或也可以用于预防相关疾病、病症或失调,或用于鉴定适合此目的的候选者。如本文所用,术语“预防(preventing)、(prevent)”或“保护免于”描述减轻或消除此疾病、病症或失调的症状或并发症的发作。应当理解,发明所属
技术领域:
中具有通常知识者可以参考一般参考文本来获得对本文所讨论的已知技术或等效技术的详细描述。这些文本包括ausubel等人,currentprotocolsinmolecularbiology,johnwileyandsons,inc.(2005);sambrook等人,molecularcloning,alaboratorymanual(第3版),coldspringharborpress,coldspringharbor,newyork(2000);coligan等人,currentprotocolsinimmunology,johnwiley&sons,n.y.;enna等人,currentprotocolsinpharmacology,johnwiley&sons,n.y.;fingl等人,thepharmacologicalbasisoftherapeutics(1975),remington'spharmaceuticalsciences,mackpublishingco.,easton,pa,第18版(1990)。当然,在制作或使用本公开的一个方面时,也可以参考这些文本。如本文所用,术语“药物组合物”是包含以适于向受试者施用的形式的本公开的耳用治疗剂(例如,听觉损失治疗剂)的制剂。在一实施方案中,药物组合物为散装或单位剂型。单位剂型是多种形式中的任一种,包括例如胶囊、iv袋、片剂、气雾剂吸入器或小瓶上的单个泵。组合物单位剂量中的活性成分(例如,所公开的化合物或其盐、水合物、溶剂合物或异构体的制剂)的量是有效量,并根据所涉及的特定治疗而变化。发明所属
技术领域:
中具有通常知识者将理解,有时有必要根据患者的年龄和状况对剂量进行常规改变。剂量也将取决于施用路径。考虑多种路径,包括口服、肺、直肠、肠胃外、经皮、皮下、静脉内、肌肉内、腹膜内、吸入、颊、舌下、胸膜内、鞘内、鼻内等。用于本公开的化合物的局部或经皮施用的剂型包括粉剂、喷雾剂、软膏、糊剂、乳膏、洗剂、凝胶剂、溶液、贴剂和吸入剂。在一个实施方案中、将活性化合物在无菌条件下与药学上可接受的载剂以及与所需的任何防腐剂、缓冲剂或推进剂混合。如本文所用,术语“药学上可接受”是指在合理的医学判断范围内适合与人和动物组织接触而无过度毒性、刺激、过敏反应或其他问题或并发症,与合理的利益/风险比相称的那些化合物、阴离子、阳离子、材料、组合物、载剂及/或剂型。如本文所用,术语“药学上可接受的赋形剂”是指用于制备通常是安全、无毒且生物学上或其他方面均非所需的药物组合物的赋形剂,并且包括兽医学使用以及人医药使用可接受的赋形剂。如说明书和权利要求中所用的“药学上可接受的赋形剂”包括一种或多于一种的这些赋形剂。应理解,将本公开的药物组合物配制成与其预期的施用路径相容。施用路径的例子包括肠胃外,例如,静脉内、皮内、皮下、口服(例如,吸入)、经皮(局部)和经粘膜施用。用于肠胃外、皮内或皮下应用的溶液或悬浮液可包括以下组分:无菌稀释剂,诸如注射用水、盐水溶液、不挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,诸如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,诸如抗坏血酸或亚硫酸氢钠;螯合剂,诸如乙二胺四乙酸;缓冲剂,诸如乙酸盐、柠檬酸盐或磷酸盐以及调节张力的剂,诸如氯化钠或右旋糖。可用酸或碱,诸如盐酸或氢氧化钠调节ph。肠胃外制剂可以装入玻璃或塑胶制造的安瓿、一次性注射器或多剂量小瓶中。应当理解,本公开的化合物或药物组合物可以以目前用于化学治疗处理的许多已知的方法施用至受试者。例如,可以将本公开的化合物注射到血流或体腔中,或者口服或通过皮肤用贴剂施用。选择的剂量应足以构成有效治疗,但又不能高到引起不可接受的副作用。在治疗期间和治疗之后的合理时期内,应优选地密切监测疾病状况(例如,印记疾病等)和患者健康的状态。如本文所用,术语“治疗有效量”是指用于治疗、改进或预防已鉴定的疾病或病状,或呈现出可检测的治疗或抑制效果的药剂的量。可以通过本领域已知的任何测定方法来检测效果。受试者的确切有效量将取决于受试者的体重、体型和健康;病症的性质和程度;以及选择用于施用的治疗剂或治疗剂组合。对于给定情况的治疗有效量可以通过临床医师的能力和判断范围内的常规实验来确定。在一个优选的方面,待治疗的疾病或病症是印记疾病。应当理解,对于任何化合物,可以首先在例如肿瘤细胞的细胞培养测定中,或者在动物模型中,通常是大鼠、小鼠、兔、狗或猪中,估计治疗有效量。动物模型还可用于确定适当的浓度范围和施用路径。然后可以将此类资讯用于确定在人体内施用的有用剂量和路径。可以通过细胞培养或实验动物中的标准药学程序确定治疗/预防功效和毒性,例如,ed50(对50%的群体治疗有效的剂量)和ld50(对50%的群体致死的剂量)。毒性和治疗效果之间的剂量比是治疗指数,并且可以表示为ld50/ed50之比。具有大治疗指数的药物组合物是优选的。剂量可以在此范围内变化,取决于所采用的剂型、患者的敏感性和施用路径。调整剂量和施用以提供足够量的活性剂或维持所需的效果。可以考虑的因素包括疾病状态的严重性、受试者的总体健康、受试者的年龄、体重和性别、饮食、施用时间和频率、药物组合、反应敏感性和耐受性/对治疗的反应。长效药物组合物可以每3至4天、每周或每两周施用一次,取决于特定制剂的半衰期和清除率。包含本公开的活性化合物的药物组合物可以以通常已知的方式来制造,例如,通过常规的混合、溶解、造粒、糖衣锭制作、粉碎、乳化、囊封、包埋或冻干方法。可以使用一种或多种包含赋形剂及/或助剂的药药学上可接受的载剂以常规方式配制药物组合物,所述赋形剂及/或助剂促进将活性化合物处理成可药用的制剂。当然,适当的制剂取决于选择的施用路径。用于药物组合物和剂的配制和制造的一般指南是可获得的,例如,在remington’sthescienceandpracticeofpharmacy,第21版,a.r.gennaro;lippincott,williams&wilkins,baltimore,md,2006。常规赋形剂和辅助成分可用于任何药物组合物中。在一些实施方案中,本公开的药物组合物或重构溶液经冷藏或冷冻以储存及/或运输(例如,储存在4℃或更低的温度,诸如于约-150℃及约0℃或介于约-80℃至约-20℃的温度(例如,约-5℃、-10℃、-15℃、-20℃、-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-130℃或-150℃)。在一些实施方案中,本公开还涉及增加药物组合物或重构溶液稳定性的方法并且通过储存药物组合物或重构溶液在4℃或更低的温度,诸如介于约-150℃至约0℃或介于约-80℃至约-20℃的温度,例如,约-5℃、-10℃、-15℃、-20℃、-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-130℃或-150℃)。适用于注射用途的药物组合物包括无菌水溶液(在水溶性的情况下)或分散液以及用于即刻制备无菌可注射溶液或分散液的无菌粉末。对于静脉内施用,适合的载剂包括生理盐水、抑菌水、cremophoreltm(basf,parsippany,n.j.)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物必须是无菌的,并且应具有一定程度的流动性,以至于存在易注射能力。其必须在制造和储存条件下稳定,并且必须进行防腐处理对抗微生物(如细菌和真菌)的污染作用。载剂可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其适合的混合物。可以例如通过使用诸如卵磷脂的涂布,在分散液的情况下通过维持所需的粒度以及通过使用表面活性剂来维持适当的流动性。可以通过各种抗菌和抗真菌剂,例如,对羟基苯甲酸酯、氯丁醇、酚、抗坏血酸、乙汞硫柳酸钠等,来达到防止微生物的作用。在许多情况下,优选地在组合物中包括等渗剂,例如糖、多元醇,诸如甘露醇和山梨糖醇以及氯化钠。通过在组合物中包括延迟吸收的剂,例如单硬脂酸铝和明胶,可以带来可注射组合物的延长吸收。无菌可注射溶液可通过将在适当的溶剂中所需量的活性化合物与所需的一种或以上列举的成分的组合合并,然后过滤灭菌来制备。通常,通过将活性化合物并入到无菌媒介物中来制备分散液,所述无菌媒介物包含基本分散介质和来自以上那些列举的所需其他成分。在用于无菌可注射溶液的制备的无菌粉末的情况下,制备方法是真空干燥和冷冻-干燥,产生活性成分加上来自其先前无菌过滤溶液的任何额外所需成分的粉末。口服组合物通常包含惰性稀释剂或可食用的药学上可接受的载剂。其可以装入明胶胶囊中或压成片剂。为了口服治疗施用的目的,可以将活性化合物与赋形剂结合并且以片剂、锭剂或胶囊的形式使用。口服组合物也可以使用流体载剂制备以用作漱口剂,其中将流体载剂中的化合物口服施用并漱口和吐出或吞咽。药学上相容的粘合剂及/或佐剂材料可以作为组合物的一部分包括在内。片剂、丸剂、胶囊、片剂等可包含以下任何成分或类似性质的化合物:粘合剂,诸如微晶纤维素、西黄蓍胶或明胶;赋形剂,诸如淀粉或乳糖,崩解剂,诸如藻酸、primogel或玉米淀粉;润滑剂,诸如硬脂酸镁或sterotes;助流剂,诸如胶体二氧化硅;甜味剂,诸如蔗糖或糖精;或调味剂,诸如薄荷、水杨酸甲酯或橙调味剂。为了通过吸入施用,将化合物以气雾剂喷雾的形式从加压的容器或分配器中递送,所述容器或分配器包含适合的推进剂,例如,诸如二氧化碳的气体或喷雾器。全身施用也可以通过经粘膜或经皮方式。对于经粘膜或经皮施用,在制剂中使用适合于要渗透的屏障的渗透剂。此渗透剂是本领域已知的,并且包括,例如用于经粘膜施用的清洁剂、胆盐和梭链孢酸衍生物。经粘膜施用可通过使用鼻喷雾剂或贴剂、薄膜、用于颊或舌下施用的片剂或栓剂来完成。对于经皮施用,将活性化合物配制成软膏、油膏、乳膏、凝胶、贴剂或微针递送系统,如本领域通常已知的。活性化合物可以与药学上可接受的载剂一起制备,所述载剂将保护化合物免于从体内快速消除,诸如控制释放制剂,包括植入物和微囊递送系统。可以使用生物可降解的生物相容性聚合物,诸如乙烯乙酸乙烯酯、聚酸酐、聚羟乙酸、胶原蛋白、聚原酸酯、聚乳酸羟乙酸和聚乳酸。此制剂的制备方法对发明所属
技术领域:
中具有通常知识者而言是显而易见。材料也可以从alzacorporationandnovapharmaceuticals,inc.商购获得。脂质体悬浮液(包括靶向具有针对病毒抗原的单克隆抗体的受感染细胞的脂质体)也可用作药学上可接受的载剂。这些可以根据发明所属
技术领域:
中具有通常知识者已知的方法来制备,例如,如美国专利第4,522,811号中所述。特别有利的是以剂量单位形式配制口服或肠胃外组合物,以易于施用和剂量均匀。如本文所用,剂量单位形式是指适合作为待治疗受试者的单位剂量的物理上离散的单位;各单元包含预定量的活性化合物,经计算与所需的药学载剂有关联产生所需的治疗效果。本公开内容的剂量单位形式的说明由活性化合物的独特特征和要达到的特定治疗效果主宰,并直接取决于其。在治疗应用中,根据本公开使用的药物组合物的剂量在其他影响所选剂量的因素中根据接受患者的剂、年龄、体重和临床状况以及施用疗法的临床医生或从业者的经验和判断而变化。通常,剂量应足以导致减缓并且优选消退印记疾病的症状,并且也优选地引起印记疾病的完全消退。剂量范围可以从剂量范围可以从约0.01mg/kg/天至约5000mg/kg/天。在优选的方面中,剂量范围可以从约1mg/kg/天至约1000mg/kg/天。在一个方面,剂量将在约0.1mg/天至约50g/天;约0.1mg/天至约25g/天;约0.1mg/天至约10g/天;约0.1mg至约3g/天;或约0.1mg至约1g/天的范围内,以单次、分次或连续剂量(可为患者的体重(kg)、体表面积(m2)和年龄(年)调整剂量)。有效量的药剂是如临床医师或其他合格的观察者所注意的提供客观可识别的改进者。生存和生长的改进指出消退。如本文所用,术语“剂量有效方式”是指在受试者或细胞中产生所需生物效果的活性化合物的量。应当理解,药物组合物可以与施用说明书一起包括在容器、包装或分配器中。应当理解,对于能够进一步形成盐的本公开的化合物,所有这些形式也被认为在要求保护的公开的范围内。如本文所用,术语“药学上可接受的盐”是指本公开化合物的衍生物,其中母体化合物通过制备其酸式盐或碱式盐而被修饰。药学上可接受的盐的例子包括,但不限于,碱性残基(诸如胺)的矿物或有机酸盐、酸性残基(诸如羧酸)的碱或有机盐等。药学上可接受的盐包括例如由无毒的无机酸或有机酸形所成的母体化合物的常规无毒盐或季铵盐。例如,此常规的无毒盐包括,但不限于,衍生自选自2-乙酰氧基苯甲酸、2-羟基乙烷磺酸、乙酸、抗坏血酸、苯磺酸、苯甲酸、碳酸氢盐、碳酸、柠檬酸、依地酸盐、乙烷二磺酸、1,2-乙烷磺酸、富马酸、葡萄庚酸、葡萄糖酸、谷氨酸、羟乙酸、对乙酰氨基苯胂酸(glycollyarsanilic)、己基间苯二酚、海巴明酸(hydrabamic)、氢溴酸、盐酸、氢碘酸、羟基马来酸、羟基萘甲酸、羟乙磺酸、乳酸、乳糖酸、乳酸、十二基磺酸、马来酸、苹果酸、苦杏仁酸、甲烷磺酸、萘磺酸(napsylic)、硝酸、草酸、帕莫酸、泛酸、苯基乙酸、磷酸、聚半乳糖醛酸、丙酸、水杨酸、硬脂酸、亚乙酸(subacetic)、琥珀酸、胺磺酸、对氨基苯磺酸、硫酸、鞣酸、酒石酸、甲苯磺酸及常见的胺酸,例如甘氨酸、丙氨酸、苯基丙氨酸、精氨酸等的无机及有机酸所衍生者。药学上可接受的盐的其他例子包括己酸、环戊烷丙酸、丙酮酸、丙二酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基双环-[2.2.2]-辛-2-烯-1-羧酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、粘康酸等。本公开也涵盖当母体化合物中存在的酸性质子被金属离子(例如碱金属离子、碱土金属离子或铝离子)替代时形成的盐;或与诸如乙醇胺、二乙醇胺、三乙醇胺、胺丁三醇、n-甲基葡萄糖胺等的有机碱的配位。以盐的形式,应理解化合物与盐的阳离子或阴离子的比例可以为1:1或除1:1以外的任何比例,例如3:1、2:1、1:2或1:3。应理解,所有提及的药学上可接受的盐均包括同一盐的本文定义的溶剂加成形式(溶剂合物)或晶体形式(多晶形物)。应理解,本公开的化合物也可以制备成酯,例如,药学上可接受的酯。例如,化合物中的羧酸官能团可以被转化为其相应的酯,例如,甲酯、乙酯或其他酯。同样,化合物中的醇基团可以转化为其相应的酯,例如,乙酸酯、丙酸酯或其他酯。在某些实施方案中,应理解,本公开的化合物可以是本文公开的任何化合物的前药(可以包括酯)。在某些实施方案中,应理解,本公开的化合物也可以与其他化合物一起制备为共晶体。化合物或其药学上可接受的盐经口服、经鼻、经皮、经肺、经吸入、经颊、经舌下、腹膜内、皮下、肌肉内、静脉内、直肠、胸膜内、鞘内和肠胃外施用。在一个实施方案中、化合物经口服施用。发明所属
技术领域:
中具有通常知识者将认知到某些施用路径的优点。根据多种因素选择使用化合物的剂量方案、所述因素包括患者的类型、种族、年龄、体重、性别和医疗状况;待治疗病症的严重程度;施用路径;患者的肾和肝功能;以及所使用的特定化合物或其盐。普通技术的医师或兽医可以容易地确定并处方预防、抵抗或阻止病症进展所需的药物有效量。用于配制和施用所公开的本公开化合物的技术可以在remington:thescienceandpracticeofpharmacy,第19版,mackpublishingco.,easton,pa(1995)中找到。在一个实施方案中,本文所述的化合物及其药学上可接受的盐与药学上可接受的载剂或稀释剂组合用于药物制剂中。适合的药学上可接受的载剂包括惰性固体填充剂或稀释剂和无菌水溶液或有机溶液。化合物将以足以提供本文所述范围内的所需剂量的量存在于此药物组合物中。除非另有说明,否则本文中使用的所有百分比和比率均以重量计。从不同的实施例,本公开的其他特征和优点是显而易见。所提供的实施例说明可用于实践本公开的不同组分和方法。实施例不限制所要求保护的公开。基于本公开,技术人员可以识别和采用有用于实践本公开的其他组分和方法。在给出范围之处,包括端点。再者,应当理解,除非另外指出或从上下文和发明所属
技术领域:
中具有通常知识者的理解中显而易见,否则在本公开的不同实施方案中,表示为范围的值可以假定为所述范围内的任何特定值或子范围,除非上下文另有明确规定,否则至范围的下限的单位的十分之一。本文引用的所有刊物和专利文件都通过引用方式并入本文,就好像各此类刊物或文件均被明确地和单独地指示通过引用方式并入本文。引用刊物和专利文件无意于承认任何相关的现有技术,也不构成对其内容或日期的任何承认。现在已经通过书面描述的方式描述本发明,发明所属
技术领域:
中具有通常知识者将认知到本发明可以在各种实施方案中实践,并且前述描述和下面实施例是出于说明目的而非限制接下来的权利要求。实施例实施例1:制备chir99021、丙戊酸、泊洛沙姆407及dmso的组合物。泊洛沙姆溶液的制备:将17g的泊洛沙姆407缓慢添加到不断搅拌的70ml的冰冷磷酸盐缓冲盐水中。将所得混合物在冰上(或在冷室中)搅拌过夜以溶解泊洛沙姆。加入额外的磷酸盐缓冲盐水直到达到100ml的总体积。在测试物件制剂之前,使用0.2um过滤器过滤所得泊洛沙姆溶液。然后可以将此溶液保存在4℃下。chir99021溶液的制备:将55.6mg的chir99021溶解在dmso中至终体积为1ml。可将所得混合物缓慢加热至约37℃并涡旋以确保chir99021溶解。chir99021、丙戊酸、泊洛沙姆407和dmso的组合物的制备:在约4℃下将87.6mg的丙戊酸添加到0.95ml的所制备的泊洛沙姆407溶液中,且将所得混合物在约350rpm下15分钟以溶解丙戊酸。为了制备1ml的凝胶,将25μl的chir99021溶液和25μl的dmso加入到包含丙戊酸的泊洛沙姆40溶液中。chir99021可以从溶液中出来,并将混合物可以在37℃温育至再溶解chir99021,然后冷却至约4℃以形成可流动的混合物。终浓度:1.39mg/ml的chir99021,87.6mg/ml的vpa,5wt%的dmso和16wt%的泊洛沙姆407。组合物在约37℃形成凝胶。在此实施例中,丙戊酸是指丙戊酸钠。实施例2:用于冷冻干燥的chir99021、丙戊酸钠、泊洛沙姆407和dmso的组合物的制备和稳定性分析。泊洛沙姆407水溶液的制备:向锥形瓶中加入249.0g的冷纯水。用顶置式搅拌器搅拌水,同时在1小时内小增量添加总计51.0g的泊洛沙姆407粉末。然后将包含泊洛沙姆407-水混合物的烧瓶密封,并在0-8℃冷却过夜,以使泊洛沙姆407完全溶解,得到澄清的均匀溶液。chir99021dmso溶液的制备:向20ml容量瓶中加入1.32g的chir99021,然后加入18ml的dmso。将混合物搅拌或轻轻涡旋。然后将混合物温热至约37℃(但不高于37℃)10分钟或直到得到澄清溶液。反复温和涡旋和加热,直到形成澄清黄色溶液。将额外的dmso添加到溶液中以达到20ml的最终体积,并将溶液在烧瓶中轻轻混合以获得澄清黄色溶液。溶液可以储存在0-8℃冰箱直到需要。溶液在使用前必须在37℃加热下解冻直到观察到无混浊或沉淀物,并且可能需要间歇涡旋。泊洛沙姆407、丙戊酸钠、chir99021和dmso溶液的制备:在带有磁力搅拌棒的1升玻璃烧杯中添加291.6g的冷泊洛沙姆407水溶液。然后将包含泊洛沙姆溶液的烧杯放入冰浴中,并将溶液轻轻混合。在连续搅拌的同时,将26.6g的丙戊酸钠粉末以小部分添加到泊洛沙姆水溶液中。搅拌所得混合物直至丙戊酸钠完全溶解。在搅拌下将15ml(16.5克)的chir99021dmso溶液逐滴加到泊洛沙姆/丙戊酸钠溶液中。搅拌所得混合物直至形成澄清黄色溶液。然后通过加入等重量的水(334.7克)稀释溶液。向溶液中喷氮气1分钟,然后使用0.2μmpes膜滤器和ptfe注射器无菌过滤。稳定性分析:在冻干之前,通过hplc分析过滤的溶液的稳定性。将溶液在室温下保持4小时,并且在一段时间段内通过hplc分析溶液的样品。对于chir99021,在4个小时内形成约总共为约4.6%杂质,这表明在溶液的制备和冻干之间的处理时间可能会影响冻干组合物的纯度。再者,溶液中剩余约有100%的丙戊酸钠。实施例3:chir99021、丙戊酸钠、泊洛沙姆407和dmso的组合物的冻干,以及冻干组合物的稳定性分析。用个别剂量填充玻璃小瓶:将无菌玻璃小瓶和无菌塞子的托盘转移到无菌环境中。对于各5ml玻璃小瓶,将2.2克的无菌泊洛沙姆407、丙戊酸钠和chir99021溶液作为个别剂量分配。使用微量移液器或适合的分配器进行分配。然后将塞子无菌地部分插入各小瓶的颈部。泊洛沙姆407、丙戊酸钠、chir99021和dmso溶液的冻干:将填充的玻璃小瓶的托盘放在无菌环境中的冻干器中。将冻干器中的温度缓慢降低至-45℃(以每分钟0.5℃的速率),然后在-45℃下保持3小时。将80毫托的真空施加至冻干器。然后将温度缓慢增加至-30℃(以每分钟0.5℃的速率),然后在80毫托的真空下于-30℃保持15小时。然后将温度缓慢增加至15℃(以每分钟0.5℃的速率)。将温度在80毫托的真空下保持15℃20小时。在循环尾声,将玻璃小瓶在氮气和真空下塞住,然后完全释放真空,同时用氮气回填冻干器。将玻璃瓶从冻干器中移出、加盖、并在无菌环境中压接。包含个别剂量的经配制的饼的5ml玻璃小瓶可以在-20℃下储存直至使用。稳定性分析:在黑暗中于75%相对湿度,5℃、室温或40℃下储存时分析冻干组合物制剂(剂量1)的稳定性。在各个时间点采集样品,如实施例4中所述重构,并通过hplc分析样品。如下表a和b所示,与75%相对湿度下的40℃相比,chir99021在5℃或室温(环境)下的降解速率降低。剩余约100%的丙戊酸钠。表a.在测试条件下剩余chir99021的百分比。时间(小时)40℃/75%相对湿度环境5℃096.97%96.97%96.97%19.597.05%2296.36%4795.28%115.596.82%11893.25%16892.27%96.63%2个月95.18%表b.在相对保留时间的chir99021杂质百分比。时间(小时)40℃/75%相对湿度环境5℃00.04%0.04%0.04%19.50.07%220.58%471.10%115.50.13%1182.40%1682.68%0.06%2个月1.26%测试冻干组合物制剂(剂量1)的长期稳定性。将组合物在室温(环境)中于黑暗中保持两个月,并如以下实施例4中所述重构。相较于t=0的0.04%,在不同的保留时间,分析显示chir99021的降解物。与冻干制剂相比,chir99021在溶液制剂中具有增加的杂质形成速率。实施例4.来自chir99021、丙戊酸钠、泊洛沙姆407和dmso的冻干组合物的注射剂量的配制和稳定性分析。剂量1的配制:将6.4克的dmso添加到包含93.6克的纯水的烧杯中。将混合物搅拌3-5分钟直至均匀。向溶液中喷入氮气1-2分钟,然后使用pes0.2um过滤器和10-ml注射器无菌过滤至干净的容器中。0.85ml的经过滤的溶液加到在5ml小瓶中的冻干组合物(实施例3),并将混合物在2至8℃下保持20分钟,或直至形成澄清溶液。剂量2的配制:将4.6克的泊洛沙姆407加到包含89.5克的纯水的烧杯中。将混合物搅拌,然后在2-8℃保持过夜直至泊洛沙姆407完全溶解以形成澄清溶液。然后将5.9克的dmso加入烧杯中,并将溶液搅拌直至均匀。向溶液中喷入氮气1-2分钟,然后使用pes0.2um过滤器和10-ml注射器无菌过滤至干净的容器中。1.4ml的经过滤的溶液加到在5ml小瓶中的冻干组合物(实施例3),并将混合物在2至8℃下保持20分钟,或直至形成澄清溶液。剂量3的配制:将8.4克的泊洛沙姆407添加到包含85.7克的纯水的烧杯中。将混合物搅拌,然后在2-8℃保持过夜直至泊洛沙姆407完全溶解以形成澄清溶液。然后将5.9克的dmso加入烧杯中,并将溶液搅拌直至均匀。向溶液中喷入氮气1-2分钟,然后使用pes0.2um过滤和10-ml注射器无菌过滤至干净的容器中。2.1ml的经过滤的溶液加到在5ml小瓶中的冻干组合物(实施例3),并将所述混合物在2至8℃下保持20分钟,或直至形成澄清溶液。剂量4的配制:将6.47克的dmso加入到包含92.35克的纯水和1.18克的苯甲醇的烧杯中。将混合物搅拌3-5分钟直至均匀。向溶液中喷入氮气1-2分钟,然后使用聚醚砜(pes)0.2um过滤器过滤器和10-ml注射器无菌过滤至干净的容器中。0.85ml的经过滤的溶液加到在5ml小瓶中的冻干组合物(实施例3),并将混合物在2至8℃下保持20分钟,或直至形成澄清溶液。剂量1-3的代表性组成在下表c中呈现。剂量1的范围是基于三批冻干产品和准备好给药的重构产品的观察量。剂量2和3的范围是基于两批冻干产品和准备好给药的重构产品的观察量。表c稳定性分析:在2至8℃冰箱中储存8小时后,通过目视检查和hplc分析较高浓度的chir99021和vpa(与上述配制的剂量1相似)的稳定性。较高浓度的冻干制剂显示两剂在溶液中有效重构8小时。分析结果显示在下表d中:表d实施例5:制备chir99021、丙戊酸钠、泊洛沙姆407和苯甲醇的组合物泊洛沙姆407水溶液的制备:向锥形瓶中加入81.0g的冷纯水。用顶置式搅拌器搅拌水,同时在1小时内小增量添加总共为19.0g的泊洛沙姆407粉末。然后将包含泊洛沙姆407-水混合物的烧瓶密封,并在0-8℃冷却过夜,以使泊洛沙姆407完全溶解,得到澄清均匀溶液。chir99021dmso溶液的制备:向20ml容量瓶中加入330mg的chir99021,然后加入4ml的dmso。将混合物搅拌或轻轻涡旋。然后将混合物加热到37℃(但不高于37℃)10分钟或直到得到澄清溶液。反复温和涡旋和加热,直到形成澄清黄色溶液。将额外的dmso添加至溶液中以达到5ml的最终体积,并将溶液在烧瓶中轻轻混合以获得澄清黄色溶液。溶液可以储存在0-8℃冰箱直到需要。如果溶液在储存时冷冻,它必须在使用前被解冻(在37℃加热直至观察到无混浊或沉淀物,并可能需要间歇涡旋)。泊洛沙姆407、丙戊酸钠,chir99021和苯甲醇溶液的制备:向带有磁力搅拌棒的烧杯中加入2.91g的冷泊洛沙姆407水溶液。然后将包含泊洛沙姆溶液的烧杯放入冰浴中,并将溶液轻轻混合。在连续搅拌同时,将280mg的丙戊酸钠粉末以小部分添加到泊洛沙姆水溶液。搅拌所得混合物直至丙戊酸钠完全溶解。在搅拌同时将150μl的chir99021dmso溶液逐滴加到(以防止形成大的沉淀聚集物)泊洛沙姆/丙戊酸钠溶液中。搅拌所得混合物直至形成澄清黄色溶液。加入150μl的苯甲醇,并搅拌混合物直至形成均匀溶液。向溶液中喷入氮气1分钟,然后使用0.22μm聚醚砜(pes)膜过滤器和聚四氟乙烯(ptfe)注射器无菌过滤。实施例6:制备用于注射的chir99021、丙戊酸钠、泊洛沙姆407和dmso的组合物(低且等渗组合物)。泊洛沙姆407溶液的制备:将17g的泊洛沙姆407缓慢添加到不断搅拌的83g的冰冷的磷酸盐缓冲盐水中。将所得混合物在冰上(或在冷室中)搅拌过夜以溶解泊洛沙姆。在测试物件制剂之前,使用0.2um过滤器过滤所得泊洛沙姆溶液。然后可以将此溶液储存在4℃下。chir99021dmso溶液的制备:向2ml容量瓶中加入0.112g的chir99021,然后加入1.5ml的dmso。将混合物搅拌或轻轻涡旋。然后将混合物温热至约37℃10分钟或直到得到澄清的溶液。反复温和涡旋和加热,直到形成澄清黄色溶液。将额外的dmso添加至溶液中以达到2ml的最终体积,并将溶液在烧瓶中轻轻混合以获得澄清黄色溶液。溶液可以储存在0-8℃冰箱直到需要。溶液在使用前必须在37℃加热解冻直到观察到无混浊或沉淀物,并且可能需要间歇涡旋。泊洛沙姆407、丙戊酸钠、chir99021和dmso溶液(低)的制备:向具有磁力搅拌棒的100-ml玻璃烧杯中添加14.685g的冷泊洛沙姆407水溶液。然后将包含泊洛沙姆溶液的烧杯放入冰浴中,并将溶液轻轻混合。向其中加入0.6ml的磷酸盐缓冲盐水,并搅拌所得混合物。在连续搅拌的同时,将0.1575g的丙戊酸钠粉末以小部分加入到泊洛沙姆水溶液中。搅拌所得混合物直至丙戊酸钠完全溶解。在搅拌的同时,将50.2ul的dmso逐滴加到泊洛沙姆/丙戊酸钠溶液中。然后,在搅拌下将99.8ul的chir99021dmso溶液逐滴加到泊洛沙姆/丙戊酸钠/dmso溶液中。搅拌所得混合物直至形成澄清黄色溶液。向溶液中喷入氮气1分钟,然后使用0.2μmpes膜滤器和ptfe注射器无菌过滤。组合物在约37℃形成凝胶。泊洛沙姆407、丙戊酸钠、chir99021和dmso溶液(等渗)的制备:向具有磁力搅拌棒的100-ml玻璃烧杯中添加14.685g的冷泊洛沙姆407水溶液。然后将包含泊洛沙姆溶液的烧杯放入冰浴中,并将溶液轻轻混合。向其中加入0.713ml的磷酸盐缓冲盐水,并搅拌所得混合物。在连续搅拌的同时,将0.0395g的丙戊酸钠粉末以小部分添加到泊洛沙姆水溶液中。搅拌所得混合物直至丙戊酸钠完全溶解。在搅拌的同时,将13.2ul的dmso逐滴加到泊洛沙姆/丙戊酸钠溶液中。然后,在搅拌的同时。将24.3ul的chir99021dmso溶液逐滴加泊洛沙姆/丙戊酸钠/dmso溶液中。搅拌所得混合物直至形成澄清黄色溶液。向溶液中喷入氮气1分钟,然后使用0.2μmpes膜滤器和ptfe注射器无菌过滤。组合物在约37℃形成凝胶。实施例7:体内小鼠听觉损失模型检查chir99021和丙戊酸(vpa)对有snhl的小鼠听觉的影响。十周大的cba/caj小鼠使用既定方法失聪,其中小鼠在≥116db暴露于8-16khz倍频程噪音2小时(wang等,2002)。此模型被显示会导致立即且大量的发细胞损失,但也会损坏其他结构,例如侧壁、支持细胞和螺旋神经节,所有这些都可限制可能的听觉恢复的程度(wang等,2002)。噪音听觉后24小时,使用单音脉冲刺激(频率跨越耳蜗的~80%)获得听觉脑干反应(abr),以建立恢复基线。在24小时abr之后对动物给药一次。由于治疗后的阈值高于变频耳声传射(distortionproductoctoacousticemission)(dpoae)检测水平,因此不常规分析变频耳声传射(dpoae)。使用模拟标准临床中耳注射技术的拉动玻璃移液器,通过鼓室内注射将chir99021和vpa局部递送至中耳。传递媒介物是根据以前的工作采用,使用热可逆的泊洛沙姆凝胶将药物传递到中耳中,以扩散到耳蜗中(salt等人,2011;wang等人,2009)。chir99021和vpa的剂量比活性体外浓度高数百倍,以解释先前研究中所述通过圆窗膜药物进入的梯度(plontke等人,2008)。具体地,小鼠施用10μl的包含87.6mg/mlnavpa(527mm)和1.39mg/mlchir99021(大约3mm)的组合物。使用已建立的技术(hirose等人,2014),从7只动物中取样外淋巴,并使用质谱法分析,以确定chir99021和vpa进入耳蜗。在0.5小时内,检测到chir99021为3.5μm±1.5μm,而检测到vpa310.3μm±51.8μm。因此,使用鼓室内注射在耳蜗内达到体外lgr5+细胞测定中活化的浓度。与先前使用此噪音损伤模型的快速hc死亡的报导一致(wang等人,2002),在注射前(损伤后24小时)观察到的总hc数与在5周媒介物注射动物中观察到的没有显著差异(数据未显示,n=6,p=0.11)。这支持先前的研究,证实出生后哺乳动物缺乏自发的发细胞再生(cox等人,2014;bramhall等人,2014)。注射后五周,接受chir99021/vpa的动物相对于5、10、20(p<0.0001)和28.3(p<0.05)khz的媒介物注射动物,显示显著较低的绝对abr阈值(图1)。在经治疗动物中所测试的所有频率中,从损坏后到5周的平均阈值变化显著较大,其中一些证实阈值恢复高达35db(图1)。豚鼠低或等渗测试组合物的研究研究使用重400-600g的色素沉着的nih品系豚鼠。实验是在华盛顿大学机构动物护理和使用委员会批准的方案20180054进行。动物使用遵循美国农业部和国家卫生研究院关于处理和使用实验动物的准则的政策。使用模拟标准临床中耳注射技术的拉动玻璃移液器,通过鼓室内注射向中耳而向动物施用20ml或50ml的测试组合物。所有实验均按照非恢复程序进行。用100mg/kg的硫代巴比妥(thiobutabarbital)钠(inactin,sigma,stlouis,mo)麻醉动物。插入聚乙烯气管套管,并使用机械呼吸机将动物维持在氧气中0.8至1.2%的异氟烷(isoflurane)。通过调节呼吸机潮气量,将潮气末co2量维持在接近5%。监测心率和氧饱和度,并使用热敏电阻控制的加热毯将核心体温保持在38℃。当在最终生理学测试后对组织学分析时,相对于媒介物处理的动物,chir99021+vpa处理的动物的总发细胞(总hc)、内部发细胞(ihc)和外部发细胞(ohc)的数量增加(总hc=376.0±18.5,ihc=245.9±7.9,ohc=130.1±18.8;平均值±se)比对(总hc=259.3±29.0[p<0.01],ihc=188.6±16.5[p<0.01],ohc=75.3±12.4[p<0.05])(图2)。此体内研究显示组合物的组分chir99021和vpa在噪音诱导的听觉损失的小鼠模型中改进听觉阈值并恢复发细胞。实施例8:在动物模型中用包含chir99021、navpa和泊洛沙姆的重构冻干测试组合物治疗导致听觉改进为了确认包含navpa和chir99021的重构冻干组合物展示对听觉损失的治疗,评估测试组合物(实施例9)和navpa+chir99021在动物功效模型中的效果。方法:噪音暴露在120dbspl下,将10周龄的cba/caj小鼠完全清醒地暴露于8-16khz倍频程噪音中两小时。噪音暴露是在工业声学双壁隔声室中进行。两个30×19×13cm回响塑料围栏在顶部敞开,各包含两只分离在不同隔间中的小鼠,隔间的底部悬吊在指数喇叭(seleniumcornetahm4750-slf)下方28cm处。使用定制的labview例行程序以数字方式生成噪音,然后使用tdtrz6结合crown功率放大器来呈现。声级由brüel&type2203声级计实时监控,并通过定制软件进行追踪。abr记录用氯胺酮和赛拉嗪(xylazine)的混合物(80/15mg/kg,ip)麻醉动物,并将其背侧置于具有es-1自由场扬声器(tucker-davistechnologies)的定制头部保持器中,自右耳直接侧面7cm。皮下铂电极(grass)放置在右耳廓后面(参考)、顶点(活性)和背部皮肤下(接地)。使用直肠探针监测温度,并使用基于dc电流的等温垫(fhc)将其保持在38℃附近。使用5db的最小步长以20/s的下降强度呈现持续时间为5ms的单音脉冲(0.5mscos2r/f)500-1000次,直到无法从视觉上识别出abr的波i。然后增加刺激量,直到再次出现反应。记录利用biosig32和tdt硬件。在暴露后24h和5周在5、10、20、28.3和40khz下,由对实验治疗不知情的操作员获得abr阈值。绘制abr,并使用标准误差报告。使用双尾t检验比较组之间和组之中从24h到5周的比较。鼓室内注射在噪音暴露后24小时,在abr测试之后进行鼓室内注射。将治疗组合物维持在低温下,以降低粘度并允许加载注射器和通过移液管注射。将溶解在冷泊洛沙姆407和伊文思蓝(evansblue)中的1ml组合物配额1ml治疗剂配额抽吸到1ml一次性注射器中,所述注射器附有34cm的聚乙烯塑料管。调整管尺寸,使其紧贴玻璃1.5mmod的微毛细管(wpi),在定制的移液器拉针器中将其拉动至细点,并用镊子将其折断至尖端宽度40-60μm。组合件保持在4℃的黑暗中直到使用。在即将使用之前,将拉动的移液器连接到微型定位器上。给小鼠注射氯胺酮/赛拉嗪(80/15mg/kg),并将其腹侧定位在定制的头部保持器中。在手术窥镜下,通过在腹侧无血切口略微扩张右耳廓底部的软骨环,并使用牵开器和镊子露出了耳廓全景。然后使用定位器-管组合件在鼓室膜上打两个孔,其大小刚好足以容纳移液管。第一个孔用作通气孔,并在凸的正前方制作。对于进入孔,移液器对准鼓室膜的后缘,正好位于砧骨的腹侧(松弛部)。将移液管放置在适当的位置,从后背到前腹,按下注射器缓慢填充中耳,直到多余的泊洛沙姆开始从通气孔中出来。然后施加局部利多卡因,并允许小鼠在加热灯下恢复。小鼠在24小时内显示正常活动水平,并且没有中耳感染或手术并发症。组织处理在所有过程尾声时,使用戊巴比妥对小鼠深度麻醉,并用在0.1m磷酸盐缓冲液中的4%多聚甲醛经心灌注。然后将耳蜗取出并置于相同的固定液中24小时,之后将其转移至0.12medta钠中,并储存在4℃下以备后处理。组织学在edta钠中脱钙72小时后,然后取出柯蒂氏器用于组织学分析。耳蜗在阻断溶液(pbs中的0.3%tritonx-100和15%热灭活的驴血清)中通透并阻断1小时,并在阻断溶液中于4℃暴露于经稀释的一级抗体过夜。随后,对柯蒂氏器进行肌凝蛋白viia的免疫测定,以检测发细胞。肌凝蛋白viia的一级抗体(proteusbiosciences,抗-兔子,#25-6790)以1:500的稀释度使用,且alexflour568二级抗体以1:500的稀释度使用。将invitrogen稀释1:500以检测一级抗体。用4,6-二脒基-2-苯基吲哚(dapi;vectorlaboratories)目视细胞核。图5显示具有低浓度的navpa的navpa+chir99021溶液的结果(例如,见实施例6,但是省略泊洛沙姆)。从图5看出,在所有频率下,见到阈值都显著改进。图4显示具等渗浓度的navpa的navpa+chir99021溶液的结果(例如,见实施例6,但省略泊洛沙姆)。从图4看出,在所有频率下,见到阈值显著改进。图3显示重构测试组合物的结果(例如,见实施例10)。从图3看出,在20khz和28.3khz时,见到阈值显著改进。这证实包含navpa、chir99021和泊洛沙姆407的重构冻干组合物在施用navpa和chir99021是可行策略,因为对听觉改进的效果类似于施用navpa和chir99021作为溶液。实施例9:在耳蜗外淋巴中观察到的chir99021和navpa量增加navpa药物动力学(图6)。在有和没有nacl下测试不同浓度的chir99021和navpa,以调节渗透压,以解释navpa对组合物中渗透压的贡献。在将组合物施用于圆窗后三小时,从顶部至基部依次取样耳蜗外淋巴,以测试沿耳蜗长度的navpa的总浓度,其中样品1为极顶部,随后的各样品更接近基部,而第5个样品被视为极基部。第5次之后的所有样品均为脑脊髓液。由图6中的线(4)表示,高渗透压组合物(通过添加nacl)和低navpa(14.4mg/ml)显示少量navpa进入耳蜗,并且navpa仅存在于接近药物施用位置(基部)。由图6中的线(3)表示,具有较高量的navpa(88.6mg/ml)的高渗透压制剂显示navpa增加药物进入,进一步深入耳蜗。增加navpa浓度大约1.5x更高(~130mg/ml)令人惊讶地显示耳蜗内navpa的浓度增加大约10倍,沿耳蜗长度的增加分布(图6中的线(2)和(1))。此实施例中的测试组合物包含~15.5%w/v%的p407(例如,见表34),并且可以按照实施例10的方法制造。chir99021(chir)药物动力学(图7)。在有和没有nacl下测试不同浓度的chir99021和navpa,以调节渗透压,以解释navpa对组合物中的渗透压的贡献。在将组合物施加到圆窗后三小时,从顶部依次取样耳蜗外淋巴以测试沿耳蜗长度的总浓度,其中样品1是极顶部,随后的各样品更靠近基部,并且第5个样品被视为极基部。第5次之后的所有样品均为脑脊髓液。由图7中的线(5)表示,从制剂中完全除去navpa显示低chir99021进入耳蜗。由图7中的线(6)表示,高渗透压制剂(通过添加nacl)和低navpa(14.4mg/ml)同样显示低浓度的chir99021进入耳蜗,其不符合顶部。由图7中的线(4)表示,完全除去navpa并用nacl(24mg/ml)调节渗透压显示低chir99021进入。在图7中的线(3)表示,具有较高量的navpa(88.6mg/ml)的高渗透压制剂显示chir99021的药物进入增加,其也进一步深入耳蜗。增加navpa在组合物中的浓度大约1.5x(~130mg/ml)(图7中的线(1)和(2))显示与具有88.6mg/mlnavpa的组合物(线(3)相比,chir99021相似但稍好的进入。这些数据表明,在一定阈值下(最佳在~130mg/mlnavpa),navpa令人惊讶地促进chir99021进入耳蜗的幅度为4-14倍。此实施例中的测试组合物包含p407在~15.5%w/v%(例如,见表34),并且可以按照实施例10的方法制造。实施例10:用于注射的chir99021、丙戊酸钠、泊洛沙姆407和dmso的组合物的制备和冻干(测试组合物)(gmp)。步骤1:将6453g的注射用水(wfi)添加至20l加套配制容器中。使用加套容器组合件将水温控制在2-4℃之间。将1322g的p407分批添加到冷却水中,同时使用顶置式搅拌器以300rpm搅拌溶液以初步混合(调节速度以确保混合时无起泡)。水中p407的温度保持低温,以确保溶液在实际混合步骤期间自由流动,尽管在此步骤中,温度控制并不紧要。然后,将p407的储备溶液用于混合测试组合物的下一步。步骤2:称量709g的固体丙戊酸钠,并分批加入上述步骤1的p407水溶液中,同时维持溶液温度为2至8℃,并使用顶置式搅拌器连续搅拌溶液。调节混合速度以确保混合时不起泡。通过设定加套容器的温度至15℃达到所需的溶液温度。混合在60分钟内完成。步骤3:称重26.3g的chir99021,并添加到在标记的清洁玻璃容器中的预热(在32-35℃下)407g的dmso中。使用磁力搅拌板和搅拌棒搅拌溶液,并混合最多60分钟,直到获得澄清溶液。同时维持navpa-p407-水溶液的温度在~15-20℃,使用蠕动泵以~10g/min将chir99021-dmso溶液缓慢加入。步骤4:然后通过在2-8℃下添加8917.4g的wfi来稀释在步骤4中获得的澄清溶液,同时将容器中溶液的温度维持在20℃。将经稀释的溶液用氮气喷入1-2分钟。步骤5:在无菌条件下,使用基于聚醚砜(pes)膜的标准2,0.2μm孔径,1000cm2囊状过滤器过滤经稀释的溶液。步骤6:以个别剂量填充玻璃小瓶:将无菌玻璃小瓶和无菌塞子的托盘转移到无菌环境中。对于各5ml玻璃小瓶,将2.2克的无菌泊洛沙姆407、丙戊酸钠和chir99021溶液作为个别剂量分配。使用填充机进行分配。然后将塞子无菌地部分插入各小瓶的颈部。组合物在约37℃形成凝胶。步骤1-6花费约12小时来完成。步骤7:泊洛沙姆407、丙戊酸钠、chir99021和dmso溶液的冻干:将填充玻璃的小瓶的托盘在无菌环境中放入冻干器中。将冻干器中的温度缓慢降低至-45℃(以每分钟0.5℃的速率),然后在-45℃下保持3小时。将80毫托的真空施加至冻干器。然后将温度缓慢增加至-30℃(以每分钟0.5℃的速率),然后在80毫托的真空下于-30℃保持15小时。然后将温度缓慢增加至15℃(以每分钟0.5℃的速率)。将温度在80毫托的真空下保持15℃20小时。在循环尾声时,将玻璃小瓶在氮气和真空下塞住,然后完全释放真空,同时用氮气回填冻干器。将玻璃瓶从冻干器中移出、加盖、并在无菌环境中压接。包含个别剂量的饼测试组合物的5ml玻璃小瓶可以在-20℃下储存直至使用。关于冻干循环的注意事项:为了在步骤6之后形成有用的冻干产物,重要的是使用由干燥过程中使用的适当温度和适当真空压力所组成的适当冻干循环(例如,见步骤7)。在没有适当的冻干循环下,干燥的物质可能会形成平片,例如见图8。图9中可见的平片是通过将“湿”测试组合物(即,步骤6的产品)以液态氮在样品小瓶中冷冻产生。然后通过在400毫托的真空压力下在室温干燥而将样品冻干。使用适合的冻干周期生产的测试组合物,如上面步骤7中所述,产生如图9所示的冻干饼。实施例11:混合顺序在实施例中研究其中添加测试组合物的组分(即,混合)的顺序(见表26)。表26显示在测试组合物的制造中的不同阶段添加chir99021时的结果。对于可接受的组合物中,chir99021储备溶液在dmso中的给定的浓度下制备,因为chir99021的溶解度在除了极性溶剂,诸如dmso以外,在几乎所有的有机溶剂中非常受限。混合顺序的第一步骤是在冰上将预先称重的固体丙戊酸钠添加到储备的p407水溶液中。p407溶液的温度对于将此热可逆聚合物的粘度保持在液体自由流动状态是重要的。获得澄清溶液后,将chir99021-dmso储备溶液缓慢添加到navpa-p407-水溶液。为了避免从溶液中沉淀出chir99021,必须缓慢加入chir99021-dmso。在navpa已溶解以最小化chir99021在溶液中的时间之后,加入chir99021-dmso储备溶液。已建立对于测试组合物,必须在12小时内完成混合,否则chir99021可能开始从溶液中沉淀出来。在溶液中延长时间段之后,chir99021也开始降解。实施例12:制备重构流体/稀释剂水和dmso稀释剂的制备:步骤1:向15l加套的容器中添加注射用水(wfi)(9547g)。在单独的1l容器中称重dmso(653g)。在环境温度(~20℃)下,在4-6分钟内将dmso缓慢添加到容器中的wfi中。使用磁力搅拌板和搅拌棒将溶液连续混合15-20分钟,同时避免溶液起泡或飞溅。向澄清溶液中喷入氮气8-10分钟。步骤2:然后在无菌条件下,使用基于pes膜的标准2,0.2μm孔径,1000cm2囊状过滤器对喷气的溶液无菌过滤。步骤3:将经过滤的溶液无菌地填充到3-ml无菌玻璃小瓶中,使用无菌的teflon面橡胶塞塞住,并用铝密封件压接密封以获得无菌稀释剂。稀释剂可用于以下重构程序。冻干测试组合物(chir99021、navpa和泊洛沙姆):稀释剂1,0.85ml+冻干饼。使用注射器,将0.85ml加到测试组合物的冻干饼中,并在冰箱或冰浴(2-8℃)中静置20分钟或直到形成澄清溶液。将饼放在冰箱(或冰浴)中时,可能需要轻敲容器的外部以帮助饼溶解在稀释剂中。为避免组合物降解,最小化搅拌及/或涡旋。安慰剂组合物:稀释剂1,0.95ml+安慰剂饼:使用注射器,将稀释剂添加到安慰剂饼中,并在冰箱或冰浴(2-8℃)中静置60分钟,或直到形成澄清溶液。将饼放在冰箱(或冰浴)中时,可能需要轻敲容器的外部以帮助饼溶解在稀释剂中。为避免组合物降解,最小化搅拌及/或涡旋。实施例13:非冻干组合物的稳定性对比冻干组合物的稳定性当在冷藏条件(2-8℃)下储存时,“湿”测试组合物(即,非冻干-见实施例10,步骤1-6)具有差的稳定性。相反地,已经测试冻干组合物(见实施例10,步骤1-7)的稳定性在冷藏条件下6个月和在-20℃下储存2年,并保持稳定。(注意:“湿”测试组合物将在-20℃冻结,这会对测试组合物产生负面影响,因此未研究冻结组合物的稳定性)。未冻干测试组合物的稳定性(使用新鲜混合的溶液,批次nbk29-75)将测试组合物新鲜混合(见实施例10的步骤1-6),储存在冰箱中,并以0、5、24、48、54、120小时的时间间隔测试navpa和chir99021的含量和外观。结果请见图10和11。从图10和11可以看出,chir99021的测定量从初始量开始随时间下降,而navpa的测定量在这段时间内保持恒定。测试组合物的溶液在24至48小时之间的某时发展出沉淀并且溶液变得浑浊,然后在冷藏条件下溶液储存120小时后发展出沉淀。因此,“湿”测试组合物chir99021和navpa在储存期间不稳定。重构组合物的稳定性数据将冻干测试组合物在冰箱中用0.85ml的稀释剂重构大约30分钟。重构溶液储存在冰箱中,并在0、1、2、6、8和24小时的时间间隔测试navpa和chir99021的药物含量和外观。重构测试组合物中的navpa和chir99021测定量储存在聚丙烯注射器中,并冷藏保持稳定,初始量保持6小时,如图12所示。在8至24小时之间某时,chir99021的测定量从初始量降低37%,而navpa的测定量在这段时间内保持恒定。冻干测试组合物(见实施例10,步骤1-7)的稳定性数据。研究冻干测试组合物的储存稳定性。将冻干组合物在具有橡胶封口和压接密封的玻璃容器中在冷藏下储存6个月并且在-20℃下储存24个月。在下表27中指出的各时间间隔,测试冻干测试组合物的药物含量。可以看到,冻干测试组合物在冷藏下保持稳定至少6个月(无分解迹象),在-20℃保持稳定24个月,如下所示。表27:gmp批次b17030018的冻干组合物稳定性数据。时间点(月)储存条件测定navpa测定chir990210释放100%103%1冷藏100%105%2冷藏100%105%3冷藏100%104%6冷藏99%102%1-20101%107%2-20100%107%3-20100%104%6-20100%103%9-2099%102%12-2099%99%18-20101%100%24-2098%100%实施例14:缩短的冻干泊洛沙姆的重构时间。根据实施例2和3制备冻干测试组合物。根据实施例2和3制备冻干p407;然而,省略添加navpa和chir99021的步骤。粉末p407(即,未冻干)可以从basf获得。a):比较:冻干测试组合物的重构时间对比冻干泊洛沙姆的重构时间对比非冻干泊洛沙姆粉末的溶解时间。使用小瓶中的850μl稀释剂(见上述例如,稀释剂制备)对冻干p407(安慰剂)和粉末p407进行重构。样品具有有效浓度为16.1%p407和5.4%dmso。表e显示使用850μl的稀释剂的重构时间(或在粉末p407的情况下的溶解时间)。表ep407添加作为使用850μl稀释剂的重构时间冻干测试组合物(实施例2及3)20分钟冻干p4071小时粉末p4071小时冻干测试组合物在添加稀释剂的20分钟内重构。发现冻干p407的重构时间或p407粉末在等量的稀释剂中的溶解时间为1小时。不希望受任何特定理论的束缚,据信有机酸的盐减少冻干泊洛沙姆的重构时间。细节b):有机酸盐(如丙戊酸钠)和其他盐类对冻干泊洛沙姆的重构时间的影响。测试组合物具有16.15%w/v的泊洛沙姆(p407)浓度和533.25mm的丙戊酸钠浓度。因此,为了探查除丙戊酸钠以外的盐对重构时间的影响,冻干单独的16.15%浓度的泊洛沙姆溶液或包括533.25mm浓度的盐(例如,无机盐或有机酸盐)的泊洛沙姆溶液。然后使用重构稀释剂(6.4%dmso(wt.%)在水)或以水,重构冻干材料。结果显示在表28中。表28由于添加有机酸盐诸如丙戊酸钠、二丙戊酸镁(丙戊酸镁)、2-(丙-2-炔-1-基)辛酸钠(也称为(例如2-己基-4-戊炔酸的钠盐),大幅改进冻干泊洛沙姆的重构时间,且发现为4-20分钟。可以看出,诸如丙戊酸钠(navpa)、二丙戊酸镁和2-(丙-2-炔-1-基)辛酸钠的有机酸盐对改进冻干泊洛沙姆的重构时间影响最大。冻干泊洛沙姆的重构速率的顺序大致为:(泊洛沙姆+有机酸盐)>单独泊洛沙姆>(泊洛沙姆+无机酸盐)的顺序。实施例15a:泊洛沙姆407(p407)的纯化泊洛沙姆407的纯化是指除去残留的较小的聚合物链,诸如单体和二聚体,从而提供更一致的胶凝特性。根据公开的程序纯化p407:a.fakhari,mcorcoran,aschwarz,thermogellingpropertiesofpurifiedpoloxamer407,heliyon(2017),3(8),e00390。除非另有说明,否则未纯化的p407意指尚未进行纯化方法。相反地,纯化意指已经进行某种形式的纯化方法。在大多数情况下,未纯化的p407是直接从供应商处获得的材料,且无需任何进一步操作即可使用。使用两种hplc方法表征泊洛沙姆407:rplc-cad(具有电晕充电气雾剂检测器的反相液体色谱法)和sec-cad(具有相同电晕cad检测器的尺寸排阻色谱法)。泊洛沙姆407没有发色团,且因此传统的紫外线(uv)检测器无法检测到。cad检测器是质量敏感检测器,其工作方式类似于质谱仪检测器。尺寸排阻色谱法(sec)尺寸排阻色谱法(sec)用于通过基于分子大小(流体力学半径)分离组分,然后用cad检测来表征泊洛沙姆407。藉此,大分子先于小分子洗脱。p407可能包含残留的嵌段和二嵌段聚合物杂质,这些杂质通过此方法分离和检测。表29详细介绍用于泊洛沙姆407表征的sec方法。用此方法测定的峰面积百分比代表质量百分比。所有测试的泊洛沙姆407批次均显示双峰分布,具有所需mw峰(三嵌段共聚物)和低mw峰(认为是peo嵌段和peo-ppo二嵌段杂质),如图13-15所示。一些批次的p407也显示hmw肩峰在主峰之前洗脱。两种hplc方法的分析条件如下。表29:用于p407表征的sec-cad方法在一批泊洛沙姆407中,既有较高的(hmw)杂质,也有较低的分子量(lmw)杂质(见图13-15)。分析显示,在一批p407中,lmw杂质多于hmw杂质(见图13-15)。使用1,450da至35,000da范围内的聚乙二醇标准品生成六点分子量校准曲线-见图16。peg标准品为聚乙二醇easivials(2ml),agilent,部件号pl2070-0201。hmw馏份对应于相对于peg标准品为分子量>17,350da。所需mw馏份对应于相对于peg标准品为7,250和17,350da之间洗脱的组分。lmw馏份对应于相对于peg标准品为分子量<7,250da。下表总结泊洛沙姆407批次的sec-cad分析(峰面积%代表质量百分比)。所采用的纯化过程显示去除hmw杂质并减少lmw杂质的量,这导致经纯化批次中所需mw类的百分比更高。表30:纯化的泊洛沙姆和商购产品中杂质的比较。相对于peg校准标准品,对于经纯化和未纯化的p407批次,计算mp(峰分子量)、mn(数量平均分子量)、mw(重量平均分子量)和pdi(多分散性指数,pd=mw/mn)。批次013-180是通过液液萃取技术纯化的泊洛沙姆。表xba:未经纯化和纯化的p407的mn、mw和pdi*相对于peg标准品的分子量表xbb:未经纯化和纯化的p407的mp*相对于peg标准品的分子量未经纯化和纯化的泊洛沙姆407的累积分子量分布如图17所示。纯化导致减少lmw杂质。可以看出,纯化的泊洛沙姆407具有约10%更少的lmw杂质(质量计)。反相hplc(rp-hplc)反相hplc(rp-hplc)用于表征泊洛沙姆407(p407)纯度,通过基于疏水性分离组分,然后用电晕带电气雾剂检测器(cad)检测。下表中详述的rp-hplc方法用于表征p407的疏水特性,包括低分子量(lmw)杂质。表31:用于p407表征的rp-hplc-cad方法见图18关于rp-hplc产生的色谱图。杂质在色谱图中分“区域”(图19)。基于在方法开发过程中获得的实验结果,假设区域1和2对应于lmw嵌段peo,区域3和4对应于二嵌段peo-ppo,及区域5对应于所需三嵌段peo-ppo-peo。峰面积百分比用作批次间比较或监测纯化的相对基准。预期较早的洗脱区域更亲水,而预期较后洗脱区域更疏水。另外,较低分子量聚合物将比相同组成的较高分子量聚合物具有更短的滞留时间。下表显示几批次的泊洛沙姆407的峰面积百分比。批次013-180是通过液液萃取技术纯化的泊洛沙姆,而表中列出的所有其他批次都未经修饰,并如从供应商处接收已经分析。表32:不同批次的泊洛沙姆407的按区域的rp-hplc峰面积百分比可以看出,p407的纯化对于去除lmw杂质是有效的。实施例15b:泊洛沙姆407(p407)纯化分析产生并分析三个批次纯化的泊洛沙姆407。按照相同的液液萃取方法(a.fakhari,mcorcoran,aschwarz,thermogellingpropertiesofpurifiedpoloxamer407,heliyon(2017),3(8),e00390)纯化批次。通过sec分析批次(如上所述)。这三个批次是:批次013-180(来自basf批次gna17521c);批次nbk29-81(来自basf批次gna17822c);和批次nbk29-81a(来自basf批次gna17822c)。表sec泊洛沙姆407批次的sec表征峰面积百分比(预期近似等于质量百分比)。相对于peo标准品的分子量。纯化导致整个聚合物分布的mn和mw增加,且pdi总体降低。纯化后,所需mw馏分改变约10重量%。lmw馏分显示mp、mn、mw略有增加,而pdi降低,表明在较低分子量馏分内,较小的分子被优先去除。表g(如下)显示整个p407聚合物、所需mw馏分和lmwlwm馏分的mn、mw、mp和pdi。实施例16a:纯化的和未纯化的p407的流变学。分析泊洛沙姆407溶液的流变学。表33:用纯化的泊洛沙姆407和未纯化的泊洛沙姆407制得的17%(w/w)水性原液的流变学。使用malvernmodelknx2110的kinexuslab+流变仪进行流变学。sn#mal1147460。kinexus是一种旋转流变仪系统,可对受测样品施加受控的剪切变形,以测量流动特性(诸如,流动测试中的剪切粘度)和动态材料性质(诸如,振荡测试中的粘弹性模量和相角)。为了确定溶胶/凝胶转变温度,以振荡模式运行仪器,并在5-45℃的范围内以0.75hz的频率和3℃/min的加热速率进行温度扫描。用于表征溶胶/凝胶转变的参数是弹性模量g'和粘性模量g”。溶胶/凝胶转变(或胶凝温度)被视为g'和g”曲线的交点。溶胶到凝胶的转变温度和复合物粘度的测量是使用粗化的主轴板(spindle-plate)几何形状(半径40mm)、640ul样品体积和20s-1剪切速率进行。使用malvernmodelknx2110的kinexuslab+流变仪,通过粗化的主轴板几何形状(半径为40mm)、640ul样品体积和20s-1剪切速率测量粘度。sn#mal1147460。使用malvernmodelknx2110的kinexuslab+流变仪测量粘度。sn#mal1147460。尽管可以看出,与未纯化的泊洛沙姆溶液相比,纯化的泊洛沙姆407溶液具有相似的胶凝温度,但是与未纯化的泊洛沙姆溶液相比,纯化的泊洛沙姆具有较高的粘度。在组合物中使用纯化的泊洛沙姆407的效果表34:具有纯化的和未纯化的p407的组合物的流变学使用malvernmodelknx2110的kinexuslab+流变仪进行流变学。sn#mal1147460,如上所述。用未纯化的p407制造的测试组合物可以容纳~80mg/ml的navpa,同时维持适合使用的特性。从这个意义上,组合物必须能够形成粘稠的凝胶组合物,其中粘稠意指当加热到37℃(体温)时形成不动凝胶,因此可以通过注射入耳内施用。向p407溶液中添加组分,诸如盐及/或活性物质,会影响胶凝温度和粘度,从而影响组合物是否仍适合使用。令人惊讶地,可以看出用纯化的p407制造的测试组合物可以适应navpa量的大幅增加(83对比133mg/ml),同时仍然适合使用。chir99021的量也可以调整,例如,3.1对比5.1mg/ml。然而,navpa或等效物的量可以独立于任何其他活性物质的量而变化,例如,在chir99021这种情况下。不希望受任何特定理论的束缚,包含纯化的泊洛沙姆的组合物增加总粘度并降低胶凝温度,因为已经减少与lmw杂质的不利相互作用。的确,在此实施例中,可以看出用纯化的泊洛沙姆407制造的组合物赋予改进的凝胶粘度。与包含未纯化的泊洛沙姆的其他相同组合物相比,这允许更高的药物酬载。对于药物组分(诸如丙戊酸钠)而言尤其如此,它本质上是离子性,并限制泊洛沙姆以较高的量形成具有足够粘度的凝胶的能力(足够粘度是指加热至体温为37℃时形成不动凝胶)。与未纯化的泊洛沙姆制造的其他相同测试组合物相比,由纯化的泊洛沙姆制造的冻干组合物在相似的时间内重构。实施例16b:具有未纯化的p407对比纯化的p407的组合物中的navpa浓度如实施例16a中所讨论,由未纯化的p407制造的测试组合物不能容纳高浓度的navpa(例如,大于90mg/ml)并且不能维持适合的胶凝温度(例如,37℃)。以下数据例示这一观察。当在本公开的组合物中使用泊洛沙姆作为胶凝剂时,可以容纳的navpa的最大浓度被限制在约90mg/ml,同时维持适合的胶凝温度。当navpa的浓度大于~90mg/ml时,所得组合物的胶凝特性受到损害。据此,组合物在所需温度下不会胶凝。例如,在37℃下,包含130mg/mlnavpa和2.2mg/mlchir99021在16.15%未纯化的泊洛沙姆407和5%dmso的组合物(样品008-39a)没有形成凝胶。还应当理解,胶凝温度也与粘度有关。相反地,包含133.7mg/mlnavpa和5.39mg/mlchir99021在15.6%w/v纯化的泊洛沙姆407和4.9%w/vdmso的组合物(样品nbk29-80-2a)在37℃(体温)形成凝胶。因此,包含纯化的泊洛沙姆407的组合物可将navpa的浓度增加至约138mg/ml,同时在可接受的温度(例如,体温)下仍形成凝胶。因此可以看出,将泊洛沙姆从未纯化的泊洛沙姆改变为纯化的泊洛沙姆导致能够在组合物中容纳增加量的navpa的效果。实施例17:进一步冻干组合物及其重构基于实施例14至16的结果,制造进一步冻干组合物,并对其重构时间评估。表28的测试组合物包含在下表中比较(项目1)。根据实施例10制备进一步冻干组合物,并根据实施例12重构。表35:进一步测试组合物和重构时间。表35中的组合物花费可比拟的时间(~12小时)达到冻干前阶段(见步骤1-6,实施例10)。上文例示的组合物通常包含纯化的泊洛沙姆407,其使~130mg/ml的navpa的增加浓度。当使用未纯化的泊洛沙姆407时,不能制造有130mg/ml浓度的navpa的组合物,因为不能维持所需胶凝特性。因此,测试组合物(例如,实施例10)具有83mg/ml的navpa浓度。再者,且与纯化的泊洛沙姆/navpa效果无关,组合物可以两种不同浓度的耳用治疗剂为特色,例如,当组合物包含chir99021时,浓度可以为3.1mg/ml或约一个半剂量大,5.1mg/ml。表35中的项目2-5例示1.5x剂量。表35中的项目6例示1x剂量。使用本公开的冻干方法冻干的项目2-6(测试组合物a-e)充分冻干以提供多孔和蓬松的产品饼。图20展示冻干测试组合物a(项目2,表35))。图21展示冻干测试组合物b(项目3,表35)。图22展示冻干测试组合物c(项目4,表35)。图23展示冻干测试组合物d(项目5,表35)。图24展示冻干测试组合物e(项目6,表35)。图25显示来自表35的重构组合物a(a1)、b(b-1)、c(c-1)、d(f-1)、e(g-1)。如从表35中可见,项目2-5在约20分钟或更短内重构,从而证实包含泊洛沙姆和丙戊酸或其药学上可接受的盐的冻干组合物的一般方法展示改进重构时间。再者,从表28和35中可以看出,丙戊酸组分可以被取代(例如2-(丙-2-炔-1-基)辛酸钠),并且仍然观察到改进重构时间的效果。确实,表35的项目6显示包含亚麻油酸或其药学上可接受的盐的冻干组合物展示改进重构时间。基于来自此实施例和实施例14-16的数据,以下假设组合物落入本公开内。(上面已经例示这些同伴的一些。)将进一步理解,可以用chir99021、ly2090314、gsk3xxii或化合物i-7中的任何一者;以及navpa、2-(丙-2-炔-1-基)辛酸钠或亚麻油酸的钠盐的任何一种;用经纯化或未纯化的泊洛沙姆407来制造组合物。实施例18:冻干组合物百分比本公开的一些冻干组合物可以具有大约以下百分比的组分。例如,表35的项目1中提及的测试组合物可以具有约165.24mg泊洛沙姆407(约64.25%)、约88.63mgnavpa(约34.5%)和约3.3mgchir99021(约1.25%)。例如,表35的项目2中提及的组合物可具有约174.96mg纯化的泊洛沙姆407(约53%)、约150mgnavpa(约45.25%)和约6.05mgchir99021(约1.75%)。应了解这些值可变化约10%,并且冻干组合物基本上不含水及/或dmso。实施例19:测定测试组合物和安慰剂中的低分子量醛。样品制备将样品稀释,用spe处理(固相萃取)以分离醛,用dnph(2,4-二硝基苯基肼)衍生,并使用hplc-uv定量。样品重构和稀释将冻干组合物样品用0.85ml稀释剂1(6.4%w/wdmso在h2o)在4℃下重构至少30分钟。安慰剂冻干样品在4℃下用0.95ml稀释剂1(6.4%w/wdmso在h2o)重构至少1小时。重构完成后,将0.75g的样品称量到7ml玻璃闪烁小瓶中。将1.5ml的稀释缓冲液添加至样品中,并将所得溶液涡旋直至完全溶解。此溶液的总体积大约为2.25ml。测试稀释剂1(6.4%w/wdmso在h2o)的醛含量,无需进一步稀释。泊洛沙姆407样品的制备将泊洛沙姆407通过将300mg的泊洛沙姆407溶解在4.7mldih2o中以产生大约5.0ml的总溶液体积来制备为60mg/ml溶液。搅拌溶液直至完全溶解,并在制备的8小时内分析。固相萃取在衍生化之前,使用固相萃取(spe)从样品基质中分离醛。使用c18spe匣(agilentbondelut12102028,500mg床,3ml)保留泊洛沙姆407基质组分,同时洗脱醛。将spe匣连接到12位置真空歧管(agilent,5982-9110),并将流量调节为大约1至2ml/min。spe匣用meoh(fisher,hplc等级)调节,用acn(honeywell,无羰基)洗涤,并用稀释缓冲液(90%10mm乙酸盐缓冲液,10%acn)平衡,如表36所示。从匣中移除过量溶剂,并将4ml的琥珀色小瓶置于各匣下。将第6.4.1节中制备的0.5ml经稀释的样品添加到匣中。使用两轮1.25ml稀释缓冲液洗脱醛。从匣中取出所有液体,且总收集体积为3.0ml。表36中详细介绍spe程序。表36固相萃取程序对于选择的实验,使用表37中详述的85:15洗脱缓冲液(85%10mm乙酸盐缓冲液,15%acn)进行洗脱。表37使用85:15洗脱缓冲液的固相萃取程序用dnph衍生化dnph衍生化溶液是通过将98.5ml不含羰基的acn(乙腈)、1ml磷酸(85%w/w,emdmillipore)和0.5mldnph溶液(70%dnph在30%h2o,光谱di149)合并创造。向上述“固相萃取”一节所收集的3.0ml洗脱液中加入1.5ml的dnph衍生化溶液。将溶液涡旋5秒,并在室温下进行衍生化反应至少30分钟。衍生的醛可以通过hplc-uv定量。用于确定醛含量的计算以μg/g计的醛含量,即,每重构组合物、测试组合物或安慰剂重量的醛重量,使用以下方程式计算。其中“浓度(μg/ml)”是通过hplc-uv测定的给定醛的溶液浓度。样品重量是指在上文“样品重构和稀释”一节中记录的重量,对于组合物大约为0.75g。稀释体积是指如上文“样品重构和稀释”一节所述,在spe之前将样品稀释的总体积;对于组合物样品,总体积为2.25ml。0.5ml/3.0ml表示来自spe的稀释因子,其中将0.5ml样品承载到匣,并用2.5ml洗脱,导致总收集体积为3.0ml。使用以下方程式计算出以μm计的醛含量。其中密度是指原始样品溶液的密度。组合物、安慰剂和稀释液1的密度被确定分别为1.04、1.03和1.01g/ml。分子量是指各醛的分子量,分别具有30.0、44.05及58.08μg/μmol分子量的甲醛、乙醛和丙醛。使用以下方程式计算以200μl的重构组合物的临床剂量存在的醛。测定测试组合物和安慰剂中的低分子量醛在一方面中,组合物(包含navpa、chir99021和泊洛沙姆407)是用于治疗慢性噪音诱导的听觉损失(cnihl)的方法的药物组合物。泊洛沙姆407因其形成热可逆凝胶的能力而用作测试组合物中的赋形剂。包括甲醛、乙醛和丙醛的醛是泊洛沙姆407的潜在杂质和降解产物。为gmp和glp测试组合物、安慰剂和稀释剂保留物,使用对固相萃取样品制备和dnph衍生化的最佳条件测定甲醛(fa)、乙醛(aa)和丙醛(pa)量。在四批次商购泊洛沙姆407中定量醛含量。在冻干前后,比较加速和非加速液体安慰剂中的醛含量。测试组合物中的醛测定测定测试组合物和安慰剂的fa、aa和pa含量。按照上述“样品制备”一节中的程序,将各批次测试组合物和安慰剂的1小瓶重构(即,测试组合物/安慰剂以冻干形式储存)并测试醛。对于测试组合物批次300006,将3个小瓶重构并测试醛。如上文“样品重构和稀释”一节所述,无需进一步稀释即可直接测试稀释剂1。对于所制备的各小瓶分析两重复,且结果显示在表38、表39和表40。表38测试组合物中的醛含量lod=检测极限。lloq=定量下限。表39安慰剂中的醛含量表40稀释剂1中的醛含量根据上文“用于确定醛含量的计算”一节中指定的方程式,计算200μl临床剂量中的醛含量,且在表9.1-4中对测试组合物和表42中对安慰剂详细说明。表41临床剂量的测试组合物中的醛含量表42临床剂量的安慰剂中的醛含量在暴露于初级储存条件下一年或加速储存条件下六个月的测试组合物、安慰剂或稀释剂中,未检测到高于lod量的甲醛。测试组合物和安慰剂以冻干饼的形式储存,证实pa量低于lod,而aa量低于0.7μg/g样品的lloq。稀释剂1包含在h2o的6.4%w/wdmso,且无泊洛沙姆407;如预期的那样,在稀释剂1样品中未检测到醛。当泊洛沙姆407作为冻干饼储存时,在加速储存条件下显示出最低量的醛并且醛含量没有显著增加。在rp-hplc色谱图中未观察到更高的醛同源物的证据。泊洛沙姆407中的醛测定根据上文“制备泊洛沙姆407样品”一节中指定的程序,在商购的泊洛沙姆407中测定醛含量。通过hplc-uv定量甲醛、乙醛和丙醛,且结果制表于表43中。表43泊洛沙姆407中的醛含量(n=2)商购的泊洛沙姆407不包含任何可检测的甲醛,并且包含可检测量的乙醛和丙醛。假设测试组合物的冻干在制造时去除泊洛沙姆407中存在的醛杂质。冻干对醛含量的影响对两批液体安慰剂研究冻干对醛含量的影响。发展冻干方法以从测试组合物和安慰剂制剂中除去h2o和dmso。尽管甲醛、乙醛和丙醛是挥发性化合物,但尚不清楚在冻干方法中是否会降低彼的浓度。表44详细说明液体安慰剂的组成和储存条件。表44液体安慰剂的组成和储存条件对于ft-021-094,将三个包含各1ml的小瓶在加速条件下储存6个月。储存6个月后,通过从各小瓶中称重400mg到2mlhplc小瓶中来提取冻干前样品,并用800μl的90:10稀释缓冲液稀释。冻干各大约600μl的剩余溶液(例如,见上文)。对于ft-032-081,创造3l批次的液体安慰剂,并在4℃下储存1周。通过称重400mg到2mlhplc小瓶中来提取冻燥前的三个样品,并用800μl的90:10稀释缓冲液稀释。用1ml的ft-032-081制备三个小瓶并冻干(例如,见上文)。冻干后,添加稀释剂1(4.6%w/wdmso在h2o)以替代冻干方法中的重量损失,并允许样品在4℃下重构至少1小时。称重来自各重构小瓶的500mg到2mlhplc小瓶中,并添加1ml的90:10稀释缓冲液。将冻干前和冻干后的样品涡旋直至完全溶解,并根据上述“样品制备”一节中详述的方法,一式两份地分析醛含量。冻干前后的醛含量显示于表45和图26。表45冻干前后液体安慰剂的醛含量将泊洛沙姆407水溶液在40℃、75%rh下储存6个月会导致fa、aa和pa杂质增加(见图26)。冻干将ft-021-094中存在的醛杂质分别减少fa、aa和pa的98.8%、99.1%和99.7%。冻干还将ft-032-081中存在的aa和pa减少至低于0.3μg/g的量(见图26)。尽管冻干前具有不同醛概况,但是冻干后的样品具有低于1.0μg/g总醛的类似醛含量。总之,确定测试组合物、安慰剂制剂和泊洛沙姆407溶液的醛含量。对于所有测试的储存条件,作为冻干饼储存的测试组合物和安慰剂证实最低醛含量,总醛含量低于1μg/g。泊洛沙姆407水溶液(包括未冻干的安慰剂制剂)证实较高的醛量,其在样品暴露于加速的稳定性条件下时增加。包含>100μg/g醛的泊洛沙姆407溶液的冻干导致去除99%的甲醛、乙醛和丙醛。将泊洛沙姆407储存为冻干饼而不是水溶液时减少醛的形成;再者,冻干方法有效地降低醛含量。可以看出,在一种临床剂量中,冻干的安慰剂和冻干测试组合物样品中的总醛量经测定为每克的样品少于1μg醛,即,1ppm,或少于0.2μg总醛。当泊洛沙姆407作为水溶液储存时,易于降解和形成醛杂质。冷冻干燥有效地从泊洛沙姆407溶液中去除醛杂质,并且在初级储存条件下储存长达12个月时,所得的冻干饼没有醛形成的证据。实施例20:有其他胶凝剂的组合物使用玻糖醛酸钠作为胶凝剂生产以下冻干组合物。重量和测量与冻干透明质酸组合物相关。组分量(mg/克)chir990215.96navpa168.0透明质酸钠14.4聚乙二醇(15)-羟基硬脂酸酯(solutol)50.6dmso104.2稀盐酸94.8水(足以到1克)根据供应商提供的分析证书,用于制造此组合物的透明质酸具有mw平均值为8.23×10^5道尔顿。其也由lifecorebio以“ha1m”出售,其中1m代表1百万道尔顿mw。制备1-3%水溶液并用于制造此组合物。因此,基于透明质酸的进一步组合物是可行并且由本公开设想。均等物应所述理解,在不脱离本发明的精神或基本特征下,本发明可以以其他特定形式具体化。因此,前述实施方案在所有方面都应被认为是说明性,而不是限制本文所述的发明。因此,本发明的范畴由所附权利要求而不是由前述描述指示,并且意图在权利要求的等同物的含义和范围内的所有改变被包含在其中。本公开也包括下述编号的子句(clause)1.一种冻干药物组合物,包含一种或多种耳用治疗剂及胶凝剂。2.如子句1所述的冻干药物组合物,其中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。3.如子句1所述的如子句2所述的冻干药物组合物,其中,一种或多种耳用治疗剂为一种或多种与听觉损失相关的生物路径与生物标靶的调节剂。4.如前述子句中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自由下列组成的组:wnt路径激动剂、组蛋白去乙酰酶(hdac)抑制剂、dkk1抑制剂、axin抑制剂、sfrp1抑制剂、骨形态发生蛋白(bmp)抑制剂、β-连环蛋白激动剂、周期蛋白d1活化剂、rest辅阻遏物1(corest)抑制剂、notch激动剂、tgf-β抑制剂、camp反应元件结合蛋白质(creb)活化剂、周期蛋白依赖型激酶(cdk)活化剂、cdk抑制剂、pi3k-akt活化剂、pi3k-akt抑制剂、pten抑制剂、atoh1激动剂、atoh1拮抗剂、pou4f3激动剂、pou4f3拮抗剂、gfi1激动剂、gfi1拮抗剂、erk/mapk激动剂、erk/mapk拮抗剂、fgf激动剂、fgf拮抗剂、γ-氨基丁酸(gabas)、电位闸控na+通道拮抗剂、肌醇、pkc激动剂、pkc拮抗剂、foxo抑制剂、foxo激动剂、kv3通道拮抗剂、p27kip1抑制剂、il-1β、n-甲基-d-天门冬氨酸盐(nmda)受体拮抗剂、nadph醌氧化还原酶1、γ分泌酶抑制剂、γ分泌酶活化剂、nk1受体拮抗剂、nk1受体激动剂、ampa受体激动剂、ampa受体拮抗剂、toll样受体(tlr)激动剂、toll样受体(tlr)拮抗剂、组织胺h4受体激动剂、h4受体拮抗剂、5-ht3受体激动剂、5-ht3受体拮抗剂、oct4活化剂、sox2活化剂、sox17诱导物、klf4诱导物、cmyc活化剂、音猬因子激动剂、音猬因子拮抗剂、表皮生长因子(egf)、胰岛素样生长因子(igf)、血管内皮生长因子(vegf)、内皮氧化氮合成酶(enos)、前列腺素e(pge)、脑源性神经营养因子(bdnf)、smad抑制剂、sall4诱导物、gata4诱导物、gata6诱导物、蛋白酶体抑制剂、视黄酸受体激动剂、mtor抑制剂、mtor活化剂、抗坏血酸、2-磷酸-l-抗坏血酸、kdm抑制剂、ttnpb、神经营养素3、dna-修饰酶、lsd-1抑制剂、烟酰胺、sirtuin、组蛋白甲基转移酶抑制剂、组蛋白去甲基化酶抑制剂、组蛋白赖氨酸甲基转移酶抑制剂、dnmt抑制剂、p53抑制剂、p21抑制剂、ampk活化剂、hippo活化剂、hippo抑制剂、yap/taz抑制剂、mst1/2抑制剂、ck1活化剂、ck1抑制剂、头发生素、r-spondin1、bet活化剂、sirt1活化剂、sirt1抑制剂、sirt2活化剂、sirt2抑制剂、sirt3活化剂、sirt3抑制剂、jmjd3抑制剂、dmnt抑制剂、stat3抑制剂、lsd1抑制剂、活性前列腺素、camp活化剂、氧化磷酸化解偶联剂、精氨酸甲基转移酶抑制剂、alk4抑制剂、过氧化物酶体增殖物活化受体γ活化剂、egfr抑制剂、shh抑制剂、vitd活化剂、dot1l抑制剂、甲状腺激素、e盒依赖性转录活化剂及蛋白质降解抑制剂。5.如前述子句中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂为发细胞再生剂及/或耳保护剂。6.如前述子句中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自由下列组成的组:表1至13中所述的剂及其药物盐。7.如前述子句中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。8.如子句7所述的冻干药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。9.如前述子句中任一项所述的冻干药物组合物,其中,胶凝剂为热可逆胶凝剂。10.如子句9所述的冻干药物组合物,其中,热可逆胶凝剂包含泊洛沙姆。11.如子句10所述的冻干药物组合物,其中,泊洛沙姆选自由下列组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403及泊洛沙姆407;任选地,泊洛沙姆为泊洛沙姆188或泊洛沙姆407;以及任选地,泊洛沙姆为泊洛沙姆407。12.如前述子句中任一项所述的冻干药物组合物,其中,泊洛沙姆为纯化的泊洛沙姆;任选地,泊洛沙姆为纯化的泊洛沙姆407。13.如前述子句中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。14.如前述子句中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407系通过液液萃取或尺寸排阻色谱法制备。15.如前述子句中任一项所述的冻干药物组合物,其中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。16.如前述子句中任一项所述的冻干药物组合物,呈冻干饼的形式。17.如前述子句中任一项所述的冻干药物组合物,相较于包含一种或多种溶剂的可比拟的药物组合物对氧及/或光具有较高稳定性。18.如前述子句中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。19.如前述子句中任一项所述的冻干药物组合物,其中,杂质为残余溶剂。20.如前述子句中任一项所述的冻干药物组合物,其中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。21.如前述子句中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。22.如前述子句中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。23.如前述子句中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。24.如前述子句中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。25.如前述子句中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。26.如前述子句中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有较低胶凝温度、较窄胶凝温度范围及/或较高粘度;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。27.如前述子句中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。28.如前述子句中任一项所述的冻干药物组合物,适于通过重构方法制备重构溶液。29.如前述子句中任一项所述的冻干药物组合物,其中,重构方法为少于约30分钟。30.如前述子句中任一项所述的冻干药物组合物,其中,重构溶液适于注射;任选地,重构溶液适于鼓室内注射。31.如前述子句中任一项所述的冻干药物组合物,其中,重构溶液维持用于制备冻干药物组合物的预冻干溶液的一种或多种流变性质。32.如前述子句中任一项所述的冻干药物组合物,其中,相较于从无纯化的泊洛沙姆407的可比拟的冻干药物组合物所制备的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。33.如前述子句中任一项所述的冻干药物组合物,用于治疗有其需要的受试者中的听觉损失。34.如前述子句中任一项所述的冻干药物组合物的用途,其用于制备用于治疗有其需要的受试者中的听觉损失的重构溶液。35.治疗听觉损失的方法,包括向有其需要的受试者施用药学上可接受量的重构溶液,其中,重构溶液系通过重构方法使用如前述子句中任一项所述的冻干药物组合物制备。36.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。37.如子句36所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。38.如前述子句中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约1.45mg/ml至约1.65mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。39.如前述子句中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约43mg/ml至约46mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml。40.如前述子句中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约8wt%。41.如前述子句中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%;任选地,dmso的浓度为约2.5wt%。42.如前述子句中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。43.如前述子句中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。44.如前述子句中任一项所述的药物组合物,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。45.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约1.45mg/ml至约1.65mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约43mg/ml至约46mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。46.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约1.55mg/ml;丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml;泊洛沙姆407的浓度为约8wt%;以及dmso的浓度为约2.5wt%。47.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。48.如子句47所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。49.如前述子句中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约10mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml、从约0.85mg/ml至约1.15mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约1.05mg/ml。50.如前述子句中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml、从约28mg/ml至约31mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml。51.如前述子句中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约11wt%至约10wt%、从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约7.5wt%。52.如前述子句中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%、从约2wt%至约3wt%;任选地,dmso的浓度为约2.5wt%。53.如前述子句中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。54.如前述子句中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。55.如前述子句中任一项所述的药物组合物,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。56.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约0.95mg/ml至约1.15mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约28mg/ml至约31mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。57.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约1.05mg/ml;丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。58.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。59.如子句58所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。60.如前述子句中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约0.6mg/ml至约0.75mg/ml;任选地,chir99021或其药学上可接受的盐的浓度范围为约0.7mg/ml。61.如前述子句中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约18mg/ml至约21mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml。62.如前述子句中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约7.5wt%。63.如前述子句中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%;任选地,dmso的浓度为约5wt%。64.如前述子句中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。65.如前述子句中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。66.如前述子句中任一项所述的药物组合物,其中:介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。67.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约0.6mg/ml至约0.75mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约18mg/ml至约21mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。68.如前述子句中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约0.7mg/ml;丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。69.如前述子句中任一项所述的药物组合物,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。70.处理如子句36至69中任一项所述的药物组合物以形成冻干药物组合物的方法。71.如子句70所述的方法,包括下述步骤:i)在低于0℃的第一温度下冷却药物组合物达第一时间段;ii)在低于0℃的第二温度下,并在低于760托的减压下,自步骤(i)的所得混合物移除一种或多种溶剂达第二时间段。72.如子句70所述的或子句71所述的方法,包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以从每分钟约0.1℃至每分钟约5℃的速率冷却药物组合物到范围从约-20℃至约-80℃的第一温度;ib)在第一温度保持药物组合物达范围从约1小时至约6小时的第一时间段;iia)将药物组合物经范围从约1毫托至1000毫托的减压且以从每分钟约0.1℃至每分钟约5℃的速率使药物组合物温热到范围从约-10℃至-50℃的第二温度;iib)在第二温度下且在减压下保持药物组合物达范围从约10小时至约30小时的第二时间段;iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。73.如子句70至72中任一项所述的方法,其中,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆;任选地,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆407;以及任选地,药物组合物包含一种或多种耳用治疗剂及纯化的泊洛沙姆407。74.如子句70至73中任一项所述的方法,其中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆、dmso及水;任选地,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆407、dmso及水;任选地,药物组合物包含chir99021、丙戊酸钠盐、纯化的泊洛沙姆407、dmso及水。75.如子句70至74中任一项所述的方法,包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以每分钟约0.5℃的速率冷却药物组合物到约-45℃的第一温度;ib)在第一温度保持药物组合物达约3小时的第一时间段;iia)将药物组合物经约80毫托至1000毫托的减压且以每分钟约0.5℃的速率使药物组合物温热至约-30℃的第二温度;iib)在第二温度下且在减压下保持药物组合物达范围从约10小时至约15小时的第二时间段;iic)以每分钟约0.5℃的速率使药物组合物温热到20℃;iid)在20℃且在减压下保持药物组合物达20小时,iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。76.冻干药物组合物,通过冻干如子句36至69中任一项所述的药物组合物而制备。77.冻干药物组合物,通过如子句70至75中任一项所述的方法而制备。78.重构溶液,通过添加稀释剂到如子句1至24及76至77中任一项所述的冻干药物组合物而制备。79.重构溶液,通过添加稀释剂至通过冻干如子句36至69中任一项所述的药物组合物所制备的冻干药物组合物而制备。80.重构溶液,通过添加稀释剂至通过如子句70至75中任一项所述的方法所制备的冻干药物组合物而制备。81.重构溶液,通过添加稀释剂至冻干药物组合物而制备,包含一种或多种耳用治疗剂及胶凝剂。82.如前述子句中任一项所述的重构溶液,其中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。83.如前述子句中任一项所述的重构溶液,其中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。84.如子句83所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。85.如前述子句中任一项所述的重构溶液,其中,胶凝剂为热可逆胶凝剂。86.如子句85所述的重构溶液,其中,热可逆胶凝剂包含泊洛沙姆。87.如子句86所述的重构溶液,其中,泊洛沙姆选自由下列组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403及泊洛沙姆407;任选地,泊洛沙姆为泊洛沙姆188或泊洛沙姆407;以及任选地,泊洛沙姆为泊洛沙姆407。88.如前述子句中任一项所述的重构溶液,其中,泊洛沙姆为纯化的泊洛沙姆;任选地,泊洛沙姆为纯化的泊洛沙姆407。89.如前述子句中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。90.如前述子句中任一项所述的重构溶液,其中,纯化的泊洛沙姆407系通过液液萃取或尺寸排阻色谱法制备。91.如前述子句中任一项所述的重构溶液,其中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。92.如前述子句中任一项所述的重构溶液,其中,稀释剂包含水及二甲基亚砜(dmso)。93.如前述子句中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约1%w/w至约15%w/w、从约2%w/w至约12%w/w、从约3%w/w至约10%w/w、从约4%w/w至约9%w/w、从约5%w/w至约8%w/w、从约5.5%w/w至约7.5%w/w、从约5.8%w/w至约7%w/w、从约6%w/w至约6.8%w/w或从约6.2%w/w至约6.6%w/w;任选地,在稀释剂中dmso的浓度为约6.4%w/w。94.如前述子句中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约1μl至约6μl、从约2μl至约5μl、从约2.5μl至约4.5μl、从约2.8μl至约4μl、从约3μl至约3.8μl或从约3.2μl至约3.6μl/mg的冻干药物组合物;任选地,构造期间所添加的稀释剂量为约3.4μl/mg的冻干药物组合物95.如前述子句中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。96.如子句95所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。97.如前述子句中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约2.9mg/ml至约3.3mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约3.1mg/ml。98.如前述子句中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约86mg/ml至约92mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约89mg/ml。99.如前述子句中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约16wt%。100.如前述子句中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。101.如前述子句中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。102.如前述子句中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。103.如前述子句中任一项所述的重构溶液,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。104.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约2.9mg/ml至约3.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约86mg/ml至约92mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。105.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约3.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约89mg/ml;泊洛沙姆407的浓度为约16wt%;以及dmso的浓度为约5wt%。106.如前述子句中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。107.如子句106所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。108.如前述子句中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml、从约1.9mg/ml至约2.3mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约2.1mg/ml。109.如前述子句中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml、从约56mg/ml至约62mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约59mg/ml。110.如前述子句中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%、从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约15wt%。111.如前述子句中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%、从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。112.如前述子句中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。113.如前述子句中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。114.如前述子句中任一项所述的重构溶液,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。115.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约1.9mg/ml至约2.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约56mg/ml至约62mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。116.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约2.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约59mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。117.如前述子句中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。118.如子句117所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。119.如前述子句中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约1.2mg/ml至约1.5mg/ml;任选地,chir99021或其药学上可接受的盐的浓度范围为约1.4mg/ml。120.如前述子句中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约36mg/ml至约42mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约39mg/ml。121.如前述子句中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约15wt%。122.如前述子句中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。123.如前述子句中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。124.如前述子句中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。125.如前述子句中任一项所述的重构溶液,其中:介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。126.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约1.2mg/ml至约1.5mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约36mg/ml至约42mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。127.如前述子句中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约1.4mg/ml;丙戊酸或其药学上可接受的盐的浓度为约39mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。128.如前述子句中任一项所述的重构溶液,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。129.如前述子句中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,重构溶液相较于无纯化的泊洛沙姆407的可比拟的重构溶液对氧及/或光具有较高稳定性;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。130.如前述子句中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。131.如前述子句中任一项所述的重构溶液,其中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。132.如前述子句中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。133.如前述子句中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。134.如前述子句中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。135.如前述子句中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。136.如前述子句中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,重构溶液具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。137.如前述子句中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的重构溶液,重构溶液具有较低胶凝温度、较窄胶凝温度范围、更持续释放听觉损失治疗剂及/或较高粘度;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。138.如前述子句中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。139.如前述子句中任一项所述的重构溶液,适于注射;任选地,重构溶液适于鼓室内注射。140.如前述子句中任一项所述的重构溶液,其中,重构溶液维持用于制备冻干药物组合物的药物组合物的一种或多种流变性质。141.如前述子句中任一项所述的重构溶液,其中,相较于从无纯化的泊洛沙姆407的可比拟的冻干药物组合物所制备的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。142.如前述子句中任一项所述的重构溶液,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。143.促进产生组织及/或细胞的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液到组织及/或细胞。144.治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的方法,包括向受试者施用药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。145.增加在前庭组织中的前庭细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。146.治疗患有前庭病症或有发展前庭病症的风险的受试者的方法,包括向受试者施用药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。147.增加耳蜗组织中的耳蜗细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。148.治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的方法,包括向受试者施用药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。149.增加柯蒂氏器中发现的细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液至所述群。150.增加柯蒂氏器中发现的发细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液至所述群。151.增加柯蒂氏器中发现的内发细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液至所述群。152.增加柯蒂氏器中发现的外发细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液至所述群。153.增加柯蒂氏器中发现的神经元细胞群的方法,包括递送药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液至所述群。154.治疗患有听觉病症或有发展听觉病症的风险的受试者的方法,包括向受试者施用药物有效量的如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液。155.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于促进产生组织及/或细胞。156.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者。157.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加在前庭组织中的前庭细胞群。158.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于治疗患有前庭病症或有发展前庭病症的风险的受试者。159.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加耳蜗组织中的耳蜗细胞群。160.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者。161.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加柯蒂氏器中发现的细胞群。162.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加柯蒂氏器中发现的发细胞群。163.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加柯蒂氏器中发现的内发细胞群。164.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加柯蒂氏器中发现的外发细胞群。165.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于增加柯蒂氏器中发现的神经元细胞群。166.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液,用于治疗患有听觉病症或有发展听觉病症的风险的受试者。167.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造促进产生组织及/或细胞的药剂。168.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的药剂。169.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加在前庭组织中的前庭细胞群的药剂。170.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造治疗患有前庭病症或有发展前庭病症的风险的受试者的药剂。171.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加耳蜗组织中的耳蜗细胞群的药剂。172.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的药剂。173.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加柯蒂氏器中发现的细胞群的药剂。174.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加柯蒂氏器中发现的发细胞群的药剂。175.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加柯蒂氏器中发现的内发细胞群的药剂。176.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加柯蒂氏器中发现的外发细胞群的药剂。177.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造增加柯蒂氏器中发现的神经元细胞群的药剂。178.如子句1至35及76至77中任一项所述的冻干药物组合物、如36至69中任一项所述的药物组合物或如子句78至142中任一项所述的重构溶液的用途,其用于制造治疗患有听觉病症或有发展听觉病症的风险的受试者的药剂。本公开也包括下述编号的实施方案。1.一种包含胶凝剂及式(i)的化合物的药物组合物:或其药学上可接受的盐;其中:r1选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r2a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r2b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;x选自及或不存在;r3a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r3b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r4选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r5a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r5b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;y选自及或不存在;r6a选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r6b选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;各r7独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r8a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r8b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;z选自及或不存在;r10a独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r10b独立地选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r11a选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;r11b选自h、烷基、烷氧基、卤基、环烷基、烯基、炔基、碳环基及芳基;na选自0、1、2、3、4、5、6、7及8;nb选自0、1、2、3及4;nc选自0、1及2;nd选自0、1及2;以及;ne选自0、1、2、3、4、5及6。2.如实施方案1所述的药物组合物,其中,药物组合物为冻干组合物。3.冻干药物组合物,包含一种或多种耳用治疗剂及胶凝剂。4.如实施方案3所述的组合物,其中,一种或多种耳用治疗剂包括式(i)的化合物。5.如实施方案1或2所述的组合物,其中,式(i)的化合物为耳用治疗剂。6.如任一前述实施方案所述的组合物,其中,r1为h。7.如任一前述实施方案所述的组合物,其中,r1为烷基。8.如任一前述实施方案所述的组合物,其中,r1为烷氧基。9.如任一前述实施方案所述的组合物,其中,r1为卤基。10.如任一前述实施方案所述的组合物,其中,r1为环烷基。11.如任一前述实施方案所述的组合物,其中,r1为烯基。12.如任一前述实施方案所述的组合物,其中,r1为炔基。13.如任一前述实施方案所述的组合物,其中,r1为碳环基。14.如任一前述实施方案所述的组合物,其中,r1为芳基。15.如任一前述实施方案所述的组合物,其中,r2a为h。16.如任一前述实施方案所述的组合物,其中,r2a为烷基。17.如任一前述实施方案所述的组合物,其中,r2a为烷氧基。18.如任一前述实施方案所述的组合物,其中,r2a为卤基。19.如任一前述实施方案所述的组合物,其中,r2a为环烷基。20.如任一前述实施方案所述的组合物,其中,r2a为烯基。21.如任一前述实施方案所述的组合物,其中,r2a为炔基。22.如任一前述实施方案所述的组合物,其中,r2a为碳环基。23.如任一前述实施方案所述的组合物,其中,r2a为芳基。24.如任一前述实施方案所述的组合物,其中,r2b为h。25.如任一前述实施方案所述的组合物,其中,r2b为烷基。26.如任一前述实施方案所述的组合物,其中,r2b为烷氧基。27.如任一前述实施方案所述的组合物,其中,r2b为卤基。28.如任一前述实施方案所述的组合物,其中,r2b为环烷基。29.如任一前述实施方案所述的组合物,其中,r2b为烯基。30.如任一前述实施方案所述的组合物,其中,r2b为炔基。31.如任一前述实施方案所述的组合物,其中,r2b为碳环基。32.如任一前述实施方案所述的组合物,其中,r2b为芳基。33.如任一前述实施方案所述的组合物,其中,r3a为h。34.如任一前述实施方案所述的组合物,其中,r3a为烷基。35.如任一前述实施方案所述的组合物,其中,r3a为烷氧基。36.如任一前述实施方案所述的组合物,其中,r3a为卤基。37.如任一前述实施方案所述的组合物,其中,r3a为环烷基。38.如任一前述实施方案所述的组合物,其中,r3a为烯基。39.如任一前述实施方案所述的组合物,其中,r3a为炔基。40.如任一前述实施方案所述的组合物,其中,r3a为碳环基。41.如任一前述实施方案所述的组合物,其中,r3a为芳基。42.如任一前述实施方案所述的组合物,其中,r3b为h。43.如任一前述实施方案所述的组合物,其中,r3b为烷基。44.如任一前述实施方案所述的组合物,其中,r3b为烷氧基。45.如任一前述实施方案所述的组合物,其中,r3b为卤基。46.如任一前述实施方案所述的组合物,其中,r3b为环烷基。47.如任一前述实施方案所述的组合物,其中,r3b为烯基。48.如任一前述实施方案所述的组合物,其中,r3b为炔基。49.如任一前述实施方案所述的组合物,其中,r3b为碳环基。50.如任一前述实施方案所述的组合物,其中,r3b为芳基。51.如任一前述实施方案所述的组合物,其中,r4为h。52.如任一前述实施方案所述的组合物,其中,r4为烷基。53.如任一前述实施方案所述的组合物,其中,r4为烷氧基。54.如任一前述实施方案所述的组合物,其中,r4为卤基。55.如任一前述实施方案所述的组合物,其中,r4为环烷基。56.如任一前述实施方案所述的组合物,其中,r4为烯基。57.如任一前述实施方案所述的组合物,其中,r4为炔基。58.如任一前述实施方案所述的组合物,其中,r4为碳环基。59.如任一前述实施方案所述的组合物,其中,r4为芳基。60.如任一前述实施方案所述的组合物,其中,r5a为h。61.如任一前述实施方案所述的组合物,其中,r5a为烷基。62.如任一前述实施方案所述的组合物,其中,r5a为烷氧基。63.如任一前述实施方案所述的组合物,其中,r5a为卤基。64.如任一前述实施方案所述的组合物,其中,r5a为环烷基。65.如任一前述实施方案所述的组合物,其中,r5a为烯基。66.如任一前述实施方案所述的组合物,其中,r5a为炔基。67.如任一前述实施方案所述的组合物,其中,r5a为碳环基。68.如任一前述实施方案所述的组合物,其中,r5a为芳基。69.如任一前述实施方案所述的组合物,其中,r5b为h。70.如任一前述实施方案所述的组合物,其中,r5b为烷基。71.如任一前述实施方案所述的组合物,其中,r5b为烷氧基。72.如任一前述实施方案所述的组合物,其中,r5b为卤基。73.如任一前述实施方案所述的组合物,其中,r5b为环烷基。74.如任一前述实施方案所述的组合物,其中,r5b为烯基。75.如任一前述实施方案所述的组合物,其中,r5b为炔基。76.如任一前述实施方案所述的组合物,其中,r5b为碳环基。77.如任一前述实施方案所述的组合物,其中,r5b为芳基。78.如任一前述实施方案所述的组合物,其中,r6a为h。79.如任一前述实施方案所述的组合物,其中,r6a为烷基。80.如任一前述实施方案所述的组合物,其中,r6a为烷氧基。81.如任一前述实施方案所述的组合物,其中,r6a为卤基。82.如任一前述实施方案所述的组合物,其中,r6a为环烷基。83.如任一前述实施方案所述的组合物,其中,r6a为烯基。84.如任一前述实施方案所述的组合物,其中,r6a为炔基。85.如任一前述实施方案所述的组合物,其中,r6a为碳环基。86.如任一前述实施方案所述的组合物,其中,r6a为芳基。87.如任一前述实施方案所述的组合物,其中,r6b为h。88.如任一前述实施方案所述的组合物,其中,r6b为烷基。89.如任一前述实施方案所述的组合物,其中,r6b为烷氧基。90.如任一前述实施方案所述的组合物,其中,r6b为卤基。91.如任一前述实施方案所述的组合物,其中,r6b为环烷基。92.如任一前述实施方案所述的组合物,其中,r6b为烯基。93.如任一前述实施方案所述的组合物,其中,r6b为炔基。94.如任一前述实施方案所述的组合物,其中,r6b为碳环基。95.如任一前述实施方案所述的组合物,其中,r6b为芳基。96.如任一前述实施方案所述的组合物,其中,r7为h。97.如任一前述实施方案所述的组合物,其中,r7为烷基。98.如任一前述实施方案所述的组合物,其中,r7为烷氧基。99.如任一前述实施方案所述的组合物,其中,r7为卤基。100.如任一前述实施方案所述的组合物,其中,r7为环烷基。101.如任一前述实施方案所述的组合物,其中,r7为烯基。102.如任一前述实施方案所述的组合物,其中,r7为炔基。103.如任一前述实施方案所述的组合物,其中,r7为碳环基。104.如任一前述实施方案所述的组合物,其中,r7为芳基。105.如任一前述实施方案所述的组合物,其中,x为106.如任一前述实施方案所述的组合物,其中,x为107.如任一前述实施方案所述的组合物,其中,x为108.如任一前述实施方案所述的组合物,其中,x为109.如任一前述实施方案所述的组合物,其中,x不存在。110.如任一前述实施方案所述的组合物,其中,y为111.如任一前述实施方案所述的组合物,其中,y为112.如任一前述实施方案所述的组合物,其中,y为113.如任一前述实施方案所述的组合物,其中,y为114.如任一前述实施方案所述的组合物,其中,y不存在。115.如任一前述实施方案所述的组合物,其中,r8a为h。116.如任一前述实施方案所述的组合物,其中,r8a为烷基。117.如任一前述实施方案所述的组合物,其中,r8a为烷氧基。118.如任一前述实施方案所述的组合物,其中,r8a为卤基。119.如任一前述实施方案所述的组合物,其中,r8a为环烷基。120.如任一前述实施方案所述的组合物,其中,r8a为烯基。121.如任一前述实施方案所述的组合物,其中,r8a为炔基。122.如任一前述实施方案所述的组合物,其中,r8a为碳环基。123.如任一前述实施方案所述的组合物,其中,r8a为芳基。124.如任一前述实施方案所述的组合物,其中,r8b为h。125.如任一前述实施方案所述的组合物,其中,r8b为烷基。126.如任一前述实施方案所述的组合物,其中,r8b为烷氧基。127.如任一前述实施方案所述的组合物,其中,r8b为卤基。128.如任一前述实施方案所述的组合物,其中,r8b为环烷基。129.如任一前述实施方案所述的组合物,其中,r8b为烯基。130.如任一前述实施方案所述的组合物,其中,r8b为炔基。131.如任一前述实施方案所述的组合物,其中,r8b为碳环基。132.如任一前述实施方案所述的组合物,其中,r8b为芳基。133.如任一前述实施方案所述的组合物,其中,r9a为h。134.如任一前述实施方案所述的组合物,其中,r9a为烷基。135.如任一前述实施方案所述的组合物,其中,r9a为烷氧基。136.如任一前述实施方案所述的组合物,其中,r9a为卤基。137.如任一前述实施方案所述的组合物,其中,r9a为环烷基。138.如任一前述实施方案所述的组合物,其中,r9a为烯基。139.如任一前述实施方案所述的组合物,其中,r9a为炔基。140.如任一前述实施方案所述的组合物,其中,r9a为碳环基。141.如任一前述实施方案所述的组合物,其中,r9a为芳基。142.如任一前述实施方案所述的组合物,其中,r9b为h。143.如任一前述实施方案所述的组合物,其中,r9b为烷基。144.如任一前述实施方案所述的组合物,其中,r9b为烷氧基。145.如任一前述实施方案所述的组合物,其中,r9b为卤基。146.如任一前述实施方案所述的组合物,其中,r9b为环烷基。147.如任一前述实施方案所述的组合物,其中,r9b为烯基。148.如任一前述实施方案所述的组合物,其中,r9b为炔基。149.如任一前述实施方案所述的组合物,其中,r9b为碳环基。150.如任一前述实施方案所述的组合物,其中,r9b为芳基。151.如任一前述实施方案所述的组合物,其中,z为152.如任一前述实施方案所述的组合物,其中,z为153.如任一前述实施方案所述的组合物,其中,z为154.如任一前述实施方案所述的组合物,其中,z为155.如任一前述实施方案所述的组合物,其中,z不存在。156.如任一前述实施方案所述的组合物,其中,r10a为h。157.如任一前述实施方案所述的组合物,其中,r10a为烷基。158.如任一前述实施方案所述的组合物,其中,r10a为烷氧基。159.如任一前述实施方案所述的组合物,其中,r10a为卤基。160.如任一前述实施方案所述的组合物,其中,r10a为环烷基。161.如任一前述实施方案所述的组合物,其中,r10a为烯基。162.如任一前述实施方案所述的组合物,其中,r10a为炔基。163.如任一前述实施方案所述的组合物,其中,r10a为碳环基。164.如任一前述实施方案所述的组合物,其中,r10a为芳基。165.如任一前述实施方案所述的组合物,其中,r10b为h。166.如任一前述实施方案所述的组合物,其中,r10b为烷基。167.如任一前述实施方案所述的组合物,其中,r10b为烷氧基。168.如任一前述实施方案所述的组合物,其中,r10b为卤基。169.如任一前述实施方案所述的组合物,其中,r10b为环烷基。170.如任一前述实施方案所述的组合物,其中,r10b为烯基。171.如任一前述实施方案所述的组合物,其中,r10b为炔基。172.如任一前述实施方案所述的组合物,其中,r10b为碳环基。173.如任一前述实施方案所述的组合物,其中,r10b为芳基。174.如任一前述实施方案所述的组合物,其中,r11a为h。175.如任一前述实施方案所述的组合物,其中,r11b为烷基。176.如任一前述实施方案所述的组合物,其中,r11a为烷氧基。177.如任一前述实施方案所述的组合物,其中,r11a为卤基。178.如任一前述实施方案所述的组合物,其中,r11a为环烷基。179.如任一前述实施方案所述的组合物,其中,r11a为烯基。180.如任一前述实施方案所述的组合物,其中,r11a为炔基。181.如任一前述实施方案所述的组合物,其中,r11a为碳环基。182.如任一前述实施方案所述的组合物,其中,r11a为芳基。183.如任一前述实施方案所述的组合物,其中,r11b为h。184.如任一前述实施方案所述的组合物,其中,r11b为烷基。185.如任一前述实施方案所述的组合物,其中,r11b为烷氧基。186.如任一前述实施方案所述的组合物,其中,r11b为卤基。187.如任一前述实施方案所述的组合物,其中,r11b为环烷基。188.如任一前述实施方案所述的组合物,其中,r11b为烯基。189.如任一前述实施方案所述的组合物,其中,r11b为炔基。190.如任一前述实施方案所述的组合物,其中,r11b为碳环基。191.如任一前述实施方案所述的组合物,其中,r11b为芳基。192.如任一前述实施方案所述的组合物,其中,na为0。193.如任一前述实施方案所述的组合物,其中,na为1。194.如任一前述实施方案所述的组合物,其中,na为2。195.如任一前述实施方案所述的组合物,其中,na为3。196.如任一前述实施方案所述的组合物,其中,na为4。197.如任一前述实施方案所述的组合物,其中,na为5。198.如任一前述实施方案所述的组合物,其中,na为6。199.如任一前述实施方案所述的组合物,其中,na为7。200.如任一前述实施方案所述的组合物,其中,na为8。201.如任一前述实施方案所述的组合物,其中,nb为0。202.如任一前述实施方案所述的组合物,其中,nb为1。203.如任一前述实施方案所述的组合物,其中,nb为2。204.如任一前述实施方案所述的组合物,其中,nb为3。205.如任一前述实施方案所述的组合物,其中,nb为4。206.如任一前述实施方案所述的组合物,其中,nc为0。207.如任一前述实施方案所述的组合物,其中,nc为1。208.如任一前述实施方案所述的组合物,其中,nc为2。209.如任一前述实施方案所述的组合物,其中,nd为0。210.如任一前述实施方案所述的组合物,其中,nd为1。211.如任一前述实施方案所述的组合物,其中,nd为2。212.如任一前述实施方案所述的组合物,其中,ne为0。213.如任一前述实施方案所述的组合物,其中,ne为1。214.如任一前述实施方案所述的组合物,其中,ne为2。215.如任一前述实施方案所述的组合物,其中,ne为3。216.如任一前述实施方案所述的组合物,其中,ne为4。217.如任一前述实施方案所述的组合物,其中,ne为5。218.如任一前述实施方案所述的组合物,其中,ne为6。219.如任一前述实施方案所述的组合物,其中,r1为me。220.如任一前述实施方案所述的组合物,其中,r2a为me。221.如任一前述实施方案所述的组合物,其中,r2b为me。222.如任一前述实施方案所述的组合物,其中,r3a为me。223.如任一前述实施方案所述的组合物,其中,r3b为me。224.如任一前述实施方案所述的组合物,其中,r4为me。225.如任一前述实施方案所述的组合物,其中,r5a为me。226.如任一前述实施方案所述的组合物,其中,r5b为me。227.如任一前述实施方案所述的组合物,其中,r6a为me。228.如任一前述实施方案所述的组合物,其中,r6b为me。229.如任一前述实施方案所述的组合物,其中,r7为me。230.如任一前述实施方案所述的组合物,其中,r8a为me。231.如任一前述实施方案所述的组合物,其中,r8b为me。232.如任一前述实施方案所述的组合物,其中,r9a为me。233.如任一前述实施方案所述的组合物,其中,r9b为me。234.如任一前述实施方案所述的组合物,其中,r10a为me。235.如任一前述实施方案所述的组合物,其中,r10b为me。236.如任一前述实施方案所述的组合物,其中,r11a为me。237.如任一前述实施方案所述的组合物,其中,r11b为me。238.如任一前述实施方案所述的组合物,其中,r1为f。239.如任一前述实施方案所述的组合物,其中,r2a为f。240.如任一前述实施方案所述的组合物,其中,r2b为f。241.如任一前述实施方案所述的组合物,其中,r3a为f。242.如任一前述实施方案所述的组合物,其中,r3b为f。243.如任一前述实施方案所述的组合物,其中,r4为f。244.如任一前述实施方案所述的组合物,其中,r5a为f。245.如任一前述实施方案所述的组合物,其中,r5b为f。246.如任一前述实施方案所述的组合物,其中,r6a为f。247.如任一前述实施方案所述的组合物,其中,r6b为f。248.如任一前述实施方案所述的组合物,其中,r7为f。249.如任一前述实施方案所述的组合物,其中,r8a为f。250.如任一前述实施方案所述的组合物,其中,r8b为f。251.如任一前述实施方案所述的组合物,其中,r9a为f。252.如任一前述实施方案所述的组合物,其中,r9b为f。253.如任一前述实施方案所述的组合物,其中,r10a为f。254.如任一前述实施方案所述的组合物,其中,r10b为f。255.如任一前述实施方案所述的组合物,其中,r11a为f。256.如任一前述实施方案所述的组合物,其中,r11b为f。257.如任一前述实施方案所述的组合物,其中,r1为烷基。258.如任一前述实施方案所述的组合物,其中,r2a为烷基。259.如任一前述实施方案所述的组合物,其中,r2b为烷基。260.如任一前述实施方案所述的组合物,其中,r3a为烷基。261.如任一前述实施方案所述的组合物,其中,r3b为烷基。262.如任一前述实施方案所述的组合物,其中,r4为烷基。263.如任一前述实施方案所述的组合物,其中,r5a为烷基。264.如任一前述实施方案所述的组合物,其中,r5b为烷基。265.如任一前述实施方案所述的组合物,其中,r6a为烷基。266.如任一前述实施方案所述的组合物,其中,r6b为烷基。267.如任一前述实施方案所述的组合物,其中,r7为烷基。268.如任一前述实施方案所述的组合物,其中,r8a为烷基。269.如任一前述实施方案所述的组合物,其中,r8b为烷基。270.如任一前述实施方案所述的组合物,其中,r9a为烷基。271.如任一前述实施方案所述的组合物,其中,r9b为烷基。272.如任一前述实施方案所述的组合物,其中,r10a为烷基。273.如任一前述实施方案所述的组合物,其中,r10b为烷基。274.如任一前述实施方案所述的组合物,其中,r11a为烷基。275.如任一前述实施方案所述的组合物,其中,r11b为烷基。276.如任一前述实施方案所述的组合物,其中,烷基为甲基。277.如任一前述实施方案所述的组合物,其中,烷基为乙基。278.如任一前述实施方案所述的组合物,其中,烷基为正丙基。279.如任一前述实施方案所述的组合物,其中,烷基为异丙基。280.如任一前述实施方案所述的组合物,其中,烷基为正丁基。281.如任一前述实施方案所述的组合物,其中,烷基为仲丁基282.如任一前述实施方案所述的组合物,其中,烷基为异丁基。283.如任一前述实施方案所述的组合物,其中,烷基为叔丁基。284.如任一前述实施方案所述的组合物,其中,烷氧基为甲氧基。285.如任一前述实施方案所述的组合物,其中,烷氧基为乙氧基。286.如任一前述实施方案所述的组合物,其中,烷氧基为正丙氧基。287.如任一前述实施方案所述的组合物,其中,烷氧基为异丙氧基。288.如任一前述实施方案所述的组合物,其中,烷氧基为正丁氧基。289.如任一前述实施方案所述的组合物,其中,烷氧基为仲丁氧基。290.如任一前述实施方案所述的组合物,其中,烷氧基为异丁氧基。291.如任一前述实施方案所述的组合物,其中,烷氧基为叔丁氧基。292.如任一前述实施方案所述的组合物,其中,卤基为f。293.如任一前述实施方案所述的组合物,其中,卤基为cl。294.如任一前述实施方案所述的组合物,其中,卤基为br。295.如任一前述实施方案所述的组合物,其中,卤基为i。296.如任一前述实施方案所述的组合物,其中,环烷基为环丙基。297.如任一前述实施方案所述的组合物,其中,环烷基为环丁基。298.如任一前述实施方案所述的组合物,其中,环烷基为环戊基。299.如任一前述实施方案所述的组合物,其中,环烷基为环己基。300.如任一前述实施方案所述的组合物,其中,芳基为苯基。301.如任一前述实施方案所述的组合物,其中,芳基为甲苯基。302.如任一前述实施方案所述的组合物,其中,芳基为二甲苯基。303.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被甲基取代。304.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被乙基取代。305.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丙基取代。306.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丙基取代。307.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丁基取代。308.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被仲丁基取代。309.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丁基取代。310.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被叔丁基取代。311.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被甲氧基取代。312.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被乙氧基取代。313.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丙氧基取代。314.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丙氧基取代。315.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被正丁氧基取代。316.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被仲丁氧基取代。317.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被异丁氧基取代。318.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被叔丁氧基取代。319.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被f取代。320.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被cl取代。321.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被br取代。322.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被i取代。323.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被环烷基取代。324.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被烯基取代。325.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被炔基取代。326.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被碳环基取代。327.如任一前述实施方案所述的组合物,其中,r1、r2a、r2b、r3a、r3b、r4、r5a、r5b、r6a、r6b、r7、r8a、r8b、r9a、r9b、r10a、r10b、r11a及r11b之一进一步被芳基取代。328.如实施方案1所述的组合物,其中,式(i)的化合物为丙戊酸或其药学上可接受的盐。329.如实施方案1所述的组合物,其中,式(i)的化合物为2-(丙-2-炔-1-基)-辛酸或其药学上可接受的盐。330.如实施方案1所述的组合物,其中,式(i)的化合物为苯基丁酸或其药学上可接受的盐。331.如实施方案1所述的组合物,其中,式(i)的化合物为亚麻油酸或其药学上可接受的盐。332.如任一前述实施方案所述的组合物,其中,式(i)的化合物为hdac抑制剂。333.药物组合物,包含胶凝剂、大于约70mg/ml的浓度的丙戊酸或其药学上可接受的盐及一种或多种耳用治疗剂。334.如任一前述实施方案所述的组合物,其中,组合物适于鼓室内注射。335.如任一前述实施方案所述的组合物,其中,胶凝剂为泊洛沙姆。336.药物组合物,包含泊洛沙姆,其中,按照wt%为至少85%的泊洛沙姆具有大于约7250da的平均分子量,以及大于70mg/ml的丙戊酸或其药学上可接受的盐。337.如任一前述实施方案所述的组合物,其中,至少85重量%的泊洛沙姆具有平均分子量为约7250至约17350da。338.如任一前述实施方案所述的组合物,其中,至少86重量%的泊洛沙姆具有平均分子量为约7250至约17350da。339.如任一前述实施方案所述的组合物,其中,至少87重量%的泊洛沙姆具有平均分子量为约7250至约17350da。340.如任一前述实施方案所述的组合物,其中,至少88重量%的泊洛沙姆具有平均分子量为约7250至约17350da。341.如任一前述实施方案所述的组合物,其中,至少89重量%的泊洛沙姆具有平均分子量为约7250至约17350da。342.如任一前述实施方案所述的组合物,其中,至少90重量%的泊洛沙姆具有平均分子量为约7250至约17350da。343.如任一前述实施方案所述的组合物,其中,至少86重量%的泊洛沙姆具有大于约7250da的平均分子量。344.如任一前述实施方案所述的组合物,其中,至少87重量%的泊洛沙姆具有大于约7250da的平均分子量。345.如任一前述实施方案所述的组合物,其中,至少88重量%的泊洛沙姆具有大于约7250da的平均分子量。346.如任一前述实施方案所述的组合物,其中,至少89重量%的泊洛沙姆具有大于约7250da的平均分子量。347.如任一前述实施方案所述的组合物,其中,至少90重量%的泊洛沙姆具有大于约7250da的平均分子量。348.如任一前述实施方案所述的组合物,其中,至少91重量%的泊洛沙姆具有大于约7250da的平均分子量。349.如任一前述实施方案所述的组合物,其中,至少92重量%的泊洛沙姆具有大于约7250da的平均分子量。350.如实施方案337至349中任一项所述的组合物,其中,泊洛沙姆具有约12,000至约12,500da的峰分子量。351.如实施方案337至350中任一项所述的组合物,其中,泊洛沙姆具有峰分子量为约11,500至约13,000da。352.如实施方案337至351中任一项所述的组合物,其中,泊洛沙姆具有约11,500至约12,000da的数量平均分子量。353.如实施方案337至352中任一项所述的组合物,其中,泊洛沙姆具有数量平均分子量为约11,000至约12,500da。354.如实施方案337至353中任一项所述的组合物,其中,泊洛沙姆具有约11,750至约12,250da的重量平均分子量。355.如实施方案337至354中任一项所述的组合物,其中,泊洛沙姆具有重量平均分子量为约11,250至约12,750da。356.如实施方案337至355中任一项所述的组合物,其中,泊洛沙姆具有约1.02的多分散性指数。357.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含纯化的泊洛沙姆。358.如任一前述实施方案所述的组合物,其中,泊洛沙姆为纯化的泊洛沙姆。359.如任一前述实施方案所述的组合物,进一步包含一种或多种耳用治疗剂。360.药物组合物,包含泊洛沙姆,其中,少于20重量%的泊洛沙姆具有小于约7250da的平均分子量,以及大于70mg/ml的丙戊酸或其药学上可接受的盐。361.如任一前述实施方案所述的组合物,其中,少于19重量%的泊洛沙姆具有小于约7250da的平均分子量。362.如任一前述实施方案所述的组合物,其中,少于18重量%的泊洛沙姆具有小于约7250da的平均分子量。363.如任一前述实施方案所述的组合物,其中,少于17重量%的泊洛沙姆具有小于约7250da的平均分子量。364.如任一前述实施方案所述的组合物,其中,少于16重量%的泊洛沙姆具有小于约7250da的平均分子量。365.如任一前述实施方案所述的组合物,其中,少于15重量%的泊洛沙姆具有小于约7250da的平均分子量。366.如任一前述实施方案所述的组合物,其中,少于14重量%的泊洛沙姆具有小于约7250da的平均分子量。367.如任一前述实施方案所述的组合物,其中,少于13重量%的泊洛沙姆具有小于约7250da的平均分子量。368.如任一前述实施方案所述的组合物,其中,少于12重量%的泊洛沙姆具有小于约7250da的平均分子量。369.如任一前述实施方案所述的组合物,其中,少于11重量%的泊洛沙姆具有小于约7250da的平均分子量。370.如任一前述实施方案所述的组合物,其中,少于1810重量%的泊洛沙姆具有小于约7250da的平均分子量。371.如任一前述实施方案所述的组合物,其中,少于179重量%的泊洛沙姆具有小于约7250da的平均分子量。372.如任一前述实施方案所述的组合物,其中,少于16重量%的泊洛沙姆具有小于约7250da的平均分子量。373.如任一前述实施方案所述的组合物,其中,少于15重量%的泊洛沙姆具有小于约7250da的平均分子量。374.如任一前述实施方案所述的组合物,其中,少于14重量%的泊洛沙姆具有小于约7250da的平均分子量。375.如任一前述实施方案所述的组合物,其中,少于13重量%的泊洛沙姆具有小于约7250da的平均分子量。376.如任一前述实施方案所述的组合物,其中,少于12重量%的泊洛沙姆具有小于约7250da的平均分子量。377.如任一前述实施方案所述的组合物,其中,少于11重量%的泊洛沙姆具有小于约7250da的平均分子量。378.如任一前述实施方案所述的组合物,其中,少于10重量%的泊洛沙姆具有小于约7250da的平均分子量。379.如任一前述实施方案所述的组合物,其中,少于9重量%的泊洛沙姆具有小于约7250da的平均分子量。380.如实施方案361至379中任一项所述的组合物,其中,泊洛沙姆具有约5,000至约5,500da的峰分子量。381.如实施方案361至380中任一项所述的组合物,其中,泊洛沙姆具有峰分子量为约4,500至约6,000da。382.如实施方案361至381中任一项所述的组合物,其中,泊洛沙姆具有约5,000至约5,500da的数量平均分子量。383.如实施方案361至382中任一项所述的组合物,其中,泊洛沙姆具有数量平均分子量为约4,500至约6,000da。384.如实施方案361至383中任一项所述的组合物,其中,泊洛沙姆具有约5,000至约5,500da的重量平均分子量。385.如实施方案361至384中任一项所述的组合物,其中,泊洛沙姆具有重量平均分子量为约4,500至约6,000da。386.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含纯化的泊洛沙姆。387.如任一前述实施方案所述的组合物,其中,泊洛沙姆为纯化的泊洛沙姆。388.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度大于约100mg/ml。389.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约100至约500mg/ml。390.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约100至约350mg/ml。391.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约110至约160mg/ml。392.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约130至约140mg/ml。393.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约125至约145mg/ml。394.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约128至约138mg/ml。395.如任一前述实施方案所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约133mg/ml。396.如任一前述实施方案所述的组合物,进一步包含超过一种耳用治疗剂。397.制备药物组合物的方法,包括下述步骤:(a)具有包含胶凝剂的水溶液;以及(b)添加一种或多种耳用治疗剂或其药学上可接受的盐的溶液。398.如实施方案397所述的方法,其中,水溶液进一步包含丙戊酸或其药学上可接受的盐到第一溶液。399.如实施方案397或398所述的方法,其中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐。400.如任一前述实施方案所述的方法,其中,一种或多种耳用治疗剂为ly2090314或其药学上可接受的盐。401.如任一前述实施方案所述的方法,其中,在步骤(b)中,溶液包含极性非质子性溶剂。402.如实施方案401所述的方法,其中,在步骤(b)中,极性非质子性溶剂包含dmso。403.如实施方案401或402所述的方法,其中,在步骤(b)中,极性非质子性溶剂为dmso。404.如实施方案401所述的方法,其中,在步骤(b)中,极性非质子性溶剂包含二甲基甲酰胺。405.如实施方案401所述的方法,其中,在步骤(b)中,极性非质子性溶剂包含二甲基乙酰胺。406.如实施方案401所述的方法,其中,在步骤(b)中,极性非质子性溶剂包含n-甲基-2-吡咯烷酮。407.如任一前述实施方案所述的方法,其中,胶凝剂包含泊洛沙姆。408.包含胶凝剂及一种或多种耳用治疗剂的冻干药物组合物,其中,在组合物不包含额外的增积剂。409.包含泊洛沙姆及一种或多种耳用剂的冻干药物组合物,其中,在组合物不包含抗氧化剂。410.如任一前述实施方案所述的组合物,其中,式(i)的化合物为丙戊酸或其药学上可接受的盐。411.如任一前述实施方案所述的组合物,进一步包含式(i)的化合物或其药学上可接受的盐。412.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括丙戊酸或其药学上可接受的盐。413.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。414.如任一前述实施方案所述的组合物,进一步包含一种或多种耳用治疗剂。415.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包含gsk3抑制剂。416.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包含hdac抑制剂。417.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括chir99021。418.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为少于约10mg/ml。419.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为少于约7.5mg/ml。420.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为约3至约7mg/ml。421.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为约4至约6mg/ml。422.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为约1至约5mg/ml。423.如任一前述实施方案权利要求实施方案所述的组合物,其中,chir99021或其药学上可接受的盐的浓度为约2至约4mg/ml。424.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。425.如任一前述实施方案所述的组合物,进一步包含额外的耳用治疗剂。426.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括ly2090314或其药学上可接受的盐。427.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括azd1080或其药学上可接受的盐。428.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括gsk3xxii或其药学上可接受的盐。429.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括化合物i-7或其药学上可接受的盐。430.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂包括化合物i-1或其药学上可接受的盐。431.如任一前述实施方案所述的组合物,其中,胶凝剂包含热可逆胶凝剂。432.如任一前述实施方案所述的组合物,其中,热可逆胶凝剂包含玻糖醛酸钠。433.如任一前述实施方案所述的组合物,其中,热可逆胶凝剂包含纤维素衍生物。434.如任一前述实施方案所述的组合物,其中,热可逆胶凝剂包含泊洛沙姆。435.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物。436.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少50%聚环氧乙烷。437.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少55%聚环氧乙烷。438.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少60%聚环氧乙烷。439.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少65%聚环氧乙烷。440.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少66%聚环氧乙烷。441.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少67%聚环氧乙烷。442.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少68%聚环氧乙烷。443.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少69%聚环氧乙烷。444.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计至少70%聚环氧乙烷。445.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计60至80%聚环氧乙烷。446.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含按分子质量计65至75%聚环氧乙烷。447.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含:其中a为2至130且b为15至70。448.如任一前述实施方案所述的组合物,其中,a为10至120。449.如任一前述实施方案所述的组合物,其中,a为20至120。450.如任一前述实施方案所述的组合物,其中,a为30至120。451.如任一前述实施方案所述的组合物,其中,a为40至120。452.如任一前述实施方案所述的组合物,其中,a为50至120。453.如任一前述实施方案所述的组合物,其中,a为60至120。454.如任一前述实施方案所述的组合物,其中,a为70至120。455.如任一前述实施方案所述的组合物,其中,a为80至120。456.如任一前述实施方案所述的组合物,其中,a为90至120。457.如任一前述实施方案所述的组合物,其中,a为100至120。458.如任一前述实施方案所述的组合物,其中,a为110至120。459.如任一前述实施方案所述的组合物,其中,a为10至110。460.如任一前述实施方案所述的组合物,其中,a为20至110。461.如任一前述实施方案所述的组合物,其中,a为30至110。462.如任一前述实施方案所述的组合物,其中,a为40至110。463.如任一前述实施方案所述的组合物,其中,a为50至110。464.如任一前述实施方案所述的组合物,其中,a为60至110。465.如任一前述实施方案所述的组合物,其中,a为70至110。466.如任一前述实施方案所述的组合物,其中,a为80至110。467.如任一前述实施方案所述的组合物,其中,a为90至110。468.如任一前述实施方案所述的组合物,其中,a为100至110。469.如任一前述实施方案所述的组合物,其中,a为10至100。470.如任一前述实施方案所述的组合物,其中,a为20至100。471.如任一前述实施方案所述的组合物,其中,a为30至100。472.如任一前述实施方案所述的组合物,其中,a为40至100。473.如任一前述实施方案所述的组合物,其中,a为50至100。474.如任一前述实施方案所述的组合物,其中,a为60至100。475.如任一前述实施方案所述的组合物,其中,a为70至100。476.如任一前述实施方案所述的组合物,其中,a为80至100。477.如任一前述实施方案所述的组合物,其中,a为90至100。478.如任一前述实施方案所述的组合物,其中,a为95至105。479.如任一前述实施方案所述的组合物,其中,a为95至115。480.如任一前述实施方案所述的组合物,其中,a为85至105。481.如任一前述实施方案所述的组合物,其中,a为85至115。482.如任一前述实施方案所述的组合物,其中,b为25至70。483.如任一前述实施方案所述的组合物,其中,b为35至70。484.如任一前述实施方案所述的组合物,其中,b为45至70。485.如任一前述实施方案所述的组合物,其中,b为55至70。486.如任一前述实施方案所述的组合物,其中,b为60至70。487.如任一前述实施方案所述的组合物,其中,b为65至70。488.如任一前述实施方案所述的组合物,其中,b为56+/-10%,且各a为101+/-10%。489.如任一前述实施方案所述的组合物,其中,b为61+/-15%,且各a为101+/-10%。490.如任一前述实施方案所述的组合物,其中,b为70+/-20%,且各a为101+/-20%。491.如任一前述实施方案所述的组合物,其中,b为56+/-10%,且各a为100+/-10%。492.如任一前述实施方案所述的组合物,其中,b为61+/-15%,且各a为100+/-10%。493.如任一前述实施方案所述的组合物,其中,b为70+/-20%,且各a为100+/-10%。494.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约7250至约17350道尔顿。495.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约8000至约17000道尔顿。496.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约8000至约16000道尔顿。497.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约9000至约16000道尔顿。498.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约9000至约15000道尔顿。499.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约9800至约14600道尔顿。500.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约10000至约14000道尔顿。501.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约10500至约14000道尔顿。502.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约10500至约13500道尔顿。503.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约11000至约14000道尔顿。504.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约11000至约13500道尔顿。505.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约11500至约14000道尔顿。506.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约11500至约13000道尔顿。507.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约12000至约14000道尔顿。508.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有平均分子量为约12000至约13000道尔顿。509.如任一前述实施方案所述的组合物,其中,平均分子量为数量平均分子量。510.如任一前述实施方案所述的组合物,其中,平均分子量为重量平均分子量。511.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含泊洛沙姆407。512.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少10重量%的泊洛沙姆。513.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少20重量%的泊洛沙姆。514.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少30重量%的泊洛沙姆。515.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少40重量%的泊洛沙姆。516.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少50重量%的泊洛沙姆。517.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少60重量%的泊洛沙姆。518.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少70重量%的泊洛沙姆。519.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少75重量%的泊洛沙姆。520.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少80重量%的泊洛沙姆。521.如任一前述实施方案所述的组合物,其中,泊洛沙姆407为至少90重量%的泊洛沙姆。522.如任一前述实施方案所述的组合物,其中,泊洛沙姆为泊洛沙姆407。523.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂不包括chir99021或其药学上可接受的盐。524.如任一前述实施方案所述的组合物,其中,一种或多种耳用治疗剂不包括丙戊酸或其药学上可接受的盐。525.如任一前述实施方案所述的组合物,其中,组合物不包含增积剂。526.如任一前述实施方案所述的组合物,其中,组合物不包含抗氧化剂。527.如任一前述实施方案所述的组合物,其中,组合物不包含低温保护剂。528.如任一前述实施方案所述的组合物,其中,chir99021或其药学上可接受的盐在组合物中的溶解度通过助溶剂增强。529.如实施方案528所述的组合物,其中,助溶剂为dmso。530.如实施方案528所述的组合物,其中,助溶剂为12-羟基硬酯酸的聚氧乙烯酯。531.如实施方案528所述的组合物,其中,助溶剂为托可索仑(tocofersolan)。532.如实施方案528所述的组合物,其中,助溶剂为胆盐。533.如实施方案528所述的组合物,其中,胆盐为去氧胆酸钠。534.如实施方案528所述的组合物,其中,助溶剂为聚氧乙烯蓖麻油衍生物。535.如实施方案534所述的组合物,其中,聚氧乙烯蓖麻油衍生物为peg-35蓖麻油。536.如实施方案528所述的组合物,其中,助溶剂为中长链甘油三酯。537.如实施方案536所述的组合物,其中,中长链甘油三酯系衍生自己酸。538.如实施方案536所述的组合物,其中,中长链甘油三酯系衍生自月桂酸。539.如任一前述实施方案所述的组合物,其中,药物组合物为冻干药物组合物。540.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约2%至约50%w/v。541.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约2%至约40%w/v。542.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约2%至约30%w/v。543.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约2%至约20%w/v。544.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约10%至约20%w/v。545.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约12.5%至约17.5%w/v。546.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约13%至约17.5%w/v。547.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约13%至约17%w/v。548.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约13.5%至约17%w/v。549.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约13.5%至约16.5%w/v。550.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约14%至约16.5%w/v。551.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约14%至约16%w/v。552.如任一前述实施方案所述的组合物,其中,泊洛沙姆的浓度为约15%至约17.5%w/v。553.如任一前述实施方案所述的组合物或方法,其中,在组合物中,泊洛沙姆分布具有约10,800至约11,200da的数量平均分子量。554.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有数量平均分子量为约10,600至约11,400da。555.如任一前述实施方案所述的组合物,其中,在组合物中,泊洛沙姆分布具有约11,500至约11,700da的重量平均分子量。556.如任一前述实施方案所述的组合物或方法,其中,在组合物中,泊洛沙姆分布为从0至约16,600da。557.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有重量平均分子量为约11,300至约11,900da。558.如任一前述实施方案所述的组合物,其中,泊洛沙姆具有多分散性指数为约少于1.07。559.如任一前述实施方案所述的组合物,其中,泊洛沙姆为从0至约16,600da。560.如任一前述实施方案所述的组合物,其中,泊洛沙姆包含纯化的泊洛沙姆。561.如任一前述实施方案所述的组合物,其中,泊洛沙姆为纯化的泊洛沙姆。562.如任一前述实施方案所述的组合物,其中,纯化的泊洛沙姆通过液液萃取制备。563.如任一前述实施方案所述的组合物,其中,纯化的泊洛沙姆通过尺寸排阻色谱法制备。564.如任一前述实施方案所述的组合物,其中,组合物进一步包含二甲基亚砜(dmso)。565.如任一前述实施方案所述的组合物,其中,dmso的浓度为少于约25重量%。566.如任一前述实施方案所述的组合物,其中,dmso的浓度为约15至约25重量%。567.如任一前述实施方案所述的组合物,其中,dmso的浓度为少于约20重量%。568.如任一前述实施方案所述的组合物,其中,dmso的浓度为约10至约20重量%。569.如任一前述实施方案所述的组合物,其中,dmso的浓度为少于约15重量%。570.如任一前述实施方案所述的组合物,其中,dmso的浓度为约5至约15重量%。571.如任一前述实施方案所述的组合物,dmso的浓度为少于约10重量%。572.如任一前述实施方案所述的组合物,其中,dmso的浓度为约5至约10重量%。573.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。574.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钾。575.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸锂。576.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钙。577.如任一前述实施方案所述的组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸镁。578.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为热可逆凝胶。579.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约20℃至约40℃的凝胶。580.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约25℃至约40℃的凝胶。581.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约30℃至约40℃的凝胶。582.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆在约35℃至约40℃形成凝胶。583.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约37℃的凝胶。584.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约体温的凝胶。585.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆为在约体温的不动凝胶。586.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有粘度大于约1×106mpa.s。587.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有粘度为约1.0至约5.0×106mpa.s。588.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有粘度为约2.0至约5.0×106mpa.s。589.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有粘度为约2.0至约4.0×106mpa.s。590.如任一前述实施方案所述的组合物或方法,其中,泊洛沙姆具有粘度为约3.0至约4.0×106mpa.s。591.如任一前述实施方案所述的冻干组合物,其包含约0.01至约2重量%chir99021。592.如任一前述实施方案所述的冻干组合物,包含至少约30重量%丙戊酸或其药学上可接受的盐。593.如任一前述实施方案所述的冻干组合物,其包含约1至约2重量%chir99021。594.如任一前述实施方案所述的冻干组合物,其中,组合物包含至少约40重量%丙戊酸或其药学上可接受的盐。595.如任一前述实施方案所述的冻干组合物,其中,组合物包含至少约50重量%丙戊酸或其药学上可接受的盐。596.如任一前述实施方案所述的冻干组合物,其中,组合物包含约30至约50重量%丙戊酸或其药学上可接受的盐。597.如任一前述实施方案所述的冻干组合物,其中,组合物包含至少约50重量%泊洛沙姆。598.如任一前述实施方案所述的冻干组合物,其中,组合物包含至少约60重量%泊洛沙姆。599.如任一前述实施方案所述的冻干组合物,其中,组合物包含约50至约70重量%泊洛沙姆。600.如任一前述实施方案所述的冻干组合物,其中,冻干药物组合物包含约50至约500mg的泊洛沙姆及约50至约500mg的式(i)的化合物,例如,丙戊酸或其药学上可接受的盐。601.如任一前述实施方案所述的冻干组合物,其中,冻干药物组合物包含约50至约500mg的泊洛沙姆及约50至约500mg的丙戊酸或其药学上可接受的盐。602.如任一前述实施方案所述的冻干组合物,其包含约50至约300mg的丙戊酸或其药学上可接受的盐。603.如任一前述实施方案所述的冻干组合物,其包含约50至约200mg的丙戊酸或其药学上可接受的盐。604.如任一前述实施方案所述的冻干组合物,其包含约50至约150mg的丙戊酸或其药学上可接受的盐。605.如任一前述实施方案所述的冻干组合物,其包含约100至约500mg的丙戊酸或其药学上可接受的盐。606.如任一前述实施方案所述的冻干组合物,其包含约100至约300mg的丙戊酸或其药学上可接受的盐。607.如任一前述实施方案所述的冻干组合物,其包含约100至约200mg的丙戊酸或其药学上可接受的盐。608.如任一前述实施方案所述的冻干组合物,其包含约100至约150mg的丙戊酸或其药学上可接受的盐。609.如任一前述实施方案所述的冻干组合物,其包含约50至约300mg的泊洛沙姆。610.如任一前述实施方案所述的冻干组合物,其包含约50至约200mg的泊洛沙姆。611.如任一前述实施方案所述的冻干组合物,其包含约50至约150mg的泊洛沙姆。612.如任一前述实施方案所述的冻干组合物,其包含约100至约500mg的泊洛沙姆。613.如任一前述实施方案所述的冻干组合物,其包含约100至约300mg的泊洛沙姆。614.如任一前述实施方案所述的冻干组合物,其包含约100至约200mg的泊洛沙姆。615.如任一前述实施方案所述的冻干组合物,其包含约100至约150mg的泊洛沙姆。616.如任一前述实施方案所述的冻干组合物,其中,组合物包含约0.01至约1.5至约2重量%chir99021、约42.5至约47.5重量%丙戊酸钠,且剩余重量百分比为泊洛沙姆407。617.如任一前述实施方案所述的冻干组合物,其中,泊洛沙姆包含泊洛沙姆407。618.如任一前述实施方案所述的冻干组合物,其中,泊洛沙姆为泊洛沙姆407。619.如任一前述实施方案所述的冻干组合物,其中,泊洛沙姆为纯化的泊洛沙姆。620.如任一前述实施方案所述的冻干组合物,其中,组合物基本上无水及/或dmso。621.如任一前述实施方案所述的冻干组合物,其中,组合物包含少于约5重量%的水及/或dmso。622.如任一前述实施方案所述的冻干组合物,其中,组合物包含少于约4重量%的水及/或dmso。623.如任一前述实施方案所述的冻干组合物,其中,组合物包含少于约3重量%的水及/或dmso。624.如任一前述实施方案所述的冻干组合物,其中,组合物包含少于约2重量%的水及/或dmso。625.如任一前述实施方案所述的冻干组合物,其中,组合物包含少于约1重量%的水及/或dmso。626.冻干药物组合物,包含一种或多种耳用治疗剂及胶凝剂。627.如任一前述实施方案所述的冻干药物组合物,其中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。628.如任一前述实施方案所述的冻干药物组合物,其中,一种或多种耳用治疗剂为一种或多种与听觉损失相关的生物路径与生物标靶的调节剂。629.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自由下列组成的组:wnt路径激动剂、组蛋白去乙酰酶(hdac)抑制剂、dkk1抑制剂、axin抑制剂、sfrp1抑制剂、骨形态发生蛋白(bmp)抑制剂、β-连环蛋白激动剂、周期蛋白d1活化剂、rest辅阻遏物1(corest)抑制剂、notch激动剂、tgf-β抑制剂、camp反应元件结合蛋白质(creb)活化剂、周期蛋白依赖型激酶(cdk)活化剂、cdk抑制剂、pi3k-akt活化剂、pi3k-akt抑制剂、pten抑制剂、atoh1激动剂、atoh1拮抗剂、pou4f3激动剂、pou4f3拮抗剂、gfi1激动剂、gfi1拮抗剂、erk/mapk激动剂、erk/mapk拮抗剂、fgf激动剂、fgf拮抗剂、γ-氨基丁酸(gabas)、电位闸控na+通道拮抗剂、肌醇、pkc激动剂、pkc拮抗剂、foxo抑制剂、foxo激动剂、kv3通道拮抗剂、p27kip1抑制剂、il-1β、n-甲基-d-天门冬氨酸盐(nmda)受体拮抗剂、nadph醌氧化还原酶1、γ分泌酶抑制剂、γ分泌酶活化剂、nk1受体拮抗剂、nk1受体激动剂、ampa受体激动剂、ampa受体拮抗剂、toll样受体(tlr)激动剂、toll样受体(tlr)拮抗剂、组织胺h4受体激动剂、h4受体拮抗剂、5-ht3受体激动剂、5-ht3受体拮抗剂、oct4活化剂、sox2活化剂、sox17诱导物、klf4诱导物、cmyc活化剂、音猬因子激动剂、音猬因子拮抗剂、表皮生长因子(egf)、胰岛素样生长因子(igf)、血管内皮生长因子(vegf)、内皮氧化氮合成酶(enos)、前列腺素e(pge)、脑源性神经营养因子(bdnf)、smad抑制剂、sall4诱导物、gata4诱导物、gata6诱导物、蛋白酶体抑制剂、视黄酸受体激动剂、mtor抑制剂、mtor活化剂、抗坏血酸、2-磷酸-l-抗坏血酸、kdm抑制剂、ttnpb、神经营养素3、dna-修饰酶、lsd-1抑制剂、烟酰胺、sirtuin、组蛋白甲基转移酶抑制剂、组蛋白去甲基化酶抑制剂、组蛋白赖氨酸甲基转移酶抑制剂、dnmt抑制剂、p53抑制剂、p21抑制剂、ampk活化剂、hippo活化剂、hippo抑制剂、yap/taz抑制剂、mst1/2抑制剂、ck1活化剂、ck1抑制剂、头发生素、r-spondin1、bet活化剂、sirt1活化剂、sirt1抑制剂、sirt2活化剂、sirt2抑制剂、sirt3活化剂、sirt3抑制剂、jmjd3抑制剂、dmnt抑制剂、stat3抑制剂、lsd1抑制剂、活性前列腺素、camp活化剂、氧化磷酸化解偶联剂、精氨酸甲基转移酶抑制剂、alk4抑制剂、过氧化物酶体增殖物活化受体γ活化剂、egfr抑制剂、shh抑制剂、vitd活化剂、dot1l抑制剂、甲状腺激素、e盒依赖性转录活化剂及蛋白质降解抑制剂。630.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自gsk3-β路径激动剂。631.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自:wnt路径激动剂、组蛋白去乙酰酶(hdac)抑制剂。632.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂为发细胞再生剂及/或耳保护剂。633.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自由下列组成的组:表1至13中所述的剂及其药物盐。634.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂选自由下列组成的组:表14至25中所述的剂及其药物盐。635.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。636.如前述实施方案中任一项所述的冻干药物组合物,其中,一种或多种耳用治疗剂为ly2090314或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。637.如任一前述实施方案所述的冻干药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。638.如任一前述实施方案所述的冻干药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐。639.如任一前述实施方案所述的冻干药物组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。640.如前述实施方案中任一项所述的冻干药物组合物,其中,胶凝剂为热可逆胶凝剂。641.如实施方案640所述的冻干药物组合物,其中,热可逆胶凝剂包含泊洛沙姆。642.如实施方案642所述的冻干药物组合物,其中,泊洛沙姆选自由下列组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403及泊洛沙姆407;任选地,泊洛沙姆为泊洛沙姆188或泊洛沙姆407;以及任选地,泊洛沙姆为泊洛沙姆407。643.如实施方案642所述的组合物,其中,泊洛沙姆为泊洛沙姆407。644.如实施方案642所述的组合物,其中,泊洛沙姆为泊洛沙姆188。645.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约9kda或更大。646.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约9.2kda或更大。647.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约9.4kda或更大。648.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约9.6kda或更大。649.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约9.8kda或更大。650.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约10kda或更大。651.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约10.2kda或更大。652.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约10.4kda或更大。653.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约10.6kda或更大。654.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约10.8kda或更大。655.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约11kda或更大。656.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约11.2kda或更大。657.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约11.4kda或更大。658.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约11.6kda或更大。659.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约11.8kda或更大。660.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约12kda或更大。661.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆407具有平均分子量为约12.1kda或更大。662.如前述实施方案中任一项所述的冻干药物组合物,其中,泊洛沙姆为纯化的泊洛沙姆;任选地,泊洛沙姆为纯化的泊洛沙姆407。663.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆为纯化的泊洛沙姆407。664.如前述实施方案中任一项所述的组合物,其中,泊洛沙姆为纯化的泊洛沙姆188。665.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。666.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大。667.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9.2kda或更大。668.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9.4kda或更大。669.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9.6kda或更大。670.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约9.8kda或更大。671.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约10kda或更大。672.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约10.2kda或更大。673.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约10.4kda或更大。674.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约10.6kda或更大。675.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约10.8kda或更大。676.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约11kda或更大。677.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约11.2kda或更大。678.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约11.4kda或更大。679.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约11.6kda或更大。680.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约11.8kda或更大。681.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约12kda或更大。682.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407具有平均分子量为约12.1kda或更大。683.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407系通过液液萃取或尺寸排阻色谱法制备。684.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407系通过液液萃取制备。685.如前述实施方案中任一项所述的冻干药物组合物,其中,纯化的泊洛沙姆407系通过尺寸排阻色谱法制备。686.如前述实施方案中任一项所述的冻干药物组合物,其中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。687.如前述实施方案中任一项所述的冻干药物组合物,其中,约10%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。688.如前述实施方案中任一项所述的冻干药物组合物,其中,约20%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。689.如前述实施方案中任一项所述的冻干药物组合物,其中,约30%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。690.如前述实施方案中任一项所述的冻干药物组合物,其中,约40%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。691.如前述实施方案中任一项所述的冻干药物组合物,其中,约50%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。692.如前述实施方案中任一项所述的冻干药物组合物,其中,约60%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。693.如前述实施方案中任一项所述的冻干药物组合物,其中,约70%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。694.如前述实施方案中任一项所述的冻干药物组合物,其中,约80%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。695.如前述实施方案中任一项所述的冻干药物组合物,其中,约90%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。696.如前述实施方案中任一项所述的冻干药物组合物,其中,约95%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。697.如前述实施方案中任一项所述的冻干药物组合物,其中,约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。698.如前述实施方案中任一项所述的冻干药物组合物,呈冻干饼的形式。699.如前述实施方案中任一项所述的冻干药物组合物,相较于包含一种或多种溶剂的可比拟的药物组合物对氧及/或光具有较高稳定性。700.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。701.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约10000百万分点(ppm)。702.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约1000ppm。703.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约100ppm。704.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约10ppm。705.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约1ppm。706.如前述实施方案中任一项所述的冻干药物组合物,其中,存在于冻干药物组合物中的杂质量为少于约0.1ppm。707.如前述实施方案中任一项所述的冻干药物组合物,其中,杂质为残余溶剂。708.如前述实施方案中任一项所述的冻干药物组合物,其中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。709.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约1、约2、约3、约4、约5或约10ppm(μg/g)。710.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约10ppm(μg/g)。711.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约5ppm(μg/g)。712.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约4ppm(μg/g)。713.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约3ppm(μg/g)。714.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约2ppm(μg/g)。715.如任一前述实施方案所述的冻干药物组合物,其中,醛的浓度为少于约1ppm(μg/g)。716.如任一前述实施方案所述的冻干药物组合物,其中,醛为挥发性醛。717.如任一前述实施方案所述的组合物,其中,醛选自下列组:甲醛、乙醛及/或丙醛。718.如任一前述实施方案所述的冻干药物组合物,其中,醛包含甲醛、乙醛及/或丙醛。719.如任一前述实施方案所述的冻干药物组合物,其中,醛包含甲醛。720.如任一前述实施方案所述的冻干药物组合物,其中,醛包含乙醛。721.如任一前述实施方案所述的冻干药物组合物,其中,醛包含丙醛。722.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。723.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约3%。724.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约2%。725.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约1%。726.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约0.5%。727.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中的聚环氧乙烷量为低于约0.1%。728.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。729.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%。730.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约25%至约29%。731.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约20%至约25%。732.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约15%至约19%。733.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约10%至约14%。734.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约5%至约9%。735.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有clogp为约1或更少的一种或多种杂质的总量为从约0%至约4%。736.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。737.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%。738.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约30%至约34%。739.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约25%至约29%。740.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约20%至约25%。741.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约15%至约19%。742.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约10%至约14%。743.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约5%至约9%。744.如前述实施方案中任一项所述的冻干药物组合物,其中,如通过高效液相色谱术(hplc)所测量,存在于冻干药物组合物中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约0%至约4%。745.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2。5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。746.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约1.5倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。747.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约1.8倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。748.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约2倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。749.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约2.5倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。750.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约3倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。751.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约5倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。752.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,存在于冻干药物组合物中的一种或多种耳用治疗剂的量为约10倍或更高;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。753.如前述实施方案中任一项所述的冻干药物组合物,其中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。754.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。755.实施方案97的冻干药物组合物,其中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。756.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有较低胶凝温度。757.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有较高粘度。758.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有较低胶凝温度、较窄胶凝温度范围及/或较高粘度;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。759.如实施方案758所述的冻干药物组合物,其中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。760.如前述实施方案中任一项所述的冻干药物组合物,其中,冻干药物组合物包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的冻干药物组合物,冻干药物组合物具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。761.重构冻干药物组合物的方法,包括将如任一前述权利要求书的冻干药物组合物溶解于稀释剂。762.如实施方案761所述的方法,其中,组合物在少于约1小时溶解于稀释剂。763.如实施方案761或762所述的方法,其中,组合物在少于约30分钟溶解于稀释剂。764.如实施方案761至763所述的方法,其中,稀释剂包含水。765.重构的药物组合物,通过实施方案761至764所述的方法获得。766.重构的药物组合物,包含如任一前述实施方案所述的冻干药物组合物及稀释剂。767.如实施方案766所述的组合物,其中,将冻干药物组合物溶解于稀释剂。768.如前述实施方案中任一项所述的冻干药物组合物,适于通过重构方法制备重构溶液。769.如前述实施方案中任一项所述的冻干药物组合物,其中,重构方法为少于约1小时。770.如前述实施方案中任一项所述的冻干药物组合物,其中,重构方法为少于约45分钟。771.如前述实施方案中任一项所述的冻干药物组合物,其中,重构方法为少于约30分钟。772.如前述实施方案中任一项所述的冻干药物组合物,其中,重构方法为少于约15分钟。773.如前述实施方案中任一项所述的冻干药物组合物,其中,重构方法为少于约10分钟。774.如前述实施方案中任一项所述的冻干药物组合物,其中,重构溶液适于注射;任选地,重构溶液适于鼓室内注射。775.如实施方案774所述的冻干药物组合物,其中,重构的组合物适于注射。776.如实施方案774或775所述的冻干药物组合物,其中,重构的组合物适于鼓室内注射。777.如前述实施方案中任一项所述的冻干药物组合物,其中,重构溶液维持用于制备冻干药物组合物的预冻干溶液的一种或多种流变性质。778.如前述实施方案中任一项所述的冻干药物组合物,其中,相较于从无纯化的泊洛沙姆407的可比拟的冻干药物组合物所制备的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。779.如实施方案778所述的冻干药物组合物,其中,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。780.如前述实施方案中任一项所述的冻干药物组合物,用于治疗有其需要的受试者中的听觉损失。781.如前述实施方案中任一项所述的冻干药物组合物的用途,用于制备用于治疗有其需要的受试者中的听觉损失的重构溶液。782.治疗听觉损失的方法,包括向有其需要的受试者施用药学上可接受量的重构溶液,其中,重构溶液通过重构方法使用如前述实施方案中任一项所述的冻干药物组合物而制备。783.重构冻干药物组合物的方法,方法包括:(a)提供如任一前述实施方案所述的冻干药物组合物;(b)以药学上可接受的稀释剂重构冻干药物组合物;以及(c)获得重构的药物组合物。784.如实施方案783所述的方法,其中,重构冻干药物组合物包含溶解冻干药物组合物于药学上可接受的稀释剂。785.如实施方案783或784所述的方法,其中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约1小时。786.如任一前述实施方案所述的方法,其中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约45分钟。787.如任一前述实施方案所述的方法,其中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约30分钟。788.如任一前述实施方案所述的方法,其中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约15分钟。789.如任一前述实施方案所述的方法,其中,溶解冻干药物组合物于药学上可接受的稀释剂花费少于约10分钟。790.重构的药物组合物,通过如实施方案783所述的方法获得。791.重构的药物组合物,包含如任一前述实施方案所述的冻干组合物及稀释剂。792.如实施方案791所述的重构的药物组合物,其中,组合物在少于约1小时重构。793.如实施方案791或792所述的重构的药物组合物,其中,组合物在少于约45分钟重构。794.如任一前述实施方案所述的重构的药物组合物,其中,组合物在少于约30分钟重构。795.如任一前述实施方案所述的重构的药物组合物,其中,组合物在少于约15分钟重构。796.如任一前述实施方案所述的重构的药物组合物,其中,组合物在少于约10分钟重构。797.药物组合物,包含:chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在。798.如实施方案797所述的药物组合物,进一步包含:丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在。799.如实施方案797或798所述的药物组合物,进一步包含:泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在。800.如任一前述实施方案所述的药物组合物,进一步包含:二甲基亚砜(dmso),以浓度低于20wt%存在。801.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。802.如实施方案801所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。803.如实施方案802所述的药物组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。804.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约1.45mg/ml至约1.65mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。805.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml。806.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.25mg/ml至约2.5mg/ml。807.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约1.75mg/ml。808.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约1.45mg/ml至约1.65mg/ml。809.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。810.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约43mg/ml至约46mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml。811.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml。812.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约100mg/ml。813.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约15mg/ml至约50mg/ml。814.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约43mg/ml至约46mg/ml。815.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml。816.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约100mg/ml。817.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约110mg/ml。818.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约120mg/ml。819.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约125mg/ml。820.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约130mg/ml。821.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约100至约500mg/ml。822.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约100至约350mg/ml。823.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约110至约140mg/ml。824.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约120至约150mg/ml。825.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约120至约140mg/ml。826.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约125至约150mg/ml。827.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约125至约140mg/ml。828.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约125至约135mg/ml。829.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约70mg/ml。830.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约75mg/ml。831.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度为至少约80mg/ml。832.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约70mg/ml至约90mg/ml。833.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约75mg/ml至约95mg/ml。834.如前述实施方案中任一项所述的组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约75mg/ml至约85mg/ml。835.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约8wt%。836.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%。837.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约5wt%至约11wt%。838.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约6wt%至约10wt%。839.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%。840.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约8wt%。841.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%;任选地,dmso的浓度为约2.5wt%。842.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约25wt%。843.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约20wt%。844.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约15wt%。845.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约10wt%。846.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%。847.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1wt%至约4wt%。848.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1.5wt%至约3.5wt%。849.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%。850.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约2.5wt%。851.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。852.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。853.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50。854.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。855.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。856.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。857.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。858.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。859.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。860.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。861.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1。862.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2.5:1至约3.5:1。863.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。864.如前述实施方案中任一项所述的药物组合物,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。865.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.02:1。866.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及dmso之间的重量比为约0.06:1。867.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1。868.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。869.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约1.45mg/ml至约1.65mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约43mg/ml至约46mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。870.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约1.45mg/ml至约1.65mg/ml。871.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约43mg/ml至约46mg/ml。872.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%。873.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%。874.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约1.55mg/ml;丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml;泊洛沙姆407的浓度为约8wt%;以及dmso的浓度为约2.5wt%。875.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。876.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约44.5mg/ml。877.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约8wt%。878.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约2.5wt%。879.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。880.如任一前述实施方案所述的药物组合物,包含丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约500mg/ml的浓度存在。881.如实施方案879或880所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。882.如实施方案881所述的药物组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。883.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约1.45mg/ml至约1.65mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约1.55mg/ml。884.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约10mg/ml。885.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.25mg/ml至约2.5mg/ml。886.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约1.75mg/ml。887.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.85mg/ml至约1.15mg/ml;888.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度为约1.05mg/ml。889.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml、从约28mg/ml至约31mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml。890.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml。891.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约100mg/ml。892.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约15mg/ml至约50mg/ml、从约28mg/ml至约31mg/ml。893.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml。894.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约11wt%至约10wt%、从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约7.5wt%。895.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%。896.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约5wt%至约11wt%。897.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约11wt%至约10wt%。898.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%899.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约7.5wt%。900.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%、从约2wt%至约3wt%;任选地,dmso的浓度为约2.5wt%。901.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%。902.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1wt%至约4wt%。903.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1.5wt%至约3.5wt%。904.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%;905.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约2.5wt%。906.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。907.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。908.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50909.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。910.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。911.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。912.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。913.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。914.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。915.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。916.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1、从约2.5:1至约3.5:1。917.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。918.如前述实施方案中任一项所述的药物组合物,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。919.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.016:1920.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及dmso之间的重量比为约0.06:1。921.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1。922.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。923.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约0.95mg/ml至约1.15mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约28mg/ml至约31mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。924.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.95mg/ml至约1.15mg/ml。925.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约28mg/ml至约31mg/ml。926.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;927.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%。928.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约1.05mg/ml;丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。929.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度为约1.05mg/ml。930.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约29.5mg/ml。931.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约7.5wt%。932.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约2.5wt%。933.药物组合物,包含:i)chir99021或其药学上可接受的盐,以范围从0.025mg/ml至约25mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从0.5mg/ml至约500mg/ml的浓度存在;iii)泊洛沙姆407,以范围从1wt%至约25wt%的浓度存在;以及iv)二甲基亚砜(dmso),以浓度低于7.5wt%存在。934.如实施方案933所述的药物组合物,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。935.如实施方案934所述的药物组合物,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。936.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml、从约0.25mg/ml至约2.5mg/ml、从约0.5mg/ml至约1.75mg/ml或从约0.6mg/ml至约0.75mg/ml;任选地,chir99021或其药学上可接受的盐的浓度范围为约0.7mg/ml。937.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.05mg/ml至约5mg/ml。938.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.25mg/ml至约2.5mg/ml。939.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约1.75mg/ml。940.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.6mg/ml至约0.75mg/ml。941.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围为约0.7mg/ml。942.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml、从约5mg/ml至约100mg/ml、从约15mg/ml至约50mg/ml或从约18mg/ml至约21mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml。943.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约2.5mg/ml至约200mg/ml。944.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约100mg/ml。945.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约15mg/ml至约50mg/ml。946.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约18mg/ml至约21mg/ml。947.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml。948.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%、从约5wt%至约11wt%、从约6wt%至约10wt%或从约7wt%至约8.5wt%;任选地,泊洛沙姆407的浓度为约7.5wt%。949.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约2.5wt%至约12.5wt%。950.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约5wt%至约11wt%。951.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约6wt%至约10wt%。952.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%。953.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约7.5wt%。954.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%、从约1wt%至约4wt%、从约1.5wt%至约3.5wt%或从约2wt%至约3wt%;任选地,dmso的浓度为约5wt%。955.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约0.5wt%至约5wt%。956.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1wt%至约4wt%。957.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约1.5wt%至约3.5wt%。958.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%。959.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约5wt%。960.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。961.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。962.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50。963.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。964.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。965.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。966.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。967.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。968.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。969.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。970.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1。971.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2.5:1至约3.5:1。972.如前述实施方案中任一项所述的药物组合物,其中:介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。973.如前述实施方案中任一项所述的药物组合物,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。974.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.013:1。975.如前述实施方案中任一项所述的药物组合物,其中,介于chir99021及dmso之间的重量比为约0.06:1。976.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1。977.如前述实施方案中任一项所述的药物组合物,其中,介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。978.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度范围从约0.6mg/ml至约0.75mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约18mg/ml至约21mg/ml;泊洛沙姆407的浓度范围从约7wt%至约8.5wt%;以及dmso的浓度范围从约2wt%至约3wt%。979.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度范围从约0.6mg/ml至约0.75mg/ml。980.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度范围从约18mg/ml至约21mg/ml。981.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度范围从约7wt%至约8.5wt%。982.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度范围从约2wt%至约3wt%。983.如前述实施方案中任一项所述的药物组合物,其中:chir99021或其药学上可接受的盐的浓度为约0.7mg/ml;丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml;泊洛沙姆407的浓度为约7.5wt%;以及dmso的浓度为约2.5wt%。984.如前述实施方案中任一项所述的药物组合物,其中,chir99021或其药学上可接受的盐的浓度为约0.7mg/ml。985.如前述实施方案中任一项所述的药物组合物,其中,丙戊酸或其药学上可接受的盐的浓度为约19.5mg/ml。986.如前述实施方案中任一项所述的药物组合物,其中,泊洛沙姆407的浓度为约7.5wt%。987.如前述实施方案中任一项所述的药物组合物,其中,dmso的浓度为约2.5wt%。988.如前述实施方案中任一项所述的药物组合物,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。989.如前述实施方案中任一项所述的药物组合物,包含水或缓冲剂。990.如前述实施方案中任一项所述的药物组合物,包含增积剂。991.如前述实施方案中任一项所述的药物组合物,包含稳定剂。992.如前述实施方案中任一项所述的药物组合物,包含张力调节剂。993.如前述实施方案中任一项所述的药物组合物,包含舒缓剂。994.冻干药物组合物,包含如任一前述实施方案所述的药物组合物。995.冻干药物组合物的方法,方法包括:(a)提供药物组合物;(b)冻干组合物;以及(c)获得冻干药物组合物。996.如实施方案995所述的方法,其中,步骤(b)进一步包含:(i)在冻干器中降低温度到低于约-15℃。997.如实施方案996或997所述的方法,其中,步骤(b)进一步包含:(i)在冻干器中降低温度到低于约-30℃。998.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(i)在冻干器中降低温度到低于-45℃。999.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步包含以每分钟少于约2℃的速率降低温度。1000.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步包含以每分钟少于约1℃的速率降低温度。1001.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步包含以每分钟少于约0.5℃的速率降低温度。1002.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步额外地包含维持温度达少于5小时。1003.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步额外地包含维持温度达少于4小时。1004.如任一前述实施方案所述的方法,其中,步骤(b)(i)进一步额外地包含维持温度达少于3小时。1005.如任一前述实施方案所述的方法,其中,步骤(b)包含:(i)以每分钟少于约0.75℃的速率在冻干器中降低温度到低于约-40℃,之后保持其在低于约-40℃达少于约3.5小时。1006.如任一前述实施方案所述的方法,其中,步骤(b)包含:(i)以每分钟约0.5℃的速率在冻干器中降低温度到约-45℃,之后保持其在约-45℃达约3小时。1007.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(ii)施加低于150毫托的真空。1008.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(ii)施加低于100毫托的真空。1009.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(ii)施加低于90毫托的真空。1010.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(ii)施加约80毫托的真空。1011.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(iii)增加温度到低于约-10℃。1012.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(iii)增加温度到低于约-20℃。1013.如任一前述实施方案所述的方法,其中,步骤(b)进一步包含:(iii)增加温度到少于-30℃。1014.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含以每分钟少于约2℃的速率降低温度。1015.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含以每分钟少于约1℃的速率降低温度。1016.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含以每分钟少于约0.5℃的速率降低温度。1017.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持温度达少于25小时。1018.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持温度达少于20小时。1019.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持温度达少于15小时。1020.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持低于约200毫托的真空。1021.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持低于约150毫托的真空。1022.如任一前述实施方案所述的方法,其中,步骤(b)(iii)进一步包含维持低于约100毫托的真空。1023.如任一前述实施方案所述的方法,其中,步骤(b)包含:(iii)以每分钟少于约0.75℃的速率增加温度到低于约-25℃,且保持其于低于100毫托的真空下在低于约-25℃达少于约17.5小时。1024.如任一前述实施方案所述的方法,其中,步骤(b)包含:(iii)以每分钟约0.5℃的速率增加温度至约-30℃,且保持其于约80毫托的真空下在约-30℃达约15小时。1025.如任一前述实施方案所述的方法,其中,步骤(b)包含:(iv)增加温度到大于约15℃。1026.如任一前述实施方案所述的方法,其中,步骤(b)包含:(iv)增加温度到大于约10℃。1027.如任一前述实施方案所述的方法,其中,步骤(b)包含:(iv)增加温度到大于约5℃。1028.如任一前述实施方案所述的方法,其中,步骤(b)(iv)进一步包含以每分钟少于约2℃的速率增加温度。1029.如任一前述实施方案所述的方法,其中,步骤(b)(iv)进一步包含以每分钟少于约1.5℃的速率增加温度。1030.如任一前述实施方案所述的方法,其中,步骤(b)(iv)进一步包含以每分钟少于约1.0℃的速率增加温度。1031.如任一前述实施方案所述的方法,其中,步骤(b)(iv)进一步包含以每分钟少于约0.5℃的速率增加温度。1032.如任一前述实施方案所述的方法,其中,步骤(b)包含:(v)保持温度在大于约15℃。1033.如任一前述实施方案所述的方法,其中,步骤(b)包含:(v)保持温度在大于约10℃。1034.如任一前述实施方案所述的方法,其中,步骤(b)包含:(v)保持温度在大于约5℃。1035.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持温度达超过约5小时。1036.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持温度达超过约10小时。1037.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持温度达超过约15小时。1038.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持温度达超过约20小时。1039.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持低于约200毫托的真空。1040.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持低于约150毫托的真空。1041.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持低于约100毫托的真空。1042.如任一前述实施方案所述的方法,其中,步骤(b)(v)进一步包含维持约80毫托的真空。1043.如任一前述实施方案所述的方法,进一步包含退火步骤。1044.如任一前述实施方案所述的方法,其中,方法包括:(a)提供药物组合物;(b)通过下述冻干组合物:(i)以每分钟0.5℃的速率降低冻干器中的温度到-45℃,之后保持在-45℃达3小时;(ii)施加80毫托的真空;(iii)增加温度至-30℃(以每分钟0.5℃的速率)并在80毫托的真空下保持在-30℃达15小时;(iv)增加温度至15℃(以每分钟0.5℃的速率);及/或(v)在80毫托的真空下保持温度在15℃达20小时;以及(c)获得冻干药物组合物。1045.如任一前述实施方案所述的方法,其中,组合物在冻干之前,经过温度为至少-50℃。1046.处理如任一前述实施方案所述的药物组合物以形成冻干药物组合物的方法。1047.如实施方案1046所述的方法,包括下述步骤:i)在低于0℃的第一温度下冷却药物组合物达第一时间段;ii)在低于0℃的第二温度下,并在低于760托的减压下,自步骤(i)的所得混合物移除一种或多种溶剂达第二时间段。1048.如实施方案1046或实施方案1047所述的方法,包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以从每分钟约0.1℃至每分钟约5℃的速率冷却药物组合物到范围从约-20℃至约-80℃的第一温度;ib)在第一温度保持药物组合物达范围从约1小时至约6小时的第一时间段;iia)将药物组合物经范围从约1毫托至1000毫托的减压且以从每分钟约0.1℃至每分钟约5℃的速率使药物组合物温热到范围从约-10℃至-50℃的第二温度;iib)在第二温度下且在减压下保持药物组合物或范围从约10小时至约30小时的第二时间段;iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。1049.如任一前述实施方案所述的方法,包括将药物组合物分配于无菌小瓶。1050.如任一前述实施方案所述的方法,包括以从每分钟约0.1℃至每分钟约5℃的速率冷却药物组合物到范围从约-20℃至约-80℃的第一温度。1051.如任一前述实施方案所述的方法,包括在第一温度保持药物组合物达范围从约1小时至约6小时的第一时间段1052.如任一前述实施方案所述的方法,包括将药物组合物经范围从约1毫托至1000毫托的减压且以从每分钟约0.1℃至每分钟约5℃的速率使药物组合物温热到范围从约-10℃至-50℃的第二温度。1053.如任一前述实施方案所述的方法,包括在第二温度下且在减压下保持药物组合物或范围从约10小时至约30小时的第二时间段。1054.如任一前述实施方案所述的方法,包括以氮填充无菌小瓶。1055.如任一前述实施方案所述的方法,包括加盖并压接无菌小瓶。1056.如任一任何前述实施方案所述的方法,其中,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆;任选地,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆407;以及任选地,药物组合物包含一种或多种耳用治疗剂及纯化的泊洛沙姆407。如任一任何前述实施方案所述的方法,其中,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆;1057.如任一前述实施方案所述的方法,其中,药物组合物包含一种或多种耳用治疗剂及泊洛沙姆407。1058.如任一前述实施方案所述的方法,其中,药物组合物包含一种或多种耳用治疗剂及纯化的泊洛沙姆407。1059.如任一前述实施方案所述的方法,其中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆、dmso及水;任选地,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆407、dmso及水;任选地,药物组合物包含chir99021、丙戊酸钠盐、纯化的泊洛沙姆407、dmso及水。1060.如任一前述实施方案所述的方法,其中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆、dmso及水。1061.如任一任何前述实施方案所述的方法,其中,药物组合物包含chir99021、丙戊酸钠盐、泊洛沙姆407、dmso及水。1062.如任一前述实施方案所述的方法,其中,药物组合物包含chir99021、丙戊酸钠盐、纯化的泊洛沙姆407、dmso及水。1063.如任一前述实施方案所述的方法,包括选自下述的一种或多种步骤:0a)将药物组合物分配于无菌小瓶;ia)以每分钟约0.5℃的速率冷却药物组合物到约-45℃的第一温度;ib)在第一温度保持药物组合物达约3小时的第一时间段;iia)将药物组合物经约80毫托至1000毫托的减压且以每分钟约0.5℃的速率使药物组合物温热至约-30℃的第二温度;iib)在第二温度下且在减压下保持药物组合物达范围从约10小时至约15小时的第二时间段;iic)以每分钟约0.5℃的速率使药物组合物温热到20℃;iid)在20℃且在减压下保持药物组合物达20小时,iiia)以氮填充无菌小瓶;以及iiib)加盖并压接无菌小瓶。1064.如任一前述实施方案所述的方法,包括1065.如任一前述实施方案所述的方法,包括将药物组合物分配于无菌小瓶。1066.如任一前述实施方案所述的方法,包括以每分钟约0.5℃的速率冷却药物组合物到约-45℃的第一温度。1067.如任一前述实施方案所述的方法,包括在第一温度保持药物组合物达约3小时的第一时间段。1068.如任一前述实施方案所述的方法,包括将药物组合物经约80毫托至1000毫托的减压且以每分钟约0.5℃的速率使药物组合物温热至约-30℃的第二温度。1069.如任一前述实施方案所述的方法,包括在第二温度下且在减压下保持药物组合物达范围从约10小时至约15小时的第二时间段。1070.如任一前述实施方案所述的方法,包括以每分钟约0.5℃的速率使药物组合物温热到20℃。1071.如任一前述实施方案所述的方法,包括在20℃且在减压下保持药物组合物达20小时。1072.如任一前述实施方案所述的方法,包括以氮填充无菌小瓶。1073.如任一前述实施方案所述的方法,包括加盖并压接无菌小瓶。1074.冻干药物组合物,通过冻干如任一前述实施方案所述的药物组合物而制备。1075.冻干药物组合物,通过如任一前述实施方案所述的方法而制备。1076.重构溶液,通过添加稀释剂至如任一前述实施方案所述的冻干药物组合物而制备。1077.重构溶液,通过添加稀释剂至通过冻干如任一前述实施方案所述的药物组合物所制备的冻干药物组合物而制备。1078.重构溶液,通过添加稀释剂至通过如任一前述实施方案所述的方法所制备的冻干药物组合物而制备。1079.重构溶液,通过添加稀释剂至包含一种或多种耳用治疗剂及胶凝剂的冻干药物组合物而制备。1080.如前述实施方案中任一项所述的重构溶液,其中,一种或多种耳用治疗剂为一种或多种听觉损失治疗剂。1081.如前述实施方案中任一项所述的重构溶液,其中,一种或多种耳用治疗剂为chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐。1082.如实施方案1081所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。1083.如实施方案1082所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐。1084.如实施方案1082所述的重构溶液,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。1085.如前述实施方案中任一项所述的重构溶液,其中,胶凝剂为热可逆胶凝剂。1086.如实施方案1085所述的重构溶液,其中,热可逆胶凝剂包含泊洛沙姆。1087.如实施方案1086所述的重构溶液,其中,泊洛沙姆选自由下列组成的组:泊洛沙姆101、泊洛沙姆105、泊洛沙姆108、泊洛沙姆122、泊洛沙姆123、泊洛沙姆124、泊洛沙姆181、泊洛沙姆182、泊洛沙姆183、泊洛沙姆184、泊洛沙姆185、泊洛沙姆188、泊洛沙姆212、泊洛沙姆215、泊洛沙姆217、泊洛沙姆231、泊洛沙姆234、泊洛沙姆235、泊洛沙姆237、泊洛沙姆238、泊洛沙姆282、泊洛沙姆284、泊洛沙姆288、泊洛沙姆331、泊洛沙姆333、泊洛沙姆334、泊洛沙姆335、泊洛沙姆338、泊洛沙姆401、泊洛沙姆402、泊洛沙姆403及泊洛沙姆407;任选地,泊洛沙姆为泊洛沙姆188或泊洛沙姆407;以及任选地,泊洛沙姆为泊洛沙姆407。1088.如实施方案1087所述的重构溶液,其中,泊洛沙姆为1089.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆101。1090.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆105。1091.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆108。1092.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆122。1093.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆123。1094.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆124。1095.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆181。1096.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆182。1097.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆183。1098.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆184。1099.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆185。1100.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆188。1101.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆212.1102.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆215。1103.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆217。1104.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆231。1105.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆234。1106.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆235。1107.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆237。1108.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆238。1109.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆282。1110.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆284。1111.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆288。1112.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆331。1113.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆333。1114.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆334。1115.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆335。1116.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆338。1117.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆401。1118.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆402。1119.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆403。1120.如实施方案1087所述的重构溶液,其中,泊洛沙姆为泊洛沙姆407;1121.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆为纯化的泊洛沙姆;任选地,泊洛沙姆为纯化的泊洛沙姆407。1122.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆为纯化的泊洛沙姆。1123.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆为纯化的泊洛沙姆407。1124.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大、约9.2kda或更大、约9.4kda或更大、约9.6kda或更大、约9.8kda或更大、约10kda或更大、约10.2kda或更大、约10.4kda或更大、约10.6kda或更大、约10.8kda或更大、约11kda或更大、约11.2kda或更大、约11.4kda或更大、约11.6kda或更大、约11.8kda或更大、约12kda或更大或约12.1kda或更大。1125.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9kda或更大。1126.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9.2kda或更大。1127.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9.4kda或更大。1128.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9.6kda或更大。1129.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约9.8kda或更大。1130.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约10kda或更大。1131.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约10.2kda或更大。1132.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约10.4kda或更大。1133.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约10.6kda或更大。1134.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约10.8kda或更大。1135.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约11kda或更大。1136.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约11.2kda或更大。1137.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约11.4kda或更大。1138.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约11.6kda或更大。1139.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约11.8kda或更大。1140.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约12kda或更大。1141.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407具有平均分子量为约12.1kda或更大。1142.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407系通过液液萃取或尺寸排阻色谱法制备。1143.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407系通过液液萃取制备。1144.如前述实施方案中任一项所述的重构溶液,其中,纯化的泊洛沙姆407系通过尺寸排阻色谱法制备。1145.如前述实施方案中任一项所述的重构溶液,其中,约10%或更多、约20%或更多、约30%或更多、约40%或更多、约50%或更多、约60%或更多、约70%或更多、约80%或更多、约90%或更多、约95%或更多、约98%或更多或约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1146.如前述实施方案中任一项所述的重构溶液,其中,约10%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1147.如前述实施方案中任一项所述的重构溶液,其中,约20%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1148.如前述实施方案中任一项所述的重构溶液,其中,约30%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1149.如前述实施方案中任一项所述的重构溶液,其中,约40%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1150.如前述实施方案中任一项所述的重构溶液,其中,约50%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1151.如前述实施方案中任一项所述的重构溶液,其中,约60%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1152.如前述实施方案中任一项所述的重构溶液,其中,约70%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1153.如前述实施方案中任一项所述的重构溶液,其中,约80%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1154.如前述实施方案中任一项所述的重构溶液,其中,约90%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1155.如前述实施方案中任一项所述的重构溶液,其中,约95%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1156.如前述实施方案中任一项所述的重构溶液,其中,约98%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1157.如前述实施方案中任一项所述的重构溶液,其中,约99%或更多的一种或多种具有低于9kda的分子量的杂质在纯化期间自泊洛沙姆407移除。1158.如前述实施方案中任一项所述的重构溶液,其中,稀释剂包含水及二甲基亚砜(dmso)。1159.如前述实施方案中任一项所述的重构溶液,其中,稀释剂包含水。1160.如前述实施方案中任一项所述的重构溶液,其中,稀释剂进一步包含二甲基亚砜(dmso)。1161.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约1%w/w至约15%w/w、从约2%w/w至约12%w/w、从约3%w/w至约10%w/w、从约4%w/w至约9%w/w、从约5%w/w至约8%w/w、从约5.5%w/w至约7.5%w/w、从约5.8%w/w至约7%w/w、从约6%w/w至约6.8%w/w或从约6.2%w/w至约6.6%w/w;任选地,在稀释剂中dmso的浓度为约6.4%w/w。1162.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约1%w/w至约15%w/w。1163.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约2%w/w至约12%w/w。1164.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约3%w/w至约10%w/w。1165.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约4%w/w至约9%w/w。1166.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约5%w/w至约8%w/w。1167.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约5.5%w/w至约7.5%w/w。1168.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约5.8%w/w至约7%w/w。1169.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约6%w/w至约6.8%w/w。1170.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度范围从约6.2%w/w至约6.6%w/w。1171.如前述实施方案中任一项所述的重构溶液,其中,在稀释剂中dmso的浓度为约6.4%w/w。1172.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约1μl至约6μl、从约2μl至约5μl、从约2.5μl至约4.5μl、从约2.8μl至约4μl、从约3μl至约3.8μl或从约3.2μl至约3.6μl/mg的冻干药物组合物;任选地,构造期间所添加的稀释剂量为约3.4μl/mg的冻干药物组合物。1173.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约1μl至约6μl/mg的冻干药物组合物。1174.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约2μl至约5μl/mg的冻干药物组合物。1175.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约2.5μl至约4.5μl/mg的冻干药物组合物。1176.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约2.8μl至约4μl/mg的冻干药物组合物。1177.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约3μl至约3.8μl/mg的冻干药物组合物。1178.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量范围从约3.2μl至约3.6μl/mg的冻干药物组合物。1179.如前述实施方案中任一项所述的重构溶液,其中,构造期间所添加的稀释剂量为约3.4μl/mg的冻干药物组合物。1180.如前述实施方案中任一项所述的重构溶液,包含:chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在。1181.如前述实施方案中任一项所述的重构溶液,进一步包含:丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在。1182.如前述实施方案中任一项所述的重构溶液,进一步包含:泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在。1183.如前述实施方案中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。1184.如实施方案1183所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。1185.如实施方案1183所述的重构溶液,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。1186.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约2.9mg/ml至约3.3mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约3.1mg/ml。1187.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml。1188.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约5mg/ml。1189.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1mg/ml至约3.5mg/ml。1190.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约2.9mg/ml至约3.3mg/ml。1191.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度为约3.1mg/ml。1192.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约86mg/ml至约92mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约89mg/ml。1193.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml。1194.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约10mg/ml至约200mg/ml。1195.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约30mg/ml至约100mg/ml。1196.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约86mg/ml至约92mg/ml。1197.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围丙戊酸或其药学上可接受的盐的浓度为约89mg/ml。1198.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约16wt%。1199.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%。1200.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约10wt%至约22wt%。1201.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约12wt%至约20wt%。1202.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1203.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约16wt%。1204.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。1205.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%。1206.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约2wt%至约8wt%。1207.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约3wt%至约7wt%。1208.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1209.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1210.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。1211.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。1212.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50。1213.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。1214.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。1215.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。1216.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1或从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。1217.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。1218.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。1219.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。1220.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1。1221.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2.5:1至约3.5:1。1222.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。1223.如前述实施方案中任一项所述的重构溶液,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.02:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。1224.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.02:1。1225.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及dmso之间的重量比为约0.06:1。1226.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.54:1。1227.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及dmso之间的重量比为约3.2:1。1228.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约2.9mg/ml至约3.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约86mg/ml至约92mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。1229.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约2.9mg/ml至约3.3mg/ml。1230.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约86mg/ml至约92mg/ml。1231.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1232.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1233.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约3.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约89mg/ml;泊洛沙姆407的浓度为约16wt%;以及dmso的浓度为约5wt%。1234.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度为约3.1mg/ml。1235.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度为约89mg/ml。1236.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约16wt%。1237.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1238.如前述实施方案中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。1239.如前述实施方案中任一项所述的重构溶液,包含chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在。1240.如前述实施方案中任一项所述的重构溶液,包含丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在。1241.如前述实施方案中任一项所述的重构溶液,包含泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在。1242.如前述实施方案中任一项所述的重构溶液,包含二甲基亚砜(dmso),以低于15wt%的浓度存在。1243.如实施方案1242所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。1244.如实施方案1242所述的重构溶液,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。1245.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml、从约1.9mg/ml至约2.3mg/ml;任选地,chir99021或其药学上可接受的盐的浓度为约2.1mg/ml。1246.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml。1247.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约5mg/ml。1248.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1mg/ml至约3.5mg/ml。1249.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1.9mg/ml至约2.3mg/ml。1250.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度为约2.1mg/ml。1251.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml、从约56mg/ml至约62mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约59mg/ml。1252.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml。1253.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约10mg/ml至约200mg/ml。1254.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约30mg/ml至约100mg/ml。1255.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约56mg/ml至约62mg/ml。1256.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度为约59mg/ml。1257.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%、从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约15wt%。1258.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%。1259.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约10wt%至约22wt%。1260.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约12wt%至约20wt%。1261.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1262.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约15wt%。1263.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%、从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。1264.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%。1265.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约2wt%至约8wt%。1266.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约3wt%至约7wt%。1267.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1268.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1269.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。1270.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。1271.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50。1272.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。1273.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。1274.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。1275.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1;任选地,介于泊洛沙姆407及dmso之间的重量比为约3:1。1276.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。1277.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。1278.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。1279.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1。1280.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2.5:1至约3.5:1。1281.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。1282.如前述实施方案中任一项所述的重构溶液,其中:介于chir99021及泊洛沙姆407之间的重量比为约0.016:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。1283.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.016:1。1284.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及dmso之间的重量比为约0.06:1。1285.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.42:1。1286.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及dmso之间的重量比为约1.5:1。1287.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约1.9mg/ml至约2.3mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约56mg/ml至约62mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。1288.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1.9mg/ml至约2.3mg/ml。1289.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约56mg/ml至约62mg/ml。1290.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1291.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1292.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约2.1mg/ml;丙戊酸或其药学上可接受的盐的浓度为约59mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。1293.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度为约2.1mg/ml。1294.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度为约59mg/ml。1295.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约15wt%。1296.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1297.如前述实施方案中任一项所述的重构溶液,包含:i)chir99021或其药学上可接受的盐,以范围从0.05mg/ml至约50mg/ml的浓度存在;ii)丙戊酸或其药学上可接受的盐,以范围从1mg/ml至约1000mg/ml的浓度存在;iii)泊洛沙姆407,以范围从2wt%至约50wt%的浓度存在;以及iv)二甲基亚砜(dmso),以低于15wt%的浓度存在。1298.如实施方案1297所述的重构溶液,其中,丙戊酸的药学上可接受的盐为钠盐;任选地,丙戊酸的药学上可接受的盐为丙戊酸钠。1299.如实施方案1297所述的重构溶液,其中,丙戊酸的药学上可接受的盐为丙戊酸钠。1300.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml、从约0.5mg/ml至约5mg/ml、从约1mg/ml至约3.5mg/ml或从约1.2mg/ml至约1.5mg/ml;任选地,chir99021或其药学上可接受的盐的浓度范围为约1.4mg/ml。1301.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.1mg/ml至约10mg/ml。1302.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约0.5mg/ml至约5mg/ml。1303.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1mg/ml至约3.5mg/ml。1304.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1.2mg/ml至约1.5mg/ml。1305.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围为约1.4mg/ml。1306.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml、从约10mg/ml至约200mg/ml、从约30mg/ml至约100mg/ml或从约36mg/ml至约42mg/ml;任选地,丙戊酸或其药学上可接受的盐的浓度为约39mg/ml。1307.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约5mg/ml至约400mg/ml。1308.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约从约10mg/ml至约200mg/ml。1309.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约从约100mg/ml至约200mg/ml。1310.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约从约120mg/ml至约140mg/ml。1311.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约从约30mg/ml至约100mg/ml。1312.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约从约36mg/ml至约42mg/ml。1313.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度为约39mg/ml。1314.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%、从约10wt%至约22wt%、从约12wt%至约20wt%或从约14wt%至约17wt%;任选地,泊洛沙姆407的浓度为约15wt%。1315.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约5wt%至约25wt%。1316.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约10wt%至约22wt%。1317.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约12wt%至约20wt%。1318.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1319.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约15wt%。1320.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%、从约2wt%至约8wt%、从约3wt%至约7wt%或从约4wt%至约6wt%;任选地,dmso的浓度为约5wt%。1321.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约1wt%至约10wt%。1322.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约2wt%至约8wt%。1323.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约3wt%至约7wt%。1324.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1325.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1326.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10、从约1:10至约1:50、从约1:20至约1:35、从约1:25至约1:31或从约1:27至约1:29。1327.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:5至约1:10。1328.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:10至约1:50。1329.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:20至约1:35。1330.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:25至约1:31。1331.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021或其药学上可接受的盐及丙戊酸或其药学上可接受的盐之间的重量比范围从约1:27至约1:29。1332.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1、从约1:2至约15:1、从约1:1至约8:1、从约2:1至约4:1、从约2.5:1至约3.5:1。1333.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:5至约40:1。1334.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:2至约15:1。1335.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约1:1至约8:1。1336.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2:1至约4:1。1337.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比范围从约2.5:1至约3.5:1。1338.如前述实施方案中任一项所述的重构溶液,其中:介于泊洛沙姆407及dmso之间的重量比为约3:1;介于chir99021及泊洛沙姆407之间的重量比为约0.013:1;介于chir99021及dmso之间的重量比为约0.06:1;介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1;及/或介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。1339.如前述实施方案中任一项所述的重构溶液,其中,介于泊洛沙姆407及dmso之间的重量比为约3:1。1340.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及泊洛沙姆407之间的重量比为约0.013:1。1341.如前述实施方案中任一项所述的重构溶液,其中,介于chir99021及dmso之间的重量比为约0.06:1。1342.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及泊洛沙姆407之间的重量比为约0.23:1。1343.如前述实施方案中任一项所述的重构溶液,其中,介于丙戊酸钠盐及dmso之间的重量比为约1.8:1。1344.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度范围从约1.2mg/ml至约1.5mg/ml;丙戊酸或其药学上可接受的盐的浓度范围从约36mg/ml至约42mg/ml;泊洛沙姆407的浓度范围从约14wt%至约17wt%;以及dmso的浓度范围从约4wt%至约6wt%。1345.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度范围从约1.2mg/ml至约1.5mg/ml。1346.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度范围从约36mg/ml至约42mg/ml。1347.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度范围从约14wt%至约17wt%。1348.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度范围从约4wt%至约6wt%。1349.如前述实施方案中任一项所述的重构溶液,其中:chir99021或其药学上可接受的盐的浓度为约1.4mg/ml;丙戊酸或其药学上可接受的盐的浓度为约39mg/ml;泊洛沙姆407的浓度为约15wt%;以及dmso的浓度为约5wt%。1350.如前述实施方案中任一项所述的重构溶液,其中,chir99021或其药学上可接受的盐的浓度为约1.4mg/ml。1351.如前述实施方案中任一项所述的重构溶液,其中,丙戊酸或其药学上可接受的盐的浓度为约39mg/ml。1352.如前述实施方案中任一项所述的重构溶液,其中,泊洛沙姆407的浓度为约15wt%。1353.如前述实施方案中任一项所述的重构溶液,其中,dmso的浓度为约5wt%。1354.如前述实施方案中任一项所述的重构溶液,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。1355.如前述实施方案中任一项所述的重构溶液,包含水。1356.如前述实施方案中任一项所述的重构溶液,包含缓冲剂。1357.如前述实施方案中任一项所述的重构溶液,包含增积剂。1358.如前述实施方案中任一项所述的重构溶液,包含稳定剂。1359.如前述实施方案中任一项所述的重构溶液,包含张力调节剂。1360.如前述实施方案中任一项所述的重构溶液,包含舒缓剂。1361.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,重构溶液相较于无纯化的泊洛沙姆407的可比拟的重构溶液对氧及/或光具有较高稳定性;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。1362.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约10000百万分点(ppm)、少于约1000ppm、少于约100ppm、少于约10ppm、少于约1ppm或少于约0.1ppm。1363.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约10000百万分点(ppm)。1364.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约1000ppm。1365.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约100ppm。1366.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约10ppm。1367.如前述实施方案中任一项所述的重构溶液,其中,存在于重构溶液中的杂质量为少于约1ppm或少于约0.1ppm。1368.如前述实施方案中任一项所述的重构溶液,其中,杂质选自由下列组成的组:1-乙酸酯-2-甲酸酯-1,2-丙二醇、乙酸、甲酸、甲醛、乙醛及丙醛。1369.如前述实施方案中任一项所述的重构溶液,其中,杂质为1-乙酸酯-2-甲酸酯-1,2-丙二醇。1370.如前述实施方案中任一项所述的重构溶液,其中,杂质为乙酸。1371.如前述实施方案中任一项所述的重构溶液,其中,杂质为甲酸。1372.如前述实施方案中任一项所述的重构溶液,其中,杂质为甲醛。1373.如前述实施方案中任一项所述的重构溶液,其中,杂质为乙醛。1374.如前述实施方案中任一项所述的重构溶液,其中,杂质为及丙醛。1375.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约3%、低于约2%、低于约1%、低于约0.5%或低于约0.1%。1376.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约3%。1377.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约2%。1378.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约1%。1379.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为低于约0.5%。1380.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中的聚环氧乙烷量为或低于约0.1%。1381.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。1382.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约30%至约35%。1383.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约25%至约29%。1384.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约20%至约25%。1385.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约15%至约19%。1386.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约10%至约14%。1387.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约5%至约9%。1388.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中有clogp为约1或更少的一种或多种杂质的总量为从约0%至约4%。1389.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%、从约30%至约34%、从约25%至约29%、从约20%至约25%、从约15%至约19%、从约10%至约14%、从约5%至约9%或从约0%至约4%。1390.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约35%至约40%。1391.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约30%至约34%。1392.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约25%至约29%。1393.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约20%至约25%。1394.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约15%至约19%。1395.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约10%至约14%。1396.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约5%至约9%。1397.如前述实施方案中任一项所述的重构溶液,其中,如通过高效液相色谱术(hplc)所测量,存在于重构溶液中具有沸腾为约220℃或更低的一种或多种杂质的总量为从约0%至约4%。1398.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约1.5倍或更高、约1.8倍或更高、约2倍或更高、约2.5倍或更高、约3倍或更高、约5倍或更高或约10倍或更高;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。1399.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约1.5倍或更高。1400.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约1.8倍或更高。1401.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约2倍或更高。1402.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约2.5倍或更高。1403.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约3倍或更高。1404.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约5倍或更高。1405.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,存在于重构溶液中的一种或多种耳用治疗剂的量为约10倍或更高。1406.如前述实施方案中任一项所述的重构溶液,其中,可比拟的重构溶液包含未纯化的泊洛沙姆407。1407.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,重构溶液具有一种或多种胶凝特性(例如,胶凝温度、粘度及/或稳定性)的较低批次间差异;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。1408.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的重构溶液,重构溶液具有较低胶凝温度、较窄胶凝温度范围、更持续释放听觉损失治疗剂及/或较高粘度;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。1409.如前述实施方案中任一项所述的重构溶液,其中,重构溶液包含纯化的泊洛沙姆407,且其中,相较于无纯化的泊洛沙姆407的可比拟的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的重构溶液包含未纯化的泊洛沙姆407。1410.如前述实施方案中任一项所述的重构溶液,适于注射;任选地,重构溶液适于鼓室内注射。1411.如前述实施方案中任一项所述的重构溶液,其中,重构溶液维持用于制备冻干药物组合物的药物组合物的一种或多种流变性质。1412.如前述实施方案中任一项所述的重构溶液,其中,相较于从无纯化的泊洛沙姆407的可比拟的冻干药物组合物所制备的重构溶液,重构溶液具有降低的降解率;任选地,可比拟的冻干药物组合物包含未纯化的泊洛沙姆407。1413.如前述实施方案中任一项所述的重构溶液,包含下述的一种或多种:水或缓冲剂;增积剂;稳定剂;张力调节剂;以及舒缓剂。1414.如前述实施方案中任一项所述的重构溶液,包含水或缓冲剂。1415.如前述实施方案中任一项所述的重构溶液,包含增积剂。1416.如前述实施方案中任一项所述的重构溶液,包含稳定剂。1417.如前述实施方案中任一项所述的重构溶液,包含张力调节剂。1418.如前述实施方案中任一项所述的重构溶液,包含舒缓剂。1419.促进产生组织及/或细胞的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物到组织及/或细胞。1420.治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的方法,包括向受试者施用药物有效量的如任一前述实施方案所述的冻干药物、药物组合物或重构的组合物。1421.增加在前庭组织中的前庭细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1422.治疗患有前庭病症或有发展前庭病症的风险的受试者的方法,包括向受试者施用药物有效量的如任一前述实施方案所述的冻干药物、药物组合物或重构的组合物。1423.增加耳蜗组织中的耳蜗细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1424.治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的方法,包括向受试者施用药物有效量的如任一前述实施方案所述的冻干药物、药物组合物或重构的组合物。1425.增加柯蒂氏器中发现的细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1426.增加柯蒂氏器中发现的发细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1427.增加柯蒂氏器中发现的内发细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1428.增加柯蒂氏器中发现的外发细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1429.增加柯蒂氏器中发现的神经元细胞群的方法,包括递送药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1430.治疗患有听觉病症或有发展听觉病症的风险的受试者的方法,包括向受试者施用药物有效量的如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物。1431.如实施方案1430所述的方法,其中,听觉病症为感觉神经性听觉损失。1432.如任一前述实施方案所述的冻干组合物、药物组合物或重构的组合物,用于疗法。1433.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于促进产生组织及/或细胞。1434.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者。1435.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加在前庭组织中的前庭细胞群。1436.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于治疗患有前庭病症或有发展前庭病症的风险的受试者。1437.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加耳蜗组织中的耳蜗细胞群。1438.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者。1439.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加柯蒂氏器中发现的细胞群。1440.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加柯蒂氏器中发现的发细胞群。1441.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加柯蒂氏器中发现的内发细胞群。1442.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加柯蒂氏器中发现的外发细胞群。1443.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于增加柯蒂氏器中发现的神经元细胞群。1444.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物,用于治疗患有听觉病症或有发展听觉病症的风险的受试者。1445.根据实施方案1444所述的使用的组合物,其中,听觉病症为感觉神经性听觉损失。1446.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造促进产生组织及/或细胞的药剂。1447.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造治疗患有与不存在或缺乏组织及/或细胞相关的疾病或有发展与不存在或缺乏组织及/或细胞相关的疾病的风险的受试者的药剂。1448.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加在前庭组织中的前庭细胞群的药剂。1449.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造治疗患有前庭病症或有发展前庭病症的风险的受试者的药剂。1450.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加耳蜗组织中的耳蜗细胞群的药剂。1451.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造治疗患有耳蜗病症或有发展耳蜗病症的风险的受试者的药剂。1452.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加柯蒂氏器中发现的细胞群的药剂。1453.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加柯蒂氏器中发现的发细胞群的药剂。1454.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加柯蒂氏器中发现的内发细胞群的药剂。1455.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造增加柯蒂氏器中发现的外发细胞群的药剂。1456.如任一前述实施方案所述的冻干药物、药物组合物或重构的组合物的用途,其用于制造增加柯蒂氏器中发现的神经元细胞群的药剂。1457.如任一前述实施方案所述的冻干药物组合物、药物组合物或重构的组合物的用途,其用于制造治疗患有听觉病症或有发展听觉病症的风险的受试者的药剂。1458.如实施方案1457所述的用途,其中,听觉病症为感觉神经性听觉损失。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1