包含针对Fas信号传导的抑制肽的用于预防或治疗肥胖症、脂肪肝或脂肪性肝炎的药物组合物的制作方法
本发明涉及一种药物组合物,其包含针对fas信号传导的抑制肽作为活性成分以用于预防或治疗肥胖症、脂肪肝或脂肪性肝炎。
背景技术:
肥胖症在全球范围内迅速蔓延,目前,有17亿人(相当于世界人口的25%)超重(bmi为25或更高),并且在西欧bmi为30或更高的肥胖患者人数约为3亿。此外,五分之一的儿童属于儿童肥胖症,并且这个数字正在迅速增加,使得儿童肥胖症已成为一个严重的社会问题。特别是,儿童肥胖症会导致性发育异常如性早熟,因为儿童的脂肪越多,性激素的分泌就越受刺激,并且儿童肥胖症还是通过影响血液循环和营养平衡抑制生长的原因。肥胖症作为成人疾病的风险因素,参与成人疾病(诸如高血压、糖尿病、动脉硬化、中风、心脏病发作和各种肿瘤)的发展(wilson等人,2005,circulation112:3066-3072),并促进了疾病的进程,并且已知由于肥胖症患上成人疾病的风险比正常人高3至6倍。因此,肥胖不仅是一个美容问题,而且是与健康直接相关的严重问题。
尤其是,随着肥胖人群的增加,患有非酒精性脂肪肝的患者数也在增加,其中体内剩余的能量以甘油三酯的形式积累在肝脏中。当延长非酒精性脂肪肝时,会引起炎症反应并发展为脂肪性肝炎,并可最终恶化为肝硬化和肝癌,因此需要预防和有效治疗非酒精性脂肪肝。
目前用作肥胖症的治疗剂的novonordisk的saxenda(成分名利拉鲁肽)是一种glp-1类似物,其与人激素glp-1为约97%相似,并且每天皮下给药一次。临床研究表明,saxenda可通过将肥胖者的体重减轻5至10千克(无论其最初体重多少)并且当维持减少的体重时获得许多健康有益效果,包括改善血糖水平和血压、胆固醇水平和阻塞性睡眠呼吸暂停综合症。然而,存在恶心、呕吐、腹泻和便秘等副作用,即使是减肥成功的人,中断给药也会导致溜溜球现象(体重返回到其初始值的现象),因此在不改善生活方式的情况下,不能从根本上治疗肥胖症。
作为对肥胖症和脂肪肝的根本性治疗的研究的结果,本发明人发现fas受体不仅在脂肪组织中而且在肝脏中广泛表达,并且确认肥胖症、脂肪肝或脂肪性肝炎可通过阻断fas受体的信号传导以抑制炎症反应而减轻,从而完成了本发明。
技术实现要素:
[技术问题]
本发明的目的是提供针对fas信号传导的抑制肽,以及包含该肽作为活性成分以用于预防或治疗胖症、脂肪肝或脂肪性肝炎的药物组合物。
[技术方案]
为实现该目的,本发明的一个方面提供了一种药物组合物,其包含针对fas信号传导的抑制肽作为活性成分以用于预防或治疗肥胖症、脂肪肝或脂肪性肝炎,所述抑制肽包含由以下通式i表示的氨基酸序列:
[通式i]
xaa1-cys-asp-glu-his-phe-xaa2-xaa3,
在通式中,xaa1和xaa3各自独立地不存在或为任何氨基酸,并且
xaa2不存在或选自ala、gly、val、leu、ile、met、pro、ser、cys、thr、asn和gln。
如本文所用,术语“fas”是指fas、fas受体(fasr)、细胞凋亡抗原1(apo-1)、或分化簇95(cd95),并且是调节细胞凋亡的一种肿瘤坏死因子(tnf)受体。当fas结合到配体时,其通过多聚化激活,因此各种衔接蛋白结合到fas。结合的衔接蛋白激活各种细胞凋亡信号传导途径,并且代表性信号传导调节子包括半胱天冬酶(caspase)、nf-κb、应激激活蛋白激酶(sapk)、bcl-2家族等等。
如本文所用,术语“针对fas信号传导的抑制肽”是指一种肽,其具有如上所述结合到fas的活性以抑制fas的下游信号传导途径,其与典型的fas配体相反,并具有抑制凋亡的活性。
在本发明的一个示例性实施方案中,在通式i中,xaa1和xaa3可各自独立地不存在或为任何氨基酸,并且优选地,可各自独立地选自tyr、phe和trp。
另外,在通式i中,xaa2可不存在或选自ala、gly、val、leu、ile、met、pro、ser、cys、thr、asn和gln,并且优选地可选自gly、ala、ser、thr和cys。
例如,各种组合是可能的,诸如1)可仅存在xaa2,然而xaa1和xaa3不存在,2)xaa2可存在,同时xaa1和xaa3中的任一个存在,以及3)xaa1至xaa3全部均不存在。
在本发明的一个示例性实施方案中,通式i的氨基酸序列可以为选自seqidnos:1至12的序列,优选地可选自seqidnos:7至12,并且更优选地可以为选自seqidnos:10至12的序列。
同时,对于针对用于本发明的fas信号传导的抑制肽而言,该肽的n-和/或c-端可被修饰以便获得改善的稳定性、增强的药理学特性(半衰期、可吸收性、滴度、功效等)、改变的特异性(例如,广谱生物活性)以及肽的减小的抗原性。上述化学式可以呈以下形式,其中乙酰基基团、芴基甲氧基羰基基团、酰胺基基团、甲酸基基团、肉豆蔻基基团、硬脂基基团、或乙二醇(peg)结合到肽的n端和/或c端,但肽的修饰可特别地包括但不限于可改善肽的稳定性的任何组分。如本文所用,术语“稳定性”不仅是指保护本发明的肽免受体内蛋白质裂解酶攻击的体内稳定性,而且还指储存稳定性(例如,室温储存稳定性)。
在本发明中,肥胖症包括除了肥胖症之外的肥胖症相关疾病,诸如糖尿病、脂肪肝、高血脂、动脉硬化及其组合,并且脂肪肝可以为非酒精性脂肪肝。
非酒精性脂肪肝是由于较差的生活方式相关的习惯(诸如缺少锻炼或高卡路里饮食)导致肝脏中呈甘油三酯形式的过量能量积聚而发生的疾病。当非酒精性脂肪肝保持未治疗时,其可从肝炎和硬化发展成肝癌,但至今没有对非酒精性脂肪肝的适当治疗药物,因此主要进行通过运动和饮食改善的治疗。在本发明中,非酒精性脂肪肝包括各种形式的肝脏疾病,其范围是从简单的只积聚脂肪并几乎不导致对肝细胞的损伤的简单非酒精性脂肪肝、具有严重肝细胞损伤的慢性非酒精性脂肪性肝炎到肝硬化。
本发明确认了fas不仅在脂肪组织中过度表达而且在处于肥大状态的肝组织中过度表达,并且具体地讲,在肝脏中,fas的表达随着肥胖程度增加而成比例地增加(图8)。因此,可以看到当在体内施用针对fas信号传导的抑制肽时,该肽特异性递送到肥胖模型小鼠的肝脏和脂肪组织(图10)并因此结合到fas(图9)。即,确认了本发明由于通过将药物(针对fas信号传导的抑制肽)直接递送到脂肪组织和肝组织的fas信号传导,抑制了炎症反应、细胞凋亡、脂肪积聚等,因此可改善肥胖症、脂肪肝或脂肪性肝炎的症状(图14至44)。
如本文所用,术语“治疗”是指其中肥胖症、脂肪肝或脂肪性肝炎相关疾病的症状通过施用根据本发明的针对fas信号传导的抑制肽或包含所述抑制肽的药物组合物而改善或有利地改变的所有行为。
如本文所用,术语“施用”是指以任何适当的方式将预定物质,即根据本发明的针对fas信号传导的抑制肽或包含所述抑制肽的药物组合物引入受试者中。因此,本发明的药物组合物可通过诸如腹膜内给药、静脉内给药、肌内给药、皮下给药、皮内给药、口服给药、局部给药、肺内给药或直肠给药等的方法来施用。特别是,当本发明的药物组合物用于预防或治疗肥胖症时,优选静脉内给药,并且当组合物用于预防或治疗脂肪肝或脂肪性肝炎时,优选皮下给药。
根据本发明的示例性实施方案,本发明的针对fas信号传导的抑制肽的特征在于在静脉内注射期间(在全身给药期间)特异性递送到肝脏和脂肪组织,并且在皮下注射期间特异性递送到肝脏以抑制炎症反应。此外,当将针对fas信号传导的抑制肽静脉内给药于肥胖模型小鼠时,体重增加(图24a),但在皮下注射期间体重趋于保持(图37)。由此,可以发现,即使使用相同量的针对fas信号传导的抑制肽或包含所述抑制肽的药物组合物,对肥胖症、脂肪肝或脂肪性肝炎的治疗/减轻效果的程度也根据给药途径而有所不同。
同时,本发明的药物组合物可以注射的形式施用,从而被静脉内或皮下给药。当本发明的药物组合物以注射剂形式制备时,可混合缓冲液、防腐剂、舒缓剂、增溶剂、等渗剂等,并且本发明的药物组合物可以单位计量安瓿或多剂量形式制备。
在本发明中,“包含……作为活性成分”是指足以以适用于医学治疗的合理有益/风险比治疗疾病的量,并且有效剂量的水平可根据患者疾病的类型和严重性、患者的药物敏感性、给药时间、给药途径和释放速率、治疗持续时间、包括与本发明组合物同时使用的药物的元素、或医学领域众所周知的其他元素来确定。根据本发明的肽或包含所述肽的药物组合物可以单独治疗即或与其他治疗剂组合的形式施用,或可以单剂量或多剂量形式施用。对于施用者而言重要的是,考虑所有前述因素,最小量的组合物可获得最大的效果而不具有任何副作用,并且这可由本领域技术人员容易地确定。本发明的药物组合物的剂量和频率由活性成分的类型,以及各种相关因素(诸如待治疗的疾病,给药途径,患者的年龄、性别、体重以及疾病的严重度)来确定。
因此,除了包括针对fas信号传导的抑制肽作为活性成分之外,本发明的药物组合物还可包括药学上可接受的载体。包含在本发明的药物组合物中的药学上可接受的载体通常在配制期间使用,并且包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁、矿物油等,但不限于此。除了上述成分之外,本发明的药物组合物还可另外包含润滑剂、润湿剂、甜味剂、调味剂、乳化剂、悬浮剂、防腐剂等。合适的药学上可接受的载体和制剂详细描述于remington'spharmaceuticalsciences(第19版,1995)中。
本发明的药物组合物的合适剂量可根据诸如配制方法,给药方法,患者的年龄、体重、性别或疾病状况、饮食、给药时间、给药途径、排泄速率和反应敏感性等因素而有所不同。同时,本发明的药物组合物的剂量优选为每天0.001至1000mg/kg(体重)。
本发明的药物组合物可以单位剂量的形式或通过容纳在多剂量容器中来制备,其根据本发明所属领域普通技术人员容易实施的方法使用要学上可接受的载体和/或赋形剂来配制。在这种情况下,剂型也可以呈油或水性介质中的溶液形式、悬浮液或乳液、浸膏、粉剂、颗粒剂、片剂或胶囊剂的形式,并且本发明的药物组合物可另外包含分散剂或稳定剂。
本发明的另一方面提供了针对fas信号传导的抑制肽,所述抑制肽包含由以下通式i表示的氨基酸序列:
xaa1-cys-asp-glu-his-phe-xaa2-xaa3,
在通式中,
xaa1和xaa3各自独立地为不存在或任何氨基酸,并且
xaa2为不存在或选自ala、gly、val、leu、ile、met、pro、ser、cys、thr、asn和gln。
因为针对fas信号传导的抑制肽与包含在用于治疗或改善肥胖症、脂肪肝或脂肪性肝炎的药物组合物中的针对fas信号传导的抑制肽相同,所以将省略其重复内容。
[有利效果]
因为根据本发明的针对fas信号传导的抑制肽特异性结合到大量表达于脂肪组织和处于肥大状态的肝组织中的fas,所以针对fas信号传导的抑制肽表现出到由肥胖症导致的炎性区域的高递送速率。此外,抑制肽可直接抑制作为主要炎症信号传导途径的fas信号传导,以抑制炎症反应。因此,该肽可有利地用于减轻或治疗肥胖症、脂肪肝或脂肪性肝炎。
附图说明
图1示出了确认对经常表达fas的jurkat细胞系进行处理的作为针对fas信号传导的抑制肽的fbp-8、fbp-a和fbp-7是否结合到fas的结果:mock=未处理组(未用任何肽处理的实验组;ctrfbp=阴性对照(对照肽处理组);fbp-8=ycdehfcy肽处理组;fbp-a=ycdehfay-处理组和fbp-7=ycdehfy-处理组。
图2示出了确认在用作为针对fas信号传导的抑制肽的fas配体(fasl)和fbp-8、fbp-a或fbp-7组合处理jurkat细胞系之后,细胞凋亡水平的结果(a)以及确认fbp-8和fbp-7在血清中的稳定性的结果(b).
图3示出了确认用各种浓度的fbp-8处理3t3l1细胞系之后,是否存在细胞毒性的结果。
图4示出了确认在用fas配体(fasl)和fbp-8组合处理3t3l1细胞系之后的细胞凋亡水平的结果。
图5示出了确认在用fas配体(fasl)和fbp-8组合处理3t3l1细胞系之后的炎症反应相关基因的表达水平的结果。
图6示出了确认在用fas配体(fasl)和fbp-8组合处理3t3l1细胞系之后的细胞培养溶液中炎症反应相关细胞因子水平的结果。
图7示出了确认在用fas配体(fasl)和fbp-8组合处理3t3l1细胞系之后,释放到细胞培养溶液中的游离脂肪酸(ffa)的浓度的结果。
图8示出了确认正常体重小鼠(ncd)的白色脂肪组织和肝脏组织中的fas表达水平的结果(a和b),肥胖症模型小鼠(hfd)的肝脏组织中fas表达根据体重的变化(c),以及fas表达细胞的比例:ncd=正常对照饮食组;hfd=高脂肪饮食组;wat=白色脂肪组织;以及liver=肝脏组织。
图9示出了确认fbp-8是否结合到肥胖症模型小鼠(hfd)的白色脂肪组织和肝脏组织切片中的fas的结果。
图10示出了通过皮下注射(a)和静脉内注射(b)将荧光标记的fbp-8注射到肥胖型模型小鼠(fhd)中,并确认24小时和48小时后其在每个器官中的荧光分布的结果:mock=未给药组(无肽给药);ctrfbp=阴性对照(对照肽给药);和fbp-8=fbp-8给药组。
图11示出了确认通过静脉内给药在其中注入fbp-8的肥胖症模型小鼠的肝脏组织切片中fbp-8的荧光信号的结果。
图12示出了通过静脉内注射(iv)或皮下注射(sc)将荧光标记的fbp-8注射到正常体重小鼠中,并确认12小时后其在每个器官中的荧光分布的结果。
图13示意性地示出了根据本发明的示例性实施方案的动物实验的过程。
图14示出了通过tunel染色确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织切片中死亡细胞比例的结果。
图15示出了通过tunel染色确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的白色脂肪组织中死亡细胞比例的结果。‘
图16示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的白色脂肪组织中的作为促炎性巨噬细胞标记的基因的f4/80和cd11c的表达水平的结果。
图17示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的白色脂肪组织中的冠状结构(cls)区域的结果。
图18示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的白色脂肪组织中炎症反应相关基因的表达水平的结果。
图19示出了测量通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的血液中促炎性细胞因子的含量的结果。
图20示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织中的f4/80、cd11c和cd206的表达水平的结果。
图21示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织中炎症反应相关基因的表达水平的结果。
图22示出了评估通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠中的葡萄糖抵抗结果。
图23示出了评估通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠中的胰岛素敏感性的结果。
图24示出了确认在通过静脉内注射将fbp-8施用于肥胖症模型小鼠的过程中,每日进食(a)和体重变化(b)的结果。
图25示出了确认在通过静脉内注射将fbp-8施用于肥胖症模型小鼠的肝脏组织中,作为产生脂肪的基因的硬脂酰基-coa去饱和酶(scd-1)的表达水平的结果。
图26示出了测量通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的血液中的脂肪酸和胰岛素浓度的结果。
图27示出了测量通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织中的甘油三酯(tg)浓度的结果。
图28示出了测量通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织形态和重量的结果。
图29示出了确认通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的肝脏组织切片中肝损坏程度的结果。
图30示出了测量通过静脉内注射在其中注入fbp-8的肥胖症模型小鼠的血液中,作为肝功能指数的丙氨酸转氨酶(alt)含量的结果。
图31示出了通过tunel染色确认在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织中的死亡细胞比例的结果:ncd=正常组(正常对照饮食组);mock=未给药组(无肽给药);ctrfbp=阴性对照(对照肽给药);saxenda=阳性对照(利拉鲁肽给药);以及fbp-7=fbp-7给药组。
图32示出了确认在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织中,炎症反应相关巨噬细胞标记的基因的表达水平的结果。
图33示出了确认在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织中炎症反应相关基因的表达水平的结果。
图34示出了确认在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织中的fas基因表达水平的结果。
图35示出了测量在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的血液中的促炎性细胞因子含量的结果。
图36示出了评估通过皮下注射在其中注入fbp-7的肥胖症模型小鼠中的葡萄糖抵抗的结果。
图37示出了随时间推移通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的体重的测量结果。
图38示出了确认随时间推移通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的进食的结果。
图39示出了确认通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织形态和体重的结果。
图40示出了确认在通过皮下注射在其中注入fbp-7的肥胖症模型小鼠的肝脏组织切片中的肝损伤程度的结果。
图41示出了确认通过皮下注射在其中注入fbp-7的肥胖模型小鼠的肝脏组织中,作为参与脂肪积累的基因的ppar-γ的表达水平的结果。
图42示出了确认在通过皮下注射在其中注入fbp-7的肥胖模型小鼠的肝脏组织中的甘油三酯含量的结果。
图43示出了测量在通过皮下注射在其中注入fbp-7的肥胖模型小鼠的血液中的脂肪酸和胰岛素浓度的结果。
图44示出了测量在通过皮下注射在其中注入fbp-7的肥胖模型小鼠的血液中的作为肝功能指数的alt含量的结果。
具体实施方式
下文中,将通过实施例更详细地描述本发明。提供这些实施例仅是为了更具体地描述本发明,并且对于本发明所属领域的普通技术人员而言显而易见的是,本发明的范围不受根据本发明的这些要旨的这些实施例的限制。
实验方法
1.肽
通过在peptron(daejeon,republicofkorea)合成以下序列,然后将肽溶解在ph值为7.4的pbs中以冻干状态使用这些肽。第一肽在相关技术文献(procnatlacadsciusa.2004apr27;101(17):6599-604)中公开。
fas阻断肽(fbp或fbp-8):ycdehfcy(seqidno:11)
fas阻断肽7(fbp7):ycdehf-y(seqidno:10)
fas阻断肽a(fbpa):ycdehfay(seqidno:12)
对照肽(ctrp):ycnstvcy(seqidno:13)
2.细胞培养
作为人类血液癌细胞系的jurkat细胞系和作为鼠脂肪细胞的3t3l1细胞系购自atcc(usa),并将jurkat细胞系在含有10%胎牛血清(fbs)、1%青霉素、1%链霉素和25mm葡萄糖的rpmi培养基中培养。
将3t3l1细胞系在含有10%fbs、1%青霉素、1%链霉素和25mm葡萄糖的dmem培养基中培养。将3t3l1细胞系以2×105细胞/ml的浓度等分到上述dmem培养液中以诱导脂肪细胞成熟并持续3天,然后用含有胰岛素的培养液替换以再次诱导脂肪细胞成熟并持续3天。此后,将3t3l1细胞系在上述dmem培养液中进一步培养2天,以使脂肪细胞完全成熟。
3.细胞毒性和细胞凋亡实验
上文1.中所述的肽的细胞毒性实验通过cck-8分析试剂盒(dojindolaboratories,japan)进行。用各种浓度(um)的肽处理3t3l1细胞系并在24小时后分析细胞毒性。
用浓度为500ng/ml的fas配体(fasl)处理3t3l1细胞系以诱导细胞凋亡,并分别处理fbp信号阻断肽(fbp-8、fbp-a和fbp-7)和结合到alexa647的ctrfbp。肽处理4小时后,用dpbs洗涤细胞并用fitc结合的膜联蛋白v(bdpharmingen)处理以通过流式细胞仪分析细胞凋亡抑制作用。
4.动物实验
对本发明进行的所有动物实验均由汉阳大学机构动物护理和使用委员会批准。对6周龄的c57bl/6小鼠喂食高脂饮食并持续8周以制备肥胖症模型小鼠,并且当小鼠体重在42g至44g范围内时,将小鼠随机分为实验组。此后,根据实验组,通过静脉内注射每周两次施用60μg/一次的fbp8,共计5周(图13),或通过皮下注射每天两次施用fbp7。
5.组织免疫学分析
动物实验完成后,处死小鼠以分离肝脏组织和白色脂肪组织,并制备组织切片。将制备的肝脏组织和白色脂肪组织切片用抗原修复缓冲液在95℃下处理25分钟,然后在室温下冷却。此后,组织切片用tris基盐水+tween20(tbst,其含有1%牛血清白蛋白(bsa)、10%山羊血清和0.05%tween20)进行处理以经历封闭过程,并在4℃下与fas受体特异性-一抗反应18小时。此后,组织切片用tbst洗涤并在室温下与fitc结合的二抗反应2小时。
此外,为了检查肽的组织结合能力,在4℃下使alexa488所结合的肽与一抗反应18小时。细胞核用hoechst33342(gehealthcare)染色,用tbst洗涤,然后确认。
在tcs-sp共聚焦显微镜(leica,germany)下分析每个组织切片的荧光信号。
6.肽向组织的递送分析
将100μgalexa647结合的肽通过静脉内注射施用于肥胖症模型小鼠中,并且在12、24、48小时后,分离组织,并用imagestation荧光分析仪(carestream)分析每个组织的荧光信号。在荧光信号分析后,使用nih提供的imagej程序比较每个组织的相对荧光强度。
此外,将100μgalexa488结合的fbp通过静脉内注射施用于肥胖症模型小鼠中,以确认肽的细胞单元是否被递送至肝脏组织,并在12、24和48小时后通过分离肝脏组织制作冰冻组织切片。此后,用hoechst33342染色细胞核,并在tcs-sp5共聚焦显微镜下分析荧光信号。
7.组织学分析和tunel分析
肝脏组织和白色脂肪组织切片用苏木精和伊红染色,然后在光学显微镜下进行组织学分析。
此外,使用原位细胞死亡检测试剂盒(millipore,usa)对每个组织进行末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)分析。此后,通过用hoechst33342染色细胞核在tcs-sp5共聚焦显微镜下分析荧光信号,并用imagej程序分析每个细胞的荧光信号。
8.基因表达水平分析
使用rnaiso(takara,japan)从肝脏组织和白色脂肪组织中提取mrna,并使用iscriptcdna合成试剂盒(bio-radlaboratories,usa)合成cdna。此后,通过7500fastreal-timepcr系统(appliedbiosystems,usa)分析基因表达水平。将每个基因的表达水平用gapdh基因的表达水平归一化,然后计算为相对于对照的相对基因表达水平。
9.葡萄糖耐受不良和胰岛素抵抗的分析
对于葡萄糖耐受不良分析,通过腹腔内注射将2g/kg剂量的葡萄糖注射到保持禁食状态12小时的每个实验组中,并通过accu-check(roche,usa)测量30、60、120分钟后的血糖水平。
通过腹腔内注射将0.75u/kg剂量的胰岛素注射到保持禁食状态4小时的每个实验组中后30分钟、60分钟和120分钟测量血糖水平来分析胰岛素抵抗。
10.其他分析
用elisa试剂盒(ebioscience,usa)分析血清和组织的细胞因子水平,并用甘油三酯测定试剂盒(cayman,usa)确认肝脏组织的甘油三酯水平。
11.统计分析
对于实验结果,当存在两个不同的实验组时,使用非参数mann-whitneyu分析,并且当存在三个或更多个实验组时,通过单因素方差分析确认统计显著性。graphpadprism5程序用于统计分析。0.05或更小的p值被确定为具有统计学意义。
实验结果
1.确认fas阻断肽与fas表达细胞系的结合力及fas信号控制的效果
除了先前揭示的fas信号传导抑制肽(ycdehfcy、fbp-8)之外,还制备了具有两种修饰序列的肽fbp-a(ycdehfay)和fbp-7(ycdehfy),并确认了其与表达fas的细胞系的特异性结合力和信号控制的效果。
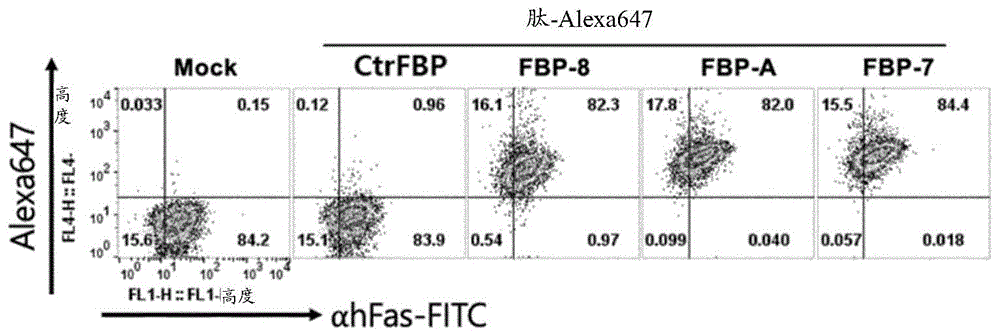
fas始终在其中表达的jurkat细胞系用fitc标记的fas抗体处理,并用alexa647标记的fbp-8、fbp-a、fbp-7或对照肽(ycnstvcy;ctrfbp)处理。此后,作为分析荧光信号的结果,可以看出,由于在对照(ctrfbp;对照肽处理组)中几乎没有确认到alexa647信号,因此对照肽几乎不与jurkat细胞结合,并且可以确认fbp-8-、fbp-a-和fbp-7-处理组以相似水平结合到jurkat细胞(图1)。
此外,作为确认用fas配体(fasl)和针对fas信号传导的抑制肽处理jurkat细胞系后的细胞凋亡水平的结果,fbp-8、fbp-a和fbp-7全部表现出以相似水平抑制fas信号传导的作用。具体而言,可确认阴性对照(ctrfbp)具有与未处理组(mock;未用任何肽处理的实验组)相似的细胞凋亡水平(分别为31±2.32%和29±3.24%),但是fbp-8、fbp-a和fbp-7处理组分别表现出17±4.11%、15±5.26%和14±3.22%的细胞凋亡水平,因此与未处理组(mock)相比,细胞凋亡得到有效抑制(图2a)。此外,作为确认环状fbp-8、线性fbp-8和fbp-7的血清稳定性的结果,可以看出fbp-7是最好的(图2b)。
此外,对具有与jurkat细胞系不同的fas信号传导途径的3t3l1细胞系进行了相同的实验。可确认,当分化的3t3l1细胞系用100μm至1000μm的各种浓度的fbp-8处理时,几乎没有观察到细胞毒性(图3),并且与未处理组(mock+)和阴性对照(ctrfbp)相比,用fas配体和fbp-8的联合处理显著抑制了细胞凋亡。每个实验组的细胞凋亡水平分别为25±3.31%、23±5.12%和14±2.98%(图4)。
fbp-8的优异的fas信号传导抑制作用也可通过炎症相关基因的表达水平来确认。可观察到,当分化的3t3l1细胞系用fas配体和fbp-8联合处理时,炎症相关基因fas、tnf-α、单核细胞趋化蛋白-1(mcp-1)、f4/80、il-6和诱导型一氧化氮合酶(inos)的表达显著降低(图5)。
可以看出,抑制这些炎症相关基因的表达导致炎症相关细胞因子的产生减少,并且fbp-8处理降低了细胞培养液中il-6和mcp-1的浓度(图6)。这些结果意指fbp-8处理可有效抑制fas衍生的炎症相关信号传导通路。
此外,脂肪细胞的炎症导致细胞凋亡,因此最终细胞内储存的脂肪酸(ffa)被释放到细胞外,但fbp-8处理也显著抑制了脂肪酸的细胞外释放(图7)。
2.fas结合肽与非酒精性脂肪性肝炎动物模型中肝脏组织和白色脂肪组织的特异性结合能力评价
当对正常体重的小鼠喂食高脂肪饮食时,该小鼠成为肥胖症模型小鼠,在这种情况下,肝脏组织或白色脂肪组织中fas的表达水平增加。具体地,作为确认高脂肪饮食(hfd)组的白色脂肪组织(wat)和肝脏组织中fas的表达水平的结果,可以看出分别与正常对照饮食(ncd)相比,该水平增加了4倍和3倍(图8a和图8b)。可以看出,特别是在高脂肪饮食(hfd)组的情况下,fas的表达水平也随着体重的增加而成比例增加(8c)。这种表达的增加可通过实际组织中表达fas的细胞比例的增加来进一步确认,与正常饮食组(ncd)相比,高脂肪饮食(hfd)组的白色脂肪组织和肝脏组织中的表达fas的细胞的比例分别增加至70%和75%(图8d)。
此外,当从高脂肪饮食(hfd)组中分离出的肝脏组织切片和白色脂肪组织切片用fas-特异性抗体和荧光标记的fbp-8处理时,染色位点重合(图9),这意指fbp-8有效结合到由于肥胖症而过度表达的fas。
基于通过实验确认的fbp-8的fas特异性结合能力,确认了当通过静脉内注射或皮下注射全身给药时,fbp-8可特异性地递送至肝脏组织还是脂肪组织。将荧光标记的fbp-8通过静脉内注射或皮下注射注射到高脂饮食组的肥胖症模型小鼠中,并在24、48小时后,通过分离各器官研究荧光分布。
结果,可以看出,与阴性对照(ctrfbp)相比,通过皮下注射而注射的fbp-8被特异性地递送至肝脏组织,并且保留在肝脏组织中直至48小时或更晚(图10a)。通过静脉内注射而注射的fbp-8被特异性递送至肝脏组织和白色脂肪组织(图10b)。观察肝脏组织切片的结果发现,通过静脉内注射而注射的fbp-8从注射后12小时开始有效递送至肝脏组织,并保留在肝脏组织中直至注射后48小时(图11)。
可确认,当通过静脉注射(iv)或皮下注射(sc)将fbp-8注射到正常小鼠中时,不能在肝脏组织中观察到显著的荧光信号,从而指示fbp-8没有被递送到肝脏(图12)。
通过图10至图12的结果,可以看出,肥胖症增加了肝脏组织和白色脂肪组织中fas受体的表达,并且fbp-8特异性结合到表达fas的肝脏组织和白色脂肪组织。
3.评价通过全身给药fbp对非酒精性脂肪性肝炎、胰岛素抵抗和代谢性疾病的治疗效果
由于在图10和11中确认了通过静脉内注射而注射的fbp-8被递送至肥胖症模型小鼠的肝脏组织和白色脂肪组织,所以确认通过全身给药fbp导致的对fas信号传导的控制,是否有可能在肝脏组织和白色脂肪组织中获得减轻炎症和抑制细胞凋亡的作用。
肥胖症模型小鼠通过对正常小鼠喂食高脂肪饮食并持续8周来产生,并且fbp-8通过每周两次静脉内注射来施用,共计5周(图13)。五周后处死肥胖症模型小鼠,分离白色脂肪组织和肝脏组织,并且通过tunel染色分析死亡细胞比例。
作为分析的结果,确认了在肝脏组织的情况下,未给药组(mock)和阴性对照(ctrfbp)的死亡细胞比例分别为19±5.28%和17±7.98%,然而fbp-8处理组中的死亡细胞的比例示为9±2.37%,因此显著减少(图14)。
可以看出,在白色脂肪组织的情况下,未给药组(mock)和阴性对照(ctrfbp)中的死亡细胞比例分别为55±3.42%和51±2.98%,然而fbp-8处理组中的死亡细胞比例示为31±2.37%,因此显著减少(图15)。
由fbp-8控制fas信号传导的效果不仅抑制细胞凋亡,而且抑制炎症反应,并且作为确认作为白色脂肪组织中促炎性巨噬细胞标记的f480和cd11c的表达水平的结果,可看出与阴性对照(ctrfbp)相比,fbp-8处理组中的表达水平显著降低,因此,白色脂肪组织中的炎症反应被抑制(图16)。
此外,与阴性对照(ctrfbp)相比,通过巨噬细胞在白色脂肪组织中的脂肪细胞周围聚集而形成的冠状结构(cls)在fbp-8处理组中也显著减少(图17),并且在白色脂肪组织中,与阴性对照(ctrfbp)相比,炎症相关基因如fas、tnf-α、mcp-1和il-6在fbp-8处理组中的表达也减少(图18)。
虽然在肥胖状态下,白色脂肪组织中产生的促炎性细胞因子通过血液输送到肝脏组织引起炎症,但可确认血液中的il-6和mcp-1的浓度在fbp-8-治疗组中减小(图19)。
即使在肝脏组织中,也可确认与白色脂肪组织相似的抗炎作用,并且与阴性对照(ctrfbp)相比,作为促炎性巨噬细胞标记的f480和cd11c的表达水平在fbp-8治疗组中降低,并且作为抗炎性巨噬细胞标记的cd206的表达水平没有显著变化(图20)。与阴性对照(ctrfbp)相比,炎症相关基因如fas、tnf-α、mcp-1和il-6的表达水平在fbp-8治疗组中也显著减少(图21)。
根据肥胖症模型小鼠胰岛素抵抗的增加,fbp-8的全身给药也改善了葡萄糖代谢障碍。具体地讲,可观察到,在葡萄糖耐受测试(gtt)和胰岛素耐受测试(itt)中,阴性对照(ctrfbp)的血糖水平变化与未给药组()mock)相似,但与阴性对照(ctrfbp)相比,fbp-8处理组改善了葡萄糖代谢(图22和23)。
每个实验组的每日进食没有显著变化(图24a),但与阴性对照(ctrfbp)相比,fbp-8处理组趋于具有较慢的体重增加(图24b)。
fbp-8的全身给药减轻了炎症,抑制了细胞凋亡,并且改善了肝脏组织和白色脂肪组织的葡萄糖代谢障碍,因此改善了由肥胖症引起的非酒精性脂肪性肝炎。
具体地讲,作为在肥胖症模型小鼠的肝脏组织中确认的结果,与阴性对照(ctrfbp)相比,作为脂肪生成基因的硬脂酰基-coa去饱和酶(scd-1)的表达水平在fbp-8治疗组中降低了约30±5.32%(图25),并且与阴性对照(ctrfbp)相比,血液中脂肪酸和胰岛素的浓度也降低了约20%(图26)。在fbp-8治疗组的情况下,肝脏组织和血液中甘油三酯(tg)的浓度分别降低了约50%和约25%(图27)。
此外,在fbp-8处理组中,与阴性对照(ctrfbp)相比,肝脏组织的尺寸更小且重量更轻(图28),并且通过肝脏组织切片的组织学分析,可以观察到对肝组织的损伤在fbp-8治疗组中被抑制(图29)。甚至从测量作为评价肝脏组织功能的主要指标的血液丙氨酸氨基转移酶(alt)水平的结果,也可确认与阴性对照(ctrfbp)相比,alt水平在fbp-8治疗组中降低了30%或更多(图30)。
4.评价通过经由皮下注射全身给药fbp-7对非酒精性脂肪性肝炎、胰岛素抵抗和代谢性疾病的治疗效果
肥胖症模型小鼠通过对正常小鼠喂食高脂饮食并持续8周来制备,并且每天两次皮下注射施用fbp-7,共计3周。施用对照肽作为阴性对照(ctrfbp),并施用可作为肥胖症治疗剂的商购获得的利拉鲁肽(商品名:saxenda)作为阳性对照。
三周后处死肥胖症模型小鼠,分离肝脏组织,通过tunel染色分析死亡细胞比例。结果,fbp-7给药组中的死亡细胞比例为10±2.45%,这显著低于未给药组(mock)和阴性对照(ctrfbp),并且fbp-给药组表现出与作为阳性对照的利拉鲁肽给药组相似的水平(11±4.89%)(图31)。
通过施用fbp-7也抑制了肝脏组织中的炎症反应。与阴性对照(ctrfbp)相比,在fbp-7-给药组中,作为促炎性巨噬细胞标记基因的f480和cd11c的表达水平降低,而作为抗炎性巨噬细胞标记的cd206的表达水平显著增加(图32)。具体地,与利拉鲁肽给药组相比,fbp-7给药组中的cd206的表达水平增加更多,并且f4/80的表达水平显著降低。
与阴性对照组(ctrfbp)相比,炎症相关基因tnf-α、mcp-1和il-6的表达水平在fbp-7给药组中也降低(图33),并且作为炎症主要标记的fas的表达在fbp-7治疗组的肝脏组织中也显着降低(图34)。通过抑制此类肝脏组织中的炎症反应,促炎性细胞因子il-6和mcp-1的血液水平也降低(图35)。
通过全身递送fbp-7抑制炎症反应的效果也导致了改善葡萄糖代谢障碍的效果。在葡萄糖抵抗评价实验中,与阴性对照(ctrfbp)相比,fbp-7给药组示出优异的血糖升高减缓效果和正常的血糖恢复,从而减轻了葡萄糖代谢障碍,并示出与利拉鲁肽相似的改善作用(图36)。
由于葡萄糖代谢障碍的这种改善,与阴性对照相比,fbp-7给药组的体重增加被显着抑制(图37),并且fbp-7给药组也示出进食略有减少的模式(图38)。
fbp-7给药对减轻肝脏组织中的炎症和抑制细胞凋亡的作用最终改善了由肥胖症引起的非酒精性脂肪性肝炎。
与阴性对照(ctrfbp)相比,fbp-7给药组的肝脏组织重量减少(图39),并且肝脏组织切片的组织学分析也示出与利拉鲁肽给药组相似水平的抑制组织损伤的效果(图40)。
此外,与阴性对照(ctrfbp)相比,参与肝脏中脂肪积累的基因ppar-γ的表达水平在fbp-7给药组中降低,并且该表达降低效果甚至优于作为阳性对照的利拉鲁肽给药组(图41)。此外,与阴性对照(ctrfbp)相比,可以确认,肝脏组织中的甘油三酯水平和血液脂肪酸浓度在fbp-7给药组中也显著降低(图42和43),并且作为评价肝脏组织功能的主要指标的血液丙氨酸氨基转移酶(alt)水平在fbp-7给药组中显著降低(图44)。
本发明的针对fas信号传导的抑制肽当通过静脉内注射而注射到肥胖症模型小鼠中时,被特异性递送至肝脏组织和白色脂肪组织,当通过皮下注射而注射到肥胖症模型小鼠中时被特异性递送至肝脏组织。在注射后抑制肽结合到肥胖症期间在肝脏和脂肪组织中大量表达的fas,然后通过阻断下游信号抑制炎症反应和细胞凋亡,因此可抑制体重增加、脂肪积累等。
<110>斯格尼特生物技术有限公司
<120>包含针对fas信号传导的抑制肽的用于预防或治疗肥胖症、脂肪肝或脂肪性肝炎的药物组合物
<130>x19u10c0246_o20190328wo
<150>kr10-2018-0154274
<151>2018-12-04
<160>13
<170>kopatentin3.0
<210>1
<211>5
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>1
cysaspgluhisphe
15
<210>2
<211>6
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>2
cysaspgluhisphetyr
15
<210>3
<211>6
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>3
cysaspgluhisphecys
15
<210>4
<211>6
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>4
cysaspgluhispheala
15
<210>5
<211>7
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>5
cysaspgluhisphecystyr
15
<210>6
<211>7
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>6
cysaspgluhisphealatyr
15
<210>7
<211>6
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>7
tyrcysaspgluhisphe
15
<210>8
<211>7
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>8
tyrcysaspgluhisphecys
15
<210>9
<211>7
<212>prt
<213>人工序列
<220>
<223>fas结合肽
<400>9
tyrcysaspgluhispheala
15
<210>10
<211>7
<212>prt
<213>人工序列
<220>
<223>fas结合肽-7(fbp-7)
<400>10
tyrcysaspgluhisphetyr
15
<210>11
<211>8
<212>prt
<213>人工序列
<220>
<223>fas结合肽-8(fbp-8)
<400>11
tyrcysaspgluhisphecystyr
15
<210>12
<211>8
<212>prt
<213>人工序列
<220>
<223>fas结合肽-a(fbp-a)
<400>12
tyrcysaspgluhisphealatyr
15
<210>13
<211>8
<212>prt
<213>人工序列
<220>
<223>对照肽
<400>13
tyrcysasnserthrvalcystyr
15
- 还没有人留言评论。精彩留言会获得点赞!