结肠药物递送制剂的制作方法
本发明涉及延迟释放药物制剂,其包括含有药物的核心和延迟释放包衣。具体地,本发明涉及用于递送至结肠的延迟释放制剂。
背景技术:
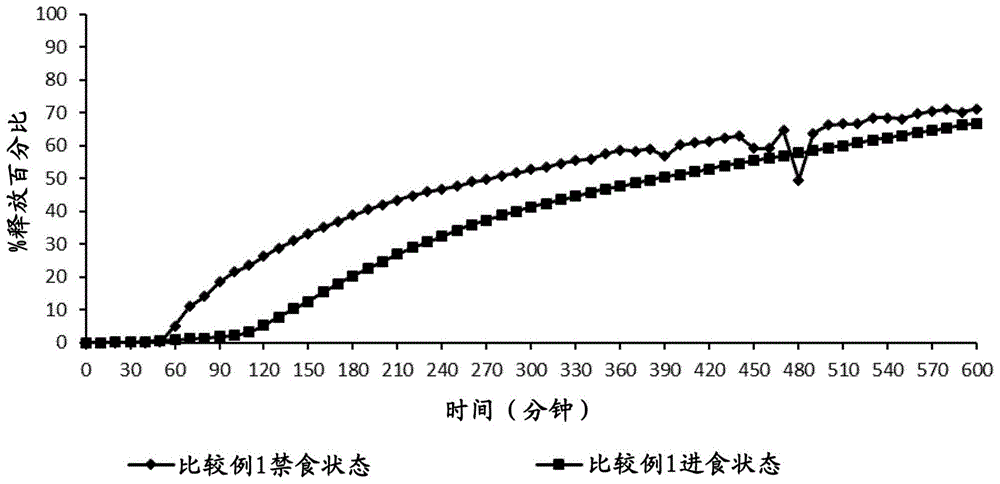
:将药物靶向至肠是众所周知的,并且已知超过一百年。通常,药物的靶点是小肠,尽管结肠可以用作实现局部治疗或全身治疗的手段。对药物上的包衣的要求根据靶点位置不同而不同。为了到达结肠,药物需要通过小肠,并且因此需要预期在结肠中释放药物的延迟释放包衣不会在小肠中释放药物。用于在小肠中释放的包衣产品通常使用以ph依赖方式溶解或崩解的聚合物包衣。在胃的低ph环境中,聚合物包衣是不溶的。然而,在到达小肠后,ph升至5以上,并且聚合物包衣溶解或崩解。一般使用的包衣是含有可离子化的羧酸基团的包衣。在较高的ph水平,所述羧酸基团离子化,使得聚合物包衣崩解或溶解。所使用的该类型的常见聚合物包括l和s。已知多种通过确保药物的较早释放而改善在小肠中的释放的方法。us2008/0200482是多个公开了部分中和羧酸基团以降低发生崩解时的ph值的参考文献之一。wo2008/135090公开了一种片剂,其包括部分中和材料的内层包衣和具有较少中和或没有中和的外层包衣。这据说在从胃中转移时的较早时间点引起崩解。药物在结肠中的释放通常需要备选的方法。结肠易感多种疾病,包括炎症性肠病、肠易激综合症、便秘、腹泻、感染和癌症。在这些病况中,靶向结肠的药物将会最大化治疗的疗效。也可将结肠用作药物进入体循环的入口。已经为结肠药物递送开发了多种制剂,包括前药及配方剂型,后者更加常见,因为该理念已被证明可应用于其他药物。在开发结肠药物递送剂型中,通过将天然生成的多糖(其构成常驻结肠细菌生产的多种酶的底物)用作可消化的载体材料,也利用了结肠内的高细菌菌落。这些材料能够完整地通过上胃肠道区,但在进入结肠后被消化。其实例包括:淀粉、直链淀粉、支链淀粉、果胶、壳聚糖和半乳甘露聚糖和瓜儿胶。在该细菌酶方法中使用多糖来进行结肠药物递送的一个主要的吸引力是,所使用的材料至少是食品级的,所以可安全地用于人类。常把它们用作包衣或作为基质载体掺入核心材料,而当它们进入结肠后被结肠细菌酶消化导致释放药物负载。该制剂的实例(使用直链淀粉包衣)公开于ep0343993a(btg国际有限公司(btginternationallimited))。但是,这些天然材料的主要的局限是,它们在含水介质中过度膨胀,这导致药物负载在上胃肠道区浸出。为了避免该问题,已经使用了天然存在的物质与多种水不溶性材料的混合物。ep0502032a(英国技术集团有限公司(britishtechnologygroupltd))教导了如下用于含活性化合物片剂的外层包衣的应用,所述外层包衣包括成膜用纤维素或丙烯酸酯聚合物材料和无定形直链淀粉。所使用的聚合物材料是不依赖ph释放的聚合物材料。控制释放杂志(journalofcontrolledrelease)中的一篇文章(milojevic等人;38卷;(1996年);第75-84)报道了关于将一系列不溶性聚合物掺入直链淀粉包衣以控制直链淀粉膨胀的研究结果。评价了一系列纤维素和基于丙烯酸酯的共聚物,并且发现市购可得的乙基纤维素最有效地控制膨胀。使用了l100的依赖于ph的可溶性包衣,但是仅用于多层系统,所述多层系统包含用直链淀粉的内层包衣包被并且再用l100的外层包衣包被的生物活性物质。wo99/21536a(英国技术集团有限公司)公开了另一种基于直链淀粉的包衣组合物。该包衣组合物包含直链淀粉与由非水溶性的纤维素或丙烯酸酯聚合物材料制成的非水溶性不依赖于ph的成膜聚合物的混合物。wo99/25325a(英国技术集团有限公司)也公开了包含直链淀粉和乙基纤维素(优选)或可选的不溶性丙烯酸酯聚合物的延迟释放包衣。该包衣组合物还包含增塑剂,并且所述方法发现具体应用于制备包含在60℃以上不稳定的活性物质的剂型,因为该组合物在低于该温度下制成。wo03/068196a(利茨默治疗有限公司(alizymetherapeuticsltd))公开了用于生物活性的泼尼松龙间苯磺酸钠的特异性延迟释放包衣,该包衣包括玻璃状直链淀粉、乙基纤维素和癸二酸二丁酯。gb2367002(英国糖业公司(britishsugarplc))公开了在延迟释放包衣中使用多糖而不是无定形直链淀粉。其实例包括瓜儿胶、刺梧桐树胶、黄芪胶和黄原胶。将这些多糖的微粒分散于由例如纤维素衍生物、丙烯酸聚合物或木素制成的非水溶性成膜用聚合物基质中。wo01/76562a(坦佩雷代理人(tampereenpatenttitoimistooy))公开了含有药物和用于控制其释放的壳聚糖(由壳多糖得到的多糖)的口服药物制剂。将该药物和壳聚糖混合成均匀的机械性粉状混合物,经制粒,然后任选地制成片剂。可以使用肠溶聚合物(如甲基丙烯酸的共聚物)进行制粒,或者所述颗粒可以提供有多孔肠溶包衣。wo2004/052339a(赛诺菲那公司(salvonallc)公开了依赖于ph的药物释放系统,其是固体疏水性纳米球的自由流动的粉剂,含有包裹在ph敏感性微球胶囊内的药物。所述纳米球由药物和蜡材料制成,所述ph敏感性微球由ph敏感性聚合物(如聚合物)和水敏感性材料(如多糖)制成。欧洲药物科学杂志(europeanjournalofpharmaceuticalsciences)中的一篇文章(akhgari等人;28卷;2006年3月;第307-314页)报道了将某些聚甲基丙烯酸酯聚合物,尤其用于控制菊粉膨胀的研究结果。所测试的聚甲基丙烯酸酯聚合物是rs、rl、rs和rl的1:1混合物、fs以及rs和s的1:1混合物。us5422121(罗姆化学(gmbh))公开了具有被包入壳材料内的、含至少一种活性成分的核心的口服剂型,所述壳材料包含在结肠内分解的多糖以及与其混合的成膜用聚合物。多糖与成膜用聚合物的重量比为1:2至5:1,优选为1:1至4:1。可以使用耐胃液性隔离层来抑制活性成分从核心的过早扩散。参考文献尤其例证了具有l30d的内隔离层和含l30d和瓜尔胶的外层的片剂(实施例2)。wo96/36321a公开了包含核心(含比沙可啶)和用于核心的肠溶聚合物包衣(所述包衣包含至少一种内包衣层和外包衣层)的口服剂型。所述或各内包衣层是在约5至约6.3的ph值下开始溶于含水介质中的肠溶聚合物,并且外包衣层是在约6.8至约7.2的ph值下开始溶于含水介质中的肠溶聚合物。用于内层的肠溶聚合物包衣材料选自邻苯二甲酸醋酸纤维素;乙酸偏苯三酸纤维素;羟丙基甲基纤维素邻苯二甲酸酯;醋酸羟丙基甲基纤维素琥珀酸酯;聚醋酸乙烯邻苯二甲酸酯;聚(甲基丙烯酸,甲基丙烯酸甲酯)1:1;聚(甲基丙烯酸,丙烯酸乙酯)1:1;以及其可兼容的混合物。wo2007/122374a公开了一种结肠药物递送制剂,其中使用了ph依赖的成膜用聚合物材料和多糖如淀粉的混合物。尽管已知该制剂显示出药物的延迟释放,随后相对快速的释放,但是如果药物在结肠中释放更快会更是所希望的。wo2013/164315a和wo2013/164316a公开了结肠药物递送制剂,其中使用了ph依赖的成膜用聚合物材料和多糖如淀粉的混合物作为外层。使用在小肠液和胃肠液体中可溶解的内层,其选自部分中和的聚羧酸聚合物和非离子聚合物。所述内层包括非离子聚合物,另外包括缓冲剂和/或碱。技术实现要素:根据本发明的第一方面,提供了一种用于口服给药以将药物递送至受试者的结肠的延迟释放药物制剂,所述制剂包括:核心和用于所述核心的包衣,所述核心包括药物,并且所述包衣包括外层和内层,其中,所述外层包括具有约ph值6以上的ph阈值的成膜用肠溶聚合物,并且其中,所述内层包括可溶于小肠液或胃肠液的成膜用非离子聚合物和缓冲剂,基于所述非离子聚合物的干重,所述缓冲剂的量为大于约20wt%至约60wt%。令人惊讶地发现,不仅当本发明的延迟释放药物制剂已预先暴露于禁食状态模拟胃液(fassgf)时,而且当本发明的延迟释放药物制剂暴露于进食状态模拟胃液(fssgf)时,该延迟释放药物制剂在克雷布氏(krebs)缓冲液(ph7.4)中有利地显示出未改变的释放曲线。这是有利的,因为使用本发明制剂的药物释放是相对恒定的,与服用药物制剂的时间或使用者的饮食无关。此外,药物的加速释放机制与胃的状态无关,即,该胃处于“进食”状态还是“禁食”状态。本发明的制剂不包括含有肠溶材料的中间层是另一个优点。所述肠溶材料相对昂贵,因此,不存在含有此类材料的中间层且同时保持性能,将降低生产延迟释放制剂的成本。此外,当中和肠溶聚合物以允许形成水性包衣组合物时,需要大量的增塑剂以允许良好的形成膜并且避免脆性。本发明的另一个技术优势(例如,与wo01/76562a中公开的制剂相比)是,在较长的时间段内基本上不释放药物(即,同时包衣溶解),随后药物相对快速地释放。这与wo01/76562a中描述的维持缓释基质片剂形成对比,其药物释放曲线从开始就是渐进的而不是延迟的,然后是脉动释放。外层所述外层包含具有约ph6或以上的ph阈值的成膜用肠溶聚合物。在优选的实施方式中,所述外层包含肠溶聚合物和被结肠酶降解的可酶降解的聚合物的混合物。已经发现,以适当比例将两种合适的聚合物的混合物作为薄膜包衣施加到核心上,至少使药物在胃和小肠中的释放最小化,并且可以基本上消除药物在胃和小肠中的释放。据信随后在结肠中的药物释放是通过组合的活性生理触发剂而发生的,即通过第二材料(特别是s)的溶解和第一材料(如淀粉或直链淀粉)的消化。可酶降解的聚合物与成膜用肠溶聚合物的比例通常至少为1:99,例如,至少10:90且优选至少25:75。该比例通常为不超过99:1,例如,不超过75:25且优选不超过60:40。在一些实施方式中,该比例可以为不大于35:65。在一些优选的实施方式中,该比例为从10:90至75:25,例如,从10:90至60:40,优选从25:75至60:40。在一些特别优选的实施方式中,该比例为从15:85至35:65,例如,从25:75至35:65且优选约30:70。在其它特别优选的实施方式中,该比例为从40:60到约60:40,例如,约50:50。核心的外包衣的厚度通常为约10μm至约300μm。然而,具体包衣的厚度将取决于包衣的组成和所述核心的尺寸。例如,包衣厚度与包衣中多糖的量成正比。因此,在外层包衣包括约30:70的比率的高直链淀粉和s的实施方式中,包衣厚度可以为约70μm至约300μm,并且优选地为约150μm至约250μm。给定的包衣组成的厚度(μm)取决于核心尺寸。所述外层中的肠溶聚合物的量与所述核心的尺寸无关。外包衣通常具有约2mg/cm2至约10mg/cm2的肠溶聚合物的包衣量,例如,约2mg/cm2至约8mg/cm2,或约3mg/cm2至约8mg/cm2,或约4mg/cm2至约8mg/cm2,或约5mg/cm2至约8mg/cm2,或约6mg/cm2至约8mg/cm2,或约7mg/cm2至约8mg/cm2,例如,约7.5mg/cm2。当所述外层仅仅包括成膜用肠溶聚合物时,以及当所述外层包括成膜用肠溶聚合物和可酶降解的聚合物的混合物时,这是适用的。典型的核心的直径为约约5×10-4m至约25mm。想要说的是,外包衣包括多糖和肠溶聚合物的混合物,意图排除已知的多层剂型(例如,在milojevic等人文献中所公开的,如上所述),其中,活性核心首先用直链淀粉的内包衣包被,然后用l100的外包衣包被。在本发明的上下文中,这样的多层剂型没有包含淀粉和l100的混合物。所述外包衣优选是单层多糖和肠溶聚合物的混合物,优选是均质混合物。所述外层可以任选地包含一种或多种用于聚合物膜的常规赋形剂,例如,用于成膜的增塑剂(例如,柠檬酸三乙酯(tec))、表面活性剂(例如,聚山梨醇酯80)、防粘剂(例如,单硬脂酸甘油酯)和颜料(例如,氧化铁红或氧化铁黄)。这些任选的赋形剂可以包含在聚合物包衣配混物的最终组合物中,其量可以高达30wt%。成膜用肠溶聚合物所述外层包括具有约ph6以上的ph阈值的成膜用肠溶聚合物。所述成膜用肠溶聚合物对ph敏感,并且具有约ph6以上的ph阈值。“ph阈值”是指低于该ph值不溶且等于或高于该ph值是可溶时的ph值。因此,周围介质的ph值触发肠溶性聚合物的溶解。由此,在低于该ph阈值下,没有(或基本上没有)肠溶性聚合物溶解。一旦周围介质的ph值达到(或超过)该ph阈值,第二材料就变得可溶。“不溶”是指1g的第二材料在给定的ph值下需要超过10,000ml的溶剂(周围介质)来溶解。“可溶”是指1g的聚合物材料在给定的ph值下需要少于10,000ml,优选少于5,000ml,更优选少于1000ml,甚至更优选少于100ml或10ml的溶剂来溶解。“周围介质”优选是指胃肠道中的介质,例如,胃液或肠液。或者,所述周围介质可以是胃肠道中介质的体外等效物。胃液的正常ph值通常在ph为1~3的范围内。肠溶性聚合物在ph值6以下不溶,并且在ph值约6以上时可溶,因此通常不溶于该胃液。肠液的ph值从十二指肠的约6逐渐增加到远端小肠的约7~8。所述肠溶聚合物优选在低于ph6.5下是不溶的(并且在约ph6.5以上是可溶的),更优选在低于ph7下是不溶的(并且在约ph7以上时是可溶的)。可以通过简单的滴定技术确定材料变得可溶的ph阈值,这是本领域技术人员公知常识的一部分。合适的成膜用肠溶性聚合物的实例包括丙烯酸酯聚合物、纤维素聚合物或聚乙烯基聚合物。合适的纤维素聚合物的实例包括邻苯二甲酸乙酸纤维素(cap)和羟丙基甲基纤维素乙酸琥珀酸酯。所述成膜用肠溶聚合物优选是(甲基)丙烯酸和(甲基)丙烯酸c1-4烷基酯的共聚物,例如,甲基丙烯酸和甲基丙烯酸甲酯的共聚物。这种聚合物被称为聚(甲基丙烯酸/甲基丙烯酸甲酯)共聚物。这种共聚物的合适例子是阴离子型且不是维持释放的聚甲基丙烯酸酯。这些共聚物中羧酸基团与甲酯基团的比率(“酸:酯比率”)决定了该共聚物可溶的ph值。酸:酯之比可以为约2:1至约1:3,例如,约1:1或优选约1:2。优选的阴离子共聚物的分子量(mw)通常为约120,000至150,000g/mol,优选为约135,000g/mol。优选的阴离子聚(甲基丙烯酸/甲基丙烯酸甲酯)共聚物包括l(酸:酯比率为约1:1;mv分子量为约135,000;ph阈值为约6);s100(酸:酯比率为约1:2;mv分子量为约135,000;ph阈值为约7);以及fs(聚(丙烯酸甲酯/甲基丙烯酸甲酯/甲基丙烯酸酯);酸:酯比率为约1:10;mv分子量为约220,000;ph阈值为约7)。所述成膜肠溶聚合物可以是甲基丙烯酸和丙烯酸乙酯的共聚物。l100-55聚(甲基丙烯酸/丙烯酸乙酯);酸:酯比率为约1:1;mv分子量为约250,000;ph阈值为约6。共聚物由德国达姆施塔特赢创公司(evonik,darmstadt,germany)制造和/或分销。可以合适地使用成膜用肠溶聚合物的混合物。合适混合物的实例包括l和s100的混合物,例如,l和s100的1:1混合物。然而,优选单独使用特定的成膜用聚合物材料,例如,聚(甲基丙烯酸/甲基丙烯酸甲酯)共聚物。仅仅使用s100作为成膜用肠溶聚合物是特别优选的。优选地,示例性聚合物以至少部分中和形式用作成膜用肠溶聚合物,即至少一部分,例如,至少10%,优选15%和20%(基于摩尔量),更优选至少50%,最优选至少90%的羧酸基团以羧酸盐阴离子的形式存在。可酶降解的聚合物如以上所讨论的,所述外层包括成膜用肠溶聚合物与被结肠酶降解的可酶降解的聚合物的混合物。所述可酶降解的聚合物通过在受试者的结肠中发现的一种或多种酶(结肠细菌酶)进行降解。这种酶是由结肠细菌产生的,并且包括淀粉酶(amylases)如α-淀粉酶、β-淀粉酶和异淀粉酶;淀粉酶(amylopullunase);葡糖淀粉酶;α-葡糖苷酶;麦芽糖淀粉酶;糖基转移酶和麦芽糖转葡糖基酶(amylomaltase)。本领域技术人员能够使用包括部分常识的技术来确定材料是否易受结肠细菌攻击。例如,可以将预定量的给定材料暴露于包含来自结肠中发现的细菌的酶的测试,并且可以测量材料的重量随时间的变化。或者,可以测量作为结肠细菌酶作用的结果而产生的降解产物的量。可酶降解的聚合物优选是多糖。合适的多糖选自淀粉、直链淀粉、支链淀粉、壳聚糖、硫酸软骨素、环糊精、右旋糖酐、普鲁兰多糖(pullulan)、角叉菜胶、小核菌葡聚糖、壳多糖、凝胶多糖(curdulan)和果聚糖。所述多糖优选是淀粉。淀粉通常从自然来源如谷物、豆类和块茎中提取。用于本发明的合适淀粉通常是食品级淀粉,包括大米淀粉;小麦淀粉;玉米(或包谷)淀粉;豌豆淀粉;土豆淀粉;红薯淀粉;木薯淀粉;高粱淀粉;西米淀粉和箭根淀粉。玉米淀粉的应用示例如下。淀粉通常是两种不同多糖,即直链淀粉和支链淀粉的混合物。不同的淀粉可以具有不同比例的这两种多糖。大多数天然(未改性)的玉米淀粉具有约20重量%至约30重量%的直链淀粉,其余的至少基本上由支链淀粉组成。合适的淀粉包括“高直链淀粉”和“低直链淀粉”淀粉。高直链淀粉是特别优选的。“高直链淀粉”的淀粉是具有至少50重量%直链淀粉的淀粉。特别合适的淀粉具有约50重量%至约75重量%的直链淀粉,优选约50重量%至约70重量%,更优选约50重量%至约65%(重量),最优选约50重量%至约60%,例如,约55重量%。“低直链淀粉”的淀粉是具有小于50重量%的直链淀粉和至少50重量%的支链淀粉的淀粉,例如,最高达75重量%的支链淀粉,甚至最高达99重量%的支链淀粉。适用于本发明的淀粉通常具有至少0.1重量%,例如,至少10重量%或15重量%,优选至少35重量%的直链淀粉。这样的淀粉具有不超过99.9重量%,例如,不超过90重量%或85重量%,优选不超过65重量%的支链淀粉。这样的淀粉可以具有至多约99重量%的直链淀粉和不少于1重量%的支链淀粉。适用于本发明的淀粉可以具有最高达100%的支链淀粉,更典型地为约0.1重量%至约99.9重量%的支链淀粉。所述淀粉可以是例如未改性的蜡质玉米淀粉。这通常包含约100%支链淀粉。优选的淀粉具有不超过50重量%的支链淀粉。特别合适的淀粉具有约25重量%至约35重量%的支链淀粉,例如,约30重量%支链淀粉。本领域技术人员能够确定任何给定淀粉中直链淀粉和支链淀粉的相对比例。例如,可以使用由近红外光谱(nir),通过使用实验室生产的已知量的这两种组分的混合物由nir获得的标准曲线来确定淀粉中的直链淀粉和支链淀粉含量。此外,可以使用淀粉葡糖苷酶将淀粉水解为葡萄糖。酶催化的一系列磷酸化和氧化反应导致还原的烟酰胺腺嘌呤二核苷酸磷酸(nadph)的形成。形成的nadph的量与原始葡萄糖含量是化学计量的。可获得用于该程序的合适测试试剂盒(例如,由德国r-biopharm公司获得的)。可以使用的另一种方法包括使包衣经历被细菌酶(例如,α-淀粉酶)消化,以生产短链脂肪酸(scfa),其可以通过使用毛细管柱的气液色谱法进行定量。优选的淀粉是“现成的”淀粉,即在本发明的上下文中使用前不需要加工的淀粉。特别合适的“高直链淀粉”的淀粉的实例包括6(或vi)或amylon-400(法国罗盖特公司(roquette,lestrem,france))或amylogel03003(美国明尼阿波利斯市嘉吉公司(cargill,minneapolis,usa)),所有这些都是具有约50重量%至约75重量%直链淀粉的玉米淀粉。内层所述内层包括可溶于胃肠液(胃液和肠液)的成膜用非离子聚合物和缓冲剂,基于所述非离子聚合物的干重,所述缓冲剂的量为大于约20wt%至约60wt%。与所述外层一样,所述内层中的聚合物的量与核心的尺寸无关。基于所述非离子聚合物的干重,所述内层通常具有约2mg/cm2至约5mg/cm2,例如,约3mg/cm2的非离子聚合物的包衣量。所述内层可以任选地包括用于聚合物膜的一种或多种常规赋形剂,例如,用于形成膜的增塑剂(例如,柠檬酸三乙酯)、表面活性剂(例如,聚山梨醇酯80)和防粘剂(例如,甘油单硬脂酸酯)。成膜用非离子聚合物所述内层的成膜用非离子聚合物可溶于肠液或胃肠液(胃液和肠液)。“胃液”在本发明中是指哺乳动物(特别是人类)的胃中的含水液体。该液体含有最高达0.1n的盐酸以及大量的氯化钾和氯化钠,并且通过激活消化酶和使摄入的蛋白质变性来在消化过程中发挥关键作用。胃酸是由胃粘膜细胞产生的,并且其他细胞产生碳酸氢盐,该碳酸氢盐起到缓冲剂的作用,防止胃液变得太酸。“肠液”在本发明中是指哺乳动物(特别是人类)的肠腔中的液体。肠液是由肠壁腺体分泌的淡黄色水性液体。肠液包括小肠内发现的液体,即在十二指肠内发现的液体(或“十二指肠液”)、在空肠内发现的液体(或“空肠液”)和回肠内发现的液体(或“回肠液”)以及大肠内发现的液体,例如,“结肠液”。本领域技术人员可以容易地确定聚合物是否可溶于胃液和/或肠液。如果聚合物在ph值为1~3的水(或水溶液),例如,缓冲溶液中可溶,则该聚合物通常可溶于胃液。类似地,如果聚合物在ph值为5~8的水(或水溶液),例如,缓冲溶液中可溶,则该聚合物通常可溶于肠液。或者,胃液和肠液的组成是已知的,并且可以在体外重复制备。如果聚合物可溶于在体外的人工胃液或肠液中,则它通常分别可溶于在体内的胃液或肠液中。所述成膜用非离子聚合物可以溶于至少一种选自胃液、十二指肠液、空肠液和回肠液中的液体。然而,在优选的实施方式中,所述成膜用非离子聚合物在水中的溶解度不依赖于ph值;至少在肠道的ph值范围内是不依赖于ph值的。在优选的实施方式中,所述成膜用非离子聚合物可溶于胃和肠中任何位点的液体中,即在胃肠液中。优选所述内层的非离子聚合物是基于非离子纤维素的聚合物。合适的基于非离子纤维素的聚合物的实例包括甲基纤维素(mc)、羟丙基纤维素(hpc)、羟丙基甲基纤维素(hpmc)。特别优选的基于非离子纤维素的聚合物是hpmc。基于非纤维素的聚合物如聚(环氧乙烷)-接枝聚乙烯醇、聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、pvp接枝的peg和聚乙烯醇(pva)也是优选的。可以使用非离子聚合物的混合物。特别优选的混合物是hpmc和peg。碱在优选的实施方式中,所述内层包括至少一种碱。该碱的目的是,一旦肠液开始渗透到外层,在所述外层的底部提供碱性环境。不局限于任何特定理论约束,本发明人认为碱性环境有助于溶解,因此也有助于所述外层的崩解,因为碱性环境的ph值高于第二聚合物材料的ph阈值,从而一旦所述外层包衣溶解和/或崩解,就会加速药物从所述制剂中释放。原则上,可使用任何药理学上可接受的碱。碱通常是非聚合化合物。合适的碱包括无机碱如氢氧化钠、氢氧化钾和氢氧化铵;以及有机碱如三乙醇胺、碳酸氢钠、碳酸钾、磷酸三钠、柠檬酸三钠或生理学上可耐受的胺如三乙胺。所述碱优选选自氢氧化物类碱、碱金属碳酸氢盐、碱金属碳酸盐、碱金属磷酸盐、碱金属柠檬酸盐或生理学上耐受的胺。更优选地,所述碱是氢氧化物类碱,尤其优选是氢氧化钠。所述内层中存在的碱的量至少部分取决于在包被给定批次的核心之前所述内包衣配混物的最终ph值;在该批次中待包被的核心的数量;在该批次的包被工艺中使用的内层包衣配混物的量。缓冲剂所述内层包括至少一种缓冲剂。所述缓冲剂的目的是,一旦肠液开始渗入外层,提供或增加在所述外层的底部上的缓冲能力。不局限于任何特定理论的约束,本发明人相信所述缓冲剂增加了在溶解内层中的缓冲能力,并且帮助所述外层中的聚合物的电离和溶解。对于给定的ph值,缓冲能力越高,聚合物的溶解速度越快。在所述内层中存在碱的实施方式中,一旦肠液穿透所述外层,所述缓冲剂有助于维持在外层下的碱性环境。所述缓冲剂以大于20wt%至约60wt%的量存在于所述内层中。优选地,基于所述内层中非离子聚合物的干重,所述缓冲剂以大于约20wt%至约50wt%,或约25wt%至约40wt%,例如,约30wt%的量存在于所述内层中。所述缓冲剂可以是本领域技术人员已知的任何合适的缓冲剂。所述缓冲剂可以是有机酸如药理学上可接受的非聚合羧酸,例如,具有1~16个、优选1~3个碳原子的羧酸。w02008/135090a中公开了合适的羧酸。柠檬酸就是这种羧酸的例子。所述羧酸可以羧酸盐的形式使用,也可以使用羧酸的混合物、羧酸盐的混合或两者的混合物。所述缓冲剂也可以是无机盐如碱金属盐、碱土金属盐、铵盐和可溶性金属盐。作为可溶金属盐的金属,可以提及锰、铁、铜、锌和钼。进一步优选地,所述无机盐选自氯化物、氟化物、溴化物、碘化物、磷酸盐、硝酸盐、亚硝酸盐、硫酸盐和硼酸盐。磷酸盐如磷酸二氢钾比其他无机缓冲盐和有机酸缓冲液更优选,因为它们在包衣溶液的ph值(例如,ph8)下具有更大的缓冲能力。在另一优选的实施方式中,所述缓冲剂与以盐络合物形式的碱结合。所述碱优选地选自氢氧化物类碱、碱金属碳酸氢盐、碱金属碳酸盐、碱金属磷酸盐、碱金属柠檬酸盐或生理学上耐受的胺。更优选地,所述碱是氢氧化物类碱,尤其优选的是氢氧化钠。可选的附加层所述内层与所述核心的表面直接接触,即内层与药物本身直接接触;或与药物和一种或多种赋形剂的混合物(形成未包被的核心)直接接触;或与隔离的核心的表面(即包被有隔离层的核心)直接接触。因此,本发明的制剂可以具有附加的隔离层作为核心的一部分,即在活性核心的表面与内层之间。当核心的组成与延迟释放包衣不相容时,可能需要隔离层。例如,本发明包含其中所述内层提供被认为有助于外层溶解和降解的碱性环境的实施方式。然而,如果核心含有具有酸性基团的药物,则所述内层可以与所述核心不相容。具有酸性基团的药物的例子是5-asa。在此情况下,包括隔离层通常是合适的。可以使用本领域技术人员已知的任何合适的隔离层。在一个优选的实施方式中,所述隔离层包含非离子聚合物。合适的非离子聚合物包括甲基纤维素(mc);羟丙基纤维素(hpc);羟丙基甲基纤维素(hpmc);聚(氧化乙烯)-接枝-聚乙烯醇;聚乙烯吡咯烷酮(pvp);聚乙烯乙二醇(peg);和聚乙烯醇(pva)。hpmc或pva是优选的。也可使用非离子聚合物的混合物。特别优选的混合物是hpmc和peg。所述隔离层还可以包括增塑剂。合适的增塑剂包括但不限于聚乙二醇、柠檬酸三乙酯(tec)、三醋酸甘油酯和柠檬酸乙酰三乙酯。也可以在外层和内层之间设置中间层,前提是中间层不会对该制剂的释放特性产生不利影响。然而,外层通常与内层接触设置,也就是说外层通常被直接施加在内层上,即,通常不存在将内层和外层分隔的中间层。所述制剂可以任选地具有包被本发明的延迟释放组合物层的外层。例如,如果延迟释放组合物层包含l和淀粉的混合物,则添加ph依赖性释放包衣材料(ph阈值为约7,例如,s)的外层可能是优选的。本发明的延迟释放包衣优选是所述制剂的外包衣。有利地,已经发现不需要额外的外层来确保所述组合物是延迟释放组合物。核心“核心”是其上施加有包衣的固体物部。核心可以是任何合适的剂型,例如,片剂、丸剂、颗粒、微粒、硬或软胶囊或微胶囊。在优选的实施方式中,所述核心是片剂或胶囊。所述核心包含药物。所述药物可以包含在所述核心的体内,例如,在片剂或小丸的基质内,或在胶囊内封装的内容物中。可选择地,所述药物可以在施加到所述核心上的包衣中,例如,其中所述核心是可食用材料如糖的珠粒,例如,其中所述核心是无与伦比的珠粒或糖衣丸。所述核心可以仅由药物组成,或更通常地可以由药物和至少一种药理学上可接受的赋形剂组成。对此,所述核心通常是片剂或丸剂,并且在为片剂的情况下,由药物与一种或多种赋形剂的混合物组成,所述赋形剂选自填充剂或稀释剂材料(例如,乳糖或纤维素材料如微晶纤维素);粘合剂(例如,聚乙烯吡咯烷酮(pvp)或羟丙基甲基纤维素(hpmc);崩解剂(例如,交联羧甲基纤维素钠(例如,)和羟基乙酸淀粉钠(例如,);和/或润滑剂(例如硬脂酸镁和滑石粉)。所述核心可以是包括这些材料中的至少一些的压缩颗粒。所述核心可以是未包被的,或者如上所述的,所述核心本身可以包括包衣如隔离层,在该隔离层上施加内层,然后施加外层包衣。每个核心的最小直径通常为至少约10-4m,通常至少为约5×10-4m,优选为至少约10-3m。最大直径通常不大于30mm,通常不大于25mm,优选地,不大于20mm。在优选的实施方式中,所述核心的直径为约0.2mm至约25mm,并且优选为约0.2mm至约4mm(例如,对于粒料或微小片剂)或约15mm至约25mm(例如,对于某些片剂或胶囊)。术语“直径”是指穿过所述核心的最大线性尺寸。所述制剂可以包含多个包被的核心以提供单剂量的药物,特别是在其中所述核心是“小”的实施方式中,例如,具有小于5毫米的直径。包含直径小于3mm的颗粒的多单位剂型是优选的。本发明可应用于包含以相同剂型(例如,胶囊)的至少两种复数个颗粒(例如,包被的丸粒)的多阶段药物释放制剂中,其中通过包衣将一种复数个所述颗粒与其它或每个其它种的复数个颗粒区分开。所述包衣可以在包衣厚度和组成(例如,成分的比例和同一性)方面将一种复数个颗粒与下一种复数个颗粒区别开。所述多阶段药物释放制剂将特别适合于克罗恩氏病的患者,其会影响沿着肠道的不同区域。从本发明制剂的释放通常是延迟的,直到小肠,优选结肠。从某些制剂的释放也可以持续。但在优选的制剂中,释放是脉动的。从初始暴露于适合药物释放的条件到开始药物释放之间的时间称为“滞后时间”。滞后时间取决于许多因素,包括包衣厚度和组成。根据本发明的制剂通常在结肠条件下显示至少30分钟的滞后时间。在本发明的大多数实施方式中,滞后时间为约30分钟至约3小时,在优选的制剂中,所述滞后时间优选为约45分钟至约2小时。如果在2小时后在酸性介质中药物释放小于10wt%,则通常将制剂定义为抗胃酸性。根据本发明的制剂通常在酸性介质中显示出远小于10wt%的药物释放,并且可以被认为是抗胃酸性的。所述制剂通常在酸性介质中显示小于1wt%的药物释放,并且通常在酸性介质中显示出基本上没有药物释放。当淀粉与丙烯酸酯成膜用材料结合以形成用于核心的包衣时,在模拟胃和小肠的条件下,通常在6小时内药物释放小于5%。在淀粉与纤维素成膜用材料结合以用于包被核心时,在模拟胃和小肠的条件下,通常在5小时内药物释放小于5%。初始暴露于适合药物释放的条件和完全药物释放之间的时间还取决于许多因素,包括包衣成分和药的特性。在本发明的大多数实施方式中,该时间通常不超过5小时。在优选的实施方式中,该时间通常不超过4小时。方法根据本发明的第二方面,提供了一种制备根据第一方面所述的延迟释放制剂的方法,所述方法包括:形成含有药物的核心;将可溶于小肠液或胃肠液的成膜用非离子聚合物溶解于具有缓冲剂的水性溶剂中,以形成ph值大于ph7的内层包衣配混物,基于所述非离子聚合物的干重,所述缓冲剂的量为大于20wt%至约60wt%;使用所述内层包衣配混物包被所述核心,以形成内层包被的核心;以及用外层包衣配混物包被内层包被的核心,以形成外层包被的核心,所述外层包衣配混物包括在溶剂系统中的成膜用肠溶聚合物,所述成膜用肠溶聚合物具有约ph值6以上的ph阈值。所述方法优选包括首先用隔离层包衣配混物包被核心,以形成用于包被内层包衣配混物的隔离的核心,所述隔离层包衣配混物包括在溶剂中的成膜用非离子聚合物。进一步优选的是,所述隔离层包衣配混物的非离子聚合物的特性与所述内层包衣配混物的非离子聚合物的特性相同。优选的成膜非离子聚合物为如上所详述的。在一些实施方式中,水溶剂中存在的缓冲剂的量不足以实现内包衣层配混物的目标ph值。在那些实施方式中,将碱添加到内包衣层配混物中,其添加量足以将ph值提高到所要求的水平。进一步优选的是,添加到内层包衣配混物中的碱的量足以将内层包衣配混物的ph值提高到在约ph7.5至约ph10的范围内,更优选在约ph7.5至约ph8.5的范围内,最优选为约ph8。优选的碱为如上所详述的。优选用内层包衣配混物包被核心,直到基于所述非离子聚合物干重,非离子聚合物以约2mg/cm2到约5mg/cm2,例如,约3mg/cm2的量包被到核心上。基于所述非离子聚合物的干重,所述缓冲剂优选以大于约20wt%至约50wt%,约25wt%至约40wt%,例如,约30wt%的量存在于内层包衣配混物中。优选的缓冲剂为如上所详述的。优选的是,外层包衣配混物包含肠溶聚合物和易受结肠酶攻击的可酶降解的聚合物的混合物。进一步优选的是,当可酶降解的聚合物和肠溶聚合物存在于所述外层包衣配混物中时,它们以大于10:90至80:20,例如,10:90至60:40,优选25:75至60:40的比例存在。在一些特别优选的实施方式中,该比例为15:85至35:65,例如,25:75至35:65,优选为约30:70。在其它特别优选的实施方式中,该比例为40:60至约60:40,例如,约50:50。适用于外层的优选的可酶降解的聚合物和肠溶聚合物为如上所详述的。优选用外层包衣配混物包被内层包被的核心,直到所述肠溶聚合物以约2mg/cm2至约10mg/cm2,例如,约2mg/cm2至约8mg/cm2,或约4mg/cm2至约8mg/cm2,或约5mg/cm2至约8mg/cm2,或约6mg/cm2至约8mg/cm2,或约7mg/cm2至约8mg/cm2,例如,约7.5mg/cm2的量包被到所述内层包被的核心。在外层包衣配混物包括肠溶聚合物和可酶降解的聚合物的混合物的实施方式中,制备外包衣配混物的方法通常包括以下步骤:形成包含所述肠道聚合物的有机溶液或水分散体;形成包含可酶降解的聚合物的醇溶液或水溶液;以及将至少一部分包含可酶降解的聚合物的醇溶液或水溶液添加到(优选逐滴添加)包含所述肠溶聚合物的有机溶液或水分散体中,以形成外层包衣配混物。在其中可酶降解的聚合物为淀粉的实施方式中,优选分散在至少一种醇,优选c1至c6醇,例如,甲醇;乙醇;丙-1-醇;丙-2-醇;丁-1-醇;丁-2-醇;以及它们的混合物,尤其是仅仅分散在丁-1-醇中,然后通常随后在良好地搅拌下添加水。通常将所获得的水分散体加热至沸腾,然后通过搅拌冷却过夜。醇的目的是使准备形成水分散体的第一材料溶剂化。或者,所述材料可以直接分散在水中。肠溶聚合物通常溶解在至少一种溶剂,例如,水或有机溶剂中。有机溶剂可以是醇,例如,甲醇;乙醇;丙-2-醇;甲基乙二醇;丁二醇;丙酮;甲基乙二醇醋酸酯;以及它们的混合物如丙酮和异丙醇(例如,以约2:3的比率混合)。肠溶聚合物优选在高速搅拌下溶解于乙醇中(优选85%至98%)。外包衣配混物优选通过在快速搅拌下逐滴向含肠溶聚合物的有机溶液或水分散体中添加适量的含可酶降解的聚合物的醇溶液或水溶液或分散体来形成。通常在搅拌的同时将其它赋形剂如增塑剂(例如,柠檬酸三乙酯(tec))和/或润滑剂(例如,单硬脂酸甘油酯)添加到所述配混物中。不同方面在进一步方面,提供根据第一方面的制剂用于通过治疗对人体或动物身体进行医疗治疗的方法中。所述核心包含至少一种药物。该制剂通常用于施用作为唯一治疗活性成分的单一药物。然而,可以以单一制剂施用多种药物。本发明的制剂可以包含任何尺寸的核心。在一些实施例中,所述药物可以以如下的量存在于所述制剂的核心中:约50mg至约1650mg,或约100mg至约1550mg,或约150mg至约1500mg,或约200mg至约1450mg,或约250mg至约1400mg,或约300mg至约1350mg,或约350mg至约1300mg,或约400mg至约1250mg,或约450mg至约1200mg,或约500mg至约1150mg,或约550mg至约1100mg,或约600mg至约1050mg,或约650mg至约1000mg,或约700mg至约950mg,或约800mg至约1600mg,或约850mg至约1600mg,或约900mg至约1500mg,或约950mg至约1400mg,或约1000mg至约1300mg,或约1150mg至约1200mg。优选地,所述药物以从约400mg、约800mg、约1200mg、约1500mg或约1600mg中选择的量存在于所述核心中。本发明的制剂被设计用于施用广泛范围的药物。合适的药物包括已知使用熟知的缓释口服制剂进行肠道给药的那些药物。本发明可用于施用具有局部或全身效应的药物。本发明的制剂在药物的肠道给药中具有特殊应用,所述药物包含至少一个酸性基团,例如,羧酸基团。这类药物可以是酸性药物或两性离子药物。这种药物的例子是5-氨基水杨酸(5-asa)。所述制剂中的药物特性明显取决于待治疗的病况。对此,所述制剂尤其在ibd(包括克罗恩病和溃疡性结肠炎);ibs;便秘;腹泻;感染;以及癌症(特别是结肠癌或大肠癌)的治疗中具有特殊的应用。对于治疗或预防ibd,所述制剂可以包含至少一种选自以下所组成的组中的药物:抗炎剂(例如,5-asa、4-asa、柳氮磺吡啶和巴柳氮);非甾体抗炎剂(例如,布洛芬和双氯芬酸);甾体(例如,泼尼松龙、布地奈德或氟替卡松);免疫抑制剂(例如,硫唑嘌呤、环孢菌素和甲氨蝶呤);抗生素;和生物制剂,包括肽、蛋白质、抗体和抗体片段。生物制剂的合适的实例包括碱性磷酸酶和抗-tnf抗体如英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)、塞妥利珠单抗(certulizumabpegol)、戈利木单抗(golimumab)和优特克单抗(ustekinumab)。对于癌症的治疗或预防,所述制剂可以包含至少一种抗肿瘤药。合适的抗肿瘤药包括:氟尿嘧啶、甲氨蝶呤、防线菌素d、博来霉素、依托泊苷、紫杉醇、长春新碱、阿霉素、顺铂、道诺霉素、vp-16、雷替曲塞、奥沙利铂及其药物学上可接受的衍生物和盐。对于主要在患有结肠炎的患者中预防结肠癌或结直肠癌,所述制剂可以包含抗炎剂5-asa、舒林酸、塞来昔布和/或依洛尼塞(dfmo)。对于治疗或预防ibs、便秘、腹泻或感染,所述制剂可以包含至少一种适用于治疗或预防这些病症的活性剂。药理学上可接受的药物衍生物和/或盐也可以用于所述制剂中。泼尼松龙的合适盐的例子是甲基泼尼松龙琥珀酸钠。另一个例子是氟替卡松丙酸酯。本发明在治疗ibd(尤其是溃疡性结肠炎)或预防结肠癌或结直肠癌(主要是在结肠炎患者中)中具有特殊应用,两者均使用5-asa。它还可以作为药物通过结肠进入体循环的入口。这对于在上胃肠道中不稳定的肽和蛋白质药物尤其有利。本发明还可用于时间疗法(chronotherapy)。本发明的第三方面提供了一种将药物靶向结肠的方法,包括给患者施用如上所定义的制剂。本发明第四个方面提供了如上定义的制剂在制备用于治疗或预防ibd(尤其是溃疡性结肠炎)、ibs、便秘、腹泻、感染和癌症的药物中的用途。还提供了至少一种选自抗炎剂和甾体的药物在制备包含如上定义的用于治疗ibd的制剂的药物中的用途。另外,还提供了至少一种抗肿瘤剂在制备包含如上定义的用于治疗癌症的制剂的药物中的用途。此外,还提供5-asa在制备包含如上定义的用于预防结肠癌或结直肠癌的制剂的药物中的用途。本发明第五个方面提供了医学治疗或预防ibd或癌症的方法,包括给患者施用治疗量的如上定义的制剂。所述制剂典型地包括治疗有效量的所述药物或每种药物,基于所述制剂的总重量,所述药物可以占约0.01重量%至99重量%。由本领域技术人员使用其公知常识确定实际剂量。然而,通过实施例,“低”剂量制剂典型地包含不多于约20重量%的药物,并且优选包含约1重量%至约10重量%,例如,约5重量%的药物。“高”剂量制剂典型地包含至少40重量%的药物,并且优选约45重量%至约85重量%,例如,约50重量%或约80重量%的药物。食物效应传统延迟释放剂型的药物释放曲线经常取决于胃的状态,即,胃处于“进食”状态还是“禁食”状态。简言之,“进食状态”导致胃滞留时间增加,这会影响到tlag,即药物从剂型开始释放前的时间。此外,离开胃后体内快速溶解可能导致cmax增加、或药物的峰值血浆浓度增加。药物释放对胃状态的依赖性通俗地称为“食物效应(foodeffect)”,这也是为什么常规剂型通常在空腹服用,或与食物一起服用或刚吃完食物时服用的原因。显然地,当服用口服剂型可能由于药物过早释放而对患者安全性和疗效产生不利影响时,显著的食物效应是不希望的。通过将剂型最初暴露于0.1n的hci中2小时(禁食状态)或暴露于进食状态模拟胃液(fessgf)(例如,在ph5下)中4小时,可以在体外模拟禁食和进食状态。在模拟禁食或进食状态后,将所述片剂进一步暴露于ph为7.4的克雷布氏(krebs)缓冲液中至少4小时,以模拟回肠结肠区域的病况。将所述片剂暴露超过4小时,例如,在ph6.8的汉克斯(hanks)缓冲液中暴露10小时,如在以下实施例中所述的,可以提供该片剂在模拟的上小肠病况下的“鲁棒性”指示。在文献:jantrad等人(2008)“近端人体胃肠道中溶出介质模拟条件:更新(药物杂志,第25(7):1663-1678)(jantratidetal(2008)“dissolutionmediasimulatingconditionsintheproximalhumangastrointestinaltract:anupdate.”(pharm.res.25(7):1663-1676))”中描述了fessgf的例子。简言之,此fessgf的实例由牛奶与醋酸/醋酸钠缓冲液和氯化钠的混合物(50:50)组成。作为实例,本发明人已观察到:与模拟禁食状态条件相比,包被的800mg的5-asa片剂(用s的单个包衣来包被)在体外暴露于这种模拟进食状态时显示出更短的tlag。较早的5-asa初始释放可能导致在小肠中吸收药物,从而导致系统副作用的增加。对于(来自cosmopharmaceuticals/shire公司的1200mg5-asa片剂制剂,用于5-asa的特定部位结肠释放),在体外和在体内也观察到类似的效果。实施例本发明的许多优选实施例现在将参考附图进行详细描述,其中:图1是比较根据比较例1的包被的5-asa片剂在暴露于(a)fassgf中2小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时;和(b)fessgf中4小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时,药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出;图2是比较根据比较例2和3以及实施例1至3的包被的5-asa片剂在暴露于fassgf中2小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出;图3是比较根据比较例3的包被的5-asa片剂在暴露于(a)fassgf中2小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时;和(b)fessgf中4小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时,药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出;图4是比较根据实施例1的包被5-asa片剂在暴露于(a)fassgf中2小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时;和(b)fessgf中4小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时,药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出;图5是比较根据实施例2的包被5-asa片剂在暴露于(a)fassgf中2小时,然后再暴露于克雷布氏缓冲液(ph7.4)中10小时时;和(b)fessgf中4小时,然后再暴露于克雷布氏缓冲液(ph7.4)中10小时时,药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出;图6是比较根据实施例3的包被的5-asa片剂在暴露于(a)fassgf中2小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时;和(b)fessgf中4小时,然后暴露于克雷布氏缓冲液(ph7.4)中10小时时,药物释放作为时间函数的曲线图。仅仅在ph7.4的克雷布氏缓冲液中的数据被示出。材料s100购自德国达姆施塔特的赢创工业集团公司(evonikgmbh)。玉米淀粉(6)购自法国莱斯特雷姆的罗盖特公司(roquette,lestrem,france))。聚山梨酯80(80)、丁-1-醇、柠檬酸三乙酯(tec)、乙醇95%、丁醇、磷酸二氢钾(kh2po4)、磷酸氢二钠二水合物(na2hpo4·2h2o)和氢氧化钠均购自瑞士布克斯的西格玛奥德里奇公司(sigma-aldrich,buches,switzerland)。hpmc(603)购自信越化学株式会社(shin-etsu)。amb购自卡乐康公司(colorcon)。单硬脂酸甘油酯(gms)购自科宁公司(cognis)。聚乙二醇6000(peg6000)购自弗卢卡公司(fluka)。氧化铁红和氧化铁黄(sicovit)购自巴斯夫公司(basf)。片剂核心提供了包含800mg的5-asa(实施例1-3和比较例2-3)和包含1200mg的5-asa(比较例1)的片剂核心。比较例1-3和实施例1的片剂核心包被有羟丙基甲基纤维素(hpmc)的隔离层,而实施例2和3的片剂核心包被有amb(基于聚乙烯醇(pva)的包衣材料)的隔离层。包被的片剂核心的制备比较例1和2(5-asa片剂核心,包被有hpmc隔离层/中和的s100以及缓冲剂和碱的内层/s100和高直链淀粉的50:50混合物(比较例1)或70:30混合物(比较例2)的外层)。隔离层由hpmc和20%的peg6000的水性混合物以如下量施加隔离层:表1组分mg/cm2hpmc3peg60000.6在磁力搅拌下将hpmc溶于水中,然后加入peg6000以形成隔离层包衣配混物。使用具有0.8l鼓且每批次400g的包衣机将隔离层包衣配混物喷涂到5-asa核心上,直到hpmc的涂层量达到3mg聚合物/cm2,以形成隔离层包衣核心。喷涂参数为如下表所示的:表2鼓转速(rpm)10-15喷嘴直径(mm)0.8喷雾速率(g/min)3-5.2喷雾压力(bar)0.7模式压力(bar)1.0空气流速(m3/h)30入口空气温度(℃)65-70出口空气温度(℃)40-43产品温度(℃)33-34内层所述内层由s100的水溶液配混物来施加,其中所述水溶液配混物的ph值被调整至ph8。所述内层的组成还包括70%的tec(基于聚合物的干重)、1%的kh2po4(基于聚合物的干重)、10%的gms(基于聚合物的干重)和40%的聚山梨醇酯80(基于gms重量)。使用1m的naoh调节ph值,直到获得ph8。表3通过将所需量的kh2po4和tec溶解在蒸馏水中,接着在机械搅拌下分散s100,来制备内层包衣配混物。然后用1m的naoh将ph值调节至ph8,并且混合1小时以形成中和的s100溶液。以10%w/w的浓度制备gms乳液。将聚山梨酯80(以gms重量计为40%)溶解于蒸馏水中,接着分散gms。然后在强磁场搅拌下将该配混物加热至75℃下15分钟,以形成乳液。将该乳液在搅拌下冷却至室温。将gms乳液添加到中和的s100溶液中,并且使用穿孔包衣机将最终内层包衣喷涂到隔离层包被的片剂上,直到s100的包衣量达到5mg聚合物/cm2,以制备内层包被的核心。喷涂参数为如下表所示的:表4比较例1比较例2鼓转速(rpm)12-1612喷嘴直径(mm)0.80.8喷雾速率(g/min)3.16.8-7.2喷雾压力(bar)0.40.7模式压力(bar)0.51.0空气流速(m3/h)3030入口空气温度(℃)58-6570出口空气温度(℃)37.6-38.034.1-37.8产品温度(℃)24.5-25.525.5-31.5外层使用由50%的s100和50%的高直链淀粉形成的外包衣(比较例1)或者使用由70%的s100和30%的高直链淀粉形成的外包衣(比较例2),来包被已内层包被的片剂核心。由如下量(基于s100干聚合物重量)的淀粉水分散液和s100乙醇溶液的混合物来施加外层包衣:表5通过将高直链玉米淀粉(6,也称为amylon-400)分散到丁-1-醇中,然后在磁力搅拌下通过水分散,从而制备淀粉水分散体。将所获得的分散体加热至沸腾,然后在搅拌下冷却过夜。s100溶液是通过在高速搅拌下将s100分散在96%乙醇中来制备的。在搅拌下将淀粉水分散体逐滴滴加到s100溶液中,以获得s100:淀粉的比例为50:50(比较例1)或者70:30(比较例2)。将混合物搅拌1小时,并且加入柠檬酸三乙酯和gms乳液(先前用聚山梨醇酯80制备),并且再混合30分钟。加入氧化铁红和氧化铁黄的悬浮液,并且将混合物再搅拌10分钟。以5%w/w的浓度制备gms乳液。将聚山梨醇酯80(基于gms重量为40%)溶解在蒸馏水中,然后分散gms。在强磁力搅拌下将分散体在75℃下加热15分钟,以形成乳液。将所述乳液在室温搅拌下冷却。通过在均质化条件下将红色和黄色的氧化铁颜料悬浮在96%乙醇中10分钟而形成颜料悬浮液。使用与在施加隔离层中所使用的相同包衣机(具有0.8l鼓且每批次400g)将最终的外层包衣配混物喷涂到内层包被的核心上,直到s100的包衣量达到5mg聚合物/cm2。喷涂参数如下表所示:表6比较例1比较例2鼓转速(rpm)1212喷嘴直径(mm)1.00.8喷雾速率(g/min)2.953.2喷雾压力(bar)0.40.4模式压力(bar)0.50.5空气流速(m3/h)4040入口空气温度(℃)53-5552-55出口空气温度(℃)40.5-41.640.9-42.6产品温度(℃)34.5-36.534.5-36.5比较例3和实施例1(5-asa片剂核心,包被有hpmc隔离层/具有10wt%的缓冲盐和碱(比较例3)或30wt%的缓冲盐和碱(实施例1)的hpmc内层/s100与高直链淀粉的70:30混合物的外层)。如比较例1和2中所描述的方式施加所述隔离层。由如下量的hpmc、20%的peg6000(基于hpmc干重)和kh2po4缓冲剂的混合物来施加所述内层:表7通过在磁搅拌下将所需量的kh2po4和peg6000溶解于水中,来制备内层包衣配混物。缓慢添加hpmc并且允许搅拌,直到观察到完全溶解。通过添加等分量的1m的naoh,将溶液的ph值调节至ph8。使用与用于隔离层的包衣机相同的包衣机将最终的内层包衣配混物喷涂到隔离层包被的核心上,直到hpmc的包衣量达到3mg聚合物/cm2,以形成内层包被的核心。喷涂参数如下表所示:表8比较例3和实施例1鼓转速(rpm)10-12喷嘴直径(mm)0.8喷雾速率(g/min)2.5喷雾压力(bar)0.6模式压力(bar)0.8空气流速(m3/h)30入口空气温度(℃)62-70出口空气温度(℃)40.6-40.9产品温度(℃)30.5-31外层内层包被的片剂核心包被有由30%的s100和70%的高直链淀粉形成的包衣配混物。由如下量的水性淀粉分散体和s100的乙醇溶液的混合物(基于s100干聚合物重量)来施加所述外包衣:表9通过在磁搅拌下将高直链玉米淀粉(6,也称为amylon-400)分散在1-丁醇,接着分散在水中,来制备淀粉水分散液。将所获得的分散液加热至沸腾,然后在搅拌下冷却过夜。通过在高速搅拌下将s100分散在96%的乙醇中,来制备s100溶液。在搅拌下将淀粉水分散液逐滴滴加到s100溶液中,以获得s100:淀粉的比例为30:70(实施例1和2)或者50:50(实施例3)。将混合物搅拌1小时,并且加入柠檬酸三乙酯和gms乳液(先前用聚山梨醇酯80制备),并且再混合30分钟。加入氧化铁红和氧化铁黄的悬浮液,并且将混合物再搅拌10分钟。以5%w/w的浓度制备gms乳液。将聚山梨醇酯80(基于gms重量为40%)溶解在蒸馏水中,然后分散gms。在强磁力搅拌下将分散液在75℃下加热15分钟,以形成乳液。将所述乳液在室温搅拌下冷却。通过在均质化条件下将红色和黄色的氧化铁颜料悬浮在96%乙醇中10分钟而形成颜料悬浮液。使用与在施加隔离层中所使用的相同包衣机(具有0.8l鼓且每批次400g)将最终的外层包衣配混物喷涂到内层包被的核心上,直到s100的包衣量达到5mg聚合物/cm2。喷涂参数如下表所示:表10鼓转速(rpm)12喷嘴直径(mm)0.8喷雾速率(g/min)3.8喷雾压力(bar)0.4模式压力(bar)0.5空气流速(m3/h)40入口空气温度(℃)55-57出口空气温度(℃)41-43产品温度(℃)32.5-33实施例2和实施例3(5-asa片剂核心,包被有基于pva的隔离层/具有缓冲剂和碱的hpmc内层/s100与高直链淀粉的30:70混合物的外层)。隔离层由amb的水分散液以3.1mg/cm2的量(总固体物)来施加所述隔离层。amb是基于聚乙烯醇(pva)的全配方包衣系统。在磁搅拌下用纯化水稀释amb30分钟,以制备隔离层包衣配混物。使用具有0.8l鼓且每批次400g的包衣机将隔离层包衣配混物喷涂到5-asa核心上,直到amb的包衣量达到形成隔离层包被的核心的目标量。喷涂参数与用于比较例3和实施例1的喷涂参数相同:内层由如下量的hpmc、20%的peg6000(基于hpmc干重)和kh2po4缓冲剂的混合物来施加所述内层:表11制备所述内层并将其施加于根据比较例3和实施例1的隔离层包被的核心。外层制备所述外层并根据比较例3和实施例1施加所述外层。结果药物释放测试#1-模拟的禁食状态,然后在ph值为7.4的克雷布氏缓冲液在uspii型装置上使用50rpm的搅拌桨转速和37±0.5℃的介质温度进行了体外溶解研究。为了模拟“禁食”状态,首先将片剂在0.1m的hcl中测试2小时,然后在克雷布氏缓冲液(ph值为7.4)中测试8小时。药物释放测试#2-模拟的进食状态,然后在ph值为7.4的克雷布氏缓冲液在uspii型装置上使用50rpm的搅拌桨转速和37±0.5℃的介质温度进行了体外溶解研究。为了模拟“进食”状态,首先将片剂在ph为5.0的进食状态模拟胃液(fessgf)中测试4小时,然后在克雷布氏缓冲液中(ph7.4)中测试10小时。所述fessgf为如在文献:“jantrid等人(2008)supra”中所描述的。其结果如图1至图6中所示的。与禁食模拟的胃液条件相比,根据比较例1的片剂在模拟的禁食状态的胃液条件下显示出延迟释放(图1)。在暴露于0.1n的hcl2小时后,根据实施例1-3的片剂显示出与比较例2的片剂类似的性能。尤其是,在暴露于模拟的胃液条件下2小时内,没有任何被测试的片剂释放出5-asa。但是,应当注意的是,一旦所述片剂暴露于ph7.4(药物释放测试#2),观察到5-asa的快速释放(图2)。还应当注意的是,在模拟的禁食状态的胃液条件下,仅含有10wt%缓冲盐的内层显示出最慢的滞后时间(比较例3,图2)。图2中的数据还表明:用含有大于10wt%的缓冲盐的hpmc的内层(实施例1-3)代替比较例2的中和的s100内层,同样有效地促进快速药物释放。与在暴露于禁食模拟的胃液相比,具有hpmc和30wt%至50wt%的kh2po4缓冲盐(基于干聚合物重量)的内层的根据实施例1-3的片剂在暴露于模拟的进食胃液后,显示出在ph7.4的克雷布氏缓冲液中没有5-asa的延迟释放(图4至图6)。与在内层中具有30wt%至50wt%缓冲盐的实施例1-3的片剂(图4至图6)相比,根据比较例3的片剂(具有含10wt%的缓冲盐(基于干聚合物重量)的hpmc的中间层)在预暴露于模拟的进食胃液后在ph7.4的克雷布氏缓冲液中显示出更慢的溶解速率(图3)。不局限于理论的约束,通常认为:如果所述制剂的外层对胃液是可渗透的,例如,在进食状态模拟的胃液(fessgf)中,由此允许进入内层,则可以影响药物释放的内层改性可能会发生。由中性聚合物如hpmc制成的内层中的缓冲盐含量可以有助于在包衣层与片剂核心之间的界面处保持高的缓冲能力,减少或避免进食状态胃液在ph7.4的克雷布氏缓冲液(其类似于远端小肠的肠腔电解质成分)中延迟药物释放方面的影响。应当理解的是,本发明不限于上文参考优选的实施方式所描述的细节,而是可以在不脱离由以下权利要求所定义的本发明范围的情况下进行许多修改和变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1