促进糖尿病对象组织修复的方法及组合物与流程
本发明涉及促进糖尿病对象细胞生长和组织修复的方法及组合物。
背景技术:
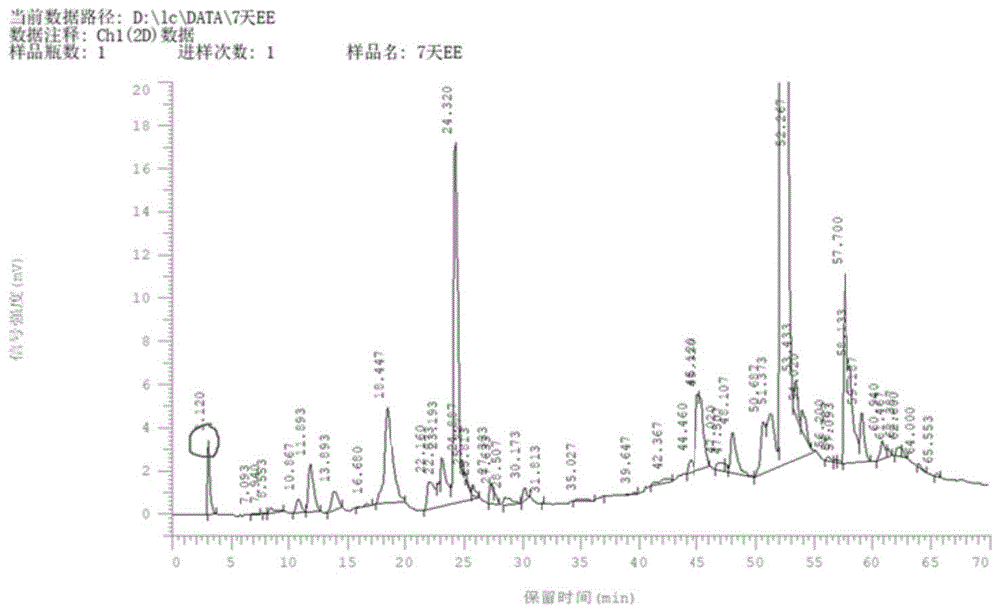
:由于传统疗法的局限以及老龄化的人口,对于组织修复的新治疗方案的需求越来越多。当前,组织和器官缺损治疗通常采用基于细胞的疗法。这些疗法包括将前体细胞,优选是干细胞,引入到缺损部位,从而扩增内源性细胞种群以及增加组织再生和修复率。这些细胞本质上是自体的,从需要治疗的病人中分离,并在将其返回到病人的缺损部位之前进行体外扩增。但是,现有的疗法也有一些问题。首先,在体外长期培养的细胞会发生突变,不同于体内这些突变目前是无法从培养系统中识别并区分的,因而培养时间越久肿瘤化的细胞也就越多;在体外长期培养的细胞也会分化,这会降低细胞在体内的增殖以及组织修复的能力。其次,细胞本身带有病毒,细胞的体外培养更使得细胞暴露于可能含有污染颗粒(例如病毒和细菌)或化学品的外来物质。如果在植入之前没有被检测到,这些污染物有可能导致重大疾病和病态。此外,细胞成为毒害的风险会随着细胞培养的时长增加而增加。糖尿病是多系统疾病,糖尿病溃疡是糖尿病的一种并发症,多发于患者脚部,因此又称为糖尿病足。糖尿病患者因周围神经病变与外周血管疾病合并过高的机械压力,可引起足部软组织及骨关节系统的破坏与畸形形成,进而引发一系列足部问题,从轻度的神经症状到严重的溃疡、感染、血管疾病、charcot关节病和神经病变性骨折。如果积极治疗不能充分解决下肢出现的症状和并发症,则会造成灾难性的后果。与其他原因引起的溃疡和损伤不同,糖尿病患者的足部并发症起自感觉性神经病变、自主与运动神经病变以及血管病变。感觉神经病变合并过高的机械应力,是引起足部溃疡和感染的主要始动因素。炎症与组织损害是一定程度的反复应力作用于一个特定的失去感觉的区域的结果。来自地面、鞋子或其他邻近足趾的压力或剪切力导致溃疡形成,由于缺乏正常的神经保护机制,溃疡常因骨突的存在而加重。自主神经系统的病变造成皮肤正常排汗调节功能、皮肤温度调节功能和血运调节能力丧失,导致局部组织柔韧性降低,形成厚的胼胝以及更易破碎和开裂。正常排汗能力的丧失阻断了局部组织的再水化,造成组织进一步破坏,使得深部组织更易于细菌定植。运动神经病变在糖尿病足的发病中也起到了一定作用,足内在肌的挛缩造成典型的爪状趾畸形。跖趾关节的过伸也被证明能够直接增加跖骨头下压力,使得该部位更易形成溃疡。近趾间关节屈曲造成突起的趾间关节背侧与趾尖跖侧形成溃疡的风险增加。而血管病变使得破坏的组织难以愈合。此外,自主神经功能障碍导致皮肤软组织破坏,造成外源细菌侵入。化学趋向性改变导致白细胞反应效率低下。而且,高血糖、氧分压降低和营养不良等可共同引发组织水肿、酸积聚、高渗和低效无氧代谢。此类环境阻碍了白细胞的功能。此外,血管病变可造成抗生素运输受限,进一步造成细菌清除效率降低,导致局部软组织感染,甚至骨髓炎的形成。糖尿病治疗的总体目标是预防、控制和延缓糖尿病急慢性并发症,最大限度维持或提高患者生活质量。然而,现如今针对糖尿病足溃疡这一严重并发症仍缺乏确切有效的治疗方案,主要依赖早期预防治疗。一旦发生糖尿病足溃疡,由于感觉受损、微循环障碍、创面愈合困难、伤口感染和坏疽,绝大多数患者最终只能接受截肢手术。既往,糖尿病足溃疡主要依靠血糖控制、减轻患肢负重、伤口敷料、局部外敷抗生素、负压封闭引流技术等处理,但并不能降低截肢风险。因此,本领域仍然需要新的组织修复的方法和组合物,该方法和组合物能在糖尿病对象体内实现组织修复。技术实现要素:本发明提供羊水和/或其提取物在制备促进糖尿病对象细胞生长、组织修复和/或伤口愈合的试剂中的应用,其中,所述羊水来自胚龄为5-12天的鸡蛋,优选胚龄为6-11天的鸡蛋,更优选胚龄为7-9天的鸡蛋,更优选胚龄为7-8天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-14天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-14天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。本发明还提供羊水和/或其提取物在制备治疗神经病变和/或血管病变引起的神经性溃疡、血管性溃疡或神经-血管性溃疡的药物中的应用,其中,所述羊水来自胚龄为5-12天的鸡蛋,优选胚龄为6-11天的鸡蛋,更优选胚龄为7-9天的鸡蛋,更优选胚龄为7-8天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-14天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-14天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。本发明还提供羊水和/或其提取物在制备用于治疗糖尿病对象的血管病变,或恢复/改善糖尿病对象的皮肤排汗调节功能、皮肤温度调节功能和/或血运调节功能的药物中的应用,其中,所述羊水来自胚龄为5-12天的鸡蛋,优选胚龄为6-11天的鸡蛋,更优选胚龄为7-9天的鸡蛋,更优选胚龄为7-8天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-14天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-14天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。本发明还提供羊水和/或其提取物在制备治疗糖尿病足或与糖尿病足相关的病情的药物中的应用,其中,所述羊水来自胚龄为5-12天的鸡蛋,优选胚龄为6-11天的鸡蛋,更优选胚龄为7-9天的鸡蛋,更优选胚龄为7-8天的鸡蛋,或者来自发育时期与所述胚龄的鸡蛋所处的发育时期相对应的鸡以外的其它禽类的蛋;或来自胎龄为8-14天的啮齿类动物的胚胎,或来自发育时期与胎龄为8-14天的啮齿类动物的发育时期相对应的啮齿类动物以外的其它非人哺乳动物的胚胎。在一个或多个实施方案中,所述试剂或药物是包含本文所述羊水和/或其提取物的细胞培养物。在一个或多个实施方案中,所述试剂或药物是包含本文所述羊水和/或其提取物以及药学上可接受辅料的药物组合物。在一个或多个实施方案中,所述提取物中主要生物活性成分在ph7.0-8.0之间不和离子交换柱结合,且其所含成分的分子量在150-2000道尔顿范围,但不限于此范围。在一个或多个实施方案中,所述组织来自:软骨组织、半月板组织、韧带组织、肌腱组织、椎间盘组织、牙周组织、皮肤组织、血管组织、肌肉组织、筋膜组织、骨膜组织、神经组织、泌尿生殖组织、和脂肪组织等中的任意一种或多种组织;所述细胞来自所述任意一种或多种组织。在一个或多个实施方案中,所述与糖尿病足相关的病情包括但不限于神经病变和/或血管病变引起的神经性溃疡、血管性溃疡或神经-血管性溃疡。在一个或多个实施方案中,与糖尿病足相关的病情包括但不限于糖尿病对象中由疾病或外伤所引起的长期不愈合伤口病情,选自:皮肤干燥;靠毛脱离;皮温下降;色素沉着;肢端动脉搏动减弱或消失;撕裂或断裂的肌腱或韧带;皮肤伤口,如疤痕、外伤性创伤、缺血性伤口、糖尿病伤口、手术伤口、烫伤、烧伤、皮肤溃疡如褥疮或压力导致的溃疡、静脉溃疡、糖尿病溃疡、坏疽、坏死;血管病情,如外周动脉疾病、静脉疾病、血管缺损、血管发育不当;肌肉疾病,如肌肉萎缩、炎性、神经性和生肌性肌肉疾病;神经疾病例如刺痛、灼痛、麻木、感觉迟钝或丧失;骨疾病例如休息痛、骨髓炎、charcot关节病、足趾畸形;感染、组织水肿、间歇性跛行等,及皮肤肿瘤引起的长期不愈合伤口。本发明还提供修复因糖尿病引起的组织的方法,包括:通过体外使用本文所述的羊水和/或其提取物或含有所述羊水和/或其提取物的培养基培养自体或异体细胞,或采用本文所述的细胞培养方法培养自体细胞或异体细胞或鸡的胚胎干细胞,形成可植入的组织或基质,将其植入动物体,以修复相应的受损的组织。优选在组织缺损部位植入。附图说明图1,胚龄为7天的鸡蛋的羊水的hplc检测结果。图2,胚龄为11天的鸡蛋的羊水的hplc检测结果。图3,胚龄为13天的鸡蛋的羊水的hplc检测结果。图4,不同胚龄的鸡蛋盐水的抗自由基能力。其中,横坐标表示胚龄,纵坐标表示清除率。图5,鸡胚胎成纤维细胞在不同培养条件下的生长曲线。图6,来自鸡蛋的羊水对对人脐静脉内皮细胞(huvec)的生长活力和迁移能力的影响。其中,横坐标表示培养基,纵坐标表示od450值。图7,来自鸭蛋的羊水对鸡胚胎成纤维细胞的生长活力和迁移能力的影响。其中,横坐标表示培养基,纵坐标表示od450值。图8,来自鸡蛋的羊水促进小鼠成骨细胞的生长。其中,横坐标表示培养基,纵坐标表示od450值。图9,来自鸡蛋的羊水促进原代心肌细胞的生长。其中,横坐标表示培养基,纵坐标表示od450值。图10,凝胶柱gehiload16/600superdex75pg分离色谱图。图11,细胞活力检测凝胶柱gehiload16/600superdex75pg分离馏分。横坐标表示培养基,其中,fbs表示胎牛血清;dmem为dulbecco'smodifiedeaglemedium;ee表示羊水;“ee”表示冻干羊水;s-200b表示b峰的馏分;qunbound表示阴离子柱未结合馏分;3-1到3-6分别表示第三步纯化中等体积的馏分1-6。图12,细胞活力检测阳离子交换柱gehiprepsp和阴离子交换柱hiprepq分离得到的未结合馏分。横坐标表示培养基,其中,fbs表示胎牛血清;dmem为dulbecco'smodifiedeaglemedium;ee表示羊水;“ee”表示冻干羊水;hiprepsp-un表示未结合hiprepsp柱的馏分;hiprepq-un表示未结合hiprepq柱的馏分;hiprepq-bound表示结合hiprepq柱的馏分。图13,小鼠烫伤后d0-d20各组平均体重(g)。control为对照健康小鼠;dm为糖尿病模型小鼠;dm_he为糖尿病模型小鼠给予he治疗。图14,小鼠烫伤后d0-d20各组平均伤口愈合率。图例同图13。图15,使用本发明的羊水能明显促进糖尿病对象的伤口愈合。小鼠烫伤后d0-d20各组平均伤口愈合率。对照(control)为健康小鼠,n=5;dm为糖尿病模型小鼠,n=4;dm_dws为糖尿病模型小鼠给予dws治疗,n=6。具体实施方式应理解,在本发明范围中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成优选的技术方案。本发明人发现,非人动物羊水和/或其提取物所含生长因子群能促进糖尿病对象细胞生长或伤口愈合。因此,本文涉及使用羊水和/或其提取物来促进糖尿病对象细胞生长、组织修复或伤口愈合。羊水可来自禽蛋和非人哺乳动物。禽蛋指禽类的蛋。优选的禽类为家禽,如鸡、鸭和鹅。优选的是,本发明使用胚龄在5-20天、优选6-15天的禽蛋。应理解,不同禽蛋,合适的胚龄未必相同。例如,当使用鸡蛋时,优选使用胚龄为5-12天的鸡蛋,更优选使用胚龄为6-11天的鸡蛋,更优选使用胚龄为7-9天的鸡蛋、更优选使用胚龄为7-8天的鸡蛋。当使用其它禽类的蛋时,可使用其发育时期与上述胚龄的鸡蛋所处的发育时期相对应的蛋。例如,当使用鸭蛋时,胚龄为8-10天、尤其是8-9天的鸭蛋可能是最好的。可采用常规的方法获得禽蛋羊水。例如,可敲击相应胚龄的蛋的钝端,使蛋壳碎裂,将蛋壳剥开形成一个直径约为2厘米的口子。然后用镊子小心撕开壳膜和卵黄膜,注意不要破坏羊膜。将包裹着胚胎的羊膜和相连组织从壳中倾倒至培养皿中,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。本文中,羊水还可来自非人哺乳动物,尤其是啮齿类动物,如来自小鼠。其它非人哺乳动物可以是常见的家畜,例如牛、羊、狗、猫、猪等。在某些实施方案中,羊水来自胎龄为8-14天的啮齿类动物的胚胎,或来自其发育时期与胎龄为8-14天的啮齿类动物所处的发育时期相对应的非人哺乳动物的胚胎。可采用常规的方法获得羊水。例如,用手术剪剪开怀孕8-14天的小鼠腹腔,小心取出并剪开子宫,用注射器刺入羊膜抽取羊水,直至羊膜紧贴胚胎,由此即可获得用于本发明的羊水。应理解,必要时,可对羊水进行离心,以分离出可能含有的杂质,例如卵黄等,尽可能获得纯的羊水。离心后获得的上清液即为用于本发明的羊水。应理解的是,获取羊水的所有步骤都需在无菌条件下进行;另外,本文所示的“羊水”应指“纯”的羊水,即分离自禽蛋或非人哺乳动物胚胎的不含有禽蛋内或非人哺乳动物胚胎内其它成分、且也未被外源物质污染的羊水。纯的羊水可储存于-60℃以下的冰箱中,解冻后再使用。在某些实施方案中,本发明使用羊水的提取物。优选地,该提取物中主要生物活性成分在ph7.0-8.0之间不和离子交换柱子结合,且其所含成分的分子量在150-2000道尔顿范围内,但不限于此范围。可从羊水中分离出分子量为150-2000道尔顿的中性馏分,由此获得所述提取物。可采用本领域周知的凝胶柱和离子交换柱来实施本文的方法。例如,可使用周知的凝胶层析柱(如下文所述的各种凝胶层析柱)从羊水中分离出分子量为150-2000道尔顿的馏分,然后使用离子交换方法(如使用下文所述的离子交换柱)从该馏分中分离出中性馏分。或者,也可先用离子交换方法(如使用下文所述的离子交换柱)从羊水中分离出中性馏分,然后再使用凝胶层析柱(如下文所述的各种凝胶层析柱)分离出该中性馏分中分子量在150-2000道尔顿范围内的馏分。在某些实施方案中,可先从羊水中分离得到分子量在150-2000道尔顿的中性馏分,然后再从中分离得到分子量在200-1200道尔顿范围内的馏分。具体而言,该方法可包括以下步骤:(1)从羊水中分离得到分子量为150-2000道尔顿的中性馏分;和(2)从该分子量为150-2000道尔顿的中性馏分中分离得到分子量为200-1200道尔顿的中性馏分。步骤(1)可通过使用凝胶层析和离子交换方法来实现。通过凝胶层析柱分离出羊水中分子量在150-2000道尔顿的成分,而通过离子交换可获得不带电荷(中性)的馏分。本文中,可采用各种市售的凝胶层析柱来实施凝胶层析,这类凝胶层析柱包括但不限于ge公司的sephacryls-100、sephacryls-200、sephacryls-300、sephacryls-400、superose12、superose6、superdex12和superdex6等。应理解,也可使用分离范围为100-10000道尔顿的其它任意凝胶层析填料。通常,在使用凝胶层析柱时,可先用ddh2o平衡凝胶层析柱,流速可根据实际情况确定。例如,在某些实施方案中,流速可以是0.5-50ml/min,如1ml/min。通常,紫外吸收在200-300nm之间,如280nm。待紫外吸收曲线平稳,回归基线后,结束平衡。平衡结束后,可上样。上样流速根据实际制备情况确定。上样结束后,可用脱气ddh2o洗脱粗品,收集分子量在150-2000道尔顿之间的馏分。需要时,可重复凝胶层析的分离数次,混合每一次分离时相同出峰时间的馏分。本文中,可采用本领域周知的方法将带电荷的成分与不带电荷的成分分离。例如,可使用离子交换方法实现。阴离子交换和阳离子交换都可用于本发明方法中。在某些实施方案中,本文采用阴离子交换法。可使用市售的阴离子交换柱,包括但不限于ge公司的deaesepharose、anxsepharose、qsepharose、captodeae、captoq、monoq和miniq等。应理解,也可使用其它品牌的阴离子交换填料。或者,也可使用市售的阳离子交换柱,包括但不限于cmsepharose、spsepharose、captos、monos和minis等。通常,在实施离子交换时,先用缓冲液平衡离子交换柱。缓冲液可以是本领域常规的缓冲液,例如可使用磷酸盐缓冲液,尤其是磷酸钠缓冲液。缓冲液的ph可根据所使用的离子交换柱确定。例如,使用阴离子交换柱时,可使用ph为7.5~8.5、优选7.5~8.0的缓冲液平衡阴离子交换柱;使用阳离子交换柱时,可使用ph为5.8~7.0、优选5.8~6.5的缓冲液平衡阳离子交换柱。在某些实施方案中,该磷酸钠缓冲液含有na2hpo4和nah2po4,ph为约5.8或8.0。本发明优选使用阴离子交换柱进行分离。流速可根据实际情况确定。例如,在某些实施方案中,流速可以是0.5-50ml/min,如1ml/min。通常,待280nm紫外吸收曲线平稳,回归基线后,结束平衡。平衡结束后,可上样,收集流出部分(即未与柱结合的部分)。上样流速根据实际制备情况确定。步骤(1)中,可先进行凝胶层析,分离出分子量在150-2000道尔顿的馏分,然后再进行离子交换,分离出中性馏分;或者,也可以先进行离子交换,分离出羊水中的中性馏分,然后再通过凝胶层析将中性馏分中分子量在150-2000道尔顿范围内的活性成分分离出来,获得分子量在150-2000道尔顿之间的中性馏分。步骤(2)中的主要目的是进一步对步骤(1)获得的中性馏分进行分离,获得分子量大小在150-1200道尔顿范围内的活性成分。本文中,可使用市售的凝胶层析柱来分离得到分子量在150-1200道尔顿范围内的馏分。合适的凝胶层析柱包括但不限于ge公司的hiloadsuperdex16/600superdex75pg、superdexpeptide、superdex200和superdex30等。应理解,也可以使用分离范围在500-10000道尔顿的其它品牌的凝胶层析填料。通常,可先用ddh2o平衡凝胶柱,流速可根据实际情况确定。例如,在某些实施方案中,流速可以是0.5-50ml/min,如1ml/min。通常,待280nm紫外吸收曲线平稳,回归基线后,结束平衡。平衡结束后,可上样。上样流速根据实际制备情况确定。上样结束后,可用脱气ddh2o洗脱粗品,收集馏分,获得所含成分的分子量在150-1200道尔顿范围的馏分,即为本文所述的提取物。在一个或多个实施方式中,本发明羊水和/或其提取物或由其为主要原料配制成的复合敷料称为dws。采用上述方法获得的提取物,将其配制成ph为5.8-8.0的溶液后过多种离子交换柱(包括deaesepharose、qsepharose、monoq、cmsepharose、spsepharose和monos),其所含活性成分均不与这些离子交换柱结合。本文所述的羊水和/或其提取物可作为药物的活性成分,用于体内给予需要的对象,体内促进细胞生长和组织修复。例如,可给予需要的对象有效量的本文所述的羊水和/或其提取物,或含有所述羊水和/或其提取物的药物组合物。本文中,动物可以是哺乳动物,尤其是人。本文所述的“修复”指形成足以至少部分填补无效的或结构不连续的组织缺损部位的新组织。“组织缺损”或“组织缺损部位”是指上皮、结缔或肌肉组织的破坏。组织缺损导致组织在不理想的水平或不理想的条件下运行。例如,组织缺损可以是肌腱的部分层或整层被撕裂,或由心肌梗塞导致的局部细胞死亡。组织缺损可以形成一个“空隙”,这可以理解为三维的缺损,例如在上皮,结缔或肌肉组织的完整性结构中形成裂口、空腔、孔或其他实质性的破坏。在某些实施方式中,组织缺损是指没有能力进行内源性修复或自发性修复的那些组织。组织缺损可以是由意外事故、疾病和/或手术操作引起的。例如,软骨缺损可能是关节创伤引起的,例如撕裂的半月板组织移动到关节中。组织缺损还可以是退化性疾病(如骨关节炎)引起的。在某些实施方式中,本发明特别涉及神经病变和/或血管病变引起组织缺损的修复。本文所述的组织包括但不限于肌肉组织、上皮组织、结缔组织和神经组织。在某些实施方案中,本文所述的组织包括但不限于:软骨组织、半月板组织、韧带组织、肌腱组织、椎间盘组织、牙周组织、皮肤组织、血管组织、肌肉组织、筋膜组织、骨膜组织、滑膜组织、神经组织、骨髓和脂肪组织。因此,本文所述的细胞可以是来自上述任一组织的细胞。在某些实施方案中,可使用本文所述的羊水和/或其提取物治疗与组织损伤相关的病情,包括但不限于由疾病或外伤或组织未能正常发育所引起的病情,如皮肤干燥;靠毛脱离;皮温下降;色素沉着;肢端动脉搏动减弱或消失;撕裂或断裂的肌腱或韧带;皮肤伤口(如疤痕、外伤性创伤、缺血性伤口、糖尿病伤口、手术伤口)、烫伤、烧伤、皮肤溃疡(如褥疮或压力导致的溃疡、静脉溃疡、糖尿病溃疡、坏疽、坏死);血管病情(如外周动脉疾病、静脉疾病、血管缺损、血管发育不当);肌肉疾病(如肌肉萎缩、炎性、神经性和生肌性肌肉疾病);神经疾病例(如刺痛、灼痛、麻木、感觉迟钝或丧失);骨疾病(例如休息痛、骨髓炎、charcot关节病、足趾畸形);感染、组织水肿、间歇性跛行,及皮肤肿瘤引起的长期不愈合伤口等。因此,本文提供本文所述的羊水和/或其提取物在促进糖尿病对象细胞生长、组织修复和/或伤口愈合中的应用。本文还提供一种糖尿病对象组织修复方法,所述方法包括使用本文所述的羊水和/或其提取物或由其为主要原料配制成的复合敷料,或含有本文所述的羊水或提取物的细胞培养基体外培养感兴趣的组织细胞,形成组织基质后,将该组织基质植入组织损伤或缺损部位。本文还提供治疗神经病变和/或血管病变引起的神经性溃疡、血管性溃疡或神经-血管性溃疡的方法,包括给予有需要的对象治疗有效量的本文所述的羊水和/或其提取物或含有所述羊水和/或其提取物的药物组合物的步骤。本发明还提供治疗糖尿病对象的血管病变,恢复糖尿病对象的皮肤排汗调节功能、皮肤温度调节功能和血运调节功能的方法。本发明还提供治疗糖尿病足或与糖尿病足相关的病情的方法。治疗有效量是指可在受试者中实现治疗、预防、减轻和/或缓解疾病或病症的剂量。可根据患者年龄、性别、所患病症及其严重程度、患者的其它身体状况等因素确定治疗有效量。本文中,受试者或患者通常指哺乳动物,尤其指人。本文中,可通过体外使用本文所述的羊水和/或其提取物或含有所述羊水和/或其提取物的培养基培养自体细胞或异体细胞,或采用本文所述的细胞培养方法培养自体细胞或异体细胞,形成可植入的组织或基质,将其植入动物体,尤其是人体内,尤其是在组织缺损部位植入,以修复相应的受损的组织。自体细胞是分离自需要组织修复或治疗的动物体自身,尤其是分离自需要修复或治疗的组织本身的细胞。本文还涉及直接使用本文所述的羊水和/或其提取物或由其为主要原料配制成的复合敷料用于本文所述的方法或用途,给予需要的对象。给药方式可以是肠胃外给药,也可以静脉注射给药或心腔注射等。在某些实施方案中,可将治疗有效量的羊水和/或其提取物与适量的注射用生理盐水、注射用水或葡萄糖注射液混匀,然后通过合适的方式给药,如静脉内输注、心腔注射给药或病灶区给药,例如涂敷于伤口表面。在优选的实施方案中,本文涉及直接在受损部位给予本文所述的羊水和/或其提取物或由其为主要原料配制成的复合敷料,以促进所述部位正常细胞的增殖,从而实现缺损部分的组织修复。含有本文所述羊水和/或其提取物的药物组合物通常还含有药学上可接受的辅料。本文中,“药学上可接受的辅料”是指在药理学和/或生理学上与受试者和活性成分相容的载体、稀释剂和/或赋形剂,包括但不限于:抗生素,保湿剂,ph调节剂,表面活性剂,碳水化合物,佐剂,抗氧化剂,螯合剂,离子强度增强剂、防腐剂、载剂、助流剂、甜味剂、染料/着色剂、增味剂、润湿剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。在一些实施方案中,药学上可接受的辅料可以包括一种或多种非活性成分,包括但不限于:稳定剂、防腐剂、添加剂、佐剂、喷雾剂、压缩空气或其它适宜的气体,或其它适宜的与药效化合物合用的非活性成分。更具体而言,合适的药学上可接受的辅料可以是本领域常用于糖尿病足的辅料。在一个或多个实施方案中,适用于喷剂的合适的药学上可接受的辅料选自以下一种或多种:水、葡糖酸内酯、苯甲酸钠、熊果苷、透明质酸钠、烟酰胺、甘油。在一个或多个实施方案中,适用于涂敷剂或敷料的合适的药学上可接受的辅料选自以下一种或多种:水、甘油、泛醇、抗坏血酸磷酸酯镁、烟酰胺、透明质酸钠、苯氧乙醇、辛甘醇、山梨酸。本领域可根据实际情况确定药学上可接受的辅料的含量。将药物涂敷于伤口一般需添加敷料。“敷料”是包扎伤口的用品,用以覆盖疮、伤口或其他损害的材料。伤口敷料的种类有被动型敷料、相互作用型敷料和生物活性敷料。本领域知晓适用于本发明用途的伤口敷料。本文所述药物组合物除含有羊水和/或其提取物之外,还可含有其他有助于糖尿病患者伤口恢复的活性成分,包括但不限于积雪草提取物、玫瑰纯露、甘草根提取物、油橄榄叶提取物、金盏花花提取物、白柳树皮提取物、薰衣草提取物、柠檬果提取物、水解大豆蛋白、艾叶提取物、茶叶提取物、百里香提取物、紫松果菊提取物、贯叶连翘花/叶提取物、库拉索芦荟叶汁粉、酵母提取物。给药的剂量和频次可根据具体的病情,患者的年龄和性别等情况由医护人员确定。通常,对于特定疾病的治疗,治疗有效量是指足以改善或以某些方式减轻与疾病有关的症状的药量。这样的药量可作为单一剂量施用,或者可依据有效的治疗方案给药。给药量也许可治愈疾病,但是给药通常是为了改善疾病的症状。一般需要反复给药来实现所需的症状改善。例如,对于给予人的剂量,通常可在1-200ml/次,可每天或每周注射给予。在某些实施方案中,给药频次可以是每天多次、每天二次、每二天、每三天、每四天、每五天或每六天给药一次,或每半个月给药一次,或者每月给药一次。本文还提供一种药物组合物,该药物组合物含有本文所述的羊水和/或其提取物,尤其是家禽的蛋中的羊水和/或其提取物,更优选为胚龄为5-12天、更优选为6-11天、更优选6-9天、更优选7-8天的鸡蛋的羊水和/或其提取物。药物组合物可以是-60℃以下冷冻保存羊水和/或其提取物或其冻干试剂,例如冻干羊水和/或其提取物。药物组合物中还可含有其它药学上可接受的载体或赋形剂,例如注射用生理盐水、注射用水或葡萄糖注射液等。优选地,药物组合物含有5-40%(v/v)或10%-35%的羊水和/或其提取物,优选15-30%。在某些实施方案中,本文还提供一种细胞培养基,该细胞培养基含有适量的本文所述的羊水和/或其提取物。细胞培养基中羊水和/或其提取物的含量可根据所培养的细胞的类型加以确定,例如,羊水或提取物的添加量可以是该细胞培养基重量的0.1~30%,如1~25%或3~20%不等。可根据待培养的细胞选择合适的细胞培养基,示例性的细胞培养基包括但不限于可市售获得的各种培养基,如dmem、rpmi1640、mem、dmem/f12等。下文将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并不意图限制本发明的范围。实施例中所用到的方法、试剂和仪器,除非另有说明,否则为本领域常规的方法、试剂和仪器。实施例实施例1:材料和方法1、材料a)仪器和工具微电脑全自动孵化器(正大tmzf880),洁净培养皿,1.0ml注射器(江西洪达tm),经70%酒精消毒的镊子,不锈钢筛子,无菌离心管(#sct-50ml-25-s)和低速冷冻离心机(中佳kdc-2046)。b)试剂和生物材料胚龄7天的鸡蛋。2、实验流程取鸡蛋,敲击朝上放置的、较为扁平的钝端,使蛋壳碎裂,将蛋壳剥开形成一个直径约为2厘米的口子,边缘应尽量平整。用镊子小心撕开壳膜和卵黄膜,注意不要破坏羊膜。观察胚胎发育状况,只有发育良好且符合对应阶段标准的胚胎可用于抽提羊水。将包裹着胚胎的羊膜和相连组织从壳中倾倒至培养皿中,用注射器刺入羊膜抽取羊水,针口斜面应背对胚胎,直至羊膜紧贴胚胎,然后将澄清、无色、无异物的羊水注入冰盒内的离心管中。用镊子取出羊膜中的胚胎,收集于放置在冰上的不锈钢筛子中,每隔一小时将收集的胚胎用搅拌机匀质化,封装在无菌的塑料储物罐中,倾斜放置于-80℃冰箱中。冷冻后可竖直放置。通过美谱达tm1800紫外分光光度仪测试收集的羊水抽提液,光度仪标准操作流程参见使用手册。将收集羊水抽提液的离心管配平后用中佳tmkdc-2046低速冷冻离心机于5℃,3500rpm离心20分钟(离心机标准操作流程参见使用手册)。将上清液倾析转移至洁净的塑料储物罐中,储存于-80℃冰箱中。每批次预留5ml小样用于后续测试。所有步骤都在无菌条件下进行。实施例2:成分检测本实施例使用日立primaide型高效液相色谱仪检测不同胚龄的鸡蛋的羊水成分。按该色谱仪的使用说明书进行检测。其中,检测开始前先用100%乙腈洗涤30分钟,流速时间为0.8ml/min,之后用水平衡30分钟,流速0.8ml/min时间。抽取25μl样品并排除气泡,点击色谱仪自带的软件的“数据采集”按钮,选择“方法2”,点击屏幕下方“单分析开始”,待系统出现“等待进样”时,开始注射样品,注射要迅速,注射完后切换阀门。该方法2如下:时间(min)水(%)乙腈(%)流量(ml/min)0.0100.00.00.811.0100.00.00.817.095.05.00.830.090.010.00.845.055.045.00.860.00.0100.00.870.00.0100.00.8本实施例检测了胚龄为7天、11天和13天的羊水,结果如图1-3所示。实施例3:抗自由基能力检测dpph即1,1-二苯基-2-苦基肼基自由基,其结构如下所示:dpph的分子中由于存在多个吸电子的-no2和苯环的大π键,所以氮自由基能稳定存在。当dpph自由基被清除,其最大吸收波长519nm处的吸光度a值随之减小。dpph这种稳定的自由基为清除自由基活性的检测提供了一个理想而又简单的药理模型。本实施例利用dpph来检测来自鸡胚羊水的抗自由基能力。取0.8mg的dpph,溶于20ml溶剂甲醇中,超声5min,充分振摇,使上下各部分均匀。取1ml该dpph溶液,在519nm处测a0值,a=0.5-0.7。该dpph溶液避光保存,3.5小时内用完。采用实施例一所述的方法分别获得胚龄为6天、7天、8天、9天、10天和11天的鸡蛋的羊水,离心后保存在4℃冰箱中待用。以维生素c作为正对照,测定标准曲线。取不同体积的0.04mg/mlvc样品加入0.6ml的dpph,加入无水乙醇补足至1ml,混匀,以甲醇为对照调零,测定519nm波长下的吸光值。重复三次数据后作图。取不同胚龄的羊水400μl至试管中,加入600μl中配制好的dpph的甲醇溶液,混匀,反应10min,使气泡不再产生(测定前要混匀)。以甲醇为对照调零,测定519nm的吸光度。各组的加样信息如下表所示:实验组样品液95%乙醇(或无水乙醇)dpph测试液总体积空白组0ml0.4ml0.6ml1mlvcnμl(400-n)μl0.6ml1ml样品组0.4ml0ml0.6ml1ml采用以下公式计算清除率(抑制率):清除率(%)=(a0-a)/a0×100%。结果如图4所示。实施例4:对鸡胚胎成纤维细胞的影响本实施例测试实施例1的鸡蛋羊水(ee)对鸡胚胎成纤维细胞在不同培养条件下的生长的影响。本实施例使用的dmem培养基的组成如下:#cat.11960077,加入1%l-谷氨酰胺(#g0200)和5%fbs(#cat.10099141)),0.25%胰酶-edta(杭州科易生物tm#cy003),pbs(bitm#02-024-1acs),0.4%台盼蓝染剂(bbitm#72-57-1)。取胚龄7天的鸡蛋的胚胎,用pbs冲洗胚胎表面,将液体用移液枪吸干净。取出胚胎内脏,将其余组织剪碎至无肉眼可见的大颗粒、团块。加1ml的0.25%胰酶-edta,用枪头使之与组织混匀,将悬液吸取至15ml离心管。用1ml的0.25%胰酶-edta冲洗培养皿,将悬液吸取至同一支15ml离心管。将离心管放入37℃水浴,消化5-7分钟后,加入8ml的dmem培养基(含pbs)中和胰酶-edta。将离心管放入离心机,离心5-10秒。取出离心管,收集上清液。2000rpm离心该离心上清液2min。弃上清,加入4ml的dmem培养基,用枪头使细胞重悬。分别取1ml细胞悬液注入10cm细胞培养皿,再加入10ml的dmem培养基。十字方向晃动培养皿,每个方向至少20次,使细胞分布均匀。于37℃、5%co2条件下培养。当细胞覆盖70%-90%的培养皿底部时,将细胞传代。将培养皿从培养箱取出,收集原有的培养基于离心管中。小心加入5ml的pbs清洗细胞。之后,加入500μl0.25%胰酶-edta,将培养皿放入培养箱,消化1分钟。轻轻拍打培养皿侧边加快消化过程,待细胞团块快速分解,大部分细胞呈漂浮状态,迅速加入9.5ml回收的原有培养基中和胰酶-edta。用移液管吹打培养皿底部,将尽量多的细胞悬液收集至15ml离心管中,于2000rpm离心3min。弃上清,加入4ml的dmem培养基,用枪头使细胞重悬。分别将1ml细胞悬液注入含有10ml含不同体积比的羊水的新鲜培养基的10cm细胞培养皿中。十字方向晃动培养皿,每个方向至少20次,使细胞分布均匀,于37℃、5%co2条件下培养。取生长良好的鸡胚胎成纤维细胞,收集原有的培养基于离心管中。小心加入5ml的pbs清洗细胞,注意不可造成细胞层破损,轻轻晃动后倒除pbs。加入100μl的0.25%胰酶-edta消化2-5分钟(24孔板),用100μl培养基中和。用枪头使之成为单细胞悬液。按照一定倍数稀释该单细胞悬液,加入等量0.4%台盼蓝染液染色,稀释倍数以稀释后细胞数在20-200之间为宜。吸取适量(15μl)细胞悬液,从盖玻片上下边缘加样到血球计数板上,显微镜下计活细胞数。计算活细胞总数,调整细胞浓度至1×105个细胞/ml。每24小时取样一次,每次取3个孔细胞,进行常规胰酶-edta消化、制备单细胞悬液、显微镜计数。以时间(天)为横轴,细胞浓度为纵轴绘制生长曲线。细胞个数=细胞总计数/4×104×稀释倍数,细胞浓度=该细胞个数/ml。结果如图5所示。图5显示,在共培育96小时以后,添加ee的实验组中鸡胚胎成纤维细胞的数量明显高于与未添加ee的对照的细胞数量。实施例5:细胞在羊水提取物中的活力和迁移能力采用与实施例1相同的方法获得胚龄为8天的鸭蛋的羊水。采用划痕实验测试鸡蛋羊水对鸡胚胎成纤维细胞和鸭蛋羊水对人脐静脉内皮细胞(huvec)的生长活力和迁移能力的影响。鸭蛋羊水获自胚龄8天的鸭蛋,采用实施例一的方法获得。鸡胚胎成纤维细胞采用实施例五所述的方法获得,人脐静脉内皮细胞从市售途径获得。本实施例使用的dmem培养基的组成如下:#cat.11960077,加入1%l-谷氨酰胺(#g0200)和5%fbs(#cat.10099141)),0.25%胰酶-edta(杭州科易生物tm#cy003),pbs(bitm#02-024-1acs),0.4%台盼蓝染剂(bbitm#72-57-1)。实验前第一天,准备6孔板,用马克笔在6孔板背后用直尺画出5-6条分布均匀的横线,横穿过孔;再在中线位置画一条垂直的竖线以指示划痕的位置。在每个孔中加入约5×105个处于对数生长期的细胞,原则上接种过夜后融合率达到90%。实验当天,用枪头比着直尺,沿马克笔竖线,垂直于6孔板底面划线。尽量不要倾斜、弯曲,不同孔之间最好用同一支枪头,宽度在1000-2000μm为宜。每个孔用2mlpbs清洗3次,洗去划痕处的细胞。各个孔中分别加入2ml含不同含量的ee的培养基,常规培养,每48小时换液。从划痕计时为0h,每24小时定点拍照,测量划痕两侧细胞间距。观察每个孔中细胞生长状况;以时间(天)为横轴,每个孔中划痕距离为纵轴绘制图表;计算每个孔中划痕愈合的速度。结果如图6和7所示。图6显示来自鸡蛋的羊水对对人脐静脉内皮细胞(huvec)的生长活力和迁移能力的影响,添加5%(体积比)的羊水明显对huvec的愈合具有非常明显的促进作用。图7显示来自鸭蛋的羊水对鸡胚胎成纤维细胞的生长活力和迁移能力的影响,羊水的添加对鸡胚胎成纤维细胞的愈合也显示出非常明显的促进作用。实施例6:对哺乳动物成骨细胞的影响按实施例1所述方法制备得到胚龄为7天的鸡蛋羊水(ee),用于本实验。从成年小鼠中分离得到成骨细胞,用加10%fbs的dmem培养液在37℃、5%co2培养箱中培养至第三代(p3)。在96孔平板中每个孔接种400个细胞。24小时后换成只有dmem培养液(饥饿),培养24小时,然后换成下列培养液(ee的添加量以dmem的体积计),继续培养72小时,之后采用cck-8试剂盒检测细胞生长:1)dmem(无血清);2)dmem+2.5%ee;3)dmem+5%ee;4)dmem+7.5%ee;5)dmem+10%ee。结果如图8所示。图8显示,鸡胚羊水能明显促进小鼠成骨细胞的生长。实施例7:羊水对心肌细胞的影响。1、分离原代心肌细胞(vm)取乳鼠心室于预冷pbs清洗,之后在dmem/f12中剪碎心脏组织。37℃水浴震荡,用0.04%胶原酶ⅱ+0.08%胰酶消化。用筛网将已经消化下来的细胞过滤离心,1000rpm/min,10min。加15%fbs细胞培养液铺板,在5%co2饱和湿度37℃培养箱培养。2、细胞活力检测将原代心肌细胞消化后,铺于96孔板中,6000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养24小时之后,分别用培养基dmem/f12、含10%fbs的dmem/f12、含10%fbs和5%ee的dmem/f12代替原来培养基15%fbs的dmem/f12。培养48小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。结果如图9所示。实施例8-10:纯化羊水中的活性化合物本实施例的目的在于通过分析柱凝胶柱sephacryls-200、阴离子交换柱hiprepq、脱盐柱hiprep26/10desalting、hiload16/600superdex75pg逐步纯化鸡胚羊水中具有生物活性的化合物。1、材料1.1纯化样品:新鲜的胚龄为7天的鸡蛋羊水,50ml。1.2主要实验设备及耗材1)geaktapurifier;2)凝胶柱gesephacryls-200;3)阴离子交换柱gehiprepq;4)脱盐柱gehiprep26/10desalting;5)凝胶柱gehiload16/600superdex75pg;6)superloop10ml。2、方法2.1溶液制备磷酸钠缓冲液a(50mmna2hpo4+nah2po4,ph8.0)的制备:46.6ml1mna2hpo4与3.4ml1mnah2po4混合,加ddh2o定容至1l。2.2实验方法2.2.2样本处理:新鲜羊水50ml,加入适量己烷,2500rpm、4℃离心20min,获得水相,0.22μm滤膜过滤。2.2.3样品纯化第一步:凝胶柱gesephacryls-200ddh2o平衡凝胶柱:流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱粗品,流速2ml/min,等体积收集馏分,3ml/管。2柱体积(240ml)洗脱;重复分离纯化5次,每一次中相同出峰时间的部分充分混合;第二步:阴离子交换柱gehiprepq磷酸钠缓冲液a(50mmna2hpo4+nah2po4,ph8.0)平衡阴离子交换柱:流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:取第一步纯化后具有生物活性的部分,用泵上样流速1.5ml/min,上样量250ml,同时等体积收集阴离子柱未结合部分,2ml/管;脱盐:将离子柱中结合和不结合的馏分分别用gehiprep26/10desalting置换到脱气ddh2o中,收集脱盐后的部分;第三步:凝胶柱gehiload16/600superdex75pgddh2o平衡凝胶柱:流速1ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱样品,流速1ml/min,等体积收集馏分,2ml/管。洗脱1.5柱体积(240ml);测细胞活性:将长势较好的ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成10%fbs的dmem、dmem和含20%馏分的培养基。培养24小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。3、实验结果经凝胶柱gehiload16/600superdex75pg分离的未结合部分的色谱图如图10所示。细胞活力检测跟踪到具有生物活性的生长因子群,结果如图11所示。实施例9采用与实施例8相同的方法,实施以下分离纯化:1、活性成分分离纯化第一步:凝胶柱gesephacryls-200ddh2o平衡凝胶柱:流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱粗品,流速2ml/min,收集分子量在500-2000道尔顿范围内的馏分;重复分离纯化5次,每一次中相同出峰时间的部分充分混合;第二步:阳离子交换柱gehiprepsp磷酸钠缓冲液a(50mmna2hpo4+nah2po4,ph5.8)平衡阳离子交换柱:流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:取第一步获得的分子量在150-2000道尔顿范围内的馏分,用泵上样流速1.5ml/min,上样量250ml,收集阳离子交换柱未结合部分;第三步:凝胶柱gehiload16/600superdex75pgddh2o平衡凝胶柱:流速1ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:取第二步获得的未结合部分上样,流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱样品,流速1ml/min,收集分子量在500-1200道尔顿范围内的馏分。2、活性成分检测将长势较好的ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成10%fbs的dmem、dmem和含20%馏分的培养基。培养24小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。阳离子交换柱gehiprepsp处理后不结合区的细胞活力如图12所示。实施例10采用与实施例8相同的方法实施以下分离纯化:1、活性成分分离纯化第一步:离子交换柱,可使用阴离子交换柱hiprepq,使各溶液的ph分别为5.8和8.0,然后分别上样与离子交换柱,流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:取羊水,用泵上样流速1.5ml/min,上样量50ml,收集离子柱未结合馏分;第二步:凝胶柱gesephacryls-200ddh2o平衡凝胶柱:流速2ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:样品为第一步未结合馏分,流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱粗品,流速2ml/min,收集分子量在150-2000道尔顿范围内的馏分;第三步:凝胶柱gehiload16/600superdex75pgddh2o平衡凝胶柱:流速1ml/min,直到280nm紫外吸收曲线平稳,回归基线;上样:取第二步获得的150-2000道尔顿范围内的馏分上样,流速1ml/min,上样量10ml;洗脱:用脱气ddh2o洗脱样品,流速1ml/min,收集分子量在150-1200道尔顿范围内的馏分。2、活性成分检测将长势较好的ac16消化后,铺于96孔板中,8000个/孔,每一组五个复孔。在5%co2饱和湿度37℃培养箱培养2小时,细胞贴壁。用培养基dmem饥饿培养24小时后,替换成10%fbs的dmem、dmem和含20%馏分的培养基。培养24小时后,每孔加入10μlcck-8试剂。孵育2小时后,于酶标仪在450nm检测吸收值。阴离子交换柱gehiprepq处理后不结合区的细胞活力如图12所示。实施例11:羊水对对糖尿病足的治疗作用1、材料生物材料:c57bl6小鼠(雄性,6-8周龄开始高脂饲养,实验时为11-13周龄)饲料:36%脂肪含量小鼠饲料试剂和药品:75%乙醇,异氟烷无水柠檬酸(a100529-0250),柠檬酸三钠二水(a100101-0500),链脲佐菌素(stz,),透明质酸钠(ha,1706221),实施例1的鸡蛋羊水(ee),5%水合氯醛(a600288-0250),头孢喹肟(50ml,1.25g)器械和工具:血糖仪及试纸(onetouch),体视显微镜(smz168),恒温电烙铁,眼科剪,镊子,电动剃毛器(hc1055),小鼠固定器,1ml注射器100μl移液枪麻醉仪(abm型)2、方法2.1、糖尿病模型造模-6周将健康的6-8周龄雄性小鼠3只一笼饲养,提供足量36%脂肪含量的高热量饲料和二次水,自主摄食。室温控制在22-24℃之间,跟随自然节律(自然光照不良时灯光模拟自然光照),每周更换木屑垫料,持续饲养6周。-16小时注射stz前16小时,将所有饮用水和饲料移除,换上干净的垫料,每只小鼠单独一笼并编号。0天称量并记录每只小鼠体重。剪尾采血并用血糖仪测空腹血糖,及时压迫止血,用医用棉球拭去残余血迹。用0.1m柠檬酸(mw=192)母液和0.1m柠檬酸三钠二水(mw=294)母液以1.3:1体积比配制ph4.4-4.5的0.1mm柠檬酸缓冲溶液,4℃保存。称取stz,用柠檬酸缓冲溶液配制20mg/ml的stz溶液,15分钟内使用,使用过程中将stz溶液避光置于冰上。将stz溶液按140mg/kg的剂量腹腔注射入#s01-#s26小鼠体内。对照组#c01-#c05注射0.20ml柠檬酸缓冲溶液。注射stz一小时后给与充足灭菌水和36%脂肪含量高脂饲料,保持垫料干燥。注射后第d4、d8、d11(烫伤d0)提前16小时禁食不禁水后测小鼠空腹血糖和体重。每次禁食时间和测量时间相同。空腹血糖持续大于11.1mm者视为糖尿病模型可用于下一步实验。2.2、烫伤实验根据建模成功率和需实验的敷料种类设置组别(如下表所示),对照组为无糖尿病小鼠,实验组为stz诱导后符合糖尿病血糖标准的小鼠。所有小鼠生长阶段、饲养条件相同。每只小鼠制造相同面积相同程度的烫伤伤口,采用不同敷料进行实验。对照组:无糖尿病小鼠,无敷料实验组:糖尿病小鼠无敷料、糖尿病小鼠涂he敷料(0.8%ha,20%ee,余量为水)实验小鼠分组和编号组别编号无糖尿病小鼠,无敷料(control)c1-7糖尿病小鼠,无敷料(dm)dm1-9糖尿病小鼠,he(dm_he)dm_he1-9准备干净的笼子,将小鼠分别称重后单独放到笼内,此时为d0。小鼠经腹腔注射5%水合氯醛(0.007ml/g),待翻正反射消失后,在手术布上固定其躯体,用电动剃毛器刮去背部毛发。将温控电焊笔加热至150℃,恒温后稳定接触小鼠背中部皮肤60秒,制造一个圆形烫伤伤口。烫伤后股部肌注头孢喹肟注射悬液(2.5mg/kg)预防感染。用体视显微镜于同一放大倍率拍摄伤口照片,并测量烧伤面积,记录数据。烧伤部位应尽量与镜头平行,减小测量误差。将敷料用医用棉签滴涂于对应小鼠伤口上,敷料面积应覆盖伤口。每天早晚滴涂辅料各一次。饲养盒中用医用棉替代木屑,每盒一只单独饲养,防止小鼠刮蹭伤口。给与充足灭菌水和36%脂肪含量高脂饲料,每隔2-3天换医用棉,保持垫料清洁。d2、d4、d7、d9、d14、d17、d20检查并测量伤口,记录照片和数据。观察正常各组小鼠伤口愈合的差别,计算并比较敷料对伤口愈合速率和效果的影响。数据由graphpadprism处理。3、结果3.1糖尿病模型造模stz诱导后,于10天内血糖持续符合造模标准的小鼠用作烫伤实验。本实验中,造模总数为35,造模后第4、10天持续观测空腹血糖。烫伤后d7、d14、d20持续监测血糖,全部符合实验组设置要求。3.2烫伤实验3.2.1体重实验过程中,尤其在烫伤后,糖尿病小鼠均有不同程度状态较差的表现,主要体现为行动迟缓,部分死亡。d0-d20各组平均体重体重(g)d0d2d4d7d9d14d17d20对照28.627.627.827.828.128.828.629.0dm23.221.721.321.321.021.321.120.9dm_he22.520.020.223.022.221.420.821.3因药物诱导造模造成的糖尿病模型小鼠体重显著低于正参照组健康小鼠,且糖尿病小鼠各组间无显著差异,属于正常情况。各组小鼠体重于烫伤(d0)后略有下降后相对平稳,符合预期,如图13所示。2.2伤口愈合率利用下式计算烫伤后d0-d20各组伤口愈合率(ε),d0-d20各组伤口愈合率的平均值如下表所示:愈合(%)d0d2d4d7d9d14d17d20对照0.00%-49.35%-98.14%-60.08%-29.60%57.92%82.41%94.20%dm0.00%-29.50%-86.94%-67.40%-63.80%-7.70%22.58%55.30%dm_he0.00%-31.72%-46.66%-41.09%-23.93%29.85%49.54%94.89%如图14所示,在烫伤后d0-d4,各组烫伤伤口具有不同程度扩大,表现为红肿、水疱和溃疡;d4-d9,伤口逐渐开始愈合,愈合速率较缓;d9后,愈合速率对照组最高,优于dm_he组,dm组最低;后对照组和dm_he组较接近愈合,于d20分别达到94.20%和94.89%。比较各组伤口愈合速率中control和dm两组,证明糖尿病小鼠伤口愈合能力低于健康小鼠;dm_he与dm相比,显示he有促进糖尿病小鼠伤口愈合的功能。观察到he敷料均能有效降低烫伤初期伤口扩大的范围。实施例12,复合敷料对糖尿病足的治疗作用1、材料生物材料和饲料:如实施例11所述。试剂和药品:75%乙醇,异氟烷无水柠檬酸(a100529-0250),柠檬酸三钠二水(a100101-0500),链脲佐菌素(stz,),透明质酸钠(ha,1706221),5%水合氯醛(a600288-0250),复合配方敷料(diabeticwound-healingserum,dws,含15%的实施例1的鸡蛋羊水(ee)、植物提取物和涂敷用辅料,其中植物提取物包括甘草根提取物、油橄榄叶提取物、积雪草提取物和金盏花花提取物)。器械和工具:如实施例11所述。2、方法2.1、糖尿病模型造模如实施例11所述。2.2、烫伤实验根据建模成功率和需实验的敷料种类设置组别(如下表所示),对照组为5只未注射stz的健康小鼠,实验组为stz诱导后符合糖尿病血糖标准的小鼠。所有小鼠生长阶段、饲养条件相同。每只小鼠制造相同面积相同程度的烫伤伤口,采用不同敷料进行实验。正对照组:无糖尿病小鼠,无敷料(对照,1-5)实验组:糖尿病小鼠无敷料(dm,1-8)、糖尿病小鼠涂dws敷料(dm_dws,1-8)、糖尿病小鼠涂透明质酸(0.8%ha-pbs)治疗(dm_ha-pbs,1-6)实验小鼠分组和编号准备干净的笼子,将糖尿病小鼠分别称重后单独放到笼内。小鼠经腹腔注射5%水合氯醛(0.007ml/g),待翻正反射消失后,用小鼠解剖板固定其躯体,用电动剃毛器刮去背部毛发。将温控电焊笔加热至150℃,恒温后稳定接触小鼠背中部皮肤60秒,制造一个圆形烫伤伤口。用体视显微镜于同一放大倍率拍摄伤口照片,并测量烧伤面积,记录数据。烧伤部位应尽量与镜头平行,减小测量误差。将质检合格的敷料用医用棉签涂于对应小鼠伤口上,敷料面积应覆盖伤口。每天早晚涂敷料各一次。饲养盒中用医用棉取代木屑,单独饲养,防止小鼠刮蹭伤口。此后d2、d4、d7、d10、d14、d17、d20检查并测量伤口,记录照片和数据。定期饥饿,监测小鼠空腹血糖水平。观察正常小鼠和糖尿病小鼠伤口愈合的差别,计算并比较dws敷料对伤口愈合速率和效果的影响。3、结果3.1糖尿病模型造模stz诱导后,血糖持续符合造模标准至少10天的小鼠用作烫伤实验。本实验中,造模总数为23,造模后d4、d8、d11(烫伤d0)持续观测空腹血糖,达标的样本数量为22,造模成功率达95.7%。烫伤后d4、d10、d14、d21持续监测空腹血糖,全部符合实验组设置要求。3.2烫伤实验3.2.1存活率实验过程中,尤其在烫伤后,dm各组小鼠均有不同程度状态较差的表现,个别样本死亡,如下表所示。dm_ha-pbs组于d10时样本量仅为2,故后续结果中不再包含。截至烫伤后第20天(d20)的各组存活率如上表所示,对照组存活率最高为100%。与dm组和dm_ha-pbs组相比,dm_dws具有显著较高的存活率,且与实验过程中观察到的样本状态相符,dm_dws状态显著优于dm组。3.2.2伤口愈合率利用下式计算烫伤后d0-d20各组伤口愈合率(ε),d0-d20各组伤口愈合率的平均值如下表所示:d0d2d4d7d10d14d17d20对照0-34.18%-88.52%-39.34%10.05%79.65%96.50%99.90%dm0-61.38%-78.32%-46.86%0.77%21.96%31.25%54.37%dm_dws0-35.00%-69.89%-40.26%-25.09%33.40%65.89%74.48%如图15所示,在烫伤后d0-d4,各组烫伤伤口具有不同程度扩大,表现为红肿、水疱和溃疡;d4-d10,伤口逐渐愈合,愈合速率对照组与dm组、dm_dws组无显著差异;d10后,愈合速率对照组优于dm组和dm_dws组,于d20分别达到99.90%、54.37%和74.48%。综上,结合实验过程中对小鼠状态的观察和各组样本存活率,dws对小鼠烫伤伤口有镇静作用,可在一定程度上缓解烫伤带来的痛苦;比较各组伤口愈合速率中对照和dm两组,证明糖尿病小鼠伤口愈合能力低于健康小鼠;比较dm_dws和dm两组,证明dws有促进糖尿病小鼠伤口愈合的功能。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1