肽及其在调节巨核细胞分化、治疗血小板相关疾病中的应用
本发明属于生物医药领域,涉及调节巨核细胞分化用于治疗血小板减少症和血小板增多症,具体涉及一种肽及其在调节巨核细胞分化、治疗血小板相关疾病中的应用。
背景技术:
血小板是血液循环系统的重要组成部分,在血栓形成、止血、炎症和肿瘤转移中起着重要作用。巨核细胞是造血系统中血小板的祖细胞。造血干细胞来源的原始巨核细胞经过一系列复杂的生物学过程,如有丝分裂、多倍体形成、巨核细胞分界膜系统成熟、致密小管系统成熟和分泌颗粒形成等,形成成熟的巨核细胞。
血小板减少症是一种严重的疾病,会增加患者血管、粘膜和内脏出血的危险。血小板减少症是由巨核细胞产生的血小板受损(再生障碍性贫血)或血小板过度破坏(免疫性血小板减少性紫癜)。骨髓巨核细胞增殖或发育受损是血小板减少症的主要原因,会增加血管、粘膜和内脏出血的风险。同时,原发性血小板增多症、真性红细胞增多症和原发性骨髓纤维化被描述为典型的ph染色体阴性骨髓增生性疾病(mpd),mpd是一种造血祖细胞的克隆性疾病,常伴有巨核细胞发育过度活跃,导致造血系统紊乱,进而引起血小板增多症,血小板增多症患者有较高的动脉和静脉血栓形成和白血病的风险。
血小板生成素(tpo)/mpl/jak2/stat3信号通路是调节巨核细胞发育和血小板形成的主要途径。mpl主要在肝细胞中产生,并被巨核细胞和造血干细胞中的血小板生成素mpl受体识别,导致mpl受体二聚和janus激酶2(jak2)磷酸化;mpl中的tyr626和tyr631又被jak2磷酸化,招募含有src同源结构域(sh2结构域)的信号分子,如信号转导子和转录激活子(stat)家族,导致转录因子stat发生磷酸化,进而进一步地进入细胞核,发挥其转录因子的功能,导致巨核细胞发育相关基因的表达。jak2中的jak同源2(jh2)结构域是一个抑制jak同源1(jh1)结构域激酶活性的自抑制结构域,jh2结构域jak2v617f突变是mpd患者中最常见的突变,苯丙氨酸(f)替换为缬氨酸(v)会导致jh2结构域抑制作用的消失,导致巨核细胞/血小板的jak2/stat3信号的持续激活,并进一步导致骨髓增生性疾病(mpd)、真性红细胞增多症(pv)、原发性血小板增多症(et)、和/或原发性骨髓纤维化(pmf)的发生。
酰基甘油激酶(agk)首先被鉴定为线粒体内膜蛋白,是一种线粒体酰基甘油激酶,它能够分别磷酸化二酰甘油(dag)和单酰甘油(mag)形成pa和lpa。在一些研究中,agk也被认为是tim22复合物的一个亚单位,是一个独立于激酶活性的组成部分,参与线粒体一些内膜蛋白(如载体蛋白)的锚定过程,提示agk具有激酶无关和激酶依赖的线粒体功能。agk基因突变被认为是sengers综合征的主要病因;sengers综合征是一种以心肌肥大、先天性白内障、乳酸性酸中毒和肌无力为特征的严重遗传病;根据报道,部分sengers综合征也会伴随有血小板减少症。然而,agk在血小板生成素中的作用尚不清楚。
技术实现要素:
本发明中,本发明提出巨核细胞/血小板特异性agk缺乏会导致血小板减少和脾肿大。本发明还提出agk参与巨核细胞的发育和血小板的生成并不依赖于其线粒体功能。本发明进一步提出,janus激酶2(jak2)中的jh2结构域的jak2v617f突变能够显著提高agk与jak2的结合水平,并促进血小板生成素tpo引起的巨核细胞/血小板的jak2/stat3信号传导/信号通路的活化。本发明还提出,jak2-jh2结构域肽ygvcfcgdeni(617f)能够显著增强agk与jak2的结合,而含有ygvcfcgdeni(617f)序列的细胞穿膜肽c-617f(细胞通透性肽c-617f)能够显著促进前血小板的形成。本发明的研究揭示了agk在巨核细胞分化和血小板生成中的重要作用,并提示靶向agk与jak2的相互作用可能为血小板减少或血小板增多症的治疗提供一种新的策略。
本发明提出agk在作为预防/缓解/治疗血小板相关疾病的标志物中的应用。
本发明还提出了调节agk和jak2结合的药剂在制备治疗血小板相关疾病的药物中的应用。
本发明中,所述血小板相关疾病包括:血小板减少症、血小板增多症、骨髓增生性疾病、真性红细胞增多症、原发性血小板增多症、原发性骨髓纤维化等。
本发明提出了一种肽或小分子类似物,所述肽的氨基酸序列为ygvcvcgdeni(617v)(seqidno.1)。
本发明还提出了一种肽或小分子类似物,所述肽的氨基酸序列为ygvcfcgdeni(617f)(seqidno.2)。
本发明还提出了一种含ygvcvcgdeni(617v)序列的细胞穿膜肽c-617v或小分子类似物,所述c-617v的氨基酸序列为grkkrrqrrrygvcvcgdeni(seqidno.3)。
本发明还提出了一种含ygvcfcgdeni(617f)序列的细胞穿膜肽c-617f或小分子类似物,所述c-617f的氨基酸序列为grkkrrqrrrygvcfcgdeni(seqidno.4)。
本发明还提出了一种药物组合物,所述药物组合物包含如上所述的肽617v、c-617f或小分子类似物或细胞穿膜肽c-617v、c-617f。
本发明还提出了如上所述的肽或小分子类似物或细胞穿膜肽c-617f或药物组合物在制备促进/加速agk的转录表达,和/或增强/促进agk的功能,和/或增强/促进jak2的功能,和/或增强/促进/加速agk与jak2的结合,和/或增强/促进/加速巨核细胞/血小板中jak2/stat3信号通路/信号转导,和/或增强/促进/加速巨核细胞的分化、发育,和/或增强/促进/加速前血小板的形成,和/或增强/促进/加速血小板的形成,和/或提高骨髓造血效率和避免髓外造血过度,和/或治疗血小板减少症的药物中的应用。
本发明还提出了促进/加速agk的转录表达、和/或增强/促进agk的功能,和/或增强/促进jak2的功能、和/或增强/促进/加速agk与jak2结合、和/或增强/促进/加速巨核细胞/血小板中jak2/stat3信号通路/信号转导的药剂在制备增强/促进/加速巨核细胞的分化、发育,和/或增强/促进/加速前血小板的形成,和/或增强/促进/加速血小板的形成,和/或提高骨髓造血效率和避免髓外造血过度,和/或治疗血小板减少症的药物中的应用。其中,所述药剂还可以包括如上所述肽或小分子类似物或细胞穿膜肽c-617f;其中,所述小分子类似物包括化合物。
本发明还提出了阻断/减弱/抑制agk的转录表达、和/或阻断/减弱/抑制agk的功能、和/或阻断/减弱/抑制jak2的功能、和/或阻断/减弱/抑制agk与jak2结合、和/或阻断/减弱/抑制巨核细胞/血小板中jak2/stat3信号通路/信号转导的药剂在制备阻断/减弱/抑制巨核细胞发育过度活跃,和/或阻断/减弱/抑制巨核细胞分化,阻断/减弱/抑制/减少前血小板的形成,和/或阻断/减弱/抑制/减少血小板的形成,阻断/降低骨髓造血效率,和/或治疗骨髓增生性疾病,和/或治疗血小板增多症的药物中的应用。
本发明还提出了一种治疗血小板减少症的方法,所述方法包括,向有需要的个体中施用如上所述的肽或小分子类似物、或细胞穿膜肽c-617f、或药物组合物、或药剂。
本发明还提出了一种治疗血小板减少症的方法,所述方法包括,向有需要的个体中施用能够促进/加速agk的转录表达,和/或增强/促进agk的功能,和/或增强/促进jak2的功能,增强/促进/加速agk与jak2的结合,和/或增强/促进/加速巨核细胞/血小板中jak2/stat3信号通路/信号转导,和/或增强/促进/加速巨核细胞的分化、发育,和/或增强/促进/加速前血小板的形成,和/或增强/促进/加速血小板的形成,提高骨髓造血效率和避免髓外造血过度,和/或治疗血小板减少症的药物。
本发明还提出了一种治疗血小板增多症的方法,所述方法包括,向有需要的个体中施用能够阻断/减弱/抑制agk的转录表达,和/或阻断/减弱/抑制agk的功能,和/或阻断/减弱/抑制jak2的功能,和/或阻断/减弱/抑制agk与jak2结合,和/或阻断/减弱/抑制巨核细胞/血小板中jak2/stat3信号通路/信号转导的药剂。
本发明的有益效果包括:本发明提出了agk缺乏显著损害血小板生成,进而导致血小板减少症;agk通过调控jak2/stat3信号通路,对巨核细胞分化和血小板形成起重要作用;肽617v、617f通过促进agk和jak2的结合增强jak2/stat3信号转导,从而加速巨核细胞分化;阻断agk和jak2结合能够抑制巨核细胞分化;调节agk和jak2结合可用于治疗血小板减少症和血小板增多症。本发明研究揭示了agk在巨核细胞分化和血小板生成中的重要作用,并提示靶向agk与jak2的相互作用可能为血小板减少或血小板增多症的治疗提供一种新的策略。
附图说明
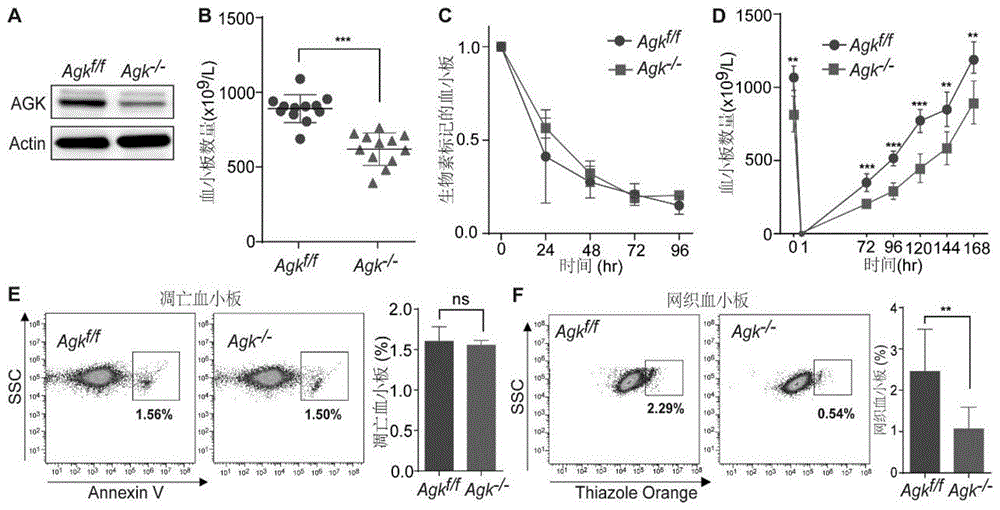
图1所示(a)通过westernblot检测agk-/-小鼠和agkf/f小鼠的血小板中agk的水平。(b)agkf/f和agk-/-小鼠的血小板计数(n=12;***p<0.001)。(c)测定尾静脉注射sulfo-nhs-lc-biotin后血小板存活率(n=3)。(d)血小板通过尾静脉注射anti-cd42b抗体(2μg/g)来清除血小板,然后用hemavet自动监测血液分析仪在不同时间点进行血小板计数(n=6;**p<0.01,***p<0.001)。(e)annexinv染色后,通过流式细胞术检测血小板凋亡(n=3)。ns,统计学差异不显著。(f)流式细胞术用噻唑橙染色法测定网织血小板(n=9;**p<0.01)。
图2所示(a)agkf/f小鼠和agk-/-小鼠股骨和脾脏中cd42c的免疫组化图像以及agkf/f小鼠和agk-/-小鼠的股骨和脾脏的巨核细胞统计(n=13;***p<0.001)。(b)采用流式细胞术检测agkf/f小鼠和agk-/-小鼠骨髓和脾脏标本中cd41+cd42b+巨核细胞。骨髓(n=6;***p<0.001)和脾(n=5;**p<0.01)中cd41+cd42b+巨核细胞的统计。(c)agkf/f小鼠和agk-/-小鼠的脾脏。(d)agkf/f小鼠和agk-/-小鼠生成前血小板的巨核细胞中微管蛋白的免疫荧光图像。生成前血小板的巨核细胞/总巨核细胞的百分比统计数据(n=10;***p<0.001)。(e)agkf/f和agk-/-小鼠胎肝来源巨核细胞多倍体率(n=3;*p<0.05,**p<0.01,***p<0.001)。
图3所示(a)使用agk-flag转染hek293t细胞的免疫荧光图像。hek293t细胞分别用flag抗体(alexafluor488)、4',6-二脒基-2-苯基吲哚(dapi)和线粒体靶向染料(mitotrackerdeepred)染色。(b)使用ha琼脂糖珠或flag琼脂糖珠转染jak2-ha,agk-flag或agk-g126e-flag的hek293t细胞裂解液的共免疫沉淀。(c)抗agk或抗jak2抗体免疫沉淀血小板裂解液后,免疫印迹检测agk与jak2的结合。(d)westernblot检测agkf/f小鼠和agk-/-小鼠血小板对tpo反应的jak2和stat3磷酸化水平。(e)westernblot检测wt小鼠以及agk-g126e位点突变(pm)小鼠血小板对tpo反应的jak2和stat3磷酸化水平。(f)来自agkf/f和agk-/-小鼠胎儿肝脏的未分化或分化巨核细胞的免疫荧光图像。巨核细胞被微管蛋白抗体(alexafluor488)、dapi和stat3抗体(罗丹明)染色。
图4所示(a)使用ha琼脂糖珠或flag琼脂糖珠孵育转染agk-flag和jak2-ha/jak2v617f-ha质粒转染的hek293t细胞裂解液,进行免疫共沉淀。(b)多肽617v和617f序列。(c)用agk-flag和jak2-ha或g126e-flag的质粒转染hek293t细胞,细胞裂解液中加入或不加入617v或617f肽孵育,然后用ha琼脂糖珠或flag琼脂糖珠进行免疫共沉淀,免疫印迹检测agk和jak2相互作用。
图5所示(a)c-617v和c-617f肽的序列。(b)hek293t细胞用四甲基罗丹明(tamra)-labeledc–617f或tamra-labeledc-617v处理后的免疫荧光图像。(c)肽c-617f/c-617v孵育的血小板中stat3和jak2磷酸化水平的免疫印迹分析。(d)肽c-617f孵育的agkf/f或agk-/-小鼠血小板中stat3和jak2磷酸化水平的免疫印迹分析。(e)胎肝来源的巨核细胞用pbs、5μm肽c-617f或10μm肽c-617f处理过后的免疫荧光图。统计pbs、5μm肽c-617f或10μm肽c-617f处理巨核细胞后前血小板生成的巨核细胞与总巨核细胞的比例(n=10,**p<0.005)。(f)肽c-617f介导的巨核细胞中agk和jak2相互作用增强,导致jak2/stat3信号增强的示意图。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附权利要求书为保护范围。
试验方法和材料
1、材料
抗ha琼脂糖珠和ez-link(tm)磺基sulfo-nhs-lc生物素购自pierce(美国伊利诺伊州罗克福德)。apyrase、pge1、抗flagm2琼脂糖珠、抗flagm2单克隆抗体、抗α-微管蛋白单克隆抗体和血浆纤维蛋白原均购自sigmaaldrich(美国密苏里州圣路易斯)。抗agk多克隆抗体来自abcam(美国马萨诸塞州剑桥市)。抗jak2多克隆抗体、抗磷酸化jak2(tyr1007/1008)多克隆抗体、抗磷酸化stat3(tyr705)多克隆抗体购自cellsignalingtechnology(danvers,ma,usa)。抗stat3多克隆抗体购自proteintech(武汉,湖北,中国)。抗cd42c多克隆抗体来自lifespanbiosciences,inc(美国华盛顿州西雅图)。pe结合抗cd41单克隆抗体和apc链霉亲和素购自bdbiosciences(美国加利福尼亚州圣何塞)。抗cd42b单克隆抗体和fitc结合抗cd42b单克隆抗体来自emfret分析(德国würzburg)。抗agk单克隆抗体、抗jak2单克隆抗体和抗ha探针单克隆抗体均购自美国德克萨斯州达拉斯市的santacruzbiotechnology。alexafluor488结合抗鼠igg抗体,rhodamine结合抗兔igg来自jacksonimmunoresearchlaboratories(westgrove,pa,美国)。重组小鼠白细胞介素-3(il-3)来自以色列的prospec(rehovot)。重组人血小板生成素(tpo)购自3sbio公司(辽宁沈阳)。肽617f,617v,c-617f,c-617v由上海吉尔生物化工有限公司合成。
2、小鼠
巨核细胞/血小板特异性agk基因敲除小鼠的建立
从上海南方模式生物科技股份有限公司获得agk-floxed小鼠,将agk-floxed小鼠与pf4(血小板因子4)-cre(pf4-cre)小鼠杂交,获得agkfl/wtpf4-cre+小鼠。进一步交配产生巨核细胞/血小板特异性agk基因敲除小鼠(agkfl/flpf4-cre+,agk-/-)。
用聚合酶链反应(pcr)进行基因分型,westernblotting证实所述agk-/-小鼠血小板agk缺乏。其中,测定agk-floxed小鼠基因型的pcr引物分别为5'-gtgtcaggatggtca-3'(seqidno.5)和5'-atagatggatgggcttaa-3'(seqidno.6)。测定pf4-cre小鼠基因型的pcr引物分别为5'-cccatacagcatactttg-3'(seqidno.7)和5'-tgcacagtcaggtt-3'(seqidno.8)。
3、质粒构建
从hek293t的cdna中扩增带flag标记的人野生型和突变型agk,并克隆到载体pcdna3.1-flag中。从hek293t的cdna中扩增带ha标记的人野生型和突变型jak2,并克隆到慢病毒载体plvx-ires-puro中,得到ha标记的人野生型和突变型jak2两种质粒。
4、血小板清除率测定
向小鼠尾静脉注射sulfo-nhs-lc生物素,在不同时间点采集眼眶血,用apc-streptavidin流式细胞术检测生物素标记血小板,测定内源性血小板清除率。
5、血小板再生率监测
首先由全血计数用hemavet自动血液分析仪测定基础血小板数量。然后将2μg/g(体重)抗cd42b单克隆抗体静脉注射到小鼠体内以清除/消耗血小板。在不同时间点采集眼眶血,测定血小板数量,监测血小板再生率。
6、凋亡血小板和网织血小板的百分率检测
在小鼠的富血小板血浆(prp)中加入annexinv(检测凋亡血小板)以及噻唑橙(检测网织血小板),然后通过流式细胞术检测凋亡血小板以及网织血小板在总血小板中的百分率。
7、巨核细胞分化、前体形成和多倍体检测
(7.1)分离巨核细胞
将怀孕13.5天的孕鼠解剖,取出胚胎,然后再分离出胎肝。取胎肝匀浆,在含10%胎牛血清、1%青霉素/链霉素储备液(10000u/ml)、10ng/mlil-3和70iu/ml重组人血小板生成素(tpo)的dmem中培养5天。用1.5%bsa和3%bsa在37℃梯度分离巨核细胞1h。
(7.2)巨核细胞分化、前体形成检测
血小板前体形成(proplateletformation,ppf)的巨核细胞的测定:在37℃下,将上述(7.1)分离得到的巨核细胞培养在涂有50μg/ml纤维蛋白原的玻片上。培养12h后,用4%多聚甲醛固定巨核细胞,α-微管蛋白染色免疫荧光,通过荧光显微镜观察,统计ppf的巨核细胞的数量。
(7.3)巨核细胞多倍体的测定
对上述(7.1)分离得到的巨核细胞用cd41-apc染色,然后在4℃用70%乙醇固定过夜,然后用50μg/ml溴化乙锭(pi)、100μg/ml核糖核酸酶a和0.2%tritonx-100孵育30分钟。采用流式细胞术,分析巨核细胞多倍体情况。
8、免疫沉淀
取10μg上述第3点构建的质粒,与200μlopti-men和25μllipo2000混匀,室温静置20分钟后,加入hek293t细胞的细胞培养液中,轻轻混匀,然后在37℃,5%co2中培养。48小时后,将转染的hek293t细胞在4℃的细胞裂解缓冲液孵育20分钟,12000g离心15分钟,然后在4℃与抗ha琼脂糖珠或抗flag琼脂糖珠结合过夜。收集琼脂糖珠,于第2天以12000g离心1分钟,冲洗3次。
从野生型小鼠全血中分离出血小板,在4℃裂解缓冲液(50mmtris-hcl,ph7.4;1%np40;150mmnacl;1mmedta;1mmnaf)中孵育20分钟,12000g离心15分钟,分别加入小鼠igg、抗agk和抗jak2抗体。在4℃孵育过夜。proteina/g琼脂糖微球在4℃孵育3h。最后,收集proteina/g琼脂糖微球,在12000g下离心1分钟,冲洗3次。所有样本均通过westernblot进行分析。
9、线粒体呼吸速率的测定
采用seahorsexfe96细胞外流量分析仪测定线粒体呼吸速率。血小板以每孔2×107的密度播种。为了测量耗氧率(ocr),用以下浓度的注入化合物对血小板进行细胞线粒体压力测试试验:2μm寡霉素(oligomycin),0.25μm氟羰基氰化物苯肼(fccp),1μm鱼藤酮(rotenone)和抗霉素a(antimycina)。
10、统计分析
使用graphpadprism6(加利福尼亚州拉荷拉市,美国)进行统计分析。采用studentt检验和单因素方差分析分别测定两组间和多组间的统计学意义。p≤0.05为具有显著统计学意义,p<0.001为具有极其显著统计学意义。
以下实施例中对应的统计数据标记在附图中。
实施例1agk缺乏引起小鼠血小板减少
(1)构建巨核细胞/血小板特异性agk基因敲除小鼠
为了确定agk在巨核细胞分化中的作用,本发明构建了巨核细胞/血小板特异性agk基因敲除小鼠(agkfl/flpf4-cre+,agk-/-)。通过免疫印迹方法证实,agk-/-小鼠血小板中agk蛋白质水平显著降低(图1a),细胞骨架蛋白actin表达相同的水平下,agk-/-小鼠血小板中agk的蛋白质水平显著降低。
(2)小鼠外周血细胞计数
血小板计数结果显示,agk-/-小鼠循环血小板数为619.7±31.44x109个/l,而对照组(agkf/f)小鼠循环血小板数为890.6±27.15x109个/l(图1b),因此agk缺乏导致agk-/-小鼠中血小板数量显著减少(p<0.001)。
(3)测定血小板清除率和再生率
为了确定agk-/-小鼠血小板减少症是由血小板清除率增加还是血小板生成减少引起的,本发明测定了小鼠的血小板清除率和再生率。
通过测定不同时间点生物素标记的血小板的比率,结果显示agk-/-小鼠血小板清除率正常(图1c)。
采用如上“试验方法和材料”第5点所述的方法测定血小板再生率,不同时间点采集的眼眶血的血小板数量,结果如图1d所示,表明agk缺乏显著损害血小板生成,进而导致血小板生成减少。
以上结果说明,agk-/-小鼠血小板减少症是由血小板生成减少引起的,而不是由血小板清除异常而引起的。
(4)凋亡血小板和网织血小板的百分率检测
分别用annexinv和噻唑橙染色检测凋亡血小板和网织血小板的百分率。流式细胞术结果显示,annexinv阳性的凋亡血小板百分比在agk-/-小鼠(1.553%±0.03528%)和agkf/f小鼠(1.600%±0.1058%)之间没有差异(图1e)。但是,与agkf/f小鼠(2.451%±0.3426%)相比,agk-/-小鼠(1.067%±0.1733%)的噻唑橙阳性的网织血小板百分率明显降低(图1f)。
以上结果说明,agk会影响血小板的生成,但对血小板的凋亡没有影响。
综上,实施例1的实验结果表明,agk的缺失会导致血小板生成受阻,从而会导致血小板减少症的发生。
实施例2agk缺乏导致骨髓造血功能低下和髓外造血过度
为确定agk-/-小鼠血小板减少的原因,本发明采用抗cd42c抗体对其骨髓和脾脏巨核细胞进行染色,测定巨核细胞数。
agk-/-小鼠股骨切片巨核细胞数(4.168±0.1265/mm2)比agkf/f小鼠股骨切片(5.136±0.1388/mm2)减少20%。然而,与agkf/f小鼠脾脏切片(0.4286±0.05719/mm2)相比,agk-/-小鼠脾脏切片(1.619±0.1537/mm2)中的巨核细胞增加了4倍(图2a),其中,fm代表股骨,sp代表脾脏。
其次,采用流式细胞仪检测agk-/-小鼠和agkf/f小鼠骨髓细胞和脾细胞中cd41+cd42b+巨核细胞的百分率。agk-/-小鼠骨髓cd41+cd42b+细胞比例为6.102±0.2419%,agkf/f小鼠骨髓cd41+cd42b+细胞比例为10.01±0.7500%,因此,与对照组agkf/f小鼠相比,agk-/-小鼠骨髓中巨核细胞减少近40%。在脾脏中,agk-/-小鼠巨核细胞比例为9.094±0.6412%,而agkf/f巨核细胞比例为6.078±0.3065%(图2b),p值<0.001,。
同时,与agkf/f小鼠相比,agk-/-小鼠出现脾脏肿大(图2c)。
以上这些结果表明,agk-/-小鼠出现血小板减少和脾肿大,而血小板减少和脾肿大主要是由骨髓血小板生成减少和过度的髓外造血引起的。因此,agk缺乏导致agk-/-小鼠骨髓造血效率低下和髓外造血过度。
实施例3agk缺乏显著影响巨核细胞分化
巨核细胞向血小板分化过程复杂,包括有丝分裂、多倍体形成、分界膜系统成熟、致密小管系统成熟和分泌颗粒形成。经过这些过程后,前血小板从巨核细胞表面萌发,并在外周血中进一步变成成熟血小板。
为了进一步确定agk在巨核细胞分化中的作用,本发明从agkf/f和agk-/-小鼠胚胎中分离了胎肝。与il3和tpo共孵育5天后,采用bsa梯度分离法获得巨核细胞。
(1)血小板形成(ppf)实验表明,agk缺乏的agk-/-小鼠的巨核细胞产生的血小板比对照组agkf/f小鼠少(图2d),p<0.001。
(2)有趣的是,agkf/f和agk-/-小鼠巨核细胞在形态学上是不同的。agk-/-小鼠的巨核细胞,其细胞核发生了高度分化,但是其产生的前血小板的结构却遭到了破坏(图2d)。
(3)多倍体检测显示,与agkf/f小鼠巨核细胞相比,agk-/-小鼠巨核细胞在四倍体阶段(4n)停滞的细胞较多,但在高倍性阶段(≥8n)的细胞较少(图2e)。
以上这些结果提示,agk缺乏会影响巨核细胞的发育。
实施例4agk维持jak2/stat3通路激活和巨核细胞分化
为了进一步阐明这一机制,本发明在转染质粒表达agk-flag的hek293t细胞中分析了agk的位置,通过免疫荧光实验,共染flag(alexafluor488)、4',6-二脒基-2-苯基吲哚(dapi)和线粒体靶向染料(mitotrackerdeepred)后,发现agk除了位于线粒体外,还位于细胞质中(图3a)。
已有研究表明,agk能与jak2-jh2结构域结合,并能扩增食管鳞状细胞中jak2/stat3信号通路。jak2/stat3信号通路在髓系细胞的分化和发育中起重要作用。
但是,agk如何调控巨核细胞的发育,对于开发血小板相关疾病的药物至关重要。如,agk是否通过参与jak2/stat3信号通路调控巨核细胞的发育等?
本发明通过进行(一)免疫沉淀法和(二)免疫荧光染色来确定agk调控巨核细胞的发育机制。
(一)免疫沉淀法
方法如上述“试验方法与材料”第8点“免疫沉淀”所述。
免疫沉淀结果:
(1)agk可以与巨核细胞/血小板中的jak2结合,agk也可与hek293t细胞中的jak2结合,并且这样的结合并不依赖于agk的激酶活性(图3b和3c)。
(2)与agkf/f小鼠的血小板相比,在用tpo处理的agk-/-小鼠的血小板中,jak2和stat3的磷酸化水平显著被抑制(图3d),这说明agk确实参与到jak2/stat3信号通路的活化之中。
(3)此外,agkf/f和agk-g126epm小鼠的血小板接收tpo刺激后,jak2和stat3的磷酸化水平没有差异(图3e),这表明agk对jak2/stat3信号的影响并不依赖于agk的激酶活性。
(4)用表达jak2-ha、agk-flag或g126e-flag的质粒转染hek293t细胞,然后用ha琼脂糖珠或flag琼脂糖珠与其细胞裂解液进行免疫沉淀;结果如图4c所示,agk-g126e突变对jak2和agk结合没有影响(图4c),提示agk参与巨核细胞发育和血小板生成并不依赖于其激酶活性。
以上这些结果表明,jak2/stat3信号传导与agk激酶活性无关。
(二)免疫荧光染色结果
如图3f所示,agk-/-小鼠agk缺乏显著抑制未分化和分化的巨核细胞stat3进入细胞核。这些结果提示agk可以维持巨核细胞中jak2/stat3信号,agk的缺失会对巨核细胞的发育造成损害。
综上,实施例4的实验结果表明,agk可以与jak2相互结合,从而维持巨核细胞/血小板中的jak2/stat3信号通路。
实施例5肽ygvcfcgdeni(617f)促进agk与jak2的结合
jak2的激酶活性是由两个羧基末端的同源结构域(jh1和jh2)相互作用调节的。jh1结构域负责受体靶酪氨酸的磷酸化,激活含sh2结构域的下游信号分子,包括stat家族或其他信号分子。jh2结构域被认为是一个假激酶结构域,在生理条件下,可以抑制jh1结构域的功能。已有报道,在大多数mpd患者中发现了jak2-jh2结构域的v617f突变,其特征是真性红细胞增多症、原发性血小板增多症和原发性骨髓纤维化。先前的研究表明,agk与jak2-jh2结构域结合,消除jh2结构域对催化活性jh1结构域的抑制作用,促进了jak2/stat3信号通路的激活。
为确定agk在jak2v617f突变诱导的jak2/stat3信号通路过度激活中的作用,本发明采用agk-flag、jak2-ha或jak2v617f-ha质粒转染的hek293t细胞。免疫沉淀结果表明,jak2v617f显著促进了agk和jak2之间的相互作用(图4a)。
与野生型jh2结构域相比,v617f突变型jh2结构域的晶体结构仅显示出phe594、phe595和phe617在其空间位置上呈现旋转。本发明根据jh2结构域的序列,选取了v617f位点前后各5个氨基酸序列,分别合成了两端11个氨基酸的肽段,即:肽ygvcvcgdeni(617v)和ygvcfcgdeni(617f)。本发明使用这两条肽段(图4b)分别进行免疫沉淀实验,来确定这两条多肽是否会影响agk与jak2的结合,结果如图4c所示,结果表明,肽671f和617v都能增加agk和jak2的相互作用,而肽617f比肽617v能招募更多的agk结合到jak2。
实施例6肽ygvcfcgdeni(617f)促进巨核细胞的发育
为了研究肽617v和617f的生物学功能,本发明进一步合成了n段带有所述两个肽段的细胞穿透肽(cpps)序列(图5a),其中,c-617v为grkkrrqrrrygvcvcgdeni(seqidno.3),c-617f为grkkrrqrrrygvcfcgdeni(seqidno.4)。用四甲基罗丹明标记的肽c-617f或c-671v处理hek293t细胞的免疫荧光图像显示这两种肽能够成功地渗透到细胞中(图5b)。
本发明进一步研究了c-617f和c-617v肽对agkf/f和agk-/-血小板jak2/stat3信号转导的影响。结果显示,肽c-617f和c-617v都增强了血小板中的jak2/stat3信号通路,肽c-617f对jak2/stat3信号通路的促进作用比肽c-617v更强(图5c)。此外,本发明利用肽c-617f孵育agkf/f和agk-/-小鼠的血小板,结果显示,肽c-617f的促进作用主要取决于agk的存在(图5d)。这些结果表明,肽c-617f能够显著促进血小板中jak2/stat3信号转导。
在研究肽c-617f增强agk与jak2结合及jak2/stat3信号通路相互作用的基础上,本发明进一步探讨肽c-617f对血小板生成的影响。具体地说,将胎肝来源的巨核细胞用不同剂量的肽c-617f孵育,经过tpo的诱导分离后,进行前血小板分析实验;结果如图5e所示,与pbs组相比,肽c-617f处理显著地引起巨核细胞的更长和更多分支形态;统计分析显示,肽c-617f显著促进巨核细胞分化为前血小板。这些结果提示肽c-617f能够促进血小板的生成,有望开发为促进血小板生成的新药。
综上,实施例6的实验结果表明,肽ygvcfcgdeni(617f)能够促进巨核细胞的发育为血小板。
结果及分析
本发明的研究表明,agk的缺失会导致巨核细胞发育障碍,并最终导致血小板减少症的发生。而agk-g126e突变抑制agk的酰甘油激酶活性,阻断agk激酶活性,同时对血小板计数和巨核细胞分化没有影响,提示agk参与巨核细胞发育和血小板生成并不依赖于其激酶活性。mpl/jak2/stat3是调节巨核细胞发育的主要信号通路。本发明的研究证实了巨核细胞/血小板中胞浆agk与jak2结合。agk与jak2的结合显著增强了tpo/mpl介导的巨核细胞jak2/stat3活化,从而促进血小板生成。在过去的三十年中,mpd中发现了多个突变等位基因,大多数病例是由jak2,mpl或calr突变驱动的,都可导致jak/stat信号持续激活。jak2v617f是mpd患者中最常见的突变。因此,几种jak2抑制剂已成功应用于mpd或其他疾病的临床治疗。
jak2jh2结构域是一个在生理条件下控制jak2激酶活性的自抑制结构域。jak2v617f突变会消除jh2结构域的抑制作用,导致jak2/stat3信号转导和造血系统的持续激活。在本发明的研究中,本发明提出jak2v617f突变显著增强了jak2与agk的结合,并对巨核细胞/血小板对血小板生成素所触发的jak2/stat3信号转导有很大的促进作用。而agk缺乏则显著抑制tpo诱导的jak2/stat3信号激活。以上结果提示,靶向jak2和agk结合位点,解除两者之间的联系,是抑制jak2活性和治疗mpd的新策略。但是,在开发阻断jak2和agk结合的抑制剂之前,有必要阐明agk与jak2的共晶体结构。
现有治疗血小板减少症的药物主要是重组血小板生成素(tpo)或mpl激动剂。在本发明的研究中,本发明提出模拟jak2v617f突变的肽ygvcfcgdeni(617f)能显著增强agk与jak2的结合,并且极大地促进了血小板生成素tpo引起的巨核细胞/血小板的jak2/stat3信号通路的活化。含ygvcfcgdeni(617f)序列的细胞穿膜肽c-617f能显著增强jak2/stat3信号传导,促进血小板的形成,提示肽c-617f或小分子类似物可作为血小板减少症的一种新的治疗方法。
因此,本发明的研究揭示了agk在巨核细胞分化和血小板生成中的重要作用,并提示靶向agk与jak2的相互作用可能为血小板减少和血小板增多症的治疗提供一种新的策略。
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
<110>上海交通大学医学院
<120>肽及其在调节巨核细胞分化、治疗血小板相关疾病中的应用
<160>8
<170>patentinversion3.3
<210>1
<211>11
<212>prt
<213>人工序列
<400>1
tyrglyvalcysvalcysglyaspgluasnile
1510
<210>2
<211>11
<212>prt
<213>人工序列
<400>2
tyrglyvalcysphecysglyaspgluasnile
1510
<210>3
<211>21
<212>prt
<213>人工序列
<400>3
glyarglyslysargargglnargargargtyrglyvalcysvalcys
151015
glyaspgluasnile
20
<210>4
<211>21
<212>prt
<213>人工序列
<400>4
glyarglyslysargargglnargargargtyrglyvalcysphecys
151015
glyaspgluasnile
20
<210>5
<211>15
<212>dna
<213>人工序列
<400>5
gtgtcaggatggtca15
<210>6
<211>18
<212>dna
<213>人工序列
<400>6
atagatggatgggcttaa18
<210>7
<211>18
<212>dna
<213>人工序列
<400>7
cccatacagcatactttg18
<210>8
<211>14
<212>dna
<213>人工序列
<400>8
tgcacagtcaggtt14
- 还没有人留言评论。精彩留言会获得点赞!