一种多功能纳米药物载体及其制备方法与载药组合物与流程
[0001]
本发明涉及生物医用药物载体与缓释材料技术领域,尤其涉及一种多功能纳米药物载体及其制备方法与载药组合物。
背景技术:
[0002]
药物载体主要是天然或合成的高分子材料,以不同的形式与药物分子通过化学键合、物理吸附或包裹,构成药物控制系统,可在不降低原药物分子药效并抑制其副作用的情况下,通过一系列物理、化学及生物控制,实现药物定时、定位、定量释放,协助增强其疗效。药物载体系统已经被运用于多种给药途径,包括注射、口服、透皮吸收等。药物载体种类较多,纳米药物载体是指粒径在10~1000nm的一类新型载体,由于其粒径比毛细血管通路小,且具有降低药物毒副作用、提高药物稳定性、缓释控释药物和药物靶向释放等优点,近年来,纳米药物载体逐渐引起人们的高度重视。纳米药物载体有聚合物胶束、纳米囊和纳米球、纳米脂质体、固体脂质纳米粒以及磁性纳米颗粒等。多种高分子材料可用于纳米药物载体的研究开发,但生物相容性、生物降解性和安全性等是必须要考虑的重要问题。
[0003]
氨基酸是生物功能大分子蛋白质的基本组成单位,是构成机体营养所需蛋白质的基本物质。采用天冬氨酸、谷氨酸、赖氨酸、丙氨酸、苯丙氨酸等制备的聚氨基酸是一类低毒、生物相容性好、容易被机体吸收和代谢的生物降解高分子,在药物载体领域发展潜力极大。由于氨基酸分子之间的强氢键作用等,其水溶性较差,在体内降解速率和周期难以掌控,且在体内易被免疫系统识别而清除等。
[0004]
因此,现有技术仍有待于改进和发展。
技术实现要素:
[0005]
发明人研究发现,peg(聚乙二醇)具有柔韧的亲水性长链,无毒无免疫原性,fda已经批准用于临床使用,是目前已知亲水载体中最具有发展前途的材料之一。peg与聚氨基酸结合形成嵌段共聚物,能够改善聚氨基酸嵌段的亲水性,减少体内蛋白质在材料表面的吸附和细胞的粘附等。此外,由于peg具有在体内循环时不易被免疫系统识别的优点,可以保护聚氨基酸不受免疫系统的破坏,延长材料在体内的循环时间等。因此,peg的引入可以显著增强聚氨基酸用于纳米药物载体的综合性能。
[0006]
同时,功能化、智能化已是当前纳米药物载体发展的战略性趋势。研究发现,人体必需微量元素硒具有抗氧化、调节免疫、拮抗有害重金属、抗衰老等重要生物功能。硒缺乏与许多人类疾病的发病有关,包括糖尿病、癌症和神经退行性疾病等。人体摄入硒主要有两种方式:无机硒,利用率低,毒性大;有机硒,如硒代氨基酸,生物相容性更好,利用率高,更容易被人体吸收,具有更低的毒性和更高的安全性。故,硒代氨基酸的引入有望积极推动功能化纳米聚氨基酸类药物载体的研究开发。
[0007]
为此,鉴于当前多聚氨基酸类纳米载体主要功能单一,只能作为药物载体等不足,本发明提供了一种多功能纳米药物载体,兼具一般氨基酸类纳米药物载体优势的同时,具
备了硒的多种生物学功能,是一类新型、多功能纳米药物载体。
[0008]
具体地,本发明的技术方案如下:
[0009]
一种多功能纳米药物载体,其中,由式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物自组装而成;
[0010][0011]
其中,22≤n≤454、2≤x≤50、2≤y≤50,其中n、x、y均为整数;
[0012]-r1选自-ch(ch3)ch3、-h、-ch3、-ch2ch(ch3)ch3、-ch(ch3)ch2ch3、-ch2oh、-ch2sh、-ch2ch2sch3、-ch(oh)ch3、
[0013]-r2选自-ch2ch2sech3或-ch2seh。
[0014]
可选地,所述纳米药物载体以纳米球形胶束、纳米棒状胶束或纳米囊泡的形式存在。
[0015]
可选地,将总聚氨基酸的分子量与甲氧基聚乙二醇胺的分子量之比记为p,
[0016]
p≤1/3时,所述纳米药物载体为纳米球形胶束形式的纳米药物载体;
[0017]
1/3≤p≤1/2时,所述纳米药物载体为纳米棒状胶束形式的纳米药物载体;
[0018]
1/2≤p≤1时,所述纳米药物载体为纳米囊泡形式的纳米药物载体。
[0019]
一种本发明所述的多功能纳米药物载体的制备方法,其中,包括以下步骤:
[0020]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于第一有机溶剂中,振荡至混合均匀,得到聚合物溶液;
[0021]
向所述聚合物溶液中加入去离子水,搅拌反应2-3h,得到混合溶液;
[0022]
将得到的混合溶液用装有去离子水的透析袋透析,然后过滤透析袋内液,得到纳米棒状胶束形式的纳米药物载体。
[0023]
一种本发明所述的多功能纳米药物载体的制备方法,其中,包括以下步骤:
[0024]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于第二有机溶剂中,除去第二有机溶剂制成薄膜;
[0025]
然后加入至双蒸水中水化,震荡混匀,超声,离心,冷冻,干燥,得到纳米囊泡形式的纳米药物载体。
[0026]
一种本发明所述的多功能纳米药物载体的制备方法,其中,包括以下步骤:
[0027]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于油相溶液中,得到共聚物油相溶液;
[0028]
用注射器吸取水相溶液至共聚物油相溶液中,并进行超声处理,然后用注射器将超声后的溶液全部吸出后,注入到外水相溶液中,进行搅拌;
[0029]
最后离心、洗涤、冷冻、干燥,得到纳米球状胶束形式的纳米药物载体。
[0030]
一种载药组合物,其中,包括本发明所述的纳米药物载体和包裹于所述纳米药物载体内的药物。
[0031]
可选地,所述药物选自抗ad药物、抗肿瘤药物、甾体类或非甾体抗炎药物、代谢调节类药物、抗生素、心血管药物、抗病毒药物、抗真菌药物、免疫调节剂中的一种或多种。
[0032]
可选地,所述纳米药物载体与药物的质量比为1mg:(0.1~10)mg。
[0033]
有益效果:本发明提供的纳米药物载体由式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物自组装而成,这些纳米药物载体能够负载药物分子制成缓释控释的药物输送系统,可通过各种方式给药,所包载的药物可以根据需要从输送系统中缓释控释的释放,从而降低给药频率、提高治疗效果,并减少药物的毒副作用。与现有技术相比,本发明提供的纳米药物载体兼具一般氨基酸类纳米药物载体优势的同时,具备了硒的多种生物学功能,是一类新型、多功能纳米药物载体。
附图说明
[0034]
图1为本发明所述多聚硒代氨基酸两亲性嵌段共聚物mpeg
45-pbla
2-pmet(se)2的1h nmr谱图。
[0035]
图2为本发明所述多聚硒代氨基酸两亲性嵌段共聚物mpeg
45-pbla
2-pmet(se)2的红外谱图。
[0036]
图3为本发明所述多聚硒代氨基酸纳米球形胶束的tem(透射电镜)图。
[0037]
图4为本发明所述多聚硒代氨基酸纳米棒状胶束的tem(透射电镜)图。
[0038]
图5为本发明所述多聚硒代氨基酸纳米囊泡的tem(透射电镜)图。
具体实施方式
[0039]
本发明提供一种多功能纳米药物载体及其制备方法与载药组合物,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0040]
本发明实施例提供一种多聚硒代氨基酸两亲性嵌段共聚物,具有式(ⅰ)所示结构:
[0041][0042]
其中,22≤n≤454、2≤x≤50、2≤y≤50,其中n、x、y均为整数;
[0043]-r1选自-ch(ch3)ch3、-h、-ch3、-ch2ch(ch3)ch3、-ch(ch3)ch2ch3、-ch2oh、-ch2sh、-ch2ch2sch3、-ch(oh)ch3、
[0044]-r2选自-ch2ch2sech3或-ch2seh。
[0045]
本发明实施例提供的多聚硒代氨基酸两亲性嵌段共聚物具有式(ⅰ)所示结构,其是由含甲氧基聚乙二醇胺亲水链段、离子型聚氨基酸和聚硒代氨基酸疏水链段构成的两亲性三嵌段共聚物。本发明实施例所述多聚硒代氨基酸两亲性嵌段共聚物,能够与同种两亲性嵌段共聚物或不同种两亲性嵌段共聚物进行自组装,如不带电荷的两亲性嵌段共聚物之间,不带电荷的与带电荷的两亲性嵌段共聚物之间,带同种电荷的两亲性嵌段共聚物之间,或带相反电荷的两亲性嵌段共聚物之间等均可以完成自组装;亦能够在不同环境下自组装成不同形式的纳米胶束,如纳米球形胶束、纳米棒状胶束或纳米囊泡等。所述纳米胶束可以用作药物载体负载药物分子制成缓释控释的药物输送系统,可通过各种方式给药,所包载的药物可以根据需要从输送系统中缓释控释的释放,从而降低给药频率、提高治疗效果,并减少药物的毒副作用。与现有技术相比,本发明实施例提供的多聚硒代氨基酸两亲性嵌段共聚物兼具一般氨基酸类优势的同时,具备了硒的多种生物学功能,是一类新型、多功能两亲性嵌段共聚物。
[0046]
具体的,本发明实施例中的含甲氧基聚乙二醇胺用于提供亲水端,形成纳米胶束的外壳,这样可以延长纳米胶束在体内循环时间;聚硒代氨基酸提供疏水端,用于载药,以
提供一种稳定、既具有药物缓释控释功能,同时又具备硒的多种生物学功能的纳米药物载体;离子型聚氨基酸中的活泼离子基团可用于嵌段共聚物之间的交联,以提供一种更稳定,药物缓释控释功能更优的纳米药物载体。
[0047]
本发明实施例提供一种如上所述的多聚硒代氨基酸两亲性嵌段共聚物的制备方法,其中,包括步骤:
[0048]
s10、将甲氧基聚乙二醇胺溶解在有机溶剂中,得到甲氧基聚乙二醇胺溶液;
[0049]
s11、将氨基酸-n-内羧酸酐(nca)溶解在有机溶剂中,得到氨基酸-n-内羧酸酐溶液;
[0050]
s12、将硒代-氨基酸-n-内羧酸酐溶解在有机溶剂中,得到硒代-氨基酸-n-内羧酸酐溶液;
[0051]
s13、将甲氧基聚乙二醇胺溶液和氨基酸-n-内羧酸酐溶液混合,置于惰性气氛(如氮气气氛)下,搅拌反应;
[0052]
s14、反应结束后,加入硒代-氨基酸-n-内羧酸酐溶液,于惰性气氛(如氮气气氛)下继续搅拌反应,得到所述多聚硒代氨基酸两亲性嵌段共聚物。合成反应式如下式所示:
[0053][0054]
本发明实施例中,氨基酸-n-内羧酸酐反应活性较强,在弱的引发剂存在下即可引发氨基酸-n-内羧酸酐发生开环聚合反应,其中具有-nh2的化合物(即甲氧基聚乙二醇胺)作为所述引发剂。
[0055]
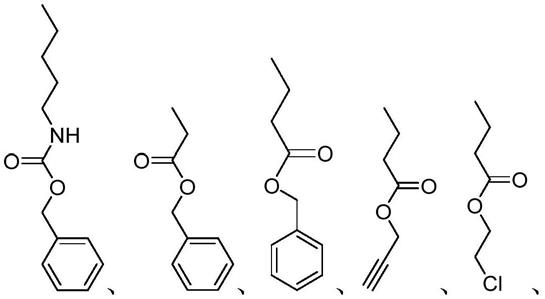
在一种实施方式中,所述氨基酸-n-内羧酸酐为l-缬氨酸-n-内羧酸酐、ε-苄氧羰基-l-赖氨酸-n-内羧酸酐、γ-苯甲基-l-天冬氨酸酯-n-内羧酸酐、γ-苯甲基-l-谷氨酸酯-n-内羧酸酐、γ-丙炔基-l-谷氨酸酯-n-内羧酸酐、γ-2-氯乙基-l-谷氨酸酯-n-内羧酸酐、甘氨酸-n-内羧酸酐、l-丙氨酸-n-内羧酸酐、l-亮氨酸-n-内羧酸酐、l-异亮氨酸-n-内羧酸酐、l-苯丙氨酸-n-内羧酸酐、l-色氨酸-n-内羧酸酐、l-丝氨酸-n-内羧酸酐、l-酪氨酸-n-内羧酸酐、ε-苄氧羰基-l-半胱氨酸-n-内羧酸酐、l-天冬酰胺-n-内羧酸酐、l-谷氨酰胺-n-内羧酸酐、l-苏氨酸-n-内羧酸酐、精氨酸-n-内羧酸酐或组氨酸-n-内羧酸酐等,但不限于此。
[0056]
在一种实施方式中,所述硒代-氨基酸-n-内羧酸酐为硒代-l-蛋氨酸-n-内羧酸酐或硒代-l-半胱氨酸-n-内羧酸酐等,但不限于此。
[0057]
在一种实施方式中,所述甲氧基聚乙二醇胺、氨基酸-n-内羧酸酐和硒代氨基酸-n-内羧酸酐的摩尔比为1:(2~50):(2~50)。其中,疏水链段与亲水链段的分子量之比p(即p为总聚氨基酸的分子量与甲氧基聚乙二醇胺的分子量之比)不同,决定了自组装形成的纳米胶束结构的不同,具体为:p≤1/3时,形成纳米球形胶束;1/3≤p≤1/2时,形成纳米棒状或虫状胶束;1/2≤p≤1时,形成纳米囊泡。
[0058]
在一种实施方式中,按所述氨基酸-n-内羧酸酐和有机溶剂的用量比为(1~5)g:100ml,将氨基酸-n-内羧酸酐溶解在有机溶剂中。
[0059]
在一种实施方式中,按所述甲氧基聚乙二醇胺和有机溶剂的用量比为(1~5)g:
100ml,将甲氧基聚乙二醇胺溶解在有机溶剂中。
[0060]
在一种实施方式中,按所述硒代-氨基酸-n-内羧酸酐和有机溶剂的用量比为(1~5)g:100ml,将硒代-氨基酸-n-内羧酸酐溶解在有机溶剂中。
[0061]
在一种实施方式中,所述有机溶剂包括无水n,n-二甲基甲酰胺、无水四氢呋喃和无水三氯甲烷中的一种或多种等,但不限于此。
[0062]
在一种实施方式中,所述反应的时间为24~72h;所述反应的温度为25~30℃。需说明的是,所述反应指步骤s13中的反应,也指步骤s14中的反应。
[0063]
一种本发明实施例所述的多聚硒代氨基酸两亲性嵌段共聚物在药物载体中的应用。
[0064]
本发明实施例提供一种纳米药物载体,其中,由式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物自组装而成;
[0065][0066]
其中,22≤n≤454、2≤x≤50、2≤y≤50,其中n、x、y均为整数;
[0067]-r1选自-ch(ch3)ch3、-h、-ch3、-ch2ch(ch3)ch3、-ch(ch3)ch2ch3、-ch2oh、-ch2sh、-ch2ch2sch3、-ch(oh)ch3、
[0068]-r2选自-ch2ch2sech3或-ch2seh。
[0069]
本发明实施例提供的纳米药物载体由式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物自组装而成。所述多聚硒代氨基酸两亲性嵌段共聚物,能够与同种两亲性嵌段共聚物或不同种两亲性嵌段共聚物进行自组装,如不带电荷的两亲性嵌段共聚物之间,不带
电荷的与带电荷的两亲性嵌段共聚物之间,带同种电荷的两亲性嵌段共聚物之间,或带相反电荷的两亲性嵌段共聚物之间等均可以完成自组装;亦能够在不同环境下自组装成不同形式的纳米胶束,如纳米球形胶束、纳米棒状胶束或纳米囊泡等。这些纳米药物载体能够负载药物分子制成缓释控释的药物输送系统,可通过各种方式给药,所包载的药物可以根据需要从输送系统中缓释控释的释放,从而降低给药频率、提高治疗效果,并减少药物的毒副作用。与现有技术相比,本发明实施例提供的纳米药物载体兼具一般氨基酸类纳米药物载体优势的同时,具备了硒的多种生物学功能,是一类新型、多功能纳米药物载体。
[0070]
在一种实施方式中,所述纳米药物载体以纳米球状胶束、纳米棒状胶束或纳米囊泡等的形式存在。
[0071]
本发明实施例中,疏水链段与亲水链段的分子量之比p(即p为总聚氨基酸的分子量与甲氧基聚乙二醇胺的分子量之比)不同,决定了自组装形成的纳米药物载体的结构的不同,具体为:p≤1/3时,形成纳米球形胶束;1/3≤p≤1/2时,形成纳米棒状胶束;1/2≤p≤1时,形成纳米囊泡。
[0072]
本发明实施例提供一种如上所述的纳米药物载体的制备方法,其中,包括以下步骤:
[0073]
s20、将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于第一有机溶剂中,振荡至混合均匀,得到聚合物溶液;
[0074]
s21、向所述聚合物溶液中加入去离子水,搅拌反应2-3h,得到混合溶液;
[0075]
s22、将得到的混合溶液用装有去离子水的透析袋透析,然后过滤透析袋内液,得到纳米棒状胶束形式的纳米药物载体。
[0076]
在一种实施方式中,所述第一有机溶剂包括但不限于二甲基亚砜、n,n-二甲基甲酰胺和三氯甲烷等中的一种或多种。
[0077]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物和第一有机溶剂的用量比为10mg:(1~3)ml;所述多聚硒代氨基酸两亲性嵌段共聚物和去离子水的用量比为10mg:(2~5)ml。
[0078]
在一种实施方式中,所述透析袋透析的时间为3~7天,每隔一天换一次水。
[0079]
在一种实施方式中,所述透析袋截留分子量为1000~5000da。
[0080]
本发明实施例提供一种如上所述的纳米药物载体的制备方法,其中,包括以下步骤:
[0081]
s30、将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于第二有机溶剂中,除去有机溶剂制成薄膜;
[0082]
s31、然后加入至双蒸水中水化,震荡混匀,超声,离心,冷冻,干燥,得到纳米囊泡形式的纳米药物载体。
[0083]
在一种实施方式中,所述除去有机溶剂制成薄膜的步骤,具体包括:旋转蒸发制成均匀薄膜,并抽真空除去残留的有机溶剂。
[0084]
在一种实施方式中,所述第二有机溶剂包括但不限于二氯甲烷、四氢呋喃等易挥发溶剂中的一种或多种。
[0085]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物和第二有机溶剂的用量比为10mg:(1~2)ml;多聚硒代氨基酸两亲性嵌段共聚物和双蒸水的用量比为10mg:(2~
5)ml。
[0086]
在一种实施方式中,所述水化温度为50~70℃。
[0087]
在一种实施方式中,所述水化时间为1~2h。
[0088]
在一种实施方式中,所述离心速度为2000~3000r/min,离心时间为25~35min。
[0089]
本发明实施例提供一种如上所述的纳米药物载体的制备方法,其中,包括以下步骤:
[0090]
s40、将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于油相溶液中,得到共聚物油相溶液;
[0091]
s41、用注射器吸取水相溶液至共聚物油相溶液中,并进行超声处理,然后用注射器将超声后的溶液全部吸出后,注入到外水相溶液中,进行搅拌;
[0092]
s42、最后离心、洗涤、冷冻、干燥,得到纳米球状胶束形式的纳米药物载体。
[0093]
在一种实施方式中,所述油相溶液包括但不限于二氯甲烷溶液和四氢呋喃溶液等中的一种或多种。
[0094]
在一种实施方式中,所述水相溶液和外水相溶液均为聚氧乙烯醚、聚氧丙烯醚、聚乙烯醇等乳化剂的水溶液中的一种或多种。
[0095]
在一种实施方式中,所述水相溶液的质量分数为0.1%~0.2%。
[0096]
在一种实施方式中,所述外水相溶液的质量分数为0.25%~0.5%。
[0097]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物和油相溶液的用量比为(1~5)g:100ml。
[0098]
在一种实施方式中,所述超声处理的时间为30秒/次,共两次,间隔30秒。
[0099]
在一种实施方式中,所述搅拌时间为2~4小时;所述搅拌速率为400r/min。
[0100]
本发明实施例提供一种载药组合物,其中,包括本发明实施例所述的纳米药物载体和包裹于所述纳米药物载体内的药物。
[0101]
在一种实施方式中,所述药物选自抗ad药物、抗肿瘤药物、甾体类或非甾体抗炎药物、代谢调节类药物、抗生素、心血管药物、抗病毒药物、抗真菌药物、免疫调节剂等各类药物中的一种或多种,但不限于此。
[0102]
在一种实施方式中,所述纳米药物载体与药物的质量比为1mg:(0.1~10)mg。
[0103]
本发明实施例提供一种如上所述的载药组合物的制备方法,其中,包括以下步骤:
[0104]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物溶解于第一有机溶剂中,振荡至混合均匀,得到聚合物溶液;
[0105]
向所述聚合物溶液中加入药物,并搅拌,然后加入去离子水,搅拌2-3h,得到混合溶液;
[0106]
将得到的混合溶液用装有去离子水的透析袋透析,然后过滤透析袋内液,得到载药组合物。
[0107]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物与药物的质量比为1mg:(0.1~10)mg。
[0108]
本发明实施例提供一种如上所述的载药组合物的制备方法,其中,包括以下步骤:
[0109]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物与药物溶解于第二有机溶剂中,除去第二有机溶剂制成薄膜;
[0110]
然后加入至双蒸水中水化,震荡混匀,超声,离心,冷冻,干燥,得到载药组合物。
[0111]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物与药物的质量比为1mg:(0.1~10)mg。
[0112]
本发明实施例提供一种如上所述的载药组合物的制备方法,其中,包括以下步骤:
[0113]
将式(ⅰ)所示结构的多聚硒代氨基酸两亲性嵌段共聚物与药物溶解于油相溶液中,并用注射器吸取水相溶液至所述油相溶液中,进行超声处理,然用注射器将超声后的溶液全部吸出,注入至外水相溶液中,进行搅拌;
[0114]
最后离心、洗涤、冷冻、干燥,得到载药组合物。
[0115]
在一种实施方式中,所述多聚硒代氨基酸两亲性嵌段共聚物与药物的质量比为1mg:(0.1~10)mg。
[0116]
下面通过具体的实施例对本发明作进一步地说明。
[0117]
本发明设计了三个不同p值的聚乙二醇单甲醚聚天冬氨酸聚硒代蛋氨酸两亲性嵌段共聚物(mpeg
n-pasp
x-pmet(se)
y
)(p=总聚氨基酸的分子量与甲氧基聚乙二醇胺的分子量之比),以制备三种不同自组装形貌的多功能纳米药物载体,具体见实施例1~3。具体合成路线如下:
[0118][0119]
实施例1:
[0120]
聚乙二醇单甲醚聚天冬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pasp2-pmet(se)2)的合成
[0121]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量25mg新制备的l-天冬氨酸苄酯nca(bla-nca)(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量22.3mg新制备的硒代-l-蛋氨酸nca(0.1mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚天冬氨酸苄酯聚硒代蛋氨酸嵌段共聚物mpeg
45-pbla
2-pmet(se)2。再通过碱水解反应除去嵌段共聚物中的苄酯。将嵌段共聚物溶于适量0.5mol/lnaoh溶液中,并搅拌1h,然后将溶液用去离子水透析(mwco:2000),并冻干以获得最终产物mpeg
45-pasp
2-pmet(se)2。对本实施例产物进行核磁共振检测(溶剂为氘代三氟乙酸)和红外吸收检测,检测结果分别见图1和图2。
[0122]
实施例2:
[0123]
聚乙二醇单甲醚聚天冬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pasp
2-pmet(se)4)的合成
[0124]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量25mg新制备的l-天冬氨酸苄酯nca(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量44.6mg新制备的硒代-l-蛋氨酸nca(0.2mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚天冬氨酸苄酯聚硒代蛋氨酸嵌段共聚物mpeg
45-pbla
2-pmet(se)4。再通过碱水解反应除去嵌段共聚物中的苄酯。将嵌段共聚物溶于适量0.5mol/lnaoh溶液中,并搅拌1h,然后将溶液用去离子水透析(mwco:2000),并冻干以获得最终产物mpeg
45-pasp
2-pmet(se)4。
[0125]
实施例3:
[0126]
聚乙二醇单甲醚聚天冬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pasp
2-pmet(se)6)的合成
[0127]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量25mg新制备的l-天冬氨酸苄酯nca(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量66.9g新制备的硒代-l-蛋氨酸nca(0.3mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h得到产物聚乙二醇单甲醚聚天冬氨酸苄酯聚硒代蛋氨酸嵌段共聚物mpeg
45-pbla
2-pmet(se)6。再通过碱水解反应除去嵌段共聚物中的苄酯。将嵌段共聚物溶于适量0.5mol/l naoh溶液中,并搅拌1h,然后将溶液用去离子水透析(mwco:2000),并冻干以获得最终产物mpeg
45-pasp
2-pmet(se)6。
[0128]
本发明还设计了三个不同p值的聚乙二醇单甲醚聚赖氨酸聚硒代蛋氨酸两亲性阳离子三嵌段共聚物(mpeg
n-pll
x-pmet(se)
y
)(p=总聚氨基酸的分子量与甲氧基聚乙二醇胺的分子量之比),以制备三种不同自组装形貌的多功能纳米药物载体,具体见实施例4~6。具体合成路线如下:
[0129][0130]
实施例4:
[0131]
聚乙二醇单甲醚聚赖氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pll
2-pmet(se)2)的合成
[0132]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量31mg新制备的ε-苄氧羰基-l-赖氨酸nca(lys
(z)-nca)(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量22.3mg新制备的硒代-l-蛋氨酸nca(0.1mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚苄氧羰基赖氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pzll
2-pmet(se)2。再通过酸解反应除去嵌段共聚物中的苄氧羰基。将嵌段共聚物溶于适量三氟乙酸中,在冰浴搅拌下加入5倍量的33%hbr/acoh溶液,反应4h后在无水乙醚中沉淀离心得到粗产物。再把粗产物用dmso完全溶解,然后将溶液用去离子水透析(mwco:2000),在去离子水中透析24h后转入到ph 9.0的氨水中透析24h,然后再ph 5.0的hcl溶液中透析24h,最后在去离子水中透析24h,并冻干以获得最终产物mpeg
45-pll
2-pmet(se)2。
[0133]
实施例5:
[0134]
聚乙二醇单甲醚聚赖氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pll
2-pmet(se)4)的合成
[0135]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量31mg新制备的ε-苄氧羰基-l-赖氨酸nca(lys
(z)-nca)(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量44.6mg新制备的硒代-l-蛋氨酸nca(0.2mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚苄氧羰基赖氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pzll
2-pmet(se)4。再通过酸解反应除去嵌段共聚物中的苄氧羰基。将嵌段共聚物溶于适量三氟乙酸中,在冰浴搅拌下加入5倍量的
33%hbr/acoh溶液,反应4h后在无水乙醚中沉淀离心得到粗产物。再把粗产物用dmso完全溶解,然后将溶液用去离子水透析(mwco:2000),在去离子水中透析24h后转入到ph9.0的氨水中透析24h,然后再ph5.0的hcl溶液中透析24h,最后在去离子水中透析24h,并冻干以获得最终产物mpeg
45-pll
2-pmet(se)4。
[0136]
实施例6:
[0137]
聚乙二醇单甲醚聚赖氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pll
2-pmet(se)6)的合成
[0138]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量31mg新制备的ε-苄氧羰基-l-赖氨酸nca(lys
(z)-nca)(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量66.9mg新制备的硒代-l-蛋氨酸nca(0.3mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚苄氧羰基赖氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pzll
2-pmet(se)6。再通过酸解反应除去嵌段共聚物中的苄氧羰基。将嵌段共聚物溶于适量三氟乙酸中,在冰浴搅拌下加入5倍量的33%hbr/acoh溶液,反应4h后在无水乙醚中沉淀离心得到粗产物。再把粗产物用dmso完全溶解,然后将溶液用去离子水透析(mwco:2000),在去离子水中透析24h后转入到ph9.0的氨水中透析24h,然后再ph5.0的hcl溶液中透析24h,最后在去离子水中透析24h,并冻干以获得最终产物mpeg
45-pll
2-pmet(se)6。
[0139]
本发明还设计了一种聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸两亲性三嵌段共聚物(mpeg
n-pv
x-pmet(se)
y
),以制备一种不带电荷的多功能纳米药物载体,具体见实施例7。具体合成路线如下:
[0140][0141]
实施例7:
[0142]
聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pv
2-pmet(se)2)的合成
[0143]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量15mg新制备的l-缬氨酸nca(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量23mg新制备的硒代-l-蛋氨酸nca(0.1mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pv
2-pmet(se)2。
[0144]
实施例8:
[0145]
聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pv
2-pmet(se)4)的合
成
[0146]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量15mg新制备的l-缬氨酸nca(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量46mg新制备的硒代-l-蛋氨酸nca(0.2mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pv
2-pmet(se)2。
[0147]
实施例9:
[0148]
聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物(mpeg
45-pv
2-pmet(se)6)的合成
[0149]
称量0.1g mpeg-nh2(0.05mmol,mn=2000)于真空干燥箱真空干燥4小时,然后溶解在3ml经过干燥处理的dmf中用作大分子引发剂。称量15mg新制备的l-缬氨酸nca(0.1mmol)溶于1ml超干dmf中,然后用注射器将两个反应液混合,置于氮气环境下,搅拌反应24h。反应结束后,称量69mg新制备的硒代-l-蛋氨酸nca(0.3mmol)溶于1ml超干dmf中,加入上述混合反应液中,继续搅拌反应。24小时后,反应结束。将三嵌段聚合物在冰无水异丙醚中沉降、离心、冻干,真空烘箱中干燥24h,得到产物聚乙二醇单甲醚聚缬氨酸聚硒代蛋氨酸嵌段共聚物mpeg
45-pv
2-pmet(se)2。
[0150]
实施例10:
[0151]
纳米球形胶束的制备
[0152]
取20mg mpeg
45-pv
2-pmet(se)2(p=0.28)完全溶解于2ml dmso中,振荡使聚合物混合均匀,得到聚合物溶液;然后向其中逐滴滴加去离子水5ml,搅拌2小时,得到溶液;将得到的溶液直接加入截留分子量为2000da的透析袋中,在2l去离子中室温透析7天,每天换一次水,然后使用水相滤头过滤(孔径450nm)透析袋内液,过滤掉大分子沉淀和聚集的胶束颗粒,得到目的产物mpeg
45-pv
2-pmet(se)2纳米球形胶束。
[0153]
实施例11:
[0154]
纳米棒状胶束的制备
[0155]
取20mg mpeg
45-pv
2-pmet(se)4(p=0.46)完全溶解于2ml二氯甲烷中,在茄形瓶中旋转蒸发制成均匀薄膜,抽真空过夜除去残留的有机溶剂。在茄形瓶中加入5ml双蒸水于60℃水化1h,震荡混匀,水浴下超声即得纳米棒状胶束分散液,3000r/min离心30min,除去大的聚集粒子,清液经冷冻干燥,得到目的产物纳米棒状胶束。
[0156]
实施例12:
[0157]
纳米囊泡的制备
[0158]
量取16ml的0.25%聚乙烯醇的水溶液于50ml烧杯中,搅拌。称量20mg mpeg
45-pv
2-pmet(se)6(p=0.64)溶于4ml的ch2cl2溶液,然后用超声波细胞粉碎机进行两次超声,一次超声工作时间为4s,间歇时间4s,总工作时间30s,两次超声间隔时间为30s。在开始第一次超声时用注射器吸取0.1ml0.1%聚乙烯醇的水溶液注入该溶液中,观察乳化情况。超声完毕,用注射器将溶液全部吸出,缓慢均匀注入质量分数为0.25%聚乙烯醇的水溶液中,室温下搅拌2h。最后经反复洗涤,冷冻、干燥,得到目的产物纳米囊泡。
[0159]
实施例13:
[0160]
阴阳离子复合纳米球形胶束的制备
[0161]
取10mg mpeg
45-pasp
2-pmet(se)2(p=0.30)和10mg mpeg
45-pll
2-pmet(se)2(p=0.30)完全溶解于2ml dmso中,振荡使聚合物混合均匀,得到聚合物溶液;然后向其中逐滴滴加去离子水5ml,搅拌2小时,得到溶液;将得到的溶液直接加入截留分子量为2000da的透析袋中,在2l去离子中室温透析7天,每天换一次水,然后使用水相滤头过滤(孔径450nm)透析袋内液,过滤掉大分子沉淀和聚集的胶束颗粒,得到目的产物纳米球形胶束。用透射电子显微镜观察形成的纳米球形胶束,胶束呈规则圆球状性状,测得粒径约为60nm,结果见图3。
[0162]
实施例14:
[0163]
阴阳离子复合纳米棒状胶束的制备
[0164]
取10mg mpeg
45-pasp
2-pmet(se)4(p=0.47)和10mg mpeg
45-pll
2-pmet(se)4(p=0.49)完全溶解于2ml二氯甲烷中,在茄形瓶中旋转蒸发制成均匀薄膜,抽真空过夜除去残留的有机溶剂。在茄形瓶中加入5ml双蒸水于60℃水化1h,震荡混匀,水浴下超声即得纳米棒状胶束分散液,3000r/min离心30min,除去大的聚集粒子,清液经冷冻干燥,得到目的产物纳米棒状胶束。用透射电子显微镜观察形成的纳米棒状胶束,纳米囊呈棒球状,粒径约为80nm,结果见图4。
[0165]
实施例15:
[0166]
阴阳离子复合纳米囊泡的制备
[0167]
量取16ml的0.25%聚乙烯醇的水溶液于50ml烧杯中,搅拌。称量10mg mpeg
45-pasp
2-pmet(se)6(p=0.65)和10mg mpeg
45-pll
2-pmet(se)6(p=0.67)溶于4ml的ch2cl2溶液,然后用超声波细胞粉碎机进行两次超声,一次超声工作时间为4s,间歇时间4s,总工作时间30s,两次超声间隔时间为30s。在开始第一次超声时用注射器吸取0.1ml0.1%聚乙烯醇的水溶液注入该溶液中,观察乳化情况。超声完毕,用注射器将溶液全部吸出,缓慢均匀注入质量分数为0.25%聚乙烯醇的水溶液中,室温下搅拌2h。最后经反复洗涤,冷冻、干燥,得到目的产物纳米囊泡。用透射电子显微镜观察形成的纳米囊泡,纳米球呈圆球形,测得粒径约为100nm,结果见图5。
[0168]
实施例16:
[0169]
阴阳离子复合型载阿霉素纳米球形胶束的制备
[0170]
取10mg mpeg
45-pasp
2-pmet(se)2(p=0.30)和10mg mpeg
45-pll
2-pmet(se)2(p=0.30)与2.7mg阿霉素分别完全溶解于适量dmso中。振荡前者使聚合物混合均匀,得到聚合物溶液,然后在快速搅拌下缓慢逐滴加入阿霉素溶液,在上述聚合物溶液中加入2.7mg阿霉素,轻微搅拌使两者混合均匀;然后向其中逐滴滴加去离子水5ml,搅拌2小时,得到溶液;将得到的溶液直接加入截留分子量为2000da的透析袋中,在1l去离子中室温透析7天,每天换一次水,然后使用水相滤头过滤(孔径450nm)透析袋内液,过滤掉大分子沉淀和聚集的胶束颗粒,得到目的产物mpeg
45-pasp
2-pmet(se)
2-阿霉素纳米球形胶束。
[0171]
实施例17:
[0172]
阴阳离子复合型载多奈哌齐纳米囊泡的制备
[0173]
量取16ml的质量分数为0.25%的聚乙烯醇的水溶液于50ml烧杯中,搅拌。称量10mg mpeg
45-pasp
2-pmet(se)6(p=0.65)和10mg mpeg
45-pll
2-pmet(se)6(p=0.67)与2.7mg
多奈哌齐完全溶于4ml的ch2cl2溶液,然后用超声波细胞粉碎机进行两次超声,一次超声工作时间为4s,间歇时间4s,总工作时间30s,两次超声间隔时间为30s。在开始第一次超声时用注射器吸取0.1ml0.1%聚乙烯醇的水溶液注入该溶液中,观察乳化情况。超声完毕,用注射器将溶液全部吸出,缓慢均匀注入0.25%聚乙烯醇的水溶液中,室温下搅拌2h。最后经反复洗涤,冷冻、干燥,得到目的产物mpeg
45-pasp
2-pmet(se)
6-多奈哌齐纳米囊泡。
[0174]
实施例18:
[0175]
阴阳离子复合型载药纳米胶束的体外释放试验
[0176]
精确称取4mg实施例12所制备的阴阳离子复合载阿霉素纳米球形胶束放入透析袋(截留分子量为2000da)内,透析袋内加入5ml磷酸盐缓冲溶液(lmol/l,ph 7.4)分散。将透析袋放入三角瓶中,加入20ml pbs(lmol/l,ph7.4)作为释放介质。将三角瓶置于37℃、100r/min的恒温摇床中进行释放实验,每隔1h取样2ml,取样后再补充相同体积的新鲜pbs保证释药外液体积恒定。通过紫外-可见分光光度计测量样品在λ=483nm的紫外吸光度,绘制阿霉素纳米胶束的体外药物释放曲线。按照上述操作绘制阿霉素纯品的体外药物释放标准曲线。由阿霉素纳米胶束体外药物释放曲线可知,mpeg
45-pasp
2-pmet(se)2纳米胶束的载药量约为10.0%,包封率50.5%。且与阿霉素体外药物释放标准曲线对比,发现本发明提供的载药纳米胶束在体外释放过程中未出现突释现象,说明胶束表面吸附的药物比较少,绝大多数的药物被包裹在其内部,证明载药纳米胶束具有较好的控释效果,有利于减少药物的毒副作用。
[0177]
实施例19:
[0178]
纳米药物载体中硒抗氧化功能的检测
[0179]
将乳腺癌mda-mb-231细胞株(以下简称231细胞)用含10%胎牛血清的dmem培养基,置于5%co2、37℃培养箱中培养,1~2d传代一次,取对数生长期的细胞进行实验。取对数生长期的231细胞,以8
×
103/孔细胞接种于96孔板,培养24h后药物处理。实验分为四组:对照组、纳米胶束组、阿霉素组和纳米胶束+阿霉素组,给药剂量为纳米胶束(100μmol/l),阿霉素(2.0μmol/l),每孔加100μl,设6个复孔,对照孔加等量不含药物的dmem培养基。24h后收集各组细胞,加入细胞裂解液冰上裂解,离心收取细胞全蛋白。bca法测定蛋白浓度,再由wst-1法测定细胞总sod活性、tba法测定细胞mda含量,操作步骤严格按照试剂盒要求。通过测定231细胞内sod、mda水平可知,处理后各组与对照组相比细胞sod活力均降低,mda水平均升高(p<0.05);其中纳米胶束联合阿霉素组细胞总sod活力下降、mda水平升高最为显著。由此表明,纳米药物载体具备了硒的抗氧化功能,且纳米药物载体与阿霉素的联合具有相加作用。
[0180]
综上所述,本发明提供的的多聚硒代氨基酸两亲性嵌段共聚物具有式(ⅰ)所示结构,能在不同环境下自组装成不同形式的纳米药物载体(如纳米球状胶束、纳米棒状胶束和纳米囊泡)。该类纳米药物载体可用于多种药物的研究开发,能够负载药物分子制成缓释控释的药物输送系统,可通过各种方式给药,所包载的药物可以根据需要从输送系统中缓释控释的释放,从而降低给药频率、提高治疗效果,并减少药物的毒副作用。与现有技术相比,本发明提供的多功能纳米药物载体兼具一般氨基酸类纳米药物载体优势的同时,具备了硒的多种生物学功能,是一类新型、多功能纳米药物载体。
[0181]
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可
以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1