一种促进软骨形成的透明质酸水凝胶的制备方法和应用
本发明涉及一种透明质酸水凝胶的制备方法和应用,属于软骨修复或形成领域,特别涉及一种促进软骨形成的透明质酸水凝胶的制备方法和应用。
背景技术:
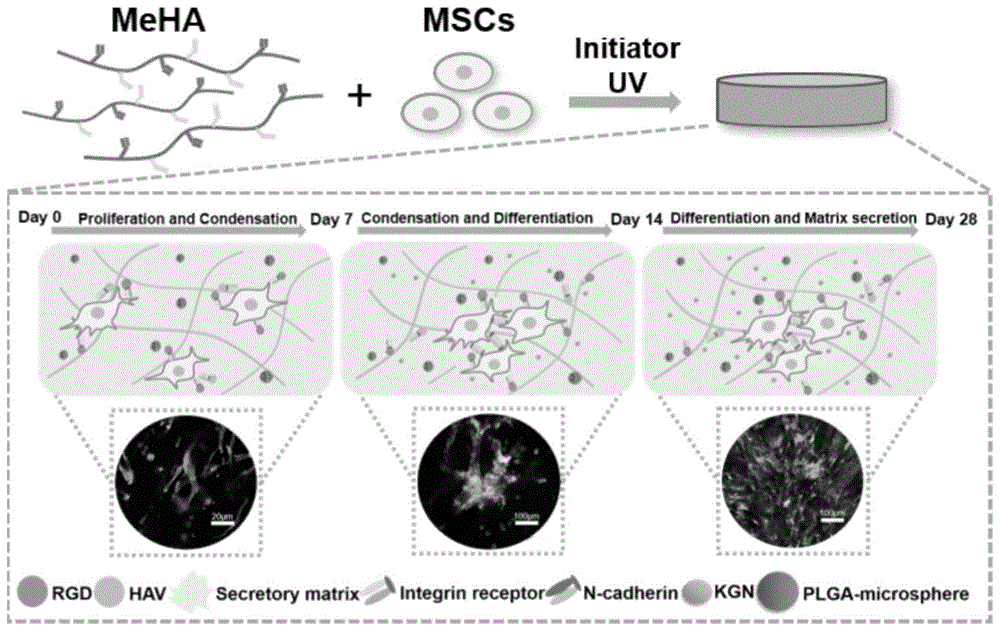
:膝关节软骨、颞下颌关节髁突软骨等软骨组织,是创伤、肿瘤、感染、疾病的易发部位,也是人体组织中不可缺少的组成部分。由于软骨缺乏血管以及低细胞性,其自愈能力非常有限,这使得临床治疗极具挑战性。基于合成水凝胶的组织工程为这些问题提供了一个解决方案。透明质酸(ha)、海藻酸钠、壳聚糖等天然材料被用于制备水凝胶。每一种材料都有其优点和缺点,应该根据具体的研究目标来选择。ha常作为软骨修复和再生的支架材料,是软骨、关节腔滑液和各种组织中的细胞外基质(ecm)的重要组成成分。ha水凝胶基质通过提供三维(3d)环境促进细胞的存活和生长,而天然的ecm通过复杂成分和动态三维结构影响细胞。水凝胶基质中,与新软骨形成相关的细胞行为,包括细胞增殖、聚集、分化和基质沉积等行为仍然受限,尤其是在稳定的共价交联水凝胶中。在软骨形成和基质产生前,间充质干细胞(mscs)表现为增殖、细胞间广泛接触和凝结。为了模拟msc微环境,仿生肽被广泛应用于水凝胶中促进细胞活性。精氨酸-甘氨酸-天冬氨酸(rgd)肽是整合素结合配体,可将细胞与ecm结合并启动细胞相关信号传导事件。已有报道表明,rgd在水凝胶体系中可以促进细胞的扩散和增殖。此外,rgd肽调控细胞信号传导行为的能力与基质的力学性能、交联程度、弛豫应变等密切相关。bian等人发现,交联程度较高的meha促进了干细胞肥大分化和基质钙化。高交联强度与基质钙化也限制了软骨基质的分泌。chaudhari等人发现改变凝胶的力学性能和松弛模量可以影响配体的聚集、细胞的扩散和增殖、成骨分化和ecm沉积。此外,在研究ha凝胶的物理性质对软骨细胞的影响时,发现弹性应力调节了软骨细胞的产生和凋亡。这些结果表明,为了实现间充质向软骨分化的最佳效果,应考虑水凝胶基质强度对细胞的影响。骨髓间充质干细胞的相互作用和凝集是软骨形成所必需的。细胞-细胞相互作用可在粘附过程中触发高神经粘附素(n-cadherin)和神经细胞粘附分子(ncam)表达,从而促进软骨分化。作为一种跨膜蛋白,来自钙粘蛋白的组氨酸-丙氨酸-缬氨酸(hav)序列调节细胞与细胞的相互作用。既往研究表明,将hav多肽接枝到3d电纺丝支架上可促进间充质干细胞的聚集,上调ncam、n-cadherin和软骨相关基因的表达。在以往的研究中,hav肽添加到水凝胶体系中已被证明有助于软骨分化。虽然hav是间充质干细胞软骨分化的良好调节因子,但很少有研究其在3d水凝胶基质中对间充质凝结的作用。为了准确再现软骨再生环境,细胞在水凝胶仿生基质中早期聚集是必要的。hav和rgd多肽对hmscs成软骨分化的调控不能脱离成软骨分化诱导环境。此外,为了更好的在凝胶基质中调控mscs向软骨分化,将促msc软骨分化的因子引入三维基质中必不可少。kgn作为一种小分子有机化合物,在促进软骨细胞增殖和hmscs向软骨分化中具有巨大潜力。与蛋白质生长因子相比,kgn在不同环境下具有良好的物理化学稳定性。但由于kgn的低水溶性和疏水性,无法在meha水凝胶等高亲水性水凝胶体系中有效加载。此外,大量的研究表明,生物信号的释放时机对细胞分化的尤为重要。因此,有必要将kgn包载于其他载体,以达到有效和持续的释放趋势。越来越多的研究开始关注细胞在组织工程支架中的行为。特别是作为一种仿生三维培养系统的功能性水凝胶,其在调节细胞信号和行为方面已成为热门。通过修饰活性基团,将活性信号引入水凝胶体系,改变凝胶的结构等方式,可以调节间充质干细胞的活性。在软骨组织工程领域,很少有研究使用水凝胶支架来模拟成软骨分化的关键步骤,即细胞自发增殖、凝结和分化以及基质沉淀。值得注意的是,这些关键阶段并不是软骨细胞分化过程的独立因素。因此,将这些关键环节纳入水凝胶的功能设计势在必行。技术实现要素:为了克服现有技术的不足,本发明目的是提供一种促进软骨形成的透明质酸水凝胶的制备方法,操作简单,通过控制交联时间筛选得出最优的水凝胶系统,接枝rgd和hav多肽、引入plga-kgn微球,能够调控三维基质中hmscs的细胞行为,依次促进hmscs的增殖、粘附、凝结、成软骨分化。本发明的另一目的是提供如上所述制备方法获得的透明质酸水凝胶产品。本发明的另一目的是提供如上所述透明质酸水凝胶在制备促进软骨形成的药物中的应用。为了达到上述目的,本发明采用以下技术方案:本发明一种促进软骨形成的透明质酸水凝胶的制备方法,包括以下步骤:(1)功能化透明质酸水凝胶的制备:用甲基丙烯酸酯对ha进行改性,得到meha,后与光引发剂反应,交联形成水凝胶;(2)采用迈克尔加成反应,接枝rgd多肽和hav多肽于meha;(3)kgn封装plga微球的制备:将溶解的plga和kgn加入壳聚糖溶液中乳化成球,得到包封kgn的plga微球;(4)将包裹kgn的plga微球引入接枝rgd和hav多肽的meha体系,交联成胶。进一步地,步骤(1)中,所述用甲基丙烯酸酯进行改性包括以下步骤:将1-2重量份的ha溶解在50-100重量份去离子水中,滴入5-20重量份的甲基丙烯酸酐溶液;用氢氧化钠调节反应ph至8-9,在冰浴中反应12-48小时;所得的meha溶液透析3-5天,冻干后,-20℃保存;将1-2重量份meha溶解于50-150重量份含光引发剂的去离子水溶液中,所得meha溶液在紫外光下照射,交联形成水凝胶。更进一步地,所述得到的meha溶液浓度为1wt%-2wt%。更进一步地,所述紫外光为365nm,1w。更进一步地,所述交联时间为30-120s。更进一步地,所述交联时间为60s。进一步地,步骤(2)中,所述接枝rgd多肽和hav多肽于meha包括以下步骤:将1-5重量份的rgd/hav多肽或者2-10重量份rgd+hav多肽和10-100重量份的meha水凝胶溶解在三乙醇胺缓冲液中,调节溶液ph至8-9,37℃在下反应6-48小时,然后透析3-5天,冻干后,-20℃保存。更进一步地,所述三乙醇胺缓冲液浓度为0.2m,ph8.0。更进一步地,所述rgd多肽、hav多肽的肽用量浓度为50-150mol/gha。更进一步地,所述rgd多肽、hav多肽的肽用量为112mol/gha。进一步地,步骤(3)中,所述kgn封装plga微球的制备包括以下步骤:将1-5重量份的plga,在室温下,在10-100重量份的二氯甲烷溶液中溶解1-3小时;1-5重量份的kgn在10-100重量份的丙酮中溶解;将两种溶液混合,慢慢滴入50-200重量份的的壳聚糖溶液中,在10,000-30,000转/分钟,冰浴中高速搅拌5-10秒,搅拌得到乳浊液;将1-5重量份的乳浊液滴入10-50重量份的壳聚糖溶液中,200转/分钟-500转/分钟搅拌6-12小时;10,000-15,000转/分钟,离心20-30分钟,收集包封kgn的plga微球。更进一步地,所述壳聚糖溶液浓度为0.1wt%-0.2wt%。更进一步地,离心后收集plga微球还包括用去离子水洗涤三次,冷冻干燥保存的步骤。进一步地,步骤(4)中,所述将包裹kgn的plga微球引入接枝rgd和hav多肽的meha体系包括以下步骤:将包封kgn的plga微球添加到接枝rgd和hav多肽的meha水凝胶溶液中,通过紫外光交联成胶。本发明提供一种如上所述促进软骨形成的透明质酸水凝胶的制备方法获得的透明质酸水凝胶产品。本发明提供如上所述的透明质酸水凝胶在制备促进软骨形成的药物中的应用。与现有技术相比,本发明具有以下有益效果:(1)本发明提供的透明质酸水凝胶制备方法通过接枝rgd和hav多肽,以及引入plga-kgn微球,可以调控三维基质中hmscs的细胞行为;(2)本发明提供的透明质酸水凝胶系统可以通过模拟新软骨形成过程中的微细胞环境,在凝胶基质中,依次促进hmscs的增殖、粘附、凝结、成软骨分化;(3)本发明提供的透明质酸水凝胶制备方法通过接枝rgd多肽,可以促进hmscs的增殖、上调细胞受体蛋白的表达、增加基质细胞的粘附;(4)本发明提供的透明质酸水凝胶制备方法通过接枝hav多肽,可以在早期调控细胞间的粘附,在长周期新软骨形成过程中可以调节hmscs分泌软骨基质;同时使用hav和rgd多肽可以调控hmscs的细胞行为,导致更明显的软骨分化,且实验结果表明,含有rgd和hav多肽能使细胞凝结现象明显,两种肽同时接枝对细胞的粘附和迁移具有协同作用;(5)本发明提供的透明质酸水凝胶制备方法通过plga微球对kgn进行缓释,kgn的控释确保了凝胶体系中kgn浓度恒定,更能促进软骨形成;且kgn和ecm的协同作用增强了软骨形成;(6)本发明还通过控制不同的交联时间,筛选制备出最优的水凝胶系统,其能使细胞延展良好,增殖活性增强,并能促进细胞的扩散、迁移和聚集。附图说明图1为诱导hmsc软骨形成的k@pm-hr水凝胶示意图;图2为功能化水凝胶的制备与表征;图3为1hnmr测定甲基丙烯酸酐接枝率;图4为水凝胶体积的变化图;图5为具有代表性的图像表示hmscs封装在2d基质和3d基质中;图6为hmscs在二维基质和三维基质中的增殖和活性研究;图7为培养3天后间充质凝集的分析;图8为kgn在多肽改性水凝胶(hr)、pms(pm)和pms与水凝胶(pm-hr)中的释放趋势;图9为meha凝胶包裹hmscs的活/死染色图像;图10为软骨培养14天(图a-i)和28天(图j-r)后的软骨形成评估;图11为评价在裸鼠皮下植入富含hmscs的水凝胶复合物;图12为评价裸鼠皮下植入含hmscs水凝胶后软骨形成效果;图13为不同组别的兔膝关节软骨缺损修复的肉眼观察和micro-ct分析。具体实施方式在本发明中,干细胞首先被rgd调控,以增强与基质间的相互作用;然后具有合适溶胀比和弹性应力的凝胶基质可以促进细胞在凝胶中的增殖和聚集。hav多肽介导的细胞间相互作用可以在基质环境中促进细胞迁移和聚集。rgd和hav多肽能够介导细胞增殖和聚集,更好地调控hmscs的软骨分化,促进基质沉积。在上述研究的基础上,为了更好地模拟软骨形成的微环境,在适当的时间引入促进hmscs成软骨分化的生物活性因子。通过微球包裹kgn使其缓慢释放,我们可以确定其对hmscs软骨形成的影响。这在软骨组织工程中具有一定的应用价值。水凝胶支架作为一种天然的干细胞培养空间,广泛应用于软骨组织工程中。基于多种生物信号的水凝胶可以指导间充质干细胞在新软骨形成过程中的行为。在本研究的第一阶段,我们发现接枝rgd多肽功能化的水凝胶和较低的交联程度可以促hmscs的增殖和上调细胞受体蛋白的表达。此外,接枝rgd和hav多肽在水凝胶支架中可以在早期调控细胞间的粘附。在第二阶段,我们证实与空白对照组和单肽组相比,同时使用hav和rgd多肽可导致更明显的软骨分化。此外,与其他组相比,kgn的控释更能促进细胞软骨形成。有趣的是,随着培养时间的延长,含有rgd和hav肽的组细胞凝结现象明显。在使用rgd肽的所有组中,观察到显著的基质沉积,并伴有糖胺聚糖(gag)和胶原蛋白(coll)的产生。本研究通过体外和体内实验证实,我们的水凝胶系统可以通过模拟新软骨形成过程中的细胞微环境,依次促进hmscs的增殖、粘附、凝结、成软骨分化。本发明涉及的水凝胶简称如下表1。表1水凝胶的简称简称描述hameha水凝胶hha接枝hav多肽的ha水凝胶rha接枝rgd多肽的ha水凝胶hr接枝rgd和hav多肽的ha水凝胶k@hrhr水凝胶内负载kgnk@pm-hrhr水凝胶负载包裹kgn的plga微球现结合附图与具体实施例、效果试验例对本发明作进一步说明。实施例1.功能化透明质酸水凝胶的制备ha(66-90kda;lifecore,chaska,mn,美国)用甲基丙烯酸酯进行改性。简单来说,ha的羟基与过量10倍的甲基丙烯酸酐的反应。将1gha溶解在100ml去离子水中,滴入甲基丙烯酸酐(sigma-aldrich,st.louis,mo,usa)。用5m氢氧化钠调节反应ph至8~9,在冰浴中反应24小时。所得的meha透析3天,冻干,-20℃保存。用质子核磁共振(1hnmr)光谱法测定甲基丙烯酸甲酯(meha)的甲基化程度。将meha溶于irgacure2959水溶液中(0.1%,w/v),得到meha溶液(1%,w/v)。然后用紫外光(365nm,1w)照射不同时间,交联形成水凝胶。用质子核磁共振(1hnmr)技术测定了meha的甲基丙烯酸化程度。2.接枝多肽于mehargd肽(序列gcgyrgdspg)和hav肽(序列ac-havdiggc)购自chinapeptideco.ltd.(中国上海),保证肽的纯度至少为98%。简单地说,将meha和多肽溶解在0.2m三乙醇胺(teoa)缓冲液(ph8.0)中,在37℃下反应过夜,然后透析3天,冷冻和冻干。rgd或hav肽用量为112mol/gha。偶联肽反应消耗的甲基丙烯酸酯基团不超过20%。3.kgn封装plga微球(kgn@pm)的制备采用单油包水乳液/溶剂蒸发法制备plga微球。首先,45mgplga(actide/glycolide,50:50)在室温下,在4.5ml二氯甲烷溶液中溶解3小时,5mgkgn(selleck,usa)在0.5ml丙酮中溶解。将两种溶液混合,慢慢滴入0.1%50ml的壳聚糖溶液中,用手动高速匀浆器(th;omni,omni国际,马里埃塔,佐治亚州,美国),30,000rpm,在冰浴搅拌。最后,将乳液滴入0.1%150ml壳聚糖溶液中,每分钟400转,过夜。使用超快离心机(12,000rpm,30分钟)收集plga微球。离心后用去离子水洗涤三次,冷冻干燥保存。4.k@hr、k@pm-hr的制备k@hr制备:将一定浓度的kgn稀释到hr水凝胶中,通过紫外光交联,得到k@hr水凝胶。k@pm-hr制备:将k@pm添加到hr水凝胶溶液中,通过紫外光(365nm,1-5w)交联成胶,得到包封k@pm的hr水凝胶(k@pm-hr)。通过以下效果试验例验证本发明复合水凝胶性能。1.功能化透明质酸水凝胶的表征为了测量弹性模量,对不同交联程度的水凝胶进行压缩模量试验(1mm/min)(electroforce3100;bose,弗雷明汉,美国麻州)。测定溶胀比时,将不同交联程度的水凝胶浸泡在磷酸盐缓冲盐水(pbs)中,在37℃震荡培养箱中充分膨胀24h,称重确定溶胀比。水凝胶经过液氮冷冻和冷冻干燥后,采用扫描电镜(sem)(s-4800,日立,东京,日本)观察了不同交联程度的水凝胶的三维多孔结构。2.kgn的释放率包封kgn的hr,pm和pm-hr水凝胶分别置于pbs溶液中,37℃震荡培养箱,转速100rpm。离心收集溶液,采用高效液相色谱法测定kgn含量。注射体积设定为10千兆元。样品分析采用反相柱(4.6×100mm,3.5×m),流动相由乙腈/水(v/v,40/60)的0.1%甲酸溶液制备。cpt吸光度在275nm处检测,流速设为1ml/min(37℃)。3.体外细胞活性的评价3.1.细胞培养hmscs从人类骨髓中提取,购自sciencell研究实验室(产品目录号:7500,美国加州卡尔斯巴德)。hmscs于高糖eagle’s培养基(dmem);(含10%胎牛血清(胎牛血清,gibco)和1%(v/v)青霉素/链霉素(gibco)),并扩大到第4-5代使用。3.2.基于凝胶的2d和3d细胞培养对于二维细胞培养,首先在24孔板底部形成水凝胶。将消化后的细胞以2×104个细胞/孔的密度置于各种水凝胶表面。每孔加入1.5ml培养基培养细胞,每隔一天换液1次。研究以水凝胶为基础的三维培养时,将消化的细胞离心,之后吸除上清后使用。用凝胶溶液重悬细胞(最终达到1×106个细胞/500μl)。细胞凝胶溶液(400μl/孔)在超低附着24孔板底部形成水凝胶。每孔加入1.5ml培养基,每隔一天换液1次。3.3.hmscs在凝胶2d和3d培养中的增殖和活/死分析用细胞计数kit-8法(cck-8,dojindo,日本)检测hmscs在凝胶2d和3d培养中的增殖情况。简单地说,在体外培养1、3、7d时,将cck-8试剂加入24孔板中。孵育液在37℃5%co2加湿培养箱中孵育3小时后转移到新的96孔板上。应用酶标仪(spectramaxm5)在450nm处测定光密度(od)。活/死法检测凝胶对细胞的生物毒性,首先细胞-凝胶复合体用pbs洗涤三次,加入活/死染色液(日本,道津岛),在37℃,5%co2湿化培养箱中孵育15min。染色后的样品立即用共聚焦激光扫描显微镜(clsm)观察。3.4.细胞骨架形态细胞骨架形态学观察二维和三维细胞培养。样品在4%(w/v)多聚甲醛中固定(美国hyclone,洛根,ut)30分钟,之后用pbs洗了三次,然后用0.1%(v/v)tritonx-100(sigma-aldrich)透明15分钟。之后,再用pbs清洗三次,然后用在5mg/mlfitc(sigma-aldrich)中孵育30分钟。最后在10mg/ml的dapi溶液(sigma-aldrich)孵育10分钟。染色后的样品立即在clsm下观察。4.hmscs在体外软骨分化的评价研究hmscs在凝胶三维环境下的软骨分化,在软骨诱导培养基培养样本,此培养基中包含了低糖dmem,1%青霉素和链霉素,100μg/ml丙酮酸钠,40μg/mll-proline,50μg/mll-ascorbic1%insulin-transferrin-selenium,100nm地塞米松,10ng/mltgf-β3。所有组的软骨培养基每隔一天更换一次。5.体内hmscs软骨分化的评价5.1.在裸鼠皮下植入含有hmscs的水凝胶装载hmsc的水凝胶植入雄性裸鼠(6-8周)皮下,研究其体内成软骨分化的效果。将装载hmscs的水凝胶(1000万个细胞/ml)直接植入每只裸鼠背部左右两侧的皮下口袋中。样品在4周和8周后采集。本实验使用的动物程序均经北京大学动物保护与使用委员会批准。5.2.组织学分析裸鼠第28天和56天术后,实施安乐死,摘取标本,用福尔马林溶液固定过夜。经过梯度乙醇脱水,石蜡包埋,切成7μm厚的切片。切片进行脱蜡和复水处理,然后按进行苏木精和伊红(h&e)染色。染色的样品在倒置光学显微镜下观察(奥林巴斯,东京,日本)。6.胶原蛋白和gag含量及rna分析为了确定水凝胶中的gag含量,细胞凝胶首先经过冻干并称重(来自裸鼠的样品直接称重后研磨)。然后,用玻璃研磨管,添加1ml木瓜蛋白酶裂解液后研磨样品。然后将上述产物在60℃下孵育24小时后进行后续测试。使用二甲亚甲基蓝染料(sigma-aldrich)评估gag含量。为测定水凝胶中的胶原蛋白含量,将组织或细胞凝胶用6mol/l盐酸水解液研磨,在沸水浴中消化3-6小时,然后15,000rpm离心。收集上清液,调整ph至6-8。胶原蛋白使用羟脯氨酸(hyp)检测试剂盒(solarbio,中国,北京)进行定量。(羟脯氨酸占胶原蛋白总含量的13.4%)。为了分析细胞-凝胶结构中的rna,细胞-凝胶用pbs洗涤三次,然后用1mltrizol(invitrogen公司,卡尔斯巴德,美国加州)在玻璃研磨管中研磨。之后,使用“cdna合成及逆转录试剂盒”(thermo,usa)将细胞凝胶的rna逆向转录为cdna。采用sybrgreen(roche,indianapolis,in,usa)和abi7500rt-pcr仪(appliedbiosystems,fostercity,usa)进行实时聚合酶链反应(rt-pcr)。本文的rna序列列于表2。28sr作为内参基因进行pcr扩增。ct(2-δδct)方法应用于评价相对rna表达。表2rna序列7.免疫荧光分析体外培养14或28天后,细胞凝胶用多聚甲醛(4%,w/v)固定30min,pbs洗涤3次。tritonx-100在室温下渗透15min(0.1%,v/v)(分析体内样品时,石蜡切片应脱蜡,再水化,并在免疫荧光染色前行抗原修复)。pbs洗涤三次后,在室温下用3%(w/v)牛血清白蛋白溶液(sigma-aldrich)孵育2小时。将一抗(整合素抗体(ab183666)[1:200,abcam,uk],n-cadherin抗体(ab98952)[1:200,abcam],ncam1抗体(ab133345)[1:100,abcam],aggrecan抗体(ab3778)[acan,1:50,abcam],collii抗体(ab34712)[colii,1:200,abcam])在4℃孵育过夜。pbs洗涤三次后,使用二抗在室温黑暗孵育2小时。最后,在室温下用dapi孵育10min。染色后的样品立即用clsm观察。免疫荧光染色定量分析采用imagej软件(nih,bethesda,usa)。8.兔膝关节缺损植入水凝胶及细胞-凝胶复合体新西兰大白兔(4月龄,2.5±0.3kg)双侧膝关节内侧切口入路,贴髌骨内侧缘作长约3cm的弧形纵切口,逐层切开,从股四头肌肌腱向远端,在髌韧带内缘延至胫骨结节内下缘,打开关节腔,造成髌骨外侧脱位,暴露股骨髁间窝部,用种植机环钻在髁间窝钻孔,造成直径4mm,深度约3mm骨-软骨复合缺损。将单纯水凝胶和负载兔骨髓间充质干细胞(rmscs)的水凝胶分别植入缺损处,喂养兔子一个月后取材。通过肉眼直接观察和micro-ct分析实验标本。9.统计分析采用spss24.0统计学软件进行分析,组间比较采用方差分析,两两比较采用lsd检验,检验水准α=0.05。试验结果如下:1.功能化水凝胶的制备与表征本发明使用水凝胶支架来模拟成软骨分化的关键步骤,即细胞自发增殖、凝结和分化以及基质沉淀。同样值得注意的是,这些关键阶段并不是软骨细胞分化过程的独立因素。细胞凝聚通常发生在大量细胞扩增后,是细胞分化过程中不可缺少的环节(图1)。功能化的meha包裹hmscs后,在紫外光交联下成胶,凝胶中的多重生物成分发挥着对mscs增殖、凝集、分化和基质沉积的调控作用。功能化水凝胶的制备与表征图2中,图2a为甲基丙烯酸酯改性ha和多肽接枝到meha;图2b为接枝和未接枝多肽水凝胶的弹性模量;图2c为接枝多肽和未接枝多肽水凝胶的溶胀率;图2d为不同交联时间的代表性sem图像。水凝胶体积的变化图图4中,图4a为充分溶胀后,meha水凝体积变化的大体视图;图4b为软骨缺损修复过程中水凝胶体积变化的示意图。在本研究初始阶段,ha与过量的甲基丙烯酸酐反应生成双键(图2a),以保证接枝肽的质量和凝胶的稳定性。通过1nmr分析,我们确认了ha的“双键结合率”,即甲基丙烯酸酐后双键的接枝率约为43%(图3)。高接枝率的双键可以保证接枝足够量的多肽以及保证交联成胶的稳定性。溶胀和弹性应力试验表明,接枝多肽对meha的溶胀和弹性应变无明显影响(图2b和c,数据以均数±标准差表示;n=3,*p<0.05,n.s.p>0.05)。交联时间对凝胶特性的影响表明,随着交联时间的延长,凝胶基质的弹性模量增大(图2b)。30s交联组的机械强度最低,溶胀比最高,充分溶胀后有显著的体积变化(图2b和c,图4a和b)。当交联时间60,90或120s时,肿胀比率较低,体积相对稳定。适当的体积变化可能对软骨缺损的修复和再生很重要。软骨缺损形成水凝胶后,高溶胀率会引起凝胶体积的明显变化。相反,高交联强度和低肿胀率维持了肿胀前后的凝胶体积,有助于软骨缺损的闭合。因此,我们假定交联60s以上有助于凝胶体积的稳定性和临床应用。sem图像显示,90s组交联的冻干凝胶的孔隙比30s和60s组的孔隙要小(图2d,标尺=100μm)。制备的冻干水凝胶中孔隙大小均在微米级。然而,冻干水凝胶很难反映水化状态下的实际凝胶孔隙结构和大小。值得注意的是,交联程度越低,水凝胶的孔径越大,而空隙较大的水凝胶往往与促进细胞分化、增殖、聚集以及基质分泌密切相关。2.负载于水凝胶表面和包封于水凝胶中的hmscs的扩散和增殖通过对不同交联程度凝胶的弹性模量和溶胀率的研究表明,具有合适交联强度(60s、90s和120s)的水凝胶值得进一步研究。此外,我们研究了交联强度对细胞存活率的影响。将不同交联程度的meha水凝胶包裹的hmscs体外培养7天,活/色染色未发现死亡细胞(图9)。具有代表性的图像表示hmscs封装在2d基质和3d基质的图5中,图5a为培养3天后,不同交联时间下hmscs在ha表面的形态(f-actin);图5b为培养3天后,不同交联时间的hmscs在rha表面的形态;图5c为培养3天后,不同交联时间的3dha基质中hmscs的形态和整合素表达情况;图5d为培养3天后,不同交联次时间的3drha基质中hmscs的形态和整合素表达情况;图5e为培养7天后,3dha基质中不同交联时间下hmscs的形态和整合素表达情况;图5f为培养7天后,3drha基质中不同交联时间下hmscs形态和整合素(integrinsirt1)表达情况。hmscs在二维基质和三维基质中的增殖和活性研究图6中,图a、b为不同交联时间hmscs在ha和rha表面的增殖;图c、d为不同交联时间hmscs在3dha和rha基质中的增殖;图e、f为荧光强度分析整合素在ha或rha组中的表达;图g为绘制细胞-基质相互作用的原理图。通过研究rgd多肽是否对不同交联程度的凝胶中的细胞有不同的作用。在2d水平上,与ha组相比,rha组细胞在水凝胶表面培养3天后增强了细胞的粘附、扩散和增殖。在ha或rha组中,不同交联水凝胶表面上的细胞状态表现相似(图5a和b,图6a和b)。在3d的情况下,ha组的细胞表现为孤立状态,细胞表现为球形结构,并且无细胞间接触。(图5c和e)。其中,各ha组细胞增殖幅度均低于rha组(图6c、d)。另一方面,不同交联程度的rha组细胞表现出不同的形态和活性(图5d、f、6d)。交联30s和60s后,细胞延展良好,增殖活性增强(图5d、f、6d)。同时,细胞在培养第3天开始扩散和迁移(图5d),第7天出现明显聚集(图5f,箭头:细胞聚集)。较长的交联时间(90s和120s)限制了细胞的扩散、迁移和增殖(图5d和f,图6d),导致细胞形态接近球形(图5d),与ha组细胞相似。细胞培养3天后,与ha组相比,rha组整合素受体表达上调。此外,随着rgd多肽的参与,整合素受体在低交联组中表达更明显(图5d、图6e和f)。rgd多肽可以增加基质细胞的粘附,这模仿自然矩阵和细胞之间的关系。重要的是,整合素的高表达预示着细胞增殖分化的开始。当细胞被包裹在材料内部时,它们倾向于增殖、迁移和聚集。ecm配体指导细胞的这些行为,但高交联度会产生一种稳定的基质与细胞结合,从而抑制这种行为(图6g)。细胞与凝胶基质的动态相互作用有利于细胞分化。本实验中,交联强度较低的rha基团形成了软基质;因此,凝胶基质通过细胞运动诱导重塑过程。(图6中,数据以均数±标准差表示;n=3.*<0.05,**<0.01,***<0.001。)值得注意的是,在培养7天后,各组整合素受体的表达均显著下降(图5e和f)。这可能是由于整合素受体消耗rgd肽,并伴随着rgd和整合素的降解。因此,不难发现,越低的交联时间对细胞增殖活性和整合素受体表达的上调都起着积极作用,通过对凝胶理学特性和生物学特性的评价和筛选得出,交联60s组别可以应用于之后的体外和体内研究。3.接枝肽影响细胞凝聚为了验证移植的hav对干细胞聚集的调节作用,以及研究两种多肽(rgd和hav)对细胞行为的影响,我们评估了与软骨粘连相关(ncam1和n-cadherin)和迁移(fak)相关标志物的表达水平。培养3天后间充质凝集的分析图7中,图a为细胞骨架(f-actin)、ncam1和n-cadherin的免疫荧光染色;图b为培养3天后fak、ncam1、n-cadherin的表达。培养3天后,免疫荧光染色清晰显示,hav组早期未有细胞聚集现象(图7a,黄色箭头:细胞聚集),hr组中ncam1和n-cadherin表达最高(图7a)。在rha和hr组中,细胞在局部聚集(图7a)。既往研究表明,在hav的影响下,meha凝胶基质并不促进间充质干细胞的聚集,尤其是在早期培养中。这也说明需要合适的水凝胶基质微环境才能发挥基质对间充质干细胞的调控作用。在基因表达方面,与空白对照组和rha组相比,单独接枝rgd并不能促进fak和ncam1的显著早期表达,而移植hav肽能促进n-cadherin的明显上调(图7b,数据以均数±标准差表示;n=3.*<0.05,**<0.01)。n-cadherin的高表达与msc的活跃聚集有关,这被认为是软骨细胞形成的先决条件。值得注意的是,与其他组相比,hr组中fak、ncam1和n-cadherin的表达最明显(图7b)。这些黏附相关基因的上调也表明了软骨分化。两种肽同时接枝对细胞粘附和迁移有协同作用,但潜在的机制尚不清楚。rgd可能促进细胞增殖和迁移,细胞运动介导的细胞-细胞相互作用上调了与细胞间黏着相关的蛋白和基因。4.kgn释放为了确保水凝胶中的hmscs表现出与天然ecm中类似的软骨细胞分化,从而适用于体内应用,凝胶中需要包载稳定有效的诱导因子。但由于kgn的低水溶性和疏水性,无法在meha水凝胶等高亲水性水凝胶体系中有效加载。微球首先分散在水凝胶溶液内部,均匀混合后,通过紫外成胶后,均匀分布在水凝胶内部。kgn在多肽改性水凝胶(hr)、pms(pm)和pms与水凝胶(pm-hr)中的释放趋势图8中,图a为kgn封装pms的sem图像;图b为kgn在多肽改性水凝胶、pms及pms-hr中的释放动力学。在不同介质中的释放行为(图8b)中,hr组在前7天内释放约释放总量的80%。此外,越来越多的报道显示了生物信号时机对细胞分化的重要性。为了模拟软骨再生所需的微环境,促进软骨分化的信号应以有效和持续的方式释放。与hr组相比,经pms包覆的kgn释放延迟(图8a,标尺=2μm,和图8b)。如预期的那样,包覆凝胶的k@pm释放速率最低,这确保了凝胶体系中kgn浓度恒定。5.水凝胶包裹hmscs的软骨形成和分泌软骨培养14天和28天后的软骨形成评估图10中,图a、j为不同组软骨相关蛋白的免疫荧光染色(黄色箭头:细胞聚集;红色箭头:细胞核);图b-e、k-n为在不同组别中软骨相关基因的表达;图f、g和o、p为分析acan和collⅱ在不同组别中的荧光强度;图h、i和q、r为在不同组别中胶原和gag分泌量。免疫荧光染色显示,细胞核数量间接反映了体外培养14天后的细胞数量(图10a,dapi染色)。在rha、hr、k@hr和k@pm-hr组中,与第7天对比(图5),在第14天时,细胞数量随时间显著增加,聚集现象更加明显(图5f)。同时,成软骨相关蛋白质在rgd和hav多肽参与的组中明显表达(图10a、f和g)。值得注意的是,软骨相关的collⅱ和acan在kgn组中表达明显,表明kgn促进了hmscs的软骨向分化(图10a、f和g)。在rgd参与下,细胞collⅹ表达明显(图10d)。而collⅹ高表达提示细胞肥大化,且不利于软骨形成和软骨修复。hr、k@hr和k@pm-hr组肥大基因的上调可能与水凝胶基质中rgd肽相关。之前的研究也表明,rgd加入到水凝胶基质中可以上调msc的肥大相关基因。在k@hr、k@pm-hr组,collⅱ和sox-9表达显著。同时,在k@pm-hr组中,sox-9表达水平最高。经过14天的培养,以上结果证实了我们的水凝胶体系能够持续促进hmscs向软骨细胞的增殖、聚集和发育。免疫荧光染色显示体外培养28天后细胞数量较14天后明显增加,rha组、hr组、k@hr组和k@pm-hr组细胞数量明显增加。此外,细胞聚合更明显和更广泛(图10j)。collⅱ在所有组内都表达明显(图10j,o和p)。随后,伴随着广泛的细胞间接触,软骨相关蛋白在k@hr和k@pm-hr组明显高于ha、hr和rha组(图10j,o和p)。hmsc软骨形成取决于细胞间接触的程度,与相邻细胞数呈线性相关。collⅱ型的表达在k@pm-hr组最高(图10p)。基因表达方面,与k@hr组和k@pm-hr组对比,kgn的持续释放对软骨相关基因的上调影响最为显著,提示这种释放方式有利于新软骨的形成(图10k-n)。k@hr和k@pm-hr组的成软骨细胞相关蛋白和基因明显上调,反映了kgn和ecm的协同作用增强了软骨形成,这与之前的研究报道的结果一致。软骨基质的主要成分,如gag和胶原,维持基质内细胞的表型并支撑软骨组织。相对于3d多孔支架,关于hmscs在水凝胶支架中分泌的研究较少,尤其针对共价交联水凝胶。在这项研究中,经过14天的软骨诱导,gag和总胶原蛋白的分泌在rha,hr,k@hrk@pm-hr组明显高于hha组和ha组(图10h和i)。胶原蛋白的分泌在k@hr和k@pm-hr组最高。另一方面,软骨诱导28天后(图10q和r),rha、hr、k@hr和k@pm-hr组的gag和胶原分泌量明显高于hha和ha组。k@pm-hr组的gag分泌明显高于rha、hr和k@hr组。这些结果表明,在多肽和缓释释放kgn的调控下,mscs在水凝胶中分泌了与软骨形成相关的基质成分。(图10中,数据以均数±标准差表示;n=3.*<0.05,**<0.01,***<0.001。)通过本研究的数据,可以看到kgn-plga+rgd+hav的水凝胶中,多肽和凝胶基质可以调控细胞行为,相比较于kgn-plga-meha,在rgd+hav的加入下,能够更好的调控hmscs的细胞活性和软骨向分化,并且促进软骨基质沉积。6.在体内评价水凝胶包裹hmscs的软骨形成和分泌评价在裸鼠皮下植入富含hmscs的水凝胶复合物图11中,图a为皮下植入56天后标本的大体观察;图b为含hmscs水凝胶在皮下植入28和56天后的h&e染色。为了进一步研究我们的水凝胶体系是否在体内促进了干细胞活性和软骨分化,我们将不同凝胶包裹的高密度细胞皮下植入裸鼠体内(图11a,标尺=5mm)。植入后56天,hr、k@hr和k@pm-hr组较空白组更加不透光(图11a)。与hr组相比,k@hr组和k@pm-hr组的标本更致密、更亮,与软骨相似。这一结果与kgn的加入有关,kgn在调节软骨分化和促进软骨基质分泌方面发挥作用。h&e染色显示,空白对照组的基质成分在28到56天时变化不大,与凝胶的成分相似(图11b,白色箭头:纤维囊层)。hr组、k@hr组和k@pm-hr组细胞分布更广,基质分泌更多(图11b)。此外,h&e染色和免疫荧光证实,由于裸鼠不可避免的异物反应,标本包裹在包括血管和细胞在内的纤维囊层中。评价裸鼠皮下植入含hmscs水凝胶后软骨形成效果图12中,图a为皮下植入28、56天水凝胶重量、胶原蛋白、gag含量的定量分析;图b为皮下植入28天后软骨相关蛋白的免疫荧光染色;图c为皮下植入56天后软骨相关蛋白的免疫荧光染色。空白对照组在第28、56天重量均低于其他各组。第56天,k@hr和k@pm-hr组的重量显著高于空白对照组和hr组(图12a)。标本重量的增加与基质分泌量有关。基质成分的定量分析表明,hr组分泌的gag和胶原比空白组分泌的多。皮下培养28天和56天后,k@hr组和k@pm-hr组的gag和胶原的分泌量均高于hr组。同时,k@pm-hr组的胶原分泌在第56天最高(图12a)。免疫荧光染色结果与定量分析结果一致(图12b、c,白色箭头:纤维囊层;红色箭头:细胞核)。另一方面,dapi染色显示,在第28天和第56天(图12b和c),hr组、k@hr组和k@pm-hr组细胞数量均高于空白对照组。此外,hr组、k@hr组和k@pm-hr组在第28天至第56天细胞增殖明显增加,而空白对照组无此变化。结果表明,多肽对细胞的存活和生长以及基质分泌具有重要意义。acan和collⅱ染色表明,kgn存在于k@hr和k@pm-hr凝胶基质中,软骨基质的分泌很明显(图12b和c)。特别是,通过调控kgn的释放,增强了hmscs软骨形成(图12b和c)。(图12中,数据以均数±标准差表示;n=3.*<0.05,**<0.01,***<0.001。)通过体内实验验证了我们的水凝胶体系的可行性:凝胶体系促进hmscs的活性和软骨向分化,促进软骨基质的生成。7.兔子原位移植修复图13中,control为缺损处未植入水凝胶材料和细胞;gel为缺损处植入功能化水凝胶k@pm-hr;gel+rmscs为缺损处植入负载rmscs的功能化水凝胶k@pm-hr;normal为正常软骨组。从图13中可以看到,未植入凝胶材料组的缺损处未出现明显的骨软骨修复效果,表面未有软骨样组织,且micro-ct可见未有致密组织及骨小梁结构。而植入功能化水凝胶k@pm-hr和负载细胞的水凝胶组,骨软骨修复效果显著,创口表面有软骨样组织,内部有较致密骨小梁结构,这与正常软骨组表面和内部相似。这些结果表明,此功能化水凝胶可以明显促进兔原位软骨缺损的修复和再生,这种体内修复的优良效用,为之后进一步的临床应用奠定基础。在本发明中,k@pm-hr水凝胶系统成功地提供了一个细胞培养微环境,促进干细胞向软骨向分化。rgd增强细胞-基质相互作用,促进细胞存活和增殖,而hav调节细胞-细胞相互作用。实验的初衷是利用这些不同功能的多肽来指导细胞的不同行为。但是,我们发现,在早期没有引入hav肽时,弱交联凝胶基质在rgd肽的作用下增强了细胞的增殖甚至凝集。当然,在hav和rgd的共同参与和作用下,细胞表现出更明显的聚集和软骨形成。kgn的持续释放作为调控细胞分化的关键步骤之一,可促进hmscs的成软骨分化。因此,功能化的ha水凝胶有望作为干细胞培养体系和临床应用的支架基质,包括3d打印凝胶支架、微流体技术和软骨组织工程。本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1