一种阳离子复合物脂质体流感疫苗以及制备方法、应用方法
本发明属于纳米材料技术领域及疫苗领域,具体涉及一种阳离子复合物脂质体流感疫苗及其制备方法、应用方法。
背景技术:
流感是由流感病毒引起的一种急性呼吸道传染病,严重危害人类健康,迄今为止,预防流感最有效的方法仍是接种疫苗。目前广泛应用的主要为流感病毒裂解疫苗及灭活疫苗,但其生产工艺复杂,生产成本高,在疫情迅速传播期难以在短时间内生产出足够剂量以预防流感的大行爆发,且安全性较差,副反应多,接种剂量大,免疫原性弱,难以对机体产生高效保护作用。新一代亚单位疫苗、合成肽疫苗、核酸疫苗等新型疫苗与传统疫苗相比,虽然安全性有所提高,但因其分子小,免疫原性弱,仍然较难诱导机体产生有效的免疫应答,因此,急需进一步开发更高效的流感疫苗。
佐剂是一种免疫增强剂,它和抗原一起或预先注射到机体内可有效提高抗原对机体的免疫原性,增强疫苗的免疫效果。
脂质体就是一种对疫苗有很强的增效作用的佐剂,是目前应用最广泛的疫苗佐剂,也是最有希望成为理想疫苗佐剂的物质之一。脂质体是由同心脂质双分子层包围一个水核形成的球形小囊,作为一种新型疫苗载体,具有许多生物学特点:①增强抗原透入细胞的能力,能将目的抗原特异传递到靶细胞中,无毒无免疫原性,减少了疫苗对鼻黏膜的毒性和刺激性;②稳定抗原,防止疫苗抗原被黏膜上的酶类降解而失活,使黏膜免疫部位保持高的疫苗浓度;③包被脂质体的抗原可长期在吞噬细胞和抗原提呈细胞中存在,持续释放被包封疫苗,形成长效缓释作用;④脂质体作为鼻黏膜免疫佐剂具有生物黏附特性,特别是带正电荷的脂质体生物黏附性较强,能减少疫苗被黏膜纤毛的清除,使疫苗较长时间保持有效血药浓度,提高生物利用度;⑤可作为鼻黏膜免疫载体,刺激机体的黏膜和全身免疫应答反应。
综上所述,构建一种脂质体复合的流感疫苗,借助脂质体增强疫苗的免疫应答效应是开发高效疫苗的一种有效方式。
技术实现要素:
本发明的目的就在于提供一种能有效增强免疫应答效果的阳离子复合物脂质体流感疫苗。
本发明的另一目的是提供上述阳离子复合物脂质体流感疫苗的制备方法。
本发明的另一目的是提供上述阳离子复合物脂质体流感疫苗的应用方法。
为实现上述发明目的所采取的技术方案为:
一种阳离子复合物脂质体流感疫苗,其特征在于该阳离子复合物脂质体流感疫苗是以阳离子脂质体作为流感疫苗的免疫载体兼佐剂,同时添加免疫调节剂构建而成,该阳离子复合物脂质体流感疫苗粒径为200~700nm,zeta电位为5~40mv,包封率为30~90%,载药量为1~10%;
其中所述阳离子脂质体为氯化三甲基-2,3-二油烯氧基丙基铵、溶血卵磷脂、二甲基双十八烷基铵(dda)、溴化三甲基十二烷基铵、3β-[n-(n’,n’-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)和硬脂胺的一种或几种组成;
所述免疫调节剂为氨基酰亚胺-精胺、聚磷腈、乙二醇壳聚糖、二硬脂酰基磷脂酰胆碱(dspc)、二油酰基磷脂酰乙醇胺、维生素e聚乙二醇琥珀酸酯(tpgs)和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)的一种或几种组成。
所述阳离子脂质体优选为二甲基双十八烷基铵(dda)。
所述免疫调节剂优选为二硬脂酰基磷脂酰胆碱(dspc)和维生素e聚乙二醇琥珀酸酯(tpgs)。
以二甲基双十八烷基铵(dda)为阳离子脂质体,二硬脂酰基磷脂酰胆碱(dspc)和维生素e聚乙二醇琥珀酸酯(tpgs)为免疫调节剂构建的阳离子脂质体中,dda-dspc-tpgs摩尔比为4~8:5~20:1~2,优选为4:15:1。
上述阳离子复合物脂质体流感疫苗的制备方法,其特征在于,以阳离子脂质体作为流感疫苗的免疫载体兼佐剂,同时添加免疫调节剂,然后采用薄膜分散法、冻融法和冷冻干燥法中的一种或联合法将流感疫苗原液包载于其中。
采用薄膜分散法将流感疫苗原液包载其中的具体工艺步骤为:
按照处方量精密称取阳离子脂质体和免疫调节剂,溶于适量有机溶液中,涡旋混匀后旋转蒸发,充入氮气除尽残留有机溶剂;
然后加入水化介质,在50~80℃水浴条件下水化20~50min,获得空白脂质体;
在上述制得的空白脂质体中加入流感疫苗原液,涡旋使其均匀混合,室温孵育30min~50min,即制得阳离子脂质体流感疫苗。
采用薄膜分散法结合冻融-冻干法将流感疫苗原液包载其中的具体工艺步骤为:
按照处方量精密称取阳离子脂质体和免疫调节剂,溶于适量有机溶液中,涡旋混匀后减压旋转蒸发,充入氮气除尽残留有机溶剂;
然后加入水化介质,在50~80℃水浴条件下水化20~50min,获得空白脂质体;
将上述制得的空白脂质体与流感疫苗原液、冻干保护剂充分混匀,分装于安瓿瓶中,在-40℃~-80℃温度条件下快速冷冻1h~2h,后室温环境下缓慢融化,融化后在-40℃~-80℃温度条件下快速冷冻8~12h,最后将冷冻后的载药脂质体放在真空冷冻干燥机中冷冻干燥12~24小时,即得阳离子复合物脂质体流感疫苗。
所述有机溶剂为氯仿、甲醇、四氢呋喃、丙酮、二氯甲烷或乙醇中的一种或几种。
所述旋转蒸发是指采用旋转蒸发仪,在37~40℃恒温水域条件下蒸发15~30min。
所述水化介质为tris-hcl缓冲液、pbs缓冲液或葡萄糖溶液,其浓度为5~30mmol/l,ph为5~8,根据脂质体的浓度确定缓冲液的用量。
所述冻干保护剂为5%的蔗糖和5%的乳糖按质量比1:1合用。
上述阳离子复合物脂质体流感疫苗的应用方法,其特征在于,所述阳离子复合物脂质体流感疫苗通过皮下、肌肉内注射或经鼻黏膜免疫途径进行免疫治疗,优选鼻黏膜免疫途径。
所述冻干保护剂为5%的蔗糖和5%的乳糖按质量比1:1合用。
本发明以阳离子脂质体作为疫苗佐剂和载体,尤其是以dda阳离子脂质体作为疫苗佐剂和载体,同时添加可提高免疫效力的活性物质tpgs或/和peg等作为免疫调节剂,将流感疫苗原液包载于其中,从而制得免疫应答效果强的阳离子脂质体流感疫苗,其技术优势体现在:
1、阳离子脂质体的佐剂特性与其“储库效应”有关,其可通过静电作用与细胞相互作用,将抗原有效提呈给抗原提呈细胞(apcs),并诱导其活化、成熟。本发明将流感疫苗包载于阳离子脂质体和免疫调节剂组成的佐剂和疫苗传递系统中,能够显著促进树突细胞的抗原摄取,刺激dcs活化成熟,进一步引起免疫应答。
2、本发明构建的阳离子复合物脂质体流感疫苗,其粒径是200~700nm,zeta电位为5~40mv,包封率为30~90%,载药量为1~10%。
3、免疫途径作为影响疫苗免疫应答效应的另一重要因素,在疫苗的设计开发中具有重要意义。本发明构建的阳离子复合物脂质体流感疫苗,可通过肌内、皮下注射或鼻黏膜给药进行免疫治疗。考虑到流感感染的主要途径是通过呼吸道感染,黏膜表面是流感病毒入侵的首要部位,且鼻腔中含有丰富的免疫细胞和淋巴组织(例如nalt),疫苗在此部位接种,不仅可以诱导体液免疫及细胞免疫应答,还能诱导黏膜免疫免疫应答,且鼻腔中具有较高的免疫活性区域及鼻相关淋巴组织,含有大量的抗原提呈细胞(apcs)、b及t淋巴细胞等,其中的树突状细胞(dcs)接触抗原后,能够有效摄取抗原并活化初始t细胞,引发适应性免疫应答,故而,本发明优选为通过鼻黏膜途径给药,本发明的动物实验结果显示:dda-dspc-chol-tpgs组脂质体流感疫苗诱导了较高水平的iga抗体,表明dda复合物脂质体流感疫苗与流感抗原组相比,能够有效诱导黏膜免疫应答,诱导高水平的iga抗体表达(如图1b所示)。因此,通过鼻黏膜途径给药可有效的增强了机体的黏膜免疫应答以及细胞免疫应答水平,在流感预防方面具有广阔的应用前景。
4、脂质体作为一种混悬液,其稳定性较差。本发明通过将阳离子复合物脂质体流感疫苗制成冻干疫苗,从而提高了脂质体疫苗的稳定性,延长了疫苗的保存期,并且更容易储藏、运输。
5、体外的树突状细胞刺激成熟实验结果显示:与其他各组相比,dda-dspc组能显著增强树突细胞对其的摄取能力。dcs成熟结果显示:各组dda复合物脂质体能明显上调dcs表面共刺激分子cd86及mhc-ii的表达。充分表明:dda复合物脂质体流感疫苗能够有效促进小鼠骨髓未成熟树突状细胞的分化成熟,从而表明dda复合物是一种优良的疫苗佐剂和载体。
6、体液免疫作为机体抵抗外界细菌和病毒的主要途径之一,对保护机体免遭病原体侵害具有重要作用。体液免疫主要由b细胞介导,其分泌的抗体水平是评价体液免疫应答强弱的标准。本发明的动物实验结果表明:dda-dspc-tpgs组脂质体流感疫苗经鼻黏膜免疫后能诱导高水平的血清igg1,表明dda-dspc-tpgs组脂质体流感疫苗可有效诱导th2型免疫应答,辅助b细胞产生抗体,从而有效增强机体的体液免疫应答。此外,细胞免疫对消除病毒及胞内寄生微生物感染均具有重要作用。通过检测细胞培养上清中ifn-γ及il-4的含量,结果表明dda-dspc-tpgs组脂质体流感疫苗鼻黏膜免疫后可诱导小鼠产生较高水平的ifn-γ,说明以上两组脂质体流感疫苗能有效诱导th0细胞向th1细胞分化并促进其分泌高水平的ifn-γ,th1细胞可增强吞噬细胞介导的抗感染免疫,特别是抗胞内病原体的感染,ifn-γ可有效活化巨噬细胞,增强其杀伤已被吞噬的病原体的能力,th1细胞和ifn-γ在细胞免疫应答中具有重要作用。
综上所述,本发明构建的阳离子复合物脂质体流感疫苗,包封率和载药量较高,且稳定性较好,经小鼠鼻黏膜免疫后,该新型疫苗能显著提高小鼠体液免疫及黏膜免疫应答水平。
附图说明
图1为本发明一种阳离子复合物脂质体流感疫苗的模式图。
图2为脂质体流感疫苗的tem图,其中a.dda-dspc脂质体流感疫苗,b.dda-dspc-tpgs脂质体流感疫苗,c.dda-dspc-peg脂质体流感疫苗。
图3为各组dda复合物脂质体对bmdcs和dc2.4的细胞毒性图,其中a.脂质体对bmdcs的细胞毒性,b.脂质体对dc2.4细胞的细胞毒性。
图4为bmdcs和dc2.4对包载fitc-bsa的各组脂质体摄取的流式细胞仪测定结果,其中(a)bmdcs与游离fitc-bsa或包载fitc-bsa的各组脂质体孵育2小时后的细胞摄取结果(b)dc2.4与游离fitc-bsa或包载fitc-bsa的各组脂质体孵育2小时后的细胞摄取结果。
图5为不同dda复合物脂质体流感疫苗刺激dc2.4成熟图,涉及cd80,cd86和mhcii的表达(a-c)。
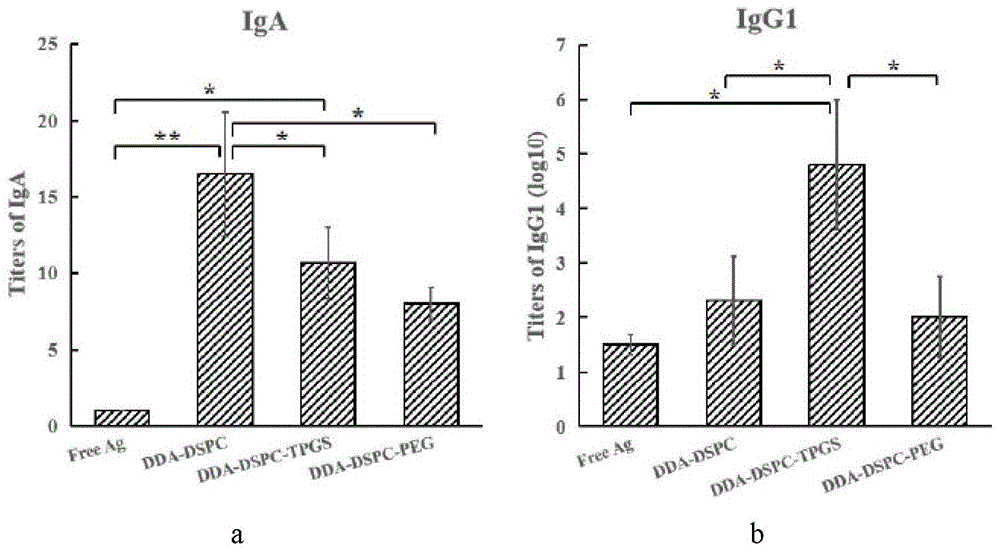
图6为脂质体流感疫苗诱导的鼻黏液iga及血清igg1抗体水平,其中(a)鼻黏液中iga抗体滴度,(b)血清中igg1抗体滴度。
图7为不同dda复合物脂质体流感疫苗刺激小鼠脾细胞上清液分泌细胞因子ifn-γ及il-4表达水平。
具体实施方法
以下通过实例对本发明做进一步的阐述。但实施例所叙述的技术内容是说明性的,而不是限定性的,不应依此来局限本发明的保护范围,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
实施例1:薄膜分散法制备dda-dspc-peg阳离子脂质体流感疫苗
精密称取处方量的阳离子脂质体(二甲基双十八烷基铵dda)和免疫调节剂(二硬脂酰基磷脂酰胆碱dspc、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000dspe-peg2000),上述dda-dspc-peg摩尔比4:15:1,置于50ml圆底烧瓶中,加入2ml氯仿-甲醇溶液溶解(v氯仿:v甲醇=9:1),涡旋1min混匀后在旋转蒸发仪上37℃恒温水浴蒸发20min,挥干有机溶剂后,此时圆底烧瓶底部可见一层脂质薄膜。此时充入氮气2min,除尽残留有机溶剂。
之后在圆底烧瓶内加入一定量的tris缓冲液(浓度为10mmol/l、ph7.4),65℃水浴锅内水化40min,即制得dda-dspc-peg空白脂质体。
在上述制得的dda-dspc-peg空白脂质体中加入流感疫苗原液,涡旋5min使其均匀混合,室温孵育至少30min,即制得dda-dspc-peg阳离子脂质体流感疫苗,4℃条件下保存备用。用马尔文激光粒度仪测粒径、电位。采用透射电镜(tem)观察疫苗的形态,观察拍照。
结果如图2(c)所示,结果表明:可以成功构建阳离子复合物脂质体流感疫苗,粒径为591.4±19.3nm,pdi0.470±0.023,zeta电位6.9±0.8mv,ee45.8±3.0(包封率),le3.0±0.3%(载药量);在透射电镜下观察其形态,外观均呈圆球形或椭球形。
实施例2:薄膜分散法制备dda-dspc阳离子脂质体流感疫苗
精密称取处方量的阳离子脂质体(二甲基双十八烷基铵dda)和免疫调节剂(二硬脂酰基磷脂酰胆碱dspc),上述dda-dspc摩尔比1:4,置于50ml圆底烧瓶中,加入2ml氯仿-甲醇溶液溶解(v氯仿:v甲醇=9:1),涡旋1min混匀后在旋转蒸发仪上37℃恒温水浴蒸发40min,挥干有机溶剂后,此时圆底烧瓶底部可见一层脂质薄膜。此时充入氮气2min,除尽残留有机溶剂。
之后在圆底烧瓶内加入一定量tris缓冲液(浓度为5mmol/l,ph7.4),65℃水浴锅内水化20min,即制得dda-dspc空白脂质体。
在上述制得的dda-dspc空白脂质体中加入流感疫苗原液,涡旋5min使其均匀混合,室温孵育至少30min,即制得dda-dspc阳离子脂质体流感疫苗,4℃条件下保存备用。用马尔文激光粒度仪测粒径、电位。采用透射电镜(tem)观察疫苗的形态,观察拍照。
结果如图2(a)所示,结果表明:可以成功构建dda-dspc阳离子复合物脂质体流感疫苗,粒径为685.0±17.8nm,pdi0.522±0.342,zeta电位25.4±1.9mv,ee65.7±2.0%,le6.2±0.2%;在透射电镜下观察其形态,外观均呈圆球形或椭球形。
实施例3:薄膜分散法制备dda-dspc-tpgs阳离子脂质体流感疫苗
精密称取处方量的阳离子脂质体(二甲基双十八烷基铵dda)和免疫调节剂(二硬脂酰基磷脂酰胆碱dspc,维生素e聚乙二醇琥珀酸酯tpgs),上述dda-dspc-tpgs摩尔比4:15:1,置于50ml圆底烧瓶中,加入2ml氯仿-甲醇溶液溶解(v氯仿:v甲醇=9:1),涡旋1min混匀后在旋转蒸发仪上37℃恒温水浴蒸发20min,挥干有机溶剂后,此时圆底烧瓶底部可见一层脂质薄膜。此时充入氮气2min,除尽残留有机溶剂。
之后在圆底烧瓶内加入一定量的pbs缓冲液(浓度为30mmol/l,ph7.4),65℃水浴锅内水化20min,即制得dda-dspc-tpgs空白脂质体。
在上述制得的dda-dspc-tpgs空白脂质体中加入流感疫苗原液,涡旋5min使其均匀混合,室温孵育至少30min,即制得dda-dspc-tpgs阳离子脂质体流感疫苗,4℃条件下保存备用。用马尔文激光粒度仪测粒径、电位。采用透射电镜(tem)观察疫苗的形态,观察拍照。
结果如图2(b)所示,结果表明:可以成功构建dda-dspc-tpgs阳离子复合物脂质体流感疫苗,粒径为337.3±2.4nm,pdi0.555±0.061,zeta电位15.4±2.1mv,ee78.5±1.5%,le4.2±0.2%;在透射电镜下观察其形态,外观均呈圆球形或椭球形。
实施例4:薄膜分散法结合冻融-冻干法制备dda-dspc-tpgs阳离子脂质体流感疫苗
精密称取处方量的阳离子脂质体(二甲基双十八烷基铵dda)和免疫调节剂(二硬脂酰基磷脂酰胆碱dspc,维生素e聚乙二醇琥珀酸酯tpgs),上述dda-dspc-tpgs摩尔比4:15:1,置于50ml圆底烧瓶中,加入2ml氯仿-甲醇溶液溶解(v氯仿:v甲醇=9:1),涡旋1min混匀后在旋转蒸发仪上37℃恒温水浴蒸发20min,挥干有机溶剂后,此时圆底烧瓶底部可见一层脂质薄膜。此时充入氮气2min,除尽残留有机溶剂。
之后在圆底烧瓶内加入一定量的pbs缓冲液(浓度为30mmol/l,ph7.4),65℃水浴锅内水化20min,即制得dda-dspc-tpgs空白脂质体。
将上述制得的dda-dspc-tpgs空白脂质体与流感疫苗原液充分混匀,后加入浓度为5%葡萄糖和5%蔗糖(质量比1:1)作为冻干保护剂分装于安瓿瓶中,在-80℃低温冰箱快速冷冻装有载药脂质体的安瓿瓶1h后,室温环境下缓慢融化,融化后再在-80℃低温冰箱冷冻8h。最后将预冻的载药脂质体放在真空冷冻干燥机中冷冻干燥12小时,即得阳离子复合物脂质体流感疫苗。对冻干所得制剂进行评价。
结果表明:可以成功构建dda-dspc-tpgs阳离子复合物脂质体流感疫苗,粒径为843.2±10.7nm,ee83.4±4.5%。
实施例5:采用薄膜分散法结合冻融-冻干法制备dda-dspc-chol-tpgs阳离子脂质体流感疫苗
精密称取处方量的脂质体(二甲基双十八烷基铵dda、胆固醇chol)和免疫调节剂(二硬脂酰基磷脂酰胆碱dspc、维生素e聚乙二醇琥珀酸酯tpgs),上述dda、dspc、chol和tpgs按摩尔比为8:10:3:1,置于50ml圆底烧瓶中,加入2ml氯仿-甲醇溶液溶解(v氯仿:v甲醇=9:1),涡旋混匀后在旋转蒸发仪上37℃恒温水浴蒸发20min,挥干有机溶剂后,此时圆底烧瓶底部可见一层脂质薄膜。此时充入氮气2min,除尽残留有机溶剂。
随后加入5mltris缓冲液(浓度为8mmol/l,ph7.4),70℃条件下水化50min,得到dda-dspc-chol-tpgs空白脂质体。
将上述制得的dda-dspc-chol-tpgs空白脂质体与流感疫苗原液充分混匀,后加入浓度为5%葡萄糖和5%蔗糖(质量比1:1)作为冻干保护剂分装于安瓿瓶中,在-75℃低温冰箱快速冷冻装有载药脂质体的安瓿瓶1h后,室温环境下缓慢融化,融化后再在-75℃低温冰箱冷冻8h。最后将预冻的载药脂质体放在真空冷冻干燥机中冷冻干燥12小时,即得阳离子复合物脂质体流感疫苗。对冻干所得制剂进行评价。结果表明:可以成功构建阳离子复合物脂质体流感疫苗,粒径为1153.2±8.7nm,ee63.7±4.1%。
下属考察实验中,dda-dspc-peg、dda-dspc、dda-dspc-tpgs分别来源于依据上述实施例1、实施例2、实施例3所制成的。
考察实验1:考察不同阳离子脂质体流感疫苗体外毒性
调整树突细胞(骨髓树突状细胞bmdcs、小鼠骨髓来源树突状细胞dc2.4)密度接种于96孔板,分别加入不同浓度的制剂组,每一梯度做三个复孔、置37℃5%co2细胞培养箱培养24小时后,通过cck-8试剂盒考察各组阳离子复合物脂质体对bmdcs和dc2.4的细胞毒性。
结果如图3所示,(a)为dda复合物脂质体对bmdcs的毒性,(b)图为dda复合物脂质体对dc2.4细胞的毒性。由图3中可以看出,本实验所制备的dda阳离子复合物脂质体在浓度0~1500μg/ml范围内,细胞相对存活率达到90%~100%,对bmdcs和dc2.4细胞无明显毒性,细胞活力较好。结果表明:各组制剂的细胞毒性较低,在本研究的浓度范围内具有良好的生物安全性。
考察实验2:考察树突细胞对不同阳离子脂质体流感疫苗体外摄取
使用fitc荧光染料标记的牛血清白蛋白bsa作为模型抗原,将其包载于各组脂质体中考察bmdcs、dc2.4对不同制剂组的摄取情况。
制备不同制剂组空白脂质体,分别向各组制剂中加入fitc共轭的牛血清白蛋白(fitc-bsa)25μg/ml,涡旋,避光静置备用。分别取培养至第7天的bmdcs细胞和dc2.4细胞,接种于24孔板,均设置空白对照组(只加培养基和细胞)、freefitc-bsa组、包载fitc-bsa的dda-dspc组、dda-dspc-chol-tpgs组和dda-dspc-peg组。采用流式细胞仪(fcm)检测bmdcs和dc2.4对各组dda复合物脂质体的摄取。
结果如图4所示,结果表明:将抗原(fitc-bsa)包载于dda复合物脂质体中,与未成熟bmdcs及dc2.4共孵育2小时后,三组dda复合物脂质体均可以有效促进dcs对其的摄取(与抗原组相比),证实了dda复合物脂质体良好的佐剂特性。其中,dda-dspc脂质体组摄取率最高,dda-dspc-tpgs和dda-dspc-peg组摄取率较低,其原因可能与其较低的zeta值及脂质体成分中tpgs及peg组分的含量有关,不同比例的tpgs及peg可能会影响dcs对其的摄取,也有可能与其他影响摄取的机制有关,除此之外,dda-dspc-peg组在bmdcs和dc2.4细胞中摄取差异较大,可能由于bmdcs相较于dc2.4对peg化更敏感,还有待于后续进一步深入探究。
考察实验3:考察不同组dda复合物脂质体流感疫苗刺激bmdcs成熟作用
制备dda-dspc、dda-dspc-tpgs和dda-dspc-peg脂质体流感疫苗,采用流式细胞仪(fcm)检测不同组dda复合物脂质体流感疫苗刺激bmdcs成熟作用。本实验比较了不同脂质体流感疫苗与dc2.4共培养24h后,dc2.4表面cd80、cd86和mhcii分子的表达,mhcii、cd80和cd86是否高水平表达是dc成熟和具有激活t细胞能力的标志。结果如图5所示,结果表明,dc2.4与各组dda复合物脂质体流感疫苗共培养后,可显著提高其表面cd86和mhcii分子的表达(和对照组相比),表明dda复合物脂质体能够有效促进dcs成熟。
考察实验4:考察不同制剂组流感疫苗诱导的鼻黏液iga及血清igg1抗体水平
血清样品采集:小鼠末次免疫14天后,眼眶采血,采集血液样品400μl,室温静置30min至血液分层后,4000rpm离心15min,收集上清液并分装,置于-80℃冰箱中冻存待测。黏液样品釆集:取适量含0.1%bsa的pbs,分别冲洗鼻咽部和气管,共收集黏膜冲洗液500μl,4000rpm离心15min,收集上清液并分装,置于-80℃冰箱中冻存待测。采用间接elisa法检测小鼠血清igg1、iga抗体滴度。
间接elisa法检测小鼠血清igg1抗体滴度
每板设未免血清为阴性对照组,各实验组elisa的od值与阴性血清的od值之比大于2.1,则可判为阳性血清,表明有抗体产生,抗体滴度即产生阳性结果的最大稀释度。
间接elisa法检测小鼠血清igg1抗体滴度:
(1)包被:配制ph9.6的碳酸盐缓冲液,稀释并包被流感抗原于酶标板,使其蛋白终浓度为2μg/ml,4℃下放置12h后,弃掉液体,用pbst洗涤液洗版,冲洗6次,每次洗板后在吸水纸上拍干移除残留液体,除去未吸附的游离蛋白。
(2)封闭:用含有无关蛋白质(bsa)的封闭缓冲液(tst-b)再次包被酶标板,每孔200μl,37℃孵育2h后弃掉液体,洗涤液冼涤6次,以封闭固相上的未结合位点和空余间隙,避免非特异性抗原的吸附。
(3)加样:设阴性对照组和实验组,阴性对照组血清样品不稀释,直接加入酶标板,每孔100μl,实验组血清样品先稀释10倍后,再以2n倍比稀释,每孔100μl,37℃孵育1h后洗涤液洗涤6次。
(5)加酶标记抗体:每孔加入100μl稀释的hrp偶联的山羊抗小鼠igg1,37℃孵育1h后,洗涤液洗涤6次。
(6)加底物显色:每孔加入100μltmb显色工作液,避光,室温孵育25-30min。
(7)终止反应:每孔加50μl0.5mh2so4,置于振荡器上充分混匀,终止显色。
(8)检测od值:使用酶标仪在450nm波长下检测吸光度(od)值,读数并记录。
阳性结果判断:每板设空白组小鼠血清为阴性对照组,若各实验组样本的od值与阴性组血清的od值之比大于2.1,则可判定样本为阳性,表明有抗体产生,抗体滴度即产生阳性结果的最大稀释度。
制备dda-dspc、dda-dspc-tpgs和dda-dspc-peg脂质体流感疫苗,对小鼠血清igg1抗体及鼻黏液iga抗体滴度进行测定。
实验结果如图6所示,结果表明:dda-dspc组脂质体流感疫苗经鼻黏膜免疫后,鼻黏液中iga抗体滴度较高。同时,dda-dspc-tpgs组脂质体流感疫苗与流感抗原组相比,也有显著性差异此外,研究结果显示,dda-dspc-tpgs组脂质体流感疫苗经鼻黏膜免疫后还能诱导高水平的血清igg1。
考察实验5:考察不同制剂组流感疫苗刺激脾细胞分泌细胞因子情况
按上述考察实验4给药21天后,处死小鼠,分离脾脏、收集各组制剂脾细胞,红细胞裂解液裂解红细胞后,pbs重新悬浮,调整细胞密度,接种于培养板,同时加入流感抗原原液对淋巴细胞进行再刺激。37℃培养箱培养72小时后收集细胞并离心,收集上清、分装并冻存于-80℃待测。采用elisa试剂盒测定细胞因子il-4、il-2分泌情况。
实验结果如图7所示,结果表明:dda-dspc、dda-dspc-tpgs及dda-dspc-peg组脂质体流感疫苗鼻黏膜免疫后可诱导小鼠产生较高水平的ifn-γ,而il-4几乎未表达,表明以上三组脂质体流感疫苗能提高dda诱导的t细胞反应并促进其分泌高水平的ifn-γ,增强细胞免疫应答。
- 还没有人留言评论。精彩留言会获得点赞!