神经激肽1受体拮抗剂在结直肠癌中促进化疗敏感和逆转化疗耐药的作用的制作方法
本发明属于医药领域,具体涉及结直肠癌治疗中促进化疗敏感和逆转化疗耐药的方法,以及涉及一种含有神经激肽1受体拮抗剂的药学产品。
背景技术:
结直肠癌(colorectalcancer,crc)在女性和男性中分别被诊断为第二和第三大最常见的癌症,并且死亡率逐渐增加[1]。自1995年以来,尤其是50岁以下的年轻成年人的发病率每年以2.2%的速度增长[2]。使用当前的标准疗法,包括手术,化学疗法和放射疗法,crc患者的5年相对生存率是65%,但是,对于iv期疾病的crc患者,这一比例下降到12%[3]。因此,了解crc的发病机理和开发新疗法代表了crc患者尚未满足的临床需求。
p物质(substancep,sp)是速激肽家族中第一个被鉴定的成员,在中枢神经系统和周围神经系统中分布广泛。sp调节各种生理和病理过程,例如疼痛、胃运动、炎症、免疫调节、呕吐和抑郁[4-7]。对sp的生物学反应是由神经激肽受体(neurokininreceptors,nkrs)介导的,nkrs包括神经激肽1受体(nk-1r)、神经激肽2受体(nk-2r)和神经激肽3受体(nk-3r)等是g蛋白偶联受体家族的成员,其中nk-1r对sp的亲和力最高[8,9]。nk-1r拮抗剂已在临床上用于治疗癌症化学疗法引起的恶心和呕吐[10]。
显而易见的是,sp/nk-1r复合物在包括结肠癌在内的多种癌症类型中具有致癌作用[11-22]。nk-1r优先在溃疡性结肠炎后来发展为结肠癌的患者的结肠上皮细胞中上调[23]。也有报道与相邻的正常组织相比,sp和nk-1r在crc肿瘤组织中的表达升高[24]。nk-1r拮抗剂在人结肠癌细胞中显示出抑制肿瘤生长和诱导细胞凋亡的作用[25-28]。但是,nk-1r拮抗剂在癌细胞中功效的分子机制仍未得到很好的描述。尽管最近的一项研究报道了nk-1r拮抗剂阿瑞匹坦(aprepitant)在人结肠癌细胞中的细胞毒性是通过抑制经典的wnt途径介导的,但aprepitant的疗效与基础wnt活性无关[26],暗示了其他相关途径。因此,本发明的发明人决定进行深入的机制描述,以了解人类结肠癌细胞对nk-1r拮抗剂的敏感性。
技术实现要素:
为了应对癌症患者化学治疗易产生耐药的问题,本发明的发明人研究发现nk-1r拮抗剂在结直肠癌中促进化疗敏感和逆转化疗耐药的作用。具体而言,nk-1r拮抗剂在crc细胞中诱导的凋亡是通过诱导内质网(endoplasmicreticulum,er)应激(upr的perk-eif2α-atf4分支)和通过抑制erk信号传导而失去c-myc蛋白稳定性来介导的。有吸引力的是,nk-1r拮抗剂通过er应激和c-myc降解介导的治疗益处的新机制,在体外和体内改善了化疗敏感和化疗耐药的crc细胞对化学疗法的细胞反应。这一发现扩展了对癌细胞中nk-1r下游细胞内信号传递的理解,更重要的是支持nk-1r拮抗剂与化学疗法联合应用,作为治疗化疗敏感和化疗耐药人类crc的新疗法。
因此,本发明一方面提供了一种促进crc受试者癌症化疗敏感性或逆转受试者癌症化疗耐药性的方法,其包括向所述受试者施用治疗有效量的nk-1r拮抗剂。
本发明的另一方面提供了nk-1r拮抗剂在制备用于促进crc癌症化疗敏感或逆转癌症化疗耐药的药物或药剂中的用途。
本发明还提供了一种药物组合物,其包含nk-1r拮抗剂和化疗药物。
附图说明
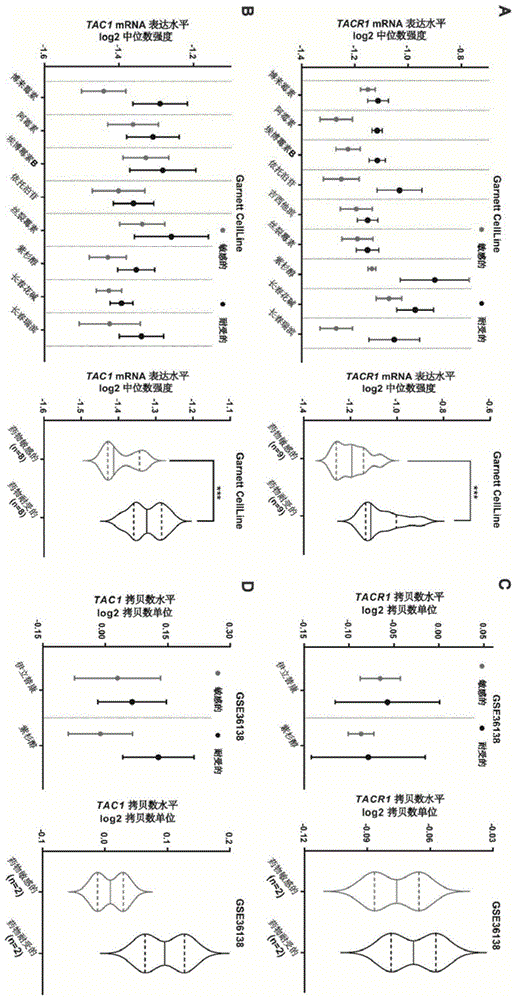
图1为oncomine数据库分析的化疗耐药的结直肠癌细胞系的tacr1和tac1的基因拷贝数和mrna表达具有更高的水平,其中:(a)tacr1的mrna表达水平。(b)tac1的mrna表达水平。(c)tacr1的基因拷贝数水平。(d)tac1的基因拷贝数水平。(***p<0.001)。
图2为nk-1r拮抗剂可增强结直肠癌细胞对化疗药物的敏感性,其中:(a)5-氟尿嘧啶(5-fu,60μm)与sr140333(30μm)或阿瑞匹坦(40μm)联合处理24小时,与单独加药组比较,联合加药组显著降低hct116细胞的增殖活力。(b)sn-38(400nm)与sr140333(30μm)或阿瑞匹坦(40μm)联合处理24小时,与单独加药组比较,联合加药组显著降低hct116细胞的增殖活力。(c)5-fu(60μm)与sr140333(15μm)或阿瑞匹坦(30μm)联合处理24小时,与单独加药组比较,联合加药组显著降低sw620细胞的增殖活力。(d)sn-38(300nm)与sr140333(15μm)或阿瑞匹坦(30μm)联合处理24小时,与单独加药组比较,联合加药组显著降低sw620细胞的增殖活力。(**p<0.01,***p<0.001)。
图3为hct116/5fu耐药细胞株具有更高的耐药蛋白和sp/nk-1r系统表达水平,其中:(a)5-fu处理24小时后,hct116/5fu耐药细胞株相比hct116亲本有显著更高的细胞活力和耐药蛋白表达水平。(b)sp/nk-1r系统在hct116/5fu耐药细胞株中相比hct116亲本有显著更高的表达水平。(*p<0.05,**p<0.01,***p<0.001)。
图4为5-fu(80μm)和sr140333(30μm)或aprepitant(40μm)联合处理48小时,与单独加药组比较,联合加药组显著降低hct116/5-fu耐药细胞株的增殖活力。(*p<0.05,**p<0.01,***p<0.001)。
图5为5-fu(80μm)和sr140333(30μm)或aprepitant(40μm)联合处理48小时,降低hct116/5-fu耐药细胞株中耐药相关蛋白p-gp、abcc1、abcg2的表达水平。
图6为5-fu(60μm)和sr140333(30μm)或aprepitant(40μm)联合处理24小时,明显降低hct116/5-fu细胞erk1/2磷酸化水平和c-myc表达水平。
图7为5-fu(60μm)和sr140333(30μm)或aprepitant(40μm)联合处理24小时,明显激活hct116/5-fu细胞内质网应激(upr的perk-eif2α-atf4分支)。
图8为5-fu(10mg/kg)联合sr140333(10mg/kg)或阿瑞匹坦(10mg/kg)每两天注射一次治疗hct116/5-fu细胞株构建的荷瘤裸鼠模型能能有效地抑制肿瘤生长,其中:(a)各组离体的异种移植瘤第18天的照片。(b)在指定时间点测量的各组肿瘤体积变化趋势。(c)在人性化处死时测量的各组肿瘤重量。(d)各组肿瘤的苏木精-伊红染色代表性结果。标尺为50μm。(*p<0.05,**p<0.01)。
图9为五组裸鼠均未见显著毒性,其中:(a)在指定时间点测量的小鼠体重趋势变化。(b)在人性化处死后各组裸鼠的脏器照片。(c)各组各脏器重量指数。(d)各组各脏器的苏木精-伊红染色代表性结果。标尺为50μm。
图10为免疫组化检测到nk-1r拮抗剂和5-fu联合处理抑制裸鼠肿瘤中耐药相关蛋白(abcc1、abcg2)、p-erk1/2和c-myc表达水平,促进内质网应激相关蛋白(p-perk、atf4、chop)的表达水平,其中:(a)各组肿瘤免疫组化代表性结果图。(b)各组肿瘤免疫组化阳性染色区域统计图。标尺为50μm。
(***p<0.001)。
图11为在结直肠癌治疗中通过阻断nk-1r激活内质网应激(upr的perk-eif2α-atf4分支)介导erk信号的失活和c-myc下调,从而促进化疗敏感性,以及逆转化疗耐药性的作用机制。
具体实施方式
本发明的发明人经过长期不懈地研究发现,nk-1r拮抗剂在结直肠癌中具有促进化疗敏感和逆转化疗耐药的作用。
因此,本发明一方面提供了一种促进受试者癌症化疗敏感性或逆转受试者癌症化疗耐药性的方法,其包括向所述受试者施用治疗有效量的nk-1r拮抗剂。
本发明的另一方面提供了nk-1r拮抗剂在制备用于促进癌症化疗敏感或逆转癌症化疗耐药的药物或药剂中的用途。
本发明还提供了一种药物组合物,其包含nk-1r拮抗剂和化疗药物,以及包括该涉及该药物组合物的产品的说明书。
本发明中化疗可以为施用5-氟尿嘧啶(5-fu)、伊立替康(一种活性代谢产物为sn-38)、奥沙利铂等药物的化疗。
对于本发明所述的受试者,其优选为哺乳动物,更优选为人。本发明以结直肠癌进行了举例说明,无特殊说明的情况或明显的上下文的相反启示下,本文中术语“癌症”或“癌”均为结直肠癌及其相关癌细胞。
对于本发明的药物组合物,其可为任何能够治疗受试者中癌症或缓解受试者中癌症症状的nk-1r拮抗剂和化疗药物。如上述“背景技术”中所述,nk-1r拮抗剂临床上用于治疗恶心和呕吐,现发现其具有广谱的抗肿瘤效果,通过靶向阻断nk1r抑制癌细胞的生长。在本发明教导的基础上,nk-1r拮抗剂联合化疗药物也是能够实现本发明的目的。
本发明的作为活性成分的nk-1r拮抗剂和化疗药物可以连同药学上可接受的载体一起使用。除活性成分外,本发明的方法、用途和产品还可以包含合适的药学上可接受的载体,包括促进活性化合物加工成制剂的赋形剂和助剂。
例如适于注射或输注的制剂包括水性和非水性无菌注射液和水性和非水性无菌混悬剂,所述无菌注射液可任选地包含抗氧剂、缓冲剂、抑菌剂和能使制剂与目的接收者的血液等压的溶质,所述无菌混悬剂可包括悬浮剂和增稠剂。所述制剂可存在于单位剂量或多剂量容器中,例如密封的安瓿,并且可以保存在冻结干燥的(冻干)条件,在立即使用前仅需要加入无菌液体载体,例如注射用水。
本发明的活性成分任选地可与固体赋形剂相组合,且任选地磨碎所得到的混合物,并且需要时,在加入合适的助剂后,加工颗粒的混合物,以获得所需剂型。合适的赋形剂特别是填充剂例如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素或淀粉制剂、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(pvp)。需要时,可以加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐例如海藻酸钠。
示例性地,本发明的活性成分可以以nk-1r拮抗剂使用1-15mg/kg剂量,化疗药物依据药物具体说明使用。例如nk-1r拮抗剂使用2-12mg/kg,化疗药物使用2-8mg/kg。优选地,sr140333使用10mg/kg,aprepitant使用10mg/kg,5-fu使用10mg/kg。
根据本发明,本发明的药学产品(药物、药剂)或药物组合物可以以任意有效剂量数施用给药受试者。优选地,本发明的药物组合物可以以多次剂量给药,例如从约2至约15次剂量,更优选从约4-10次剂量,最优选约6次剂量。在特别优选的实施方案,在给药过程中,以每三周给药约一次的频率将本发明的药学产品(药物、药剂)或药物组合物给药至受试者,例如注射、输注或口服。在特别优选的实施方案,给药为通过注射。
应当理解本发明的药物组合物可以用于通过任意适宜的途径给药的任意适宜的方式配制。
本发明的药物组合物的剂量单位是基于常规进行给药受试者。例如,剂量单位可以给药多于每日一次、每周一次、每月一次等。剂量单位可以是以两次/周为基础给药,即每周两次,例如每三天一次。
如本文所使用的,“包含”与“包括”、“含有”或“特征在于”同义,并且是包括在内的或开放性的,并且不排除另外的未陈述的元件或方法步骤。术语“包含”在本文中的任何表述,特别是在描述本发明的方法、用途或产品时,应理解为包括基本上由所述组分或元件或步骤组成和由所述组分或元件或步骤组成的那些产品、方法和用途。本文示例性描述的本发明适当地可以在不存在本文未具体公开的任何一种或多种元件、一种或多种限制的情况下进行实践。
本发明的药学产品中所包含的涉及该药学产品的说明书可以含有如下内容:适应症(例如结直肠癌)、施用剂量(例如上述所示例性说明的)以及可能产生的副作用等。
本文已采用的术语和表述用作描述性而不是限制性术语,并且在此种术语和表述的使用中不预期排除所示和所述特征或其部分的任何等价物,但应认识到各种修饰在请求保护的本发明的范围内是可能的。因此,应当理解尽管本发明已通过优选实施方案和任选特征具体公开,但本领域技术人员可以采用本文公开的概念的修饰和变化,并且此类修饰和变化被视为在如由附加权利要求定义的本发明的范围内。
为更清楚地说明本发明,现结合如下实施例进行详细说明,但这些实例仅仅是对本发明的示例性描述,并不能解释为对本申请的限制。
实施例
1材料与方法
1.1oncomine中的数据挖掘。从oncomine数据库(www.oncomine.org)中提取患者和细胞系的基因拷贝数和表达数据。tacr1拷贝数水平数据从barretinacellline2(gse36138)数据集的reporter02-072503625获取。tacr1mrna表达水平从garnettcellline数据集的reporter208048_at获取。tac1拷贝数水平数据从barretinacellline2(gse36138)数据集的reporter07-097203463获取。tac1mrna表达水平从garnettcellline数据集的reporter206552_s_at获取。
1.2细胞培养。在本发明的研究中,从浙江大学附属第一医院获得hct116和sw620细胞,从北京北纳创联生物技术研究院获得了对5-fu耐药的hct116细胞(hct116/5-fu)。sw620在dmem(lifetechnologies)中培养,hct116、hct116/5-fu在ripm1640(lifetechnologies)中培养。所有培养基均添加了10%热灭活的fbs(胎牛血清,北京索莱宝科技有限公司)。将所有细胞系在37℃,5%co2的潮湿环境中培养。
1.3药物治疗。sr140333由药明康德(中国)合成,并溶于dmso(二甲基亚砜,sigma-aldrich)中。阿瑞匹坦由四川金仟烨科技有限公司(中国)合成,并溶于dmso中。5-fu和sn-38(来自medchemexpress)溶解在dmso中,制成10mm储备液,并保存在-20℃。
1.4蛋白质提取。为了从细胞中提取蛋白质,在冰冷的pbs洗涤后,将细胞在含有0.5mmedta(乙二胺四乙酸)、20mmhepes(羟乙基哌嗪乙硫磺酸)、2%sds(十二烷基磺酸钠)和1mmpmsf(苯甲磺酰氟)的wsb裂解缓冲液中裂解。为了从肿瘤组织中提取蛋白质,先将速冻的冷冻组织块在研钵中的液氮中研磨,然后在均质器中研磨,然后溶解在wsb裂解缓冲液中。
1.5蛋白质印迹。制备40μg蛋白样品,并在8-12%的sds-page凝胶上电泳,然后电转移到pvdf膜上。然后将pvdf膜用含5%牛血清白蛋白v(roche)和0.1%tween20的tbst溶液在室温下封闭2小时。然后将膜与感兴趣的蛋白的特异性一抗孵育过夜,包括来自bioworldtechnology(中国南京)的sp(bs1598)、nk-1r(bs2632)、erk(bs1112)、chop(k121)(bs1136)、eif2α(i45)(bs3651)、p-eif2α(s51)(bs4787)、atf-4(bs1026)、atf-6(bs6476)、grp78(bs1154)、gapdh(ap0063);来自cellsignaltechnology(美国)的p-erk(thr202/tyr204)(#4370s);来自abcam(中国香港)的c-myc(ab32072);来自affinity(美国)的p-perk(thr982)(df7576)、perk(af5304)、p-ire1(ser724)(af7150)、ire1(df7709);来自abclonal(中国武汉)的xbp1(a1731)、p-gp(a11758)、abcc1(a11153)、abcg2(a5661)。使用tanon5500化学发光检测系统(天能,中国上海),利用biodlighttmecl化学发光hrp底物(bioworld,中国南京),通过化学发光对特定蛋白质进行可视化检测。
1.6异种移植瘤裸鼠模型。购买4-6周龄的雌性balb/c裸鼠,并将其置于杭州师范大学动物实验中心。所有操作均按照杭州师范大学实验室动物护理和使用标准进行。将hct116/5-fu细胞(约5×106个细胞)皮下注射到每只小鼠的右后方。细胞接种后,当形成的肿瘤达到100-150mm3时,将动物随机分为6组(每组n=5只)。第一组小鼠接受瘤内注射溶剂(10%玉米油和5%dmso)作为对照。第二至第四组接受5-fu(10mg/kg)或sr140333(10mg/kg)或阿瑞匹坦(10mg/kg)的治疗,第5组接受5-fu(10mg/kg)和sr140333(10mg/kg)的治疗/kg)治疗,第6组接受5-fu(10mg/kg)和aprepitant(10mg/kg)治疗。肿瘤周围注射每2天一次,持续18天。每两天使用游标卡尺测量肿瘤大小,并在接种肿瘤细胞28天后以v(mm3)=1/2×a×b2计算肿瘤体积,终止实验并人性化处死小鼠。切除每只小鼠的肿瘤和器官并测量其重量。
1.7苏木精-伊红染色。将切除的肿瘤在12孔板中浸入4%多聚甲醛中过夜,然后转移至逐渐增加浓度的乙醇中进行脱水,然后进行石蜡包埋和切片。染色前,将厚度为7μm的切片在二甲苯中脱蜡,通过降低乙醇浓度重新水化,然后用pbs洗涤。然后将肿瘤分别用苏木精和伊红染色2分钟和3分钟。染色后,将切片通过增加浓度的乙醇和二甲苯脱水,固定并拍摄(olympusbx53,日本)。
1.8免疫组织化学。将裸鼠肿瘤固定在4%pfa中24小时并包埋石蜡,随后切成连续的4μm切片。将切片在二甲苯中脱蜡,再用梯度乙醇水化,然后在高压锅中用柠檬酸盐缓冲液(ph6.0)中进行抗原修复。随后用3%过氧化氢封闭切片的内源性过氧化物活性,用免疫前的山羊血清处理以封闭非特异性结合位点,然后分别孵育人抗体nk-1r(novus,nb300-119ss,稀释度1:200)、p-erk1/2(cellsignaltechnology,#4370s,1:100)、c-myc(abcam,ab32072,1:400)、abcc1(abclonal,a11153,1:400)、abcg2(abclonal,a5661,1:400)、p-perk(affinity,df7576,1:100)、atf-4(bioworldtechnology,bs1026,1:400)、chop(k121)(bioworldtechnology,bs1136,1:400)在4℃下过夜。洗涤切片并与生物素化的小鼠/兔二抗结合。免疫染色用二氨基联苯胺检测试剂盒(dab-0031,福州迈新)进行可视化,然后将切片用苏木精复染,脱水,清除并盖玻片。
1.9统计分析。每个实验至少进行三次。数据表示为平均值±sem(平均值的标准误差)。均值之间差异的统计显著性是通过方差单向分析(anova),然后通过dunnett检验进行事后多重比较确定的。*p<0.05,**p<0.01,***p<0.001被认为是显著的。
2实验结果
化学疗法是crc患者的常规疗法之一。尽管5-氟尿嘧啶(5-fu),伊立替康(一种活性代谢产物为sn-38)和奥沙利铂作为一线化疗药物可有效提高crc患者的生存率,但严重的副作用和耐药性的形成仍是临床化疗有效性的障碍[29,30]。
如图1所示,通过在oncomine数据库中分析crc的药物敏感和耐药细胞株的tacr1(nk-1r的编码基因)和tac1(sp的编码基因)的mrna表达水平和拷贝数水平,本发明的发明人发现两者在对一系列化学疗法具有抗性的crc细胞系中,mrna表达水平显著升高,这表明sp/nk-1r信号传导可能有助于化学耐药性的发展。
由于nk-1r拮抗剂通过与化学治疗药物不同的机制发挥有效的抗肿瘤作用,因此本发明的发明人推测nk-1r拮抗剂的组合将改善结肠癌化疗的疗效。
如图2所示,与单药处理相比,nk-1r拮抗剂sr140333或aprepitant与5-fu或sn-38的组合显著降低了细胞活力,表明nk-1r拮抗剂促进结直肠癌细胞的化疗敏感性。
为了研究nk-1r拮抗剂是否可以规避获得性化疗耐药,本发明的发明人研究了nk-1r拮抗剂在对5-fu耐药的人结肠癌hct116细胞(hct116/5-fu细胞)中的功效。
如图3所示,与亲本hct116细胞相比,hct116/5-fu细胞在5-fu存在下显示出降低的药物反应和增强的细胞活力,伴随经典的化疗药物耐药蛋白p-gp、mrp1(abcc1)和bcrp(abcg2)的上调。同时注意到在hct116/5-fu细胞中sp和nk-1r表达水平增加,提示sp/nk-1r信号传导介导结肠癌细胞对5-fu的耐药性。
如图4、图5所示,令人惊讶的是,用nk-1r拮抗剂sr140333或阿瑞匹坦治疗可显著提高hct116/5-fu细胞对5-fu的敏感性,达到与亲代细胞相当的水平,对5-fu的这种改善的反应伴随着p-gp,abcc1和abcg2的表达水平降低。
如图6、图7所示,重要的是,用sr140333或阿瑞匹坦治疗降低了p-erk和c-myc的表达水平,同时上调了p-perk,p-eif2a和atf4的表达水平。因此,阻断nk-1r信号传导通过抑制er应激(upr的perk分支)诱导erk-c-myc信号传导,从而改善了耐药结肠癌细胞对5-fu的反应。
为了进一步评估联合nk-1r拮抗剂在体内克服化疗耐药的功效,本发明的发明人将hct116/5-fu细胞皮下接种到裸鼠中,然后用nk-1r拮抗剂sr140333或aprepitant单独或联合5-fu药物治疗。
如图8、图9所示,与5-fu组相比,在联合治疗组中观察到hct116/5-fu细胞异种移植瘤的肿瘤大小、生长速率和肿瘤重量显著降低。本发明的发明人没有观察到五组之间在整体外观,体重,器官指数,器官的微观解剖学上有明显的毒性。
本发明的发明人进一步表征了体内联合治疗疗效提高的分子机制。
如图10所示,与体外结果相符,sr140333或aprepitant与5-fu的组合与5-fu单独治疗相比可降低p-erk1/2、c-myc、abcc1和abcg2的表达水平,并增加p-perk、atf-4和chop的表达。这些结果表明,nk-1r拮抗剂通过激活er应激(upr的perk-eif2α-atf-4分支)降解c-myc,在体外和体内克服了对5-fu的耐药性。
如图11所示,总的来说,这项研究揭示了一种新的分子机制,涉及crc中nk-1r阻断通过诱导er应激和erk信号通路的抑制以促进c-myc蛋白下调从而抑制肿瘤细胞生长,这对于增强crc细胞对化疗药物的敏感性并逆转crc对化疗的耐药性是有益的。
类似地,与单药处理相比,nk-1r拮抗剂sr140333或aprepitant与奥沙利铂的组合显著降低了细胞活力,表明nk-1r拮抗剂促进结直肠癌细胞的化疗敏感性。
这些新颖的机制发现揭示了人crc中nk-1r介导的gpcr信号传导下游的分子事件,并有助于临床试验的合理设计,以测试nk-1r拮抗剂在crc治疗中的应用,尤其是在化疗耐药的crc中的应用。
本领域普通技术人员应当理解,可以在本发明的实践中采用除具体例示那些外的方法和原材料等而无需过度实验。任何此类方法和原材料等的所有的本领域已知的功能等价物都预期包括在本发明中。本领域技术人员还应当理解,可对本说明书及权利要求书中描述的本发明进行各种变动和修饰,且本发明包括所有此类变动和修饰。本发明还包括本说明书中单独或同时提及或指出的所有步骤、特征、组合物和化合物,以及所述步骤或特征中的任何2个或更多个的任何和所有组合。
参考文献:
1.ferlayj,etal.(2020)globalcancerobservatory:cancertoday.internationalagencyforresearchoncancerhttps://gco.iarc.fr/today.
2.siegelrl,etal.(2020)colorectalcancerstatistics,2020.cacancerjclin70(3):145-164.
3.millerkd,etal.(2019)cancertreatmentandsurvivorshipstatistics,2019.cacancerjclin69(5):363-385.
4.greendp,limjunyawongn,gourn,pundirp,&dongx(2019)amast-cell-specificreceptormediatesneurogenicinflammationandpain.neuron101(3):412-420e413.
5.
6.kimdj,etal.(2020)substancepimprovesrenalischemiareperfusioninjurythroughmodulatingimmuneresponse.frontimmunol11:600.
7.bakirtzik,iliopoulosd,&pothoulakisc(2017)substancep-inducedcolonicepithelialcell-secretedexosomesexacerbateexperimentalcolitisandregulatecellproliferationandmigrationviaexosomalmir-21.gastroenterology152(5):s103.
8.steinhoffms,vonmentzerb,geppettip,pothoulakisc,&bunnettnw(2014)tachykininsandtheirreceptors:contributionstophysiologicalcontrolandthemechanismsofdisease.physiologicalreviews94(1):265-301.
9.munozm&covenasr(2020)neurokininreceptorantagonism:apatentreview(2014-present).expertopintherpat30(7):527-539.
10.lium,etal.(2015)neurokinin-1receptorantagonistsinpreventingpostoperativenauseaandvomiting:asystematicreviewandmeta-analysis.medicine(baltimore)94(19):e762.
11.kharevk,albinoap,&reedja(1998)theneuropeptide/mastcellsecretagoguesubstancepisexpressedincutaneousmelanocyticlesions.journalofcutaneouspathology25(1):2-10.
12.bishopa,etal.(1989)expressionoftachykininsbyilealandlungcarcinoidtumorsassessedbycombinedinsituhybridization,immunocytochemistry,andradioimmunoassay.cancer63(6):1129-1137.
13.patelhj,ramkissoonsh,patelps,&rameshwarp(2005)transformationofbreastcellsbytruncatedneurokinin-1receptorissecondarytoactivationbypreprotachykinin-apeptides.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica102(48):17436-17441.
14.mayordomoc,etal.(2012)targetingofsubstancepinducescancercelldeathanddecreasesthesteadystateofegfrandher2.journalofcellularphysiology227(4):1358-1366.
15.singhd,etal.(2000)increasedexpressionofpreprotachykinin-iandneurokininreceptorsinhumanbreastcancercells:implicationsforbonemarrowmetastasis.proceedingsofthenationalacademyofsciences97(1):388-393.
16.akazawat,etal.(2009)aconstitutivelyactiveformofneurokinin1receptorandneurokinin1receptor-mediatedapoptosisinglioblastomas.journalofneurochemistry109(4):1079-1086.
17.moul,etal.(2013)neurokinin-1receptordirectlymediatesgliomacellmigrationbyup-regulationofmatrixmetalloproteinase-2(mmp-2)andmembranetype1-matrixmetalloproteinase(mt1-mmp).journalofbiologicalchemistry288(1):306-318.
18.huangc,etal.(2018)mmp1/par1/sp/nk1rparacrineloopmodulatesearlyperineuralinvasionofpancreaticcancercells.theranostics8(11):3074-3086.
19.delvallenm,etal.(2018)communicationbetweenentericneurons,glia,andnociceptorsunderliestheeffectsoftachykininsonneuroinflammation.cellmolgastroenterolhepatol6(3):321-344.
20.munozm,rossom,&covenasr(2019)neurokinin-1receptorantagonistsagainsthepatoblastoma.cancers(basel)11(9).
21.nizame,koksoys,&erinn(2020)nk1rantagonistdecreasesinflammationandmetastasisofbreastcarcinomacellsmetastasizedtoliverbutnottobrain;phenotype-dependenttherapeuticandtoxicconsequences.cancerimmunolimmunother69(8):1639-1650.
22.rossom,munozm,&bergerm(2012)theroleofneurokinin-1receptorinthemicroenvironmentofinflammationandcancer.scientificworldjournal2012:381434.
23.gillespiee,etal.(2011)truncatedneurokinin-1receptorisincreasedincolonicepithelialcellsfrompatientswithcolitis-associatedcancer.proceedingsofthenationalacademyofsciences108(42):17420-17425.
24.chenxy,etal.(2016)highexpressionofsubstancepanditsreceptorneurokinin-1receptorincolorectalcancerisassociatedwithtumorprogressionandprognosis.oncotargets&therapy9:3595-3602.
25.rossom,robles-fríasmj,
26.garniera,etal.(2015)targetingtheneurokinin-1receptorinhibitsgrowthofhumancoloncancercells.internationaljournalofoncology47(1):151-160.
27.munozm&rossom(2010)thenk-1receptorantagonistaprepitantasabroadspectrumantitumordrug.investnewdrugs28(2):187-193.
28.munozm,rossom,&covenasr(2017)thenk-1receptorantagonistl-732,138inducesapoptosisinhumangastrointestinalcancercelllines.pharmacolrep69(4):696-701.
29.wuc(2018)systemictherapyforcoloncancer.surgoncolclinnam27(2):235-242.
30.mcwilliamsrr,etal.(2017)northcentralcancertreatmentgroupn0543(alliance):aphase2trialofpharmacogenetic-baseddosingofirinotecan,oxaliplatin,andcapecitabineasfirst-linetherapyforpatientswithadvancedsmallboweladenocarcinoma.cancer123(18):3494-3501.
- 还没有人留言评论。精彩留言会获得点赞!