一种MLN4924在制备预防或治疗APAP诱导急性肝损伤药物中的应用
一种mln4924在制备预防或治疗apap诱导急性肝损伤药物中的应用
技术领域
1.本发明涉及生物医学技术领域,特别是转录组学及药理活性领域,具体涉及一种mln4924在制备预防或治疗apap诱导急性肝损伤药物中的应用。
背景技术:
2.对乙酰氨基酚(acetaminophen,apap)在20世纪50年代被批准用于临床,目前是世界上广泛使用的解热镇痛药之一。但由于其安全治疗剂量较窄,apap诱发的肝毒性成了世界许多国家药物性肝损伤的重要原因。对于ugt、sult酶活性降低的人群,葡萄糖醛酸化和硫酸化障碍,apap代谢受阻。磺基转移酶基因的非同义编码单核苷酸多态性(non
‑
synonymous coding snps,nssnps)不同,以及降低葡萄糖醛酸化都可能影响肝脏的药代动力学,使得某些个体更易发生对apap诱导的急性肝功能衰竭(acute liver failure,alf)造成对肝脏损伤。
3.neddylation修饰是一种类泛素化蛋白翻译后修饰方式,其通过e1激活酶(nae)、e2结合酶、e3连接酶三级酶联反应,将类泛素小分子nedd8(neural precursor cell
‑
expressed developmentally downregulated 8)共价偶联到底物蛋白上,进而影响底物蛋白的稳定性、构象和功能等,调控诸多生物学过程,在细胞正常生理活动的多个关键环节中具有重要调控作用。
4.mln4924是一种有效的、选择性nae抑制剂,ic50为4.7nm,而密切相关的酶uae、sae、uba6和atg7的ic50分别为1.5、8.2、1.8和>10μm。在纯化的酶和细胞测定中,mln4924与密切相关的泛素激活酶(uae,也称为uba1)和sumo激活酶(sae;sae1和uba2亚基的异二聚体)相比,选择性地抑制nae活性。mln4924对多种人类肿瘤来源的细胞系具有强烈的细胞毒活性。但尚未存在将其作用于在制备预防或治疗apap诱导急性肝损伤药物中的应用。
5.转录组学以其不断增加的覆盖范围及其内在的高通量能力在许多领域中得到广泛应用,如疾病诊断和治疗、药物毒性研究,生物标志物发现以及疾病机制研究等。现有技术缺少一种通过转录组学相关机理预先或同时使用药物保护肝脏免受apap损伤的研究。因此,apap诱导急性肝脏损伤中neddylation修饰的变化,及mln4924在制备预防或治疗apap诱导急性肝损伤药物中的应用,已成为亟需解决的问题。
技术实现要素:
6.鉴于解决现有技术缺陷的目的,本发明提出一种mln4924在制备预防或治疗apap诱导急性肝损伤药物中的应用。
7.为实现上述目的,本发明的技术方案为:提出了apap诱导急性肝损伤模型,并试验说明肝损伤、凋亡、免疫细胞招募等相关机制变化;进一步提出apap诱导肝损伤模型体内体外试验中,neddylation修饰均存在增强;进一步提出以mln4924作用于制备预防或治疗apap诱导急性肝损伤药物,通过肝损伤模型,所述mln4924具备抑制neddylation修饰作用;
经mln4924作用,apap诱导肝损伤中中性粒细胞招募显著降低;提出mln4924保护apap诱导肝损伤细胞因子变化机制,证实肝损伤程度降低。
8.优选地,所述mln4924抑制neddylation修饰。
9.优选地,所述mln4924抑制neddylation修饰包括构建apap诱导急性肝损伤模型,将mln4924作用于小鼠,应用于制备预防或治疗apap诱导急性肝损伤药物。
10.优选地,所述mln4924作用步骤包括:
11.(1)建立apap诱导急性肝损伤模型,明确试验动物类别、种类、数量及apap用药方式及剂量;
12.(2)通过apap诱导肝损伤模型体内、体外试验,明确neddylation修饰的变化;
13.(3)将mln4924作用于肝损伤模型,明确所述mln4924对neddylation的修饰作用及相关剂量;
14.(4)将mln4924作用于肝损伤模型,明确所述apap诱导肝损伤中中性粒细胞招募变化;
15.(5)将mln4924作用于肝损伤模型,确定mln4924保护apap诱导肝损伤细胞因子变化机制。
16.优选地,所述apap诱导急性肝损伤模型,包括对小鼠腹腔注射100~500mg/kg apap后,进行he染色、tunel染色、f4/80的免疫组化染色。
17.优选地,所述apap诱导肝损伤模型体内、体外试验,包括在100~500mg/kg apap注射后取0~4h不同时间点小鼠新鲜肝组织,用预冷的pbs缓冲液洗涤、液氮研磨,分离肝组织的线粒体和胞浆蛋白,用ripa蛋白裂解液充分裂解线粒体,与分离出的胞浆蛋白共同制备样品,进行western blot实验,检测neddylation修饰水平变化。
18.优选地,所述mln4924对neddylation的修饰作用,包括:
19.(1)用dmso溶解mln4924,按照剂量20~100mg/kg对小鼠进行腹腔注射,对照小鼠注射同等体积的dmso,每只小鼠注射体积不超过70μl。在给药后的12h处死小鼠,收取肝组织样品进行western blot实验,检测体内neddylation整体修饰水平;
20.(2)按照上述步骤,提前12h对小鼠进行dmso、mln4924处理,然后再腹腔注射500~900mg/kg的apap溶液,对照小鼠注射同等体积的无菌生理盐水,apap处理后的12h再次注射同等剂量的dmso、mln,持续抑制实验组小鼠体内的neddylation水平;
21.(3)在同等dmso、mln4924处理下,给予小鼠200~500mg/kg剂量的apap,在0~12h取不同时间点对小鼠采血,收集血清测转氨酶。
22.优选地,所述apap诱导肝损伤中中性粒细胞招募变化,包括:
23.(1)对小鼠按照体重给予200~500mg/kg apap剂量进行腹腔注射,对照组注射同等体积的无菌生理盐水;药物注射后12h,将小鼠颈椎脱臼法处死取出完整肝组织,分离肝组织内所有单个核细胞,进行免疫细胞表面标志分子染色和流式细胞术分析;
24.(2)观察mln4924抑制neddylation修饰后,apap诱导肝损伤中中性粒细胞招募变化,在dmso、mln预处理12h后,按照体重给予小鼠200~500mg/kg的apap溶液;药物注射后12h,分离肝组织内的免疫细胞,对中性粒细胞进行流式细胞术染色分析。
25.优选地,所述mln4924保护apap诱导肝损伤细胞因子变化机制,包括使用20~100mg/kg mln4924预处理小鼠12h,然后小鼠腹腔注射200~500mg/kg apap,1h后取出肝脏
然后放在液氮保存,进行高通量测序。
26.优选地,所述c57bl/6雄性以及雌性野生型小鼠,6
‑
8周龄,spf级。
27.优选地,所述mln4924购自美国active biochem,货号为a
‑
1139。
28.相对于现有技术,本发明的技术方案具有如下有益效果:本发明通过mln4924在制备预防或治疗apap诱导急性肝损伤药物中的应用,具备有效降低由apap诱导急性肝损伤的有益效果。
附图说明
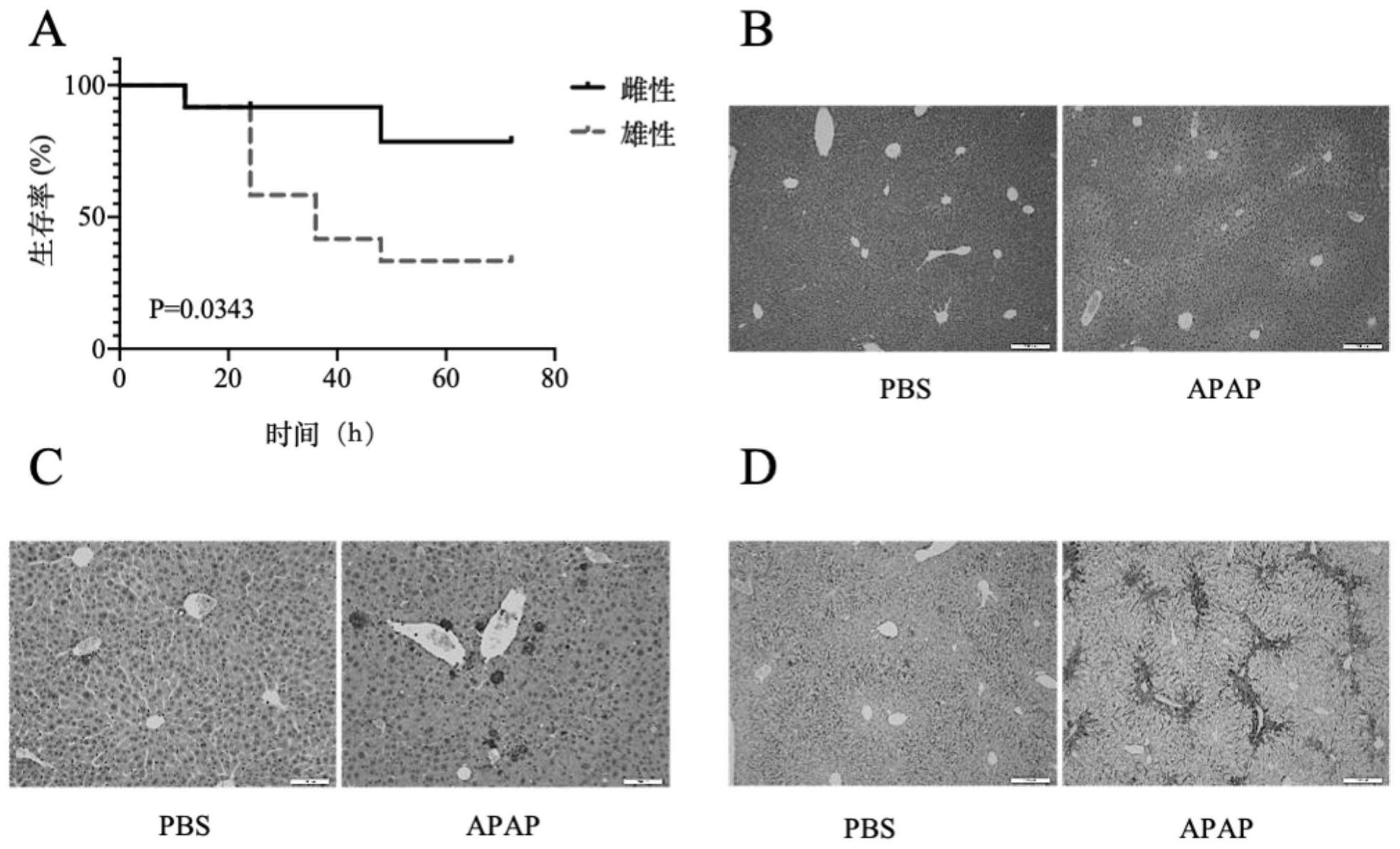
29.图1示出了apap诱导急性肝损伤模型建立的生存曲线分析及相关染色图。(a)雌性、雄性小鼠分别腹腔注射700mg/kg apap,小鼠生存曲线。生存曲线采用log
‑
rank检验,n=12,雄性的死亡率明显高于雌性。p<0.05认为差异有统计学意义。(b)apap诱导野生型小鼠急性肝损伤的肝脏病理he染色,小鼠腹腔注射350mg/kg apap,以注射相同体积pbs为对照,诱导肝损伤6h,取肝脏组织进行he染色。(c)小鼠腹腔注射350mg/kg apap,以注射相同体积pbs为对照,诱导肝损伤6h后,取肝脏组织进行tunel染色。(d)小鼠腹腔注射350mg/kg apap,以注射相同体积pbs为对照,诱导肝损伤诱导肝损伤48h后,取肝脏组织进行f4/80免疫组化染色。
30.图2示出了apap诱导急性肝损伤模型中neddylation修饰的变化相关western blot及免疫组化染色图。(a)小鼠腹腔注射350mg/kg apap,在0h、0.5h、1h、2h、4h分别取肝脏组织,通过western blot实验检测nedd8对细胞浆、线粒体底物的整体修饰水平,vdac3为线粒体蛋白内参、gapdh为细胞浆蛋白内参。(b)小鼠腹腔注射350mg/kg apap,以注射相同体积pbs为对照,4h后取肝脏组织进行nedd8免疫组化染色。
31.图3示出了通过mln4924抑制neddylation修饰,apap诱导肝损伤变化相关电泳及分析图。(a)小鼠注射mln4924,肝脏neddylation抑制情况。60mg/kg mln4924腹腔注射小鼠,12h后取肝组织通过western blot实验测肝脏neddylation水平,β
‑
actin为内参,1、2为不同小鼠所做的重复实验。(b)mln4924抑制小鼠neddylation,apap诱导急性肝损伤模型小鼠生存率。60mg/kg mln4924预处理小鼠12h,以注射相同体积dmso为对照,然后700mg/kg apap腹腔注射小鼠,绘制小鼠生存曲线,采用log
‑
rank检验,n=18。(p<0.05认为差异有统计学意义)(c)60mg/kg mln4924预处理小鼠12h,然后腹腔注射350mg/kg apap,12h后取肝脏组织进行he染色。(d)60mg/kg mln4924腹腔注射小鼠12h后,然后700mg/kg apap腹腔注射小鼠,不同时间ast、alt转氨酶水平变化,以注射相同体积dmso为对照,采用t检验进行统计分析,n=3。(***p<0.001,ns:无明显差异,p<0.05认为差异有统计。)
32.图4示出了mln4924抑制neddylation修饰,apap诱导肝损伤中中性粒细胞招募变化相关流式细胞染色分析图。(a)小鼠腹腔注射350mg/kg apap,以注射相同体积pbs为对照,12h后取肝组织进行单个核细胞的分离纯化,然后进行免疫细胞表面标志分子染色和流式细胞术分析,以cd45
+
/ssc设门,采用t检验进行统计分析,n=3。(b)60mg/kg mln4924预处理小鼠12h,然后腹腔注射350mg/kg apap,以注射相同体积pbs为对照,12h后取肝组织进行单个核细胞的分离纯化,然后进行免疫细胞表面标志分子染色和流式细胞术分析,以cd45
+
/ssc设门,采用t检验进行统计分析,n=4。(**p<0.01,***p<0.001,p<0.05认为差异有统计学意义)
33.图5示出了mln4924抑制neddylation修饰,apap诱导肝损伤中高通量测序分析趋化因子相关图。
具体实施方式
34.为了充分了解本发明的目的、特征及功效,通过下述具体实施方式,对本发明作详细说明。除非另有说明,否则本发明中涉及的技术术语均具有本领域技术人员通常理解的含义。
35.原代肝细胞维持补剂、无酚红william's e medium培养基、线粒体分离试剂盒、ecl发光液、蛋白marker购自购自美国thermo公司;mln4924购自公司美国active biochem(货号a
‑
1139);nedd8、etfa抗体购自美国abcam公司;cullin1、β
‑
actin、gapdh(glyceraldehyde
‑3‑
phosphate dehydrogenase)抗体购自美国santa cruz公司;vdac3抗体购自proteintech公司;dab显色试剂盒、辣根过氧化物酶标记的山羊抗小鼠和山羊抗兔igg二抗购自北京中杉金桥公司;pvdf膜购自美国millipore公司。组织固定液购自武汉赛维尔生物科技有限公司;percoll分离液购自美国pharmacia(ge)公司;cd45流式抗体、cd11b流式抗体、gr1流式抗体均购自美国biolegend公司。
36.c57bl/6雄性以及雌性野生型小鼠,6
‑
8周龄,spf级,购于北京斯贝福实验动物技术有限公司。
37.主要仪器设备
38.co2培养箱购自美国thermo公司;低温高速冷冻离心机购自德国eppendorf公司;紫外分光光度计购自北京普析通用仪器有限责任公司;sds
‑
page蛋白电泳及转印仪购自美国bio
‑
rad公司;流式细胞仪购自美国bd公司;微量移液器购自德国eppendorf公司。
39.统计学分析
40.应用spss 20.0对所有数据进行统计学分析。计量资料结果以均数
±
标准差(mean
±
sd)表示。组间比较采用t检验统计分析,生存曲线采用log
‑
rank(mantel
‑
cox)检验。*p<0.05,**p<0.01,***p<0.001,ns,not significant,p<0.05认为差异有统计学意义。
41.实施例1
42.本实施例提出了apap诱导急性肝损伤模型建立及相关机制。
43.一、实验方案设计
44.过量apap诱导小鼠急性肝损伤模型是一种经典的药物性肝损伤模型。既往研究表明,apap肝损伤严重程度与小鼠性别有一定关系。为更好地建立该模型,我们购买了6
‑
8周龄的c57bl/6小鼠,雄性和雌性各12只,统计72小时内小鼠的存活率。为了进一步研究apap诱导野生小鼠急性肝损伤模型的各项指标,对小鼠腹腔注射350mg/kg apap后,通过he染色、tunel染色、f4/80免疫组化染色等方法观察apap诱导急性肝损伤模型中,小鼠的肝损伤、细胞凋亡、免疫细胞招募等情况。
45.二、结果分析
46.结果显示,小鼠腹腔注射700mg/kg apap,注射后6小时开始出现死亡现象,统计72小时内小鼠的存活率,可以发现,在同等剂量用药情况下雌鼠更加耐受。apap注射72小时,12只雌鼠有10只存活,而雄鼠仅有4只存活,雄鼠的存活率明显低于雌鼠(33.3%vs 83.3%),采用log
‑
rank(mantel
‑
cox)检验,p=0.0343,n=12,差异具有统计学意义,和既
往研究一致(图1a)。因此实验后续小鼠均选择6
‑
8周龄的c57bl/6雄性小鼠。为了进一步研究apap诱导野生小鼠急性肝损伤模型的各项指标,对小鼠腹腔注射300mg/kg apap,注射后6h取肝组织,he染色结果显示,与对照组相比,药物注射6h开始出现了肝脏小叶中央区的坏死现象(图1b);进一步对切片进行了tunel组化染色,与对照组相比,药物注射6h出现了tunel染色阳性,提示肝细胞发生了凋亡(图1c)。f4/80的免疫组化染色表明,与对照组相比,注射apap后48h,肝脏招募了大量f4/80阳性的巨噬细胞,肝血窦存在严重炎性细胞浸润,炎性细胞主要在肝静脉血管富集(图1d)。
47.实施例2
48.本实施例提出了apap诱导急性肝损伤模型中neddylation修饰的变化。
49.一、实验方案设计
50.经前期研究证实,线粒体内能够发生neddylation修饰。基于此,本实验方案设计分为体内实验和体外实验,研究apap诱导急性肝损伤模型中neddylation修饰变化情况。在动物实验中,在350mg/kg apap注射后,分别于0,0.5,1,2,4小时5个时间点颈椎脱臼处死小鼠,取大约100mg新鲜肝组织,用预冷的pbs缓冲液洗涤两遍,然后液氮研磨,分离肝组织的线粒体和胞浆蛋白。用ripa蛋白裂解液充分裂解线粒体,然后和分离出的胞浆蛋白一起制备样品,进行western blot实验,检测neddylation修饰水平的变化。
51.二、结果分析
52.结果显示,在线粒体中,随着药物作用时间的延长,nedd8对底物的整体修饰不断增强,而胞浆中neddylation水平没有明显的变化。而cullin1蛋白是nedd8经典底物cullins家族成员,线粒体cullin1的修饰带随着apap注射时间延长而增多,从侧面反映了nedd8对底物修饰的整体增强(图2a)。同样地,apap注射4h的肝组织免疫组化染色中,nedd8水平也明显高于对照组(图2b)。
53.实施例3
54.本实施例提出了以mln4924抑制neddylation修饰,分析apap诱导小鼠急性肝损伤变化。
55.一、实验方案设计
56.小鼠体内注射mln4924抑制neddylation修饰,分析apap诱导小鼠急性肝损伤变化。初期的实验发现小鼠体内注射过量的apap,在损伤肝细胞的同时伴随着neddylation修饰增强,我们进一步研究了通过mln4924抑制体内的neddylation修饰,apap诱导急性肝损伤中的作用变化及其相关机制。用dmso溶解mln4924,按照剂量60mg/kg对小鼠进行腹腔注射,对照小鼠注射同等体积的dmso,每只小鼠注射体积不超过70μl。在给药后的12h处死小鼠,收取肝组织样品进行western blot实验,检测体内neddylation整体修饰水平。按照上述步骤,对小鼠进行mln4924预处理12h,以dmso为对照,然后再腹腔注射700mg/kg的apap溶液,对照小鼠注射同等体积的无菌生理盐水,apap处理后的12h再次注射同等剂量的mln4924,以dmso为对照,持续抑制实验组小鼠体内的neddylation水平。mln4924预处理12h,以dmso为对照,给予小鼠350mg/kg剂量的apap,在0h,6h,12h对小鼠进行眼眶后静脉丛采血,然后收集血清测转氨酶。
57.二、结果分析
58.结果发现,60mg/kg mln4924腹腔注射12小时后,对照小鼠注射同等体积的dmso,
mln4924组小鼠出现了明显的neddylation修饰减弱,证明mln4924能有效抑制小鼠neddylation(图3a)。60mg/kg mln4924腹腔注射,对照小鼠注射同等体积的dmso,12小时后注射700mg/kg apap,apap处理后的12h再次注射同等剂量的mln4924,对照小鼠注射同等体积的dmso(mln—apap—mln)。观察两组小鼠72小时死亡率,mln4924组小鼠的死亡率明显降低,p<0.01(图3b)。mln4924预处理12h,以dmso为对照,再注射350mg/kg apap,12小时后取肝脏组织做he染色,结果发现mln4924组小鼠肝损伤面积较对照组小(图3c)。并且,mln4924组小鼠血清血清alt、ast转氨酶水平明显低于对照组,差异具有统计学意义,***p<0.001(图3d)。
59.实施例4
60.本实施例提出了mln4924抑制neddylation修饰,apap诱导肝损伤中中性粒细胞招募变化试验。
61.一、实验方案设计
62.对6
‑
8周龄的c57bl/6雄性小鼠,按照体重给予350mg/kg apap剂量进行腹腔注射,对照组注射同等体积的无菌生理盐水。药物注射后12h,将小鼠颈椎脱臼法处死取出完整肝组织,分离肝组织内所有单个核细胞,进行免疫细胞表面标志分子染色和流式细胞术分析。为了进一步观察mln4924抑制neddylation修饰后,apap诱导肝损伤中中性粒细胞招募变化,mln4924预处理12h,对照小鼠注射同等体积的dmso,再给予小鼠350mg/kg的apap溶液。药物注射后12h,分离肝组织内的免疫细胞,对中性粒细胞进行流式细胞术染色分析。
63.二、结果分析
64.染色结果发现由cd45
+
cd11b
+
gr1
+
标记的中性粒细胞在apap诱导的急性肝损伤中,细胞比例明显增多,差异具有统计学意义,***p<0.001(图4a)。mln4924抑制neddylation修饰后,mln4924组cd45
+
cd11b
+
gr1
+
标记的中性粒细胞比例较对照组显著降低,差异具有统计学意义,**p<0.01(图4b)。
65.实施例5
66.本实施例提出了mln4924保护apap诱导肝损伤细胞因子变化机制
67.一、实验方案设计
68.为了进一步探究mln4924影响apap损伤过程中肝脏中性粒细胞水平变化的机制,我们使用60mg/kg mln4924预处理小鼠12h,对照小鼠注射同等体积的dmso,然后小鼠腹腔注射350mg/kg apap 1h,取出肝脏然后放在液氮保存,送往北京诺禾致源科技股份有限公司进行高通量测序。
69.二、结果分析
70.髓系细胞在急性损伤中向肝脏迁移需要趋化因子和趋化因子受体的相互作用,也包括整合素和粘附因子之间的作用。测序结果表明,apap剂量腹腔注射后,mln4924组的cxcl1较对照组降低,导致招募的中性粒细胞减少,从而减少了肝损伤(图5)。
71.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的替代、修饰、组合、改变、简化等,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1