一种具有载药功能的医用敷料的制备方法
本发明属于生物医用纺织品领域,具体是一种具有载药功能的医用敷料的制备方法。
背景技术:
对于急性创面,创面有大量出血,传统的止血敷料不能快速完全的止血,需要在敷料中添加止血药物来达到快速止血的效果,或者在治疗慢性伤口时,需要在敷料中添加抗菌药物,治疗炎症,所以医用敷料需要具有一定的载药性能。
传统的伤口敷料例如纱布等,能够保护创面免受机械性损伤以及减少环境中的细菌入侵,并且具有良好的透气性及透湿性,可用于治疗浅表性的伤口,但是纱布等传统敷料的屏障作用较差,细菌入侵的可能性较高,并且对创面愈合无明显促进作用。因此研究和开发出具有载药功能的医用敷料具有深刻的意义。近年来,随着制造技术的发展,生物医学工业开始着重于开发控制药物输送系统。纳米介孔二氧化硅具有超高的比表面积,负载的药物不仅仅可以粘附在微球表面,也可以吸附于纳米介孔二氧化硅的孔洞内,所以可以通过物理包埋纳米介孔二氧化硅作为药物载体。丝素蛋白具有良好的生物相容性和优良的机械性能,壳聚糖微球有粘附性号,表面富有多种基团等优点。同时静电喷涂技术能够生产生物相容和可生物降解的微米和纳米大小的颗粒,这些颗粒含有不同的治疗剂,在特定的时间内释放。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种制备具有载药功能的医用敷料的方法。
本发明的另一目的是提供上述制备方法获得的具有载药功能的医用敷料。
本发明的目的是通过下述技术方案予以实现的。
一种具有载药功能的医用敷料的制备方法,包括以下步骤。
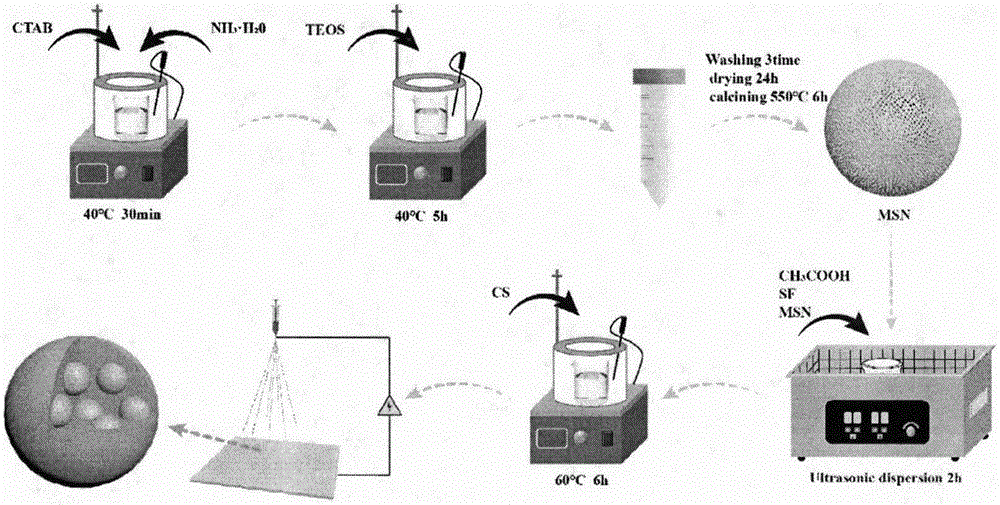
1)制备十六烷基三甲基溴化铵(ctab)溶液,缓慢滴入氨水,然后水浴加热搅拌。最后再加入正硅酸乙酯(teos),搅拌。将浑浊液体放入离心机中离心,得到白色潮湿粉末,用乙醇溶液洗涤三次。离心后,放入烘箱干燥。最后,将白色固体捣碎,煅烧。取出白色粉末后继续研磨,得到介孔纳米二氧化硅(msn)。
在所述步骤1)中,ctab溶液浓度为0.001~0.01mol/l,氨水滴加量为1~10ml。
在所述步骤1)中,水浴加热搅拌温度为30~70℃,时间为1~6小时,teos加入量为1~10ml。
在所述步骤1)中,第二次搅拌转速为100~500r/min。
在所述步骤1)中,乙醇溶液浓度为20%~95%。
在所述步骤1)中,烘箱温度为50~100℃。
在所述步骤1)中,煅烧是放在马弗炉中进行,时间为3~7小时。
2)将丝素蛋白(sf)水溶液与醋酸以一定比例混合,再加入一定浓度的壳聚糖(cs)。制备出sf/cs微球。观察形貌,确定最佳参数,进行下一步实验。
在所述步骤2)中,丝素蛋白溶液浓度为1%~30%,丝素蛋白与醋酸的比例为(5~60)∶(10~100)。
在所述步骤2)中,壳聚糖浓度为1%~5%,msn/cs=5wt%~15wt%。
3)配制sf水溶液与醋酸溶液以一定比例混合,再加入一定量的msn,超声。再加入壳聚糖,水浴加热搅拌。喷涂制备msn-sf/cs。将msn-sf/cs微球喷涂至sf/pcl-pva单向导水膜之上。
在所述步骤3)中,msn浓度为1%~20%,msn/cs=5wt%~15wt%,超声时间为2~4小时。
在所述步骤3)中,搅拌温度为20~80℃,喷涂为静电喷涂。
在所述步骤3)中,制备所述sf/pcl-pva单向导水膜的方法为:
步骤1,制备超亲水pva纳米纤维膜;
在上述技术方案中,制备超亲水pva纳米纤维膜的方法为:将pva溶于蒸馏水中制备成1%~20%(w/v)pva溶液,采用静电纺丝技术制备pva纳米纤维膜。将pva纳米纤维膜置于盛有1ml~50ml戊二醛和0.1ml~5ml盐酸的培养皿之上,放入密闭容器中,室温下交联。将0.01g~5gtris粉末和0.01g~5g多巴胺溶解在去离子水中,另外用0.01g~5gaptes溶于1ml~50ml乙醇溶液中来调节多巴胺溶液的ph值,制备ph为7~12的多巴胺溶液。
在所述步骤1中,室温下交联10h~24h。
步骤2,将再生丝素蛋白溶于甲酸溶液中,制备成1%~50%(w/v)的丝素蛋白溶液;将pcl溶于dmc溶液中,制备成1%~20%(w/v)的pcl溶液,利用静电纺将sf/pcl复合纳米纤维膜纺在pva纳米纤维膜上。
上述制备方法获得的具有载药功能的医用敷料。
与现有技术相比,本发明有益效果在于:
(1)利用静电喷涂技术制备了一种多级结构的药物载体,其主体结构为sf和cs微米级球体包覆高吸附性能的msn纳米级球体,提高微球的药物负载能力。由于cs的特性赋予了微球优异的抗菌性能,添加sf能增加细胞的粘附位点,加快伤口处细胞生长,促进伤口愈合。
(2)通过静电喷涂技术将制备的msn-sf/cs抗菌载药微球与单向导水复合膜结合在一起形成具有载药功能的医用敷料,解决单层纳米纤维膜对于伤口周围湿度控制力差,单向导水纳米纤维膜功能性不足等缺点。
附图说明
图1为本发明的msn-sf/cs微球的制备流程;
图2为本发明(a)msn的sem图像(b)msn的粒径分布曲线(c)msn的tem图像;
图3为本发明实施例1~3的静电喷涂sf/cs微球sem图像;
图4为本发明实施例1~3的静电喷涂sf/cs微球tem图像;
图5为本发明实施例2的ft-ir图像;
图6为本发明实施例2对于药物模型bsa的体外释放曲线;
图7为本发明实施例2对于大肠杆菌和金黄色葡萄球菌的抑菌效果,其中(ad)为空白对照组,(bc)和(ef)分别为sf/cs微球和实施例2;
图8为本发明实施例1~3的mtt分析;
图9为本发明实施例2中不同msn-sf/cs微球静电喷涂时间的复合纳米线纤维膜的水接触角测试;
图10为本发明实施例2中不同men-sf/cs微球静电喷涂时间复合纳米纤维膜的mmt分析,其静电喷涂时间分别为(a-d)0、10、20、30min。
具体实施方式
下面给出本发明的具体实施例。具体实施例仅用于进一步详细说明本发明,不限制本申请权利要求的保护范围。
实施例1
1)首先将0.32g十六烷基三甲基溴化铵(ctab)溶解在280ml去离子水中,搅拌30分钟,再缓慢滴入8ml氨水,然后40℃水浴加热并且搅拌30分钟。最后再加入2.44ml正硅酸乙酯(teos),搅拌5h。将浑浊液体放入离心机中离心,得到白色潮湿粉末,用75%乙醇溶液洗涤三次。离心后,放入70℃烘箱干燥。最后,将白色固体捣碎,在马弗炉中煅烧6小时。取出白色粉末后继续研磨,得到介孔纳米二氧化硅(msn)。
2)将10%丝素蛋白(sf)水溶液与90%乙酸混合,混合比例为10∶90。再加入2.0%壳聚糖(cs)。制备出sf/cs微球。
3)配制10%的sf水溶液与90%醋酸溶液以10∶90比例混合,加入5%的msn(msn/cs=5wt%),超声2h。再加入2.0%壳聚糖,在60℃环境下搅拌。采用静电喷涂方法制备msn-sf/cs,将msn-sf/cs微球喷涂至sf/pcl-pva单向导水膜之上。
实施例2
1)首先将0.32g十六烷基三甲基溴化铵(ctab)溶解在280ml去离子水中,搅拌30分钟,再缓慢滴入8ml氨水,然后40℃水浴加热并且搅拌30分钟。最后再加入2.44ml正硅酸乙酯(teos),搅拌5h。将浑浊液体放入离心机中离心,得到白色潮湿粉末,用75%乙醇溶液洗涤三次。离心后,放入70℃烘箱干燥。最后,将白色固体捣碎,在马弗炉中煅烧6小时。取出白色粉末后继续研磨,得到介孔纳米二氧化硅(msn)。
2)将10%丝素蛋白(sf)水溶液与90%乙酸混合,混合比例为10∶90,再加入2%壳聚糖(cs)。制备出sf/cs微球。
3)配制10%的sf水溶液与90%醋酸溶液以10∶90比例混合,加入10%的msn(msn/cs=10wt%),超声2h。再加入2.0%壳聚糖,在60℃环境下搅拌。采用静电喷涂方法制备msn-sf/cs,将msn-sf/cs微球喷涂至sf/pcl-pva单向导水膜之上。
实施例3
1)首先将0.32g十六烷基三甲基溴化铵(ctab)溶解在280ml去离子水中,搅拌30分钟,再缓慢滴入8ml氨水,然后40℃水浴加热并且搅拌30分钟。最后再加入2.44ml正硅酸乙酯(teos),搅拌5h。将浑浊液体放入离心机中离心,得到白色潮湿粉末,用75%乙醇溶液洗涤三次。离心后,放入70℃烘箱干燥。最后,将白色固体捣碎,在马弗炉中煅烧6小时。取出白色粉末后继续研磨,得到介孔纳米二氧化硅(msn)。
3)将10%丝素蛋白(sf)水溶液与90%乙酸混合,混合比例为10∶90,再加入2%壳聚糖(cs)。制备出sf/cs微球。
3)配制10%的sf水溶液与90%醋酸溶液以10∶90比例混合,加入15%的msn(msn/cs=15wt%),超声2h。再加入2.0%壳聚糖,在60℃环境下搅拌。采用静电喷涂方法制备msn-sf/cs,将msn-sf/cs微球喷涂至sf/pcl-pva单向导水膜之上。
由图2(a)可以观察到制备的介孔二氧化硅呈规则球状并且大小均匀,(c)显示制备的msn有明显和清晰的纳米孔道均匀散布在msn上。
由图3可以观察到,实施例1中msn浓度为5%时,所制备微球呈规则球状,微球尺寸相对均一;实施例2中当msn浓度增大到10%时,微球尺寸较均一;实施例3中当浓度达到15%时,微球外形表面不再光滑,有大量未被包覆的msn附着在sf/cs微球上。
由图4可以明确观察到,实施例1中msn浓度为5%时,有大量为包裹msn的sf/cs微球;实施例2中msn浓度10%时,sf/cs微球包覆了msn;实施例3中msn浓度为15%会出现未被包覆的msn聚集。
由图5可以观察到,sf/cs图谱中显示了壳聚糖和丝素蛋白的特征峰,没有新的特征峰产生,说明二者属于物理混合;实施例2中msn-sf/cs的图谱上,显示出了msn的si-o-si的特征峰,表明sf/cs微球成功负载上了msn。
由图6可以观察到,载药微球在释放药物时分为两个阶段,第一阶段为药物的突释阶段,sf/cs复合微球,在前一小时释放量大于实施例2的10%msn-sf/cs复合微球;第二阶段为药物的缓释阶段,实施例2的10%msn-sf/cs复合微球的释放量在缓释阶段高于sf/cs复合微球。
由图7可以观察到,微球对于大肠杆菌及金黄色葡萄球菌有一定的抑制作用,菌落数明显减少。加入10%msn后微球的抗菌性有所下降但同样具有良好的抗菌性能。
由图8可以观察到,与cs微球相比,sf/cs微球上的细胞活力更高。随着msn含量增加,细胞活力无明显的改变。并且可以观察到对于所有样品,第5天的l929细胞活性明显高于第1天。
由图9可以观察到,通过静电喷涂技术将msn-sf/cs微球喷涂至sf/pcl纳米纤维膜表面时,随着实施例2中msn-sf/cs微球的喷涂时间增加,接触角逐渐变大由115°升高至130°。
由图10可以观察到,停止供水后不同顶层厚度的纳米纤维膜的两层水分含量有非常明显的差异。图10(a)中显示下层(亲水层)的水分在停止供水后快速超越上层(疏水)水分并且上层水分逐渐减小,实现了单向导水的功能。在实施例2中复合上msn-sf/pcl微球(10min)后,如图10(b)中所示,下层水分也快速的超过了上层的水分,并且上层水分有明显的减小。随着静电喷涂的时间增加,复合膜的单向导水性能减弱,当喷涂时间达到30min时,水分几乎全部聚集在上层表面难以穿透复合膜达到下层。
以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!