一种干粉吸入剂及其制备方法和用途与流程
1.本发明涉及生物医药领域,具体涉及一种干粉吸入剂及其制备方法和用途。
背景技术:
2.本发明的发明人团队此前针对冠状病毒开发了一系列可以抑制病毒感染的ek1蛋白多肽,其由申请号为201610070216.4、发明名称为“广谱地抑制人类冠状病毒感染的多肽及其应用”的专利申请以及申请号为202010080751.4、发明名称为“多肽、其制备方法和用途”的专利申请记载。
3.目前常规使用的抑制人冠状病毒的方法为注射疫苗。但是,由于肌肉注射存在一定危险性,如热源反应以及注射安全的问题,并且存在一定的疼痛感,部分患者并不愿意接受。因此,需要研发一种能够让患者广泛接受,并且没有疼痛感,安全性高的制剂。
4.众所周知,冠状病毒病主要侵害宿主的呼吸系统,特别是肺部损伤,因此,为了使药物直达肺部,吸入制剂无疑是最优选择。而ek1蛋白的吸湿性极强,不耐高温,稳定性较弱,因此需要选择合理的制剂学方法才能够让它在药物制备及使用过程中保持稳定活性并发挥最大的效果。
5.目前常规保护蛋白药物的手段主要是干燥,而已有的干燥手段通常包含高温操作步骤,在该操作中蛋白极易降解或变性。因此需要开发适宜的蛋白药物制剂,以达到良好的蛋白药物保护效果。
技术实现要素:
6.发明要解决的问题
7.针对因ek1蛋白吸湿性强、不耐高温、稳定性弱而导致缺少其肺部给药的稳定剂型的问题,本发明提供了一种干粉吸入剂,并同时提供了其制备方法和用途。
8.用于解决问题的方案
9.第一方面,本发明提供了一种药物组合物,其包含如下以质量百分比计的组分:蛋白5%~7%、稀释剂67%~69%、助流剂22%~24%、表面活性剂1%~3%和保护剂0.5%~2%。
10.进一步地,在上述药物组合物中,所述蛋白包括ek1蛋白或其衍生物,其中,ek1蛋白包含以seq id no.1所示的序列;优选地,ek1蛋白衍生物包括胆固醇修饰的ek1蛋白;优选地,其中所述胆固醇修饰在ek1蛋白的c端进行;优选地,其中ek1蛋白在c端通过接头与胆固醇部分连接;优选地,其中所述接头是peg化的;优选地,其中ek1蛋白在c端通过接头与胆固醇修饰的半胱氨酸连接;优选地,其中所述接头包含(gsgsg)n,其中n为1或2;优选地,其中接头是-(gsgsg)n-dpeg4-,其中n为1或2;更优选地,所述ek1蛋白衍生物是sldqinvtfldleyemkkleeaikkleesyidlkel-(gsgsg)n-dpeg4-c-胆固醇,其中n为1或2。
11.进一步地,在上述药物组合物中,所述稀释剂包括甘露醇、海藻糖和乳糖中的至少一种;优选地,所述稀释剂包括甘露醇。
12.进一步地,在上述药物组合物中,所述助流剂包括亮氨酸、异亮氨酸、精氨酸和甘氨酸中的至少一种;优选地,所述助流剂包括亮氨酸。
13.进一步地,在上述药物组合物中,所述表面活性剂包括泊洛沙姆。
14.进一步地,在上述药物组合物中,所述保护剂包括聚乙二醇、羧甲基纤维素钠、聚乙二醇与羧甲基纤维素钠的组合中的一种或多种;优选地,所述保护剂包括聚乙二醇300、羧甲基纤维素钠、聚乙二醇300与羧甲基纤维素钠的组合中的一种或多种;更优选地,所述保护剂包括聚乙二醇300与羧甲基纤维素钠的组合,聚乙二醇300与羧甲基纤维素钠的质量比为3:1至1:3。
15.第二方面,本发明提供了上述药物组合物的制备方法,其包括如下步骤:将处方量的蛋白、稀释剂、助流剂、表面活性剂和保护剂溶于水中得到水溶液,用微孔滤膜过滤后喷雾干燥,即得;优选地,所述水的重量为所述蛋白、稀释剂、助流剂、表面活性剂和保护剂的总重量的100倍。
16.进一步地,在上述药物组合物的制备方法中,所述喷雾干燥包括如下工艺参数:进口温度为115~130℃,进液速度为4~6.5ml/min。
17.第三方面,本发明提供了上述药物组合物的使用方法,其包括如下步骤:将所述药物组合物加入到吸入装置中,再通过吸入装置施用于对其有需要的个体。
18.第四方面,本发明提供了一种预填装容器,其包含上述药物组合物。
19.第五方面,本发明提供了上述药物组合物在制备用于预防和/或治疗冠状病毒感染的药物或预填装容器中的用途;优选地,所述冠状病毒包括sars-cov、mers-cov、2019-ncov和hcov-229e。
20.发明的效果
21.通过上述技术方案的实施,本发明所提供的含有ek1蛋白的干粉吸入剂不仅可以直达肺部,同时其所使用的保护剂、稀释剂、助流剂以及优化后的喷雾干燥工艺可以保护ek1蛋白在喷雾干燥过程中不被高温降解,从而保证成品药物中蛋白具有良好活性。
附图说明
22.图1为ek1干粉吸入剂大鼠药代动力学实验操作模式图。
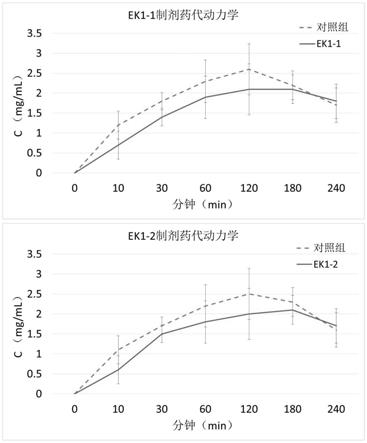
23.图2为ek1干粉吸入剂大鼠药代动力学曲线。
具体实施方式
24.以下对本发明的实施方式进行说明,但本发明不限定于此。本发明不限于以下说明的各构成,在发明请求保护的范围内可以进行各种变更,而适当组合不同实施方式、实施例中各自公开的技术手段而得到的实施方式、实施例也包含在本发明的技术范围中。
25.除非另有定义,本发明所用的技术和科学术语具有与本发明所属技术领域中的普通技术人员所通常理解的相同含义。
26.本说明书中,使用“数值a~数值b”或“数值a-数值b”表示的数值范围是指包含端点数值a、b的范围。
27.本说明书中,所提及的“一些具体/优选的实施方式”、“另一些具体/优选的实施方式”、“一些具体/优选的技术方案”、“另一些具体/优选的技术方案”等是指所描述的与该实
施方式有关的特定要素(例如,特征、结构、性质和/或特性)包括在此处所述的至少一种实施方式中,并且可存在于其它实施方式中或者可不存在于其它实施方式中。另外,应理解,所述要素可以任何合适的方式组合在各种实施方式中。
28.在本发明中,“冠状病毒”是指属于套式病毒目、冠状病毒科、冠状病毒属的病毒,例如严重急性呼吸道综合征冠状病毒sars-cov、中东呼吸道冠状病毒mers-cov、2019新型冠状病毒2019-ncov、人冠状病毒hcov-229e和类sars冠状病毒如rsshc014-cov和rsw1v1-cov等。
29.本发明所述ek1蛋白为申请号为201610070216.4、发明名称为“广谱地抑制人类冠状病毒感染的多肽及其应用”的专利申请以及申请号为202010080751.4、发明名称为“多肽、其制备方法和用途”的专利申请记载。
30.在本发明中,蛋白可以是衍生物形式。例如,ek1蛋白可以进行胆固醇修饰。胆固醇修饰的方法是公知的。蛋白与胆固醇部分连接,该连接可以是直接连接或者通过接头连接。
31.在本发明中,接头的长度可以有所变化。例如,接头可以是(gsgsg)n,其中n为大于等于1的整数,例如,n为1、2、3、4或5。
32.在本发明中,接头可以是peg化的。peg化修饰的手段对于本领域技术人员是已知的。如本文中使用,术语peg化接头是指接头附加有一个或者更多个peg。在本文中,peg化接头可以是peg化的(gsgsg)n。n为大于等于1的整数,例如,n为1、2、3、4或5。
33.在本发明中,“dpeg”是指离散聚乙二醇。dpeg4表示重复乙二醇残基的数目为4。
34.在一些具体的实施方式中,本发明所述的ek1蛋白包含以seq id no.1所示的序列(全长36aa,从n端至c段依次为sldqinvtfldleyemkkleeaikkleesyidlkel)。
35.在一些具体的实施方式中,本发明所述的ek1蛋白衍生物包括胆固醇修饰的ek1蛋白。
36.在一些具体的实施方式中,胆固醇修饰在ek1蛋白的c端进行。
37.在一些具体的实施方式中,ek1蛋白在c端通过接头与胆固醇部分连接。
38.在一些具体的实施方式中,接头是peg化的。例如,接头可以用dpeg进行peg化。
39.在一些具体的实施方式中,ek1蛋白在c端通过接头与胆固醇修饰的半胱氨酸连接。也就是说,ek1蛋白通过接头经半胱氨酸与胆固醇部分连接。
40.在一些具体的实施方式中,接头包含(gsgsg)n,其中n为大于等于1的整数,例如,n为1、2、3、4或5。
41.在一些具体的实施方式中,接头是-(gsgsg)n-dpeg4-,其中n为大于等于1的整数,例如,n为1、2、3、4或5。
42.在一些具体的实施方式中,本发明所述的ek1蛋白衍生物是sldqinvtfldleyemkkleeaikkleesyidlkel-(gsgsg)n-dpeg4-c-胆固醇,其中n为大于等于1的整数,例如,n为1、2、3、4或5。
43.在一些具体的实施方式中,本发明所述的ek1蛋白衍生物是sldqinvtfldleyemkkleeaikkleesyidlkel-gsgsg-dpeg4-c-胆固醇。
44.在一些具体的实施方式中,本发明的药物组合物包含如下以质量百分比计的组分:蛋白5%~7%、稀释剂67%~69%、助流剂22%~24%、表面活性剂1%~3%和保护剂0.5%~2%。
45.在一些优选地实施方式中,本发明的药物组合物包含如下以质量百分比计的组分:蛋白5%~7%、稀释剂67%~69%、助流剂22%~24%、表面活性剂1%~3%和保护剂0.5%~2%;所述蛋白包括ek1蛋白或其衍生物;所述稀释剂包括甘露醇;所述助流剂包括亮氨酸;所述表面活性剂包括泊洛沙姆;所述保护剂包括聚乙二醇300。
46.在另一些优选地实施方式中,本发明的药物组合物包含如下以质量百分比计的组分:蛋白5%~7%、稀释剂67%~69%、助流剂22%~24%、表面活性剂1%~3%和保护剂0.5%~2%;所述蛋白包括ek1蛋白或其衍生物;所述稀释剂包括甘露醇;所述助流剂包括亮氨酸;所述表面活性剂包括泊洛沙姆;所述保护剂包括羧甲基纤维素钠。
47.在又一些优选地实施方式中,本发明的药物组合物包含如下以质量百分比计的组分:蛋白5%~7%、稀释剂67%~69%、助流剂22%~24%、表面活性剂1%~3%和保护剂0.5%~2%;所述蛋白包括ek1蛋白或其衍生物;所述稀释剂包括甘露醇;所述助流剂包括亮氨酸;所述表面活性剂包括泊洛沙姆;所述保护剂包括聚乙二醇300和羧甲基纤维素钠,聚乙二醇300和羧甲基纤维素钠的质量比为3:1至1:3。
48.在一些更优选的实施方案中,本发明的药物组合物包含如下以质量百分比计的组分:蛋白6%、稀释剂68%、助流剂22%、表面活性剂2%和保护剂2%;所述蛋白包括ek1蛋白或其衍生物;所述稀释剂包括甘露醇;所述助流剂包括亮氨酸;所述表面活性剂包括泊洛沙姆;所述保护剂包括聚乙二醇300和羧甲基纤维素钠,聚乙二醇300和羧甲基纤维素钠的质量比为3:1至1:3。
49.在一些具体的实施方式中,本发明药物组合物的制备方式中的喷雾干燥包括如下工艺参数:进口温度为115~130℃,进液速度为4~6.5ml/min。
50.在一些优选的实施方案中,本发明药物组合物的制备方式中的喷雾干燥包括如下工艺参数:进口温度为115℃,进液速度为4~6.5ml/min。
51.除非另有说明,本发明中使用的仪器、试剂、材料、实验动物等均可通过常规商业手段获得。
52.实施例1:ek1干粉吸入剂的处方筛选
53.1.保护剂的选择
54.1.1处方设计
55.由于ek1-1/ek1-2均为蛋白(ek1-1蛋白为ek1蛋白本身,其氨基酸序列为以seq id no.1所示的序列,ek1-2蛋白为ek1蛋白的衍生物。),并不耐高温,在100℃以上的情况下会发生降解和变性。因此选择能够保护ek1-1/ek1-2在喷雾干燥条件下不被降解的保护剂是本制剂的关键。为此,以ek1蛋白为示例,设计以下处方例,如表1所示:
56.表1筛选保护剂用处方的具体组成
[0057][0058]
1.2制备方法
[0059]
称取上述各处方,溶于100倍重量的水中,制成水溶液。用0.22μm的微孔滤膜过滤后,喷雾干燥,即得ek1干粉吸入剂。喷雾干燥工艺参数如下:
[0060]
进口温度:130℃;
[0061]
进液速度:5ml/min;
[0062]
雾化压力:2bar(200kpa);
[0063]
气流量:0.5m3/min(气体:氮气)。
[0064]
1.3考察指标
[0065]
具体考察指标包括:
[0066]
·
保护率:hplc测定条件:色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂(zorbax 300sb-c18 3.5μm,4.6
×
150mm或效能相当的色谱柱);以30mmol/l的磷酸二氢钾溶液(取磷酸二氢钾4.08g,加水1000ml溶解,用42%的氢氧化钠溶液调节ph值至6.0)为流动相a,以乙腈为流动相b;流速为1.0ml/min;柱温为35℃;检测波长为215nm;按表2进行梯度洗脱。hplc(a
喷雾后
/a
喷雾前
)=喷雾后出峰面积/喷雾前出峰面积,喷雾前后分别称取0.05g本品(非水溶液),测量其出峰面积,通过计算得到蛋白保护率。
[0067]
表2纯度检测试验中液相色谱法适用的梯度洗脱条件
[0068]
时间(分钟)流动相a(%)流动相b(%)0955570304059414545555045555195560955
[0069]
·
粒径:利用激光粒度测定仪(海鑫瑞hl2020-b)测定。
[0070]
·
回收率:回收重量/初始重量。
[0071]
·
水分含量:采用卡式水分测定仪,对成品粉末进行水分测量。将粉末称量,之后快速投入反应杯,自由搅拌5分钟,之后开始测定,并读取。
[0072]
1.4考察结果
[0073]
表3筛选保护剂用处方的考察结果
[0074][0075]
注:本表中“d10和d90”代表分布曲线中累积分布为10%、90%时的最大颗粒的等效直径(平均粒径)。
[0076]
从上表可以看出,在不添加保护剂的情况下,经过喷雾干燥后,而该处方下回收率可以保持在16%,证明绝大多数的ek1蛋白都被分解。而添加保护剂之后,处方的回收率均有上升,从hplc测定含量可以看出,添加单一保护剂,能够提高ek1的稳定性,而混合的保护剂,能够进一步提升ek1的稳定性。
[0077]
同时,需要注意的是,处方4、5、6因为增加的保护剂是处方2、3的2倍,因此还需要考察保护剂处方用量。
[0078]
2.保护剂处方用量的选择
[0079]
2.1处方设计
[0080]
为选择适宜的保护剂的处方用量,设计以下处方例,如表4所示,其中保护剂为羧甲基纤维素钠和peg-300,表中比例为二者之间的质量比(羧甲基纤维素钠:peg-300)。
[0081]
表4筛选保护剂用量用处方的具体组成
[0082][0083]
2.2考察结果
[0084]
各处方制备方法同1.2,考察指标同1.3,具体考察结果如下表所示:
[0085]
表5筛选保护剂用量用处方的考察结果
[0086]
[0087]
注:本表中“d10和d90”代表分布曲线中累积分布为10%、90%时的最大颗粒的等效直径(平均粒径)。
[0088]
从上表可以看出,相比于混合的保护剂,单独使用羧甲基纤维素钠,对ek1的保护率只有31%,单独使用peg-300,保护作用也只有70%。而加入混合保护剂后,保护作用介乎接近或高于80%,有良好的效果。同时保护剂减半的情况下,依然有72%的保护力度。因此可以看出,羧甲基纤维素钠+peg-300的混合保护剂对ek1的保护力度,与用量有一定关系,但是并不是决定性的关系。
[0089]
3.稀释剂和助流剂的选择
[0090]
目前美国批准了乳糖作为稀释剂,但是申请人在实验中,多次使用甘露醇和ek1进行配伍,有良好的适配性,并且相互之间没有任何影响,是很好的处方适配对象,因此稀释剂考察乳糖和甘露醇。
[0091]
而助流剂通常为氨基酸,本发明选取亮氨酸、甘氨酸、丙氨酸进行考察。
[0092]
3.1处方设计
[0093]
为选择良好的稀释剂和助流剂,设计以下处方例,如表6所示,其中固定表面活性剂和保护剂,保护剂为羧甲基纤维素钠和peg-300且二者的质量比为1:1。
[0094]
表6筛选稀释剂和助流剂用处方的具体组成
[0095][0096]
3.2考察结果
[0097]
各处方制备方法同1.2,考察指标同1.3,具体考察结果如下表所示:
[0098]
表7筛选稀释剂和助流剂用处方的考察结果
[0099][0100]
注:本表中“d10和d90”代表分布曲线中累积分布为10%、90%时的最大颗粒的等效直径(平均粒径)。
[0101]
从上表可以看出,采用乳糖时,对ek1的保护率和回收率均有所下降。而使用甘露醇时保护率比较高。同时,使用亮氨酸、甘氨酸时的产品粒径以及回收率都比较接近,对比之下,使用丙氨酸时回收率不理想,不再考察。
[0102]
综上所述,ek1干粉吸入剂最终处方包含ek1蛋白或其衍生物、稀释剂、助流剂、表面活性剂和保护剂;其中稀释剂可以是甘露醇、海藻糖、乳糖等;助流剂可以是亮氨酸、异亮氨酸、精氨酸、甘氨酸、丙氨酸等;表面活性剂可以是泊洛沙姆或其他常规表面活性剂;保护剂可以是羧甲基纤维素钠和聚乙二醇的混合物(两者之间的比例为1:3-3:1)。
[0103]
最终优化选择确定的处方为ek1蛋白0.13g;甘露醇1.5g;亮氨酸0.5g;泊洛沙姆0.04g;羧甲基纤维素钠+peg-300(1:1)0.04g。
[0104]
实施例2:ek1干粉吸入剂的喷雾干燥工艺筛选
[0105]
1.工艺参数设计
[0106]
本实施例所使用的ek1干粉吸入剂处方包含如下成分:ek1蛋白(该蛋白氨基酸序列为以seq id no.1所示的序列)0.13g;甘露醇1.5g;亮氨酸0.5g;泊洛沙姆0.04g;羧甲基纤维素钠+peg-300(二者质量比为1:1)0.04g。制备方法同实施例1。
[0107]
为选择适宜的喷雾干燥工艺,设计以下处方例,具体参数如下表所示:
[0108]
表8用于筛选喷雾干燥工艺的具体参数
[0109]
处方进口温度(℃)进液速度(ml/min)雾化压力气流量(氮气)e-07-0110042bar0.5m3/mine-07-0211542bar0.5m3/mine-07-0313042bar0.5m3/mine-07-0410052bar0.5m3/mine-07-0511552bar0.5m3/mine-07-0613052bar0.5m3/mine-07-071006.52bar0.5m3/mine-07-081156.52bar0.5m3/mine-07-091306,52bar0.5m3/min
[0110]
2.考察结果
[0111]
具体考察指标同实施例1,具体考察结果如下表所示:
[0112]
表9不同喷雾干燥工艺下产品的考察结果
[0113][0114]
注:本表中“d10和d90”代表分布曲线中累积分布为10%、90%时的最大颗粒的等效直径(平均粒径)。
[0115]
从上表可以看出,进口温度低,会严重影响到含水量,但是也会提高hplc测定的保
护率结果,回收率也随之增高,粒径变大。而进液速度,同样也会影响到干燥是否充分,速度越快,含水量就越高。因此,为了保证ek1干粉吸入的稳定性,选择115℃作为进口温度,进液速度选择4ml/min。雾化压力和气流量不再考察。
[0116]
综上所述,最终优化选择确定的处方为ek1蛋白0.13g;甘露醇1.5g;亮氨酸0.5g;泊洛沙姆0.04g;羧甲基纤维素钠+peg-300(1:1)0.04g。最终优化选择的喷雾干燥工艺参数为进口温度115℃;进液速度4ml/min;雾化压力2bar(200kpa);气流量0.5m3/min(气体:氮气)。
[0117]
实施例3:ek1干粉吸入剂的药代动力学实验
[0118]
1.给药方式
[0119]
采用吹入法给药(参考okamoto h等发表的论文a novel apparatus for rat in vivo evaluation of dry powder formulations for pulmonary administration.j pharm sci 2000,89(8):1028-1035)。取18只大鼠,分为三组(对照组、ek1-1组、ek1-2组),腹腔右侧注射10%乌拉坦(给药剂量为1ml/100g),麻醉,仰卧固定。环境保持在35-38℃之间。
[0120]
ek1-1组和ek1-2组:用手术刀沿大鼠颈部中线切1.5cm的小切口,拨开皮下组织和肌肉,暴露气管。在第四、五环软骨中间位置的气管处,开t形切口,然后将移液管尖头深入气管内部,轻轻吹气将干粉吹入肺内。此处所用ek1干粉处方包含:ek1-1/ek1-2蛋白0.13g、甘露醇1.5g、亮氨酸0.5g、泊洛沙姆0.04g、羧甲基纤维素钠+peg-300(1:1)0.04g;其中ek1-1蛋白为ek1蛋白本身,氨基酸序列为以seq id no.1所示的序列,ek1-2蛋白为ek1蛋白衍生物,为胆固醇修饰的ek1蛋白,即sldqinvtfldleyemkkleea ikkleesyidlkel-gsgsg-dpeg4-c-胆固醇。喷雾干燥工艺参数为进口温度115℃;进液速度4ml/min;雾化压力2bar(200kpa);气流量0.5m3/min(气体:氮气)。
[0121]
对照组:将含有相同ek1-1/2蛋白量的pbs溶液(所用pbs为10mm,ph7.4,ek1-1/2蛋白质量浓度为10%)用移液管轻轻滴入肺部。
[0122]
同时,在给药后,将微渗析探针沿支气管植入大鼠左肺黏液层,用注射泵(美国erane-1600)以3μl/min的流速灌注pbs。并且在10min、30min、60min、120min、180min、240min收集渗透液,测定ek1-1/2浓度,具体操作方式见图1。
[0123]
2.药代动力学曲线
[0124]
药代动力学曲线见图2,从图可知,相比于ek1-1/2-pbs溶液,ek1-1/2两种药物的干粉吸入剂,释放都有一定的延迟,这可能是因为肺部需要一定时间代谢甘露醇等稀释剂。并且,对照组大约在一小时到一个半小时之间达峰,而干粉吸入剂大约在两小时左右达峰。
[0125]
此外,干粉吸入剂的浓度曲线下面积(auc)小于对照组,可能是因为在给药过程中有所损失(比如吹入法损失)。此外,微渗透法的回收率,本实验并没有进行过多考虑,未来将会进一步实验来佐证。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1