一种含有局部麻醉药的脂质体及其制备方法与流程
1.本公开属于制药领域,涉及一种含有局部麻醉药的脂质体及其制备方法。
背景技术:
2.脂质体,也被称为脂囊泡,是完全封闭的脂类双分子层膜,其含有包含水介质的内部体积。脂类双分子层通常由磷脂如卵磷脂和相关材料如糖脂组成。脂类双分子层膜通常以类似于细胞膜的方式起作用。他们因此展现出一些生物性质,如容易被接受进入活细胞环境内的能力。因此,近年来越来越多的兴趣在于利用脂质体作为递送对患者具有特别的生物或药学特性的化合物的载体。
3.脂质体根据结构中所包含的双层分子磷脂膜层数,可分为单室脂质体和多室脂质体。含有单层双分子层磷脂膜的囊泡称为单层脂质体,含有多层双分子层磷脂膜的囊泡称为多层脂质体(multilamellar vesicle,mlv)。单室脂质体又分为小单层脂质体(small unilamellar vesicular,suv)和大单层脂质体(1arge unilamellar vesicular,luv)。多层脂质体是双层脂质膜与水交替形成洋葱状结构的囊泡,一般由多层同心片层组成,其可作为用于局部或全身性的药物递送的脂质基质的缓释性药物载体。多层脂质体的制备方法一般有逆相蒸发法、薄膜水化法、冻干法等。
4.近年来,脂质体由于其缓释性药物载体的特性被广泛应用于药物开发。不过,脂质体递送至体内后在初始阶段释放的药物不足,因此脂质体在给药初期的治疗效果不佳。目前已有一些改善脂质体初始释放的方法。wo2019046293公开了一种递送持续释放麻醉剂组合物的mlv的制备方法,其采用了组氨酸等缓冲液体系水化高包封的脂质结构(hels)来制备mlv,得到部分包封的脂质体组合物。然而,组氨酸等缓冲液体系的稳定性较差,容易氧化变质,使产品存在潜在的质量风险。
技术实现要素:
5.本公开的目的在于提供一种改进的脂质体组合物及其制备方法,改善脂质体的释放特性。
6.本公开一方面提供了一种脂质体组合物的制备方法,包括采用水化液水化固体组合物的步骤,其中,
7.所述固体组合物包括:(1)脂质,其包含至少一种磷脂,和(2)局部麻醉药的游离碱;
8.所述水化液包含局部麻醉药的可药用盐、络合物或螯合物,优选局部麻醉药的可药用盐。
9.所述的局部麻醉药的游离碱是指以本体形式存在的局部麻醉药活性成分,其与局部麻醉药的盐形式等相对。
10.所述的局部麻醉药的可药用盐包括但不限于局部麻醉药的醋酸盐、苯甲酸盐、苯磺酸盐、氢溴酸盐、樟脑磺酸盐、盐酸盐、柠檬酸盐、乙二磺酸盐、富马酸盐、葡庚糖酸盐、葡
糖酸盐、葡萄糖醛酸盐、氢碘酸盐、羟乙磺酸盐、乳酸盐、乳糖醛酸盐、十二烷基硫酸盐、苹果酸盐、马来酸盐、甲磺酸盐、萘甲酸盐、萘磺酸盐、硝酸盐、硬脂酸盐、油酸盐、草酸盐、双羟萘酸盐、磷酸盐、聚半乳糖醛酸盐、琥珀酸盐、硫酸盐、磺基水杨酸盐、酒石酸盐、甲苯磺酸盐、三氟乙酸盐等。
11.本公开所述的固体组合物例如可以是粉末、颗粒,或者聚集在一起的饼状或块状物。
12.在某些实施方式中,所述的固体组合物为干燥的固体组合物。干燥所述组合物的方法包括但不限于蒸发、冷冻干燥或喷雾干燥等。
13.在某些实施方式中,所述的脂质体组合物包含多层脂质体(mlv)。在某些实施方式中,所述的脂质体组合物中还可存在suv或luv等其他脂质体形式。在某些实施方式中,所述的脂质体组合物主要以mlv的形式存在。
14.在某些实施方式中,所述的固体组合物基本上不包含脂质囊泡结构,优选所述的固体组合物不包含脂质囊泡结构。在某些实施方式中,所述的固体组合物尚未形成脂质体。
15.所述的水化操作通常通过将固体组合物与水化液混合来实现。水是主要的液体介质。在某些实施方案中,所述水化液还可包含等渗剂或缓冲剂。可通过等渗剂调节脂质体组合物的渗透压使之具有与人血基本相同的渗透压。所述的等渗剂包括氯化钠、氯化钾、氯化镁、氯化钙、葡萄糖、木糖醇、山梨醇。所述的缓冲剂通过其酸-碱共轭成分的作用来阻止水化液的ph的变化。在一个实施方案中,本公开的水化液的ph范围为约4.5至约8.5,优选5.0-8.0,更优选5.5-7.5。可将ph控制在该范围的缓冲剂的实例包括乙酸盐(例如乙酸钠)、琥珀酸盐(如琥珀酸钠)、葡糖酸盐、组氨酸、柠檬酸盐、碳酸盐、pbs、hepes或其它有机酸。本公开所述的水化液还包含局部麻醉药的可药用盐、络合物或螯合物,这有利于制备具有适当包封率的脂质体。
16.本公开所述的脂质包括完全中性或带负电荷的磷脂。术语“磷脂”指含有至少一个磷基的疏水分子,其可是天然或合成的。例如,磷脂可包含含磷基团及任选被oh、cooh、氧代、胺或者取代或未取代的芳基取代的饱和或不饱和的烷基。磷脂类在其无环(acylic)链的长度和不饱和度方面互相不同。
17.在某些实施方式中,所述磷脂包括磷脂酰胆碱、脂酰乙醇胺、磷脂酰甘油、磷脂酰丝氨酸、磷脂酸、磷脂酰肌醇中的一种或多种。术语“磷脂酰胆碱”指磷脂酰胆碱及其衍生物。适合用于本公开的磷脂的示例包括二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、1-棕榈酰-2-亚油酰-sn-甘油-3-磷脂酰胆碱(plpc)、二油酰磷脂酰胆碱(dopc)、二芥酰磷脂酰胆碱(depc)、蛋黄磷脂酰胆碱(epc)、二月桂酰磷脂酰胆碱(dlpc)、氢化的大豆磷脂酰胆碱(hspc)、l-肉豆蔻酰-2-棕榈酰磷脂酰胆碱(mppc)、l-棕榈酰-2-肉豆蔻酰磷脂酰胆碱(pmpc)、l-棕榈酰-2-硬脂酰磷脂酰胆碱(pspc)、l-硬脂酰-2-棕榈酰磷脂酰胆碱(sppc)、棕榈酰油酰磷脂酰胆碱(popc)、溶血磷脂酰胆碱、二亚油酰磷脂酰胆碱、二硬脂酰磷脂酰乙醇胺(dspe)、二肉豆蔻酰磷脂酰乙醇胺(dmpe)、二棕榈酰磷脂酰乙醇胺(dppe)、二油酰基磷脂酰甘油(dopg)、二肉豆蔻酰磷脂酰甘油(dmpg)、二硬脂酰基磷脂酰甘油(dspg)、二棕榈酰基甘油磷酸甘油(dppg)、二棕榈酰基磷脂酰丝氨酸(dpps)、1,2_二油酰基-sn-甘油-3-磷脂酰丝氨酸(dops)、二肉豆蔻酰基磷脂酰丝氨酸(dmps)、二硬脂酰基磷脂酰丝氨酸(dsps)、二棕榈酰基磷脂酸(dppa)、1,2_二油酰基-sn-甘
油-3-磷脂酸(dopa)、二肉豆蔻酰基磷脂酸(dmpa)、二硬脂酰基磷脂酸(dspa)、二棕榈酰基磷脂酰肌醇(dppi)、1,2_二油酰基-sn-甘油-3-磷脂酰肌醇(dopi)、二肉豆蔻酰基磷脂酰肌醇(dmpi)、二硬脂酰基磷脂酰肌醇(dspi)中的一种或多种。
18.在某些实施方式中,本公开中所述的磷脂选自二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二芥酰磷脂酰胆碱(depc)、二月桂酰磷脂酰胆碱(dlpc)和二肉豆蔻酰磷脂酰胆碱(dmpc)中的一种或多种。
19.本公开的脂质还可包含其他中性脂质、阳离子脂质和/或阴离子脂质。
20.可用于本公开的其他中性脂质的示例包括:类固醇如胆固醇及其衍生物、卵磷脂、大豆磷脂、脑磷脂、鞘磷脂、氢化大豆磷脂中的一种或多种。在某些实施方式中,相对于总脂质混合物的量,类固醇的摩尔百分比不超过90%。
21.在某些实施方式中,所述的脂质包含至少一种磷脂以及胆固醇。相对于总脂质混合物的量,胆固醇的摩尔百分比可以是0.1%-90%,优选10%-80%,更优选20%-70%。
22.基于固体组合物的总摩尔数,所述的脂质的摩尔含量可以是10%-99%,优选20%-70%。
23.在某些实施方式中,所述的局部麻醉药选自利多卡因、布比卡因、罗哌卡因、甲哌卡因、丙胺卡因、依替卡因、普鲁卡因、氯普鲁卡因、丁卡因、苯佐卡因中的一种或多种,优选利多卡因、布比卡因、罗哌卡因中的一种或多种,更优选罗哌卡因。
24.脂质体的粒径可以是多层脂质体的常规粒径。在某些实施方式中,所述脂质体的粒径d(0.1)可大于0.5μm,例如大于1μm。在某些实施方式中,所述脂质体的粒径d(0.5)可大于1μm,例如大于5μm,例如大于10μm。在某些实施方式中,所述脂质体的粒径d(0.9)可大于1μm,例如大于10μm,例如大于15μm,例如大于20μm。
25.在某些实施方式中,所述的脂质包含至少一种磷脂酰胆碱以及胆固醇。所述的磷脂酰胆碱选自二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二芥酰磷脂酰胆碱(depc)、二月桂酰磷脂酰胆碱(dlpc)和二肉豆蔻酰磷脂酰胆碱(dmpc)中的一种或多种。所述的磷脂酰胆碱与胆固醇的摩尔比可以是1000:1-1:9,优选4:1-1:4。
26.在某些实施方式中,基于脂质体组合物的总摩尔数,所述的罗哌卡因游离碱的摩尔含量可以是1%-90%,优选20%-90%,更优选30%-80%。
27.在某些实施方式中,所述固体组合物中的罗哌卡因游离碱与水化液中的罗哌卡因的可药用盐的摩尔比可以是100:1-1:100,优选50:1-1:50,优选10:1-1:10,或10:1-1:1。
28.在某些实施方式中,所述制备方法包括采用水化液水化固体组合物的步骤,其中,
29.所述固体组合物包括:(1)脂质,其包含至少一种磷脂酰胆碱,以及胆固醇;和(2)罗哌卡因游离碱;
30.所述水化液包含水以及罗哌卡因的可药用盐,其中,
31.所述的磷脂酰胆碱与胆固醇的摩尔比为4:1-1:4;
32.所述固体组合物中的罗哌卡因游离碱与水化液中的罗哌卡因的可药用盐的摩尔比为50:1-1:50,优选10:1-1:10。优选所述的固体组合物基本上不包含脂质囊泡结构。
33.在某些实施方式中,所述磷脂酰胆碱选自二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二芥酰磷脂酰胆碱(depc)、二月桂酰磷脂酰
胆碱(dlpc)和二肉豆蔻酰磷脂酰胆碱(dmpc)。
34.在某些实施方式中,所述的脂质包含至少一种磷脂酰胆碱以及胆固醇。所述的磷脂酰胆碱选自二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰胆碱(dopc)、二芥酰磷脂酰胆碱(depc)、二月桂酰磷脂酰胆碱(dlpc)和二肉豆蔻酰磷脂酰胆碱(dmpc)中的一种或多种,优选二肉豆蔻酰磷脂酰胆碱。所述的磷脂酰胆碱与胆固醇的摩尔比可以是1000:1-1:9,优选4:1-1:4。
35.本公开所述的固体组合物可由以下方法制备而得:1)将脂质混合物及一或多种局部麻醉药溶解于溶剂系统中以形成均质溶液,均质溶液中可包含一或多种溶剂;2)移除溶剂以固化脂质混合物及局部麻醉药。适于冷冻干燥的溶剂系统的实例包括但不限于水、有机溶剂、水/有机溶剂共溶剂体系。所述的有机溶剂包括但不限于甲醇,乙醇,正丙醇,异丙醇,正丁醇,异丁醇,叔丁醇,丙酮,乙腈,二氯甲烷,二甲基亚砜等。优选的溶剂系统可以是水,乙醇,异丙醇,叔丁醇,水/乙醇,水/异丙醇,水/叔丁醇等。可以使用已知的技术除去溶剂系统,例如蒸发,冷冻干燥或喷雾干燥,优选冷冻干燥。
36.在某些实施方式中,水/有机溶剂共溶剂中水与有机溶剂的体积比可以是1000:1~1:1000,优选9:1~1:1000,更优选1:4~1:1000。
37.在某些实施方式中,本公开所述的脂质体组合物在个体中提供不少于12小时的局部麻醉药的持续释放。一些实施方式提供不少于24小时的局部麻醉药的持续释放。一些实施方式提供不少于36小时的局部麻醉药的持续释放。一些实施方式提供不少于48小时的局部麻醉药的持续释放。一些实施方式提供不少于60小时的局部麻醉药的持续释放。一些实施方式提供不少于72小时的局部麻醉药的持续释放。
38.在某些实施方式中,所述的脂质体组合物可在给予个体后,约3h内达到局部麻醉药峰浓度,例如约2h内达到局部麻醉药峰浓度,优选约1.5h内达到局部麻醉药峰浓度,更优选约1h内达到局部麻醉药峰浓度,最优选约45min内达到局部麻醉药峰浓度。
39.如本文所用,术语“个体”包括哺乳动物,优选的个体可包括大鼠和人。
40.在某些实施方式中,所述的脂质体组合物中局部麻醉药的总浓度为约0.1mg/ml至约300mg/ml,优选约1mg/ml至约50mg/ml,更优选约2.5mg/ml至约40mg/ml。
41.在某些实施方式中,未包封的局部麻醉药为药物组合物中局部麻醉药总摩尔量的约1%至约80%。在某些实施方式中,未包封的局部麻醉药为药物组合物中局部麻醉药总摩尔量的约5%至约70%。在某些实施方式中,未包封的局部麻醉药为药物组合物中局部麻醉药总摩尔量的约5%至约60%。在某些实施方式中,未包封的局部麻醉药为药物组合物中局部麻醉药总摩尔量的约10%至约40%。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:50至10:1。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:40至5:1。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:30至4:1。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:20至2:1。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:10至1:1。在某些实施方式中,未包封的局部麻醉药与包封的局部麻醉药的摩尔比率为1:5至1:1。
42.本公开还提供了一种脂质体组合物,其采用本公开所述的方法制备。
43.本公开还提供了一种药物制品,包括:本公开所述的固体组合物以及本公开所述
的水化液,其中,固体组合物不与水化液直接接触。
44.所述的固体组合物不与水化液直接接触是为了最大程度的保持产品的稳定性,并可以在需要的时候随时制备脂质体组合物。阻止固体组合物与水化液直接接触的方式可以采用本领域常规的方法,例如固体组合物与水化液采用各自独立的包装,在使用时混合;或者在包装中将固体组合物与水化液通过若干条弱焊分隔条隔离在不同腔室,所述弱焊分隔条通过施压即可打开等等。
45.在某些实施方式中,所述的固体组合物以及水化液分别单独包装。
46.本公开的所述的固体组合物可单独制备,并可通过单独的水化液水化,在需要的时候随时制备脂质体组合物,使用的便利性得到了提升。所述的水化液可以是自制的含药水化液,也可是市售的普通制剂产品,同样提升了使用便利性。本公开的脂质体组合物可以以多种方式给药,包括但不限于局部、胃肠外等给药。所述组合物可以包含眼科剂型和可注射剂型,并可以包含医学诊断产品。
47.本公开的一些实施方案涉及麻醉或止痛的用途或方法,其包括将本公开所述的脂质体组合物施用给个体。在某些实施方式中,施用是肠胃外施用。在某些实施方式中,施用是局部的。在某些实施方式中,施用是肠胃外和局部的。在某些实施方式中,肠胃外施用选自静脉注射、皮下注射、组织注射、伤口浸润或伤口滴注。
48.可使用标准方法和装置,例如,笔、注射器系统、针和注射器、皮下注射口递送系统、导管等来完成本公开的脂质体组合物的施用。
49.术语“约”是指数量、尺寸、配方、参数、以及其他量和特性是不精确的并且不必是精确的,但可以是期望的近似值和/或较大值或较小值,由此反映公差、转换因子、四舍五入、测量误差等、以及本领域的技术人员已知的其他因子。其含义可包括
±
10%的变化,优选
±
5%的变化。
50.本公开制备得到的脂质体组合物中部分局部麻醉药被包封在脂质体中,部分局部麻醉药未被包封。包封与未包封的局部麻醉药的比例是适当的,以便于将脂质体施用于个体后,未被包封的局部麻醉药迅速释放,达到治疗效果,而包封的局部麻醉药可持续释放,维持治疗效果。包封与未包封的局部麻醉药的比例可通过测定脂质体包封率进行确定。
51.各种配方的“包封百分比”或“包封率”指的是包封在脂质体内的所有的局部麻醉药形式的摩尔量相对于组合物中局部麻醉药的总摩尔量的百分率。优选的包封率范围是约1%-99%,更优选是约60%-85%。可采用常规的包封率的测定方法测定包封率,例如hplc法。
52.术语“基本上不包含脂质囊泡结构”指的是固体组合物中的脂质尚未形成脂质囊泡结构,或者尚未形成干燥的脂质囊泡(例如将脂质囊泡冻干之后形成的形式),例如从所述固体组合物的扫描电镜图中基本上观察不到脂质囊泡结构或干燥的脂质囊泡。在某些实施方式中,在形成固体组合物的过程中基本上不包含形成脂质囊泡结构的过程。在某些实施方式中,固体组合物中所含的脂质囊泡结构不超过约10%或不超过5%或不超过3%或不超过1%。
53.术语“粒径分布”或“psd”指的是通过本领域的技术人员熟知的动态光散射技术例如使用malvern mastersizer
tm
2000所测量的脂质体组合物中的粒径分布。本公开所述的“d(0.1)”是指一个样品的累计粒度分布百分数达到10%时所对应的粒径。“d(0.5)”是指一个
样品的累计粒度分布百分数达到50%时所对应的粒径。“d(0.9)”是指一个样品的累计粒度分布百分数达到90%时所对应的粒径。
具体实施方式
54.实施例中所使用的盐酸罗哌卡因注射液为市售的盐酸罗哌卡因注射液,规格为10ml:100mg(按盐酸罗哌卡因计)。处方为:盐酸罗哌卡因100mg,氯化钠71mg,注射用水加至10ml,还可包含适量的调节ph的氢氧化钠或盐酸。
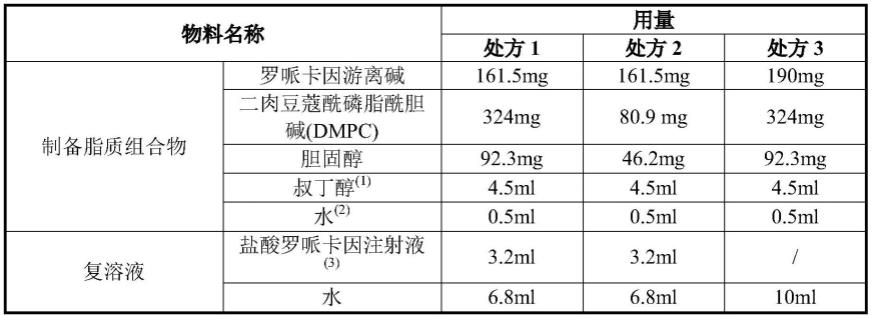
55.实施例1:罗哌卡因脂质体的制备
[0056][0057]
注:(1)和(2)在制备的过程中除去,(3)仅在复溶时加入。
[0058]
称取处方量的dmpc、胆固醇、罗哌卡因游离碱,溶解于80%的叔丁醇-水的混合溶液中。将样品置于冻干机中冷冻干燥,制得固体组合物。采用复溶液复溶,混合均匀,即得罗哌卡因脂质体。通过检测得到各处方脂质体的含量(以罗哌卡因游离碱计)和包封率,如下表。
[0059][0060]
实施例2:罗哌卡因脂质体的体外释放
[0061]
1.透析袋的清洗:
[0062]
称取10g碳酸氢钠与0.168g edta
·
2na于500ml水中,混匀。将透析袋剪成10cm的小段,在1l烧杯中用洗液煮沸10min后,用200ml纯化水清洗透析袋10次;再加入500ml纯化水,煮沸10min。长时间不用的透析袋可保存于10%乙醇中,使用前每次用200ml纯化水清洗10次。
[0063]
2.释放介质的配置:
[0064]
称取2.3g磷酸二氢钾、7.6g三水合磷酸氢二钾、5.6g氯化钠、132mg硫酸铵于_1000ml容量瓶中,加水定容,混匀即得。
[0065]
3.释放样品的放样及取样测定:
[0066]
用移液枪准确量取1.0ml待测脂质体溶液加入10cm透析袋中,加入1ml释放介质,将透析袋两端用夹子夹紧后置于装有99ml释放介质的150ml高型烧杯中。样品放置于37℃、
10rpm的摇床上进行孵育,分别于设定的时间点取样1ml,以hplc进行检验。
[0067]
测试结果如下表所示。
[0068][0069]
可见,处方3的脂质体具有较高包封率,其0-4h以内的体外释放较慢,4h释放度近似于处方1和处方2的脂质体在2h的释放度。以上结果证明,脂质体包封率适中,有利于局部镇痛类局部麻醉药迅速发挥镇痛效果,并且维持长时间释放。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1