一种纳米自组装糖肽BIVA-PK及其在缺血再灌注损伤导致的肾脏纤维化中的应用的制作方法
and repair after aki.jam soc nephrol.2016,27(2):495-508.)。随后m2a型巨噬细胞在损伤修复早期,通过抑制炎症反应,促进肾小管修复(zhang mz,wang x,wang y,niu a,wang s,zou c,harris rc.il-4/il-13-mediated polarization of renal macrophages/dendritic cells to an m2aphenotype is essential for recovery from acute kidney injury.kidney int.2017,91(2):375-386.)。但是,当组织修复不良,炎症反应持续存在时,慢性炎症会引发纤维化进程,此时,m2型巨噬细胞成为纤维化进程的核心调控者和直接参与者,通过产生促进纤维化细胞因子及生长因子,包括tgf-β,pdgf-b,igf-1,galactin-3等(distler jhw,ramanujam m,whitfield ml,lafyatis r.shared and distinct mechanisms of fibrosis.nat rev rheumatol.2019,15(12):705-730;broekema m,harmsen mc,van luyn mj,koerts ja,petersen ah,van kooten tg,van goor h,navis g,popa er.bone marrow-derived myofibroblasts contribute to the renal interstitial myofibroblast population and produce procollagen i after ischemia/reperfusion in rats.j am soc nephrol.2007,18(1):165-75.),或者发生肌成纤维细胞转化(mmt),极大的促进局部纤维化微环境的形成(huen sc,cantley lg.macrophages in renal injury and repair.annu rev physiol.2017,79:449-469.)。
5.体内自组装多肽纳米技术(in vivo self-assembly nano-polypeptide)是通过分子主动识别和特异性内切酶剪裁的双重靶向机制,在靶细胞原位自组装形成纳米结构,进而增强组织富集和延长滞留的纳米技术(zhang d,qi gb,zhao yx,qiao sl,yang c,wang h.in situ formation of nanofibers from purpurin18-peptide conjugates and the assembly induced retention effect in tumor sites.adv mater.2015,27(40):6125-30.)。体内自组装多肽纳米分子由三部分构成:(1)结合肽识别并结合细胞表面的靶标分子,并随靶标分子一起内化进入溶酶体途径;(2)溶酶体内特异性内切酶进行特异性分子剪切,随后发生自组装并滞留在细胞内部;(3)多肽纳米分子携载的效应分子释放,实现效应功能(zhang d,qi gb,zhao yx,qiao sl,yang c,wang h.in situ formation of nanofibers from purpurin18-peptide conjugates and the assembly induced retention effect in tumor sites.adv mater.2015,27(40):6125-30.)。
6.体内自组装多肽纳米技术不仅通过“双重靶向”机制(识别和剪切)提高了识别的特异性;还通过纳米结构经剪切后的自组装,改变了纳米分子在微环境部位和正常组织之间的分布和代谢,实现了灵敏和特异性的微环境富集和滞留(图2,ye d,shuhendler aj,cui l,tong l,tee ss,tikhomirov g,felsher dw,rao j.bioorthogonal cyclization-mediated in situ self-assembly of small-molecule probes for imaging caspase activity in vivo.nat chem.2014,6(6):519-26;shi j,du x,huang y,zhou j,yuan d,wu d,zhang y,haburcak r,epstein ir,xu b.ligand-receptor interaction catalyzes the aggregation of small molecules to induce cell necroptosis.j am chem soc.2015,137(1):26-9.)。基于体内自组装多肽纳米技术,开发用于肾脏纤维化治疗的药物对于解决肾脏纤维化治疗中存在的问题具有重要意义。
技术实现要素:
7.本发明的目的是提供一种纳米自组装糖肽。本发明的另一目的是提供该纳米自组装糖肽的用途。
8.首先,本发明在对肾脏纤维化发生和发展机制的研究过程中发现,通过靶向诱导肾脏纤维化微环境中m2型巨噬细胞的凋亡,阻断其向肌成纤维细胞的转化,同时减少促纤维化细胞因子的产生,能够更加特异、高效地抑制急性肾损伤进展至肾脏纤维化。
9.基于上述发现,本发明提供m2型巨噬细胞在作为缺血再灌注损伤导致的肾脏纤维化的治疗靶标中的应用。
10.本发明还提供m2型巨噬细胞的抑制剂在制备用于预防或治疗缺血再灌注损伤导致的肾脏纤维化的药物中的应用。
11.以上所述的m2型巨噬细胞的抑制剂优选以cd206为作用靶标。
12.进一步优选地,m2型巨噬细胞的抑制剂为m2型巨噬细胞的促凋亡剂。
13.上述m2型巨噬细胞的促凋亡剂可为靶向m2型巨噬细胞的促凋亡多肽。
14.在发现iri-aki进展至纤维化过程中,m2型巨噬细胞发挥了重要的促进作用的基础上,如何特异性调控肾脏纤维化微环境中m2型巨噬细胞的功能及数量仍然是目前的难点。基于多肽纳米超分子特点,将其作为药物运载结构有利于实现高度特异和安全的靶向药物递送。此外,本发明通过构建小鼠缺血再灌注肾损伤纤维化模型发现,肾脏cd206
+
巨噬细胞数量呈现时间依赖的增加,因此选择甘露糖受体(mr,cd206)作为缺血再灌注肾损伤纤维化过程中m2型巨噬细胞靶向促凋亡分子的靶点;同时,本发明还发现cathepsin b表达水平与m2巨噬细胞数量呈相同趋势,因此选择cathepsin b作为酶切位点诱导靶向促凋亡糖肽的响应性自组装。基于上述发现,本发明开发了一种新型高效纳米自组装糖肽,该纳米自组装糖肽靶向肾脏纤维化微环境中的m2型巨噬细胞,并通过搭载效应分子,调控局部微环境,发挥抑制纤维化进展的作用。
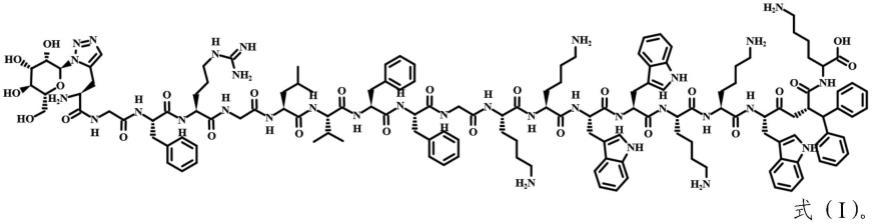
15.本发明提供一种多肽,其具有如下氨基酸序列和修饰:(mannose)-pra-gfrg-lvff-gkkwwkkwdipk,其中,(mannose)-pra为甘露糖修饰,dip为二苯基丙氨酸。
16.以上所述的多肽中,甘露糖修饰通过将pra氨基酸侧链炔基与叠氮修饰的甘露糖进行偶联(可通过click反应进行偶联)实现。该糖基化修饰可以为多肽提供靶向m2巨噬细胞的特性,同时有利于提高纳米自组装糖肽的亲水性,使得该糖肽具有分子量小、亲水性高的特点,显著提高了其在肾脏的富集效率,提高了器官靶向性。
17.上述多肽的氨基酸序列如seq id no.1所示,其中xaa代表二苯基丙氨酸(dip)。该多肽的配体(甘露糖)与特异性表达于m2型巨噬细胞表面的cd206靶向结合后通过clathrin途径内吞进入溶酶体,在溶酶体中,gfrg-lvff序列可以被cathepsin b识别并剪切,进而形成促凋亡肽衍生序列lvffgkkwwkkwdipk,该衍生序列可进行自组装,从而延长其在肾脏纤维化微环境中的滞留时间,提供了针对肾脏的二次靶向,同时有效提高了gkkwwkkwdipk促凋亡活性,促凋亡多肽gkkwwkkwdipk在细胞外无促凋亡活性,进入胞浆后通过破坏线粒体膜,释放细胞色素c,启动caspase介导的细胞凋亡途径。该多肽可作为肾脏纤维化微环境中m2型巨噬细胞的促凋亡糖肽,发挥有效诱导巨噬细胞凋亡、控制纤维化进展的作用。该多肽的具体构造及工作原理如图3所示。
18.具体地,本发明提供的多肽的化学结构式如式(i)所示:
[0019][0020]
基于上述多肽的功能,本发明提供所述多肽在制备体内自组装多肽药物中的应用。
[0021]
本发明还提供所述多肽在制备用于靶向诱导m2型巨噬细胞凋亡的药物中的应用。
[0022]
本发明还提供所述多肽在制备用于预防或治疗肾脏纤维化的药物中的应用。
[0023]
优选地,以上所述的肾脏纤维化为急性肾损伤发展为慢性肾脏病所致的肾脏纤维化。
[0024]
进一步优选地,所述肾脏纤维化为缺血再灌注损伤导致的肾脏纤维化。本发明提供的多肽尤其适用于缓解或改善缺血再灌注损伤导致的肾脏纤维化。
[0025]
本发明提供一种药物,其包含以上所述的多肽。
[0026]
上述药物除包含所述多肽外,还可包含药学领域允许的辅料或用于治疗肾脏纤维化的其它活性成分。
[0027]
本发明的有益效果在于:
[0028]
1、本发明利用纳米自组装技术构建了纤维化微环境特异性触发响应的纳米自组装糖肽biva-pk,该糖肽能够精准靶向和诱导m2型巨噬细胞凋亡,阻断其向肌成纤维细胞的转化,同时减少促纤维化细胞因子的产生,能够更加特异、高效地抑制急性肾损伤进展至肾脏纤维化。
[0029]
2、本发明构建的纳米自组装糖肽biva-pk具有双重靶向机制,可以防止非特异组织细胞损伤,同时,该糖肽具有较高的亲水性,在肾脏中具有较高的富集效率,提高了作用效果和安全性。
[0030]
3、本发明构建的纳米自组装糖肽biva-pk对缺血再灌注损伤引发的肾脏纤维化具有明显的阻断作用,可用于aki-ckd的治疗,延缓向尿毒症进展,为阻断aki-ckd进展提供新的治疗药物。
附图说明
[0031]
图1为本发明
背景技术:
中肾脏损伤、修复及纤维化中不同巨噬细胞亚群发挥不同功能示意图。
[0032]
图2为本发明背景技术中纳米自组装多肽技术体内双重靶向、功能调控机制示意图。
[0033]
图3为本发明的纳米自组装糖肽靶向诱导m2巨噬细胞凋亡工作原理图。
[0034]
图4为本发明实施例1中肾脏缺血再灌注损伤后cd206
+
巨噬细胞数量变化及cathepsin b表达水平检测结果,其中,左图为cd206
+
巨噬细胞数量变化检测结果,其中,f4/80代表emr1,为小鼠巨噬细胞表面标记物,cd206代表mmr,是巨噬细胞表面甘露糖受体,为m2巨噬细胞表面标记物,merge代表f4/80和cd206共表达;右图为cathepsin b表达水平
检测结果,其中,假手术代表假手术对照组,3天、7天、14天和28天分别代表模型构建后第3天、第7天、第14天和第28天。
[0035]
图5为本发明实施例2中纳米自组装糖肽biva-pk序列及组装后的纳米结构形貌,其标尺大小为2μm。
[0036]
图6为本发明实施例3中纳米自组装糖肽biva-pk对缺血再灌注损伤引发的肾脏纤维化模型生存率及体重的影响。
[0037]
图7为本发明实施例3中纳米自组装糖肽biva-pk减缓缺血再灌注损伤导致的肾功能丢失。
[0038]
图8为本发明实施例3中纳米自组装糖肽biva-pk有效减轻缺血再灌注损伤后肾脏纤维化面积。
[0039]
图9为本发明实施例4中纳米自组装糖肽biva-pk减少缺血再灌注损伤后肾脏m2型巨噬细胞浸润。
[0040]
图10为本发明实施例5中纳米自组装糖肽biva-pk有效靶向缺血再灌注损伤肾脏。
[0041]
图11为本发明实施例6中纳米自组装糖肽biva-pk有效靶向cd206
+
巨噬细胞。
[0042]
图12为本发明实施例6中纳米自组装糖肽biva-pk特异性诱导cd206+巨噬细胞凋亡。
具体实施方式
[0043]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0044]
实施例1小鼠缺血再灌注肾损伤纤维化模型的构建和分析
[0045]
构建c57/bl6背景的单侧缺血再灌注损伤并进行对侧肾切除术(unilateral ischemia-reperfusion injury and contralateral nephrectomy,uirix)模型,具体方法如下:实验动物为8周龄c57雄性小鼠,体重20-22g。1%戊巴比妥腹腔注射麻醉小鼠,暴露左侧肾脏,分离肾蒂,动脉夹夹闭肾动脉,肾脏颜色变为黑紫色,同时行右侧肾脏切除,40min后解除夹闭,待肾脏灌注恢复后还纳。
[0046]
对上述构建的小鼠模型进行免疫荧光染色和western blotting检测,结果如图4所示,其中,免疫荧光染色结果显示,模型的肾脏cd206
+
巨噬细胞数量呈现时间依赖的增加,提示以cd206作为m2型巨噬细胞靶标对缺血再灌注肾损伤纤维化的指示作用;western blotting结果显示,模型的cathepsin b表达水平与m2型巨噬细胞数量呈相同趋势,提示cathepsin b可作为酶切位点诱导靶向促凋亡糖肽的响应性自组装。
[0047]
实施例2纳米自组装糖肽biva-pk的设计和合成
[0048]
经筛选和优化,最终确定纳米自组装糖肽biva-pk的氨基酸序列(seq id no.1)和修饰为:(mannose)-pra-gfrg-lvff-gkkwwkkwdipk,其中,(mannose)-pra为甘露糖修饰,gfrg-lvff为cathepsinb剪切序列(seq id no.2),gkkwwkkwdipk为促凋亡序列(seq id no.3),自组装糖肽biva-pk的结构式如式(i)所示。同时合成对照多肽pk,该对照多肽只含有促凋亡序列gkkwwkkwdipk,无甘露糖修饰及cathepsin b剪切序列。
[0049]
采用固相多肽合成方法,在wang树脂上合成主体的多肽序列,偶联甘露糖,合成糖肽。将得到的自组装糖肽分子粗产物,通过制备色谱实现纯化分离,对合成的产物进行质谱鉴定,对其纳米结构形貌和堆积片层结构进行表征(图5)。
[0050]
实施例3纳米自组装糖肽biva-pk治疗aki-ckd肾脏纤维化的有效性
[0051]
构建单侧缺血再灌注损伤并进行对侧肾切除术(unilateral ischemia-reperfusion injury and contralateral nephrectomy,uirix)模型:实验动物为8周龄c57雄性小鼠,体重20-22g。1%戊巴比妥腹腔注射麻醉小鼠,暴露左侧肾脏,分离肾蒂,动脉夹夹闭肾动脉,肾脏颜色变为黑紫色,同时行右侧肾脏切除,40min后解除夹闭,待肾脏灌注恢复后还纳。于再灌注后第3天开始,尾静脉注射纳米自组装糖肽biva-pk,剂量为10mg/kg,注射频率为1次/2天,共注射3次,以此作为biva-pk治疗组;对照组于相应时间尾静脉注射生理盐水。
[0052]
各组于再灌注后第28天评估小鼠一般情况,结果显示,biva-pk治疗组小鼠生存率显著高于对照组,biva-pk治疗组小鼠体重高于对照组(生理盐水组)(图6)。
[0053]
各组于再灌注后第28天取小鼠外周血,测量血清肌酐和尿素氮水平以评估肾脏功能,结果显示,纳米自组装糖肽biva-pk能够显著降低小鼠肾脏缺血再灌注后血清肌酐及尿素氮水平(图7),对肾脏功能起到了保护作用。
[0054]
各组于再灌注后第28天取小鼠肾脏,对肾组织进行脱水、固定、石蜡包埋及切片,masson染色检测肾脏胶原沉积即纤维化病灶,imagej计算肾脏纤维化病灶面积,结果显示,纳米自组装糖肽biva-pk治疗后,肾脏纤维化面积显著减小(图8),证明纳米自组装糖肽biva-pk能够有效降低缺血再灌注后慢性期肾脏纤维化程度。
[0055]
实施例4纳米自组装糖肽biva-pk对aki-ckd肾脏纤维化微环境的重塑
[0056]
巨噬细胞是肾脏纤维化病灶中主要的免疫细胞类型,其在肾脏纤维化中起到了重要的促进作用。本实施例对纳米自组装糖肽biva-pk对于肾脏cd206
+
巨噬细胞数量的影响进行检测,具体方法和结果如下:
[0057]
于再灌注后第14天取小鼠肾脏,制备单细胞悬液后进行流式抗体染色,流式细胞术检测cd11b
+
f4/80
+
cd206
+
巨噬细胞数量及比例,结果显示:biva-pk治疗组肾脏cd206
+
巨噬细胞数量显著少于生理盐水组(对照组),提示biva-pk能够有效减少缺血再灌注损伤后肾脏cd206
+
巨噬细胞浸润数量(图9,p《0.05)。
[0058]
实施例5纳米自组装糖肽biva-pk对肾脏的靶向性
[0059]
利用荧光素标记biva-pk,对小鼠进行左侧肾动脉夹闭建立缺血再灌注损伤,右侧不予处理,于第7天时尾静脉注射荧光标记的biva-pk,结果显示:注射后第二天荧光标记的biva-pk在肾脏明显富集,尤其是左侧的损伤肾脏,而在心、肝、脾等内脏器官分布较弱,证明biva-pk的体内具有器官选择性(图10)。
[0060]
实施例6纳米自组装糖肽biva-pk对巨噬细胞的靶向性
[0061]
基于以上体内实验中观察到的biva-pk给药后aki-ckd肾脏巨噬细胞数量及表型的变化,进一步在体外验证biva-pk对于巨噬细胞表型、功能的影响及分子机制。
[0062]
体外培养巨噬细胞细胞系raw264.7,利用细胞因子il-4诱导cd206表达,同时培养肾小管上皮细胞系tcmk-1,在两种细胞的培养上清中加入alexa fluor 647标记的biva-pk(10μm),37℃孵育2小时,利用高内涵成像检测巨噬细胞中的荧光信号。结果表明,巨噬细胞中有明显的荧光信号富集,而在肾小管上皮细胞中未检测到明显的荧光信号,证明biva-pk选择性靶向并进入cd206
+
巨噬细胞内,对肾小管上皮细胞无作用(图11,p《0.05)。
[0063]
体外培养巨噬细胞细胞系raw264.7,利用细胞因子il-4诱导cd206表达,将不同浓
度的biva-pk、pk与cd206
+
巨噬细胞共孵育,37℃孵育6小时,cck8测定细胞活性,计算药物剂量效应关系。结果显示,biva-pk在较低浓度下即对m2型巨噬细胞有明显促凋亡作用(ic50=8.37μm),促凋亡作用随着浓度增加而增强,而同等剂量下pk的促凋亡作用较弱(图12)。分离小鼠原代肾小球系膜细胞,同时培养肾小管上皮细胞系tcmk-1,将这两种肾脏固有细胞与cd206
+
巨噬细胞分别接种于96孔板(10000个/孔),分别与不同浓度的biva-pk进行共孵育,37℃孵育6小时,cck8测定细胞活性,计算药物剂量效应关系;结果显示,biva-pk对m2型巨噬细胞有明显促凋亡作用,而biva-pk对肾固有细胞如系膜细胞和肾小管上皮细胞几乎无影响(图12,p《0.05)。
[0064]
综上所述,急性肾损伤后修复不良表现为肾脏正常组织结构被大量肌成纤维细胞及细胞外基质所代替,最终进展至肾脏纤维化。m2型巨噬细胞是纤维化微环境的重要调控者,通过产生各种生长因子和转分化为肌成纤维细胞,极大促进纤维化进展。本发明开发的纳米自组装多肽能够特异性干预纤维化微环境中的m2型巨噬细胞,阻断其对纤维化微环境的促进作用,达到抑制纤维化进展的目的。本发明通过对纤维化微环境的精确调控,为慢性炎症造成的肾脏纤维化治疗提供新的解决方案。本发明提供的纳米自组装糖肽biva-pk可应用于缺血再灌注损伤引发的肾脏纤维化治疗,为肾脏纤维化的治疗药物提供了新选择。纳米自组装糖肽biva-pk在应用于本发明涉及的疾病防治时,具有受体依赖的细胞靶向性以及剪切后自组装滞留的特点,细胞及器官选择性强,效果确实、机制明确,同时避免了蛋白质药物制剂难于保存、成本高以及小分子药物疗效持续效果差的缺点,有望改善肾脏纤维化缺乏有效干预手段的现状。
[0065]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1