一种金属纳米团簇的制备方法、由该方法制得的纳米团簇及包含该纳米团簇的造影剂与流程
本发明涉及一种金属纳米团簇及其制备方法,具体为一种可用于疾病靶向PET/SPECT成像领域的金属纳米团簇及其制备方法。
背景技术:
PET/SPECT(正电子发射断层成像术/单光子发射计算机断层成像术)成像由于具有较高的检测灵敏性、无限组织穿透性和能对整体成像进行定量分析等特征广泛用于肿瘤的诊断、分期及治疗的评估及神经退行性疾病和心脑血管疾病等的诊断。
目前,[18F]-脱氧葡萄糖(FDG)是常规临床评价的唯一PET放射造影剂,主要用于肿瘤成像。尽管使用FDG作为放射造影剂来评价组织代谢对肿瘤提供了有用的成像工具,但FDG是相对非特异性的,对于成像具有非常低增长率的肿瘤用处不大。因此,针对特定分子放射造影的发展,对临床相关的PET程序的发展和利用是必不可少的。虽然许多放射造影剂被发展,但这些造影剂通常显示出低特异性、在靶组织中蓄积差、在体内清除慢等特性。
64Cu、198Au作为PET/SPECT放射性核素当前受到了广泛的评价。这些放射性金属往往通过一些双功能耦合剂标记到各种纳米材料、量子点、肽、蛋白等。例如64Cu往往用DOTA、NOTA、TETA等形成络合物标记材料。然而,这些放射性金属络合物用于体内核成像有两个内在的局限性:第一、放射性金属核素和耦合剂形成的络合物体内稳定性差,这些常规的双功能螯合剂如DOTA、NOTA或者TETA可以结合许多不同的金属离子,从而导致一些放射性金属离子的释放。此外,体内许多化合物能将Cu(II)还原为Cu(I),引起Cu的损失,这些Cu能和血浆和肝中的蛋白,比如超氧化物歧化酶(SOD)复合,导致Cu在肝脏中很高的蓄积;第二、由于纳米粒表面耦合了放射金属-耦合剂的复合物,纳米粒的表面物理化学性质受到影响。这两个因素最终可能导致对PET成像结果的错误判断。
技术实现要素:
为解决上述技术问题,本发明提供了一种金属纳米团簇的制备方法,包括,提供一混合液,所述混合液包括金属盐、模板剂或包含疾病靶向配体的模板剂;使所述混合液体系发生氧化还原反应,以将所述金属盐所包含的金属离子还原为金属原子,所述金属原子通过作用于所述模板剂,形成所述金属纳米团簇;其中,所述模板剂选自蛋白、肽、聚合物或DNA。
根据本发明的一实施方式,所述金属纳米团簇的粒径为1~4nm,所述模板剂与所述金属盐的摩尔比可以为(1~5):(0.1~0.5),也可以为其它比值。
根据本发明的另一实施方式,所述金属纳米团簇的制备方法包括将所述金属盐的水溶液与所述模板剂的水溶液混合,形成所述混合液;所述模板剂的水溶液的浓度优选为1~100mg/mL,也可以为其它浓度;所述模板剂优选为蛋白或肽,所述蛋白可选自牛血清白蛋白、人血清白蛋白、鼠血清白蛋白、肌特异性肌动蛋白、转铁蛋白或者其它水溶性蛋白。
根据本发明的另一实施方式,通过向所述混合液中加入强碱或还原剂,使所述混合液体系发生氧化还原反应;所述强碱优选为NaOH或KOH,也可以为其它可溶性碱,所述还原剂优选为NaBH4。
根据本发明的另一实施方式,所述金属盐的金属离子为放射性金属离子,或者所述金属盐的金属离子为非放射性金属离子。
根据本发明的另一实施方式,所述金属盐包括放射性金属离子和非放射性金属离子,所述放射性金属离子与所述非放射性金属离子互为同位素。
根据本发明的另一实施方式,所述金属盐优选为Cu的一价盐或二价盐,或者Au的一价盐或三价盐;所述放射性金属离子被还原为放射性金属,所述放射性金属优选为64Cu或198Au,也可以为其它放射性金属;优选地,所述金属盐的放射剂量为10~1000MBq。
根据本发明的另一实施方式,所述金属纳米团簇的制备方法包括:
将带有羧基的疾病靶向配体与碳二亚胺和N-羟基琥珀酰亚胺混合,以激活所述疾病靶向配体的羧基,向该体系中加入蛋白,搅拌10~14h,用截留量8000~12000的透析袋透析6~12h,制得所述包含疾病靶向配体的模板剂;
将放射性金属盐溶液与非放射性金属盐溶液混合,形成所述金属盐溶液; 将所述金属盐溶液与所述包含疾病靶向配体的模板剂混合,形成所述混合液;
向所述混合液中加入所述强碱调节pH值为10~14,使所述混合液体系发生氧化还原反应,待溶液的颜色发生改变后,在20~55℃搅拌5~8h,得到所述金属纳米团簇。
本发明还提供了一种金属纳米团簇,由上述任一项所述的方法制得。
本发明进一步提供了一种用于成像的造影剂,包括上述任一项所述的方法制得的金属纳米团簇。
本发明提供的金属纳米团簇,用于PET成像具有诸多优点:放射标记稳定性大大提高,确保了诊断的精确性;纳米团簇超小的粒径和水溶性的肽壳致予纳米团簇一些优越的特性,如方便地逃避网状内皮系统的能力,从而提高其在肿瘤的沉积,迅速扩散,并且容易通过肾脏清除;模板的存在避免了常规用于耦合放射金属离子的大环耦合剂的使用,且模板可用来耦合功能分子,例如一些疾病靶向的小肽、小分子等。
附图说明
图1a为本发明实施例1的金属纳米团簇CuNC@BSA的高分辨透射电镜图;
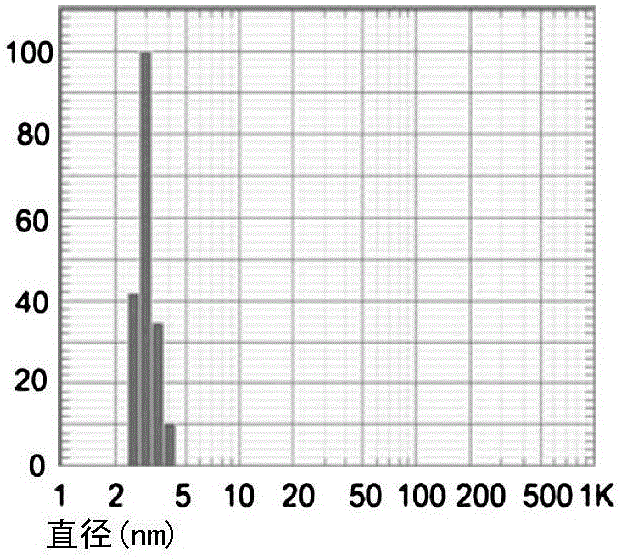
图1b为本发明实施例1的金属纳米团簇CuNC@BSA的DLS粒径分布图;
图1c为本发明实施例1的BSA、CuNC@BSA、CuNC@BSA-LHRH的紫外及荧光光谱图;
图1d为本发明实施例1的BSA、CuNC@BSA的MALDI-TOF质谱图;
图1e为本发明实施例1的BSA、CuNC@BSA-LHRH的MALDI-TOF质谱图;
图1f为根据相关表征结果理论模拟的本发明实施例1的金属纳米团簇的分子结构;
图2a为本发明实施例1的金属纳米团簇CuNC@BSA-LHRH分散到生理盐水孵育24h后的荧光发射光谱图;
图2b为本发明实施例1的金属纳米团簇CuNC@BSA-LHRH分散到DMEM高糖培养基孵育24h后的荧光发射光谱图;
图2c为本发明实施例1的金属纳米团簇CuNC@BSA-LHRH分散到胎牛 血清孵育24h后的荧光发射光谱图;
图2d为本发明实施例1的金属纳米团簇CuNC@BSA-LHRH分散到0.1mM半胱氨酸溶液孵育24h后的荧光发射光谱图;
图3为本发明实施例2的[64Cu]Cu纳米团簇在含有4mM EDTA的pH 7.4的PBS中37℃下孵育24小时后的放射化学纯度的坐标图;
图4a为本发明实施例3的[64Cu]Cu@BSA纳米团簇注射于A549皮下移植瘤后不同时间的PET成像;
图4b为本发明实施例3的[64Cu]Cu@BSA-LHRH纳米团簇注射于A549皮下移植瘤后不同时间的PET成像;
图4c为本发明实施例3的注射[64Cu]Cu@BSA或[64Cu]Cu@BSA-LHRH4小时后,皮下荷瘤鼠各组织器官的纳米团簇的放射活性分布图;
图5a为本发明实施例4的[64Cu]Cu@BSA纳米团簇注射于A549肺原位移植瘤后不同时间的PET成像;
图5b为本发明实施例4的[64Cu]Cu@BSA-LHRH纳米团簇注射于A549肺原位移植瘤后不同时间的PET成像;
图5c为本发明实施例4的注射[64Cu]Cu@BSA或[64Cu]Cu@BSA-LHRH4小时后,原位肺肿瘤移植鼠各组织器官的纳米团簇的放射活性分布图。
具体实施方式
体现本发明特征与优点的典型实施方式将在以下的说明中详细叙述。应理解的是本发明能够在不同的实施方式上具有各种的变化,其皆不脱离本发明的范围,且其中的说明及图示在本质上是当作说明之用,而非用以限制本发明。
本发明提供一种金属纳米团簇的制备方法,包括,提供一混合液,所述混合液包括金属盐、模板剂或包含疾病靶向配体的模板剂;使所述混合液体系发生氧化还原反应,以将所述金属盐所包含的金属离子还原为金属原子,所述金属原子通过作用于所述模板剂,形成所述金属纳米团簇;其中,所述模板剂选自蛋白、肽、聚合物或DNA。
具体地,模板剂与金属盐的摩尔比优选为(1~5):(0.1~0.5),进一步优选为2:0.3。
优选地,可通过向所述混合液中加入强碱或还原剂,使所述混合液体系发生氧化还原反应,所述强碱可以为水溶性的强碱,例如NaOH或KOH,所述还原剂可以为NaBH4。
所述金属盐可以包括放射性金属离子和非放射性金属离子,所述放射性金属离子与所述非放射性金属离子互为同位素。所述金属盐也可以是仅包括放射性金属离子,或者仅包括非放射性金属离子。本发明的放射性金属离子在制备过程中被还原为放射性金属,该放射性金属可以为64Cu或198Au。其中,放射性金属离子是指放射性金属所形成的离子,例如64Cu的离子;非放射性金属离子是指不具有放射性的金属形成的离子;另外,下文所涉及的放射性金属盐是指放射性金属所形成的盐,例如64CuCl2;非放射性金属盐是指非放射性金属所形成的盐。
本发明一实施方式的金属纳米团簇的制备方法,可进一步包括将金属盐的水溶液与模板剂的水溶液混合,形成所述混合液;模板剂水溶液的浓度优选为1~100mg/mL,例如40mg/mL。金属盐的水溶液可以由放射性金属盐溶液与非放射性金属盐溶液混合形成。放射性金属盐溶液与非放射性金属盐溶液的总浓度可以为1~200mM,例如20mM;放射性金属盐的放射剂量可以为10~1000MBq。
本发明中所选用的金属盐溶液可以为二价的金属盐溶液,如CuCl2溶液、CuSO4溶液;三价的金属盐溶液,如HAuCl4溶液;或其它一价的Cu+、Au+的金属盐溶液。其中金属盐溶液可以包括50~150μL放射剂量为347~1041MBq的放射性金属盐64CuCl2溶液,以及850~950μL浓度为15~25mM的非放射性金属盐CuCl2溶液。本发明对金属盐中放射性金属离子与非放射性金属离子的摩尔比没有限定,可根据实际应用对两者的比值进行调整。
本发明所提供的金属纳米团簇以金属团簇作为核心,模板剂作为外壳(模板)形成,在外壳表面可以耦联肿瘤靶向或者中枢神经退行性疾病靶向、心血管靶向的小肽、小分子等,或者直接选用包含疾病靶向配体的模板剂制备金属纳米团簇。
模板剂可以为蛋白、肽、聚合物、DNA等,优选为蛋白或肽,蛋白可以为天然来源的BSA(牛血清白蛋白)、HSA(人血清白蛋白)、MSA(鼠血清白蛋白)、转铁蛋白及其它水溶性蛋白,也可以采用人工合成的蛋白。疾病靶向配 体例如可以是肿瘤靶向配体(LHRH)。
本发明另一实施方式的金属纳米团簇的制备方法,包括:
将肿瘤等疾病靶向配体耦联到蛋白上:将带有羧基的肿瘤等疾病的靶向配体与碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)混合溶解、搅拌以激活配体的羧基,然后将蛋白与上述混合物混合,继续搅拌10~14h,用截留量8000~12000的透析袋透析6~12h后,冻干备用;
将放射性金属盐溶液与非放射性金属盐溶液混合,形成金属盐溶液,并与蛋白或耦联肿瘤等疾病靶向配体的蛋白溶液混合,室温搅拌,加入强碱溶液调节pH值为10~14,如果是含巯基的肽类,可以加入NaBH4还原剂,待溶液的颜色发生改变,所形成的溶液继续在20~55℃搅拌5~8h,得到金属纳米团簇。
进一步地,可将上述合成的放射金属核素纳米团簇用截留量3000的超滤管超滤,以去除游离的金属离子。
其中,带有羧基的肿瘤等疾病的靶向配体与EDC、NHS的摩尔比可以为(0.9~1.1):(1.1~1.3):(0.6~0.4),优选为1.1:1.2:0.5。用于调节pH值的强碱可以为,例如NaOH或KOH,其水溶液的浓度可以为0.4~0.6M。
本发明的金属纳米团簇的制备方法所制备的金属团簇粒径为1~4nm,每个金属团簇含有几个到一百个金属原子,具有光致荧光特征,在生理盐水、DMEM高糖培养基、胎牛血清(FBS)、0.1mM半胱氨酸溶液中都具有很高的稳定性。
本发明的金属纳米团簇的制备方法,利用蛋白等模板剂作为外壳,合成了金属纳米团簇,将放射性金属一步还原生长于蛋白等模板中,无需使用耦合放射性金属的大环耦合剂,因此,蛋白等模板上还可以连接一些肿瘤等疾病的靶向配体,由于放射性金属牢牢地锚定于模板剂中,使得所获得的金属纳米团簇具有高的放射标记稳定性,尤其适用于PET/SPECT成像的造影剂。
本发明的金属纳米团簇与相应的原子和块材相比有独特的特性,它们具有超小的粒径、良好的生物相容性、较高的稳定性、容易制备的特征。金属纳米团簇的模板剂可以根据要求选用不同的蛋白、肽、聚合物、DNA等。在制备金属纳米团簇的时候,可以将放射性金属盐和非放射性金属盐混合制备出具有放射活性的金属纳米团簇。在纳米团簇中放射性金属是纳米团簇整体 的一个结构单元,而不是耦合到纳米团簇,因此,纳米团簇的放射活度能通过在制备时所加的放射性金属盐的量进行调节。
本发明的金属纳米团簇用于PET成像有许多优点:(1)放射标记稳定性大大提高,确保了诊断的精确性;(2)纳米团簇超小的粒径和水溶性的模板剂外壳致予纳米团簇一些优越的特性,如方便地逃避网状内皮系统(RES)的能力,从而提高其在肿瘤的沉积,迅速扩散,并且容易通过肾脏清除;(3)以模板剂作为外壳,无需耦合大环耦合剂,能用来耦合别的功能分子,如一些疾病靶向的小肽、小分子等。
本发明所制备的金属纳米团簇,不仅可以用于肿瘤的诊断、分期及治疗的评估,也可以用于神经退行性疾病和心脑血管疾病等的诊断。
下面,结合具体实施例对本发明的金属纳米团簇及其制备方法与应用做进一步说明。其中,实施例所采用的放射性金属离子为64Cu,其半衰期(12.7h)和衰变特征(β+,0.653MeV,17.8%;β-,0.579MeV,38.4%;剩余的是电子俘获)使其成为肿瘤PET成像和放疗的理想的放射性核素。疾病靶向肽选用具有肿瘤靶向的小肽促性腺激素释放激素(LHRH)。采用高分辨透射电镜(HRTEM,JEM-2100)和动态光散射仪(DLS,NICOMP 380/ZLS(PSS))确定纳米团簇的形貌和粒径;采用UV-1800紫外和Shimadzu RF-5301荧光光谱仪对比合成的纳米团簇和模板蛋白BSA的吸收和荧光光谱特征;合成的纳米团簇采用基质辅助激光解吸电离飞行时间质谱检测(MALDI-TOF,ABI mass system),α-氰基-4-羚基肉桂酸(CHCA)作为基质检测确定团簇核心的Cu原子数。
实施例1、Cu纳米团簇的制备
将1mL、20mM CuCl2溶液与5mL、40mg/mL BSA或5mL、42mg/mL BSA-LHRH蛋白溶液混合,室温搅拌2~3min,加入0.4mL、0.5M NaOH溶液调节pH值到12,溶液的颜色由蓝色变为紫色,所形成的溶液继续在55℃搅拌5h,所合成的Cu纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的Cu纳米团簇分别表示为:CuNC@BSA、CuNC@BSA-LHRH。CuNC@BSA和CuNC@BSA-LHRH在可见光下呈现出紫色,在紫外光下呈现出蓝色的荧光。
如图1a所示,HRTEM显示合成的纳米团簇粒径超小,分散性很好,粒径大约3nm左右,图1b所示的采用DLS测定的粒径大约为3.5nm。图1c所示的紫外和荧光光谱图显示,单纯的BSA在280nm有强吸收峰,CuNC@BSA和CuNC@BSA-LHRH在280nm吸收减弱,说明在蛋白环境中形成了一种新类型材料。BSA上耦连肿瘤靶向肽LHRH没有明显影响纳米团簇的紫外吸收峰。另外,一旦Cu纳米团簇形成,它将显示出荧光特征。CuNC@BSA和CuNC@BSA-LHRH在410nm均有荧光发射峰,而模板蛋白BSA在410nm没有荧光发射峰。
图1d的MALDI-TOF质谱图中BSA的质谱显示两个峰在约66400Da和33200Da左右,分别是单倍离子分子峰和双倍离子分子峰。CuNC@BSA的质谱在m/z 33357Da显示了明显的、但低强度的峰,主要是双倍电离的离子分子峰。上述团簇与模板蛋白BSA的MALDI-TOF质谱峰之间的差异可能归因于5个铜原子,团簇的组成应为Cu5@BSA。
图1e中BSA-LHRH的质谱图中单倍离子分子峰和双倍离子分子峰显示在68993~72882Da及34497~36441Da区域,在BSA分子上有2~5个LHRH分子耦连。CuNC@BSA-LHRH的质谱在m/z 35953Da,是双倍电离的离子分子峰,因此该团簇的结构应为Cu5@BSA-LHRH4。所有这些特征说明了铜纳米团簇在BSA或者BSA-LHRH中形成。所获得的铜纳米团簇是非常稳定的,在铜纳米团簇中铜原子紧紧锚定在BSA或者BSA-LHRH耦联分子中,一旦铜原子从BSA或者BSA-LHRH耦联分子中解离,纳米团簇将不具有荧光特性。
采用密度函数理论计算获得了Cu纳米团簇的分子结构,图1f所示Cu5纳米团簇埋藏在蛋白的结合口袋中,在蛋白结合口袋中,Cu5纳米团簇定位在包括亲水的Tyr137、Tyr160、Arg185氨基酸和疏水的Ile141、Ile181、Pro117氨基酸的亲水/疏水界面,在这些结合口袋的氨基酸残基中,具有苯醌基Tyr137和Tyr160能将CuCl2溶液中的Cu2+还原为Cu原子,合成原位生长的Cu5纳米团簇。从分子对接分析,原位生长的Cu5纳米团簇通过和蛋白的亲/疏水界面接触倾向于稳定定位于它的原生长地。
图2a至2d显示将铜纳米团簇分别分散到生理盐水、胎牛血清、DMEM高糖培养基和1mM半胱氨酸的PBS溶液中在室温孵育24小时后,纳米团簇 的发射峰没有改变,表明铜纳米团簇在上述试剂中具有较高的稳定性。
实施例2、放射活性[64Cu]Cu纳米团簇的制备
将64CuCl2(555毫贝克(MBq),80μL)与920μL、20mM的CuCl2溶液混合,制得金属盐溶液。将5mL、40mg/mL BSA或5mL、42mg/mL的BSA-LHRH蛋白溶液与上述金属盐溶液混合,室温搅拌2~3min,加入0.4mL、0.5M NaOH溶液调节上述混合液的pH值至12,混合液的颜色由蓝色变为紫色,所形成的溶液继续在55℃搅拌5h,得到[64Cu]Cu纳米团簇。最后将所合成的[64Cu]Cu纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的[64Cu]Cu纳米团簇表示为:[64Cu]CuNC@BSA、[64Cu]CuNC@BSA-LHRH。在合成结束后,[64Cu]CuNC@BSA和[64Cu]CuNC@BSA-LHRH的放射标记效率均达到95%以上。
通过薄层色谱法分析了合成的[64Cu]Cu纳米团簇的放射标记稳定性,放射化学纯度为在原点的放射活性作为整个薄层色谱条带上的放射活性百分比。图3显示了所合成的[64Cu]Cu纳米团簇在含有4mM EDTA的pH 7.4的PBS中于37℃下孵育24小时后,放射活性的损失量非常少,放射化学的纯度仍然分别保持在96.8%和97.8%。血清稳定性研究也显示了[64Cu]CuNC@BSA及[64Cu]CuNC@BSA-LHRH在FBS中于37℃下孵育24小时后没有发生解离,放射化学纯度仍然分别保持在98.3%和95.8%,远远高于文献报道的64Cu-DOTA在血清中孵育24小时后81.5%的放射化学纯度。该结果也说明了[64Cu]Cu纳米团簇比64Cu-DOTA有显著较高的稳定性。64Cu非常稳定地存在于[64Cu]CuNC@BSA和[64Cu]CuNC@BSA-LHRH中。
实施例3、放射活性[64Cu]Cu纳米团簇的应用---A549皮下移植瘤
给每只具有A549皮下移植瘤的皮下荷瘤鼠的鼠尾静脉注射6.7~7.4MBq的实施例2制备的[64Cu]CuNC@BSA或者[64Cu]CuNC@BSA-LHRH后,在小动物PET成像仪上获得了不同时间的PET成像。图4a、4b显示,在注射后0.5小时,[64Cu]Cu纳米团簇很快分布到各个组织器官,在1小时之内,肾和膀胱有很强的放射活性信号,这主要是因为超小的[64Cu]Cu纳米团簇通过肾排出,肝和肿瘤也能明显地被看到。由于LHRH(促性腺激素释放激素)可以靶向结合于肿瘤细胞表面高表达的LHRH受体,因此 [64Cu]CuNC@BSA-LHRH的肿瘤摄取比非靶向的[64Cu]CuNC@BSA要高。在注射后4小时,信号慢慢衰减,因此最佳成像窗口是注射后4小时。4小时后,处死鼠,取出各组织脏器采用γ计数仪分析各组织器官64Cu的放射活性,定量分析纳米团簇的生物分布。
和体内PET成像一致,图4c的定量放射活性分布图也显示了肾有较高的[64Cu]Cu纳米团簇蓄积(超过30%ID/g),注射了[64Cu]CuNC@BSA-LHRH的鼠肿瘤的摄取(12%ID/g)几乎是注射[64Cu]CuNC@BSA的鼠肿瘤摄取(3%ID/g)的4倍多。
实施例4、放射活性[64Cu]Cu纳米团簇的应用---原位A549肺肿瘤
为了更好地模拟局部原发肿瘤,本实施例对原位A549肺肿瘤模型进行了体内PET成像。将原位A549肿瘤移植到裸鼠的左肺,肿瘤成型后通过尾静脉注射大约6.7~7.4MBq的[64Cu]CuNC@BSA或[64Cu]CuNC@BSA-LHRH。图5a、5b显示,注射后0.5小时,在注射了[64Cu]CuNC@BSA-LHRH的鼠能清晰地看到左肺的原位A549肺肿瘤,局部的背景信号很低。在注射后0.5~4h,肿瘤对[64Cu]CuNC@BSA和[64Cu]CuNC@BSA-LHRH的摄取有明显的不同。[64Cu]CuNC@BSA-LHRH通过主动靶向和被动靶向的作用倾向于蓄积和滞留在原位肺肿瘤,而大多数[64Cu]CuNC@BSA分布在肾和膀胱。同样地,进行完4小时的PET成像以后,处死鼠,取出各组织脏器采用γ计数仪分析各组织器官64Cu的放射活性。图5c所示表明携带原位肺肿瘤裸鼠的肾显示了高的放射活性(大约30%ID/g),说明纳米团簇通过肾进行清除,导致在肾和膀胱很高的蓄积。移植了肿瘤的鼠的左肺在注射[64Cu]CuNC@BSA-LHRH以后的放射活性是10%ID/g,几乎是注射[64Cu]CuNC@BSA的鼠左肺的放射活性(5.2%ID/g)的2倍。
实施例5、放射活性[64Cu]CuNC@HSA纳米团簇的制备
64CuCl2(347MBq,150μL)与850μL、20mM CuCl2溶液混合,1mL、50mg/mL人血清白蛋白(HSA)溶液混合,室温搅拌2~3min,加入0.5mL、0.5M NaOH溶液调节pH值到10,溶液的颜色由蓝色变为紫色,所形成的溶液继续在55℃搅拌5h,所合成的[64Cu]Cu纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的[64Cu]Cu纳米团簇表示为:[64Cu]CuNC@HSA。
实施例6、放射活性[64Cu]CuNC@MSA纳米团簇的制备
64CuCl2(1041MBq,50μL)与5mL、20mg/mL鼠血清白蛋白(MSA)溶液混合,室温搅拌2~3min,加入0.2mL、0.5M NaOH溶液调节pH值到13,溶液的颜色由蓝色变为紫色,所形成的溶液继续在55℃搅拌5h,所合成的[64Cu]Cu纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的[64Cu]Cu纳米团簇表示为:[64Cu]CuNC@MSA。
实施例7、放射活性[64Cu]CuNC@TRF纳米团簇的制备
64CuCl2(500MBq,100μL)与3mL、30mg/mL转铁蛋白(TRF)溶液混合,室温搅拌2~3min,加入0.3mL、0.5M NaOH溶液调节pH值到12,溶液的颜色由蓝色变为紫色,所形成的溶液继续在55℃搅拌5h,所合成的[64Cu]Cu纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的[64Cu]Cu纳米团簇表示为:[64Cu]CuNC@TRF。
实施例8、放射活性[198Au]Au纳米团簇的制备
198Au的盐溶液(800MBq,100μL)与900μL 20mM HAuCl4溶液混合,5mL、20mg/mL BSA或5mL、50mg/mL BSA-LHRH蛋白溶液混合,室温搅拌2~3min,加入0.3mL、0.5M NaOH溶液调节pH值到12,溶液的颜色由黄色变为棕色,所形成的溶液继续在55℃搅拌5h,所合成的[198Au]Au纳米团簇用截留量3000的超滤管超滤除掉游离的金属离子。合成的[198Au]Au纳米团簇表示为:[198Au]Au NC@BSA,[198Au]Au NC@BSA-LHRH。
上述实施例5至8的相关表征数据及应用数据与实施例1至4类似,故省略了相关说明。
本发明的金属纳米团簇的制备方法,以水溶性蛋白或者肽类等为模板制备了粒径超小的、生物相容性的金属纳米团簇。将放射性金属元素一步还原生长于模板中,无需使用耦合剂。由于放射性金属元素牢牢地锚定于模板中,所获得的金属纳米团簇具有高的放射标记稳定性。而且,模板还可以耦联肿瘤等疾病靶向分子,提高纳米团簇在病变部位的蓄积。该金属纳米团簇由于具有超小粒径,可以快速扩散和分布于病变组织部位,能通过肾脏排泄。根据所用的放射金属元素种类不同,比如可采用64Cu或者198Au,所合成的纳米团簇可用于肿瘤、神经退行性疾病和心脑血管疾病等的PET或者SPECT 成像。
除非特别限定,本发明所用术语均为本领域技术人员通常理解的含义。
本发明所描述的实施方式仅出于示例性目的,并非用以限制本发明的保护范围,本领域技术人员可在本发明的范围内作出各种其他替换、改变和改进,因而,本发明不限于上述实施方式,而仅由权利要求限定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种含有纳米析出相的低成本高强韧铁素体钢板及其制造方法
- Gd<sup>3+</sup>诱导金纳米团簇自组装成金纳米颗粒的方法及应用
- 银纳米团簇在Fe<sup>3+</sup>检测中的应用
- 一种镉离子和抗坏血酸检测用的碳量子点/金团簇比率荧光探针的制作方法
- 一种基于蛋壳膜的水溶性碳量子点的制备方法及其应用
- 制备水溶性发光金属铂、金、银、铜团簇的方法及用图
- 基于金纳米团簇固相复合物的nand逻辑门及其构建方法
- 基于bsa/3-mpa-金纳米团簇的nor逻辑门及其构建方法
- 基于bsa/3-mpa-金纳米团簇的nand+nor复合逻辑门及其构建方法
- 基于bsa/3-mpa-金纳米团簇的implication逻辑门及其构建方法