从废干电池回收锰的方法和回收设备与流程
1.本发明涉及从废干电池回收有价值的金属的方法和回收设备。本发明特别涉及可以将作为废弃的锰干电池和/或碱锰干电池的主要有价值的成分的锰分离并作为可以用作各种电池用的程度的高纯度锰回收作为有价值的金属的从废干电池回收锰的方法和回收设备。
背景技术:
2.近年来,由于金属资源的枯竭、交易价格的上升等,有必要从低品位的原矿、精矿、钢铁厂副产品、工业废弃物等积极地回收有价值的金属。例如,作为有价值的金属之一的锰在工业界的众多领域中被视为必须的金属,担心将来其需求量超过储藏量。特别是在钢铁厂,一直以来作为炼钢原料大量消耗锰,确保锰源是在钢铁领域非常重要的问题。另外,近年来,以锂离子电池为代表的二次电池用锰的消耗增大,在该二次电池领域,确保锰源也成为极其严重的问题。
3.另一方面,在日本国内,大量的干电池被生产、消耗,作为工业废弃物被处理和废弃。作为工业废弃物被废弃的干电池(废干电池)的一部分中锰含有率高。例如,作为一次电池的代表的锰干电池和碱锰干电池使用二氧化锰作为正极材料,使用锌作为负极材料。在锰干电池中,有时在电解液中使用氯化锌。另外,这些干电池的外筒部使用铁。
4.因此,需要从这些废干电池回收锰成分并将其作为炼钢原料再利用的技术。从这样的观点出发,最近提出了各种从废干电池不仅回收锌、铁、碳还回收锰的技术。
5.例如,在专利文献1中提出了一种从废干电池回收冶金原料的方法,其从废干电池对锰电池和碱锰电池进行筛选、粉碎、筛分而得到粉粒体,实施对得到的粉粒体用稀盐酸或稀硫酸进行溶解处理的酸处理,将含有二氧化锰和碳的混合物分离回收。通过专利文献1所记载的技术回收的含有二氧化锰和碳的混合物可以作为锰铁制造的起始原料或作为代替锰铁而在精炼炉中直接使用的材料来利用。
6.另外,在专利文献2中提出了从废干电池分离回收二氧化锰和氯化锌的技术。专利文献2所记载的技术是如下技术:从废干电池中得到大量包含锰和锌的材料,将该材料进行水洗,溶解于盐酸,去除不溶解物(碳粉等),制成氯化锰与氯化锌的混合水溶液,对该溶液通过净液去除杂质,然后加热浓缩,在该浓缩物中加入高氯酸进行加热,将溶液中的氯化锰氧化成二氧化锰,得到二氧化锰与氯化锌的固体混合物,然后在得到的固体混合物中加入水溶解氯化锌,进行过滤,将不溶性的二氧化锰与水溶性的氯化锌分离并回收。应予说明,在专利文献2所记载的技术中,氯化锌溶液溶解于有机溶剂得到氯化锌的精制物。专利文献2所记载的技术的要点在于用少量的高氯酸将氯化锰制成二氧化锰,通过专利文献2所记载的技术得到的二氧化锰和氯化锌可以用于制造新的锰干电池。
7.另外,在专利文献3~5中记载了如下技术:使酸或酸与还原剂作用于将废干电池粉碎、筛分而得的含锰粉粒体,进一步使臭氧作用于得到的锰溶液,由此仅使锰以氧化物的形式沉淀,从废干电池回收作为有价值的成分的锰。
8.更具体而言,在专利文献3中提出了从废干电池回收有价值的成分的方法。在专利文献3所记载的技术中,依次经过:从废干电池筛选锰干电池和/或碱锰干电池的工序;将筛选工序中筛选的干电池粉碎、筛分而得到粉粒体的粉碎
·
筛分工序;将粉碎
·
筛分工序中得到的粉粒体与酸溶液和还原剂混合,从该粉粒体浸出锰和锌的酸浸出工序;将酸浸出工序中得到的浸出液与浸出残渣固液分离的第一固液分离工序;使臭氧作用于第一固液分离工序中分离的浸出液,使该浸出液中包含的锰离子氧化并沉淀,得到含锰沉淀物和含锌离子溶液的臭氧处理工序;以及将臭氧处理工序中得到的含锰沉淀物与含锌离子溶液固液分离的第二固液分离工序;将废干电池中包含的锰成分作为含锰沉淀物回收。由此,在专利文献3所记载的技术中,可以从废干电池取出极少混入锌、碳等的高纯度的锰。应予说明,在专利文献3中,实施在含锌离子溶液中添加碱剂将含锌离子溶液中的锌离子制成含锌沉淀物的碱沉淀处理工序,回收废干电池中包含的锌成分。
9.另外,在专利文献4中提出了从废干电池分离资源的方法。在专利文献4所记载的技术中,依次经过:从废干电池筛选锰干电池和/或碱锰干电池的工序;将筛选工序中筛选的干电池粉碎、筛分而得到粉粒体的粉碎
·
筛分工序;使用酸溶液对粉粒体实施酸浸出处理,得到浸出了锰和锌的浸出液以及含有锰的浸出残渣的酸浸出工序;将酸浸出工序中得到的浸出液与浸出残渣固液分离的第一固液分离工序;使臭氧作用于第一固液分离工序中分离的浸出液,使该浸出液中包含的锰离子氧化并沉淀,得到含锰沉淀物和含锌离子溶液的臭氧处理工序;以及将臭氧处理工序中得到的含锰沉淀物与含锌离子溶液固液分离的第二固液分离工序;将废干电池中包含的锰成分制成浸出残渣和含锰沉淀物,将废干电池中包含的锌成分制成含锌离子溶液。
10.而且,在专利文献5中记载了高品位金属锰的制造方法。专利文献5所记载的技术是如下高品位金属锰的制造方法:在电弧熔解炉中装入含锰物质以及还原剂和助熔剂,通过通电和/或还原剂的反应热将含锰物质还原,制成金属锰。在专利文献5所记载的技术中,作为含锰物质,使用如下得到的含锰物质:对废干电池中包含的锰进行酸浸出处理,对得到的酸浸出液实施臭氧处理,仅使锰以氧化物的形式沉淀,然后实施分离处理。
11.另外,在专利文献6~7中记载了如下技术:利用使铁还原细菌作用于三价铁而得到的二价铁,从金属氧化物或金属氢氧化物浸出锰,回收锰。
12.更具体而言,在专利文献6中提出了金属回收方法。专利文献6所记载的技术是如下技术:使铁还原细菌作用于由金属氧化物和金属氢氧化物构成的组,将三价铁还原成二价铁,使用所得到的二价铁,使由金属氧化物和金属氢氧化物构成的组中包含的钴、镍、锰等金属浸出,生成浸出液和残渣,将得到的浸出液与残渣分离,回收所期望的金属。根据该技术,可以高速
·
高效地回收金属氧化物和金属氢氧化物中包含的低品位的金属。
13.另外,在专利文献7中提出了锰回收方法。专利文献7所记载的技术是具有如下工序的技术:在包含三价铁离子的处理液中混合含有锰的被处理物和铁还原细菌,将三价铁离子还原成二价铁离子,以该二价铁离子为还原剂从上述被处理物浸出锰离子的浸出工序;将得到的浸出液固液分离的固液分离工序;将该固液分离工序后的分离液中包含的锰离子氧化使其不溶化的不溶化工序;以及将得到的锰成分沉淀分离并回收的工序。由此,可以将锰类在相对温和的条件下以高浓缩率浓缩并回收,并且可以从大量的被处理物廉价且简便地回收锰。
14.现有技术文献
15.专利文献
16.专利文献1:日本特开2007-012527号公报
17.专利文献2:日本特开平11-191439号公报
18.专利文献3:国际公开第2015/162902号
19.专利文献4:日本特开2015-206077号公报
20.专利文献5:日本特开2016-156074号公报
21.专利文献6:日本特开2007-113116号公报
22.专利文献7:日本特开2014-5496号公报
技术实现要素:
23.然而,现状是从废弃的锰干电池、碱锰干电池等废干电池回收有价值的金属只不过是锌精炼厂回收废干电池中包含的锌的一部分或者一部分电炉厂回收废干电池中包含的铁、碳的一部分。废干电池中包含的有价值的金属的大部分没有被回收,而是作为废料进行填埋处理等。这是由于废干电池中包含的各种有价值的金属在技术上难以分离,存在经济性不利等问题等。
24.在这一点上,在专利文献2中记载了回收的锰可以用于制造新的锰干电池。但是,在专利文献2所记载的技术中存在步骤复杂的问题,另外存在包括加热浓缩等大量消耗能量的工序而制造成本高涨的问题。
25.进而,通过除专利文献2以外的上述专利文献所记载的技术从废干电池回收的锰都存在作为二次电池的电极材料用原料纯度低的问题。
26.在使用所回收的锰作为二次电池的电极材料用原料的情况下,要求其纯度高。这是因为二次电池的电极材料中混入的杂质对放电容量、重复特性等二次电池性能产生重大影响,导致二次电池的性能显著降低。进而,近年来,已知二次电池的电极材料中混入的杂质的存在也导致由短路引起的电池起火等。因此,对作为二次电池的电极材料用原料使用的锰,要求严格减少杂质。
27.然而,在上述现有技术中,从废干电池容易且低成本地以高纯度回收锰成分是极其困难的。因此,在现有技术中,废干电池中的锰没有被有效地回收利用。
28.本发明是鉴于上述现有技术的问题而进行的,其目的在于提供可以将废干电池中包含的锰作为极少混入锌、铁、碳等杂质的高纯度的含锰溶液回收的从废干电池回收锰的方法和回收设备。
29.应予说明,这里所说的“高纯度的含锰溶液”是指在溶液中作为杂质的锌(zn)、铁(fe)、碳(c)等在使用了常用的jis标准中规定的分析法的分析中均小于分析极限、例如小于0.1mg/l的含锰溶液。
30.如果从废干电池筛分锰干电池和/或碱锰干电池并将它们粉碎进行筛分,则构成干电池的材料被分离成筛子上的固体物和筛子下的粉粒体。在构成干电池的材料中,主要是铁皮状包装材料、锌罐、黄铜棒、纸材、塑料等在粉碎后成为箔状、片状的固体物,被分离到筛子上。另一方面,二氧化锰、碳、氯化锌、氯化铵、苛性钾、或进而通过放电产生的mno(oh)、zn(oh)2、mn(oh)2、zno等成为粉粒体,被分离到筛子下。应予说明,通常在该粉粒体中
不可避免地混入微量的铁。
31.本发明人等为了实现上述目的,对为了将废干电池中包含的锰作为杂质少的高纯度的含锰溶液回收而有效的杂质的分离方法进行了深入研究。特别是本发明人等通过从废干电池对锰干电池和碱锰干电池中的一个或两个进行筛选、进一步进行粉碎、筛分而得到粉粒体,对如何从上述粉粒体去除非目标成分(杂质)进行了深入研究。
32.其结果,本发明人等想到了对如上所述得到的粉粒体首先实施规定的加热处理。本发明人等发现如果对上述粉粒体在非活性气体气氛或还原性气氛中(即非氧化性气氛中)实施加热处理,则可以将粉粒体中包含的锌高效地制成高纯度锌并容易地去除。
33.而且,本发明人等还发现如果使酸与还原剂作用于加热处理后的粉粒体,得到使锰、铁和残留的锌浸出的浸出液,然后根据规定的步骤使残留的锌成分与铁成分从该浸出液选择性地沉淀
·
分离,则无论其沉淀
·
分离工序的步骤,都可以简便且廉价地得到高纯度的锰溶液。
34.作为更具体的一个方案,本发明人等发现通过实施如下工序,可以进一步从浸出液去除锌成分(步骤a中的锌去除工序):通过使硫氢化钠nahs等硫化物作用于该浸出液,首先使残留在浸出液中的锌离子以硫化物(含锌硫化物)的形式选择性地沉淀的硫化物沉淀处理工序;和将得到的含锌沉淀物分离的锌分离工序。而且,本发明人等发现可以容易地将上述锌去除工序后残留的溶液(第一溶液)中的锌离子浓度减少到小于作为分析极限的0.1mg/l。另外,本发明人等还发现通过调整作用的硫化物的量、硫化物离子的浓度、浸出液的ph,可以更好地将残留的锌成分从浸出液分离。
35.而且,发现如果对将锌分离到小于分析极限的第一溶液进一步实施氧化处理工序,将铁离子制成含铁沉淀物并进一步分离(铁分离工序),则作为铁成分分离后残留的溶液(第二溶液),可以简便且廉价地得到高纯度的锰溶液(步骤a中的铁去除工序)。
36.另外,作为具体的另一方案,本发明人等想到了在残留的锌成分之前去除铁成分的情况下,进行:将得到的浸出液氧化而生成含铁沉淀物的氧化处理工序和将得到的含铁沉淀物分离的铁分离工序(步骤b)。本发明人等发现通过例如用空气使浸出液氧化,使浸出液中包含的铁离子例如以氢氧化物的形式选择性地沉淀,从浸出液仅优先分离铁成分,并可以大幅减少铁成分分离后残留的溶液(第一溶液)中的铁离子浓度。另外,本发明人等还发现通过调整浸出液的ph,可以更好地从浸出液仅分离铁成分。
37.而且,发现如果对分离铁成分后的第一溶液接着实施使硫氢化钠nahs等硫化物作用的硫化物沉淀处理,将残留的锌离子制成含锌沉淀物并进一步分离,则作为分离后残留的溶液(第二溶液),可以简便且廉价地得到高纯度的锰溶液。
38.首先,本发明人等对沿上述步骤(a)和(b)分别进行的实验(a)和(b)的结果进行说明。
39.实验(a)
40.从废干电池筛选锰干电池和碱锰干电池(筛选工序),进一步实施粉碎
·
筛分工序而得到粉粒体。
41.在得到的粉粒体中进一步以作为石墨配合比率(:石墨/粉粒体)以质量比计成为0~1的范围的方式配合作为还原剂的石墨。接着,对以各种比率配合了石墨的粉粒体在作为非氧化性气氛的氮气气氛的加热炉中实施加热温度:1000℃、加热时间:30分钟的加热处理
工序。对于加热处理前后的粉粒体,测定重量和锌含量,从加热处理前与加热处理后的粉粒体中包含的锌含量之差根据下式算出基于加热处理的锌去除率。
42.锌去除率[%]=(加热处理前的粉粒体中的zn含量[kg]-加热处理后的粉粒体中的zn含量[kg])
×
100/加热处理前的粉粒体中的zn含量[kg]
[0043]
将得到的结果以表示加热处理工序中的还原剂(石墨)的配合比率与锌去除率的关系的坐标图的形式示于图4。
[0044]
从图4可知,在石墨配合比率:0的情况(也就是说在加热处理工序中不配合作为还原剂的石墨的情况)下,也成为锌去除率:84%。推测这是由于以下机理。即,由于来自干电池的粉粒体中包含的石墨与zno的反应,首先zno被还原为zn(锌)。锌的沸点为900℃左右,因此在加热温度为1000℃的情况下,生成的锌以锌蒸汽的形式从粉粒体挥发去除。
[0045]
进而,从图4也可知,随着提高石墨的配合比率,锌去除率上升,最大可以得到96%的锌去除率。但是,从图4判断也可知,即使石墨配合比率提高到超过0.5,也无法期待锌去除率的显著提高。
[0046]
应予说明,粉粒体的加热处理在非活性气氛或还原性气氛的非氧化性气氛中进行。在大气气氛等氧化性气氛中,粉粒体中包含的或添加到粉粒体的石墨的一部分不与zno而是与空气中的氧反应并燃烧。因此,阻碍从zno到锌的还原。另外,通过加热处理,粉粒体中包含的锌的大部分被挥发去除,但是从图4也可知,通常在加热处理后的粉粒体中残留少量的锌成分。
[0047]
接着,实施如下的酸浸出处理:使酸溶液与还原剂作用于实施了加热处理的粉粒体,使粉粒体中包含的锰成分、铁成分和残留的锌成分浸出到浸出液中(酸浸出工序)。另外,调查该酸浸出工序中的还原剂的添加量对锰成分的浸出率的影响。
[0048]
对从废干电池筛选锰干电池、碱锰干电池并进一步实施粉碎
·
筛分工序而得到的粉粒体不添加石墨等还原剂而是在氮气氛(非活性气氛)中在加热温度:1000℃下实施30分钟加热处理。对得到的加热处理后的粉粒体实施与酸溶液和还原剂混合的酸浸出工序。酸浸出处理条件如下。通过该酸浸出工序,得到至少含有锰离子、残留的锌离子和铁离子的浸出液与除此以外的浸出残渣的混合物。
[0049]
酸溶液:硫酸50ml
[0050]
硫酸浓度:1.5mol/l(质量%浓度约13.2%)
[0051]
还原剂:35%过氧化氢h2o2[0052]
还原剂添加量:0g(0g/l)、0.56g(11g/l)、1.1g(22g/l)、1.7g(33g/l)、2.2g(45g/l)
[0053]
酸浸出处理时间:1小时(搅拌处理)
[0054]
粉粒体与酸溶液的固液比:100g/l
[0055]
酸浸出处理后,将得到的混合物用孔径1μm的滤纸过滤,将浸出液与浸出残渣固液分离(固液分离工序)。对分离的浸出液中的锰浓度通过icp光谱法进行定量。接着,根据所得到的测定值求出浸出液中的锰质量,算出浸出液中的锰质量与加热处理后的粉粒体中含有的锰质量的比例(换算成锰元素),作为锰浸出率。将得到的结果示于图5。
[0056]
从图5可知,无论还原剂(过氧化氢)的添加量,锰浸出率几乎都为100%,通过酸浸出工序,加热处理后的粉粒体中包含的锰成分全部浸出到浸出液。从图6明确,加热处理工
序后的粉粒体中包含的锰的形态主要是mno。mno仅用酸溶解。因此,本发明人等发现,如果对粉粒体实施加热处理工序,则即使在酸浸出工序中不添加还原剂,也可以几乎全部浸出粉粒体中包含的锰成分。
[0057]
应予说明,通过加热处理前的粉粒体中包含的/添加的石墨量、加热温度、加热时间等加热条件,即使在加热处理后也有时残留mno2、mn2o3、mn3o4等mn形态,仅用酸而锰不全部浸出。在这样的情况下,如果添加还原剂(过氧化氢),则可以使以mno2、mn2o3、mn3o4的形式存在的锰也以mn
2+
的形式浸出。
[0058]
通过加热处理,粉粒体中包含的锌的大部分被挥发去除,但是如上所述,在加热处理后的粉粒体中残留少量的锌。因此,对加热处理后的粉粒体实施使酸和根据需要甚至还原剂作用的酸浸出处理而使残留的锌成分浸出,然后如果对得到的浸出液进一步实施硫化物沉淀处理,则如后所述可以使残留的锌成分选择性且充分地沉淀。其结果是想到了可以可靠、容易且廉价地去除锌成分。
[0059]
实施对不配合石墨而进行加热处理工序的加热处理后的粉粒体仅使酸溶液作用的酸浸出处理(酸浸出工序)后,实施将浸出液与沉淀物用孔径1μm的滤纸过滤的固液分离工序,得到浸出液。应予说明,酸溶液的酸浓度为硫酸浓度:1.5mol/l(质量%浓度约13.2%),酸浸出处理时间为1小时进行搅拌处理。通过该酸浸出工序和固液分离工序,得到至少含有锰离子、锌离子和铁离子的浸出液。
[0060]
对得到的浸出液中的锰浓度、锌浓度、铁浓度用icp光谱法进行定量分析,结果锰浓度为66198mg/l,锌浓度为5031mg/l,铁浓度为1131mg/l。
[0061]
接着,实施如下的硫化物沉淀处理工序:在得到的浸出液中以各种条件添加作为硫化物的硫氢化钠nahs的。应予说明,在硫氢化钠(nahs)溶解于蒸馏水的溶液状态下添加。
[0062]
硫化物沉淀处理的条件如下所示。
[0063]
浸出液:100ml
[0064]
硫化物的种类:硫氢化钠(nahs)
[0065]
硫化物的添加量:相对于溶解锌以硫计为1~3当量
[0066]
反应中的浸出液的ph:0.5~5
[0067]
ph调整剂:3m硫酸或100g/l氢氧化钠
[0068]
处理时间:添加硫氢化钠后0.5小时(搅拌处理)
[0069]
然后,在硫化物沉淀处理后,用孔径1μm的滤纸进行抽滤进行固液分离(锌分离工序),对分离的第一溶液的成分(锌、铁、锰)用icp光谱法进行定量分析。应予说明,得到的分析值对由添加硫氢化钠溶液和ph调整剂而稀释的影响进行了校正。将得到的结果示于图7。图7未图示锰的分析结果。
[0070]
从图7(a)可知,在硫化物的添加量为1当量的情况下(nahs:1当量),虽然进行锌的沉淀去除,但是高于分析极限(0.1mg/l),不完全,而且提高ph时的最终的去除率不稳定。
[0071]
另一方面,如图7(b)所示,如果硫化物的添加量为2当量(nahs:2当量),则锌的沉淀去除变得显著。特别是在浸出液的ph为3以上的条件下,可知锌去除工序(硫化物沉淀处理工序和锌分离工序)后的第一溶液中的锌浓度被去除到小于分析极限(0.1mg/l)。另外,即使在图7(c)所示的硫化物的添加量为3当量(nahs:3当量)的情况下,也显示与2当量的情况同样的倾向,特别是ph为3以上时的锌浓度低于分析极限(0.1mg/l),锌的沉淀去除变得
显著。
[0072]
应予说明,从图7可知,通过锌去除工序,也去除铁的沉淀。如图7(b)所示在硫化物的添加量为2当量(nahs:2当量)的情况下,可知在ph为3以上的条件下铁被沉淀去除,在ph为5左右的情况下fe浓度减少到1~10mg/l左右。在图7(b)所示的该条件下,虽然未图示,但是锰浓度也开始降低到55000mg/l左右。也就是说,可知在硫化物的添加量为2当量且ph为3以上的条件下,与锌、铁同时,锰也被一部分沉淀去除。
[0073]
另外,可知即使在图7(c)所示的硫化物的添加量为3当量(nahs:3当量)的情况下,也有与2当量的情况同样的倾向,铁被沉淀去除。如图7(c)所示,可知在ph为5的情况下,铁的沉淀去除变得特别显著,被去除到1mg/l左右。应予说明,虽然未图示,但是在图4(c)中ph为5的情况下,锰浓度的降低显著,30%以上的锰被沉淀去除。也就是说,可知在硫化物的添加量为3当量且ph超过3的条件下,除了去除锌之外,铁和锰也比硫化物的添加量为2当量的情况下沉淀得多。
[0074]
对于实验(a),如上所述,根据使用了含有锰离子、锌离子和铁离子的浸出液的锌去除工序,可以将锌成分沉淀
·
分离去除到小于分析极限。另外,有时与锌(zn)一起,铁(fe)也一部分沉淀。在铁(fe)浓度被沉淀去除到一定程度的情况下,也可以考虑在该阶段结束处理。但是,本发明人等为了进一步高度去除铁,想到需要进一步实施使锌去除工序后分离的第一溶液中包含的铁离子以氢氧化物等含铁沉淀物的形式沉淀的铁去除工序(氧化处理工序和铁分离工序)。
[0075]
实验(b)
[0076]
根据与实验(a)同样的方法,对通过固液分离工序分离的浸出液中的锰浓度、锌浓度、铁浓度通过icp光谱法进行测定,结果锰浓度为66198mg/l,锌浓度为5031mg/l,铁浓度为1131mg/l。
[0077]
接着,对得到的浸出液实施作为氧化处理的空气曝气(氧化处理工序)。空气曝气的条件如下所示。
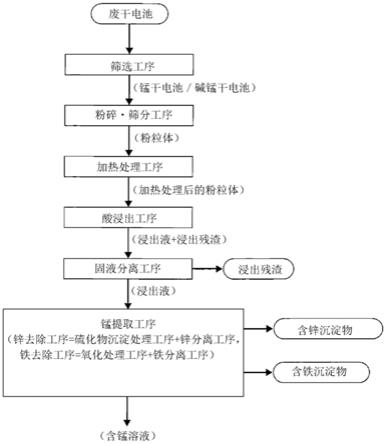
[0078]
注入量:(与浸出液量相同体积)/分钟
[0079]
曝气时间:30分钟
[0080]
反应中的浸出液的ph:4~6
[0081]
ph调整剂:3m硫酸或100g/l氢氧化钠
[0082]
这里,注入量和曝气时间为通常的实际条件(注入量:相对于溶液量为0.1~1倍量/分钟,曝气时间:15~60分钟)的范围内。
[0083]
然后,对空气曝气后的浸出液总量用孔径:1μm的滤纸进行抽滤并固液分离(铁分离工序),对分离的第一溶液的成分浓度(锌、铁、锰)用icp光谱法进行测定。应予说明,对于得到的测定值,校正由ph调整剂产生的稀释的影响。将得到的结果示于图8。由于几乎未确认到通过氧化处理工序沉淀锰和锌,所以图8仅表示铁去除工序(氧化处理工序和铁分离工序)后的第一溶液中的铁浓度。
[0084]
从图8可知,在浸出液为ph:4~6时,fe(铁)被选择性地沉淀去除。应予说明,虽然未图示,但是在该ph范围内锰、锌几乎不沉淀,在ph:6时,锌稍微被沉淀去除,但是其量少至100~200mg/l左右。在ph:5或6的情况下,铁的沉淀去除显著进行,铁浓度减少到低于0.5mg/l。这样,发现仅对浸出液实施作为廉价的氧化处理的空气曝气,可以大幅减少铁浓
度。
[0085]
接着,对调整到ph:5的浸出液实施空气曝气(氧化处理),将铁浓度减少到小于0.5mg/l,然后实施基于固液分离的铁分离工序而得到第一溶液,对上述第一溶液进一步以各种条件实施硫化物沉淀处理工序。
[0086]
硫化物沉淀处理的条件如下所示。
[0087]
第一溶液:100ml
[0088]
硫化物的种类:硫氢化钠(nahs)
[0089]
硫化物的添加量:相对于溶解锌以硫计为1~3当量
[0090]
反应中的第一溶液的ph:0.5~5
[0091]
ph调整剂:3m硫酸或100g/l氢氧化钠
[0092]
处理时间:添加硫氢化钠后0.5小时(搅拌处理)
[0093]
上述硫化物沉淀处理工序后,用孔径1μm的滤纸进行抽滤进行固液分离(锌分离工序),对于分离的第二溶液,用icp光谱法分析其成分。
[0094]
其结果可知,在硫化物的添加量为1当量的情况下(nahs:1当量),虽然进行了锌的沉淀去除,但是高于分析极限(0.1mg/l),不完全,而且提高ph时的最终的去除率不稳定。
[0095]
另一方面,发现如果硫化物的添加量为2当量(nahs:2当量),则锌的沉淀去除变得显著,特别是在第一溶液的ph为3以上的条件下,锌去除工序后的第二溶液中的锌浓度被沉淀
·
去除到小于分析极限(0.1mg/l)。
[0096]
另外发现,即使在硫化物的添加量为3当量(nahs:3当量)的情况下,也显示与2当量的情况同样的倾向,锌的沉淀去除变得显著。应予说明,在硫化物的添加量为3当量的情况下(nahs:3当量),如果ph为5左右,则锰的沉淀去除也显示变大的倾向。
[0097]
对于实验(b),如上所述,对废干电池的粉粒体实施加热处理后,在该加热处理后的粉粒体中混合酸溶液或者甚至还原剂而得到锰、锌、铁浸出的浸出液,如果对上述浸出液首先实施氧化处理,则仅通过实施空气曝气这种简便的氧化处理就可以制成将铁成分的大部分沉淀
·
分离去除了的溶液(铁去除工序)。然后,如果对之后的第一溶液实施使硫化物作用的硫化物沉淀处理工序,则可以将锌成分沉淀
·
去除到小于分析极限(锌去除工序)。
[0098]
这样,发现根据实验(a)和(b),除了加热处理工序之外,通过经过锌去除工序和铁去除工序,不管锌去除工序和铁去除工序的工序步骤,只要实施简便的工序就可以容易地制造将铁和锌都可靠地沉淀
·
分离去除了的高纯度的含锰溶液。
[0099]
本发明是基于这一发现进一步加以研究而完成的。即,本发明的要旨如下所示。
[0100]
(1)一种从废干电池回收锰的方法,其特征在于,依次实施:
[0101]
筛选工序,从废干电池筛选锰干电池和/或碱锰干电池;
[0102]
粉碎
·
筛分工序,将上述筛选工序中筛选的上述锰干电池和/或上述碱锰干电池粉碎、筛分而得到粉粒体;
[0103]
加热处理工序,对上述粉碎
·
筛分工序中得到的上述粉粒体在非氧化性气氛中实施加热处理;
[0104]
酸浸出工序,在实施了上述加热处理工序的粉粒体中混合酸溶液或者甚至还原剂,使该粉粒体所含有的锰、锌和铁从该粉粒体浸出,得到含有锰离子、锌离子和铁离子的浸出液;
[0105]
固液分离工序,将上述酸浸出工序中得到的上述浸出液与除此以外的浸出残渣分离;以及
[0106]
锰提取工序,从上述固液分离工序中分离的上述浸出液去除上述锌离子和铁离子,得到含有上述锰离子的溶液;
[0107]
通过上述锰提取工序以不同顺序包括:
[0108]
锌去除工序,包括使硫化物作用于上述锌离子而使该锌离子沉淀的硫化物沉淀处理工序和进一步将得到的含锌沉淀物分离的锌分离工序;以及
[0109]
铁去除工序,包括使上述铁离子氧化而使该铁离子沉淀的氧化处理工序和进一步将得到的含铁沉淀物分离的铁分离工序;
[0110]
由此得到高纯度的含锰溶液。
[0111]
(2)根据(1)所述的从废干电池回收锰的方法,其特征在于,上述锰提取工序依次进行上述锌去除工序然后是上述铁去除工序,
[0112]
在上述锌去除工序中,在实施使硫化物作用于上述浸出液而使该浸出液中的锌离子沉淀的硫化物沉淀处理工序后,将该硫化物沉淀处理工序中得到的含锌沉淀物与含有锰离子和铁离子的第一溶液固液分离,
[0113]
在上述铁去除工序中,在实施使上述锌去除工序中得到的上述第一溶液氧化而使该第一溶液中的铁离子沉淀的氧化处理工序后,将该氧化处理工序中得到的含铁沉淀物与含有锰离子的第二溶液固液分离。
[0114]
(3)根据(2)所述的从废干电池回收锰的方法,其特征在于,在上述硫化物沉淀处理工序中,将上述浸出液调整为ph:2~6。
[0115]
(4)根据(2)或(3)所述的从废干电池回收锰的方法,其特征在于,在上述氧化处理工序中,对含有上述锰离子和铁离子的第一溶液进行空气曝气,或进一步在该第一溶液中添加氧化剂并将该第一溶液调整为ph:3~7。
[0116]
(5)根据(1)所述的从废干电池回收锰的方法,其特征在于,上述锰提取工序依次进行上述铁去除工序然后上述锌去除工序,
[0117]
在上述铁去除工序中,在实施使上述浸出液氧化而使该浸出液中的铁离子沉淀的氧化处理工序后,将该氧化处理工序中得到的含铁沉淀物与含有锰离子和锌离子的第一溶液固液分离,
[0118]
在上述锌去除工序中,在实施使硫化物作用于上述铁去除工序中得到的上述第一溶液而使该第一溶液中的锌离子沉淀的硫化物沉淀处理工序后,将该硫化物沉淀处理工序中得到的含锌沉淀物与含有锰离子的第二溶液固液分离。
[0119]
(6)根据(5)所述的从废干电池回收锰的方法,其特征在于,在上述硫化物沉淀处理工序中,将含有上述锰离子和锌离子的第一溶液调整为ph:2~6。
[0120]
(7)根据(5)或(6)所述的从废干电池回收锰的方法,其特征在于,在上述氧化处理工序,对上述浸出液进行空气曝气并将该浸出液调整为ph:3~7。
[0121]
(8)根据(1)~(7)中任一项所述的从废干电池回收锰的方法,其特征在于,上述加热处理工序中的上述加热处理是加热到800℃~1200℃的范围的温度的处理。
[0122]
(9)根据(1)~(8)中任一项所述的从废干电池回收锰的方法,其特征在于,在上述加热处理工序中,在上述粉粒体中进一步以相对于上述粉粒体总量的质量比计在0.5以下
的范围内配合碳材料。
[0123]
(10)根据(1)~(9)中任一项所述的从废干电池回收锰的方法,其特征在于,上述酸浸出工序中的上述酸溶液是质量%浓度为1.4%~45%的稀硫酸或质量%浓度为1%~14%的稀盐酸。
[0124]
(11)根据(1)~(10)中任一项所述的从废干电池回收锰的方法,其特征在于,上述酸浸出工序中的上述粉粒体与上述酸溶液的固液比为50g/l以上。
[0125]
(12)根据(1)~(11)中任一项所述的从废干电池回收锰的方法,其特征在于,上述酸浸出工序中的上述还原剂为过氧化氢、硫化钠、亚硫酸氢钠、硫代硫酸钠和硫酸铁中的任一种。
[0126]
(13)根据(1)~(12)中任一项所述的从废干电池回收锰的方法,其特征在于,上述硫化物沉淀处理工序中使用的硫化物为硫氢化钠、硫化钠、硫化氢中的任一种。
[0127]
(14)一种从废干电池回收锰的设备,依次具备:
[0128]
筛选装置,从废干电池筛选锰干电池和/或碱锰干电池;
[0129]
粉碎装置,将上述筛选装置中筛选的上述锰干电池和/或碱锰干电池装入并实施粉碎处理,得到粉碎处理物;
[0130]
筛分装置,对上述粉碎装置中得到的上述粉碎处理物实施筛分处理而得到粉粒体;
[0131]
加热装置,对上述筛分装置中得到的上述粉粒体在非氧化性气氛中实施加热处理;
[0132]
酸浸出槽,在上述加热装置中加热处理的上述粉粒体中混合酸溶液或者甚至还原剂,使该粉粒体所含有的锰、锌和铁从该粉粒体浸出,得到含有锰离子、锌离子和铁离子的浸出液;
[0133]
固液分离装置,将上述酸浸出槽中得到的上述浸出液与浸出残渣分离;以及
[0134]
锰提取装置组,从上述固液分离装置中分离的上述浸出液去除上述锌离子和铁离子,得到含有上述锰离子的溶液;其特征在于,
[0135]
通过上述锰提取装置组以不同顺序包含:
[0136]
锌去除装置组,包含使硫化物作用于上述锌离子而使该锌离子沉淀的硫化物沉淀处理槽和进一步将得到的含锌沉淀物固液分离的锌分离装置;以及
[0137]
铁去除装置组,包含使上述铁离子氧化而使该铁离子沉淀的氧化处理槽和进一步将得到的含铁沉淀物固液分离的铁分离装置;
[0138]
由此从废干电池回收有价值的成分。
[0139]
根据本发明,可以将废干电池中包含的锰成分与碳成分、锌成分、铁成分几乎完全分离,以可以作为二次电池电极材料用的原料利用的程度的高纯度且收率高、廉价地回收,起到工业上的显著效果。
附图说明
[0140]
图1是说明本发明的锰回收方法的工序的流程。
[0141]
图2是说明本发明的锰回收方法的一个实施方式(步骤a)的流程。
[0142]
图3是说明本发明的锰回收方法的另一实施方式(步骤b)的流程。
[0143]
图4是表示加热处理工序中的作为还原剂的石墨配合比率对从粉粒体的锌去除率的影响的坐标图。
[0144]
图5是表示酸浸出工序中的作为还原剂的h2o2添加量对从实施了加热处理的粉粒体向浸出液的锰浸出率的影响的坐标图。
[0145]
图6是加热处理工序后的粉粒体的x射线衍射图案。
[0146]
图7是表示根据图2的流程的硫化物沉淀处理工序中的硫化物添加量((a)nahs:1当量、(b)nahs:2当量、(c)nahs:3当量)和ph条件对锌和铁的沉淀去除的影响的坐标图。
[0147]
图8是表示根据图3的流程的氧化处理工序中的ph对铁沉淀去除的影响的坐标图。
[0148]
图9是说明本发明的锰回收设备的一个实施方式(构成a)的示意图。
[0149]
图10是说明本发明的锰回收设备的另一实施方式(构成b)的示意图。
具体实施方式
[0150]
本发明是涉及以下内容的发明:以废干电池为对象,将废干电池中包含的锰成分与该废干电池中包含的碳成分、锌成分和铁成分分离,作为高纯度的含锰溶液回收的从废干电池回收锰的方法和回收设备。
[0151]
以下,参照图对本发明的实施方式具体进行说明。以下实施方式示出本发明的优选的一个例子,本发明不限定于这些例子。
[0152]
(锰回收方法)
[0153]
如图1所示,本发明的锰的回收方法依次具有筛选工序、粉碎
·
筛分工序、加热处理工序、酸浸出工序、固液分离工序和锰提取工序。另外,锰提取工序以不同顺序包括规定的锌去除工序和铁去除工序。
[0154]
通过本发明的锰回收方法根据上述规定的工序,可以依次可靠地去除废干电池中包含的除锰以外的成分。其结果,根据本发明的锰回收方法,利用废干电池,可以以能够作为二次电池电极材料用的原料利用的程度的高纯度容易地回收锰成分。
[0155]
筛选工序
[0156]
废干电池通常以各种种类的废干电池混合存在的形式被回收。因此,在本发明中,从回收的废干电池中筛选锰干电池和/或碱锰干电池。为了在后续工序中有效地提取锰成分,可以只筛选锰干电池,可以只筛选碱锰干电池,也可以筛选锰干电池和碱锰干电池这两者。作为筛选方法,可以使用手动筛选、利用机器的机械筛选等任意方法。
[0157]
粉碎
·
筛分工序
[0158]
接下来,将筛选工序中筛选的锰干电池和/或碱锰干电池粉碎。粉碎的目的在于从筛选工序中筛选的锰干电池和/或碱锰干电池的构成材料尽可能地排除包含除锰、锌、碳以外成分的材料。
[0159]
如果粉碎这些废干电池,则包装材料(铁、塑料和纸等)、作为锰干电池的负极材料的锌罐、作为碱锰干电池的集电体的黄铜棒成为箔状或片状的固体物。另一方面,作为正极材料的二氧化锰、作为锰干电池的集电体的碳棒、作为碱锰干电池的负极材料的锌粉、通过放电产生的mno(oh)、zn(oh)2、mn(oh)2、zno等化合物以及各种电解液成为比箔状
·
片状的固体物更细的粉粒体。
[0160]
废干电池的粉碎通常使用粉碎机。对粉碎机的类型不特别限定,例如,优选在粉碎
后将构成干电池的包装材料等固体物与粉粒体很好地分离的类型的粉碎机。作为这样的粉碎机,例如,可以举出双轴旋转式的粉碎机。
[0161]
在上述粉碎物的筛分(箔状或片状的固体物与粉粒体的筛分)中使用的筛子的网眼大约优选为1mm以上,优选为20mm以下,更优选为10mm以下,进一步优选为3mm以下。筛子的网眼优选为1~20mm左右,更优选为1~10mm左右,进一步优选为1~3mm左右。如果筛子的网眼为上述下限以上,则可以确保更多的包含锰成分的粉粒体。另外,如果筛子的网眼为上述上限以下,则可以进一步排除包含除锰以外的非目标成分的固体物,可以更有效地进行后续工序。
[0162]
因此,如果在粉碎废干电池后使用上述网眼的筛子进行筛分,则可以从废干电池去除包装材料等大的固体物,有效地得到主要含有锰
·
锌成分和碳的粉粒体。
[0163]
这样,经过粉碎
·
筛分工序得到的粉粒体是作为锰干电池和/或碱锰干电池的主要构成材料的二氧化锰、碳、氯化锌或氯化铵、苛性钾、甚至通过放电产生的mno(oh)、zn(oh)2、mn(oh)2、zno等混合而得的粉粒体。应予说明,通常在该粉粒体中不可避免地混入铁成分。
[0164]
加热处理工序
[0165]
对经过粉碎
·
筛分工序得到的粉粒体在非活性气氛中或还原性气氛中等非氧化性气氛中实施加热处理作为加热处理工序。粉粒体中的锌(zn)主要以zno的形式存在,通过实施加热处理,粉粒体中的石墨与zno反应,从zno还原为锌(zn)。如果在氧化性气氛中进行加热处理,则粉粒体中的石墨或作为还原剂混合的石墨的一部分不与zno而是与气氛中的氧反应并燃烧,因此阻碍从zno到锌的还原反应,锌从粉粒体的去除率降低。因此,加热处理设为在非氧化性气氛中进行,可以在非活性气氛中进行,也可以在还原性气氛中进行。
[0166]
加热处理优选将粉粒体加热到800℃以上,更优选加热到850℃以上,进一步优选加热到900℃以上,优选加热到1200℃以下,优选加热到800℃~1200℃的范围的温度。如果加热处理的温度为800℃以上,则实质上锌的挥发开始并成为锌蒸汽从粉粒体去除。另一方面,如果加热处理的温度超过1200℃,则可以使用的加热炉受到限定。从这样的观点出发,加热处理优选为加热到上述优选范围的温度的处理。
[0167]
另外,在加热处理中,可以仅用粉粒体中的石墨来发生从zno到锌的还原反应。但是,为了提高锌的还原反应的效率,优选在粉粒体中配合非金属系的石墨等碳材料作为还原剂。在配合碳材料的情况下,优选将碳材料以相对于粉粒体总量的质量比(碳材料配合比率=碳材料/粉粒体)计在0.5以下、更优选为0.01~0.5的范围内调整进行配合,进一步优选以0.1左右进行配合。碳材料的体积密度比粉粒体小,因此如果配合以碳材料配合比率计超过0.5的大量的碳材料,则需要大型的加热设备,因此在经济上不利。
[0168]
应予说明,如果使用金属系的还原剂,则有未反应的还原剂在后续工序中使用的酸中溶解而降低含锰溶液的品位的风险,因此使用的还原剂优选为非金属系的碳材料。
[0169]
酸浸出工序
[0170]
在酸浸出工序中,在经过加热处理工序得到的加热处理后的粉粒体中混合酸溶液和还原剂,对粉粒体实施酸浸出处理。通过该酸浸出处理,可以得到主要将锰成分、铁成分和残留的锌成分从粉粒体浸出到酸溶液的浸出液。应予说明,碳成分以固体状态的浸出残渣的形式残留。
[0171]
酸溶液中使用的酸可以是一般的酸,可以使用硫酸、硝酸、盐酸或其他酸。可以根据价格、目的来适当地选择,但是考虑成本和采购的容易性等,优选使用硫酸或盐酸作为酸溶液。
[0172]
在使用硫酸的情况下,优选使用硫酸浓度以质量%浓度计为1.4%~45%的稀硫酸。更具体而言,硫酸浓度优选为1.4%以上,更优选为2%以上,进一步优选为5%以上,优选为45%以下,更优选为30%以下,进一步优选为25%以下。硫酸更优选为浓度为2%~30%的稀硫酸,进一步优选为浓度为5%~25%的稀硫酸。
[0173]
在使用盐酸的情况下,优选使用盐酸浓度以质量%浓度计为1%~14%的稀盐酸。更具体而言,盐酸浓度优选为1%以上,更优选为2%以上,优选为14%以下,更优选为8%以下。盐酸更优选为浓度为2%~8%的稀盐酸。
[0174]
使用的硫酸或盐酸如果是市售的则都可以使用,但是如果将工业用或有害金属成分少的废酸稀释并使用,则可以减少酸的成本。另外,这里的“质量%浓度”是将酸溶液中的酸的质量除以溶液整体的质量后乘以100而得的值。
[0175]
应予说明,在使用任一种酸的情况下,锰成分、铁成分和残留的锌成分的浸出所需的酸浓度都根据粉粒体与酸溶液的固液比、粉粒体的量、粉粒体中的锰、锌和铁的含量、粉粒体中的锰和锌的形态等而变化。因此,优选通过预先进行假设了实机的预备实验来决定最佳的酸浓度。
[0176]
在本发明的酸浸出工序中,在经过了加热处理工序的粉粒体中混合酸溶液或还原剂。在仅用酸不充分浸出的情况下,根据需要进一步添加还原剂,使粉粒体中包含的锰成分几乎完全浸出。作为经过了加热处理的粉粒体中包含的锰的形态,大多是mno,但是也有时包含少量的mno2、mn2o3、mn3o4等。其中,仅用酸溶解的仅为mno和mn3o4的一部分。锰在具有二价价数的情况下溶解于酸,为了用酸溶解具有三价、四价等价数的锰,需要还原成具有二价的价数。因此,需要还原剂作为提供用于还原的电子的物质。应予说明,还原剂的添加量不特别限定,但是由于取决于粉粒体中包含的锰的形态,所以相对于酸溶液为1~500g/l左右就足够了。
[0177]
作为还原剂,可以应用常用的各种还原剂。作为还原剂,可以例示过氧化氢h2o2、硫化钠na2s
·
9h2o、亚硫酸氢钠nahso3、硫代硫酸钠na2s2o3、硫酸铁feso4·
7h2o。应予说明,有时硫系的还原剂产生亚硫酸气体、硫化氢气体等腐蚀性气体,从安全性等观点出发,需要注意。从这样的观点出发,还原剂优选为过氧化氢h2o2。
[0178]
应予说明,对于粉粒体中包含的锌成分,无论有无还原剂,只要增加酸的浓度就几乎全部溶解(浸出)。
[0179]
另外,从实现酸浸出处理的效率化的观点出发,优选将酸浸出工序中的粉粒体与酸溶液的固液比(粉粒体(g)/酸溶液(l))设为50g/l以上。另一方面,如果固液比超过800g/l,则有可能粘度上升产生操作性上的问题,或固液分离工序时的收率恶化。因此,固液比优选为800g/l以下。另外,酸浸出处理的处理温度(气氛温度、酸溶液的温度)在室温(15~25℃左右)下也可以得到充分的效果,但是也可以进行加温。如果进行加温,则在处理溶液不沸腾的范围内越升高温度越可以期待反应效率的提高。酸浸出处理的处理时间优选为5分钟以上,优选为6小时以下。
[0180]
固液分离工序
[0181]
在固液分离工序中,将酸浸出工序中得到的浸出液与浸出残渣固液分离。分离的浸出液含有锰离子、铁离子和残留的锌离子。另一方面,分离的固体的浸出残渣主要是碳残留的结果。由此,可以将粉粒体中包含的锰成分、锌成分和铁成分与碳分离。
[0182]
固液分离方法不特别限定。在固液分离工序中优选使用选自作为常用方法的例如重力沉降分离、过滤、离心分离、压滤、膜分离等的方法。
[0183]
锰提取工序
[0184]
在本发明中,需要进行如下的规定的锰提取工序:从固液分离工序中分离的浸出液去除锌离子和铁离子,得到以高纯度含有锰离子的溶液(含锰溶液)。具体而言,锰提取工序以不同顺序包括规定的锌去除工序和铁去除工序。更具体而言,锰提取工序所包括的锌去除工序包括使硫化物作用于锌离子而使锌离子沉淀的硫化物沉淀处理工序和将得到的含锌沉淀物分离的锌分离工序。另外,锰提取工序所包括的铁去除工序包括使铁离子氧化而使铁离子沉淀的氧化处理工序和将得到的含铁沉淀物分离的铁分离工序。
[0185]
这样,通过在锰提取工序中分别使锌离子和铁离子选择性地沉淀并从浸出液可靠地去除锌离子和铁离子,最终可以以高纯度得到作为目标成分的锰成分。
[0186]
在锰提取工序中,可以先进行包括使锌离子优先沉淀的硫化物沉淀处理工序和锌分离工序的锌去除工序(步骤a),也可以先进行包括使铁离子优先沉淀的氧化处理工序和铁分离工序的铁去除工序(步骤b)。从更容易简化工序的观点出发,优选先进行铁去除工序(步骤b)。在步骤a中,在从浸出液得到含锌沉淀物与含有锰离子和铁离子的第一溶液的混合物后将它们分离。另外,在步骤b中,在从浸出液得到含铁沉淀物与含有锰离子和锌离子的第一溶液的混合物后将它们分离。
[0187]
锌去除工序(步骤a)
[0188]
在步骤(a)中的锌去除工序中,对固液分离的浸出液首先实施硫化物沉淀处理工序。在该硫化物沉淀处理工序中,使硫化物作用于浸出液,浸出液中包含的离子中主要使残留的锌离子以锌硫化物的形式沉淀,可以从浸出液去除。通过该处理,从浸出液得到含有锰离子和铁离子的第一溶液与含锌沉淀物的混合物。
[0189]
在固液分离工序中分离的浸出液中包含锰离子、铁离子和残留的锌离子,如果使硫化物作用于浸出液,则包含的二价金属离子与硫化物离子s
2-反应,生成硫化物并沉淀。该硫化物的沉淀的容易性取决于溶解度积k
sp
。锰、锌、铁的硫化物的溶解度积如下所示。
[0190]
mns:k
sp
=2.5
×
10-10
[0191]
zns:k
sp
=1.6
×
10-24
[0192]
fes:k
sp
=6.3
×
10-18
[0193]
(lange,n.a.:lange's handbook of chemistry.thirteenth edition 1985)
[0194]
溶解度积k
sp
的值越小,越容易形成硫化物,因此在锰、锌、铁中,锌(zn)最容易形成硫化物。因此,在使硫化物作用于包含锰、锌、铁的离子的浸出液的情况下,可以使锌(zn)选择性地以硫化物的形式沉淀。然后,通过调整硫化物离子的浓度、浸出液的ph,可以容易地将浸出液中的锌离子浓度减少到小于分析极限(0.1mg/l)。
[0195]
作为作用的硫化物,可以例示硫氢化钠nahs、硫化钠nas、硫化氢h2s等。应予说明,由于硫化氢是气体,所以需要进行曝气。
[0196]
作用的硫化物量以相对于溶解锌的硫s计优选为1.1当量~5当量。硫化物量以相
对于溶解锌的硫s计优选为1.1当量以上,更优选为2当量以上,优选为5当量以下,更优选为3当量以下,进一步优选小于3当量。如果硫化物量为上述下限以上,则可以使锌离子可靠地沉淀。另外,如果硫化物量为上述下限以下,则可以抑制无意的锰离子的沉淀,并且可以防止所作用的硫化物量过剩而在经济上不利。
[0197]
另外,如果使硫化物作用时的浸出液的ph小于2而过低,则锌的沉淀不足,另一方面,如果超过5而变高,则锰的沉淀量提高,可以回收的锰量显著减少,锰损失加剧,锰收率降低。从这样的观点出发,硫化物沉淀处理工序中的浸出液的ph优选为2以上,更优选为3以上,优选为6以下,更优选为5以下,进一步优选小于5。浸出液的ph优选为ph2~5,进一步优选为ph3~5,进一步优选为ph3以上且小于5。
[0198]
接着,在步骤(a)中的锌去除工序中,将上述硫化物沉淀处理工序中得到的混合物分离为第一溶液和含锌沉淀物(锌分离工序),去除锌成分。
[0199]
更具体而言,将硫化物沉淀处理工序中得到的含有锰离子和铁离子的第一溶液与主要沉淀了残留的锌的硫化物的含锌沉淀物分离。由此,可以容易地从硫化物沉淀处理工序后的混合物分离锌成分,可以制成含有锰离子和铁离子的第一溶液。分离方法不特别限定,可以根据上述固液分离工序。
[0200]
应予说明,在上述硫化物沉淀处理中,有时从溶液中沉淀去除铁(fe)的一部分。在这种情况下,如果将铁去除到小于预先设定的铁浓度,则也可以考虑在该阶段结束处理。但是,在步骤(a)中,为了进一步分离去除铁而得到高纯度的锰成分,进一步进行后述铁去除工序。
[0201]
铁去除工序(步骤a)
[0202]
在步骤(a)中,在上述锌去除工序后实施铁去除工序。在步骤(a)中的铁去除工序中,首先对上述锌去除工序中得到的含有锰离子和铁离子的第一溶液实施氧化处理工序,将第一溶液中的铁离子制成含铁沉淀物,也可以分离去除铁成分。通过该处理,从第一溶液得到高纯度地含有锰离子的第二溶液(含锰溶液)与含铁沉淀物的混合物。
[0203]
作为氧化处理方法,可以根据包含第一溶液的优选ph、后述步骤(b)中的氧化处理方法。这里,如果对经过硫化物沉淀处理工序得到的第一溶液在实际条件下实施空气曝气,则有时不能完全分离去除第一溶液中的铁成分。这是因为硫化物沉淀处理工序中添加的硫化物在该工序中作为还原剂起作用。认为通过该还原剂,消耗由空气曝气供给的氧,由于空气曝气量而氧量不足,在处理后的溶液中残留不能分离去除的铁分。应予说明,如果持续空气曝气,则硫化物成为硫酸离子,最终溶液变成氧化性的,铁成分也沉淀。但是,曝气时间变长,不实用。
[0204]
因此,在步骤(a)中的氧化处理工序中,优选在实施空气曝气后进一步添加氧化剂作为最终氧化处理。氧化剂的添加量优选测定氧化还原电位(vs.she),调整为氧化还原电位成为550mv以上。作为氧化剂,可以例示过氧化氢、过锰酸钾等。
[0205]
应予说明,如果在实施锌去除工序后放置适当时间后实施氧化处理工序,则可以不实施最终氧化处理而用仅空气曝气的处理使铁成分充分沉淀。认为这是因为在前一级的硫化物沉淀处理工序中产生的第一溶液中的作为还原性物质的硫化氢被释放到空气中而第一溶液容易被氧化,即氧化还原电位容易升高。这里所说的适当时间因封闭系统或开放系统等保存状态而异,因此不能一概而论,但是推测为从几天到一周左右。
[0206]
然后,在步骤(a)中的铁去除工序中,将上述氧化处理工序中得到的混合物分离为第二溶液和含铁沉淀物(铁分离工序),去除铁成分。这样,可以回收高纯度的含锰溶液。
[0207]
分离方法不特别限定,可以根据上述固液分离工序。
[0208]
铁去除工序(步骤b)
[0209]
在步骤(b)中的铁去除工序中,对固液分离工序中得到的浸出液首先实施氧化处理。在该氧化处理中,使浸出液氧化而使浸出液中包含的离子中的铁离子以含铁沉淀物的形式沉淀,可以首先将铁成分从浸出液去除。通过该处理,从浸出液得到含有锰离子和锌离子的第一溶液与含铁沉淀物的混合物。
[0210]
作为氧化处理方法,可以应用常用的氧化处理方法,但是在本实施方式的氧化处理工序中,仅用作为廉价的氧化处理方法的空气曝气就足够了。作为空气曝气的条件,从经济的观点出发,优选为通常的实用条件(注入量:(相对于浸出液量为0.1倍量~1倍量)/分钟,曝气时间:15~60分钟)。应予说明,也可以附加添加氧化剂的处理作为最终氧化。
[0211]
应予说明,氧化处理优选使用ph调整剂调整浸出液的ph来进行。如果浸出液的ph小于3而过低,则铁成分不沉淀。另一方面,如果浸出液的ph超过7而过高,则锰成分也同时沉淀。因此,浸出液优选调整为ph3~7的范围。浸出液更优选为ph5以上,更优选为ph6以下,进一步优选为ph5~ph6附近。由此,可以成为能够从浸出液沉淀
·
分离去除铁成分的状态,进而可以得到杂质少的高纯度含锰溶液。
[0212]
接着,在步骤(b)中的铁去除工序中,将上述氧化处理工序中得到的混合物分离为含有锰离子和锌离子的第一溶液以及主要可以含有氢氧化铁的含铁沉淀物(铁分离工序)。由此,可以容易地从氧化处理工序后的混合物去除铁成分,得到含有锰成分和锌成分的第一溶液。
[0213]
分离方法不特别限定,可以根据上述固液分离工序。
[0214]
锌去除工序(步骤b)
[0215]
在步骤(b)中,在上述铁去除工序后实施锌去除工序。在步骤(b)中的锌去除工序中,使硫化物作用于上述铁去除工序中得到的第一溶液,第一溶液中的离子中主要使锌离子以锌硫化物的形式沉淀,也可以将残留的锌成分从第一溶液去除。通过该处理,从第一溶液得到高纯度地含有锰离子的第二溶液(含锰溶液)与含锌沉淀物的混合物。
[0216]
在上述铁去除工序中分离的第一溶液中包含锰离子和锌离子,如果使硫化物作用于第一溶液,则根据与上述步骤(a)中的硫化物沉淀处理工序同样的机理,锌成分选择性地以硫化物的形式沉淀。然后,通过调整所添加的硫化物的量、硫化物离子的浓度、第一溶液的ph,可以容易地将第一溶液中的锌离子浓度减少到小于分析极限(0.1mg/l)。
[0217]
硫化物的种类和第一溶液的优选ph可以根据上述步骤(a)中的硫化物沉淀处理方法。第一溶液的ph特别优选为ph:4。
[0218]
另外,作用的硫化物量以相对于溶解锌的硫s计优选为1.1当量以上,更优选为2当量以上,优选为5当量以下。如果作用的硫化物量小于1.1当量,则虽然进行了锌的沉淀去除,但是不完全,而且最终的去除率也不稳定。如果作用的硫化物量为2当量以上,则锌的沉淀去除也变得显著。另外,如果作用的硫化物量超过5当量,则作用的硫化物量过剩,有时锰也被沉淀去除。
[0219]
然后,在步骤(b)中的锌去除工序中,将上述硫化物沉淀处理工序中得到的混合物
分离为第二溶液和主要沉淀了锌硫化物的含锌沉淀物(锌分离工序),去除锌成分。这样,可以也去除残留的锌成分,作为仅包含锰成分的高纯度的溶液回收。
[0220]
分离方法不特别限定,可以根据上述固液分离工序。
[0221]
通过依次经过上述各工序,可以将废干电池中包含的除锰成分以外的碳成分、锌成分、铁成分几乎完全分离去除,可以将废干电池中包含的锰作为将锌成分、铁成分减少到小于分析极限的高纯度的含锰溶液以高收率回收。
[0222]
应予说明,得到的含锰溶液例如可以进行碱沉淀作为高纯度的氢氧化锰用于各种用途。另外,得到的含锰溶液也可以在混合ni等其他金属后实施碱沉淀处理等,作为二次电池电极材料用的材料利用。
[0223]
(锰回收设备)
[0224]
接着,对本发明的回收设备进行说明。本发明的回收设备依次具备筛选装置、粉碎装置、筛分装置、加热装置、酸浸出槽、固液分离装置和锰提取装置组,具有与本发明的锰回收方法同样的特征和效果。另外,锰提取装置组以不同顺序包含规定的锌去除装置组和铁去除装置组。
[0225]
而且,本发明的锰回收设备例如可以在实施本发明的锰回收方法时适当利用。
[0226]
构成a
[0227]
作为本发明的回收设备的一个方案,将可以很好地实施上述步骤(a)的构成(a)示于图9。如图9示意性所示,回收设备可以依次具备筛选装置10、粉碎装置20a、筛分装置20b、加热装置110、酸浸出槽30、固液分离装置40、硫化物沉淀处理槽52、锌分离装置62、氧化处理槽82、铁分离装置92和含锰溶液回收槽100。这里,硫化物沉淀处理槽52和锌分离装置62构成锌去除装置组,氧化处理槽82和铁分离装置92构成铁去除装置组。另外,锌去除装置组和铁去除装置组构成锰提取装置组。
[0228]
在筛选装置10中,从废干电池筛选锰干电池和/或碱锰干电池。筛选装置的种类不特别限定,可以例示利用形状、放射线等进行分类的装置等。应予说明,废干电池的筛选也可以是手动筛选。
[0229]
粉碎装置20a可以应用通常的粉碎机,但是优选为双轴旋转式粉碎机。
[0230]
筛分装置20b优选具备网眼1mm~20mm的筛子。对于锰回收方法与上述理由同样,筛分装置20b的网眼大约优选为1mm以上,优选为20mm以下,更优选为10mm以下,进一步优选为3mm以下。
[0231]
加热装置110可以是对经过粉碎装置20a和筛分装置20b得到的粉粒体在非活性气氛或还原性气氛的非氧化性气氛中实施加热到设定温度的加热处理的装置,其结构不特别限定。应予说明,如果加热装置是分批式,则优选为通常的可以调节气氛的加热炉。另外,如果加热装置是连续式,则优选为可以加热到设定的温度并可以调节气氛的回转窑等。应予说明,这里所说的气氛调节也包括具备包含锌蒸汽的废气的捕集装置。
[0232]
为了在粉粒体中混合酸溶液和还原剂并进行浸出反应,酸浸出槽30优选为储罐中具备搅拌机的一般搅拌槽。另外,为了对浸出液实施使硫化物作用的硫化物处理,硫化物沉淀处理槽52优选为储罐中具备搅拌机的一般搅拌槽。另外,为了对第一溶液实施氧化处理,氧化处理槽82优选为储罐中具备搅拌机的一般搅拌槽。
[0233]
固液分离装置40、锌分离装置62、铁分离装置92例如都可以使用选自重力沉降分
离装置、过滤装置、离心分离装置、压滤装置、膜分离装置等中的装置。应予说明,各分离装置优选具备可以回收固液分离的沉淀物等的回收槽70a、72b、72c。
[0234]
含锰溶液回收槽100优选为回收由铁分离装置92固液分离的含锰溶液(第二溶液)、可以储液、排出自如地构成的储罐。
[0235]
构成b
[0236]
另外,作为本发明的回收设备的另一方案,将可以很好地实施上述步骤(b)的构成(b)示于图10。如图10示意性所示,回收设备可以依次具备筛选装置10、粉碎装置20a、筛分装置20b、加热装置110、酸浸出槽30、固液分离装置40、氧化处理槽53、铁分离装置63、硫化物沉淀处理槽83、锌分离装置93和含锰溶液回收槽100。这里,氧化处理槽53和铁分离装置63构成铁去除装置组,硫化物沉淀处理槽83和锌分离装置93构成锌去除装置组。另外,铁去除装置组和锌去除装置组构成锰提取装置组。
[0237]
这里,筛选装置10、粉碎装置20a、筛分装置20b、加热装置110、酸浸出槽30、固液分离装置40、铁分离装置63、锌分离装置93、回收槽70a、73b、73c、含锰溶液回收槽100都对于构成a如上所述。
[0238]
为了对浸出液实施氧化处理,氧化处理槽53优选为储罐中具备搅拌机的一般搅拌槽。为了对第一溶液实施使硫化物作用的硫化物沉淀处理,硫化物沉淀处理槽83优选为储罐中具备搅拌机的一般搅拌槽。
[0239]
应予说明,在本发明中,构成回收设备的各种装置、反应槽、回收槽只要具有上述各自的功能,就无论其结构等。
[0240]
实施例
[0241]
以下,基于实施例,进一步对本发明进行说明。应予说明,以下实施例示出本发明的优选的一个例子,不限定本发明。另外,以下实施例也可以在可以符合本发明主旨的范围内加入变更来实施,这样的方案也包含在本发明的技术范围内。
[0242]
(实施例1)
[0243]
粉粒体的制作
[0244]
实施如下工序,得到废干电池的粉粒体:从废干电池筛选锰干电池和碱锰干电池的工序;以及将筛选的废干电池粉碎,用网眼2.8mm的筛子进行筛分,得到废干电池的粉粒体的粉碎
·
筛分工序。将得到的粉粒体的组成示于表1。应予说明,得到的粉粒体除了表1所示的元素以外,还包含来自氧化物或氢氧化物的氧、若干氢和水分。
[0245][0246]
浸出液的制作
[0247]
对得到的粉粒体不配合石墨而是进行装入到加热装置110并实施加热处理的加热处理工序。加热处理是在作为非活性气氛的n2气氛中加热温度:1000℃、加热时间:1小时的处理。
[0248]
将经过加热处理工序得到的粉粒体投入到酸浸出槽30,实施酸浸出工序。在酸浸出工序中,实施在粉粒体10g中混合酸溶液100ml并从粉粒体浸出锰、锌和铁的酸浸出处理。酸溶液的酸浓度为硫酸浓度:3n(质量%浓度约13.2%)。应予说明,酸浸出处理时间为1小时,酸浸出处理为搅拌处理。在这种情况下,作为粉粒体与酸溶液之比的固液比为100g/l,还原剂相对于酸溶液的添加量为100g/l。
[0249]
酸浸出处理后,实施如下的固液分离工序:将得到的浸出液与浸出残渣装入到固液分离装置40,用孔径1μm的滤纸进行过滤进行固液分离。对得到的浸出液中的锰浓度、锌浓度、铁浓度通过icp光谱法进行定量。将固液分离工序后的浸出液中的锰、锌、铁各成分的浓度(mg/l)示于表2。
[0250]
应予说明,基于所得到的浸出液的锰浓度,算出浸出液中的锰质量,算出浸出液中的锰质量相对于另外测定的加热处理后的粉粒体中的锰质量的比例(换算成锰元素),作为锰浸出率。锰浸出率为100%。
[0251]
第一溶液的制作(锌去除工序)
[0252]
接着,进行如下的硫化物沉淀处理工序:将由固液分离工序得到的浸出液装入到硫化物沉淀处理槽52,作用硫化物。在硫化物沉淀处理工序中,在浸出液中以相对于溶解锌以硫s计成为2当量的方式添加作为硫化物的硫氢化钠nahs。应予说明,硫氢化钠在溶解于蒸馏水的溶液状态下添加。另外,用ph调整液(3m硫酸或100g/l氢氧化钠)调整为硫化物沉淀处理中的浸出液的ph成为4。另外,硫化物沉淀处理的处理时间为30分钟,为搅拌处理。
[0253]
将上述硫化物沉淀处理工序后的混合物装入到锌分离装置62,实施用孔径1μm的滤纸进行抽滤进行固液分离的锌分离工序,分离为第一溶液和含锌沉淀物。然后,对得到的第一溶液的成分通过icp光谱法进行定量分析。应予说明,记录硫氢化钠溶液和ph调整剂的添加量,从分析值校正由这些溶液稀释的影响。将得到的结果作为“锌去除工序后的第一溶液”一并记于表2。
[0254]
第二溶液的制作(铁去除工序)
[0255]
接着,进行如下的氧化处理工序:将经过锌去除工序得到的第一溶液装入到氧化处理槽82,进行氧化反应。在氧化处理工序中,作为氧化处理,首先对得到的第一溶液实施空气曝气。空气曝气的条件为注入量:(与第一溶液量相同体积)/分钟,曝气时间:30分钟。对于实施空气曝气后用孔径1μm的滤纸抽滤而得的第一溶液,对包含的成分用上述方法进行定量分析。将得到的结果作为“氧化处理后的中间溶液”一并记于表2。
[0256]
接着,作为进一步的氧化处理,在上述空气曝气后立即在第一溶液中添加氧化剂。以第一溶液的ph成为5的方式添加ph调整液(3m硫酸或100g/l氢氧化钠)进行调整后,以氧化还原电位成为550mv以上的方式添加约8~16ml的作为氧化剂的过氧化氢。这样,使第一溶液中的铁成分以氢氧化铁的形式沉淀,成为可以去除的状态。应予说明,利用氧化剂的处理时间为30分钟。
[0257]
实施如下的铁分离工序:将利用空气曝气和氧化剂添加的氧化处理工序后的混合物装入到铁分离装置92,用孔径1μm的滤纸进行抽滤,固液分离为第二溶液和含铁沉淀物。
[0258]
对于得到的第二溶液,对包含的成分用上述方法进行定量分析。应予说明,记录过氧化氢和ph调整剂的添加量,从分析值校正由这些溶液稀释的影响。将得到的结果作为“铁去除工序后的第二溶液”一并记于表2。
[0259]
表2
[0260][0261]
※
第二溶液中的最终的mn收率:95.4%
[0262]
从表2可知,根据本发明的锰回收方法中的步骤a,可以将废干电池中包含的除锰成分以外的锌成分和铁成分分离去除到小于分析极限(0.1mg/l)。最终的锰成分的收率高达95.4%。这样,可知根据本发明,可以以高纯度的含锰离子溶液的形式容易地且以高收率回收废干电池中包含的锰成分。
[0263]
(实施例2)
[0264]
与实施例1同样地制作粉粒体,得到表1所示的组成的粉粒体。另外,与实施例1同样地制作浸出液,结果固液分离工序后的浸出液中的锰、锌、铁各成分的含量(mg/l)如表3所示。应予说明,与实施例1同样地求出的锰浸出率为100%。
[0265]
接着,与实施例1同样地制作第一溶液(锌去除工序),结果锌去除工序后的第一溶液中的成分如表3所示。
[0266]
接着,进行如下的氧化处理工序:将经过第二固液分离工序得到的溶液在室温下放置一周后,装入到氧化处理槽82,进行氧化反应。在氧化处理工序中,对作为氧化处理作为得到的第一溶液实施空气曝气。空气曝气的条件为注入量:(与第一溶液量相同体积)/分钟,曝气时间:30分钟。对于在实施空气曝气后用孔径1μm的滤纸进行抽滤而得的第一溶液,对包含的成分用上述方法进行定量分析。将得到的结果作为“铁去除工序后的第二溶液”一并记于表3。
[0267]
表3
[0268][0269]
※
第二溶液中的最终的mn收率:95.4%
[0270]
从表3可知,如果在本发明的锰回收方法中的步骤a中将实施硫化物沉淀处理而分离的第一溶液静置适当时间后实施氧化处理工序,则用仅利用空气曝气的氧化处理就可以充分将铁成分以沉淀物的形式分离去除。
[0271]
(实施例3)
[0272]
与实施例1同样地制作粉粒体,得到表1所示的组成的粉粒体。另外,与实施例1同
样地制作浸出液,结果固液分离工序后的浸出液中的锰、锌、铁各成分的含量(mg/l)如表4所示。应予说明,与实施例1同样地求出的锰浸出率为100%。
[0273]
第一溶液的制作(铁去除工序)
[0274]
接着,对固液分离工序中分离的浸出液实施氧化处理工序。在氧化处理工序中,对得到的浸出液实施空气曝气,从浸出液中包含的铁成分生成氢氧化铁,成为可以将铁成分以含铁沉淀物的形式从浸出液分离去除的状态。空气曝气的条件为注入量:(与浸出液量相同体积ml)/分钟,曝气时间:30分钟。应予说明,在实施氧化处理时,使用ph调整剂(3m硫酸或100g/l氢氧化钠)将浸出液调整为ph:5。
[0275]
氧化处理后,将第一溶液与含铁沉淀物用孔径1μm的滤纸进行抽滤,分离为第一溶液和含铁沉淀物(铁分离工序)。然后,对于铁去除工序中得到的第一溶液,对包含的成分(mn、zn、fe)通过icp光谱法进行定量分析。应予说明,记录ph调整剂的添加量,校正测定值中的由ph调整剂引起的稀释的影响。将得到的第一溶液中的锰、锌、铁各成分的浓度(mg/l)作为“铁去除工序后的第一溶液”一并记于表4。
[0276]
第二溶液的制作(锌去除工序)
[0277]
接着,实施如下的硫化物沉淀处理工序:使硫化物作用于铁分离工序中分离的第一溶液,主要使第一溶液中包含的锌离子以锌硫化物(含锌沉淀物)的形式沉淀,成为可以从第一溶液分离去除的状态。使用的硫化物为硫氢化钠nahs,添加为相对于溶解锌以硫s计成为2当量。应予说明,硫氢化钠在溶解于蒸馏水的溶液状态下添加。另外,用ph调整液(3m硫酸或100g/l氢氧化钠)调整为硫化物沉淀处理中的第一溶液的ph成为4。另外,硫化物沉淀处理的处理时间为30分钟,为搅拌处理。
[0278]
将硫化物沉淀处理后的混合物用孔径1μm的滤纸进行抽滤,分离为第二溶液和含锌沉淀物(锌分离工序)。然后,对分离后得到的第二溶液的成分通过icp光谱法进行定量分析。应予说明,记录硫氢化钠溶液和ph调整剂的添加量,从测定值校正由这些溶液稀释的影响。将得到的结果作为“锌去除工序后的第二溶液”一并记于表4。
[0279]
表4
[0280][0281]
※
第二溶液中的最终的mn收率:96.0%
[0282]
从表4可知,根据本发明的锰回收方法中的步骤b,可以将废干电池中包含的除锰成分以外的锌成分和铁成分分离去除到小于分析极限(0.1mg/l)。最终的锰成分的收率高达96.0%。
[0283]
这样,根据本发明,可以以高纯度的含锰离子溶液的形式容易地且以高收率回收废干电池中包含的锰成分。
[0284]
符号说明
[0285]
10
ꢀꢀ
筛选装置
[0286]
20a
ꢀꢀ
粉碎装置
[0287]
20b
ꢀꢀ
筛分装置
[0288]
30
ꢀꢀ
酸浸出槽
[0289]
40
ꢀꢀ
固液分离装置
[0290]
52
ꢀꢀ
硫化物沉淀处理槽(构成a)
[0291]
53
ꢀꢀ
氧化处理槽(构成b)
[0292]
62
ꢀꢀ
锌分离装置(构成a)
[0293]
63
ꢀꢀ
铁分离装置(构成b)
[0294]
70a、72b、72c、73b、73c
ꢀꢀ
回收槽
[0295]
82
ꢀꢀ
氧化处理槽(构成a)
[0296]
83
ꢀꢀ
硫化物沉淀处理槽(构成b)
[0297]
92
ꢀꢀ
铁分离装置(构成a)
[0298]
93
ꢀꢀ
锌分离装置(构成b)
[0299]
100
ꢀꢀ
含锰溶液回收槽
[0300]
110
ꢀꢀ
加热装置。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1