一种介孔二硫化亚铁/二氧化硅微球复合固相铁源的制备方法及其应用与流程
本发明属于难降解有机污染物处理领域,具体涉及一种介孔FeS2/SiO2微球复合固相铁源的制备方法和在去除难降解有机污染物的应用。
背景技术:
Fenton氧化法是一种操作过程简单、反应彻底的高级氧水处理技术,一直被广泛地应用于化工、制药、印染、焦化和制革等污染水体的处理。然而,传统均相Fenton氧化法存在一些缺陷,如受环境pH的影响大,反应在酸性条件下才能进行,导致其应用pH值范围窄,在反应过程中需要反复调节pH值;还有因H2O2与Fe2+快速反应,Fe2+短时间内被全部消耗,导致有机污染物的去除效果持续时间短,反应后体系有大量的Fe3+的残留,容易造成二次环境污染等问题。为了克服传统均相Fenton氧化体系在应用上的诸多技术瓶颈,有不少研究者尝试把含铁的矿物作为固相铁源催化剂,与H2O2相结合构成非均相Fenton氧化体系应用于有机污染物质治理。而这些含铁的矿物主要包括磁铁矿、赤铁矿、针铁矿和黄铁矿等。相关研究表明,采用含铁的矿物替代外加Fe2+的确能使该体系在一定程度上克服了Fe2+的快速被氧化成Fe3+而引起污染物降解反应中止的缺陷。然而,在非均相Fenton氧化体系降解有机污染物的过程中,由于矿物直接与H2O2接触,使两者之间反应非常激烈,容易使含铁矿物因受到快速氧化而使催化剂本身受到大量损耗。另外,反应过程中短时间内产生大量的Fe2+,其中一部分与H2O2反应生成OH·降解有机污染物,还有一部分被氧化为Fe3+而消耗。以上种因素都可能使有机污染物在固相铁源催化剂的非均相Fenton氧化体系中的降解不能维持长时间的高效率运行,最终导致污染物的降解不完全。因此,在固相铁源Fenton氧化体系里,很有必要对矿物铁源的释放速率加予控制,并增加铁源矿物与H2O2、污染物的接触,最终实现维系污染物在Fenton氧化体系中的持续高效降解。
技术实现要素:
本发明的目的是为了克服现有固相铁源非均相Fenton氧化体系因Fe2+离子释放速率过快导致污染物降解不完全、矿物铁源本身快速损耗和因矿物表面活性吸附位点较少,未能与H2O2和污染物质充分接触反应的等缺陷,而提供一种介孔FeS2/SiO2微球复合固相铁源及其制备方法,并应用于水体有机污染物的治理。
本发明的介孔FeS2/SiO2微球复合固相铁源,其是通过以下方法制备的:
通过溶胶-凝胶法在FeS2颗粒表面上形成SiO2微球,从而制备获得介孔FeS2/SiO2微球复合固相铁源。
优选,具体方法为:将十二烷胺溶于乙醇中,在搅拌的条件下加入FeS2颗粒形成混合液,并搅拌,然后往混合液加入正硅酸乙酯并保持搅拌形成固体凝胶,分离固体凝胶,用乙醇洗涤固体凝胶表面的杂质,经真空干燥后,再置于马弗炉中煅烧去模板获得介孔FeS2/SiO2微球复合固相铁源。
进一步优选,是将0.2质量份的十二烷胺溶于乙醇中,在搅拌的条件下加入0.5质量份的FeS2颗粒形成混合液,并搅拌,然后往混合液加入正硅酸乙酯并保持搅拌形成固体凝胶,所述的正硅酸乙酯与十二烷胺的用量按体积质量比为6ml:1g;分离固体凝胶,用乙醇洗涤固体凝胶表面的杂质,固体凝胶于60℃真空干燥后,再置于马弗炉中煅烧去模板获得介孔FeS2/SiO2微球复合固相铁源,所述的煅烧是于600℃下保持240min。
本发明的第二个目的是提供介孔FeS2/SiO2微球复合固相铁源在去除有机污染物中的应用。
优选,所述的应用是介孔FeS2/SiO2微球复合固相铁源联合H2O2在去除有机污染物中的应用。
本发明的第三个目的是提供一种去除有机污染物的方法,其特征在于,将上述FeS2/SiO2微球复合固相铁源和H2O2投加到含有机污染物的水体中形成多相共存体系,去除有机污染物。
所述的含有机污染物的水体优选是含有环丙沙星的抗生素水体。
优选,所述的介孔FeS2/SiO2微球复合固相铁源,其颗粒粒径为1~2μm。
优选,所述的含有机污染物的水体,其pH范围为2.0~9.0,进一步优选为2.0~3.0。
当所述的含有环丙沙星的水体中环丙沙星的浓度范围为0.025~0.15mM,所述的介孔FeS2/SiO2微球复合固相铁源投加量范围为0.75~1.50g/L,所述的H2O2浓度为1~4mM。
进一步优选,所述的含有环丙沙星的水体中环丙沙星的浓度为0.10mM,所述的介孔FeS2/SiO2微球复合固相铁源投加量为1.25g/L,所述的H2O2浓度为3mM,含有环丙沙星的水体的pH值为3.0。
本发明的介孔FeS2/SiO2微球复合固相铁源,其是在矿物铁源表面形成一种介孔SiO2微球包覆结构,这种结构能对矿物铁源的释放速率加予控制,减缓矿物铁源本身的损耗。并且,此微球结构能增加铁源矿物与H2O2、污染物质的接触活性位点,进一步促进体系的催化反应和污染物的降解反应充分进行,最终实现维系污染物质在Fenton氧化体系里的持续高效降解效果。
与现有技术相比,本发明具有以下优点及有益效果:
1、本发明制备出一种介孔FeS2/SiO2微球复合固相铁源,其能与H2O2联合构建新型Fenton氧化体系应用于水体中环丙沙星的去除。一方面,介孔FeS2/SiO2微球复合固相铁源Fenton氧化体系的构建既实现了有机物环丙沙星持续高效的去除,又减轻因大量使用H2O2而产生的运行成本,还避免了Fe3+大量释放而引起的二次环境污染问题。此外,介孔SiO2微球具备较大的比表面积,有序的介孔通道,为环境介质中的污染物质提供更多的吸附活性位点,能进一步提升污染物的去除效果。
2、适用范围广。本发明除了适用于含有环丙沙星的污染水体,还适用于其他含其它难降解的有机污染物水体,此发明为难降解有机污染物的治理提供技术指导。
3、本发明的去除有机污染物的方法具有操作简单、去除彻底、反应物易得、无需复杂设备、对后续的处理无毒害作用及对环境友好等优点。
附图说明:
图1为不同初始pH条件下的环丙沙星去除效果;
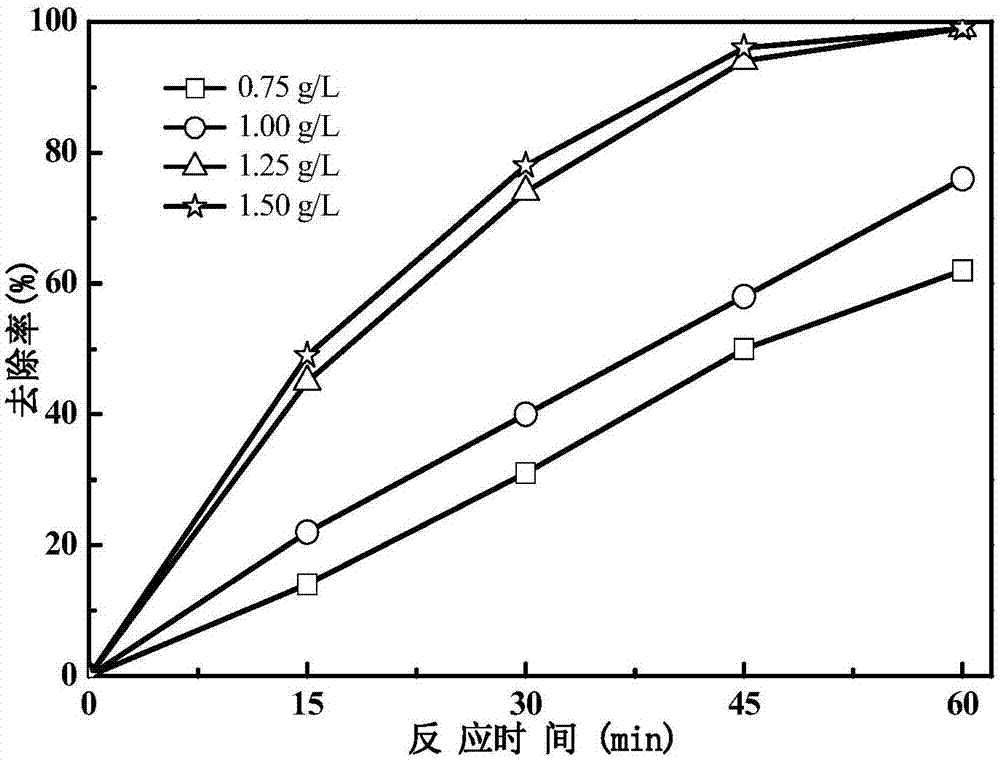
图2为不同催化剂投加量条件下的环丙沙星去除效果;
图3为不同污染物初始浓度下的环丙沙星去除效果;
图4为不同H2O2浓度下的环丙沙星去除效果;
图5为介孔FeS2/SiO2微球复合固相铁源的重复使用效果,其中1、2、3、4、5、6、7、8代表第1、2、3、4、5、6、7、8次使用。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
在以下实施例中,环丙沙星采用高效液相法测定:取经过滤后的水样2mL于棕色进样瓶中,采用安捷伦1100LC系列高效液相,色谱柱为反相C18柱(5μm,150×4.6mm),进样体积为10μL,流动相为0.1%甲酸溶液和乙腈,检测波长为278nm。
实施例1:介孔FeS2/SiO2微球复合催化剂(介孔FeS2/SiO2微球复合固相铁源)的制备
先对块状的黄铁矿进行破碎、研磨、过筛和清洗预处理,得到预处理好的FeS2颗粒。再将0.2g的十二烷胺溶于乙醇,在搅拌的条件下加入0.5g预处理好的FeS2颗粒形成混合液,并保持搅拌10min。然后,往上述混合液加入1.2g的正硅酸乙酯并保持搅拌180min形成固体凝胶,采用离心分离固体凝胶,用乙醇洗涤固体凝胶表面的杂质后,固体凝胶放置于真空干燥器于60℃下保持240min,最后置于马弗炉煅烧于600℃下保持240min去模板获得介孔FeS2/SiO2微球复合固相铁源。
介孔SiO2微球的制备方法,除了不加FeS2之外,其他条件和步骤与介孔FeS2/SiO2微球复合固相铁源的相同,FeS2则采用从矿山采集回来的样品,如天然FeS2。
实施例2:
向含有环丙沙星水体中加入实施例1制备的介孔FeS2/SiO2微球复合固相铁源,与H2O2联合构建新型Fenton氧化体系应用于水体中环丙沙星的去除。去除环丙沙星的方法的具体步骤如下:采用100mL三角瓶为反应器,处理对象是50mL环丙沙星浓度为0.10mM的水体,水体pH调至3.0。往反应器中加入介孔FeS2/SiO2微球复合固相铁源,使其终浓度为1.25g/L,随后加入H2O2,使其终浓度为3mM,并将反应器置于磁力搅拌器上保持均匀搅拌,反应时间为60min。
对比例1:
参照实施例2的去除环丙沙星的方法,本对比例采用FeS2代替介孔FeS2/SiO2微球复合固相铁源,且不加H2O2,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。
对比例2:
参照实施例2的去除环丙沙星的方法,本对比例只采用H2O2,不加催化剂介孔FeS2/SiO2微球复合固相铁源。其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。
对比例3:
参照实施例2的去除环丙沙星的方法,本对比例只采用实施例1制备的介孔SiO2微球代替介孔FeS2/SiO2微球复合固相铁源,不加H2O2,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。
对比例4:
参照实施例2的去除环丙沙星的方法,本对比例只采用实施例1制备的介孔FeS2/SiO2微球复合固相铁源,而不加H2O2,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。
对比例5:
参照实施例2的去除环丙沙星的方法,以本对比例中FeS2替代实施例2中的介孔FeS2/SiO2微球复合固相铁源,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。
比较实施例2和对比例1~5六种情况下环丙沙星的去除效果,结果如表1所示。由表1可知,单独的FeS2或H2O2均不能有效地去除环丙沙星,在反应60min期间,两者去除率分别为10.6%和6.3%,去除率非常低。此外,当采用单独的介孔SiO2微球或介孔FeS2/SiO2微球复合固相铁源时,尽管去除率有一定的提高,但仍然比较低。然而,在FeS2与H2O2联合的Fenton氧化体系下,环丙沙星的去除率达到了84.3%,当采用介孔FeS2/SiO2微球复合固相铁源与H2O2联合构建的新型Fenton氧化体系时,环丙沙星的去除率接近100%,几乎能完全把水体中的环丙沙星降解。数据表明,在FeS2表面形成的介孔SiO2微球不但有效控制了H2O2与Fe2+的反应,使体系维持高去除率,还为环丙沙星提供更多的吸附活性位点,进一步提升环丙沙星的去除效果。与传统均相和非均相Fenton体系相比,以介孔FeS2/SiO2微球复合固相铁源,与H2O2联合构建的新型Fenton氧化体系显示出更大的应用潜力和优势。
表1
实施例3:
本实施例与实施例2基本相同,只是反应器中的水体pH分别调至至2、3、5、7和9,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。结果如图1所示。由图1可知,在这个新型Fenton氧化体系下,环丙沙星的去除率随着pH的升高而下降。在反应60min期间,环丙沙星的去除率在pH 2~3范围内达到了最大值(接近100%)。随后,环丙沙星的去除率随着pH的升高而呈现快速下降的趋势。
实施例4:
本实施例与实施例2基本相同,只是介孔FeS2/SiO2微球复合固相铁源的投加浓度设置为0.75~1.50g/L,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。结果如图2所示。由图2可知,在反应60min期间,环丙沙星的去除率随着介孔FeS2/SiO2微球复合固相铁源的投加量的增加而呈现上升高的趋势,当投加量为1.25g/L时,环丙沙星的去除率几乎达到了最大值(100%),当投加量超过1.25g/L时,环丙沙星的去除率已不再变化。
实施例5:
本实施例与实施例2基本相同,只是环丙沙星初始浓度范围设置为0.025~0.15mM,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。结果如图3所示。由图3可知,在反应60min期间,环丙沙星的去除率随着环丙沙星初始浓度的增大而下降,当环丙沙星浓度从0.025mM增大到0.10mM时,环丙沙星的去除率出现了微小的下降,其去除率仍保持在98%左右。当环丙沙星浓度超过0.10mM时,其去除率均呈现急剧的下降。
实施例6:
本实施例与实施例2基本相同,只是H2O2投加浓度范围设置为1~4mM,其余条件均与实施例2中的相同,测定水体环丙沙星的去除效果。结果如图4所示。由图4可知,在反应60min期间,环丙沙星的去除率随着H2O2投加浓度的增大而上升,当H2O2投加浓度从1mM增大到3mM时,环丙沙星的去除率出现了显著的提高。当H2O2投加浓度超过3mM时,其去除率已无明显的变化。
实施例7:
本实施例与实施例2基本相同,只是待上一轮反应结束后,离心回收介孔FeS2/SiO2微球复合固相铁源,经乙醇清洗后作为下一轮如上述去除水体中环丙沙星的试验中的铁源催化剂,其余条件均与实施例2中的相同,如此重复利用8次,测定水体环丙沙星的去除效果。
对比例:
与实施例7不同之外在于,用FeS2替代介孔FeS2/SiO2微球复合固相铁源,其余条件均与实施例2中的相同,如此重复利用8次,测定水体环丙沙星的去除效果。比较实施例7和对比例两种情况下环丙沙星的去除效果,结果如图5所示。从图5可以看出,两种铁源下的环丙沙星去除率都随着反应次数的增加而降低。当FeS2重复使用三次后,环丙沙星去除率接近80%,然而,当介孔FeS2/SiO2微球复合固相铁源(图5中的FeS2/SiO2微球)重复使用三次后,环丙沙星去除率均能保持在近99%以上。数据表明介孔FeS2/SiO2微球复合固相铁源具有相对较好的重复性能。
- 还没有人留言评论。精彩留言会获得点赞!