用于具有短接触时间的催化部分氧化方法的催化体系与流程
本申请是于2011年5月31日提交的pct申请pct/ep2011/002751的中国国家阶段申请,申请号为201180031641.8、题目为“用于具有短接触时间的催化部分氧化方法的催化体系”的分案申请。本发明涉及适合短接触时间催化部分氧化方法、用于生产合成气和可能在具有另外进程的情况下生产氢气的催化体系,其从以下各物开始:i)处于反应设备的入口温度和压力下的气态烃和/或液态烃,ii)和/或来源于生物质的含氧化合物,iii)空气或富氧空气或氧气和/或水蒸气和/或co2。短接触时间催化氧化方法(sct-cpo)已经由申请人例如在专利mi93a001857、mi96a00690、mi2003a001739、mi2004a001860、mi2007a002209、mi2007a002228中广泛描述。该方法使用烃原料、氧源和可能的水蒸气和co2来在穿过催化床之后生产合成气和可能在适当地穿过其他段之后生产氢气。该技术的应用因此为经由合成气实现的所有那些方法(例如,合成ch3oh及其衍生物、合成nh3及其衍生物、费-托合成法、加氢甲酰化、亚铁矿物的还原)和氢气生产方法。对于氢气生产方法,具体地说,应注意到精炼厂中对于氢气的需求具有逐渐增加的趋势,这是因为需要处理逐渐增多的的重质原料并获得较高品质的产品。已知源于对于蒸汽转化(sr)、自热转化(atr)、非催化部分氧化(pox)技术使用sct-cpo技术的技术优势。此外,sct-cpo技术的特征在于操作简单、可以广泛改变其生产容量且在原料的组成方面具有灵活性,这些特性在精炼厂的情况下受到青睐。通过精炼和升级操作生产的烃的容量和品质实际上可经历时间演变,该时间演变可在一年的不同时期具有循环特征。为了保证sct-cpo技术提供有效的竞争优势,所使用的催化剂必须具有高活性,这意味着烃和/或氧化原料的高转化率、对所关注产物的高选择性和与导致形成不饱和化合物、碳质残余物的前体的反应的低亲和性。在不饱和化合物之中,申请人列出了挥发性有机化合物(voc)和半挥发性有机化合物(svoc)。所述半挥发性有机化合物包含多环芳烃(pah),其定义为由两个或多个稠合环组成的芳族化合物,其主要集合在表1中指出。表1pah集合通常接受的是,pah的形成机制经历了诸如乙炔的不饱和化合物的形成,诸如乙炔的不饱和化合物的形成又源于乙烯的存在。反应机制(如在frencklach等,twentiethsymposiumoncombustion,thecombustioninstitute,pittsburgh,pa,1984,887页中所述)包括首先由非芳族物质形成芳环,随后经由氢原子的消除机制和c2h2加成来生长平坦的多环芳烃、经由pah的聚结及其随后经由聚结生长或经由在颗粒与形成群簇之间的表面反应而成核。该现象在高压下变得更加相关,因为在这些条件下,生成大量的乙烯,这决定着表面生长阶段和灰粒的成核。对实验台规模水平的sct-cpo反应进行的系统研究已经证明在pah的形成与操作条件之间存在相关性:操作条件越接近工业上感兴趣的高压和高空速,则将形成越多的pah。更具体地讲,在高于15atm的压力条件下,已经显示存在pah,其即是在适度的量(所显示的最大浓度为约10ppm)下,也可能是有害的,因为随时间可能存在累积效应。实际上,碳质化合物和/或烟灰沉积物可能导致沾污和/或堵塞现象:1.在用于生产合成气的催化剂中,2.在用于水煤气变换段中的催化剂中,3.在位于sct-cpo段下游的所有装备例如用于冷却合成气的换热器中。这些现象最初引起sct-cpo工艺的效率低下,但随着反应进行,它们可能导致工厂反经济停工。具体地说,水煤气变换催化剂在存在极小量的烟灰的情况下失活。此外,从实验证据已知pah可在其中发生流出物冷却的管道内形成薄膜。因此降低换热系数,所生成的气体不再被有效地冷却且形成过热区域,这可损害换热器的表面。在目前工艺水平下已知各种方法来解决上述技术问题,其中,降低乙烯和不饱和化合物的浓度通常有助于减少pah的形成。在已知
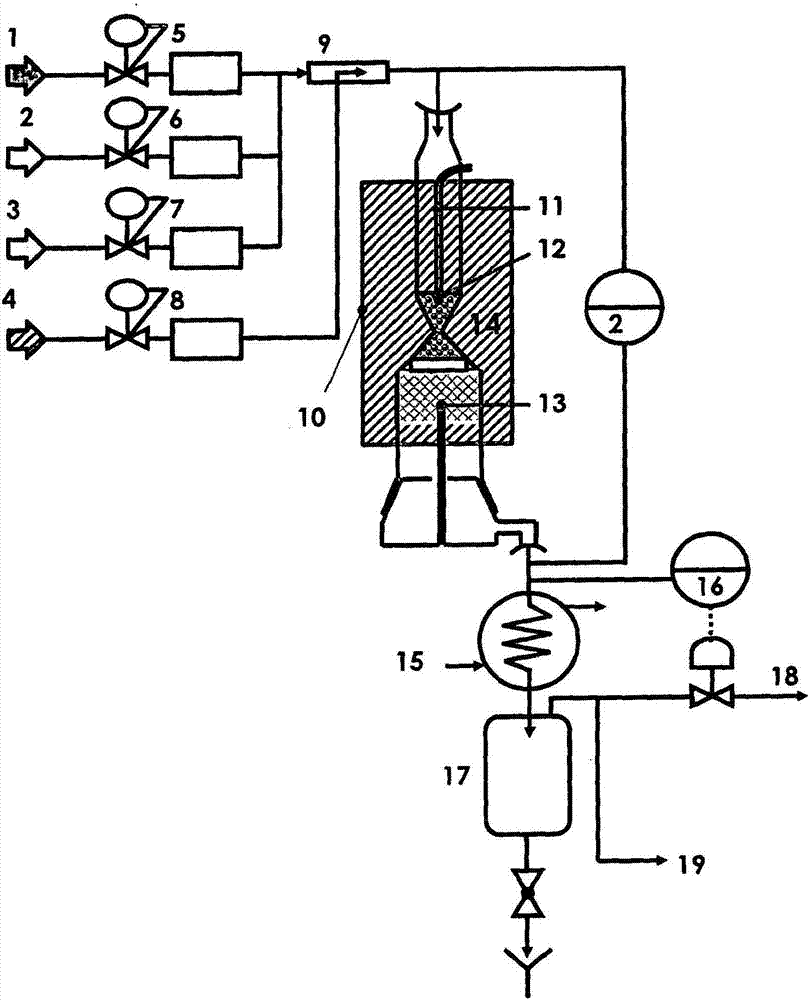
技术领域:
中用来防止形成不饱和化合物碳质残余物的前体的主要技术方案是随试剂流使用大量的蒸汽。然而,以此方式,获得合成气,其以非常高的h2/co比(高于2.00v/v)为特征,这对于合成气生产反应器下游的所有应用如费-托合成来讲不是最佳的。专利us7,226,548b2要求由基于铑和优选铱或钌的高熔点合金组成的催化剂。根据我们的经验,利用所述催化剂,不会减小不饱和分子的浓度且它们的浓度不会比在用由单独的铑组成的催化剂的情况下可获得的不饱和分子浓度低。专利us2004/0005270a1要求包含负载在耐火氧化物上并用金属、优选金稳定化的催化剂。在这种情况下,转化率和选择性值低于用基于单金属铑的催化剂可获得的值。实际上,镍在氧化环境中不稳定,如在图1中指出的埃林厄姆图表所示,其证明对于从0℃到金属镍的熔点的整个范围,如何热动力学促成氧化镍的形成。此外,在氧气存在下使用基于镍的化合物在催化剂的装料和放料操作中产生安全问题,因为氧化镍是致癌的。在专利us6,878,667b2中,使用由单一双金属催化剂、优选基于铑-镍合金和或者镧系元素的双金属催化剂组成的催化床。然而,该方案不如铑-镍合金有效,因为存在以低熔点为特点(表2)的后一元素(ni),如所有基于ni的催化剂,在氧化环境中不稳定。表2化合物t熔点kt塔曼kt许蒂希krh22581129677pd1828914548ru27231362817rh2o31373687412pt20281014608nio22281114669ni1725863518因此,必须研发新的催化体系,使得能够组合原料的高转化率与对co和h2的高选择性及不饱和化合物的低浓度。本发明涉及新的催化体系,其目标在于组合高催化活性(其中,申请人将催化活性指示为试剂的转化率与对合成气的选择性的组合)与降低浓度的副产物如不饱和化合物,所述不饱和化合物导致形成碳质沉积物和/或烟灰。所述催化体系包含总是不同且彼此接触的至少两个催化区(称为“分区催化床”)。从工艺角度上来看,氧化流首先穿过的催化区必须不含有镍,不然将形成氧化镍。本发明的一个目标涉及包含至少两个催化区的催化体系,其中至少一个区排他性地含有一种或多种选自由铑、钌、铱、钯和铂组成的集合的贵金属且至少另一区含有镍,所述催化体系的特征在于至少一个排他性地含有选自由铑、钌、铱、钯和铂组成的集合的贵金属的区总是与至少一个含有镍的区不同,但与所述至少一个含有镍的区接触。本发明的另一目标涉及如上所述的催化体系,其中有可能将一种或多种选自由铑、钌、铱、钯和铂组成的集合的金属加到所述一个或多个包含镍的催化区中。使用一种或多种选自由铑、钌、铱、钯和铂组成的集合的贵金属提供保证原料的高且稳定的转化率和对合成气的选择性的技术优势,而使用镍,可能还有一种或多种铂族金属,提供有效除去在第一催化体系中形成的作为pah的前体的不饱和烃化合物(例如乙烯)且因此有效除去烟灰的技术优势。在组合使用如上所述的各种催化体系中的至少一种类型的情况下,因此生成具有高且稳定的一氧化碳和氢气浓度且在任何情况下都不含或含有降低含量的乙烯和其他不饱和化合物及由其衍生的能够导致在催化剂中和在位于合成气生产段下游的装备中的故障的产物即乙炔、pah、碳质沉积物和/或烟灰。本发明的另一优势在于:获得合成气,其具有显著低百分数的不饱和化合物,并且使用可更容易地产生不饱和副产物碳质化合物的前体的含有相当大量的c2+的高分子量烃和/或含氧化合物和/或天然气。这改善了所生成的合成气的品质。源于使用本发明的目标的催化体系的重要优势在于使用较少量的贵金属,得到相同的催化性能,这引起催化剂成本显著降低。在这方面,降低催化剂所必需的贵金属的量允许至少部分地从关键且战略性的商品中解脱出来。例如,主要用于sct-cpo工艺中的金属铑具有变动剧烈的价格,因为它以少量且在很少的场所连同诸如铂、钯、钌和铱的其他贵金属一起生产。本发明的其他目标和优势自出于纯粹说明性且非限制性的目的而提供的以下描述和附图将显得更明显。图1为埃林厄姆图形;图2为对于在实施例2a、2b、2c、2d和2e中描述的催化试验用于进行在实施例2中描述的催化试验的模型工厂-实验室规模的简图;其中1为氢气,2为甲烷,3为氮气,4为空气,5、6、7和8为放在至少一个减压器之前的质量流量计,9为混合段,11、12和13为热电偶,14为反应段,20为压差指示计,15为用于冷却反应产物的水交换器,16为压力控制器,17为收集槽,18为放空收集器,19为连接到气相色谱仪的分析管线。在该图中没有指出预热器。图3、图4和图5描述在实施例2a、2b、2c和2d中说明的试验的转化率和选择性趋势。图6、图7和图8描述从在实施例2a、2b、2c和2d中说明的试验中获得的反应副产物的浓度趋势。图9和图10说明根据在实施例2e中所述的烃副产物的生产趋势。发明详述本发明的产物目标为特定的催化体系,其允许高催化活性与降低浓度的导致形成碳质沉积物和/或烟灰的副产物的组合。本申请人将催化活性指示为试剂的转化率与对合成气的选择性的组合。作为本发明的目标的催化体系包含至少两个不同且始终彼此接触的催化区。其中,至少一个催化区包含一种或多种选自由铱、铑、钌、钯和铂组成的集合的贵金属且决不能含有镍,而至少一个其他区包含镍,可能已经向该至少一个其他区中加入了一种或多种选自由铱、铑、钌、钯和铂组成的集合的贵金属。这些催化区的特征在于至少一个排他性地含有选自由铱、铑、钌、钯和铂组成的集合的贵金属的区与至少一个含有镍的区始终不同但与其接触。在所述贵金属之中,优选铑。所述催化体系的区优选包含铑且至少另一区包含镍。总体上,所述催化区中的至少一个必须含有镍,且一些催化区可能优选还包含仅包含选自由铱、铑、钌、钯和铂组成的集合、优选铑的贵金属的催化剂。在作为本发明的目标的催化体系中存在的贵金属的量为0.2重量%至10重量%,优选为0.5重量%至2重量%。在作为本发明的目标的催化体系中存在的镍的量为0.5重量%至20重量%,优选为2重量%至10重量%。有利地,可布置所述催化体系的区以形成催化床,其中所述床的层专门地为作为本发明的目标的催化区。如果在反应设备中包括的反应室的几何形状为截锥形,则排他性地含有诸如铑、钌、铱、钯和铂的贵金属的催化床的高度建议为所述床总高度的至少1/3。另一方面,如果反应设备的几何形状为管状,则催化床的最小高度也可低于所述床总高度的1/3。各种标准基于预选的催化体系。优选,在将与包含氧气的物流接触的催化体系的区中不包含含镍的材料,因为它们不相容。如可以推断的,实际上,通过观察埃林厄姆图形(图1,其在0℃至金属镍的熔点的范围内将金属氧化物的形成与温度和氧气的存在相关联),氧化镍的形成在热力学上是有利的。因此,镍在氧化环境中不稳定且因此必须排他性地布置在催化体系的这样的区中,其中该区中的条件使得金属态即高温下的该元素在不存在氧气且存在诸如co和h2的还原剂的条件下稳定。其次,已经任选向其中加入了一种或多种铂族金属的基于镍的催化剂在除去不饱和化合物方面极其有效,但相对于仅基于至少一种贵金属的催化剂具有降低的催化活性。其不仅催化活性较低,而且趋于随反应时间进行而退化。因此设计所描述的催化体系以使得试剂和包含空气、富氧空气或纯氧的氧化流在混合之后在所述催化体系的缺乏镍且因此排他性地含有选自由铱、铑、钌、钯和铂组成的集合的贵金属的区中反应。该混合物开始在该催化区中反应,消耗所有的氧气。所述贵金属保证高且稳定的转化率和对合成气的选择性。部分反应的不含氧气的混合物随后朝向另一催化区流动,在所述另一催化区中可完成引起在缺乏氧气的情况下形成合成气的反应(吸热蒸汽转化和co2-转化反应)且除去在第一催化区中形成的任何可能的不饱和化合物。以此方式,生成不含或在任何情况下具有减少含量的乙烯及其他不饱和化合物和由其衍生的所有副产物(即乙炔、pah、碳质沉积物和/或烟灰)的排出物。本申请人已经证实含有镍的催化体系在除去诸如乙烯及其他产物的不饱和化合物方面特别有效。然而,含有镍的催化体系即使已经被加入了一种或多种选自由铂、铱、钌、钯、铑组成的集合的贵金属,也具有比用仅由选自如上所指出的贵金属的金属组成的催化剂获得的催化性能低的催化性能。催化性能是指原料的转化率值和对合成气的选择性及其随时间的稳定性。因此,仅使用一种催化体系不能组合催化性能与不饱和化合物的减少/消除。形成作为本发明的目标的催化体系的金属用已知
技术领域:
的任何技术沉积。它们例如使用各种浸渍法沉积在以高机械阻力和热阻率以及在至少1,200℃的温度下的化学稳定性为特征的载体上。所述载体优选选自氧化物、氮化物、氮氧化物和碳化物及金属材料。所述载体可以丸粒或结构化形式。结构化载体可为陶瓷或金属的,具有泡沫体几何形状、蜂窝几何形状或针织线样几何形状。特别合适的金属合金为fecr合金,其借助于洗涂法用氧化物层适当涂布,在所述氧化物层上可沉积活性金属。所述丸粒可具有任何几何形状(例如,颗粒,以及不规则、大体上规则的球形、圆柱体,用一个或多个孔充满或穿孔),因此基于欲生产的反应设备的尺寸来选择尺寸。作为本发明的目标的催化体系可用于液态烃和/或气态烃的短接触时间催化部分氧化。作为本发明的目标的催化体系可用于从以下试剂开始生产合成气的短接触时间催化部分氧化方法(sct-cpo)并可能具有进一步的氢气进程:·在反应设备的入口温度和压力下的液态或气态的烃和/或含氧化合物,·空气、具有从21%至100%的任何体积百分数的富氧空气、纯氧;·可能还有蒸汽和/或二氧化碳。所述液态烃选自石脑油、柴油燃料、重质柴油燃料如轻质循环油(lco)及石油炼制和升级循环的其他产物如脱沥青油(dao)。所述气态烃选自甲烷、天然气、炼厂气体、液化石油气及其混合物。更优选所述气态烃原料由天然气和炼厂气体组成。在反应设备的入口温度和压力下可为液态或气态的含氧化合物选自乙醇、乙二醇、脂肪酸甘油三酯、甘油和具有通式cn(h2o)nh2的碳水化合物及其混合物。优选使用从生物燃料的生产方法中作为副产物获得的甘油,因为其易于得到但难以被用于其他用途,因此以很低的成本得到。所述催化部分氧化方法包括以下步骤:*将试剂预热到25℃-350℃的温度且使所述试剂达到2atm至50atm的压力,*在一个或多个通路中预混合试剂以形成均相且可能双相的试剂混合物,*使这样获得的试剂混合物在所述催化体系上反应,以使得所述混合物首先遇到至少一个包含一种或多种选自由铑、钌、铱、钯和铂组成的集合的贵金属的催化区,因此在所述混合物遇到所有含有镍的催化区之前氧气已经完全消耗;在2atm至50atm的反应压力下在10,000nl/kg/h至1,000,000nl/kg/h的空速下历时1ms至1,000ms的接触时间,以形成处于1,200℃的最高温度下的合成气,*在毫秒级别的接触时间下将所述合成气冷却到低于400℃的温度,*任选使所述合成气根据水煤气变换反应来反应以形成富含二氧化碳和氢气的混合物,*任选纯化所述混合物以获得纯氢气流。优选将所述试剂预热以在催化床上的入口处获得100-350℃的温度、甚至更优选200℃-350℃的温度。所述反应压力优选维持在10atm至30atm下。试剂混合物与催化剂的接触时间优选为10ms至100ms。合成气优选在1,150℃的最高温度下离开。所述试剂混合物具有优选为20,000nl/kg/h至200,000nl/kg/h的空速。所述试剂可能可经受任何类型的所需要的预热处理。出于说明性目的提供一些脱硫或加氢脱硫处理的实例。如果液态试剂在入口压力和温度下进料,则优选使用适合使该液流雾化/蒸发的装置,诸如例如在专利wo2006/034868a1中描述的装置。来自反应的排出物的传送以及其冷却必须在几毫秒内迅速发生,以避免不想要的化学反应,诸如在下文中指出的甲烷化[1]和歧化[2],co+h2=ch4+h2o[1]2co=co2+c[2]其在400℃-700℃的温度下是有利的,和裂化[3]cnhm=nc+m/2h2[3]其在高于700℃的温度下是有利的,反应[1]、[2]和[3]降低合成气的生产且导致形成碳质沉积物。作为本发明的目标的催化方法在至少一种反应设备中发生,所述反应设备包括:*混合段;*反应室,其包括:■分别位于作为本发明的目标的催化体系上游和下游的至少两个热挡板;■作为本发明的目标的催化体系,其中按形成催化床的方式布置催化区且其中包含一种或多种选自由铑、钌、铱、钯和铂组成的集合的贵金属的催化区与含有镍的催化区接触且始终在含有镍的催化区前面,*反应产物的冷却段。所述试剂的混合在混合段中进行,所述混合段包括具有圆柱形或截锥形的腔室,其设计成使得所述试剂的停留时间比火焰延迟时间短,这两者都取决于反应混合物的组成和流动、压力和温度条件,且使得所述试剂的线速度高于火焰速度。这避免了从催化床的熄火和火焰反蔓延反应且通常触发在气相中的自由基反应。在所述设备中,布置催化区以形成其中至少一个含有一种或多种选自由铑、钌、铱、钯和铂组成的集合的贵金属的催化区与所有含有镍的催化区接触且始终在所有含有镍的催化区的前面的催化床。所述短接触时间催化部分氧化方法还包括液态和/或气态试剂的入口段,其包括压缩段、预热段和可能的一个或多个试剂预处理段(例如,存在脱硫或加氢脱硫段以除去硫化的化合物)。另外,所述方法可能包括一个或多个所生成合成气的处理阶段,诸如使合成气转变成所需要的最终产物所必需的所有操作。在制氢成套设备的优选情况下,存在一个或多个水煤气变换反应器和氢气纯化系统。作为本发明的目标的催化体系可有利地用于用来借助于短接触时间催化部分氧化反应生产合成气的至少一个反应装置中。所述装置各自含有混合段和包括作为本发明的目标的催化体系的反应室及至少两个热挡板。可在所述装置内布置催化区以形成其中至少一个含有贵金属(铑、钌、铱、钯和铂)的催化区与所有含有镍的催化区接触且始终在所有含有镍的催化区的前面的催化床。在所述催化体系的上游和下游,可使用至少两个热挡板,其由以颗粒、丸粒、蜂窝状或泡沫体形式的惰性陶瓷材料组成。含有所述催化床的作为所述装置的一部分的反应室优选为圆柱形或截锥形或截断的金字塔形。此外,曲面发展的母线与所述设备的纵轴的平行线形成5°-65°、优选10°-45°的角。在所述装置的底部,存在所生成的合成气的冷却区。实施例1-合成实施例1a将7.9grh(no3)3溶液(12.5重量%铑)用去离子水稀释,直至获得36.5cm3的溶液体积。98.8g具有3mm的直径的α-氧化铝球借助于湿式浸渍技术用先前制备的铑溶液浸渍。将浸泡在该金属溶液中的球干燥并在静态马弗炉中根据以下温度分布图煅烧:50℃→120℃,速率v=3℃/min120℃→120℃,时间t=120min120℃→750℃,速率v=3℃/min750℃→750℃,时间t=120min通过自由冷却从750℃到室温r.t.。在煅烧之后,固体具有该标称组成:rh2o31.2重量%,α-氧化铝98.8重量%。铑的重量百分数(作为金属铑)对应于1重量%。实施例1b将4.8grh(no3)3溶液(12.5重量%铑)用去离子水稀释直至获得36.7cm3的溶液体积。99.3g具有3mm的直径的α-氧化铝球借助于湿式浸渍技术用先前制备的铑溶液浸渍。将浸泡在该金属溶液中的球干燥并在静态马弗炉中根据以下温度分布图煅烧:50℃→120℃,速率v=3℃/min120℃→120℃,时间t=120min120℃→750℃,速率v=3℃/min750℃-750℃,时间t=120min通过自由冷却从750℃到室温r.t.。在煅烧之后,固体具有该标称组成:rh2o30.7重量%,α-氧化铝99.3重量%。铑的重量百分数(作为金属铑)对应于0.6重量%。实施例1c将12.5gni(no3)26h2o(纯度98.5重量%)加到4.8grh(no3)3溶液(12.5重量%铑)中;将去离子水加到混合物中直至获得35.6cm3的溶液体积。96.1g具有3mm的直径的α-氧化铝球借助于湿式浸渍技术用先前制备的铑溶液浸渍。将浸泡在该金属溶液中的球干燥并在静态马弗炉中根据以下温度分布图煅烧:50℃→120℃,速率v=3℃/min120℃→120℃,时间t=120min120℃→750℃,速率v=3℃/min750℃→750℃,时间t=120min通过自由冷却从750℃至室温r.t.。在煅烧之后,固体具有该标称组成:rh2o30.7重量%,nio3.2重量%和α-氧化铝96.1重量%。铑的重量百分数(作为金属铑)对应于0.6重量%且镍的重量百分数(作为金属镍)对应于2.5重量%。实施例1d将24.8gni(no3)26h2o(纯度98.5重量%)加到4.8grh(no3)3溶液(12.5重量%铑)中;将去离子水加到混合物中直至获得34.4cm3的溶液体积。93g具有3mm的直径的α-氧化铝球借助于湿式浸渍技术用先前制备的铑和镍的溶液浸渍。将浸泡在该金属溶液中的球干燥并在静态马弗炉中根据以下温度分布图煅烧:50℃→120℃,速率v=3℃/min120℃→120℃,时间t=120min120℃→750℃,速率v=3℃/min750℃→750℃,时间t=120min通过自由冷却从750℃到室温r.t.。在煅烧之后,固体具有该标称组成:rh2o30.7重量%,nio6.3重量%和α-氧化铝93重量%。铑的重量百分数(作为金属铑)对应于0.6重量%且镍的重量百分数(作为金属镍)对应于10重量%。实施例2-催化试验催化试验在实验台规模的成套设备(参见图2)中进行,其中可区分5个主要的段:1.试剂的进料(1、2、3和4)和预热(在图中没有指出),2.混合(9),3.反应(14),4.水冷却(15),5.分析(19)。将试剂(1、2、3、4)预热到约200℃的温度,将其用“管中管”系统(9)混合并送到反应区(14)。该反应器由石英制成,具有圆柱几何形状的反应区和18mm的内径,且插入烘箱中以提供触发反应所必需的热,且一旦达到稳态条件,则使热损失减至最少。所生成的合成气在水交换器(15)中冷却,收集等分试样用于气相色谱分析(19)且剩余的量在穿过压力调节阀门之后送去放空处理(18)。“分析”段包括两个固定的在线gc和一个在线微气相色谱仪,主要用来跟踪在启动阶段和关闭阶段的瞬变值。将催化剂插入两个用来限制热耗散的具有截锥形几何形状的热挡板之间。下部热挡板,其还具有维持催化床的功能,为圆柱形状,直径为40mm且由12mm高的堇青石盘和3mm高的α-al2o3球层组成。另一方面,上部热挡板由占据19mm高的截锥形区的α-al2o3球层组成,入口直径为15mm和出口直径为4mm。在各试验中,催化床具有截锥形几何形状,高度为18mm,入口直径为4mm且出口直径为40mm。分别在距催化床的起点18mm处和距其终点19mm处布置的两个热电偶允许监测试剂混合物和排出物的温度。实施例2a-对比进行四个催化试验,每次装入相同量的在实施例1a、1b、1c和1d中制备的催化剂。各试验用相同的程序进行,即:-一次或多次反应启动,接着相应地达到稳态条件且随后关闭,-在最后一次启动之后,连续监测催化活性至少200小时。在略高于常压的压力下进行试验,进料一定量的甲烷(工业级)和空气以产生0.6v/v的o2/c比。所使用的空速为132,000nl/kg/h。用于评价催化剂性能的参数为甲烷的转化率、对合成气的选择性和对副产物乙烷、乙烯和其他多于两个碳的烃(用c3+指示)的选择性。另外,对于各试验计算氧消耗(所反应的氧气的体积量与有效生成的合成气的体积量的比值),该指数总体上可概况试验的趋势。在该实施例中描述的催化试验通过将约3g其合成在实施例1a中描述的催化剂来进行,试验持续393小时。进行5次启动和四次连续关闭,这对试验的趋势没有影响;对于整个操作时间来讲,转化率、选择性(其趋势指示在图3、4、5的曲线中)和耗氧值维持稳定。甲烷转化率:72.7%(基于体积)对co的选择性:90.7%(基于体积)对h2的选择性:73.1%(基于体积)氧消耗:0.34(基于体积)。至于所关注的副产物的形成,其趋势指示在图5、6和7的曲线中。利用具有1重量%的铑的催化剂,获得最高浓度的烃副产物。具体地讲,基于体积计算,乙烯的浓度为约60ppm,乙烯的浓度为约400ppm且c3+烃的浓度为115ppm。另外,各副产物的形成保持恒定,纵然有略微增加。实施例2b在该实施例中描述的催化试验通过装入约3g其合成在实施例1b中描述的催化剂来进行且具有371小时的持续时间。进行5次启动和4次连续关闭。如在实施例2a中,对于整个操作时间,转化率、选择性(其趋势指示在图3、4、5的曲线中)和氧消耗维持稳定。甲烷转化率:71.6%(基于体积)对co的选择性:92.1%(基于体积)对h2的选择性:71.4%(基于体积)氧消耗:0.35(基于体积)乙烯的浓度具有逐渐增加的趋势(参见图6),从30ppm略微增加到超过40ppm体积。乙烷的浓度稳定,而是相当高的(参见图7),等于约320ppm体积。c3+烃的浓度具有稳定的趋势,但其值第二高。实施例2c在该实施例中描述的催化试验通过装入约3g其合成在实施例1c中描述的催化剂来进行且具有360小时的持续时间。仅进行一次启动程序。在用单金属催化剂(其中该金属为铂族金属的一部分)和用双金属催化剂(在这种情况下,rh0.6重量%和ni2.5重量%)获得的结果对比中,甲烷的转化率值和对氢气的选择性随操作小时数而降低(参见图3和5),而对co的选择性相对稳定,但具有较低的值(参见图4)。在该试验的末尾,试验的评价参数的最终值为:甲烷转化率:65.8%(基于体积)对co的选择性:86.9%(基于体积)对h2的选择性:67.4%(基于体积)氧消耗:0.41(基于体积)所获得的副产物的浓度最低且其以随时间相当恒定的趋势为特征(参见图6、7和8)。实施例2d在该实施例中描述的催化试验通过装入约3g其合成在实施例1d中描述的催化剂来进行且具有430小时的持续时间。进行5次启动和4次连续关闭。如在实施例2c中,同样用该双金属催化剂(由rh0.6重量%和ni10重量%组成),甲烷的转化率值和对氢气的选择性以逐渐降低的趋势为特征,且另外,所获得的值为整组所进行的试验中最差的(参见图3和5)。与实施例2c类似,对co的选择性相当稳定且也以相同的值为特征(参见图4)。在该试验的末尾,试验的评价参数的最终值为:甲烷转化率:63.0%(基于体积)对co的选择性:86.2%(基于体积)对h2的选择性:61.9%(基于体积)氧消耗:0.44(基于体积)如果与通过具有较低镍含量的双金属催化剂获得的副产物的浓度相比较,副产物的浓度值较高,但在任何情况下,都低于那两种单金属催化剂所获得的副产物浓度值。另外,它们随时间具有相当恒定的趋势(参见图6、7和8)。实施例2e在该实施例中描述的催化试验通过装入约1g的其合成在实施例1a中描述的单金属催化剂和约2g的其合成在实施例1c中描述的双金属催化剂来进行。该单金属催化剂布置在催化剂床的头部,而该双金属催化剂布置在尾部。试验持续377小时。进行5次启动和4次连续关闭。在观察在图9中指示的曲线时,可以注意到甲烷转化率和对合成气的选择性的趋势具有与以仅使用单金属催化剂所获得的性能为特征的行为相当的行为(参见实施例2a和相对参考图)。更具体地讲,观察到在催化活性方面没有劣化且转化率值和选择性值高:甲烷转化率:73.0%(基于体积)对co的选择性:90.1%(基于体积)对h2的选择性:72.6%(基于体积)氧消耗:0.34(基于体积)另一方面,烃副产物的生成趋势准确地重现了仅使用双金属催化剂获得的行为(参见实施例2c和相对参考图)。乙烷、乙烯和c3+烃的浓度的趋势恒定且其值低于用单金属催化剂所获得的值(参见图10)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1