含锂盐水的处理的制作方法
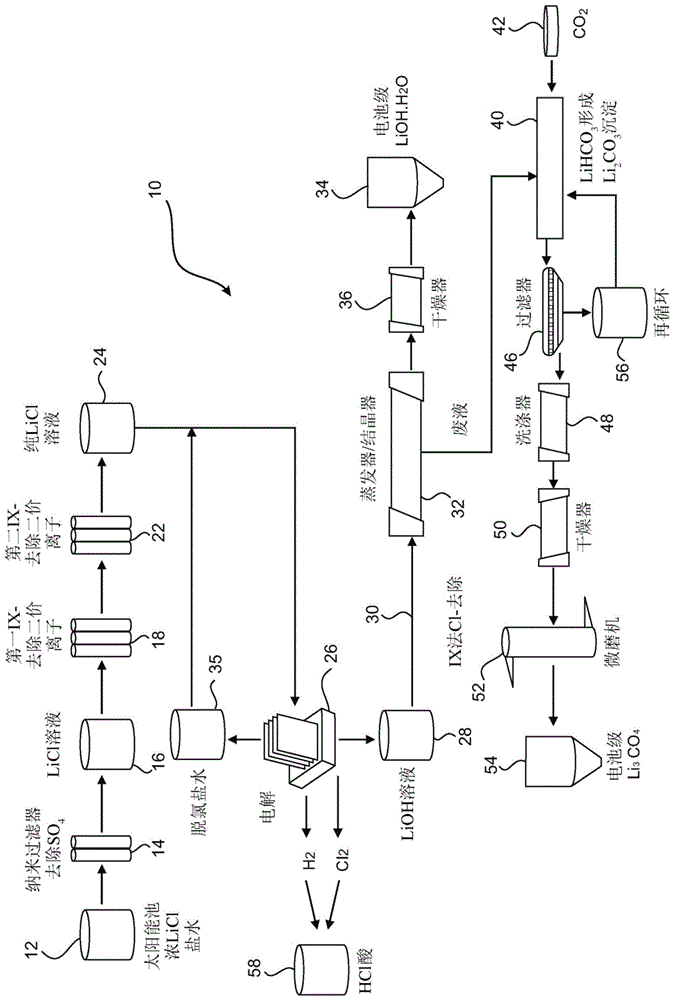
本发明涉及一种用于处理含锂盐水的方法。更具体地说,本发明方法意图用于生产适用于通过电解进一步处理的含锂溶液。反过来,尤其期望含锂溶液的电解处理提供单水合氢氧化锂产物。本发明进一步涉及生产电池级的单水合氢氧化锂和/或碳酸锂。
背景技术:
:盐水生产商采用的当前方法首先需要将含锂盐水转化为碳酸锂,需要用碳酸钠(苏打灰)处理以沉淀碳酸锂。然后使用熟石灰将此碳酸锂苛化。已知此过程是昂贵的,且其采用复杂的过程单元操作。盐水生产商以这种方式生产的碳酸锂,使用氯化锂溶液上的苏打灰反应,产生工业级的碳酸锂。工业级碳酸锂又需要使用昂贵的重碳酸化回路进一步纯化。从太阳能盐水池中获得的含锂盐水通常含有许多杂质,操作员认为所述杂质以高含量存在。因此,认为这些含锂盐水不适合于电解。本发明的方法和产品的一个目标是基本上解决与现有技术的方法和产品相关的上述问题中的一个或多个,或至少为其提供有用的替代方案。
背景技术:
的前述论述仅旨在促进对本发明的理解。此论述并不认可或承认提及的任何材料截至本申请的优先权日是或曾是公共常识的一部分。在本说明书和权利要求书通篇中,除非上下文另有规定,否则词语“包含(comprise)”或如“包含(comprises)”或“包含(comprising)”的变化形式应理解为暗示包括所陈述整体或整体的群组,但不排除任何其它整体或整体的群组。在本说明书和权利要求书通篇中,除非上下文另有规定,否则术语“电池级碳酸锂”是指具有约99.5%或更高的纯度的产品。类似地,术语“电池级氢氧化锂”是指具有约99%或更高的纯度的产品。术语盐水(brine/brines)或其变化形式应理解为包括天然来源或可能工业来源的碱金属盐和/或碱土金属盐在水中的溶液。各种盐的浓度可能大幅变化。盐水中存在的离子可包括一价阳离子(如锂)、多价阳离子、一价阴离子以及多价阴离子中的一个或多个的组合。技术实现要素:根据本发明,提供了一种用于处理含锂盐水的方法,所述方法包含以下方法步骤:(i)将含锂盐水传送至过滤步骤以去除硫酸盐;(ii)将步骤(i)的产物传送至第一离子交换步骤以去除二价杂质;(iii)将步骤(ii)的产物传送至第二离子交换步骤以去除硼杂质;(iv)将步骤(iii)的产物传送至电解步骤以产生氢氧化锂;以及(v)将步骤(iv)的产物传送至结晶步骤,继而得到单水合氢氧化锂产物。在一种形式中,本发明进一步包含将来自结晶步骤(v)的废液传送至碳酸化步骤(vi),在所述步骤中,废液与二氧化碳反应形成碳酸氢锂。然后优选将如此形成的碳酸氢锂在加热步骤(vii)中加热以沉淀碳酸锂。在另一种形式中,本发明进一步包含对沉淀的碳酸锂进行洗涤、干燥和微粉化。优选地,过滤步骤(i)利用纳米过滤。仍优选地,过滤步骤从锂盐水中去除硫酸盐至小于1gpl的含量。优选地,离子交换步骤(ii)去除选自钙、镁、锶和钡的群组的二价杂质。仍优选地,离子交换步骤(ii)从锂盐水中去除二价杂质至小于0.1ppm的含量。优选地,离子交换步骤(iii)从锂盐水去除硼杂质。仍优选地,离子交换步骤(iii)从锂盐水中去除硼杂质至小于0.1ppm的含量。优选地,结晶步骤(v)利用高真空低温多效应结晶技术和设备。附图说明现将参看附图仅通过举例来描述本发明,在附图中:图1是用于处理含锂盐水的方法的流程图,所述方法是根据本发明的一个实施例;图2是传送至图1的方法的第一离子交换步骤的锂盐水中存在的碱土金属的一系列穿透曲线;图3是图2的穿透曲线的展开图;图4是第二离子交换步骤中的硼去除的一系列穿透曲线;图5是构造用于电解测试的电解槽的示意图;图6示出了用于电解研究的5个电池堆,特别参考与直流电源的电连接;图7示出了在2%naoh和2%lioh溶液中测量的若干离子交换膜的膨胀特征;图8示出了在电解期间导致膜单元中的电流效率低下的初级电极反应和氢氧离子传输;图9是可使用本发明方法获得的单水合氢氧化锂产物的规格的表;且图10是可使用本发明方法获得的碳酸锂产物的规格的表。具体实施方式本发明提供一种用于处理含锂盐水的方法,所述方法包含以下方法步骤:(i)将含锂盐水传送至过滤步骤以去除硫酸盐;(ii)将步骤(i)的产物传送至第一离子交换步骤以去除二价杂质;(iii)将步骤(ii)的产物传送至第二离子交换步骤以去除硼杂质;(iv)将步骤(iii)的产物传送至电解步骤以产生氢氧化锂;以及(v)将步骤(iv)的产物传送至结晶步骤,继而得到单水合氢氧化锂产物。本发明方法在其一个实施例中进一步包含将来自结晶步骤(v)的废液传送至碳酸化步骤(vi),在所述步骤中,废液与二氧化碳反应形成碳酸氢锂。然后将如此形成的碳酸氢锂在加热步骤(vii)中加热以沉淀碳酸锂。然后对沉淀的碳酸锂进行洗涤、干燥和微粉化。过滤步骤(i)利用纳米过滤且从锂盐水中去除硫酸盐至小于1gpl的含量。离子交换步骤(ii)去除选自钙、镁、锶和钡的群组的二价杂质至小于0.1ppm的含量。离子交换步骤(iii)从锂盐水中去除硼杂质至小于0.1ppm的含量。结晶步骤(v)利用高真空低温多效应结晶技术和设备。蒸发器按效应数分类。例如,单效应蒸发器使用蒸汽来提供用于蒸发的能量。将蒸气产物冷凝且从系统去除。类似地,在双效应蒸发器中,离开第一效应的蒸气产物用于为第二蒸发装置提供能量。转而,效应的级联可在许多阶段上继续。多效应蒸发器可去除比单效应中可能的量大得多的量的溶剂。在多效应布置中,来自一个效应的蒸气产物的潜热用于加热随后的效应。在图1中,示出了表示一种用于处理含锂盐水的方法10的流程图,方法10根据本发明的一个实施例。方法10包含以下方法步骤:(i)将含锂盐水12传送至过滤步骤14,在其中基本上去除硫酸盐;(ii)将步骤(i)的产物16传送至第一离子交换步骤18以基本上去除二价杂质;(iii)将步骤(ii)的产物20传送至第二离子交换步骤22以基本上去除硼杂质;(iv)将包含基本上纯氯化锂溶液的步骤(iii)的产物24传送至电解步骤26以产生氢氧化锂溶液28;和(v)将步骤(iv)的产物30传送至结晶步骤32,通过干燥步骤36从所述结晶步骤获得电池级单水合氢氧化锂34。来自电解步骤26的脱氯盐水35可再循环至步骤(iii)的产物24,作为馈入至电解步骤26的另外的进料。本发明的方法10在其一个实施例中进一步包含将来自结晶步骤(v)32的废液38传送至碳酸化步骤(vi)40,在所述步骤中,废液38与二氧化碳42反应形成碳酸氢锂。然后将如此形成的碳酸氢锂在加热步骤(vii)44中加热以沉淀碳酸锂。将沉淀的碳酸锂过滤46,接着洗涤48、干燥50和微粉化52。这些步骤提供电池级碳酸锂54。来自在加热步骤44中沉淀的碳酸锂的过滤46的液体被再循环56至碳酸化步骤40。过滤步骤(i)14利用纳米过滤且从锂盐水12中去除硫酸盐至小于1gpl的含量。第一离子交换步骤(ii)18去除选自钙、镁、锶和钡的群组的二价杂质至小于0.1ppm的含量。离子交换步骤(iii)22从锂盐水中去除硼杂质至小于0.1ppm的含量。除了氢氧化锂溶液28之外,电解步骤26还产生氢气和氯气两者。将氢气和氯气催化组合以产生盐酸58。结晶步骤(v)32利用高真空低温多效应结晶技术和设备。可参考以下非限制性实例进一步理解本发明的方法。实例1典型的太阳能干燥盐水组合物与其一些典型物理特征一起提供于下表1中。表1-盐水组成和特征项目%氯化锂30.0硼酸钠0.05氯化钙0.01氯化钾0.80氯化钠3.50氯化镁0.04硫酸钠0.34水65.26sg1.17ph8.90在0.34%(3.40g/l)下记录来自主要以硫酸钠形式存在的太阳能干燥池操作的典型盐水中的硫酸盐。申请人已确定作为用于电解的硫酸钠存在的最大可允许硫酸盐应不超过1g/l。申请人已确定纳米过滤是去除硫酸根离子的优选机制。发现来自陶氏(dow)的两种膜down90tm膜和dowxus290504tm在去除硫酸根离子至可接受水平中极成功。下文提供结果。通过dowxus290504tm膜观察到最佳性能。dowxus290504tm膜的截留率表现较好,但回流率较低。在分析之前通过0.4μm玻璃纤维过滤器过滤模拟盐水以去除细粒和颗粒物质(ntu未过滤的盐水-6.42;过滤-0.20ntu)。将纳米过滤(nf)膜在使用前在超纯水中润湿24小时。用超纯水冲洗来自sterlitechhp4750tm的终端过滤单元,且以正确定向与润湿的膜一起组装。将过滤系统组装在磁性搅拌器板(设定至300rpm)上且连接至g号氮气瓶。每秒记录滤液的质量,且通过并入膜表面积和溶液密度将其转化为通量率(l.min-1.m-2)。使超纯水穿过膜直至观察到稳定通量。将模拟盐水(150ml)添加至单元储集器中且过滤,直至收集最少10ml滤液。对收集的滤液取样进行icp-oes分析(1ml等分试样),用200μlhcl和200μlhno3酸化,且用2%hno3稀释至10ml体积。通过切割150mm横截面的膜组件来制备陶氏膜。展开每个膜,获得300mm的平板膜条。切割五个47mm圆盘且将其立即置于超纯水中。将剩余的膜部分以及未使用的膜组件用偏亚硫酸氢钠(50ppm呈so2形式)润湿且在4℃下储存以供将来使用。使用装配有esisc-4dxtm自动进样器和prepfast2tm样品处理单元的perkinelmer8300dvtmicp-oes分析盐水样品,以进行在线内部标准化以及样品和校准标准品的自动稀释。纯化的硝酸用于制备在整个分析中使用的所有标准品和空白溶液。使用从电感耦合等离子体质谱仪(icp-ms)级单元素储备溶液(highpuritystandards,charleston,usa)内部制备的多元素标准品来执行仪器校准。通过对覆盖一系列常见基质和分析物浓度的多种认证参考物质(crm)进行连续分析,验证了方法稳健性、准确性和精密度(nist,gaithersburg,md,usa,美国地质调查局(unitedstatesgeologicalsurvey),reston,va,usa)。所有盐水样品均按1:10和1:10,000的稀释度进行分析,以报告整套元素组成。下表2描绘了down90tm以及dowxus290504tm膜均适合于将硫酸盐去除至可接受水平。dowxus290504tm膜的截留率表现较好,但回流率较低。表2-硫酸盐去除结果纳米过滤步骤之后获得的含licl盐水溶液现在处于可接受的硫酸盐含量内,但仍含有杂质,包括碱土金属阳离子,例如ca、mg、sr、ba以及b。这些残留杂质的含量被认为对于电解而言太高。因此,使纳米过滤后的licl盐水的水溶液通过离子交换(ix)柱,以去除所有这些杂质至<0.1ppm(100ppb)的含量。基于上文所述的纳米过滤实验,模拟的纳米过滤后锂盐水等分试样的平均组成呈现于下表3中。表3-纳米过滤后盐水的组成和phlanxessmdstp208tm和tp260tm树脂,分别是具有螯合亚氨基二乙酸基团和氨基甲基膦酸基团的弱酸性大孔阳离子交换树脂,成功地用于将碱土金属离子去除至<100ppb的可接受的含量。如上文关于纳米过滤后的样品的分析所述,分析盐水样品并校准仪器。对于所关注分析物(mg、ca、sr、ba、b)的定量,使用1:10稀释度;对于li定量,需要1:10,000稀释度。所有盐水样品均按1:10进行分析,并且储备液和经处理的散装溶液也按1:10,000的稀释度进行分析,以报告li含量;未测量间歇柱样品的li。图2展示锂盐水中存在的碱土金属离子的穿透曲线。显而易见的是,一般来说,mdstp208tm树脂的有效性大于mdstp260tm树脂。更详细地说,记录了对于所评估的两种树脂,钡对树脂交换位点均具有最小亲和力。锶是第二最不受青睐的,接着是镁,且最后是钙离子。在图3中示出了穿透曲线的展开图,以允许检查是否达到0.1mg/l的目标浓度。用作第二离子交换步骤的lewatittmmk51树脂对所处理的两种软化盐水(第一离子交换步骤后的盐水)展示一致的去除性能。如图4中所示,mk51去除98%的b。与软化树脂类似,mk51树脂最初满足<0.1mg/l的硼目标浓度,但在25-30bv处理后最终超过了此浓度。硼的穿透曲线是树脂床中的“滑移”现象的典型。因此,预期mk51树脂性能受益于例如增加床深度和床直径的操作改进。现在将这种进一步纯化的licl溶液安全地电解以产生lioh,且产生作为副产物的cl2和h2气体。将cl2和h2气体催化组合以产生hcl酸。电解槽通常可由一系列交替的阳极板和阴极板组成,在每个阳极与阴极之间具有选择性半透膜。输送至电解槽的直流电(dc)从阳极流过阳极室中的盐水,穿过膜流到阴极室中的lioh,且流入阴极中。构造用于测试的电解槽为压滤型单元,其示意图展示于图5中。在此单元中,阳极和阴极夹有置于其间的离子交换膜,阳极与膜之间的间隙以及阴极与膜之间的间隙由垫片厚度决定。单元主体由plexiglass(浇铸丙烯酸)制成,且垫片材料为0.060厚的过氧化物固化的epdm,其具有60硬度计硬度以从施加扭矩获得0.012-0.015压缩,由princerubberandplasticsco.,inc制造。阳极是涂有ruo2/iro2涂层的ti衬底,分析40%tio2/30%ruo2/30%iro2,ruo2和iro2负载分别为3.45和4.34g/m2;在3mnacl溶液中在4.6ka/m2处的标准电极电势(sep)为1.12v。使用的阴极是来自chlorineengineerscorporation的pt/sn活化的ni网(pt/snactivatednimesh)。在图6中示出研究中所用的5个电池堆,特别参考与直流电源的电连接。如下地组装电池堆:通过将5个单独的电池串联堆叠在拉杆上并使用扭矩扳手通过0.009"/垫片挤压将这些杆中的每一个拉紧,并通过测量在所述堆的宽度上的0.09"减小来确认。每个电池按以下次序堆叠:阳极腔室/阳极/垫片/膜/垫片/阴极/阴极腔室。将氟润滑脂施加至膜后面朝向腔室/膜的垫片。将含有300gpllicl的盐水加热至50-70℃,且泵送至阳极腔室底部,且使耗尽盐水与氯气一起离开单元到达耗尽盐水槽,用氮气对其进行吹扫。接着用naoh洗涤cl2+n2物料流两次,以溶解naocl形式的氯气,将其用nahso3中和以供处置。来自苛性碱洗涤器的气体在排放之前使用teledynetm氧气计320ptm(其使用微燃料电池)对其分析o2。将使用蒸馏水(去离子水)从5-9%产物lioh稀释的1-3%lioh馈送至阴极室的底部。产物苛性碱离开单元到达阴极电解液再循环槽,且接着到达lioh产物槽。用n2吹扫整个阴极电解液回路,以使单元中产生的氢气被扫除且稀释至小于4体积%。连续测量来自单元的产物苛性碱的重量和体积,以进行电流效率计算。在2%naoh和2%lioh溶液中测量了若干离子交换膜的膨胀特性,以允许基于naoh和koh溶液的膨胀量值(其与阴极效率成反比)来选择膜用于licl电解。结果呈现于下表4和图7中,且展示所有膜在lioh溶液中的膨胀比在naoh溶液中更大,表明与naoh相比,lioh的电流效率可能更低。lioh溶液中的最低膨胀由n324和n-424膜展现,其为基于磺酸的。此研究中所使用的膜为n-424。表4-ix膜的膨胀a:全磺酸;b:具有不同强化剂的磺酸;c:磺酸/羧酸如下地组装电解槽:通过将电池组件与n424膜(通过首先将其在室温下浸泡于2%lioh中24小时进行预处理)堆叠在一起,且对拉杆施加扭矩以实现紧密密封而无任何泄漏。将膜的光亮侧朝向阴极侧放置。阳极和阴极室首先分别用2%licl和2%lioh填充。当电池通电时,将licl盐水泵送通过阳极腔室,且将弱lioh泵送通过阴极腔室。起初通过以1.25ka/m2/0.5h的增量将负荷增加至5ka/m2的最终负荷来调节膜。基于系统的电荷和材料平衡来设置阳极电解液和阴极电解液流动速率。在关闭期间,阳极电解液和阴极电解液浓度分别从约300gpllicl和3-4%lioh的操作值缓慢降低至2%licl和2%lioh。电池堆一般在6至8小时的时段内操作。在电池操作期间测量的参数为:电池电压、进料和耗尽的阳极电解液和阴极电解液浓度,以及阳极和阴极室中的温度。为了避免实验室环境中的氯气漂移,用n2将单元所产生的氯气吹扫至密闭槽中。含有氯气的出口气体在通过o2计之前,在两个串联的30%naoh洗涤器中进行反应。接着将不含cl2的含氧n2排放至通风橱。根据30℃处的关系式,通过密度测量来确定氯化物浓度:x=-205.2893+162.897d+105.8709d2-63.0451d3其中d=密度且x=wt%licl,通过使用agno3与铬酸钠指示剂的体积分析来随机补充。在滴定和密度测量之前,用过氧化氢处理所使用的阳极电解液样品以去除所有溶解氯物质。在此设置中测量的耗尽氯化物水平给出错误的低氯效率值,因为当用h2o2处理阳极电解液样品时,由氯与反迁移的lioh反应形成的所有溶解氯物质均还原为氯离子。如下地确定lioh浓度:通过称量lioh的量和其在给定时间内收集的体积,并且还通过使用1%酚酞指示剂以hcl滴定来分析进料和出口物料流中lioh的量。使用便携式氧气分析仪teledynetm型号320ptm确定氯气洗涤后出口气体中的氧气%。根据气流的总体积,计算在电解期间产生的o2的体积。使用法拉第定律(faraday'slaw),由在电解期间产生的lioh的量计算lioh电流效率。从单元气体中测量的o2%计算氯效率。这些计算的理论基础如下。基于膜单元周围的电荷和材料平衡,氯(ηcl2)和苛性碱(ηlioh)电流效率的分量如下。是指氧产生的电流效率,是指在阳极电解液中形成clo3-、ocl-和hocl和溶解氯的电流效率,且是指氢氧离子传输至阳极电解液的电流效率。如果进料盐水为中性且当阳极电解液中不存在活性氯物质时,氯和苛性碱效率将相同。苛性碱效率等于过程氯效率,定义为当回收来自阳极侧的所有氯值(即气态氯、溶解氯、hocl、ocl-和氯酸盐中的氯值)时的氯效率。当回收所有活性氯物质时:当所有氯物质发生反应时,氯或%o2的电流效率可使用以下关系式计算:图8描绘导致膜单元中的电流效率低下的初级电极反应和氢氧离子传输。发现基于lioh分析计算的电流效率值与基于氧气分析的过程效率值一致。lioh的产生效率随lioh浓度的增加而降低,并随电流密度的增加而提高。n424膜的苛性碱电流效率高于n982膜的报道值,且在50℃时比在90℃时更高,在4%lioh、5ka/m2和50℃的操作温度下实现的最大效率为80%。基于此数据,以5ka/m2产生1吨lioh.h2o的能耗为约3800d.c.kwh/吨,苛性碱效率为约80%且电池电压为4.7v,其可与100%效率下的1425d.c.kwh/吨的理论能耗相比。高能耗很大程度上是因为相对于3.8v预期值(基于naoh系统)的4.66v的较高电池电压,而不是由于低效率。申请人确定这在预期范围内。通常,电化学反应可以如下表示。在阳极室中放出氯气,且排出耗尽的盐水。将冷却的再循环lioh馈送至阴极,在其中放出氢气且排出强化的lioh。发生的化学反应如下。2lici=2li+cl2+2e-2h++2oh-+2e-=h2+2oh-2li++2oh-=2lioh盐水溶液中存在的杂质(如nacl和kcl)也经历电解,且累积于阴极电解液中。2nacl=2na+cl2+2e-2h++2oh-+2e-=h2+2oh-2na++2oh-=2naoh2kci=2k+cl2+2e-2h++2oh-+2e-=h2+2oh-2k++2oh-=2koh将氯气和氢气催化组合以产生hcl酸。如果适当且可用,此hcl酸可在浓缩物的hcl酸浸出中再循环。h2+cl2=2hcl现在采用多效应低温和高真空结晶器系统来生产高纯度‘电池级’单水合氢氧化锂(lioh.h2o)晶体。lioh液与通过licl电解产生的杂质(如naoh和koh)一起在蒸气预加热器中预加热。随后引入低压蒸汽以使水蒸发。收集含有固体单水合物晶体的浓lioh溶液,且将其泵送至浓缩器单元中,且接着馈送至离心机。从浓缩器单元和离心机溢出的母液收集在母液收集槽中。离心lioh.h2o晶体之后的废液用于通过此液的碳酸化来产生碳酸锂。将粗lioh.h2o晶体再溶解于去离子水中,且再结晶。这产生高纯度电池级lioh.h2o。在离心机中,施加洗涤水并且与再循环的母液一起收集。将湿的单水合物晶体馈送至干燥器单元,在其中通入热空气以干燥湿晶体。中压蒸汽用于加热空气。来自结晶单元的lioh废液体用于转化为碳酸锂。冷凝的co2气体在90℃下鼓泡通过lioh液,其中首先产生碳酸氢锂,其分解产生碳酸锂。将如此获得的碳酸锂过滤、洗涤、干燥且粉碎为所需粒度且包装。发生的反应如下。lioh+co2=lihco32lihco3+热量=li2co3+co2+h2o将浆液馈送至离心机。从浓缩器单元和离心机溢出的母液收集在母液收集槽中。碳酸锂与na和k的碳酸盐一起形成,所述碳酸盐保留在溶液中。在离心机中,如上对于lioh.h2o一样,施加洗涤水并且与再循环的母液一起收集。将湿的li2co3晶体馈送至干燥器单元,在其中通入热空气以干燥湿晶体。中压蒸汽用于加热空气。在干燥后,将碳酸锂微粉化为如可指定的所需粒度。可使用本发明的方法获得的单水合氢氧化锂和碳酸锂产物的规格分别提供于图9和10中。从以上描述可以看出,本发明的方法提供了一种方法,通过所述方法可以处理盐水溶液以提供适合于通过电解进一步处理的含锂溶液,而无需将盐水初始转化为碳酸锂且随后用熟石灰苛化。还避免了在碳酸锂的生产中对重碳酸化回路的需要。如对于有技能的读者将显而易见的修改和变化被视为属于本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1