在重组微生物细胞中制备奇数链脂肪酸衍生物的制造方法与工艺
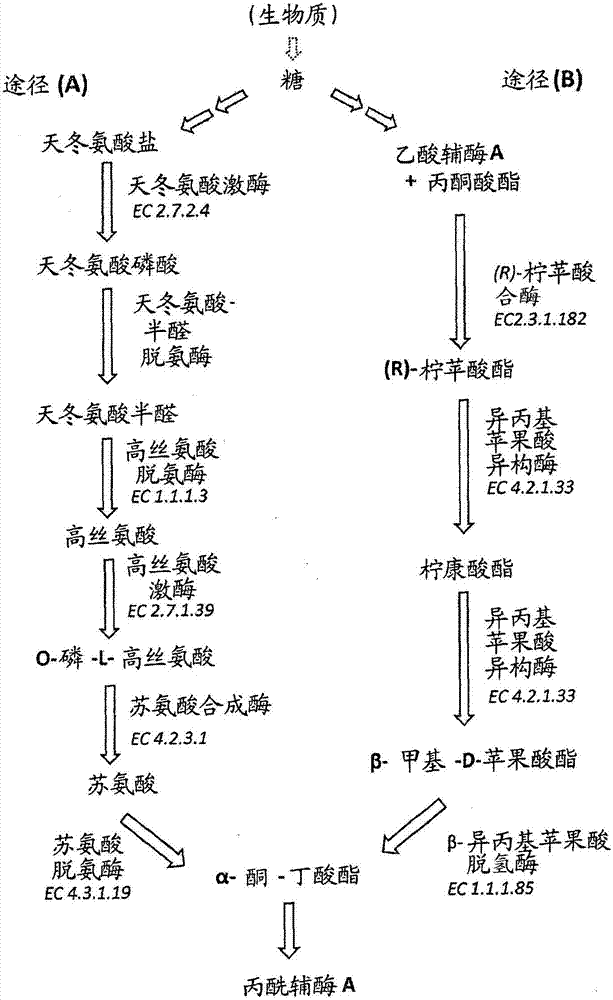
在重组微生物细胞中制备奇数链脂肪酸衍生物相关申请的交叉引用本申请是部分连续申请,并且要求2011年9月14日提交的美国申请系列第13/232,927号和2010年9月15日提交的美国临时专利申请第61/383,086号的权益,其通过引用以全文明确并入本文中。通过引用并入电子递交材料本申请含有通过EFS-Web以ASCII格式递交的序列表,其通过引用全文并入本文。所述ASCII副本,创建于2012年3月7日,名称为LS0033PC.txt,大小为350,776字节。发明背景原油是含有多种碳氢化合物的非常复杂的混合物。其通过精炼厂中的多种化学过程转变成多种燃料和化学品。原油是运输燃料的来源,也是生产石油化学品的原材料来源。石油化学品用于制备特定的化学品如塑料、树脂、光纤、弹性体、药品、润滑剂和凝胶。最重要的运输燃料——汽油、柴油和喷气燃料,含有特别不同的碳氢化合物混合物,所述碳氢化合物均向最佳的引擎性能方面调整。例如,汽油包含范围通常为约4至12个碳原子的直链、支链和芳香族碳氢化合物,而柴油主要包含范围为约9至23个碳原子的直链碳氢化合物。柴油燃料质量通过诸如十六烷数、动力学粘度、氧化稳定性和浊点评估(KnotheG.,FuelProcessTechnol.86:1059-1070(2005))。此外,这些参数受到碳氢化合物的长度以及碳氢化合物的分支程度和饱和度的影响。可以通过遗传操作调整由微生物产生的脂肪酸衍生物。代谢改造使得微生物菌株能够产生脂肪酸衍生物的各种混合物,其可以被优化,例如,以符合或超出燃料标准或其他商业相关产品规格。可以改造微生物菌株以产生通常源自石油的化学或前体分子。在一些情形下,期望模拟已存在产品的产品概况,例如已存在的石油来源的燃料或化工产品的产品概况,以用于有效的嵌入兼容性或替代。本文所述的重组细胞和方法阐述了微生物生产具有各种比例的奇数:偶数长度链的脂肪酸衍生物,作为精确控制例如基于碳氢化合物的燃料和化工产品的结构和功能的手段。人们需要石油产品的划算的替代物,其不需要勘探、提取、长距离运输或大量的精炼,并避免与石油加工相关的各种类型的环境破坏。由于类似的原因,人们需要通常源自石油的化工产品的替代来源。人们还需要从可再生能源生产高质量生物燃料、燃料替代物和化工产品的有效和划算的方法。经改造以产生具有期望链长(如具有奇数个碳的链)的脂肪酸前体分子和从其制备而来的脂肪酸衍生物的重组微生物细胞、利用这些重组微生物细胞制备包含具有期望酰基链长和期望奇数:偶数长度链比例的脂肪酸衍生物的组合物的方法,以及通过这些方法生产的组合物解决了这些需要。发明概述本发明提供了产生奇数链长度脂肪酸衍生物的新的重组微生物细胞,和包含此类新重组微生物细胞的细胞培养物。本发明还提供了生产包含奇数链长度脂肪酸衍生物的组合物的方法(包括培养本发明的重组微生物细胞)、通过这类方法制备的组合物和进一步审查后显而易见的其他特征。在第一个方面,本发明提供了重组微生物细胞,其包含编码具有有效增加细胞内丙酰辅酶A的产生的酶活性的多肽的多核苷酸,所述增加是相对于缺少或具有减少量的所述酶活性的亲代微生物细胞的丙酰辅酶A的产生,其中当所述细胞在碳源存在下、于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物。所述重组微生物细胞包含:(a)编码具有有效在所述重组微生物细胞中产生增加量的丙酰辅酶A的酶活性的多肽的多核苷酸,所述增加量是相对于缺少或具有减少量的所述酶活性的亲代微生物细胞产生的丙酰辅酶A的量,其中所述多肽为所述重组微生物细胞外源性的,或相比所述亲代微生物细胞中所述多核苷酸的表达,重组微生物细胞中所述多核苷酸的表达被调节;(b)编码具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶(“FabH”)活性的多肽的多核苷酸,和(c)编码具有脂肪酸衍生物酶活性的多肽的多核苷酸,其中当所述细胞在碳源存在下、于有效表达(a)、(b)和(c)的多核苷酸的条件下培养时,所述重组微生物细胞产生包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物。在一些实施方案中,根据(a)的多核苷酸中的至少一个的表达通过所述多核苷酸的过表达而被调节,如通过将所述多核苷酸可操作地连接至外源性启动子。在一些实施方案中,由第一方面的微生物细胞产生的组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪酸衍生物为奇数链脂肪酸衍生物。在一些实施方案中,当在含有碳源的培养基中、于有效表达(a)、(b)和(c)的多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L奇数链脂肪酸衍生物。在一些实施方案中,根据(a)的重组微生物细胞中编码具有有效产生增加量的丙酰辅酶A的酶活性的多肽的多核苷酸选自:(i)一个或多个编码具有天冬氨酸激酶活性、高丝氨酸脱氢酶活性、高丝氨酸激酶活性、苏氨酸合酶活性或苏氨酸脱氨酶活性的多肽的多核苷酸;(ii)一个或多个编码具有(R)-柠苹酸合酶活性、异丙基苹果酸异构酶活性或β-异丙基苹果酸脱氢酶活性的多肽的多核苷酸;和(iii)一个或多个编码具有甲基丙二酰辅酶A变位酶活性、甲基丙二酰辅酶A脱羧酶活性、甲基丙二酰辅酶A羧基转移酶活性或甲基丙二酰辅酶A差向异构酶活性的多肽的多核苷酸。在一些实施方案中,所述微生物细胞包含一个或多个根据(i)的多核苷酸和一个或多个根据(ii)的多核苷酸。在一些实施方案中,所述微生物细胞包含一个或多个根据(i)和/或(ii)的多核苷酸,和一个或多个根据(iii)的多核苷酸。在一些实施方案中,具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的多肽为所述重组微生物细胞外源性的。在更具体的实施方案中,所述重组微生物细胞内源性的、具有β-酮酯酰-ACP合酶活性的多肽的表达被减弱。所述脂肪酸衍生物酶活性可以为内源性的(“天然的”)或外源性的。在一些实施方案中,所述脂肪酸衍生物酶活性包括硫酯酶活性,并且由所述重组微生物细胞产生的脂肪酸衍生物组合物包含奇数链脂肪酸和偶数链脂肪酸。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪酸为奇数链脂肪酸。在一些实施方案中,当在含有碳源的培养基中,于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L的奇数链脂肪酸。在第一方面的一些实施方案中,所述脂肪酸衍生物酶活性包括酯合酶活性,并且由所述重组微生物产生的脂肪酸衍生物组合物包含奇数链脂肪酯和偶数链脂肪酯。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪酯为奇数链脂肪酯。在一些实施方案中,当在含有碳源的培养基中、于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L奇数链脂肪酯。在第一方面的一些实施方案中,所述脂肪酸衍生物酶活性包括脂肪醛生物合成活性,并且由所述重组微生物细胞产生的脂肪酸衍生物组合物包含奇数链脂肪醛和偶数链脂肪醛。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪醛为奇数链脂肪醛。在一些实施方案中,当在含有碳源的培养基中、于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L奇数链脂肪醛。在第一方面的一些实施方案中,所述脂肪酸衍生物酶活性包括脂肪醇生物合成活性,并且由所述重组微生物细胞产生的脂肪酸衍生物组合物包含奇数链脂肪醇和偶数链脂肪醇。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪醇为奇数链脂肪醇。在一些实施方案中,当在含有碳源的培养基中、于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L奇数链脂肪醇。在第一方面的一些实施方案中,所述脂肪酸衍生物酶活性包括碳氢化合物生物合成活性,并且由所述重组微生物细胞产生的脂肪酸衍生物组合物为碳氢化合物组合物,如烷烃组合物、烯烃组合物、端烯烃组合物、内烯烃组合物或酮类组合物,所述碳氢化合物组合物包含奇数链碳氢化合物和偶数链碳氢化合物。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的碳氢化合物为偶数链碳氢化合物。在一些实施方案中,当在含有碳源的培养基中、于有效表达所述多核苷酸的条件下培养时,所述重组微生物细胞产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L或至少10000mg/L偶数链碳氢化合物。在不同的实施方案中,所述碳源包含碳水化合物如糖,例如,单糖、二糖、寡糖或多糖。在一些实施方案中,所述碳源获自生物质如纤维素水解液。在不同的实施方案中,所述亲代(例如宿主)微生物细胞为丝状真菌、藻类、酵母或原核生物如细菌。在各种优选的实施方案中,所述宿主细胞为细菌细胞。在更优选的实施方案中,所述宿主细胞为大肠杆菌(E.coli)细胞或芽孢杆菌(Bacillus)细胞。制备偶数链脂肪酸衍生物和奇数链脂肪酸衍生物的示例性途径分别显示在图1A和图1B中。图2和3提供了通过丙酰辅酶A引导代谢流以增加奇数链脂肪酸衍生物产生的各种方法的概述;图2显示了通过中间产物α-酮丁酸的示例性途径,而图3显示了通过中间产物甲基丙二酰辅酶A的示例性途径。在一实施方案中,根据第一方面的重组微生物细胞包含编码多肽的多核苷酸,所述多肽具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性,优选归类为EC2.3.1.180的β-酮酯酰-ACP合酶III活性。在一实施方案中,具有β-酮酯酰-ACP合酶活性的多肽由fabH基因编码。在一实施方案中,具有β-酮酯酰-ACP合酶活性的多肽为所述亲代微生物细胞内源性的。在另一实施方案中,具有β-酮酯酰-ACP合酶活性的多肽为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有β-酮酯酰-ACP合酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有β-酮酯酰-ACP合酶活性的多肽包含选自SEQIDNO:1、2、3、4、5、6、7,8、9、10、11、12、13、146、147、148或149的序列或其变体或片段,所述序列或其变体或片段具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性,并在体外或体内,优选在体内催化丙酰辅酶A与丙二酰ACP缩合形成奇数链酰基-ACP。在另一实施方案中,具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的多肽包含一个或多个选自SEQIDNO:14-19的序列基元,并在体外或体内,优选在体内催化丙酰辅酶A与丙二酰ACP缩合形成奇数链酰基-ACP。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有β-酮酯酰-ACP合酶活性的多肽的内源性多核苷酸序列(如内源性fabH基因),并且所述重组微生物细胞中此类内源性多核苷酸序列的表达被减弱。在一些实施方案中,所述内源性多核苷酸的表达通过在重组微生物细胞中缺失所述内源性多核苷酸的所有或部分的序列而被减弱。此类包含减弱的内源性β-酮酯酰-ACP合酶基因的重组微生物细胞优选还包含编码具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的外源性多肽的多核苷酸序列。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC2.7.2.4的天冬氨酸激酶活性的多肽的多核苷酸(图2,途径(A))。在一些实施方案中,具有天冬氨酸激酶活性的多肽由thrA、dapG或hom3基因编码。在一实施方案中,具有天冬氨酸激酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有天冬氨酸激酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有天冬氨酸激酶活性的多肽包含选自SEQIDNO:20、21、22、23、24的序列或其变体或片段,所述序列或其变体或片段具有天冬氨酸激酶活性,并在体外或体内,优选在体内催化天冬氨酸盐转化为天冬氨酰磷酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC1.1.1.3的高丝氨酸脱氢酶活性的多肽的多核苷酸。在一些实施方案中,具有高丝氨酸脱氢酶活性的多肽由thrA、hom或hom6基因编码。在一实施方案中,具有高丝氨酸脱氢酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有高丝氨酸脱氢酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有高丝氨酸脱氢酶活性的多肽包含选自SEQIDNO:20、21、25、26、27的序列或其变体或片段,所述序列或其变体或片段具有高丝氨酸脱氢酶活性,并在体外或体内,优选在体内催化天冬氨酸半醛转化为高丝氨酸。在具体的实施方案中,根据第一方面的重组微生物细胞包含编码具有天冬氨酸激酶和高丝氨酸脱氢酶活性的多肽的多核苷酸。在一实施方案中,具有天冬氨酸激酶和高丝氨酸脱氢酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,重组微生物细胞中编码具有天冬氨酸激酶和高丝氨酸脱氢酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在一实施方案中,具有天冬氨酸激酶和高丝氨酸脱氢酶活性的多肽包含序列SEQIDNO:20或其变体或片段,如SEQIDNO:21,其在体外或体内,优选在体内催化天冬氨酸盐转化为天冬氨酰磷酸以及天冬氨酸半醛转化为高丝氨酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC2.7.1.39的高丝氨酸激酶活性的多肽的多核苷酸。在一些实施方案中,具有高丝氨酸激酶活性的多肽由thrB基因或thr1基因编码。在一实施方案中,具有高丝氨酸激酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有高丝氨酸激酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有高丝氨酸激酶活性的多肽包含选自SEQIDNO:28、29、30、31的序列或其变体或片段,所述序列或其变体或片段具有高丝氨酸激酶活性,并在体外或体内,优选在体内催化高丝氨酸转化为O-磷-L-高丝氨酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC4.2.3.1的苏氨酸合酶活性的多肽的多核苷酸。在一实施方案中,具有苏氨酸合酶活性的多肽由thrC基因编码。在一实施方案中,具有苏氨酸合酶活性的多肽为所述亲代微生物细胞内源性,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有苏氨酸合酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有苏氨酸合酶活性的多肽包含选自SEQIDNO:32、33、34的序列或其变体或片段,所述序列或其变体或片段具有苏氨酸合酶活性,并在体外或体内,优选在体内催化O-磷-L-高丝氨酸转化为苏氨酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC4.3.1.19的苏氨酸脱氨酶活性的多肽的多核苷酸。在一些实施方案中,具有苏氨酸脱氨酶活性的多肽由tdcB基因或ilvA基因编码。在一实施方案中,具有苏氨酸脱氨酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞编码具有苏氨酸脱氨酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有苏氨酸脱氨酶活性的多肽包含选自SEQIDNO:35、36、37、38、39的序列或其变体或片段,所述序列或其变体或片段具有苏氨酸脱氨酶活性,并在体外或体内,优选在体内催化苏氨酸转化为2-酮丁酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC2.3.1.182的(R)-柠苹酸合酶活性的多肽的多核苷酸(图2,途径(B))。在一实施方案中,具有(R)-柠苹酸合酶活性的多肽由cimA基因编码。在一实施方案中,具有(R)-柠苹酸合酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有(R)-柠苹酸合酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有(R)-柠苹酸合酶活性的多肽包含选自SEQIDNO:40、41、42、43的序列或其变体或片段,所述序列或其变体或片段具有(R)-柠苹酸合酶活性,并在体外或体内,优选在体内催化乙酰辅酶A和丙酮酸酯反应为(R)-柠苹酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC4.2.1.33的异丙基苹果酸异构酶活性的多肽的多核苷酸。在一实施方案中,具有异丙基苹果酸异构酶活性的多肽包含由leuCD基因编码的大亚基和小亚基。在一实施方案中,具有异丙基苹果酸异构酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有异丙基苹果酸异构酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有异丙基苹果酸异构酶活性的多肽包含大亚基和小亚基。在其它实施方案中,具有异丙基苹果酸异构酶活性的多肽包含选自SEQIDNO:44和46的大亚基序列和选自SEQIDNO:45和47的小亚基序列,或以上的变体或片段,所述序列或其变体或片段具有异丙基苹果酸异构酶活性,并在体外或体内,优选在体内催化(R)-柠苹酸转化为衣康酸酯以及衣康酸酯转化为β-甲基-D-苹果酸酯。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC1.1.1.85的β-异丙基苹果酸脱氢酶活性的多肽的多核苷酸。在一些实施方案中,具有β-异丙基苹果酸脱氢酶活性的多肽由leuB基因或leu2基因编码。在一实施方案中,具有β-异丙基苹果酸脱氢酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有β-异丙基苹果酸脱氢酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有β-异丙基苹果酸脱氢酶活性的多肽包含选自SEQIDNO:48、49、50的序列或其变体或片段,所述序列或其变体或片段具有β-异丙基苹果酸脱氢酶活性,并在体外或体内,优选在体内催化β-甲基-D-苹果酸酯转化为2-酮丁酸。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC5.4.99.2的甲基丙二酰辅酶A变位酶活性的多肽的多核苷酸(图3)。在一些实施方案中,具有甲基丙二酰辅酶A变位酶活性的多肽由scpA(也称为sbm)基因编码。在一实施方案中,具有甲基丙二酰辅酶A变位酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有甲基丙二酰辅酶A变位酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有甲基丙二酰辅酶A变位酶活性的多肽包含选自SEQIDNO:51、52、53、54、55、56、57、58的序列或其变体或片段,所述序列或其变体或片段具有甲基丙二酰辅酶A变位酶活性,并在体外或体内,优选在体内催化琥珀酰辅酶A转化为甲基丙二酰辅酶A。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC4.1.1.41的甲基丙二酰辅酶A脱羧酶活性的多肽的多核苷酸。在一些实施方案中,具有甲基丙二酰辅酶A脱羧酶活性的多肽由scpB(也称为ygfG)基因编码。在一实施方案中,具有甲基丙二酰辅酶A脱羧酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有甲基丙二酰辅酶A脱羧酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有甲基丙二酰辅酶A脱羧酶活性的多肽包含选自SEQIDNO:59、60、61的序列或其变体或片段,所述序列或其变体或片段具有甲基丙二酰辅酶A脱羧酶活性,并在体外或体内,优选在体内催化甲基丙二酰辅酶A转化为丙酰辅酶A。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC2.1.3.1的甲基丙二酰辅酶A羧基转移酶活性的多肽的多核苷酸。在一实施方案中,具有甲基丙二酰辅酶A羧基转移酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有甲基丙二酰辅酶A羧基转移酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过可操作地将所述多核苷酸连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有甲基丙二酰辅酶A羧基转移酶活性的多肽包含序列SEQIDNO:62或其变体或片段,所述序列或其变体或片段具有甲基丙二酰辅酶A羧基转移酶活性,并在体外或体内,优选在体内催化甲基丙二酰辅酶A转化为丙酰辅酶A。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有归类为EC5.1.99.1的甲基丙二酰辅酶A差向异构酶活性的多肽的多核苷酸。在一实施方案中,具有甲基丙二酰辅酶A差向异构酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有甲基丙二酰辅酶A差向异构酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有甲基丙二酰辅酶A差向异构酶活性的多肽包含序列SEQIDNO:63或其变体或片段,所述序列或其变体或片段具有甲基丙二酰辅酶A差向异构酶活性,并在体外或体内,优选在体内催化(R)-甲基丙二酰辅酶A转化为(S)-甲基丙二酰辅酶A。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有丙酰辅酶A∷琥珀酰辅酶A转移酶活性的多肽的内源性多核苷酸序列(如内源性scpC基因(也称为ygfH)),并且所述重组微生物细胞中所述内源性多核苷酸的表达被减弱。在一些实施方案中,所述内源性多核苷酸的表达通过所述重组微生物细胞中所述内源性多核苷酸序列的所有或部分缺失而被减弱。在一实施方案中,根据第一方面的重组微生物细胞包含编码具有酰基辅酶A脱氢酶活性的多肽的内源性多核苷酸序列(如内源性fadE基因),并且所述重组微生物细胞中所述内源性多核苷酸的表达可能或可能未被减弱。在其它实施方案中,根据第一方面的重组微生物细胞包含编码具有脂肪酸衍生物酶活性的多肽的多核苷酸,其中当在碳源存在下培养时,所述重组微生物细胞产生包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物。在不同的实施方案中,所述脂肪酸衍生物酶活性包括硫酯酶活性、酯合酶活性、脂肪醛生物合成活性、脂肪醇生物合成活性、酮生物合成活性和/或碳氢化合物生物合成活性。在一些实施方案中,所述重组微生物细胞包含编码两种或多种多肽的多核苷酸,每种多肽都具有脂肪酸衍生物酶活性。在更具体的实施方案中,所述重组微生物细胞表达或过表达选自以下的一种或多种具有脂肪酸衍生物酶活性的多肽:(1)具有硫酯酶活性的多肽;(2)具有脱羧酶活性的多肽;(3)具有羧酸还原酶活性的多肽;(4)具有醇脱氢酶活性(EC1.1.1.1)的多肽;(5)具有醛脱羰酶活性(EC4.1.99.5)的多肽;(6)具有酰基辅酶A还原酶活性(EC1.2.1.50)的多肽;(7)具有酰基-ACP还原酶活性的多肽;(8)具有酯合酶活性(EC3.1.1.67)的多肽;(9)具有OleA活性的多肽;或(10)具有OleCD或OleBCD活性的多肽;其中所述重组微生物细胞产生组合物,其包含奇数链脂肪酸、奇数链脂肪酯、奇数链蜡酯、奇数链脂肪醛、奇数链脂肪醇、偶数链烷烃、偶数链烯烃、偶数链内烯烃、偶数链端烯烃或偶数链酮类。在一实施方案中,所述脂肪酸衍生物酶活性包含硫酯酶活性,其中当在碳源存在下培养时,包含所述重组微生物细胞的培养物产生包含奇数链脂肪酸的脂肪酸组合物。在一些实施方案中,所述多肽具有归类为EC3.1.1.5、EC3.1.2.-或EC3.1.2.14的硫酯酶活性。在一些实施方案中,具有硫酯酶活性的多肽由tesA、tesB、fatA或fatB基因编码。在一些实施方案中,具有硫酯酶活性的多肽为所述亲代微生物细胞内源性的,或为所述亲代微生物细胞外源性的。在另一实施方案中,所述重组微生物细胞中编码具有硫酯酶活性的多肽的多核苷酸的表达被调节。在一些情形下,所述多核苷酸的表达通过将所述多核苷酸可操作地连接至外源性启动子而被调节,使得所述多核苷酸在所述重组微生物细胞中过表达。在另一实施方案中,具有硫酯酶活性的多肽包含选自SEQIDNO:64、65、66、67、68、69、70、71和72的序列或其变体或片段,所述序列或其变体或片段具有硫酯酶活性,并在体外或体内,优选在体内催化奇数链酰基-ACP水解为奇数链脂肪酸,或催化奇数链酰基-ACP醇解为奇数链脂肪酯。在一些实施方案中,当在碳源存在下培养时,根据第一方面的包含编码具有硫酯酶活性的多肽的多核苷酸的重组微生物细胞在含有碳源的培养基中、于有效表达所述多核苷酸的条件下培养时,产生至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L或至少2000mg/L奇数链脂肪酸。在一些实施方案中,根据第一方面的包含编码具有硫酯酶活性的多肽的多核苷酸的重组微生物细胞产生包含奇数链脂肪酸和偶数链脂肪酸的脂肪酸组合物。在一些实施方案中,所述组合物中至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的脂肪酸为奇数链脂肪酸。本发明包括包含根据第一方面的重组微生物细胞的细胞培养物。在第二方面,本发明包括在重组微生物细胞中制备奇数链脂肪酸衍生物(或包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物)的方法,所述方法包括在所述细胞中表达具有有效增加细胞内丙酰辅酶A的产生的酶活性的重组多肽,以及在碳源存在下、于有效表达所述重组多肽并产生奇数链脂肪酸衍生物的条件下培养所述细胞。在一实施方案中,所述制备包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物的方法包括获得根据第一方面的重组微生物细胞、在含有碳源的培养基中、于有效表达根据(a)、(b)和(c)的多核苷酸并产生包含奇数链脂肪酸衍生物的脂肪酸衍生物组合物的条件下培养所述细胞,以及任选地从培养基回收所述组合物。在一些实施方案中,通过根据第二方面的方法制备的脂肪酸衍生物组合物包含奇数链脂肪酸衍生物和偶数链脂肪酸衍生物,其中所述组合物中至少5%、至少6%、至少8%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%重量的脂肪酸衍生物为奇数链脂肪酸衍生物。在一些实施方案中,所述脂肪酸衍生物组合物包含的奇数链脂肪酸衍生物的量(例如,滴度)为至少50mg/L、至少75mg/L、至少100mg/L、至少200mg/L、至少500mg/L、至少1000mg/L、至少2000mg/L、至少5000mg/L、至少10000mg/L或至少20000mg/L。在第二方面的各种方法中,所述脂肪酸衍生物酶活性包括硫酯酶活性、酯合酶活性、脂肪醛生物合成活性、脂肪醇生物合成活性、酮生物合成活性和/或碳氢化合物生物合成活性。在一些实施方案中,所述重组微生物细胞包含编码两种或更多种多肽的多核苷酸,每种多肽都具有脂肪酸衍生物酶活性。在更具体的实施方案中,所述重组微生物细胞表达或过表达选自以下的一种或多种具有脂肪酸衍生物酶活性的多肽:(1)具有硫酯酶活性的多肽;(2)具有脱羧酶活性的多肽;(3)具有羧酸还原酶活性的多肽;(4)具有醇脱氢酶活性(EC1.1.1.1)的多肽;(5)具有醛脱羰酶活性(EC4.1.99.5)的多肽;(6)具有酰基辅酶A还原酶活性(EC1.2.1.50)的多肽;(7)具有酰基-ACP还原酶活性的多肽;(8)具有酯合酶活性(EC3.1.1.67)的多肽;(9)具有OleA活性的多肽;或(10)具有OleCD或OleBCD活性的多肽;其中所述重组微生物细胞产生组合物,其包含一种或多种奇数链脂肪酸、奇数链脂肪酯、奇数链蜡酯、奇数链脂肪醛、奇数链脂肪醇、偶数链烷烃、偶数链烯烃、偶数链内烯烃、偶数链端烯烃和偶数链酮类。本发明包括包含通过根据第二方面方法制备的奇数链脂肪酸衍生物的脂肪酸衍生物组合物。在第三个方面,本发明包括制备重组微生物细胞的方法,所述重组微生物细胞相比亲代微生物细胞产生更高滴度或更高比例的奇数链脂肪酸衍生物,所述方法包括获得包含编码具有脂肪酸衍生物酶活性的多肽的多核苷酸的亲代微生物细胞,以及改造所述亲代微生物细胞以获得重组微生物细胞,其相比所述亲代微生物细胞在相同的条件下培养时产生的丙酰辅酶A的量,产生或更产生更大量的丙酰辅酶A,其中当在碳源存在、于有效在所述重组微生物细胞中产生丙酰辅酶A和脂肪酸衍生物的条件下培养时,所述重组微生物细胞产生更高滴度或更高比例的奇数链脂肪酸衍生物,所述更高滴度或更高比例是相对于在相同的条件下培养的亲代微生物细胞产生的奇数链脂肪酸衍生物的滴度和比例。在第四个方面,本发明包括增加微生物细胞产生的奇数链脂肪酸衍生物的滴度或比例的方法,所述方法包括获得能产生脂肪酸衍生物的亲代微生物细胞,以及改造所述亲代微生物细胞以获得产生或能产生更大量的丙酰辅酶A重组微生物细胞,所述更大量是相对于亲代微生物细胞在相同的条件下培养时产生的丙酰辅酶A的量,,其中当在碳源存在下、于有效在所述重组微生物细胞中产生丙酰辅酶A和脂肪酸衍生物的条件下培养时,所述重组微生物细胞产生更高滴度或更高比例的奇数链脂肪酸衍生物,所述更高滴度或更高比例是相对于在相同的条件下培养的亲代微生物细胞产生的奇数链脂肪酸衍生物的滴度和比例。在根据第三或第四方面的一些实施方案中,改造亲代微生物细胞的步骤包括改造所述细胞以表达编码选自以下的多肽的多核苷酸:(a)具有天冬氨酸激酶活性、高丝氨酸脱氢酶活性、高丝氨酸激酶活性、苏氨酸合酶活性和苏氨酸脱氨酶活性的一种或多种多肽;(b)具有(R)-柠苹酸合酶活性、异丙基苹果酸异构酶活性和β-异丙基苹果酸脱氢酶活性的一种或多种多肽;和(c)具有甲基丙二酰辅酶A变位酶活性、甲基丙二酰辅酶A脱羧酶活性、甲基丙二酰辅酶A羧基转移酶活性和甲基丙二酰辅酶A差向异构酶活性的一种或多种多肽;其中根据(a)、(b)或(c)的至少一种多肽为所述亲代微生物细胞外源性的,或其中相比所述亲代微生物细胞中所述多核苷酸的表达,所述重组微生物细胞中根据(a)、(b)或(c)的至少一种多核苷酸的表达被调节。在一些实施方案中,至少一种多核苷酸的表达通过所述多核苷酸的过表达而被调节,如通过将所述多核苷酸可操作地连接至外源性启动子。在一些实施方案中,所述改造的细胞表达根据(a)的一种或多种多肽和根据(b)的一种或多种多肽。在根据第三或第四方面的一些实施方案中,所述亲代微生物细胞包含编码具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的多肽的多核苷酸。在一些实施方案中,所述重组微生物细胞经改造以表达编码具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的多肽的外源性多核苷酸或过表达其内源性多核苷酸。在一些实施方案中,所述重组微生物细胞经改造以表达编码具有利用丙酰辅酶A作为底物的β-酮酯酰-ACP合酶活性的多肽的外源性多核苷酸,并且编码具有β-酮酯酰-ACP合酶活性的多肽的内源性多核苷酸的表达被减弱。在一些实施方案中,编码具有β-酮酯酰-ACP合酶的多肽的多核苷酸为内源性多核苷酸的修饰、突变或变体形式,其相对于未修饰的内源性多核苷酸,经挑选用于增加的亲和力或对丙酰辅酶A作为底物的活性。多种产生修饰、突变或变体多核苷酸的方法为本领域熟知,其实例在下文有描述。结合附图阅读以下详细描述时,本发明的这些和其他目的和特征将得以更加充分地显现。附图的简要说明图1A和1B比较了添加不同的酰基辅酶A“引发物”分子时脂肪酸生物合成途径的示例性中间物和产物:图1A显示了利用2碳引发物乙酰辅酶A的反应途径,其产生偶数链长度的β-酮酯酰-ACP中间产物——乙酰乙酰基-ACP,产生从其产生的偶数链(ec)-酰基-ACP中间产物和偶数链脂肪酸衍生物;而图1B显示了利用3碳引发物丙酰辅酶A的反应途径,其产生奇数链长度的β-酮酯酰-ACP中间产物——3-异戊酰-ACP,产生从其产生的奇数链(oc)-酰基-ACP中间产物和奇数链脂肪酸衍生物。图2描绘了通过本文所述的苏氨酸生物合成途径(途径(A))和柠苹酸生物合成途径(途径(B)),用于增加经由中间产物α-酮丁酸酯的丙酰辅酶A生产的示例性途径。图3描绘了通过本文所述的甲基丙二酰辅酶A生物合成途径(途径(C)),用于增加丙酰辅酶A生产的示例性途径。发明的详细描述本发明并不限制于本文描述的具体组合物和方法,因为,这些当然可以改变。还应当理解,本文使用的术语仅为描述具体实施方案的目的,并非意图限制本发明的范围。登录号:本说明书通篇当中的序列登录号获自美国国立卫生研究院(NationalInstitutesofHealth)维护的NCBI(NationalCenterforBiotechnologyInformation)提供的数据库(在本文称为“NCBI登录号”或者可选择地称为“GenBank登录号”),以及瑞士生物信息学研究所(SwissInstituteofBioinformatics)提供的UniProtKnowledgebase(UniProtKB)和Swiss-Prot数据库(在本文称为“UniProtKB登录号”)。除非明确指出并非如此,NCBI/GenBank登录号指定的序列是版本编号1(即序列的版本编号为“登录号.1”)。本文提供的NCBI和UniProtKB登录号截止至2011年8月2日。酶分类(EC)号:EC编号由国际生物化学和分子生物学联盟命名委员会(NomenclatureCommitteeoftheInternationalUnionofBiochemistryandMolecularBiology(IUBMB))制定,其相关描述可在互联网的IUBMB命名网站获取。EC编号根据所催化的反应对酶进行分类。本文引用的EC编号来自由东京大学部分资助的京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomics)所维护的KEGG配体数据库。除非另作说明,EC编号按照截止到2011年8月2日的KEGG数据库中提供的。除非另有限定,本文使用的所有技术和科学术语与本发明所属领域技术人员通常理解的具有相同的意义。尽管与本文所述的那些材料和方法相似或等同的材料和方法可以用于本发明的实践或测试,目前描述了优选的组合物和材料。定义如本文使用,术语“脂肪酸”表示具有通式R-(C=O)-OH的羧酸,其中R表示长度可以为约4至约36个碳原子,长度更通常为约4至约22个碳原子的碳链。脂肪酸可以是饱和的或不饱和的。如果是不饱和的,R可以具有一个或多个不饱和点,即R可以是单不饱和的或多不饱和的。R可以是直链(在本文中也称为“线性链”)或支链。术语“脂肪酸”可以在本文中用于指可以包括一种或多种不同的“脂肪酸衍生物”脂肪酸衍生物的“脂肪酸衍生物”,或者脂肪酸衍生物的混合物。本文所用的“奇数链脂肪酸”(缩写为“oc-FA”)是指具有含奇数个碳原子(包括羰基碳)的线性碳链的脂肪酸分子。oc-FA的非限制性实例包括十三烷酸(C13:0)、十五烷酸(C15:0)和十七烷酸(C17:0),它们都是饱和的oc-FA,以及十七碳烯酸(C17:1),其是不饱和的(即单不饱和的)oc-FA。本文所用的术语“β-酮酯酰-ACP”是指酰基辅酶A引发物分子与丙二酰ACP由图1A和1B所示途径的部分(D)所表示的具有β酮酯酰-ACP合酶活性的酶(例如EC2.3.1.180)催化的缩合产物。酰基辅酶A引发物分子可以具有含偶数个碳原子的酰基基团,例如图1A中所示的乙酰辅酶A,在这种情况下,产生的β-酮酯酰-ACP中间产物是乙酰乙酰-ACP,其为偶数链(ec-)β-酮酯酰-ACP。酰基辅酶A引发物分子可以具有含奇数个碳原子的酰基基团,例如图1B中所示的丙酰辅酶A,在这种情况下,产生的β-酮酯酰-ACP中间产物是3-氧代戊酰-ACP,其为奇数链(oc-)β-酮酯酰-ACP。β-酮酯酰-ACP中间产物进入由图1A和1B的部分(E)所示的脂肪酸合酶(FAS)循环,其中其进行延长循环(即,酮还原、脱水、和烯酰还原),添加两个碳单元至酰基链,随后进入其他的延长循环,每一个循环涉及与另一丙二酰ACP分子的缩合、酮还原和烯酰还原,使得酰基-ACP的酰基链以每个延长循环延长两个碳单元。“酰基-ACP”通常是指FAS催化β-酮酯酰-ACP中间产物延长的一轮或多轮产物。酰基-ACP是烷基链的羰基碳和酰基载体蛋白(ACP)的4’-磷酸泛酰巯基乙胺基部分的巯基基团之间形成的酰基硫酯,在线性碳链的情况下,通常具有式CH3-(CH2)n-C(=O)-s-ACP,其中n可以是偶数(例如,“偶数链酰基-ACP”或“ec-酰基-ACP”,其例如在乙酰辅酶A是引发物分子时产生,参见图1A)或奇数(例如,“奇数链酰基-ACP”或“oc-酰基-ACP”,其例如在丙酰辅酶A是引发物分子时产生,参见图1B)。除非指出并非如此,“脂肪酸衍生物”(缩写为“FA衍生物”)意图包括至少部分由重组微生物细胞的脂肪酸生物合成途径产生的任何产物。脂肪酸衍生物还包括至少部分由脂肪酸途径中间产物如酰基-ACP中间产物产生的任何产物。本文所述的脂肪酸生物合成途径可以包括经改造以产生脂肪酸衍生物的脂肪酸衍生物酶,并且在一些情况下,可以表达其它酶以产生具有期望的碳链特征的脂肪酸衍生物,诸如例如,具有期望碳原子数的碳链的脂肪酸衍生物的组合物,或具有期望衍生物(含有奇数碳链)比例的脂肪酸衍生物的组合物等。脂肪酸衍生物包括但不限于,脂肪酸、脂肪醛、脂肪醇、脂肪酯(诸如蜡)、碳氢化合物(诸如烷烃和烯烃(包括端烯烃和内烯烃))以及酮。术语“奇数链脂肪酸衍生物”(缩写为“oc-FA衍生物”)是指上文定义的oc-酰基-ACP与一种或多种脂肪酸衍生物酶的反应产物。产生的脂肪酸衍生物产物同样具有线性碳链,其含有奇数个碳原子,除非脂肪酸衍生物本身是oc-FA衍生物或oc-酰基-ACP的脱羰产物或脱羧产物,在这种情况下,产生的oc-FA衍生物具有偶数个碳原子;例如,当脂肪酸衍生物是oc-脂肪醛脱羰产生的ec-烷烃或ec-烯烃、oc-脂肪酸脱羧产生的ec-端烯烃、oc-酰基-ACP脱羧产生的ec-酮或ec-内烯烃时等等。应当理解,oc-FA衍生物或oc-酰基-ACP前体分子的此类偶数链长产物,尽管具有含偶数碳原子的线性链,仍然被认为落入“oc-FA衍生物”的定义中。“内源”多肽是指由亲代微生物细胞(也称为“宿主细胞”)的基因组编码的多肽,从该亲代微生物细胞改造出(或“产生”)重组细胞。“外源”多肽是指并非由亲代微生物细胞的基因组编码的多肽。变异的(即突变的)多肽是外源多肽的实例。在本发明的实施方案中,其中多核苷酸序列编码内源多肽,在一些情况下,所述内源多肽过表达。如本文使用的,“过表达”意指在相同的条件下,细胞中以高于对应的亲代细胞(例如,野生型细胞)正常产生的浓度产生多肽或导致多核苷酸产生多肽。当在相同的条件下,与相同物种的非重组微生物细胞(例如,亲代微生物细胞)中的多核苷酸或多肽浓度相比,所述多核苷酸或多肽以更高的浓度存在于重组微生物细胞中,则该多核苷酸或多肽在所述重组微生物细胞中是“过表达的”。过表达可以通过本领域已知的任何合适的方式来实现。在一些实施方案中,重组微生物细胞中内源多肽的过表达可以通过使用外源调节元件来实现。术语“外源调节元件”通常指源自宿主细胞外的调节元件(诸如,表达控制序列或化合物)。然而,在某些实施方案中,术语“外源调节元件”(例如“外源启动子”)可以指源自宿主细胞的调节元件,为了控制重组细胞中内源多肽的表达的目的,所述调节元件的功能被重复或侵占。例如,如果宿主细胞是大肠杆菌细胞,多肽是内源多肽,则重组细胞中内源多肽的表达可以由来自另一大肠杆菌基因的启动子控制。在一些实施方案中,导致内源多肽表达和/或活性水平升高的外源调节元件是化合物例如小分子。在一些实施方案中,控制编码内源多肽的多核苷酸(例如,内源多核苷酸)的表达的外源调节元件是通过重组整合入宿主细胞基因组中的与所述内源多肽可操作连接的表达控制序列。在某些实施方案中,利用本领域已知的方法,通过同源重组将表达控制序列整合入宿主细胞染色体(例如,Datsenkoetal.,Proc.Natl.Acad.Sci.U.S.A.,97(12):6640-6645(2000))。表达控制序列是本领域内已知的,并且包括,例如,提供多核苷酸序列在宿主细胞中表达的启动子、增强子、聚腺苷酸化信号、转录终止子、内部核糖体进入位点(IRES)等。表达控制元件与参与转录的细胞蛋白特异性相互作用(Maniatisetal,Science236:1237,(1987))。示例性的表达控制序列描述于例如Goeddel,GeneExpressionTechnology:MethodsinEnzymology,Vol.185,AcademicPress,SanDiego,Calif.(1990)中。在本发明的方法中,表达控制序列与多核苷酸序列可操作地连接。“可操作地连接”表示多核苷酸序列和表达控制序列以这样的方式连接:当合适的分子(例如转录激活蛋白)与所述表达控制序列结合时,允许基因表达。可操作连接的启动子就转录和翻译的方向而言位于所选的多核苷酸序列的上游。可操作连接的增强子可以位于所选多核苷酸的上游、之内或下游。其它核酸序列,例如编码选择标记、纯化部分、靶向蛋白等的核酸序列,可以可操作地连接至所述多核苷酸序列,使得所述其它核酸序列与所述多核苷酸序列一起表达。在一些实施方案中,通过重组载体的方式将多核苷酸序列提供给重组细胞,所述重组载体包含可操作连接至所述多核苷酸序列的启动子。在一些实施方案中,所述启动子是发育调节型、细胞器特异性、组织特异性、诱导型、组成型或细胞特异性启动子。如本文所用,“载体”是指能够转运与其连接的另一核酸(即多核苷酸序列)的核酸分子。一类有用的载体是附加体(即能够染色体外的复制的核酸)。有用的载体是能够自主复制和/或表达与其连接的核酸的那些载体。能够指导与其可操作连接的基因的表达的载体在本文被称为“表达载体”。通常,在重组DNA技术中使用的表达载体经常是“质粒”的形式,所述“质粒”通常是指在其载体形式时不与染色体结合的环状双链DNA环。因为质粒是最通常使用的载体形式,所以术语“质粒”和“载体”是交换使用的。但是,还包括发挥等同功能并随后至今成为本领域已知的表达载体的这些其他形式。在一些实施方案中,重组载体包含至少一个选自以下的序列:(a)可操作地连接至多核苷酸序列的表达控制序列;(b)可操作地连接至多核苷酸序列的选择标记;(c)可操作地连接至核苷酸序列的标记序列;(d)可操作地连接至多核苷酸序列的纯化部分;(e)可操作地连接至多核苷酸序列的分泌序列;和(f)可操作地连接至多核苷酸序列的引导序列(targetingsequence)。本文所述的表达载体包括本文所述的其形式适合于在宿主细胞中表达多核苷酸序列的多核苷酸序列。本领域技术人员应当理解到,表达载体的设计可以取决于例如待转化的宿主细胞的选择、所需多肽的表达水平等因素。可以将本文所述的表达载体引入宿主细胞,以产生本文所述的多核酸序列所编码的多肽,包括融合多肽。经常用含有指导融合或非融合多肽表达的组成型或诱导型启动子的载体在例如大肠杆菌的原核生物中进行编码多肽的基因的表达。融合载体将许多氨基酸添加到其中编码的多肽,通常添加到重组多肽的氨基末端或羧基末端。这些融合载体通常担任以下3个用途中的一个或多个:(1)增加重组多肽的表达;(2)增加重组多肽的可溶性;和(3)通过作为亲和纯化中的配体,帮助重组多肽的纯化。通常,在融合表达载体中,在融合部分和重组多肽的连接处引入蛋白水解切割位点。这使得在融合多肽纯化后,重组多肽能够从融合部分分离。这些酶及其同源识别序列的实例包括Xa因子、凝血酶和肠激酶。示例性的融合表达载体包括pGEX(PharmaciaBiotech,Inc.,Piscataway,NJ;Smithetal.,Gene,67:31-40(1988))、pMAL(NewEnglandBiolabs,Beverly,Mass.)和pRITS(PharmaciaBiotech,Inc.,Piscataway,N.J.),它们分别将谷胱甘肽S-转移酶(GST)、麦芽糖E结合蛋白或蛋白A融合到靶重组多肽。通过常规转化或转染技术可以将载体引入原核或真核细胞。如本文所用,术语“转化”和“转染”是指许多本领域公认的用于将外源核酸(例如DNA)引入宿主细胞的技术,包括磷酸钙或氯化钙共沉淀、DEAE-葡聚糖介导的转染、脂转染或电穿孔。用于转化或转染宿主细胞的合适的方法可以见于例如Sambrooketal.(同上)。对于细菌细胞的稳定转化,已知的是,根据所用的表达载体和转化技术,仅小部分的细胞会摄入并复制表达载体。为了鉴定和选择这些转化子,可以将编码选择标记(例如抗生素抗性)的基因与目的基因一起引入宿主细胞中。选择标记包括赋予药物抗性的那些标记,所述药物例如,但不限于氨苄西林、卡那霉素、氯霉素或四环素。编码选择标记的核酸可以与编码本文所述的多肽在同一载体上被引入宿主细胞或可以在单独的载体上被引入。可以通过在存在合适选择药物的情况下的生长,鉴定稳定转化了所引入的核酸的宿主细胞,从而产生重组细胞。类似地,对于哺乳动物细胞的稳定转染,已知的是,根据使用的表达载体和转染技术,仅小部分的细胞可以将外源DNA整合到其基因组中。为了鉴定和选择这些整合体,可以将编码选择标记(例如抗生素抗性)的基因与目的基因一起引入宿主细胞中。优选的选择标记包括赋予药物抗性的那些标记,所述药物诸如G418、潮霉素和甲氨蝶呤。编码选择标记的核酸可以与编码本文所述的多肽在同一载体上被引入宿主细胞或可以在单独的载体上被引入。可以通过在存在合适选择药物的情况下的生长,鉴定稳定转染了所引入的核酸的宿主细胞,从而产生重组细胞。本文所用的“基因敲除”是指修饰或失活编码靶蛋白的基因以降低或消除该完整蛋白的功能的方法。基因的失活可以通过常规方法进行,例如,通过UV照射或用N-甲基-N'-硝基-N-亚硝基胍处理的诱变,定点诱变、同源重组、插入-缺失诱变、或“Red-drivenintegration”(Datsenkoetal,Proc.Natl.Acad.Sci.USA,97:6640-45,2000)。例如,在一实施方案中,将构建体引入亲代细胞从而可能在得到的重组细胞中选择同源重组事件。本领域技术人员会容易地设计包含阳性或阴性选择基因的敲除构建体,所述选择基因有效地选择经历了与构建体的同源重组事件的转染细胞。例如,亲代细胞中的改变可以通过用包含改变的DNA序列置换野生型(即内源的)DNA序列获得,所述置换通过单或双交叉重组。为了方便地选择转化子(即重组细胞),例如,所述改变可以是编码抗生素抗性标记的DNA序列或与宿主细胞的可能的营养缺陷型互补的基因。突变包括但不限于,缺失-插入突变。重组细胞中这类改变的实例包括基因中断,即基因干扰使得从该基因正常产生的产物没有以功能形式产生。这可以是由于完全缺失、选择标记的缺失或插入、选择标记的插入、移码突变、框内缺失或导致提前终止的点突变。在一些实例中,基因的整个mRNA均不存在。在其他情况下,产生的mRNA的量发生变化。短语“增加内源多肽的表达水平”意指引起编码内源多肽的多核苷酸序列的过表达,或引起内源多肽序列的过表达。过表达的程度可以是约1.5倍或更多、约2倍或更多、约3倍或更多、约5倍或更多、约10倍或更多、约20倍或更多、约50倍或更多、约100倍或更多或其中的任何范围。短语“增加内源多肽的活性水平”意指增强内源多肽的生物化学功能或生物功能(例如,酶促活性)。增强活性的程度可以是约10%或更多、约20%或更多、约50%或更多、约75%或更多、约100%或更多、约200%或更多、约500%或更多、约1000%或更多或其中的任何范围。本文所用的短语“相对于野生型多核苷酸序列,所述多核苷酸序列的表达被修饰”意指内源多核苷酸序列的表达和/或活性水平升高或降低。在一些实施方案中,控制内源多核苷酸表达的外源调节元件是通过重组整合入宿主细胞基因组中的与所述内源多肽可操作连接的表达控制序列。在某些实施方案中,利用本领域已知的方法,通过同源重组将表达控制序列整合入宿主细胞染色体中。本文所使用的短语“在有效表达所述多核苷酸序列的条件下”表示允许重组细胞产生所需的脂肪酸衍生物的任何条件。合适的条件包括,例如发酵条件。发酵条件可以包含很多参数,例如温度范围、通气水平和培养基组分。这些条件中每一个单独地以及联合地允许宿主细胞生长。示例性培养基包括培养液或凝胶。通常,培养基包括可以直接被重组细胞代谢的碳源。发酵意味着生产宿主例如本发明的重组微生物细胞对碳源的利用。发酵可以是需氧的、厌氧的或其变型(例如,微需氧的)。如本领域技术人员所理解的,重组微生物细胞能够将碳源处理成oc-酰基-ACP或期望的oc-FA衍生物(例如,oc-脂肪酸、oc-脂肪酯、oc-脂肪醛、oc-脂肪醇、ec-烷烃、ec-烯烃或ec-酮)的条件将在一定程度上随特定的微生物而不同。在一些实施方案中,处理发生在需氧环境中。在一些实施方案中,处理发生在厌氧环境中。在一些实施方案中,处理发生在微需氧环境中。本文所用的术语“碳源”是指适于用作原核细胞或简单真核细胞生长的碳源的底物或化合物。碳源可以处于不同形式,包括但不限于聚合物、碳水化合物(例如,糖、诸如单糖、二糖、寡糖和多糖)、酸、醇、醛、酮、氨基酸、肽和气体(例如CO和CO2)。示例性的碳源包括但不限于,单糖,例如葡萄糖、果糖、甘露糖、半乳糖、木糖和阿拉伯糖;二糖,例如蔗糖、麦芽糖、纤维二糖和松二糖;寡糖,例如低聚果糖和低聚半乳糖;多糖,例如淀粉、纤维素、果胶和木聚糖;纤维素原料及其变体,例如半纤维素、甲基纤维素和羧甲基纤维素钠;饱和或不饱和脂肪酸酸,例如琥珀酸酯(盐)、乳酸酯(盐)和醋酸酯(盐);醇,例如乙醇、甲醇或丙三醇或其混合物。碳源可以是光合作用的产物,例如葡萄糖。在某些优选的实施方案中,碳源来源于生物质。在另一优选的实施方案中,碳源包含蔗糖。在另一优选的实施方案中,碳源包含葡萄糖。本文所用的术语“生物质”是指碳源所来源的任何生物材料。在一些实施方案中,将生物质处理成适用于生物转化的碳源。在其他实施方案中,生物质不需要进一步处理成碳源。碳源可以转化成生物燃料。生物质的一个示例性来源是植物物质或植被。例如,玉米、甘蔗或柳枝稷。生物质的另一示例性来源是代谢废物,例如动物物质(例如牛粪)。生物质的其他示例性来源包括藻类或其他海洋植物。生物质还包括来自工业、农业、林业和家庭的废品,包括但不限于发酵废渣、青贮饲料、秸秆、无用杂物、污水、垃圾、纤维质城市废物和剩余食物。术语“生物质”还可以指例如碳水化合物(例如单糖、二糖或多糖)的碳源。为确定条件是否足以允许多肽产物生产或表达,可以培养重组微生物细胞,例如约4、8、12、24、36、48、72小时或更久。在培养过程中和/或之后,获取并分析样品以确定条件是否允许生产或表达。例如,样品中或重组微生物细胞生长的培养基中的重组微生物细胞可以被测试是否存在需要的产物。当测试是否存在期望的产物,例如奇数链脂肪酸衍生物(例如,oc-脂肪酸、oc-脂肪酯、oc-脂肪醛、oc-脂肪醇或ec-碳氢化合物)时,可以使用这样的测定:包括但不限于,气相色谱法(GC)、质谱法(MS)、薄层色谱法(TLC)、高压液相色谱法(HPLC)、液相色谱法(LC)、与火焰电离检测器耦合的GC(GC-FID)、GC-MS和LC-MS。当测试多肽的表达时,可以使用例如但不限于Western印迹和点印迹的技术。本文所用的术语“微生物”表示来自古菌域、细菌域和真核域的原核和真核微生物种类,后者包括酵母和丝状真菌、原生动物、藻类或高等原生生物。术语“微生物(microbe)”和“微生物细胞”(即,来自微生物的细胞)与“微生物(微生物)”是可交换使用的并且表示仅借助于显微镜可见的细胞或小有机体。在一些实施方案中,宿主细胞(例如亲代细胞)是微生物细胞。在一些实施方案中,宿主细胞是选自以下的属的微生物细胞:埃希氏菌属(Escherichia)、芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、泛菌属(Pantoea)、发酵单胞菌属(Zymomonas)、红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、曲霉属(Aspergillus)、木霉属(Trichoderma)、链孢霉属(Neurospora)、镰刀菌属(Fusarium)、腐质霉属(Humicola)、根毛霉属(Rhizomucor)、克鲁维酵母菌属(Kluyveromyces)、毕赤酵母属(Pichia)、毛霉菌属(Mucor)、蚀丝霉属(Myceliophtora)、青霉属(Penicillium)、平革菌属(Phanerochaete)、侧耳属(Pleurotus)、栓菌属(Trametes)、金黄孢子菌属(Chrysosporium)、酵母属(Saccharomyces)、寡养单胞菌属(Stenotrophamonas)、裂殖酵母属(Schizosaccharomyces)、耶氏酵母属(Yarrowia)、链霉菌属(Streptomyces)、聚球蓝细菌属(Synechococcus)、小球藻属(Chlorella)或原壁菌属(Prototheca)。在其他的实施方案中,宿主细胞为迟缓芽孢杆菌(Bacilluslentus)细胞、短芽孢杆菌(Bacillusbrevis)细胞、嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)细胞、地衣芽孢杆菌(Bacilluslicheniformis)细胞、嗜碱芽孢杆菌(Bacillusalkalophilus)细胞、凝结芽孢杆菌(Bacilluscoagulans)细胞、环状芽孢杆菌(Bacilluscirculans)细胞、短小芽孢杆菌(Bacilluspumilis)细胞、苏云金芽孢杆菌(Bacillusthuringiensis)细胞、克劳氏芽孢杆菌(Bacillusclausii)细胞、巨大芽孢杆菌(Bacillusmegaterium)细胞、枯草芽孢杆菌(Bacillussubtilis)细胞或解淀粉芽孢杆菌(Bacillusamyloliquefaciens)细胞。在其他的实施方案中,宿主细胞为康氏木霉(Trichodermakoningii)细胞、绿色木霉(Trichodermaviride)细胞、里氏木霉(Trichodermareesei)细胞、长枝木霉(Trichodermalongibrachiatum)细胞、泡盛曲霉(Aspergillusawamori)细胞、烟曲霉(Aspergillusfumigates)细胞、臭曲霉(Aspergillusfoetidus)细胞、构巢曲霉(Aspergillusnidulans)细胞、黑曲霉(Aspergillusniger)细胞、米曲霉(Aspergillusoryzae)细胞、特异腐质霉(Humicolainsolens)细胞、棉毛状腐质霉(Humicolalanuginose)细胞、混浊红球菌(Rhodococcusopacus)细胞、米黑根毛霉(Rhizomucormiehei)细胞或米黑毛酶(Mucormichei)细胞。在其他实施方案中,宿主细胞是浅青紫链霉菌(Streptomyceslividans)细胞或鼠灰链霉菌(Streptomycesmurinus)细胞。在其他实施方案中,宿主细胞是放线菌(Actinomycetes)细胞。在一些实施方案中,宿主细胞是酿酒酵母(Saccharomycescerevisiae)细胞。在其他实施方案中,宿主细胞是CHO细胞、COS细胞、VERO细胞、BHK细胞、HeLa细胞、Cvl细胞、MDCK细胞、293细胞、3T3细胞或PC12细胞。在一些实施方案中,宿主细胞是来自真核植物、藻类、蓝藻(cyanolacterium)、绿色硫细菌、绿色非硫细菌、紫色硫细菌、紫色非硫细菌、嗜极生物、酵母、真菌、其改造的有机体或合成的有机体的细胞。在一些实施方案中,宿主细胞为光依赖性或固定碳。在一些实施方案中,宿主细胞具有自养活性。在一些实施方案中,宿主细胞具有光合自养活性,例如在存在光的情况下。在一些实施方案中,在缺乏光时,宿主细胞是异养的或兼养的。在某些实施方案中,宿主细胞是来自以下的细胞:拟南芥(Avabidopsisthaliana)、柳枝稷(Panicumvirgatum)、巨芒(Miscanthusgiganteus)、玉米(Zeamays)、葡萄藻(Botryococcusebraunii)、莱茵衣藻(Chlamydomonasreinhardtii)、杜氏盐藻(Dunalielasalina)、聚球蓝细菌(SynechococcusSp.)PCC7002、聚球蓝细菌PCC7940、聚球蓝细菌PCC6803、长嗜热聚球蓝细菌(Thermosynechococcuselongates)BP-1、绿硫菌(Chlorobiumtepidum)、橙色绿屈挠菌(Chloroflexusaurantiacus)、酒色着色菌(Chromatiummvinosum)、深红红螺菌(Rhodospirillumrubrum)、荚膜红细菌(Rhodobactercapsulatus)、沼泽红假单胞菌(Rhodopseudomonaspalusris)、将达梭菌(Clostridiumljungdahlii)、热纤梭菌(Clostridiuthermocellum)、产黄青霉菌(Penicilliumchrysogenum)、巴斯德毕赤酵母(Pichiapastoris)、酿酒酵母、粟酒裂殖酵母(Schizosaccharomycespombe)、荧光假单胞菌(Pseudomonasfluorescens)、柠檬泛菌(Pantoeacitrea)或运动发酵单胞菌(Zymomonasmobilis)。在某些实施方案中,宿主细胞是来自以下的细胞:Chlorellafusca、原始小球藻(Chlorellaprotothecoides)、蛋白核小球藻(Chlorellapyrenoidosa)、Chlorellakessleri、Chlorellavulgaris、海水小球藻(Chlorellasaccharophila)、Chlorellasorokiniana、椭圆小球藻(Chlorellaellipsoidea)、Protothecastagnora、波多黎各原壁菌(Protothecaportoricensis)、Protothecamoriformis、魏氏原壁菌(Protothecawickerhamii)或左氏原壁菌(Protothecazopfii)。在一些实施方案中,宿主细胞是细菌细胞。在一些实施方案中,宿主细胞是革兰氏阳性细菌细胞。在一些实施方案中,宿主细胞是革兰氏阴性细菌细胞。在某些实施方案中,宿主细胞是大肠杆菌细胞。在一些实施方案中,大肠杆菌细胞是B品系、C品系、K品系或W品系大肠杆菌细胞。在本发明的某些实施方案中,宿主细胞经改造以表达(或过表达)转运蛋白。转运蛋白能够将多肽或有机化合物(例如,脂肪酸或其衍生物)输出至宿主细胞外。本文使用的术语“在代谢上改造的”或“代谢改造”涉及合理的途径设计和用于在重组细胞如本文所述的重组微生物细胞中产生期望的代谢物,诸如例如oc-β-酮酯酰-ACP、oc-酰基-ACP或oc-脂肪酸衍生物的,对应于生物合成基因的多核苷酸、与操纵子相关的基因和此类多核苷酸的控制元件的组装。“代谢改造”还可以包括利用遗传改造和合适的培养条件(包括与产生期望途径的中间产物竞争的竞争代谢途径的减少、中断或敲除),通过调节和优化转录、翻译、蛋白稳定性和蛋白功能性而优化代谢通量。“生物合成基因”可以是宿主细胞内源的(天然的)(即,未从宿主细胞修饰的基因),或者由于对于宿主细胞是外来的或通过诱变、重组、和/或在重组细胞中与外源(异源)表达控制序列结合进行修饰,而可以是宿主细胞外源的(异源的)。生物合成基因编码“生物合成多肽”或“生物合成酶”。术语“生物合成途径”也被称为“代谢途径”,是指由生物合成酶催化的一组生化反应,其将一种化学物质转化成另一种。本文使用的术语“脂肪酸生物合成途径”(或更简单地,“脂肪酸途径”)是指产生脂肪酸衍生物(例如,脂肪酸、脂肪酯、脂肪醛、脂肪醇、烷烃、烯烃、酮等)的一组生化反应。脂肪酸途径包括脂肪酸途径生物合成酶(即,“脂肪酸途径酶”),其如本文所述可以被改造以产生脂肪酸衍生物,并且在一些实施方案中,其可以与其它酶一起表达以产生具有期望的碳链特征的脂肪酸衍生物。例如,本文所述的“奇数链脂肪酸生物合成途径”(即“oc-FA途径”)包括足以产生oc-脂肪酸衍生物的酶。术语“重组微生物细胞”是指通过在选择的“亲代微生物细胞”(即宿主细胞)中引入遗传物质,从而修饰或改变所述亲代微生物细胞的细胞生理学和生物化学的遗传上修饰的(即“改造的”)的微生物细胞(即微生物)。通过引入遗传物质,重组微生物细胞获得与亲代微生物细胞相比新的或改善的特性,诸如例如,产生新的细胞内代谢物或更大量的现有细胞内代谢物的能力。本文提供的重组微生物细胞表达多种生物合成酶(例如,脂肪酸途径酶,例如oc-FA途径酶),所述生物合成酶参与从适当的碳源产生例如oc-酰基-ACP中间产物或oc-脂肪酸衍生物的途径。引入亲代微生物细胞的遗传物质可以含有,编码参与产生oc-脂肪酸衍生物的生物合成途径(即生物合成酶)的一种或多种酶的基因或基因的一部分,以及任选地或另外可以包括表达或和/或调节表达编码此类生物合成酶的基因的其它元件,例如启动子序列。因此,本文所述的重组微生物细胞已经被遗传改造以表达或过表达参与本文所述的oc-脂肪酸(oc-FA)生物合成途径的生物合成酶。应当理解,“重组微生物细胞”和“重组微生物”不仅指具体的重组微生物细胞/微生物,还指此类细胞的后代或可能的后代。重组微生物细胞可选择地或除了包含引人亲代微生物细胞中的遗传物质之外,还可以包括基因或多核苷酸的减少、断裂、缺失或“敲除”以改变所述亲代微生物细胞的细胞生理学和生物化学。通过基因或多核苷酸的减少、断裂、缺失或“敲除”(也被称为基因或多核苷酸的“弱化”),重组微生物细胞获得与亲代微生物细胞相比新的或改善的特性(诸如例如,产生新的或更大量的细胞内代谢物的能力,提高代谢物通过期望途径的通量的能力和/或降低不想要的副产物的产生的能力)。改造重组微生物细胞以产生奇数链脂肪酸衍生物很多微生物细胞正常地产生直链脂肪酸(其中线性脂肪族链主要含有偶数的碳原子),并且通常产生相对少量的具有线性脂肪族链(其含有奇数碳原子)的脂肪酸。由此类微生物细胞如大肠杆菌产生的相对少量的线性奇数链脂肪酸(oc-FA)和其它线性奇数链脂肪酸衍生物(oc-FA衍生物),在某些情况下归因于此类细胞中存在的低水平的丙酰辅酶A。此类细胞主要利用乙酰辅酶A作为脂肪酸生物合成的引发物分子,导致此类细胞产生的大多数脂肪酸和其它脂肪酸衍生物是线性偶数链脂肪酸(ec-FA)和其它线性偶数链脂肪酸衍生物(ec-FA衍生物)。本发明部分基于这样的发现:通过改造微生物使其相对于亲代微生物产生的丙酰辅酶A的量产生增加量的丙酰辅酶A,改造的微生物相对于亲代微生物产生的oc-FA衍生物的量产生更大量(滴度)的oc-FA衍生物,和/或相对于亲代微生物产生的脂肪酸衍生物组合物中oc-FA衍生物的比例产生具有更高比例的oc-FA衍生物的脂肪酸衍生物组合物。因为最终目的是为了提供从碳源(诸如例如,碳水化合物或生物质)开始的工业规模生产脂肪酸衍生物(包括oc-FA衍生物)的环保责任的、具有成本效益的方法,所以微生物产生oc-FA衍生物分子的产量的提高和/或微生物产生的脂肪酸衍生物分子的组成的优化(例如通过提高奇数链产物相对于偶数链产物的比例)是可取的。因此,不同途径中间产物的过量产生策略已被核查,以增加通过导致奇数链脂肪酸产生的途径的代谢通量。可以改造工业上有用的微生物中从起始原料例如糖将代谢引导至丙酰辅酶A,通过奇数链酰基-ACP(oc-酰基-ACP)中间产物,至oc-FA衍生物产物的途径。在一方面,本发明包括含有编码多肽(例如,酶)的一种或多种多核苷酸的重组微生物细胞,当在有效表达所述多核苷酸的条件下,在存在碳源的情况下培养所述重组微生物细胞时,所述多肽具有参与丙酰辅酶A生物合成和/或参与oc-酰基-ACP中间产物生物合成的酶促活性。在一些实施方案中,所述重组微生物细胞还包含一种或多种多核苷酸,每一种都编码具有脂肪酸衍生物酶活性的多肽,其中所述重组微生物细胞在足以表达所述多核苷酸的条件下,在存在碳源的情况下培养时,产生奇数链脂肪酸衍生物。本发明还包括制备包含奇数链脂肪酸衍生物的组合物的方法,包括培养本发明的重组微生物细胞。本发明还包括增加微生物细胞产生的丙酰辅酶A的量的方法,和增加微生物细胞产生的奇数链脂肪酸衍生物的量或比例的方法,以及进一步核查后显而易见的其它特征。重组微生物细胞可以是丝状真菌、水藻、酵母或诸如细菌(例如,大肠杆菌或芽孢杆菌)的原核生物。通常,可以在本发明的重组微生物细胞中通过图1B中描述的奇数链脂肪酸生物合成途径(“oc-FA途径”)产生奇数链脂肪酸衍生物(例如,奇数链脂肪酸、奇数链脂肪酯(包括奇数链脂肪酸甲酯(oc-FAMEs)、奇数链脂肪酸乙酯(oc-FAEEs)和奇数链蜡酯)、奇数链脂肪醛、奇数链脂肪醇,以及由于奇数链前体的脱羰或脱羧作用产生的偶数链碳氢化合物(如偶数链烷烃、偶数链烯烃、偶数链端烯烃、偶数链内烯烃和偶数链酮))。为了产生奇数链脂肪酸衍生物,重组微生物细胞利用丙酰辅酶A作为脂酰链延长过程起始的“引发物”。如图1B中所示,脂酰延长过程最初涉及由具有β-酮酯酰ACP合酶活性(例如,β-酮酯酰ACP合酶III酶)的酶催化的奇数链长引发物分子丙酰辅酶A与丙二酰ACP分子的缩合,从而形成初始的奇数链β-酮酯酰-ACP中间产物(例如,3-氧代戊酰-ACP),如图1B的步骤(D)中所描绘的。奇数链β-酮酯酰-ACP中间产物通过脂肪酸合酶(FAS)复合物在β-碳处经历酮还原、脱水和烯酰还原,从而形成初始的奇数链酰基-ACP中间产物,其经历与丙二酰ACP的缩合、酮还原、脱水和烯...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1