环氧化方法与流程
环氧化方法相关申请的引用本申请要求于2012年7月26日提交的美国临时专利申请序列号61/676,050的权益,通过引用将其全部内容结合于此。技术领域本发明涉及环氧乙烷(氧化乙烯,ethyleneoxide)的生产,更具体地涉及生产环氧乙烷的方法,其中,首先提供包含至少通过脱水乙醇得到的乙烯的进料组分,然后在使进料组分与含银环氧化催化剂接触之前,使其与脱硫催化剂接触。
背景技术:
尽管环氧乙烷以微量存在于自然状态中,但是AlsatianchemistCharles-AdolpheWurtz在1859年使用所谓的“氯乙醇”方法首次在实验室状态下合成了环氧乙烷。但是,在Wurtz时期没有完全理解环氧乙烷作为工业化学品的有用性;并且至少部分由于对于作为用于快速发展的汽车市场的防冻剂的乙二醇(环氧乙烷是其中间体)需求的快速增加,使用氯乙醇方法的环氧乙烷的这种工业生产直到第一次世界大战前夕才开始。即使这样,氯乙醇方法生产相对少量的环氧乙烷,而且是高度不经济的。氯乙醇方法最终被另一种方法所取代,法国化学家ThèodoreLefort在1931年发现乙烯与氧的直接催化氧化,其是环氧乙烷合成的第二突破的结果。Lefort使用固体银催化剂与包含乙烯的气相进料,并且利用空气作为氧源。在直接氧化方法发展的80年中,环氧乙烷的生产增加显著,以至于今天它是化学工业中最大体积的产品之一,由一些人估计计算,其与通过非均相氧化生产的有机化学品的总值的一半一样多。2000年的全球产量是约150亿吨。(生产的环氧乙烷的约三分之二被进一步加工成乙二醇,而制造的环氧乙烷的约10%被直接用于如蒸汽消毒的应用。)环氧乙烷产量的增长一直伴随着催化和处理的连续创新。近年来,以及环氧乙烷领域的研究人员特别感兴趣的一直是取代乙烯原料的来源。通常,乙烯源自用蒸汽热裂解的石油源,尤其是石脑油。取代原料的该兴趣不仅是原油价格的持续增长的结果,而且也是因为使用可再生和大量的烃源的重要性的较高环保意识。已经吸引了近年来相当大的兴趣的一种这种烃源是源自生物乙醇的乙烯。生物乙醇本身由植物生物质和农业副产品以及废物发酵得到-因此是大量的且可再生的。生物质发酵成乙醇产生包含约95%水和5%乙醇的混合物。然后使用共沸蒸馏或溶剂萃取的组合分离水。为了生产乙烯,然后将乙醇输送至脱水处理,在该处其在脱水催化剂上反应形成乙烯,然后形成用于环氧乙烷或一种或多种环氧乙烷衍生物的初级原料或进料组分。这返回到用于生产乙烯的生物乙醇,是具有讽刺意味的,因为在19世纪中期首次合成乙烯时,是在均匀的磷催化剂存在下通过脱水乙醇得到的乙烯。(Roscoe,H.A.andSchorlemmer,C.,ATreatiseonChemistry,1878,612)。在源自生物乙醇的乙烯提供作为可替代的原料、大量和可再生以及半依赖于世界石油市场的优势的同时,还存在某些挑战。此处最值得注意的是尽管试图从源自生物乙醇的乙烯中除去杂质和分离副产物,但是仍然残留有必须处理和除去的某些污染物的问题。例如,含硫化合物,在源自生物乙醇的乙烯中不仅频繁地发现常见和相对易于除去的硫化氢,还频繁地发现更顽固的含硫化合物,如难降解的(refractory)有机硫,包括硫醇、噻吩、和硫化羰。事实上,在Roscoe和Schlorlemmer分析脱水方法的报告中确定了作为乙醇脱水副产物的硫的存在,其还指明使用碱洗液来消除它。污染物硫已被确定为是特别严重的催化剂毒物。特别是吸附硫至银的情况,事实上,银对硫的亲和性可以被看作是银物体上的可见形式的玷污,该银物体从周围空气中吸附硫化氢和其他硫化合物形成硫化物层。硫在环氧乙烷体系中是特别有害的,因为它是长期已知的对Ag类环氧乙烷催化剂严重并且不可逆地有毒的(Rebsdat,S.andMayerD.,2005,EthyleneOxide,UllmansEncyclopediaofIndustrialChemistry)。多种技术可用于处理含硫化合物的烃流。在吸附脱硫中,其可能是最简单且最广泛使用的脱硫技术,烃流穿过吸附剂保护床以通过物理和/或化学吸附过程吸附含硫化合物。更典型地,吸附剂包括粒状无机材料如无机氧化物;典型的实例包括氧化锌、氧化铜、和氧化铝,但也可以选自其他的过渡金属氧化物和稀土金属氧化物。优选地,基于它们吸附某些硫物质的选择性选择保护床材料,例如,氧化铜或氧化锌有效除去简单的硫化合物,像硫化氢;而氧化铝类吸附剂具有吸附有机硫的一些能力,其他吸附金属氧化物对于该有机硫是完全无效的。然而,虽然氧化铝对于除去有机硫可能比氧化锌好,但是对于许多应用它根本是无效的。因此,可以代替使用其他脱硫技术,如加氢脱硫。在加氢脱硫(HDS)中,在高温和高压下,使烃流与氢气在加氢催化剂上反应。HDS比金属氧化物吸附床更有效地除去有机硫,但是它仍然不能除去一些有机硫。虽然HDS比脱硫技术更有效,更容易地转化硫醇和硫醚,但是它不能转化其他的有机硫,如取代的和未取代的噻吩。此外,HDS昂贵且要求高温和高压。一个可替代加氢脱硫的是氧化脱硫(“ODS”)。在ODS中,在金属催化剂(典型的是如钛、锆、铬、钨和钼)存在下,使难降解的含有机硫的烃与强氧化剂(如过氧化氢、有机过氧化物、或有机过酸)接触,以形成有机砜,然后通过蒸馏或通过进一步的化学反应可以将其除去。与加氢脱硫相比,ODS具有不要求用于操作的高温或高压的优势,并且ODS比加氢脱硫除去更全面范围的有机硫。因此,ODS具有更宽范围的它将应用至的难降解的有机硫,并且具有对用于减少原料源中的硫含量的温度和压力要求的更低需求。然而,与HDS相似,ODS具有比保护床昂贵得多和更复杂实现的劣势。另外的复杂度不仅增加成本,而且降低方法的灵活性和可操作性。此外,ODS要求配备有昂贵且难以处理的强氧化剂。鉴于上述情况,本领域仍然存在对于有效除去比常规的无机材料更宽范围的难降解的有机硫,而且同时可以比常规的加氢脱硫和氧化脱硫技术更灵活、更价廉的更便于操作的脱硫方法的需要。
技术实现要素:
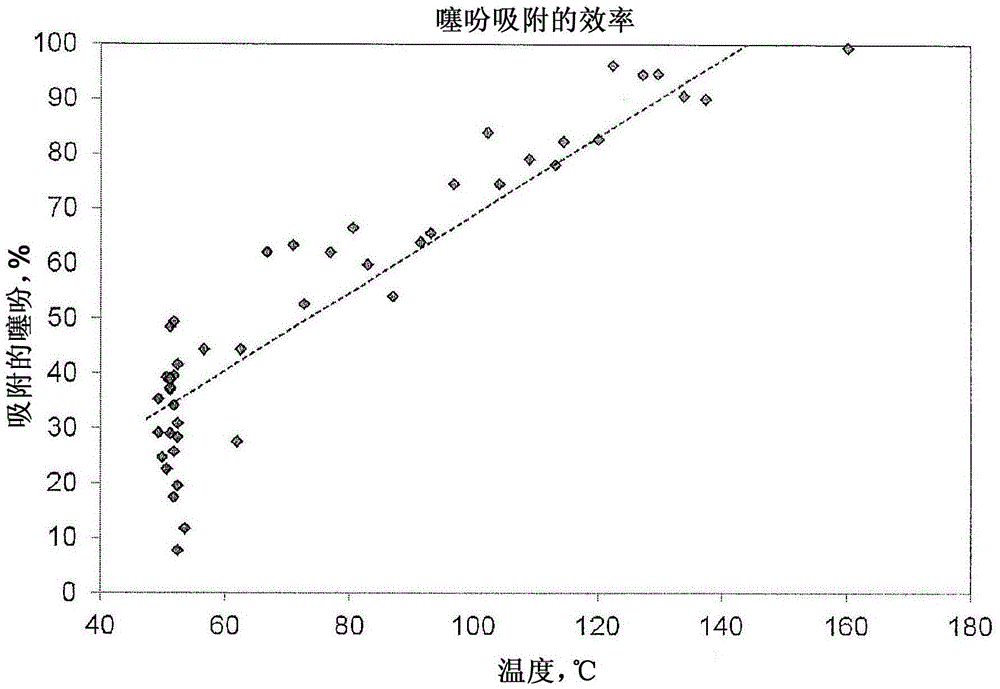
本发明涉及用于生产环氧乙烷的方法,包括:a)提供一种或多种进料组分,其中,该一种或多种进料组分至少包含通过脱水乙醇得到的乙烯;b)使一种或多种进料组分与包含高表面积的载体和一定量的银的脱硫催化剂接触,其中,至少20%的银作为氧化的银存在;以及c)使一种或多种进料组分与布置在环氧乙烷反应器内的含银环氧化催化剂接触,以形成包含环氧乙烷的反应气体。本发明还涉及用于生产环氧乙烷的体系,包括:(a)通过脱水乙醇得到的乙烯源;(b)包含高表面积的载体和一定量的银的脱硫催化剂,其中,至少20%的银作为氧化的银存在;(c)包括多个反应器管的环氧乙烷反应器;和(d)布置在反应器管内的含银环氧化催化剂。附图说明图1是示出了对于根据本发明的银浸渍的γ-氧化铝的脉冲化学吸附实验的曲线图。图2是示出了使用根据本发明的5%Ag/γ-Al2O3的噻吩吸附效率的温度依赖性的曲线图。具体实施方式除非另外指出,否则本文使用的所有份数、百分数、和比值都以体积表示。通过引用结合本文引用的所有文件。如本文使用的,术语“难降解的有机硫”或“有机硫”包括但不限于至少有机硫化合物如硫化羰(COS)和其他的硫化物,尤其是二硫化物、硫醇、硫醚和噻吩。本发明中已经发现,通过使烃流与脱硫催化剂接触可以有效率地和有效地从烃流除去难降解的有机硫,该脱硫催化剂具有对硫化合物的亲和性并且将硫吸附至它的表面。本发明的进一步优势是通过简单的固定催化剂床进行脱硫,可以容易地和在温和的条件下操作-不增加另外的方法复杂度也不要求特殊的脱硫气体。此外,脱硫催化剂在氧存在下是可再生的,并且可以持续很长一段时间而不用更换,尤其是,例如持续进料环氧乙烷催化剂的整个使用期限。本发明的方法的进一步优势是,处理难降解的有机硫的转化是有选择性的并且对于不包含难降解的有机硫的进料组分不具有明显的影响。简单讨论方法中使用的银类环氧化催化剂之后,将更详细地描述本发明的脱硫催化剂和方法。银类环氧化催化剂本发明中可以使用的银类环氧化催化剂包含载体和至少一种催化有效量的银或含银化合物;还可选地存在的是促进量的铼或含铼化合物;还可选地存在的是促进量的一种或多种碱金属或含碱金属的化合物。本发明中使用的用于银类环氧化催化剂的载体可以选自大量的固体、可以是多孔的并且可以提供优选的孔结构的难降解的载体。氧化铝是熟知的用于环氧化烯烃的有用催化剂载体,并且是优选的载体。载体可以包括材料如α-氧化铝、炭、浮石、氧化镁、氧化锆、氧化钛(titania)、硅藻土、漂白土、碳化硅、硅石、碳化硅、粘土、人造沸石、天然沸石、二氧化硅和/或二氧化钛(titaniumdioxide),陶瓷和它们的组合。载体可以包含至少约85wt%的α-氧化铝。剩余的组分可以包含除了α-氧化铝之外的无机氧化物,如硅石、碱金属化合物(例如,氧化钠)和痕量的其他含金属或含非金属的添加剂或杂质。不管使用的载体的特性,通常将其成形为适用于固定床环氧化反应器合适使用的大小的颗粒、块、片、丸、环、球、车轮(wagonwheel)、交叉分割的中空圆柱体(cross-partitionedhollowcylinder)等。载体颗粒可以优选地具有约3mm至约12mm范围内,更优选地约5mm至约10mm范围内的等效直径。(等效直径是具有与使用的载体颗粒相同的外表面(即,忽略颗粒的孔内的表面)与体积的比值的球的直径。)合适的载体是商业可获得的。不限于本文包含的具体组成和配方,关于载体组合物和用于制作载体的方法的进一步信息可以在美国专利公开号2007/0037991中找到。为了生产用于将烯烃氧化至氧化烯烃的催化剂,那么具有以上特征的载体在其表面上被提供有催化有效量的银。通过用溶解在合适溶剂中的银的化合物、络合物或盐浸渍载体导致银前体化合物沉积在载体上,制备催化剂。优选地,使用银水溶液。在沉积银之前、同时、或之后,也可以将促进量的铼组分(其可以是含铼化合物或含铼络合物)沉积在载体上。基于包含载体的总催化剂的重量,被表示为铼金属的铼促进剂(助催化剂,promoter)可以以约0.001wt%至约1wt%、优选地约0.005wt%至约0.5wt%,以及更优选地约0.01wt%至约0.1wt%的量存在。在沉积银和铼之前、同时、或之后,也可以被沉积在载体上的其他组分是促进量的碱金属或两种或更多种碱金属的混合物,以及可选的促进量的第IIA族碱土金属组分或两种或更多种第IIA族碱土金属组分的混合物,和/或过渡金属组分或两种或更多种过渡金属组分的混合物,所有的都可以以溶解在适当的溶剂中的金属离子、金属化合物、金属络合物和/或金属盐的形式。可以同时或在单独的步骤中用多种催化剂促进剂浸渍载体。本发明的载体、银、一种或多种碱金属促进剂、铼组分、和可选的另外的一种或多种促进剂的特定组合将提供超过银和载体和没有或仅一种促进剂的相同组合的一种或多种催化性质的改善。本文使用的术语“促进量”的某种催化剂组分是指与不包含该组分的催化剂相比时,有效作用以改善催化剂的催化性能的组分的量。当然,使用的确切浓度将取决于期望的银含量、载体的性质、液体的粘度、和用于将促进剂传递至浸渍溶液的特定化合物的溶解度等因素。催化性质的实例尤其包括可操作性(抗失控性)、选择性、活性、转化率、稳定性和产率。本领域的技术人员应当理解的是,一种或多种单独的催化性质可能被“促进量”增强,而其他催化性质或者可能或者可能不被增强,或者可能甚至被减弱。合适的碱金属促进剂可以选自锂、钠、钾、铷、铯或它们的组合,优选的是铯,以及尤其优选的是铯与其他碱金属的组合。沉积或存在于载体上的碱金属的量是促进量。优选地,根据金属所测量的,量的范围为按重量计总催化剂的约10ppm至约3000ppm,更优选地约15ppm至约2000ppm,以及甚至更优选地约20ppm至约1500ppm,以及尤其优选是约50ppm至约1000ppm。合适的碱土金属促进剂包括元素周期表中的第IIA族元素,其可以是铍、镁、钙、锶和钡或它们的组合。合适的过渡金属促进剂可以包括元素周期表中的第IVA、VA、VIA、VIIA和VIIIA族的元素,以及它们的组合。最优选地,过渡金属包括选自元素周期表的第IVA、VA或VIA族中的元素。可以存在的优选的过渡金属包括钼、钨、铬、钛、铪、锆、钒、钽、铌或它们的组合。沉积在载体上的一种或多种碱土金属促进剂和/或一种或多种过渡金属促进剂的量是促进量。表示为金属的过渡金属促进剂可以典型地以约0.1微摩尔/克至约10微摩尔/克,优选地约0.2微摩尔/克至约5微摩尔/克,以及更优选地约0.5微摩尔/克至约4微摩尔/克的总催化剂的量存在。催化剂可以进一步包含促进量的一种或多种硫化合物、一种或多种磷化合物、一种或多种硼化合物、一种或多种含卤素的化合物或它们的组合。用于浸渍载体的银溶液还可以包含本领域已知的可选的溶剂或络合剂/增溶剂。可以使用各种各样的溶剂或络合剂/增溶剂以溶解银至在浸渍介质中的期望浓度。有用的络合剂/增溶剂包括胺、氨、草酸、乳酸和它们的组合。胺包括具有1至5个碳原子的亚烷基二胺。在一个优选的实施方式中,溶液包括草酸银和乙二胺的水溶液。络合剂/增溶剂可以以约0.1至约5.0摩尔/摩尔银,优选地约0.2至约4.0摩尔/摩尔银,以及更优选地约0.3至约3.0摩尔/摩尔银的量存在于浸渍溶液中。当使用溶剂时,该溶剂可以是有机溶剂或水,并且可以是极性或基本或完全非极性的。一般而言,溶剂应当具有足够的溶剂化能力以溶解溶液组分。同时,优选的是避免选择的溶剂对溶剂化的促进剂具有过度的影响或相互作用。每分子具有1至约8个碳原子的有机类溶剂是优选的。可以使用若干有机溶剂的混合物或一种或多种有机溶剂与水的混合物,只要这种混合的溶剂的功能是本文所期望的。浸渍溶液中的银的浓度典型地在按重量计约0.1%上达至使用的特定溶剂/增溶剂提供的最大溶解度的范围内。通常非常合适的是使用包含按重量计0.5%至约45%的银的溶液,按重量计5%至35%的银浓度是优选的。使用任一种常规的方法实现选定的载体的浸渍;例如,过量溶液浸渍、初始润湿浸渍、喷涂等。典型地,放置载体材料与含银溶液接触,直到足量的溶液被载体吸附。优选地,用于浸渍多孔的载体的含银溶液的量不多于填充载体的孔所必须的量。部分根据溶液中银组分的浓度,可以使用单一浸渍或者有或没有中间干燥的一系列浸渍。例如,在美国专利号4,761,394、4,766,105、4,908,343、5,057,481、5,187,140、5,102,848、5,011,807、5,099,041和5,407,888中描述了浸渍步骤。可以使用现有已知的预沉积、共沉积和后沉积多种促进剂的步骤。在用含银化合物,即银前体、铼组分、碱金属组分、和可选的其他促进剂浸渍载体之后,煅烧浸渍的载体一段足以将含银化合物转化至活性银物质以及从浸渍的载体除去挥发性组分的时间,以得到催化剂前体。可以通过在约0.5bar至约35bar范围内的压力下,优选地以阶梯速率将浸渍的载体加热至约200℃至约600℃范围内的温度,完成煅烧。一般来说,温度越高,需要的加热周期越短。本领域已经建议了宽范围的加热周期;例如,美国专利号3,563,914公开了加热小于300秒,以及美国专利号3,702,259公开了在100℃至375℃的温度下加热2小时至8小时,通常持续约0.5小时至约8小时。然而,唯一重要的是加热时间与温度相关,使得基本所有的包含的银转化成活性银物质。可以使用连续的或分步加热用于该目的。煅烧期间,可以将浸渍的载体暴露于含氧的气体气氛,氧可以是纯氧或它可以包含另外的惰性或非惰性组分,例如惰性气体或惰性气体与按体积计约10ppm至21%的含氧氧化组分的混合物。出于本发明的目的,将惰性气体定义为在选定的煅烧条件下基本上不与催化剂或催化剂前体反应的气体,尤其优选的是氮。关于催化剂制造的进一步信息在上述的美国专利公开号2007/0037991中可以找到。脱硫催化剂本公开中可以使用的脱硫催化剂包括其上沉积银的高表面积的氧化铝载体。至少部分银作为氧化的银存在。“氧化的银”是指银作为氧化银或银的其他形式存在,即,银与可被用于氧化硫化合物的氧相关联。优选地大于20%的银作为氧化的银存在,更优选地大于50%的银作为氧化的银存在,最优选地大于95%的银作为氧化的银存在。以这种形式,存在丰富的表面氧。在一个实施方式中,脱硫催化剂基本上不含碱金属。“基本上不含碱金属”是指没有有意将碱金属沉积在脱硫催化剂上或包含在脱硫催化剂中,但是痕量可能作为制造的结果存在或存在于前体材料。在单独的实施方式中,脱硫催化剂基本上由氧化铝载体和一定量的银组成,至少部分银是氧化的银,其中,脱硫催化剂的基本和新的性质是它从含烃的流中吸附和除去难降解的有机硫的效力。高表面积的氧化铝载体具有以下特征:-平均孔大小:小于30nm;-BET比表面积:大于100m2/g,优选地,BET比表面积在100m2/g和400m2/g之间;-孔体积:大于0.4cm3/g,优选地,孔体积在0.7cm3/g和1.2cm3/g之间;-银颗粒大小:小于50nm,优选地小于20nm,更优选地小于10nm。在本发明的一个实施方式中,高表面积的氧化铝优选地选自氢氧化铝、氧化铝的氢氧化物(aluminaoxidehydroxide)和氧化铝。尤其优选的氧化铝的氢氧化物是勃姆石。尤其优选的氧化铝是γ-氧化铝。本文使用的,“孔径”可与“孔大小”互换使用。可以通过任何合适的方法测量,但是更优选地通过在例如DrakeandRitter,Ind.Eng.Chem.Anal.Ed.,17,787(1945)中描述的常规的压泵法得到本文描述的孔体积(和孔大小分布)。可以通过任何合适的方法测量,但是更优选地通过在Brunauer,S.,etal.,J.Am.Chem.Soc.,60,309-16(1938)中描述的方法得到本文描述的B.E.T.比表面积。以与以上描述的用于环氧乙烷催化剂的相同方法(尤其在浸渍和煅烧阶段)制备脱硫催化剂。优选地,以包括至少以下的方法制备脱硫催化剂:用至少包含银的草酸铵浸渍溶液浸渍高表面积的氧化铝载体,以及在氮气氛下煅烧。优选地,通过该方法生产的催化剂具有小于100ppm的钠。适当管理催化剂上的氧化的银以延长使用-即,超过环氧乙烷催化剂的典型使用期限是重要的。本发明的脱硫催化剂容易吸附硫,所以在延长的使用期间,连续暴露于含硫的烃,特别是暴露于富含含硫的烃但仅具有有限的氧含量的气氛时(可能正是当乙烯包含大量的硫时,环氧乙烷(EO)反应器中的情况),使脱硫催化剂的性能和效力恶化。不受理论的限制,虽然可以将性能的损失部分归因于过量的硫吸附在催化剂的银层上,然而,认为该性能损失尤其是由催化活性的银位点的氧损失造成的。为了补充氧耗尽的区域,有必要通过使催化剂暴露于氧或氧源(如空气)再生脱硫催化剂,其允许吸附氧至银中以补充氧耗尽的区域并且恢复银至氧化的银的形式。因此,再生的需要决定了脱硫催化剂的构型和布置-具体地,必须将脱硫催化剂放置在与氧源连通的流体中。环氧化方法和反应器体系在环氧化催化剂存在下,通过使含氧气体与源自乙醇的乙烯连续接触,在根据本发明的反应器体系中进行环氧化过程,以形成环氧乙烷和副产物。根据本发明的乙烯的制备开始于乙醇的准备。(优选地由生物质材料(“生物乙醇”)或一些其他大量的和可再生的乙醇源生产该乙醇,然而,由任何来源得到的乙醇都是可接受的。)准备好乙醇,然后通过蒸汽蒸发乙醇以及进一步在加热炉中将其预热至合适的反应温度。然后将预热的蒸发的乙醇送至脱水反应器中,其中,在其经过脱水催化剂时其转化为乙烯。可以将以基本上纯的分子形式或以混合物(如空气)的氧供给至反应。通过实例的方式,进料混合物中的一种或多种进料组分可以包含约0.5%至约45%的乙烯和约3%至约15%的氧,余量包含比较惰性的材料,包括这样的物质如二氧化碳、水、惰性气体、其他的烃、和本文中所描述的反应调节剂。惰性气体的非限制性实例包括氮、氩、氦和它们的混合物。其他烃的非限制性实例包括甲烷、乙烷、丙烷和它们的混合物。反应进料混合物的一种或多种组分经由与组分源流体连通的一个或多个入口进入反应器,并且所述入口还与反应管的上端流体流通(在以下更详细地讨论)。二氧化碳和水是环氧化方法的副产物以及是进料气体中常见的污染物。由于都对催化剂具有不利影响,所以通常将这些污染物的浓度保持在最小值。如上述的,硫也是污染物,其在反应器进料混合物中的浓度必须被最小化。在本发明中,这通过使反应器进料混合物与脱硫催化剂接触来完成。在一个具体地实施方式中,包含脱硫催化剂的固定床的脱硫区本身被包含在脱硫室中。脱硫室位于反应器的上游和反应器外,使得难降解的有机硫化合物在进入反应器以及接触银环氧乙烷催化剂且使其中毒之前,从进料组分中除去它们。环氧乙烷反应器中的一种或多种组分连通,并且进入脱硫室中,被处理,然后离开脱硫室,并且连通至反应器。脱硫室也被放置为与热源和压力源连通,以允许在升高的温度和压力下操作。优选地,一种或多种进料组分在约40℃至约400℃,优选地约80℃至约300℃,更优选地约150℃至约185℃范围内的温度下,与脱硫催化剂接触。通常,随着温度升高至最大使用温度,脱硫催化剂的性能和效率改善;本发明的材料具有约0.6%/℃至约0.8%/℃的效率因子,示出除去难降解的硫的效率随温度升高改善。更优选地,本发明的材料具有约0.6%/℃至约0.8%/℃的噻吩效率因子。通过测量在特定温度下吸附的有机硫的量,然后对于若干不同的温度在相同的条件下重复这种测量,确定上述的效率因子。然后将这些数据点绘制在二维网格中,Y轴表示吸附的噻吩的量,以及X轴表示温度。使用最小二乘或其他这种合适的方法,直线拟合数据,并且该直线是材料的效率因子。然而,尽管脱硫催化剂随温度升高变得更有效,但是操作者可能仍然希望在以上引用的较低的温度范围内操作,尤其是因为存在环氧化方法的标准操作温度。优选地,在约0atm至约50atm,优选地约1atm至约35atm,更优选地约1atm至约25atm范围内的压力下,一种或多种进料组分接触脱硫催化剂。硫去除单元还可以包括分析器以在乙烯进入及离开硫去除单元时测量乙烯中的硫水平。该分析器优选地是在线分析器(onlineanalyzer)。可以使用阀以允许脱硫室选择性地与一种或多种进料组分连接。可以手动或自动地操作阀。此外,可以在脱硫室周围提供绕行管路。通过使用阀和绕行管路,方法用户可以选择性地将一种或多种进料组分与脱硫室连接或断开连接。连通至反应器的一种或多种进料组分之中包含至少25%,优选地至少50%,更优选地至少90%的与环氧乙烷反应器连通的总乙烯进料(在时间平均基础上),该乙烯进料通过脱硫催化剂与环氧乙烷反应器的上游接触。如果氧或氧源都没有在连通至反应器的一种或多种进料组分中,那么反应器室必须包括用于将氧或氧源连通至反应室的单独的入口,以允许脱硫催化剂的再生。也可以串联或并联使用多个脱硫室。并联构造的一个合适的实例是摇床构造。该构造包括两个能够交替吸附模式和再生模式的摇床脱硫室。在吸附模式中,脱硫室与一种或多种进料组分连通以除去有机的难降解的硫,然后一种或多种进料组分连通至反应器。在再生模式中,脱硫室仅与氧源连通以再生内部的脱硫催化剂。也可以串联连接脱硫室。在串联构造的一个实施方式中,多个脱硫室相连接,其中,每个脱硫室具有对不同的含硫化合物物质具有选择性的不同的吸附材料。反应进料混合物的一种或多种其他组分包括一种或多种氯调节剂,其非限制性实例包括有机卤化物,如C1至C8卤代烃;尤其优选的是氯甲烷、氯乙烷、二氯乙烷、氯乙烯或它们的混合物。还合适的是不含氢的氯源,如全卤化的烃,并且双原子氯在气相环氧化作用中是特别有效的调节剂。全卤化的烃称为有机分子,其中,烃中的所有氢原子被卤素原子取代;合适的实例是三氯氟甲烷和全氯乙烯。控制调节剂的浓度水平是重要的,从而平衡若干竞争的性能特征;例如,导致改善的活性的调节剂浓度水平可以同时导致较低的选择性。对于本发明的含铼催化剂,控制调节剂的浓度水平是特别重要的,因为随着含铼催化剂老化,必须仔细监控调节剂浓度,使其在非常小的增量内不断增加,因为仅在非常窄的调节剂浓度范围内得到最佳的选择性值。在一个单独的实施方式中,脱硫催化剂直接布置在催化剂管中。在该实施方式中,反应器管包含填充的环氧乙烷催化剂床和形成在上面(可能形成在环氧乙烷催化剂床的上游,甚至直接形成在环氧乙烷催化剂床的顶部)的脱硫催化剂区。在该构造中,脱硫催化剂靠近反应管的上端,并且在靠近反应管的下端的环氧乙烷催化剂的上游(在以下详细讨论反应器和反应管的构造)。中间的环氧乙烷催化剂床上游的脱硫催化剂在硫可以“看到”银环氧乙烷催化剂之前从反应混合物中除去难降解的有机硫化合物。此外,由于氧是反应混合物的组分,所以没有必要提供另外的氧源;在该实施方式中,基本上所有的乙烯进料与脱硫催化剂接触。在该实施方式中,脱硫催化剂优选地形成在填充的催化剂床中。在上述的任一实施方式中,一种或多种组分与脱硫催化剂接触的结果是,在进料至反应器的反应混合物中的有机难降解的硫的浓度降低,尽管没有降低至零硫含量的浓度。具体地,在穿过脱硫催化剂之后,反应器进料混合物(包括硫类和物质)中的总的硫的浓度不大于约2ppmv,更优选地不大于约1ppmv,甚至更优选地不大于约100ppbv,最优选的是不大于约50ppbv的浓度。用于乙烯的环氧化方法的常用方法包括在催化剂存在下,乙烯与分子氧在固定床管状反应器中的汽相氧化。常规地,商业上的固定床环氧乙烷反应器典型地以在合适的壳中包含多个平行的细长(elongated)管的管壳式换热器的形式,每个管大约是0.7至2.7英寸O.D.和0.5至2.5英存I.D.和15-53英尺长,被银类环氧化催化剂、脱硫催化剂、和其他可选的组分(如惰性气体)填充。反应器可能包含多个反应器管,可能包含几千个管,并且多至20000个。提供上板和下板以支撑多个管,上管板位于每个反应器管的上端,以及下管板位于每个反应器管的下端。实际上,以反应气体形式的进料组分,例如乙烯、氧、镇流气体(ballastgas)(和其他的上述进料组分)通过一个或多个反应器入口引入至反应器中,通过位于临近反应器管的上端的上入口头进入,并且在反应条件下,穿过填充有适当的银催化剂的反应器管。通过循环引入至反应器壳侧的换热流体(如水)除去反应热。烯烃氧化物、未用的反应物和副产物通过反应器出口离开反应器。用于乙烯的环氧化方法的典型操作条件包括约180℃至约330℃,以及优选地约200℃至约325℃,以及更优选地约225℃至约280℃范围内的温度。根据期望的质量速度和生产力,操作温度可以从约大气压变化至约30个大气压。在本发明的范围内,可以使用较高的压力。商业规模的反应器中的停留时间通常在约2秒至约20秒的量级。使用常规的方法分离并且从反应产物中回收得到的环氧乙烷(其通过反应器出口离开反应器)。对于该发明,乙烯的环氧化方法可以包括气体循环,其中,在基本上或部分除去环氧乙烷产物和包含二氧化碳的副产物之后,基本上所有的反应器流出物重新进入反应器入口。已经示出上述的银类催化剂对于环氧乙烷与分子氧成环氧乙烷特别有选择性,尤其在高的乙烯和氧的转化率下。用于在本发明的银类催化剂存在下进行这种氧化反应的条件广泛地包括现有技术中描述的那些。这适用于合适的温度、压力、停留时间、稀释材料、调节剂、和再循环操作或在不同的反应器中应用连续转化,以增加环氧乙烷的产量。在乙烯的氧化反应中使用的本催化剂绝不限于使用已知有效的那些中的具体条件。仅为了示出的目的,以下是经常用于目前的商业环氧乙烷反应器单元中的条件:气时空速(GHSV)1500-10,000h-1,反应器入口压力10-25atm,冷却液温度180-315℃,氧转化率水平10-60%,以及EO产率(功率)7-20lbs.EO/cu.ft.催化剂/hr。在完成开始后以及在标准操作中,反应器入口中的进料组合物典型地包含(按体积计%)1-40%的乙烯,3-12%的O2;0.3%至20%、优选地0.3至5%、更优选地0.3至1%的CO2;0-3%的乙烷,一定量的一种或多种本文描述的氯化物调节剂;和余量的由氩、甲烷、氮或它们的混合物组成的进料。实施例实施例1在本发明中使用脉冲化学吸附实验以示出氧对活化和再活化难降解的化合物被所公开的吸附材料吸附的硫吸附能力的依赖性。将根据先前描述制备的但没有用氧化气体氧化的约2克脱硫催化剂(5%银沉积在具有大约200m2/g的表面积的γ氧化铝载体上)负载至测试单元中并且将其加热至255℃。一旦温度在惰性气体(在该情况中,氦气)下稳定,那么将样品暴露于还原气体氢气(在超高纯度的氩气中5%)20分钟。进行35分钟氦气吹扫,以确保除去任何物理吸附的氢气。在用氦气气体清理样品和样品室之后,在样品上脉冲噻吩。使样品暴露于1cc体积的21ppm噻吩(余量是氦)的脉冲10次。如图1所示,通过在第一噻吩区域的噻吩浓度的峰示出,噻吩脉冲表明噻吩对氢还原的银吸附剂的完全突破。这表明,当脱硫催化剂中的银没有被氧化时,银不能有效除去难降解的硫如噻吩。然后用氧化气体-氧(在超高纯度的氦中10%)处理样品20分钟。用氦气冲洗脱硫催化剂样品和室,以确保在引入噻吩之前除去了任何物理吸附的氧。如图1的第二噻吩区所示,氧化形式的银吸附剂完全吸附脉冲在样品上的噻吩。因此,根据本发明制备的以及暴露于氧化气体的脱硫催化剂对于吸附难降解的硫(如噻吩)是非常优越的。实施例2使用脉冲化学吸附实验以示出脱硫催化剂的效率如何依赖于温度。图还示出操作温度的最佳范围。使用与实施例1中相同的脱硫催化剂。并且用与实施例1相同的测试单元和操作实验报告进行实验。然而,在该实验中,首先在氦气氛下脱硫催化剂被加热至50℃,并且在该温度下保持15分钟。在该周期中,将噻吩引入至包含脱硫催化剂与恒流的室中。气体由21ppm噻吩与超高纯度的氦气余量组成。从图2可以看出,材料表明噻吩的缓慢吸收,甚至在50℃下,具有总浓度的30%的极限效率。然后以10o/分的升温速率从50℃加热样品至150℃,并且对吸附的噻吩进行46次测量。测量的吸附的噻吩如下:表1使用5%Ag/γ-Al2O3的噻吩吸附的效率的温度依赖性。在图2中绘制了列于以上表1中的这些结果。直线(通过最小二乘法绘制)示出该脱硫催化剂具有0.71%/℃的效率因子。本领域的技术人员应当了解的是,在不背离实施方式的广泛发明概念的情况下,可以对以上描述的实施方式做出改变。因此,应当理解的是,本发明并不限于公开的特定实施方式,但是旨在覆盖所附权利要求限定的本发明的精神和范围内的修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1