抗VISTA抗体及片段的制作方法
本案主张以下案件的权益:美国临时申请案第61/920,695号(于2013年12月24日提出申请)及美国临时申请案第62/085,086号(于2014年11月26日提出申请)。上述申请案皆将其完整教示并入本案作为参考。
背景技术:
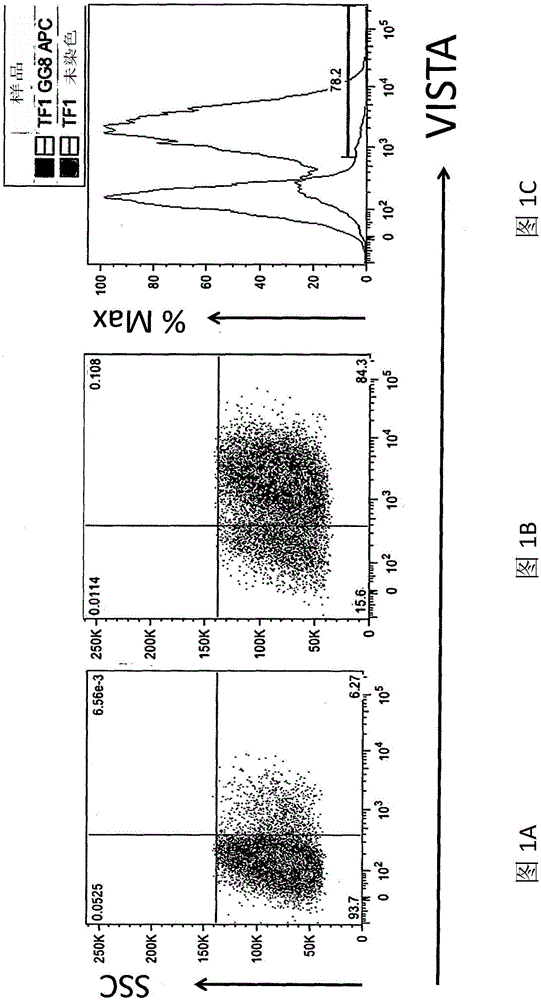
:在肿瘤微环境中,由癌细胞或免疫细胞表现免疫检查点负调节因子可抑制宿主针对肿瘤的免疫反应。为有效对抗癌症,需要阻断肿瘤介导对宿主免疫反应的抑制。因此,需要抑制肿瘤微环境中的免疫检查点负调节因子的新颖及有效治疗剂,其中该免疫检查点负调节因子抑制抗肿瘤免疫反应。技术实现要素:本发明是关于包含结合于T细胞活化的V域Ig抑制因子(VISTA)的抗原结合区的抗体及抗体片段。VISTA为不利地抑制免疫反应的检查点调节因子。参见Wang等人,「VISTA,anovelmouseIgsuperfamilyligandthatnegativelyregulatesTcellresponses,」J.Exp.Med.,208(3)577-92(2011)。其表现于正常人类嗜中性球、单核球及T细胞亚群上。此外,食蟹猕猴(cynomolgusmonkey)细胞以类似于正常人类细胞的模式表现VISTA。VISTA亦表现于癌症患者的周围血液细胞中。抗体或抗体片段结合于VISTA调节或促进免疫反应。抗体片段可包括例如Fab、F(ab')2或scFv抗体片段。抗体或抗体片段可包含抗体恒定区。抗体或抗体片段可结合于表现于造血细胞(例如骨髓细胞)及/或淋巴细胞、单核球或嗜中性球、T细胞、自然杀手(NK)细胞、自然杀手T(NKT)细胞、肿瘤细胞上及/或肿瘤微环境(TME)中的VISTA。肿瘤微环境为肿瘤的细胞环境。其可包括周围免疫细胞、纤维母细胞、血管、其他细胞、信号传导分子及胞外基质。抗体或抗体片段可包含一或多个重链互补决定区(CDR)及/或一或多个轻链CDR,其包括本文所述的任何抗VISTA抗体之一或多个CDR(例如所有三个重链CDR、所有3个轻链CDR或所有6个CDR),该等抗体包括命名为VSTB112(S2)、VSTB116(S5)、VSTB95(S16)、VSTB50(S41)、VSTB53(S43)及VSTB60(S47)的抗体。在一些具体实例中,抗体或其片段选自由以下组成的群:VSTB112、VSTB95、VSTB116、VSTB50、VSTB53及VSTB60。在一个具体实例中,抗体或片段包含本文所述的任何抗VISTA抗体之一或多个重链CDR及一或多个轻链CDR。在一些具体实例中,抗体或抗体片段可进一步包含本文所述的任何抗VISTA抗体的至少一个重链及至少一个轻链。在一些具体实例中,抗体或抗体片段包含至少一个包含重链可变区序列的重链及/或至少一个包含轻链可变区序列的轻链。在一些具体实例中,抗体包含人类架构区。在一些具体实例中,抗体为全抗体。在一些具体实例中,片段为抗VISTA结合成员。在一些具体实例中,抗体的重链CDR以SEQIDNO:1、2及3表示,且轻链CDR以SEQIDNO:4、5及6表示。在一些具体实例中,重链及轻链可变区胺基酸序列分别以SEQIDNO:7及8表示。本发明亦涵盖实质上类似于本文所述的抗体的抗VISTA抗体。举例而言,在一个具体实例中,抗体或片段包含抗体VH域,该抗体VH域包含具有实质上类似于SEQIDNO:1的胺基酸序列的VHCDR1、具有实质上类似于SEQIDNO:2的胺基酸序列的VHCDR2及具有实质上类似于SEQIDNO:3的胺基酸序列的VHCDR3,且该抗体或片段进一步包含抗体VL域,该抗体VL域包含具有实质上类似于SEQIDNO:4的胺基酸序列的VLCDR1、具有实质上类似于SEQIDNO:5的胺基酸序列的VLCDR2及具有实质上类似于SEQIDNO:6的胺基酸序列的VLCDR3。本发明亦关于竞争性抑制本文所述的抗VISTA抗体或与本文所述的抗VISTA抗体竞争结合的抗VISTA抗体。在一些具体实例中,抗VISTA抗体为结合物的一部分,例如包含本文所述的细胞毒性分子或另一试剂的结合物。此类分子为此项技术中熟知。在一些具体实例中,抗体或抗体片段为单株抗体。在一些具体实例中,抗体为嵌合、人类化或人类抗体。在一些具体实例中,抗体或抗体片段包含人类恒定区。在一些具体实例中,抗体或抗体片段对VISTA的抗原决定基有特异性,例如胺基酸序列SEQIDNO:9内。在一些具体实例中,抗体或抗体片段以至少1×10-7公升/莫耳(例如至少1×10-8公升/莫耳,例如至少1×10-9公升/莫耳)的亲和力结合于VISTA的抗原决定基。在一些具体实例中,调节免疫反应包含增加CD45+白细胞、CD4+T细胞及/或CD8+T细胞。在一些具体实例中,调节免疫反应包含提高(例如T细胞)细胞激素(例如IFNγ、IL10、TNFα、IL-17)的产生、提高T细胞反应及/或调节Foxp3表现。本发明也关于如下组成物,其包含本文所述的抗体或抗体片段(例如抗VISTA抗体)及医药学上可接受的载剂、稀释剂或赋形剂。举例而言,组成物可包含VISTA拮抗剂,该VISTA拮抗剂包含其抗体或抗体片段,该抗体或抗体片段包含结合于VISTA的抗原结合区;及疫苗(诸如病毒载体疫苗、细菌疫苗、DNA疫苗、RNA疫苗、肽疫苗)。在一些具体实例中,组成物为医药组成物,且抗体或抗体片段结合于VISTA调节或促进免疫反应。本发明亦关于治疗或预防癌症的方法,其包含投予有需要的个体(例如哺乳动物,例如人类或非人类动物)有效量的至少一种本文所述的抗体、抗体片段或组成物。在一些具体实例中,抗体或抗体片段结合于VISTA,从而调节或促进对癌症的免疫原性反应。在一些具体实例中,癌症为白血病、淋巴瘤、骨髓发育不良症候群及/或骨髓瘤。在一些具体实例中,癌症可为任何种类或类型的白血病,包括淋巴细胞性白血病或骨髓性白血病,诸如急性淋巴母细胞性白血病(ALL)、慢性淋巴细胞性白血病(CLL)、急性骨髓(骨髓性)白血病(AML)、慢性骨髓性白血病(CML)、毛细胞白血病、T细胞前淋巴细胞性白血病、大颗粒淋巴细胞性白血病或成人T细胞白血病。在一些具体实例中,淋巴瘤为组织细胞性淋巴瘤,且在一些具体实例中,癌症为多发性骨髓瘤。在一些具体实例中,癌症为实体肿瘤,例如黑色素瘤或膀胱癌。在一些实施例中,癌症为肺癌(例如非小细胞肺癌(NSCLC))。一些治疗方法进一步包含投予疫苗(诸如病毒载体疫苗、细菌疫苗、基于细胞的疫苗、DNA疫苗、RNA疫苗、肽疫苗或蛋白质疫苗)。本发明亦关于一种抑制有需要的个体中的肿瘤生长的方法,该方法包含投予本文所述的有效抗体或抗体片段或组成物。组成物、抗体或片段或其他药剂(例如疫苗)可通过任何非经肠或经肠方法(例如静脉内(IV)、皮下(SQ)或口服(PO))投予。在一些具体实例中,组成物、抗体或片段每季投予、每周投予、每两周投予一次、每三周投予一次或每四周投予一次。在一些具体实例中,在本文所述的抗体、片段及组成物之前、期间或之后共投予其他药物或治疗剂。共投予的药剂可通过与抗体、片段或组成物相同的途径或通过不同途径投予。本发明亦包括制备抗体、片段及组成物的方法,例如制备本文所述的抗体或片段的方法,其包含在制备该抗体的条件下培养宿主细胞。方法可进一步包含分离抗体。本发明亦关于包含编码抗体及片段的核苷酸序列的核酸(例如经分离核酸)、包含此类核酸的表现载体(例如其可操作地连接于启动子)及用此类表现载体转形的宿主细胞。本发明亦关于如下套组及制品,其包含有包含抗VISTA抗体的组成物及容器,且进一步包含表明组成物可用于治疗癌症的药品仿单(packageinsert)或标签。本发明亦提供一种经分离抗体或其抗体片段,其包含结合于T细胞活化的V域Ig抑制因子(VISTA)的抗原结合区,其中该抗体包含抗体VH域,该抗体VH域包含具有SEQIDNO:25的胺基酸序列的VHCDR1、具有SEQIDNO:26的胺基酸序列的VHCDR2及具有SEQIDNO:27的胺基酸序列的VHCDR3,且该抗体进一步包含抗体VL域,该抗体VL域包含具有SEQIDNO:28的胺基酸序列的VLCDR1、具有SEQIDNO:29的胺基酸序列的VLCDR2及具有SEQIDNO:30的胺基酸序列的VLCDR3。在一些具体实例中,抗体或抗体片段包含一或多个人类化或人类架构区。在特定具体实例中,抗体或抗体片段包含有包含SEQIDNO:37的抗体VH域及/或包含SEQIDNO:44的抗体VL域。在某些具体实例中,抗体包含重链恒定区(例如人类重链恒定区)及/或轻链恒定区(例如人类轻链恒定区,诸如SEQIDNO:56中所存在的轻链恒定区)。重链恒定区较佳为IgG1重链恒定区(例如SEQIDNO:61中所存在的IgG1重链恒定区)。在特定具体实例中,IgG1重链恒定区经修饰以提高抗体的蛋白酶抗性。经修饰以提高蛋白酶抗性的IgG1重链恒定区的实例为SEQIDNO:60中所存在的IgG1重链恒定区。在某些具体实例中,抗体或抗体片段包含有包含SEQIDNO:60的重链及包含SEQIDNO:56的轻链;或包含SEQIDNO:61的重链及包含SEQIDNO:56的轻链。在特定具体实例中,抗体或抗体片段表现于缺乏海藻糖基化酶的细胞(例如缺乏海藻糖基化酶的中国仓鼠卵巢(CHO)细胞)中。本发明亦关于一种组成物,其包含抗体或其抗体片段,该抗体或其抗体片段包含抗体VH域,该抗体VH域包含具有SEQIDNO:25的胺基酸序列的VHCDR1、具有SEQIDNO:26的胺基酸序列的VHCDR2及具有SEQIDNO:27的胺基酸序列的VHCDR3,且该抗体或其抗体片段进一步包含抗体VL域,该抗体VL域包含具有SEQIDNO:28的胺基酸序列的VLCDR1、具有SEQIDNO:29的胺基酸序列的VLCDR2及具有SEQIDNO:30的胺基酸序列的VLCDR3;及医药学上可接受的载剂、稀释剂或赋形剂。在另一具体实例中,本发明是关于一种治疗有需要的个体的癌症的方法,该方法包含投予个体有效量的结合于T细胞活化的V域Ig抑制因子(VISTA)的抗体或抗体片段,其中该抗体包含抗体VH域,该抗体VH域包含具有SEQIDNO:25的胺基酸序列的VHCDR1、具有SEQIDNO:26的胺基酸序列的VHCDR2及具有SEQIDNO:27的胺基酸序列的VHCDR3,且该抗体进一步包含抗体VL域,该抗体VL域包含具有SEQIDNO:28的胺基酸序列的VLCDR1、具有SEQIDNO:29的胺基酸序列的VLCDR2及具有SEQIDNO:30的胺基酸序列的VLCDR3。在特定具体实例中,癌症为肺癌。在另一具体实例中,肺癌为非小细胞肺癌(NSCLC)。在一些具体实例中,方法进一步包含投予第二癌症治疗(例如手术、化学疗法、放射疗法、生物疗法、免疫调节疗法及其组合)。本发明亦提供一种抗体或其抗体片段,其包含结合于T细胞活化的V域Ig抑制因子(VISTA)的抗原结合区,其中抗体结合于VISTA(例如人类VISTA)中的构形抗原决定基。在一些具体实例中,构形抗原决定基包含人类VISTA(SEQIDNO:46)的残基103-111(NLTLLDSGL(SEQIDNO:62))及136-146(VQTGKDAPSNC(SEQIDNO:63))或存在于该等残基内。在另一具体实例中,构形抗原决定基包含人类VISTA(SEQIDNO:46)的残基24-36(LLGPVDKGHDVTF(SEQIDNO:64))、54-65(RRPIRDLTFQDL(SEQIDNO:65))及100-102(TMR)或存在于该等残基内。在另一具体实例中,构形抗原决定基包含人类VISTA(SEQIDNO:46)的FG环中的胺基酸残基。此外,本发明是关于一种提高有需要的个体的免疫反应的方法,其包含投予个体治疗有效量的结合T细胞活化的V域Ig抑制因子(VISTA)的抗体或其抗体片段,其包含结合于VISTA的抗原结合区,从而促进对癌症的免疫反应。在特定具体实例中,免疫反应为抗肿瘤免疫反应。在另一具体实例中,本发明提供一种引发有需要的个体的生物反应的方法,其包含投予个体治疗有效量的结合T细胞活化的V域Ig抑制因子(VISTA)的抗体或其抗体片段,其包含结合于VISTA的抗原结合区,从而促进对癌症的免疫反应。生物反应的实例包括活化单核球;诱导T细胞增殖及细胞激素分泌;表现VISTA的细胞的抗体依赖性细胞介导的细胞毒性(ADCC);及表现VISTA的细胞的抗体依赖性细胞吞噬作用(ADCP)。附图说明专利或申请案文件含有至少一个彩制图式。在申请且支付必要费用后,专利局将提供具有彩色图式的本专利或专利申请公开案的复本。图1A-1C:展示TF1AML细胞上VISTA表现的曲线。在TF-1AML细胞系中展示通过流式细胞术获得的VISTA蛋白的表现。图2A-2E:鉴别人类骨髓及淋巴亚群的染色及设门策略的曲线。图3A-3G:展示来自健康正常供体的人类骨髓及淋巴亚群上VISTA的表现的曲线。图4:展示多个健康正常供体的人类骨髓及淋巴亚群上VISTA的表现的曲线。图5A-5B:展示鉴别人类单核球及巨噬细胞上VISTA的表现的染色及设门策略的曲线。图6A-6C:展示人类单核球及巨噬细胞上VISTA的表现的曲线。图7A-7E:展示鉴别人类T及NK细胞亚群上VISTA的表现的染色及设门策略的曲线。图8A-8G:展示来自健康正常供体的人类T及NK细胞亚群上VISTA的表现的曲线。图9:展示多个健康正常供体的人类T及NK细胞亚群上VISTA的表现的曲线。图10A-10D:展示鉴别人类树突状细胞亚群上VISTA的表现的染色及设门策略的曲线。图11A-11C:展示来自健康正常供体的人类树突状细胞亚群及嗜碱性球上VISTA的表现的曲线。图12:展示多个健康正常供体的人类树突状细胞亚群及嗜碱性球上VISTA的表现的曲线。图13A-13D:健康人类周围血液细胞上VISTA表现的分析。使用多色流式细胞术分析法获得的健康人类周围血液细胞上VISTA表现的特征:分析来自2个不同个体的全血样品的单核球(SSClo,CD11bhiCD14hiCD16-veCD33+veHLA-DR+veCD19-ve)(图13A)、嗜中性球(SSChiCD177+CD11bhiCD14loCD16+veCD33+veHLA-DR-veCD19-ve)(图13B)上的VISTA表现。使用Ficoll梯度分离周围血液单核细胞以分析CD4+T细胞(CD3+veCD4+ve)(图13C)及CD8+T细胞(CD3+veCD8+ve)(图13D)。图14A-14C:来自肺癌患者及健康对照供体的周围血液细胞上VISTA表现的分析。使用多色流式细胞术分析法获得肺癌患者周围血液细胞上VISTA表现的特征:展示来自一个个体的代表性FACS图(图14A)。通过Ficoll分离周围血液单核球且分析单核球(CD14+CD11b+CD33+HLADR+CD15-)(图14B)及源自骨髓的抑制因子细胞(CD14-CD11b+CD33-HLADR-CD15+CD16+)(图14C)上的VISTA表现。图15A-15C:使用多色流式细胞术分析法获得的来自患有结肠癌的患者的周围血液细胞中VISTA表现的特征:展示来自一个个体的代表性FACS图(图15A)。通过Ficoll分离周围血液单核球且分析单核球(CD14+CD11b+CD33+HLADR+CD15-)(图15B)及源自骨髓的抑制因子细胞(CD14-CD11b+CD33-HLADR-CD15+CD16+)(图15C)上的VISTA表现。图16A-16D:使用多色流式细胞术分析法获得的食蟹猕猴周围血液细胞上VISTA表现的特征:分析来自4只不同猴的全血的单核球(SSCloCD11bhiCD14hiHLA-DRhiCD16-veCD19-ve)(图16A)及嗜中性球CD11bhiCD14loHLA-DR-veCD16-veCD19-ve(图16B)上的VISTA表现。使用Ficoll梯度分离来自三只猴的周围血液单核细胞以分析CD4+T细胞(TCRα/β+veCD4+ve)(图16C)及CD8+T细胞(TCRα/β+veCD8+ve)(图16D)。图17:展示血红素细胞系中VISTARNA的绝对表现值。图18:用GFP或人类VISTA稳定转染小鼠A20细胞。将其与ova肽及DO11.10T细胞一起培育。培育开始后24小时量测T细胞的CD25表现。A20-huVISTA细胞抑制T细胞的CD25表现,但此读出结果通过与VSTB95一起培育而明显恢复。图19A-19F:展示人类VISTAELISA结果的曲线。图20A-20F:展示结合于表现人类VISTA的细胞的抗VISTA抗体的人类VISTAFACS结果。图21A-21D:混合淋巴细胞反应中30μg/ml至0.0μg/ml的6种候选抗VISTA抗体的稀释研究。图22A-22B:SEB分析(个别CPM计数及IFN-g浓度)中30μg/ml至0.0μg/ml的6种候选抗VISTA抗体的稀释研究。图23:使用涂布于ProteonSPR晶片上的抗VISTA抗体VSTB85及VISTA蛋白获得的感测器图,其中指定竞争者(表16中所列的竞争者)在晶片上经过。图24:MB49鼠膀胱肿瘤模型的实验设计。图25A-25B:雌性C57BL/6小鼠中的MB49肿瘤生长。曲线说明用抗小鼠VISTA抗体(图25B)或对照IgG(图25A)处理的个别小鼠的肿瘤生长。图26:人类VISTA的胺基酸序列(SEQIDNO:46)。图27:VISTA直系同源物的多个序列对准。图28:如由HDX所测定,与VSTB50及VSTB60抗体(上)或VSTB95及VSTB112抗体(下)结合的人类VISTA区域。图29:与VSTB112结合的VISTA抗原决定基。(上)以草图展示VISTA,并对股进行标记。将复合物中在VSTB112的内的具有至少一个原子的残基染成蓝色。蓝色及橙色球突出显示链断裂,且青色及绿色球分别标记VISTA结构的N端及C端。(下)结构测定中所用VISTA构筑体的序列。如由PISA计算,序列下的圆圈用于指示仅使主链与VSTB112接触的残基,三角形指示侧链接触,且方形指示产生氢键或盐桥相互作用的侧链接触。将形状染色以指示具有最大数目的原子与既定残基接触的CDR,其中CDR颜色如图59中所定义。次级结构要素如程式MOE所定义,其中黄色箭头代表β股且红色矩形指示α螺旋。图30:VSTB112互补位。(上)以说明方式展示VISTA抗原,且在VISTA的5埃内的VSTB112在表面中用颜色展示,用于标明以下序列中指定的CDR一致性。与CDR相邻的接触架构残基类似于VSTB112Fv区的相应CDR(下)序列染色。彩色背景指定根据Kabat定义的CDR。如由PISA计算,序列下的圆圈用于指示仅使主链与VISTA接触的残基,三角形指示侧链接触,且方形指示产生氢键或盐桥相互作用的侧链接触。图31:通过结晶学及氢氘交换(HDX)鉴别的抗原决定基区域的比较。结构测定中所用VISTA构筑体的序列。如由PISA计算,序列下的圆圈用于指示仅使主链与VSTB112接触的残基,三角形指示侧链接触,且方形指示产生氢键或盐桥相互作用的侧链接触。图32:由VSTB174(衍生自VSTB112)活化整个PBMC中的CD14+单核球。在该实验的各部分中,将细胞与PBS、IgG1对照抗体或VSTB174一起以1、0.1或0.01μg/ml培育。左图展示CD80MFI;右图展示HLA-DRMFI(经测试而展示代表性结果的两种供体)。图33:展示VSTB174针对K562-VISTA细胞的ADCC活性的曲线。图34:展示VSTB174针对K562-VISTA细胞的ADCP活性的曲线。所描绘的两种抗体具有相同Fab,但VSTB174具有IgG1Fc且VSTB140具有Fc沉默的IgG2。图35:展示由VSTB174、VSTB149或VSTB140mAb针对K562-VISTA介导的吞噬作用的曲线。以在0.0008μg/ml至0.56μg/ml范围内的7种半对数剂量测试各mAb。图36:展示由VSTB174、VSTB149或VSTB140mAb针对骨髓瘤细胞系K562细胞介导的吞噬作用的曲线。以在0.0008μg/ml至0.56μg/ml范围内的7种半对数剂量测试各mAb。图37:在雌性VISTA-KI小鼠中评估VSTB1231、5、7.5及10mg/kg的MB49肿瘤功效研究。当在植入后第6天开始给药时肿瘤体积为约50mm3。VSTB123为接枝于小鼠Fc骨架上的VSTB112Fab且结合于VISTA-KI小鼠中的人类VISTA。图38:曲线展示在13/13肺癌样品以及患者的远端肺组织及周围血液中发现表现高/中等水准VISTA的CD14+细胞。图39:使用GG8对肺癌的VISTA进行IHC染色。具体实施方式本发明的例示性具体实例的描述如下。本发明是关于命名为T细胞活化的V域免疫球蛋白抑制因子(VISTA)的新颖免疫球蛋白家族配位体(Genbank:JN602184)的抗体(Wang等人,2010,2011)。VISTA与PD-L1具有同源性,但展示限于造血隔室的独特表现模式。特定言之,VISTA组成性且高度表现于CD11bhigh骨髓细胞上,且以较低水准表现于CD4+及CD8+T细胞上。人类同源物与鼠VISTA共有约85%同源性且具有类似表现模式(Lines等人,CancerResearch74:1924,2014)。表现于抗原呈递细胞(APC)上的VISTA经由同源受体独立于PD-1地抑制CD4+及CD8+T细胞增殖及细胞激素产生。在被动EAE(实验性自体免疫性脑脊髓炎)疾病模型中,VISTA特异性单株抗体提高T细胞依赖性免疫反应且加重疾病。肿瘤细胞上的VISTA过度表现削弱了具有肿瘤的宿主的保护性抗肿瘤免疫性。人类VISTA的研究确定其对人类T细胞的抑制功能(Lines等人,CancerResearch74:1924,2014)。来自Flies等人的研究亦将VISTA(称为PD-1H)鉴别为有效免疫抑制分子(Flies等人,2011)。VISTA进一步详细描述于美国公开申请案US20130177557A1及美国专利第7,919,585号及第8,236,304号中,其全文均以引用的方式并入本文中。VISTA为抑制免疫反应的新颖检查点负调节因子。如本文实施例12中所述,在鼠肿瘤模型中用VISTA特异性单株抗体处理已展示逆转肿瘤免疫微环境的抑制特征且提高保护性抗肿瘤免疫性,因此展现VISTA单株抗体作为癌症免疫疗法的新颖治疗剂的潜力。本发明的抗体及片段术语「抗体(antibody)」意欲包括多株抗体、单株抗体(mAb)、嵌合抗体、人类化抗体、人类抗体及抗个体基因型(anti-Id)抗体以及由任何已知技术(诸如(但不限于)酶学裂解、肽合成或重组技术)提供的其片段、区域或衍生物。本发明的抗VISTA抗体能够结合VISTA的调节、调控或提高免疫反应的部分。在一些具体实例中,该等抗体竞争性抑制本文所述的抗VISTA抗体中之一或多者。测定两种或两种以上抗体是否竞争结合于同一目标的方法为此项技术中已知。举例而言,可使用竞争性结合分析判定一种抗体是否阻断另一抗体与目标的结合。典型地,竞争性结合分析包括使用结合于固体基板或细胞的经纯化目标抗原(例如PD-1)、未标记的测试结合分子及经标记的参考结合分子。竞争性抑制通过测定在测试结合分子存在下结合于固体表面或细胞的标记物的量来量测。通常测试结合分子过量存在。典型地,当竞争性结合分子过量存在时,其将使参考结合分子与共同抗原的特异性结合抑制至少50-55%、55-60%、60-65%、65-70%、70-75%或75%以上。在一些具体实例中,竞争性抑制使用竞争性抑制ELISA分析测定。多株抗体为衍生自用抗原免疫的动物的血清的抗体分子的异质群。单株抗体含有特异性抗原的抗体的实质上均质群,该群含有实质上类似抗原决定基结合位点。单株抗体可通过熟习此项技术者已知的方法获得。参见例如Kohler及Milstein,Nature,256:495-497(1975);美国专利第4,376,110号;Ausubel等人编,CurrentProtocolsinMolecularBiology,GreenePublishingAssoc.andWileyInterscience,N.Y.,(1987,1992);及Harlow及LaneANTIBODIES:ALaboratoryManualColdSpringHarborLaboratory(1988);Colligan等人编,CurrentProtocolsinImmunology,GreenePublishingAssoc.andWileyInterscience,N.Y.,(1992,1993),其中所有者的内容以全文引用的方式并入本文中。此类抗体可具有任何免疫球蛋白类别,包括IgG、IgM、IgE、IgA、GILD及其任何子类。产生本发明单株抗体的融合瘤可在试管内、当场或活体内培养。本发明亦涵盖消化片段、其指定部分及变体,包括抗体模拟物或包含模拟抗体或其指定片段或部分的结构及/或功能的抗体部分,包括单链抗体及其片段。功能性片段包括结合于哺乳动物VISTA蛋白的抗原结合片段。举例而言,本发明涵盖能够结合于VISTA的抗体片段或其部分,包括(但不限于)Fab(例如藉由木瓜蛋白酶消化)、Fab'(例如藉由胃蛋白酶消化及部分还原)及F(ab')2(例如藉由胃蛋白酶消化)、facb(例如藉由纤维蛋白溶酶消化)、pFc'(例如藉由胃蛋白酶或纤维蛋白溶酶消化)、Fd(例如藉由胃蛋白酶消化、部分还原及再凝集)、Fv或scFv(例如通过分子生物学技术)片段。本发明的抗体片段亦包括AaronL.Nelson,mAbs2:1,77-83(2010年1月/2月)中所述的抗体片段,其内容以全文引用的方式并入。此类片段可例如通过此项技术中已知及/或如本文所述的酶学裂解、合成或重组技术制备。抗体亦可使用一或多个终止密码子已引入天然终止位点的上游的抗体基因以多种截短形式制备。抗体的各种部分可通过习知技术以化学方式接合在一起,或可使用遗传工程改造技术制备成邻接蛋白质。在一个具体实例中,免疫球蛋白链或其部分(例如可变区,CDR)的胺基酸序列与本文所述的相应可变序列链的胺基酸序列具有约70-100%一致性(例如70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100或其中任何范围或值)。较佳地,使用此项技术中已知的适合电脑算法测定70-100%胺基酸一致性(例如85、89、90、91、92、93、94、95、96、97、98、99、100或其中任何范围或值)。本文提供重链及轻链可变区序列的实例。本发明的抗体或变体指定变体可包含来自本发明抗体的任何数目的邻接胺基酸残基,其中该数目是选自由抗TNF抗体中邻接残基数的10-100%组成的整数的群。视情况,此邻接胺基酸的子序列的长度为至少约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250个或250个以上胺基酸或其中任何范围或值。此外,此类子序列的数目可为选自由1至20组成的群的任何整数,诸如至少2、3、4或5。熟习此项技术者应了解,本发明包括本发明的至少一种生物学活性抗体。生物学活性抗体的特定活性为天然(非合成)、内源或相关及已知抗体的至少20%、30%或40%,且较佳至少50%、60%或70%,且最佳至少80%、90%或95%-100%。分析及量化酶活性及受质特异性的量测值的方法为熟习此项技术者所熟知。实质上类似指化合物与天然(非合成)、内源或相关及已知抗体具有至少85%(例如至少95%)一致性,且具有其活性的至少85%(例如至少95%)。如本文所用的术语「人类抗体(humanantibody)」指如下抗体,其中实质上蛋白质的各部分(例如CDR、架构、CL、CH域(例如CH1、CH2、CH3)、铰链(VL、VH))在人类中实质上具有非免疫原性,其中仅少量序列改变或变化。类似地,指定为灵长类(猴、狒狒、黑猩猩及其类似物)、啮齿动物(小鼠、大鼠及其类似物)及其他哺乳动物的抗体指此类物种、次属、属、次科、科特异性抗体。此外,嵌合抗体可包括以上的任何组合。此类改变或变化视情况且较佳相对于未修饰抗体保留或降低在人类或其他物种中的免疫原性。因此,人类抗体不同于嵌合或人类化抗体。据指出,人类抗体可由能够功能上表现重排人类免疫球蛋白(例如重链及/或轻链)基因的非人类动物或原核或真核细胞制备。此外,当人类抗体为单链抗体时,其可包含天然人类抗体中不存在的连接肽。举例而言,Fv可包含连接肽,诸如二至约八个甘胺酸或其他胺基酸残基,其连接重链的可变区及轻链的可变区。认为此类连接肽具有人类来源。亦可使用双特异性、异特异性、异结合或类似抗体,其为对至少两种不同抗原具有结合特异性的单株、较佳人类或人类化抗体。在本发明情形下,结合特异性中的一者针对至少一种VISTA蛋白,另一者针对任何其他抗原。用于制备双特异性抗体的方法为此项技术中已知。双特异性抗体的重组型制备可基于两个免疫球蛋白重链-轻链对之共表现,其中两个重链具有不同特异性(MilsteinandCuello,Nature305:537(1983))。亦参见WO93/08829;美国专利第6,210,668号、第6,193,967号、第6,132,992号、第6,106,833号、第6,060,285号、第6,037,453号、第6,010,902号、第5,989,530号、第5,959,084号、第5,959,083号、第5,932,448号、第5,833,985号、第5,821,333号、第5,807,706号、第5,643,759号、第5,601,819号、第5,582,996号、第5,496,549号、第4,676,980、WO91/00360、WO92/00373、EP03089;Traunecker等人,EMBOJ.10:3655(1991);Suresh等人,MethodsinEnzymology121:210(1986),其各以全文引用的方式并入本文中。在一个具体实例中,本发明是关于一种以VISTA及第二目标蛋白(例如免疫检查点蛋白)为目标的双特异性抗体。例示性双特异性抗体包括以VISTA及PD-L1为目标的双特异性抗体及以VISTA及PD-L2为目标的双特异性抗体。对人类VISTA蛋白有特异性的人类抗体或其片段可针对适当免疫原性抗原(诸如VISTA蛋白或其部分(包括合成分子,诸如合成肽))来培养。可类似地培养其他特异性或通用哺乳动物抗体。免疫原性抗原制备及单株抗体制备可使用任何适合技术进行。举例而言,融合瘤通过融合适合永生细胞系(例如骨髓瘤细胞系,诸如(但不限于)Sp2/0、Sp2/0-AG14、NSO、NS1、NS2、AE-1、L.5、>243、P3X63Ag8.653、Sp2SA3、Sp2MAI、Sp2SS1、Sp2SA5、U937、MLA144、ACTIV、MOLT4、DA-1、JURKAT、WEHI、K-562、COS、RAJI、NIH3T3、HL-60、MLA144、NAMAIWA、NEURO2A或其类似物,或杂合骨髓瘤、其融合产物或自其衍生的任何细胞或融合细胞,或此项技术中已知的任何其他适合细胞系,参见例如www.atcc.org)与抗体产生细胞来制备。抗体产生细胞可包括经分离或选殖的脾、周围血液、淋巴、扁桃体或其他免疫细胞(例如B细胞)或表现重链或轻链恒定或可变或架构或互补决定区(CDR)序列的任何其他细胞。此类抗体产生细胞可为重组或内源细胞,且亦可为原核或真核细胞(例如哺乳动物哺乳动物诸如啮齿动物、马、绵羊、山羊、羊、灵长类)。参见例如以上Ausubel及以上Colligan,Immunology,第2章,其以全文引用的方式并入本文中。抗体产生细胞亦可获自已用相关抗原免疫的人类或其他适合动物的周围血液或较佳脾或淋巴结。任何其他适合宿主细胞亦可用于表现编码本发明的抗体、其指定片段或变体的异质或内源性核酸。融合细胞(融合瘤)或重组细胞可使用选择性培养条件或其他适合已知方法分离且通过限制稀释法或细胞分选或其他已知方法选殖。产生具有所要特异性的抗体的细胞可通过适合分析(例如酶联免疫吸附分析(ELISA))选择。如此项技术中已知及/或如本文所述,可使用制备或分离具有必需特异性的抗体的其他适合方法,包括(但不限于)自肽或蛋白质文库(例如(但不限于)噬菌体、核糖体、寡核苷酸、RNA、cDNA或其类似物、呈现文库;例如购自CambridgeantibodyTechnologies,Cambridgeshire,UK;MorphoSys,Martinsreid/Planegg,DE;Biovation,Aberdeen,Scotland,UK;Bioinvent,Lund,Sweden;DyaxCorp.,Enzon,Affymax/Biosite;Xoma,Berkeley,Calif.;Ixsys。参见例如PCT/GB91/01134;PCT/GB92/01755;PCT/GB92/002240;PCT/GB92/00883;PCT/GB93/00605;PCT/GB94/01422;PCT/GB94/02662;PCT/GB97/01835;WO90/14443;WO90/14424;WO90/14430;PCT/U594/1234;WO92/18619;WO96/07754;EP614989;WO95/16027;WO88/06630;WO90/3809;美国专利第4,704,692号;PCT/US91/02989;WO89/06283;EP371998;EP550400;EP229046;PCT/US91/07149;或随机产生的肽或蛋白质--美国专利第5,723,323号;第5,763,192号;第5,814,476号;第5,817,483号;第5,824,514号;第5,976,862号;WO86/05803、EP590689,其各以全文引用的方式并入本文中)选择重组抗体或依赖于使能够产生人类抗体的谱系的转基因动物(例如SCID小鼠,Nguyen等人,Microbiol.Immunol.41:901-907(1997);Sandhu等人,Crit.Rev.Biotechnol.16:95-118(1996);Eren等人,Immunol.93:154-161(1998),其以及相关专利及申请案各以全文引用的方式并入本文中)免疫的方法。此类技术包括(但不限于)核糖体呈现(Hanes等人,Proc.Natl.Acad.Sci.USA,94:4937-4942(1997年5月);Hanes等人,Proc.Natl.Acad.Sci.USA,95:14130-14135(1998年11月));单细胞抗体制备技术(美国专利第5,627,052号,Wen等人,J.Immunol.17:887-892(1987);Babcook等人,Proc.Natl.Acad.Sci.USA93:7843-7848(1996));凝胶微滴及流式细胞术(Powell等人,Biotechnol.8:333-337(1990);OneCellSystems,Cambridge,Mass.;Gray等人,J.Imm.Meth.182:155-163(1995);Kenny等人,Bio/Technol.13:787-790(1995));B细胞选择(Steenbakkers等人,Molec.Biol.Reports19:125-134(1994);Jonak等人,ProgressBiotech,第5卷,InVitroImmunizationinHybridomaTechnology,Borrebaeck编,ElsevierSciencePublishersB.V.,Amsterdam,Netherlands(1988))。亦可使用工程改造或人类化非人类或人类抗体的方法且为此项技术中所熟知。一般而言,人类化或工程改造抗体具有一或多个来自非人类来源(例如(但不限于)小鼠、大鼠、兔、非人类灵长类或其他哺乳动物)的胺基酸残基。此等人类胺基酸残基通常称为「导入(import)」残基,其典型地取自已知人类序列的「导入」可变、恒定或其他域。揭示已知人类Ig序列,例如www.ncbi.nlm.nih.gov/entrez/query.fcgi;www.atcc.org/phage/hdb.html,其各以全文引用的方式并入本文中。如此项技术中已知,此类导入序列可用于降低免疫原性或降低、提高或改变结合、亲和力、亲合力、特异性、半衰期或任何其他适合特征。一般而言,维持部分或所有非人类或人类CDR序列,而用人类或其他胺基酸置换部分或所有架构及/或恒定区的非人类序列。亦可视情况使用熟习此项技术者已知的三维免疫球蛋白模型将抗体人类化,而保持对抗原的高亲和力及其他有利生物特性。可利用说明且呈现所选候选免疫球蛋白序列的可能三维构形结构的电脑程式。检测此等呈现使得可分析残基在候选免疫球蛋白序列的功能中的可能性作用,亦即分析影响候选免疫球蛋白结合其抗原的能力的残基。以此方式,可自共同及导入序列选择架构(FR)残基且组合以使得达成所要抗体特征(诸如对目标抗原的亲和力增加)。一般而言,CDR残基直接且最实质上参与影响抗原结合。人类化或工程改造本发明的抗体可使用任何已知方法进行,诸如(但不限于)以下文献中所述的方法,例如Winter(Jones等人,Nature321:522(1986);Riechmann等人,Nature332:323(1988);Verhoeyen等人,Science239:1534(1988));Sims等人,J.Immunol.151:2296(1993);Chothia及Lesk,J.Mol.Biol.196:901(1987);Carter等人,Proc.Natl.Acad.Sci.U.S.A.89:4285(1992);Presta等人,J.Immunol.151:2623(1993);美国专利第5,723,323号、第5,976862号、第5,824514号、第5,817483号、第5,814476号、第5,763,192号、第5,723,323号、第5,766,886号、第5,714,352号、第6,204,023号、第6,180,370号、第5,693,762号、第5,530,101号、第5,585,089号、第5,225,539号;第4,816,567号,其各以全文引用的方式并入本文中,包括其中所引用的参考文献。如本文所述及/或此项技术中已知,抗VISTA抗体亦可视情况通过使能够产生人类抗体的谱系的转基因动物(例如小鼠、大鼠、兔、仓鼠、非人类灵长类及其类似物)免疫来产生。产生人类抗VISTA抗体的细胞可自此类动物分离且使用适合方法(诸如本文所述的方法)不朽化。可产生结合于人类抗原的人类抗体的谱系的转基因动物可通过已知方法制备(例如(但不限于)颁予Lonberg等人的美国专利第5,770,428号、第5,569,825号、第5,545,806号、第5,625,126号、第5,625,825号、第5,633,425号、第5,661,016号及第5,789,650号;Jakobovits等人WO98/50433、Jakobovits等人WO98/24893、Lonberg等人WO98/24884、Lonberg等人WO97/13852、Lonberg等人WO94/25585、Kucherlapate等人WO96/34096、Kucherlapate等人EP0463151B1、Kucherlapate等人EP0710719A1、Surani等人美国专利第5,545,807号、Bruggemann等人WO90/04036、Bruggemann等人EP0438474B1、Lonberg等人EP0814259A2、Lonberg等人GB2272440A、Lonberg等人Nature368:856-859(1994)、Taylor等人,Int.Immunol.6(4)579-591(1994)、Green等人,NatureGenetics7:13-21(1994)、Mendez等人,NatureGenetics15:146-156(1997)、Taylor等人,NucleicAcidsResearch20(23):6287-6295(1992)、Tuaillon等人,ProcNatlAcadSciUSA90(8)3720-3724(1993)、Lonberg等人,IntRevImmunol13(1):65-93(1995)及Fishwald等人,NatBiotechnol14(7):845-851(1996),其各以全文引用的方式并入本文中)。一般而言,此等小鼠包含至少一种包含来自至少一种人类免疫球蛋白基因座的DNA的转基因,其在功能上重排或可进行功能性重排。此类小鼠中内源免疫球蛋白基因座可经破坏或缺失以去除动物产生由内源基因编码的抗体的能力。筛选特异性结合于类似蛋白质的抗体或片段可使用肽呈现文库便利地达成。此方法包括针对具有所要功能或结构的个别成员筛选大量肽。肽呈现文库的抗体筛选为此项技术中所熟知。所呈现的肽序列的长度可为3至5000个或5000个以上胺基酸,通常为5-100个胺基酸长,且通常为约8至25个胺基酸长。除用于产生肽文库的直接化学合成方法以外,已描述数种重组DNA方法。一种类型包括在噬菌体或细胞的表面上呈现肽序列。各噬菌体或细胞含有编码所呈现的特定肽序列的核苷酸序列。此类方法描述于PCT专利公开案第91/17271号、第91/18980号、第91/19818号及第93/08278号中。用于产生肽的文库的其他系统具有试管内化学合成与重组方法的态样。参见PCT专利公开案第92/05258号、第92/14843号及第96/19256号。亦参见美国专利第5,658,754号;及第5,643,768号。肽呈现文库、载体及筛选套组可购自诸如Invitrogen(Carlsbad,Calif.)及CambridgeantibodyTechnologies(Cambridgeshire,UK)的供应商。参见例如颁予Dyax美国专利第4,704,692号、第4,939,666号、第4,946,778号、第5,260,203号、第5,455,030号、第5,518,889号、第5,534,621号、第5,656,730号、第5,763,733号、第5,767,260号、第5,856,456号;第5,223,409号、第5,403,484号、第5,571,698号、第5,837,500号,颁予CambridgeantibodyTechnologies第5,427,908号、第5,580,717号;第5,885,793号;颁予Genentech第5,750,373号,第5,618,920号、第5,595,898号、第5,576,195号、第5,698,435号、第5,693,493号及第5,698,417号。本发明的抗体亦可使用至少一种编码抗VISTA抗体的核酸制备,得到转基因动物(诸如山羊、母牛、羊及其类似物),其在乳汁中产生此类抗体。可使用已知方法提供此类动物。参见例如(但不限于)美国专利第5,827,690号;第5,849,992号;第4,873,316号;第5,849,992号;第5,994,616号;第5,565,362号;第5,304,489号及其类似专利,其各以全文引用的方式并入本文中。本发明的抗VISTA抗体亦可根据已知方法使用转基因植物制备。亦参见例如Fischer等人,Biotechnol.Appl.Biochem.30:99-108(1999年10月)、Cramer等人,Curr.Top.Microbol.Immunol.240:95-118(1999)及其中所引用的参考文献;Ma等人,TrendsBiotechnol.13:522-7(1995);Ma等人,PlantPhysiol.109:341-6(1995);Whitelam等人,Biochem.Soc.Trans.22:940-944(1994);及其中所引用的参考文献。以上参考文献各以全文引用的方式并入本文中。本发明的抗体可以大范围的亲和力(KD)结合人类VISTA。在较佳具体实例中,本发明的至少一种人类单株抗体可视情况以高亲和力结合人类VISTA。举例而言,人类单株抗体可以等于或低于约10-7M的KD(诸如(但不限于)0.1-9.9(或其中任何范围或值)×10-7、10-8、10-9、10-10、10-11、10-12、10-13或其中任何范围或值)结合人类VISTA。在一些具体实例中,抗体或抗体片段可以1×10-7公升/莫耳(例如至少1×10-8公升/莫耳,例如至少1×10-9公升/莫耳)的亲和力结合人类VISTA。抗体对抗原的亲和力或亲合力可使用任何适合方法进行实验测定。(参见例如Berzofsky等人,「Antibody-AntigenInteractions,」FundamentalImmunology,Paul,W.E.编,RavenPress:NewYork,N.Y.(1984);Kuby,JanisImmunology,W.H.FreemanandCompany:NewYork,N.Y.(1992);及本文所述的方法)。若在不同条件(例如盐浓度、pH)下量测,则所量测的特定抗体-抗原相互作用的亲和力可变化。因此,量测亲和力及其他抗原结合参数(KD、Ka、Kd)较佳用抗体及抗原的标准化溶液及标准化缓冲液进行。核酸分子使用本文所提供的资讯,诸如编码指定片段、其变体或共同序列中的至少一者的邻接胺基酸的至少70-100%的核苷酸序列或包含此等序列中的至少一者的所寄存载体,可使用本文所述或此项技术中已知的方法获得编码至少一种抗VISTA抗体的本发明核酸分子,该抗VISTA抗体包含SEQIDNO:1、2及3的重链可变CDR区的全部及/或SEQIDNO:4、5及6的轻链可变CDR区的全部。本发明的核酸分子可为通过选殖或以合成方法制备而获得的RNA(诸如mRNA、hnRNA、tRNA或任何其他形式)形式或DNA(包括(但不限于)cDNA及基因组DNA)形式。DNA可为三股、双股或单股或其任何组合。DNA或RNA的至少一个股的任何部分可为编码股,亦称为有义股,或其可为非编码股,亦称为反义股。本发明的经分离核酸分子可包括包含开放阅读框架(ORF)的核酸分子,开放阅读框架例如(但不限于)至少一种CDR的至少一个指定部分,如至少一个重链或轻链的CDR1、CDR2及/或CDR3;包含抗VISTA抗体或片段(例如包含可变区的片段)的编码序列的核酸分子;及包含不同于上述的核苷酸序列但由于遗传密码的简并性仍编码至少一种如本文所述及/或此项技术中已知的抗VISTA抗体的核酸分子。熟习此项技术者产生编码本发明的特定抗VISTA抗体的此类简并核酸变体为常规的。参见例如以上Ausubel等人,且此类核酸变体包括于本发明中。如本文所表明,包含编码抗VISTA抗体的核酸的本发明核酸分子可包括(但不限于)编码抗体片段的胺基酸序列的核酸分子;整个抗体或其部分的编码序列;抗体、片段或部分的编码序列以及其他序列,诸如在存在或不存在上述其他编码序列下至少一种信号前导序列或融合肽的编码序列,诸如至少一种内含子,以及其他非编码序列,包括(但不限于)非编码5'及3'序列,诸如在转录、mRNA加工(包括拼接)及聚腺苷酸化信号(例如--mRNA的核糖体结合及稳定性)中起作用的经转录未转译序列;编码其他胺基酸的其他编码序列,诸如提供其他功能的编码序列。因此,编码抗体的序列可与标记序列(诸如编码有助于纯化包含抗体片段或部分的融合抗体的肽的序列)融合。编码本发明的抗体、片段及区域的恒定(C)区的人类基因可通过已知方法衍生自人类胎儿肝脏文库。人类C区基因可衍生自任何人类细胞,包括表现且产生人类免疫球蛋白的人类细胞。人类CH区可衍生自人类H链的任何已知类别或同型,包括γ、μ、α、δ或ε且其次型,诸如G1、G2、G3及G4。因为H链同型负责抗体的各种效应功能,故CH区的选择将由所要效应功能(诸如补体固定)或抗体依赖性细胞毒性(ADCC)中的活性引导。组成物本文所揭示的医药组成物根据标准程序制备且以经选择以治疗(例如减轻、预防或去除所治疗病状或减缓或中断其进展)的剂量投予(参见例如Remington'sPharmaceuticalSciences,MackPublishingCompany,Easton,PA及GoodmanandGilman'sThePharmaceuticalBasisofTherapeutics,McGraw-Hill,NewYork,N.Y.,其内容以引用的方式并入本文中以用于投予各种药剂进行人类治疗的方法的一般描述)。包含所揭示的抗体及药剂的组成物可使用控制或持续释放传递系统(例如胶囊、可生物降解基质)传递。适用于投予所揭示化合物的用于药物传递的延缓释放传递系统的实例描述于例如美国专利第US5,990,092号;第5,039,660号;第4,452,775号;第3,854,480号中,其整个教示以引用的方式并入本文中。为自本发明的抗VISTA抗体及/或片段制备医药组成物,医药学上可接受的载剂可为固体或液体。固体形式制剂包括粉末、锭剂、丸剂、胶囊、扁囊剂、栓剂及分散性颗粒。举例而言,本发明化合物可为粉末形式以用于在传递时复原。固体载剂可为一或多种物质,其亦可充当稀释剂、调味剂、增溶剂、润滑剂、悬浮剂、粘合剂、防腐剂、锭剂崩解剂或囊封材料。在呈粉末形式时,载剂为细粉状固体,其与细粉状活性成分形成混合物。粉末及锭剂较佳含有约1至约70%活性成分。适合载剂为碳酸镁、硬脂酸镁、滑石、糖、乳糖、果胶、糊精、淀粉、明胶、黄蓍、甲基纤维素、羧甲基纤维素钠、低熔点蜡、可可油及其类似物。锭剂、粉末、扁胶剂、口含锭、速熔条(fast-meltstrip)、胶囊及丸剂可用作适用于经口投予的含有活性成分的固体剂型。液体形式制剂包括溶液、悬浮液、保留灌肠剂及乳液,例如水或丙二醇水溶液。为进行非经肠注射,液体制剂可在聚乙二醇水溶液中调配。医药组成物可为单位剂型。在此类形式中,组成物再分为含有适量活性成分的单位剂量。单位剂型可为封装制剂,该封装含有个别量的单位剂量。剂量可视患者的要求、所治疗病状的严重性、所用化合物及投药路径而变化。测定针对特定情况的适当剂量在此项技术的技能范围内。此外,必要时,医药组成物可含有其他相容药剂,例如药物、治疗剂或预防剂。治疗剂或预防剂包括(但不限于)肽、多肽、蛋白质、融合蛋白、核酸分子、小分子、模拟剂、合成药物、无机分子及有机分子。此类药剂(例如抗癌剂)的类别的实例包括(但不限于)细胞毒素、血管生成抑制剂、免疫调节剂、肿瘤免疫剂及用于缓解疼痛或抵消一或多种治疗剂的有毒作用的药剂(例如使用降低糖皮质激素的高血钙作用的双膦酸盐)。适用于本文所述的组成物及方法的血管生成抑制剂、药剂及疗法包括(但不限于)血管生长抑素(纤维蛋白溶酶原片段);抗血管生成抗凝血酶III;安吉酶(angiozyme)。双膦酸盐包括(但不限于)阿仑膦酸盐(alendronate)、氯屈膦酸盐(clodronate)、依替膦酸盐(etidronate)、伊班膦酸盐(ibandronate)、帕米膦酸盐(pamidronate)、利塞膦酸盐(risedronate)、替鲁膦酸盐(tiludronate)及唑来膦酸盐(zoledronate)。适用于本文所述的组成物及方法的免疫调节剂及疗法包括(但不限于)抗T细胞受体抗体,诸如抗CD3抗体(例如诺维(Nuvion)(ProteinDesign实验室)、OKT3(Johnson&Johnson)或抗CD20抗体美罗华(Rituxan)(IDEC))、抗CD52抗体(例如坎帕斯1H(CAMPATH1H)(Ilex))、抗CD11a抗体(例如西利姆(Xanelim)(Genentech));抗细胞激素或抗细胞激素受体抗体及拮抗剂,诸如抗IL-2受体抗体(赛尼哌(Zenapax)(ProteinDesign实验室))、抗IL-6受体抗体(例如MRA(Chugai))及抗IL-12抗体(CNTO1275(Janssen))、抗TNFα抗体(雷米卡德(Remicade)(Janssen))或TNF受体拮抗剂(恩博(Enbrel)(Immunex))、抗IL-6抗体(BE8(Diaclone))及思图昔单抗(siltuximab)(CNTO32(Centocor))及免疫特异性结合于肿瘤相关抗原的抗体(例如曲妥珠单抗(trastuzimab)(Genentech))。适用于本文所述的组成物及方法的肿瘤免疫剂包括(但不限于)伊派利单抗(ipilimumab)(抗CTLA-4)、尼沃单抗(nivolumab)(抗-PD-1)、派立珠单抗(pembrolizumab)(抗-PD-1)、抗PD-L1抗体及抗LAG-3抗体。组成物较佳以含有治疗有效量的抗体或片段的剂量单位形式制备。剂量单位的实例为锭剂及胶囊。出于治疗目的,除活性成分之外,锭剂和胶囊可含有习知载剂,诸如结合剂,例如阿拉伯树胶、明胶、聚乙烯吡咯啶酮、山梨糖醇或黄蓍;填充剂,例如磷酸钙、甘胺酸、乳糖、玉米淀粉、山梨糖醇或蔗糖;润滑剂,例如硬脂酸镁、聚乙二醇、二氧化硅或滑石;崩解剂,例如马铃薯淀粉;调味剂或着色剂;或可接受的润湿剂。通常呈水溶液或油溶液、悬浮液、乳液、糖浆或酏剂形式的口服液体制剂可含有习知添加剂,诸如悬浮剂、乳化剂、非水性剂、防腐剂、着色剂及调味剂。液体制剂的添加剂的实例包括阿拉伯胶、杏仁油、乙醇、经部分分离的椰子油、明胶、葡萄糖浆、甘油、氢化食用脂肪、卵磷脂、甲基纤维素、对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、丙二醇、山梨糖醇或山梨酸。关于制备及使用本文所述的化合物及组成物的方法的其他一般细节为此项技术中熟知。参见例如美国专利第7,820,169号,其全部内容并入本文中。治疗方法熟习此项技术者(例如临床医师)可考虑所选药剂、医药调配物及投药路径、各种患者因素及其他考虑因素来确定投予特定抗体、片段或组成物的适合剂量及路径以向个体投予。剂量较佳不会引起或产生最少或不产生不良副作用。在标准多重给药方案中,药理学药剂可以经设计以在进行治疗的个体中维持预定或最佳血浆浓度的剂量时程投予。抗体、片段及组成物可以任何适当剂量范围或治疗有效量添加,例如0.1mg/kg、0.2mg/kg、0.3mg/kg、0.4mg/kg、0.5mg/kg、0.6mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.5mg/kg、2.0mg/kg、2.5mg/kg、3.0mg/kg、4.0mg/kg、5.0mg/kg、6.0mg/kg、7.0mg/kg、8.0mg/kg、9.0mg/kg、10.0mg/kg、11.0mg/kg、12.0mg/kg、13.0mg/kg、14.0mg/kg、15.0mg/kg、16.0mg/kg、17.0mg/kg、18.0mg/kg、19.0mg/kg、20.0mg/kg、30mg/kg、40mg/kg、50mg/kg60mg/kg、70mg/kg、80mg/kg、90mg/kg及100mg/kg。在一个具体实例中,所投予组成物、抗体或片段的剂量为每次投予0.1-15mg/kg。抗体或片段可每天投予一次、至少一次、两次、至少两次、三次或至少三次。抗体或片段可每周投予一次、至少一次、两次、至少两次、三次、至少三次、四次、至少四次、五次、至少五次、六次或至少六次。抗体或片段可每个月投予一次、每个月至少一次、每个月两次、每个月至少两次、每个月三次或每个月至少三次。抗体或抗体片段可每年投予一次、每年至少一次、每年两次、每年至少两次、每年三次、每年至少三次、每年四次、每年至少四次、每年五次、每年至少五次、每年六次或每年至少六次。抗VISTA抗体、片段及组成物可例如经由非经肠或经肠方法投予,包括(但不限于)静脉内、皮下、经口、经直肠、肌肉内、腹膜内、经粘膜、经皮、鞘内、经鼻或表面投予。一般技术者应认识到以下剂型可包含化合物或本发明化合物的相应医药学上可接受的盐作为活性成分。在一些具体实例中,剂型可包含化合物或化合物的相应医药学上可接受的盐作为活性成分。本发明的抗VISTA抗体可作为组合疗法的一部分投予(例如彼此一起投予或与一或多种其他治疗剂一起投予)。本发明化合物可以在一种或多种其他治疗剂之前、之后或同时投予。在一些具体实例中,本发明化合物及其他治疗剂可以各别调配物或结合调配物形式同时(例如同步)共投予。或者,药剂可以各别组成物形式在熟练临床医师确定的适当时间范围(例如足以使疗法的药物作用重迭的时间)内依序投予。本发明化合物及一或多种其他治疗剂可以单次剂量或多次剂量以适合于达成所要治疗作用的次序及时程投予。本发明亦提供一种调节或治疗细胞、组织、器官、动物或患者的至少一种恶性疾病的方法。在一些具体实例中,本发明的化合物及组成物用于治疗或预防癌症。癌症可包括任何器官或身体系统的任何恶性或良性肿瘤。实例包括(但不限于)以下:乳癌、消化道癌、肠胃癌、内分泌癌、神经内分泌癌、眼癌、泌尿生殖癌、生殖细胞癌、妇科癌、头颈癌、血液/血癌、肌肉骨胳癌、神经癌、呼吸道/胸癌、膀胱癌、结肠癌、直肠癌、肺癌、子宫内膜癌、肾脏癌、胰脏癌、肝癌、胃癌、睾丸癌、食道癌、前列腺癌、脑癌、子宫颈癌、卵巢癌及甲状腺癌。其他癌症可包括白血病、黑色素瘤及淋巴瘤及本文所述的任何癌症。在一些具体实例中,实体肿瘤以骨髓及/或T细胞浸润。在一些具体实例中,癌症为白血病、淋巴瘤、骨髓发育不良症候群及/或骨髓瘤。在一些具体实例中,癌症可为任何种类或类型的白血病,包括淋巴细胞性白血病或骨髓性白血病,诸如急性淋巴母细胞性白血病(ALL)、慢性淋巴细胞性白血病(CLL)、急性骨髓(骨髓性)白血病(AML)、慢性骨髓性白血病(CML)、毛细胞白血病、T细胞前淋巴细胞性白血病、大颗粒淋巴细胞性白血病或成人T细胞白血病。在一些具体实例中,淋巴瘤为组织细胞性淋巴瘤、滤泡性淋巴瘤或霍奇金氏淋巴瘤(Hodgkinlymphoma),且在一些具体实例中,癌症为多发性骨髓瘤。在一些具体实例中,癌症为实体肿瘤,例如黑色素瘤或膀胱癌。在一个实施例中,癌症为肺癌,例如非小细胞肺癌(NSCLC)。本发明亦提供一种调节或治疗细胞、组织、器官、动物或患者的至少一种恶性疾病的方法,包括(但不限于)以下中的至少一者:白血病、急性白血病、急性淋巴母细胞性白血病(ALL)、B细胞、T细胞或FABALL、急性骨髓性白血病(AML)、慢性骨髓细胞性白血病(CML)、慢性淋巴细胞性白血病(CLL)、毛细胞白血病、骨髓发育不良症候群(MDS)、淋巴瘤、霍奇金氏病(Hodgkin'sdisease)、恶性淋巴瘤、非霍奇金氏淋巴瘤(non-hodgkin'slymphoma)、伯基特氏淋巴瘤(Burkitt'slymphoma)、多发性骨髓瘤、卡波西氏肉瘤(Kaposi'ssarcoma)、结肠直肠癌、胰腺癌、鼻咽癌、恶性组织细胞增多病、副肿瘤症候群/恶性血钙过多、实体肿瘤、腺癌、肉瘤、恶性黑色素瘤、血管瘤、转移性疾病、癌症相关骨胳再吸收、癌症相关骨痛及其类似疾病。在一些具体实例中,实体肿瘤以骨髓及/或T细胞浸润。在一特定具体实例中,实体肿瘤为肺癌,诸如非小细胞肺癌(NSCLC)。在一些具体实例中,本文所述的化合物及疗法与疫苗(诸如病毒载体疫苗、细菌疫苗、基于细胞的疫苗、DNA疫苗、RNA疫苗、肽疫苗或蛋白质疫苗)一起共投予。此类疫苗为此项技术中所熟知。参见例如JeffreySchlom,「TherapeuticCancerVaccines:CurrentStatusandMovingForward,」JNatlCancerInst;104:599-613(2012),其内容全部并入本文中。在一些具体实例中,本文所述的化合物及疗法与用于化学疗法、激素疗法及生物疗法的药剂及/或双膦酸盐一起共投予。在一些具体实例中,用于化学疗法的药剂包括以下中之一或多者:卡铂(arboplatin)(铂尔定(Paraplatin))、顺铂(cisplatin)(普拉迪诺(Platinol)、普拉迪诺-AQ)、环磷酰胺(赛特杉(Cytoxan)、尼欧萨(Neosar))、小红莓(doxorubicin)(阿德力霉素(Adriamycin))、依托泊苷(etoposide)(维派德(VePesid))、氟尿嘧啶(5-FU)、吉西他滨(gemcitabine)(健择(Gemzar))、伊立替康(irinotecan)(坎普土沙(Camptosar))、太平洋紫杉醇(paclitaxel)(紫杉醇(Taxol))、拓朴替康(topotecan)(和美新(Hycamtin))、长春新碱(vincristine)(安可平(Oncovin)、文卡萨(Vincasar)PFS)、长春花碱(vinblastine)(长春碱(Velban))。在其他实施例中,本文所述的抗VISTA化合物及疗法与一或多种如下免疫检查点抗体一起共投予,诸如尼沃单抗、派立珠单抗、曲美单抗(tremelimumab)、伊派利单抗、抗PD-L1抗体、抗PD-L2抗体、抗TIM-3抗体、抗LAG-3v、抗OX40抗体及抗GITR抗体。在另一具体实例中,本文所述的抗VISTA化合物及疗法与吲哚胺2,3-二加氧酶(IDO)的小分子抑制剂一起共投予。本发明的抗VISTA化合物及组成物可投予有需要的个体以预防(包括预防癌症的复发)或治疗(例如控制或改善癌症或其一或多种症状)癌症。任何药剂或疗法(例如化学疗法、辐射疗法、标靶疗法(诸如伊马替尼(imatinib)、索拉非尼(sorafenib)及维罗非尼(vemurafenib))、激素疗法及/或生物疗法或免疫疗法)可与本文所述的本发明的化合物或组成物组合使用。抗癌剂包括(但不限于)5-氟尿嘧啶;阿西维辛(acivicin);阿地白介素(aldesleukin);六甲蜜胺(altretamine);胺格鲁米特(aminoglutethimide);安吖啶(amsacrine);阿那曲唑(anastrozole);安曲霉素(anthramycin);天冬酰胺酶(asparaginase);阿扎胞苷(azacitidine);阿扎替派(azetepa);阿佐霉素(azotomycin);巴马司他(batimastat);比卡鲁胺(bicalutamide);硫酸博莱霉素(bleomycinsulfate);布喹那钠(brequinarsodium);溴匹立明(bropirimine);白消安(busulfan);卡铂(carboplatin);卡莫司汀(carmustine);盐酸卡柔比星(carubicinhydrochloride);卡折来新(carzelesin);西地芬戈(cedefingol);苯丁酸氮芥(chlorambucil);西罗霉素(cirolemycin);顺铂;克拉屈滨(cladribine);甲磺酸克立那托(crisnatolmesylate);环磷酰胺;阿糖胞苷(cytarabine);达卡巴嗪(dacarbazine);放线菌素(dactinomycin);盐酸道诺霉素(daunorubicinhydrochloride);地西他滨(decitabine);右奥马铂(dexormaplatin);地扎胍宁(dezaguanine);甲磺酸地扎胍宁(dezaguaninemesylate);地吖醌(diaziquone);多烯紫杉醇(docetaxel);小红莓;盐酸小红莓;曲洛昔芬(droloxifene);柠檬酸曲洛昔芬(droloxifenecitrate);丙酸屈他雄酮(dromostanolonepropionate);达佐霉素(duazomycin);依达曲沙(edatrexate);盐酸依氟鸟胺酸(eflornithinehydrochloride);恩洛铂(enloplatin);恩普胺酯(enpromate);依匹哌啶(epipropidine);盐酸表柔比星(epirubicinhydrochloride);厄布洛唑(erbulozole);盐酸依索比星(esorubicinhydrochloride);雌氮芥(estramustine);雌氮芥磷酸钠(estramustinephosphatesodium);依他哒唑(etanidazole);依托泊苷(etoposide);磷酸依托泊苷(etoposidephosphate);法扎拉滨(fazarabine);非瑞替尼(fenretinide);氟尿苷(floxuridine);磷酸氟达拉宾(fludarabinephosphate);氟尿嘧啶;氟西他滨(flurocitabine);磷喹酮(fosquidone);福司曲星钠(fostriecinsodium);吉西他滨(gemcitabine);盐酸吉西他滨;羟基脲;盐酸艾达霉素(idarubicinhydrochloride);异环磷酰胺(ifosfamide);伊莫福新(ilmofosine);介白素II(包括重组介白素II或rIL2)、干扰素α-2a;干扰素α-2b;干扰素α-m;干扰素α-n3;干扰素β-Ia;干扰素γ-Ib;异丙铂(iproplatin);盐酸伊立替康(irinotecanhydrochloride);乙酸兰瑞肽(lanreotideacetate);来曲唑(letrozole);乙酸亮丙立德(leuprolideacetate);盐酸利阿唑(liarozolehydrochloride);洛美曲索钠(lometrexolsodium);洛莫司汀(lomustine);盐酸洛索蒽醌(losoxantronehydrochloride);马索罗酚(masoprocol);盐酸氮芥(mechlorethaminehydrochloride);乙酸甲地孕酮(megestrolacetate);乙酸甲烯雌醇(melengestrolacetate);美法仑(melphalan);美诺立尔(menogaril);巯基嘌呤;甲胺喋呤;甲胺喋呤钠;氯苯胺啶(metoprine);美妥替哌(meturedepa);丝裂霉素(mitomycin);米托司培(mitosper);米托坦(mitotane);盐酸米托蒽醌(mitoxantronehydrochloride);霉酚酸(mycophenolicacid);诺考达唑(nocodazole);奥马铂(ormaplatin);太平洋紫杉醇;培门冬酶(pegaspargase);甲基比裂霉素(porfromycin);泼尼氮芥(prednimustine);盐酸丙卡巴肼(procarbazinehydrochloride);嘌呤霉素(puromycin);罗谷亚胺(rogletimide);盐酸沙芬戈(safingolhydrochloride);司莫司汀(semustine);辛曲秦(simtrazene);司泊索非钠(sparfosatesodium);司帕霉素(sparsomycin);螺莫司汀(spiromustine);螺铂(spiroplatin);链黑霉素(streptonigrin);链脲菌素(streptozocin);磺氯苯脲(sulofenur);他利霉素(talisomycin);喃氟啶(tegafur);盐酸替洛蒽醌(teloxantronehydrochloride);替莫泊芬(temoporfin);替尼泊甙(teniposide);替罗昔隆(teroxirone);睾内酯(testolactone);硫米嘌呤(thiamiprine);硫鸟嘌呤(thioguanine);噻替派(thiotepa);噻唑呋林(tiazofurin);替拉扎明(tirapazamine);拓朴替康(topotecan);曲美沙特(trimetrexate);葡萄糖醛酸曲美沙特(trimetrexateglucuronate);曲普瑞林(triptorelin);尿嘧啶氮芥(uracilmustard);乌瑞替派(uredepa);伐普肽(vapreotide);维替泊芬(verteporfin);硫酸长春花碱(vinblastinesulfate);硫酸长春新碱(vincristinesulfate);长春地辛(vindesine);硫酸长春地辛;硫酸长春匹定(vinepidinesulfate);硫酸长春甘酯(vinglycinatesulfate);硫酸长春罗新(vinleurosinesulfate);酒石酸长春瑞宾(vinorelbinetartrate);硫酸长春罗定(vinrosidinesulfate);硫酸长春利定(vinzolidinesulfate);伏罗唑(vorozole);折尼铂(zeniplatin);净司他丁(zinostatin);盐酸左柔比星(zorubicinhydrochloride)。标靶疗法包括(但不限于)酪胺酸激酶抑制剂(例如伊马替尼、索拉非尼及维罗非尼)。本发明亦涵盖投予本发明的抗VISTA化合物与放射疗法的组合,该放射疗法包含使用x射线、γ射线及其他辐射来源来杀灭癌细胞。癌症治疗为此项技术中已知且描述于诸如Physician'sDeskReference(第57版,2003)的文献中。本文所述的抗VISTA抗体亦适用于例如治疗慢性感染性疾病(诸如尤其HIV、HBV、HCV及HSV)。本文表1A、1B及2中提供用于选择本发明的抗VISTA抗体的各种特性及序列资讯。表1A:所选全人类或人类化抗人类VISTA抗体的CDR序列表1B:所选全人类或人类化抗人类VISTA抗体的重链及轻链序列*VSTB140、VSTB149及VSTB174中的恒定区序列加有下划线。ΔVSTB149的重链中的赋予蛋白酶抗性的胺基酸残基以粗体表示。表2:所选抗VISTA抗体的解离常数(KD)实施例实施例1:分析人类造血细胞上的VISTA表现方法:制备且染色新鲜人类PBMC以进行VISTA表现在来自数个供体的新鲜分离的人类PBMC(周围血液单核细胞)上测试VISTA的表现。使用抗人类VISTA-生物素(GA-1)进行染色(5μg/ml)。使用小鼠IgG1,K-生物素(纯系MOPC-21,5μg/ml)作为同型对照。供体材料自BiologicalSpecialty公司(Colmar,PA)获得血液样品且当天进行分析。快递10ml含有硫酸肝素的全血进行分析。样品制备用无菌PBS1:1稀释血液。在50ml锥形管中,使22ml经稀释的脐带血在20ml无菌Ficoll-Hypaque(GEHealthcare目录号17-144003)上分层。在室温下将管以1800rpm离心20分钟。使用1ml移液器收集离心后界面处的单核细胞且合并于两个50ml锥形管中。向各管添加无菌PBS以使体积补足50ml且在4℃下将细胞以300g离心10分钟。丢弃上清液。将细胞再悬浮于50ml无菌PBS中且在4℃下将管以300g旋转10分钟。丢弃上清液。合并细胞且再悬浮于50ml无菌PBS中,随后计数。染色方案:使用含有5×107个PBMC的冷冻小瓶进行补偿控制,且用作染色对照。使用以下试剂及/或消耗品:来自BDBiosciences的FACS染色缓冲液(BSA)(目录号554657),其补充有0.2%EDTA;磷酸盐缓冲生理食盐水(PBS)(Gibco目录号14190);96孔聚丙烯圆底盘(BD#3077);1.2ml聚丙烯排管(Corning#4451);经生物素标记的抗VISTA纯系GA-1,其来自ImmunoNext批号080612B(以5μg/ml使用);经生物素标记的mIgG1,K同型对照(纯系MOPC-21),Biolegend目录号400104,批号B116649(以5μg/ml使用);抗人类抗体(参见下表的染色法);近红外活/死细胞染料(Invitrogen,目录号L10119);及抗生蛋白链菌素试剂,包括STP-APC(BDBiosciences目录号554067,批号04251)(以于FACS缓冲液中的1:200稀释度使用)、STP-PE(Biolegend目录号405203,批号B139688)(以于FACS缓冲液中的1:200稀释度使用)、STP-PECy7(展示同型对照样品中的非特异性结合)、STP-Q605(Invitrogen目录号Q10101MP,批号53449A)(以于FACS缓冲液中的1:200稀释度使用)。细胞表面染色方案染色之前,将1×106个细胞转移于96孔圆底盘中且用150μlPBS洗涤。随后在4℃下将盘以1300rpm离心3分钟。随后,将细胞再次用PBS洗涤且如上所述进行离心。随后在50μl含有0.25μl近红外活/死细胞染料的PBS中进行活/死细胞染色。在室温下10分钟后,用150μlFACs染色缓冲液洗涤孔且在4℃下以1300rpm离心3分钟。丢弃上清液。于50μlFACS染色缓冲液中将细胞以1:100用人类血清阻断。在4℃下培育盘15分钟。随后用150μlFACs染色缓冲液洗涤孔且在4℃下以1300rpm离心3分钟。丢弃上清液。随后将含有以下抗体的混合物添加于各孔中以进行表面染色:混合物描述于下表3-6中。视相关群体而定将各混合物与其他混合物分开使用。表3:谱系染色表4:T细胞染色表5:DC染色表6:骨髓染色表面染色后,如先前所述用FACS染色缓冲液洗涤细胞两次且在4℃下以1300rpm离心5分钟。将样品再悬浮于50μl含有经适当萤光标记的抗生蛋白链菌素的FACS染色缓冲液中。在4℃下培育样品30分钟。用150μlFACS染色缓冲液洗涤细胞且在4℃下以1300rpm离心5分钟。重复此洗涤步骤,随后将样品再悬浮于250μlFACS染色缓冲液中。当天在BDLSRFortessaTM细胞分析仪(BDBiosciences)上分析样品。资料分析使用FlowJo型号9软体再分析流式细胞术资料以对特定表型群体设门。使用几何平均值的列举来比较不同细胞亚群中的VISTA表现。通过自抗VISTA处理样品的平均值减去同型对照值将各群体针对背景进行标准化。用Prism制作曲线且在仅比较两个样品时使用史都登氏T检验(student'sT-test)进行统计或使用进行单因子ANOVA以及邦弗朗尼事后检验(Bonferronipost-test)统计。结果:人类骨髓及淋巴亚群上的VISTA表现:如图2A-2E、3A-3G、4、5A-5B及6A-6C中所示,CD14+单核球上的VISTA表现显著不同于全部其他群体(p<0.001)。其他群体之间未发现显著差异。单核球在周围血液中表现最高水准的VISTA,其中CD14+CD16-亚群相较于CD14loCD16+细胞具有显著较高表现。尽管APC展示中等表现,但淋巴亚群展示低表现量。人类T及NK亚群上的VISTA表现:如图7A-7E、8A-8G及9中所示,对于NK亚群,CD56lo细胞展现显著高于CD56HiNK细胞的VISTA表现量。在T细胞亚群中,CD8+记忆细胞表现最高表现量,但其并不显著高于CD8+初始(naive)或CD4+T细胞。人类树突状细胞亚群上的VISTA表现:如图10A-10D、11A-11C及12中所示,未发现VISTA表现存在显著差异;DC及嗜碱性球展现低VISTA表现,其中浆细胞样树突状细胞(pDC)一般较高但程度并不显著。结论:此等结果展示各种免疫细胞亚群上的VISTA表现且VISTA最高地表现于单核球上,其中一些表现在不同T细胞亚群及NK细胞上且几乎不表现于B细胞上。实施例2:周围血液细胞上的VISTA表现方法:全血染色:用下示抗体混合物通过在4℃下培育30分钟将新鲜分离的全血(100μl)染色。用RBC裂解缓冲液将红血球(RBC)裂解且用染色缓冲液洗涤剩余细胞1次。使细胞再悬浮于200μl染色缓冲液中。使用MACSQuant流式细胞仪收集资料且使用FlowJo分析软体分析。周围血液单核细胞(PBMC)染色:使用Ficoll梯度自全血分离周围血液单核细胞。用100μl染色缓冲液中的抗体混合物将新鲜分离的1×106个PBMC染色。在4℃下培育样品30分钟,随后用染色缓冲液洗涤一次。使细胞再悬浮于100μl染色缓冲液中。使用流式细胞仪(MiltenyiBiotec)收集资料且使用FlowJo分析软体分析。所用抗体为CD11b、CD33、CD177、CD16、CD15、CD14、CD20、HLADR、CD3、CD4、CD8、CD127、CD69及FOXP3抗体(Biolegend,SanDiego,CA)。由ImmuNext(Lebanon,NH)制备APC结合的小鼠抗人类VISTA(纯系GG8)。结论:健康人类周围血液细胞上的VISTA表现使用多色流式细胞术分析全血及周围血液单核细胞的VISTA表现。如图15A及15B中所示,在单核球上侦测到VISTA表现的最高水准,继而为嗜中性球。CD4+与CD8+T细胞君表现低水准的VISTA,如图13C及13D中所示。癌症患者周围血液细胞上的VISTA表现如图14A-C中所示,分析来自肺癌患者的周围血液单核细胞(PBMCs)。图14A为展示CD14+单核球及源自CD15+骨髓的抑制细胞(MDSC)的分析结果的代表性流式细胞分析骨髓图。结果表明表型CD15+细胞为源自嗜中性球的MDSC。另外,此等细胞不存在于健康血液样品中。图14B为源自健康及癌症患者的单核球上VISTA表现的代表性直方图,表明相较于健康对照,较高水准的VISTA表现于癌症患者细胞上。类似地,在癌症患者的MDSC上发现较高水准的VISTA,如图14C中所示。图15A为展示结肠癌患者的血液中源自嗜中性球的MDSC的存在的代表性FACS图。图15B及15C为展示相较于健康供体血液样品较高水准的VISTA表现于癌症患者单核球上的代表性直方图。食蟹猕猴周围血液细胞上的VISTA表现如图16A及16B中所示,猴全血的流式细胞术分析揭示类似于人类细胞的VISTA表现模式。相较于CD4+(图16C)及CD8+(图16D)T细胞,单核球与嗜中性球均表现最高水准的VISTA。实施例3:血红素恶性细胞系中RNA层面及蛋白质层面的VISTA表现因为VISTA表现于血红素恶性病中,故抗VISTA抗体可能以恶性细胞为目标而破坏以及阻断VISTA且促进抗肿瘤免疫反应。资料包括约140种血红素恶性细胞系(在分析中重复一些细胞系)的RNAseq分析结果。资料展示于图17中。将RNAseq值以FPKM(每1百万个所定位片段中外显子的每千个碱基的片段)值形式列出。本质上,此意谓计数属于基因之外显子区域中的所有读取结果,且通过基因的长度与每个样品的读取总数标准化(以计算样品间差异)。截止值为1;高于1为VISTA表现阳性(RNA层面),低于1为VISTA表现阴性。结果表明多个细胞系在RNA层面为阳性,主要为急性骨髓性白血病及慢性骨髓性白血病。此可因为VISTA高度表现于正常骨髓细胞中而预期到,且因为认为其功能为减弱免疫反应,包括抗肿瘤免疫反应。实施例4:针对VISTA的单株抗体的产生噬菌体淘选执行二十四个噬菌体淘选实验以富集对CynoVISTA-His具有活性的噬菌体。使用猕猴VISTA蛋白进行此等实验,因为其相较于人类VISTA蛋白展示较佳生物素结合。为确定噬菌体实验成功,将来自个别轮淘选的噬菌体池添加至涂有经生物素标记的cynoVISTA-His的中性链亲和素盘且用结合HRP的抗M13抗体侦测。自噬菌体选择轮挑取个别集落且在96孔盘中制备Fab蛋白。分析所表现的Fab上清液的与经生物素标记的cynoVISTA-His的结合。此操作得到超过200个成功结果。扩增来自Fab盘的VH及VL区,提交以进行DNA测序且作为FASTA文件输出。当挑取将转化为MAB且以MAB形式测试的纯系时,该等纯系基于序列多样性以及具有有限转译后修饰风险及尽可能具有较少疏水性残基来选择。将来自噬菌体纯系的VH及VL次选殖于哺乳动物IgG1/κ表现载体中且转染于HEK293细胞中。将抗体在蛋白A琼脂糖快速流动亲和力树脂上纯化。通过定量ELISA使用Nanodrop量测来确定噬菌体MAB的浓度。抗体组以高水准表现。SDS-PAGE分析展现各表现的抗体变体的完整性。通过扩增来自最后一轮淘选的多株抗体混合物的VH域以选殖于具有VL多样性的噬菌体载体中来进行噬菌体抗体的线上成熟。此操作得到富集的VH池,其经取样具有额外VL多样性。对噬菌体进行1-2轮严格淘选,以期鉴别VISTAECDHis蛋白质的极高亲和力结合物。操作单株FabELISA以确定成熟成功。将ELISA及表现资料根据来自原始重生淘选实验的设定成100%的参考纯系标准化,且鉴别相较于参考纯系对cynoVISTA抗原具有较高结合信号的亲和力成熟纯系。此制程产生数个在低抗原浓度(1nM)下筛选时展现高达200%结合的纯系,对具有最高亲和力的纯系测序且制成MAB。融合瘤产生使一组BALB/cAnNCrl小鼠接受一次50μg于传氏完全佐剂(CompleteFreund'sAdjuvant)中乳化的HuVISTA-Ig重组蛋白(Sino)的腹膜内(IP)注射,继而在两周后接受一次50μg于传氏不完全佐剂(IncompleteFreund'sAdjuvant)中乳化的HuVISTA-Ig重组蛋白的腹膜内注射。两周后,使小鼠接受一次50μg于传氏不完全佐剂中乳化的cynoVISTA-Fc重组蛋白的腹膜内注射。使所有小鼠在尾巴底部接受最后一次含有25μg人类及25μgcynoVISTA的PBS的注射,五天后收集脾以进行融合。使另一组BALB/cAnNCrl小鼠接受一次50μg于传氏完全佐剂中乳化的HuVISTA-His重组蛋白的腹膜内注射。两周后,使小鼠接受一次50μg于传氏不完全佐剂中乳化的HuVISTA-His重组蛋白的腹膜内注射。两周后,使小鼠接受一次50μg于传氏不完全佐剂中乳化的CynoVISTA-His重组蛋白的腹膜内注射。两周后,使所有小鼠接受最后一次含有25μgHuVISTA-His及25μgCynoVISTA-His的PBS的注射,三天后收集脾以进行融合。在融合当天,通过CO2窒息使小鼠安乐死,移出脾且置于10mL冷磷酸盐缓冲生理食盐水中。通过用小研杵将脾研磨穿过细目筛且在室温下用PBS冲洗来制备脾细胞的单细胞悬浮液。用PBS洗涤细胞一次且进行RBC裂解。简言之,将细胞再悬浮于3mLRBC裂解缓冲液(Sigma#R7757)/脾中且置于冰上5分钟。在室温下用PBS再洗涤细胞一次且进行标记以进行磁性分选。按照制造商的说明,用抗鼠Thy1.2、抗鼠CD11b及抗鼠IgM磁珠(分别为MiltenyiBiotec#130-049-101、130-049-601及130-047-301)标记细胞,随后使用具有MidiMACS的MS管柱分选。使阴性细胞洗提份(阳性细胞洗提份丢弃)与FO细胞融合。以1:1比率的鼠骨髓瘤细胞与活脾细胞进行融合。简言之,将脾及骨髓瘤细胞混合在一起,粒化且用50mLPBS洗涤一次。在37℃下用每10e8个脾细胞1mL聚乙二醇(PEG)溶液(2gPEG(分子量4000)、2mLDMEM、0.4mLDMSO)使集结粒再悬浮30秒。随后将细胞/融合混合物在轻柔搅拌下浸于37℃水浴中约60秒。经1分钟缓慢添加37℃DMEM终止融合反应。将融合细胞在室温下静置5分钟,随后以150×g离心5分钟。随后将细胞再悬浮于含有HAT(Sigma目录号H0262)的培养基E-HAT(MediumE,StemCellTechnologies目录号03805)中,且接种于96孔平底聚苯乙烯组织培养盘(Corning#3997)中。使用捕捉EIA针对特异于cynoVISTA的抗体筛选融合瘤上清液。简言之,用于涂布缓冲液(Thermo28382)中的山羊抗小鼠IgG(Fc)抗体(Jackson#115-006-071)以4μg/ml涂布盘(Nunc-Maxisorp#446612)至少60分钟。在室温下将盘用每孔200微升0.4%(w/v)牛血清白蛋白(BSA)的PBS溶液阻断30分钟。洗涤盘一次,每孔添加50μl融合瘤上清液且在室温下培育至少30分钟。洗涤盘一次,每孔添加50μl0.1μg/mLcynoVISTA-huIg且在室温下培育30分钟。洗涤盘一次,向盘添加1:40,000抗生蛋白链菌素HRP(Jackson016-030-084)于0.4%BSA/PBS中的溶液且在室温下培育30分钟。洗涤盘3次,随后每孔使用100μlTMBTurbo受质(ThermoScientific34022)显色,在室温下培育约10分钟。使用每孔25μl4N硫酸终止反应且使用自动盘分光光度计在450nm下量测吸光度。选择15个初级成功结果以通过限制稀释法次选殖且以相同初级筛选格式筛选。使用人类VISTA-Ig交叉筛选所有cynoVISTA活性融合瘤细胞系以评定交叉反应性。简言之,用于0.1M碳酸钠-碳酸氢钠缓冲液(pH9.4,Pierce28382BupHTM)中的山羊抗msFc(Jackson#115-006-071)以4μg/mL涂布盘(Nunc-Maxisorp#446612),在4℃下隔夜。无需进行洗涤,用200μl阻断剂(0.4%BSA(Sigma)(w/v)于PBS(Invitrogen)中的溶液)阻断孔,在4℃下隔夜。移除阻断溶液后,在室温下在经涂布盘上培育未稀释融合瘤上清液30分钟。用PBST(0.02%吐温(Tween)20(Sigma)(w/v)的PBS溶液)洗涤盘一次,随后与于阻断剂中稀释至100ng/ml的HuVISTA-Ig一起培育30分钟。用洗涤盘一次且在室温下用以阻断剂1:10,000稀释的山羊抗人类Fc-HRP(Jackson#109-036-098)探测30分钟。再次洗涤盘,随后每孔使用100μlTMBTurbo受质(ThermoScientific34022)显色,在室温下培育约10分钟。使用每孔25μl4N硫酸终止反应且使用自动盘分光光度计在450nm下量测吸光度。对人类与猕猴VISTA展示活性的融合瘤的V区抗体序列进行选殖。在反转录酶(RT)反应之前用Invitrogen的SuperScriptIII细胞直接cDNA系统制备融合瘤细胞。简言之,丢弃培养基且将盘置于冰上且再悬浮于200μl冷PBS中。将四十微升转移于MicroAmp快速96孔反应PCR盘中且将盘置于冷金属盘基座上,用塑胶膜密封且以700rpm旋转3分钟。丢弃PBS且向各孔中添加10μl再悬浮缓冲液及1μl裂解增强剂。密封盘,在75℃下培育10分钟且储存在-80℃下。为进行RT反应,各孔含有5μl水、1.6μl10×DNase缓冲液、1.2μl50mMEDTA、2μlOligo(dT)20(50mM)及1μl10mMdNTP混合物。在70℃下培育盘5分钟,继而在冰上培育2分钟,随后向各孔添加以下试剂:6μl5×RT缓冲液、1μlRNaseOUTTM(40U/μl)、1μlSuperScriptTMIIIRT(200U/μl)及1μl0.1MDTT。密封盘,置于预热至50℃的热循环器上且在50℃下培育50分钟,继而使其灭活(在85℃下培育5分钟)。将反应物在冰上冷冻且将单股cDNA储存在-80℃下直至进一步使用。为进行V区扩增,提供20μlPCR反应物。各孔含有16.2μl水、2.0μl10×PCR反应缓冲液、0.8μlMgSO4(50mM)、0.4μl10mMdNTP、0.15μl100μM正向引子混合物、0.05μl100μM反向引子、0.2μlHiFiTag酶。将如上所述制备的cDNA转移(每孔2μl)至PCR组分混合物,密封盘且操作扩增反应;对于VH,程式为(i)94℃1分钟,(ii)94℃15秒,(iii)55℃30秒,(iv)68℃1分钟。重复步骤(ii-iv)总共35个循环,继而在68℃下最后延长3分钟。对于VL,程式为(i)94℃1分钟,(ii)94℃15秒,(iii)55℃30秒,(iv)65℃30秒,(v)68℃1分钟。重复步骤(ii-v)总共35个循环,继而在68℃下最后延长3分钟。预混合正向引子且将此混合物与反向引子以比率3:1使用。在琼脂糖凝胶上检验PCR产物。制备反应物以通过添加强化子(In-FusionHC选殖套组,目录号639650,Clontech)进行infusion选殖。将五微升PCR反应物转移至PCR盘,继而每孔转移2μl强化子。密封盘且在热循环器中培育(在37℃下15分钟且在80℃下15分钟)。通过Esp3I消化制备目的载体(vDR243或vDR301);(在37℃下在3μlTango缓冲液、2lEsp3I及水中于30μl反应物中消化1.5μg载体2小时)。为进行infusion选殖,将经2μl强化子处理的PCR产物与100ngEsp3I消化的载体及2μl5×infusion酶(Clontech)混合。以96孔盘格式进行infusion反应。在50℃下在PCR机上培育盘15分钟且通过在42℃下在不震荡下热休克40秒将斯黛拉感胜任细胞(Stellacompetentcell)转形,且与所选抗生素一起展涂于LB琼脂盘上且在37℃下培育隔夜。第二天,将集落挑取于含有LB/卡本西林(Carbenicillin)培养基的96孔深孔盘中且在37℃下生长隔夜。由与等体积30w/v%甘油混合的隔夜培养物制成冷冻储备液。使用测序引子SPF0052对V区测序。分析序列,每个融合瘤vH及vL选择一个阳性孔,再排列于新盘中且在具有安比西林的富集培养基中生长隔夜。随后将纯系进行miniprepDNA制备以小规模转染于96孔盘中。使用内部软体程式将重链与轻链的四十八个所选小鼠融合瘤序列进行人类架构调适。对于小鼠vH或vL中的每一者选择一个人类架构。经由反向转译获得V区DNA序列。由整合DNA技术(Coralville,IA)将对应于HFA胺基酸序列的合成DNA区域定序。分别向预切割的vDR149及vDR157、人类IgG1及人类κ中进行选殖。使用QiagenEndo-freeMaxi-prep套组制备。使用Expi293(100ml)培养物表现此抗体组。实施例5:用于在试管内进行人类VISTA-IGT细胞抑制分析的方案用GFP或人类VISTA稳定转染小鼠A20细胞。将其与ova肽及DO11.10T细胞一起培育。培育开始后24小时量测T细胞的CD25表现。A20-huVISTA细胞抑制T细胞的CD25表现,但此读出结果通过与VSTB95一起培育而明显恢复(图18)。实施例6:抗VISTA抗体的人类架构区调适使用内部软体程式通过CDR接枝(Jones等人,Nature,321:522-525(1986))进行重链与轻链的小鼠融合瘤序列的人类架构调适。程式根据Kabat定义(Wu,T.T.&Kabat,E.A.(1970).JExpMed,132,211-50)描绘V区序列的互补决定区(CDR)且使用Blast比较架构区与人类生殖系基因。选择与小鼠架构具有最高序列一致性的人类生殖系作为用于人类架构调适(HFA)的接受者基因。在一些状况下,基于前述具有良好表现的人类架构的经历,选择密切相关的人类生殖系基因作为替代。经由反向转译获得选用于小鼠vH或vLV区中的每一者的人类架构的DNA序列。由整合DNA技术(Coralville,IA)将对应于HFA胺基酸序列的合成DNA区域定序。分别向人类IgG1及人类κ中进行选殖。实施例7:抗VISTA抗体构筑体用于细胞系产生的分子的质体及序列资讯:产生质体构筑体以用于具有VSTB112可变区及IgG1κ恒定区(VSTB174,由于恒定区的异型变化而产生的新编号)、IgG2δ恒定区(VSTB140)或IgG1抗蛋白酶恒定区(VSTB149)的抗VISTA抗体。Lonza载体BiologicsResearch(BR)及PharmaceuticalDevelopment&ManufacturingSciences(PDMS)中建立pEE6.4及pEE12.4中国仓鼠卵巢(CHO)表现载体系统(LonzaBiologics公共有限公司)作为在哺乳动物表现细胞系中产生治疗性mAb的主要表现系统。各载体含有驱动重链(HC)或轻链(LC)表现的人类巨细胞病毒(huCMV-MIE)启动子且含有安比西林抗性基因。pEE12.4载体亦包括编码麸酰胺酸合成酶(GS)的基因。需要麸酰胺酸合成酶活性的生长条件对细胞施加选择性压力来维持表现载体(GS基因表现系统手册4.0版(GSGeneExpressionSystemManualVersion))。使用pEE6.4作为单基因载体选殖HC基因且使用pEE12.4作为单基因载体选殖LC基因。由此两种Lonza单基因载体产生Lonza双基因质体。所选VISTAmAb的可变重链区的胺基酸序列>VSTB112重链(SEQIDNO:37)QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARSSYGWSYEFDYWGQGTLVTVSS>VSTB50重链(SEQIDNO:38)QVQLVQSGSELKKPGASVKVSCKASGYTFTNYGLNWVRQAPGQGLEWMGWINPYTGEPTYADDFKGRFVFSLDTSVSTAYLQICSLKAEDTAVYYCAREGYGNYIFPYWGQGTLVTVSS>VSTB53重链(SEQIDNO:39)QVQLVQSGAEVKKPGASVKVSCKASGYTFTHYTIHWVRQAPGQGLEWMGYIIPSSGYSEYNQKFKDRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARGAYDDYYDYYAMDYWGQGTLVTVSS>VSTB95重链(SEQIDNO:40)EVQLVESGGGLVQPGGSLRLSCAASGFTFRNYGMSWVRQAPGKGLEWVASIISGGSYTYYPDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARIYDHDGDYYAMDYWGQGTTVTVSS所选VISTAmAb之可变轻链区的胺基酸序列>VSTB50轻链(SEQIDNO:41)DIVMTQTPLSLSVTPGQPASISCRASESVDTYANSLMHWYLQKPGQPPQLLIYRASNLESGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQTNEDPRTFGQGTKLEIK>VSTB53轻链(SEQIDNO:42)DIVMTQSPLSLPVTPGEPASISCRSSQTIVHSNGNTYLEWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQASHVPWTFGQGTKLEIK>VSTB95轻链(SEQIDNO:43)DIVMTQSPLSLPVTPGEPASISCRSSQSIVHSNGNTYLEWYLQKPGQSPQLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCFQGSHVPWTFGQGTKLEIK>VSTB112轻链(SEQIDNO:44)DIQMTQSPSSLSASVGDRVTITCRASQSIDTRLNWYQQKPGKAPKLLIYSASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSAYNPITFGQGTKVEIK>VSTB116轻链(SEQIDNO:45)DIQMTQSPSSLSASVGDRVTITCRASQSINTNLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQARDTPITFGQGTKVEIK实施例8:抗VISTA抗体的ELISA及FACS筛选此等实验用于确定在ELISA中所产生抗体结合人类或猕猴VISTA蛋白的能力,以及使用FACS筛选确定抗体结合表现人类或猕猴VISTA蛋白的K562细胞(人类骨髓性白血病细胞系)的表面上VISTA蛋白的能力。方法:ELISA程序概述:在4℃下用1μg/mlSB0361(人类)或SB0361(cyno(猕猴))蛋白涂布盘隔夜,该等蛋白质为来自各别物种的VISTA的胞外域。将抗体自初始浓度1:4逐步稀释,稀释至1μg/ml,总共获得4种浓度,且在室温(RT)下培育2小时。使用小鼠抗人类IgG1-HRP(辣根过氧化酶)进行侦测且在室温下培育1小时。使用PBS-吐温(0.05%)进行所有洗涤。FACS程序概述:用5μg/ml各测试抗体对2×105个K562-G8(人类)或K562-C7(猕猴)细胞染色且在4℃下培育30分钟。使用5μg/ml的山羊抗人类IgG1-PE(藻红素)抗体作为次级侦测抗体。在BDFortessa上操作细胞且使用FlowJo软体(TreeStar,Inc.,Ashlang,OR)分析活群体的MFI(平均萤光强度)。资料分析/结果:对于各抗体,对于4个分析中的每一者的ELISA与FACS分析,关于抗体是否稳固地结合给出主观分值(是/否)。若对于任一分析中的结合,抗体给出「否」结果,则重复分析以确认其为阴性。结果展示于下表7及图19A-19F及20A-20F中。表7.实施例9:使用混合淋巴细胞反应(MLR)及葡萄球菌(STAPHYLOCOCCUS)肠毒素B(SEB)活化分析筛选抗人类VISTA抗体的结果此研究目的为提供如下资料,其在混合淋巴细胞反应(MLR)分析以及葡萄球菌肠毒素B活化(SEB)分析中支持提高细胞免疫反应的多功能α-VISTA抗体的鉴别。混合淋巴细胞反应(MLR)为标准免疫分析,其取决于MHCI类及II类错配来驱动同种异体T细胞反应。自两个错配个体分离周围血液单核细胞,一起培育,且由于此等错配,发生增殖及细胞激素产生。材料及方法:通过组合500mlRPMI与50ml人类AB血清、5ml青霉素/链霉素(10,000U/ml)、5mlL-麸酰胺酸(100×)及10mlHEPES(1M)制备10%AB培养基。培养基储存不超过14天。通过用9.8mlRPMI稀释0.2ml胸苷储备液(1mCi/ml)来制备1mCi氚化胸苷。用10%AB血清培养基将可溶性VISTA抗体稀释至20μg/ml。将100μl适当抗体溶液添加至96孔U底盘(Falcon产品#353077或等效物)的适当孔中。添加各种细胞群体后,最终浓度为10μg/ml。分离白血球:供体为至少18岁,大体上健康且自当地群体随机选择。将供体血液自分离管转移至50ml锥形瓶。每25ml血液下置放15mlFicoll1077,小心使其不与血液混合。在室温下在不进行制动下将细胞以1250g离心25分钟。在Ficoll与血清的界面处分离白血球且用40ml汉克氏平衡盐溶液(HanksBalancesSaltSolution,HBSS)稀释细胞。在4℃下以453g(1500rpm)离心10分钟。将细胞再悬浮于50mlHBSS中且通过将500μl传递至各别管中计数。混合淋巴细胞反应(MLR)96孔盘设定:基于欲分析的样品数确定分析所需的「刺激细胞(stimulatorcell)」及「反应细胞(respondercell)」的适当数目。将刺激群体以96孔U底盘每孔0.5×105个细胞接种且将反应群体以每孔1.0×105个细胞接种。所有条件必须重复进行三次。将适当数目的「刺激细胞」吸于新锥形瓶中且如先前所述进行离心。将细胞再悬浮于10ml中且用4000拉德(rad)照射。如先前所述将细胞离心,以1×106个/毫升的浓度再悬浮于10%AB血清培养基中且向适当孔中添加50μl。分离所要数目的反应细胞,如先前所述进行离心,以2×106个/毫升的浓度再悬浮于10%AB血清培养基中且向适当孔中添加50μl。在37℃及5%CO2下培育细胞5天。在第五天,移出30μl上清液以分析干扰素γ(IFN-γ)产生。在第五天,向各孔添加25μl40μCi/ml氚化胸苷溶液且在37℃及5%CO2下培育8小时。根据制造商的说明将细胞转移至96孔微闪烁盘中。根据制造商的说明使用微闪烁计数器计数。通过ELISA(eBioscience目录号88-7316-88)使用制造商的方案测定IFN-γ浓度。资料分析:计算未处理孔的平均每分钟计数(CPM)或IFN-γ浓度。计算各测试组的平均CPM或IFN-γ。将资料组进行Log10转化。使用各化合物的12个MLR倍数-分值,计算各化合物的12个测试组的平均值:12个实验的平均分值=Σ[(log10(测试化合物三次重复实验的平均CPM))-(log10(未处理的三次重复实验的平均CPM))]/12。接受准则:在操作分析之前测试所有测试试剂及适当对照的内毒素且含量应<0.1EU/mg。单独反应细胞的平均CPM计数低于700CPM,表明细胞在单独培育时静止。MLR组的CPM为单独培育的反应细胞的CPM的至少2倍,表明反应发生且供体错配。所有MLR分析包括人类IgG1阴性对照蛋白。基于使用史都登氏t检验,人类IgG1阴性对照的结果并非在统计学上不同于未处理样品。MLR中抗VISTA抗体的筛选:所有化合物的初始筛选。用抗VISTA抗体操作MLR前,确定抗体结合细胞结合的VISTA(经由FACS分析)及VISTA蛋白(经由ELISA)。抗体S26(VSTB77)、S30(VSTB86)、S31(VSTB88)、S32(VSTB90)及S39(VSTB74)在此初次筛选中不合格,但仍在分析中测试。出于初步筛选的目的,在MLR中以10μg/ml测试所有抗体,其中量测的参数为增殖及IFN-γ(图21A-21D及22A-22B)。选择前六个抗体。由初始筛选,选择六个候选物以进行进一步分析:VSTB112(S2)、VSTB116(S5)、VSTB95(S16)、VSTB50(S41)、VSTB53(S43)及VSTB60(S47)。MLR中前六个候选物的稀释研究:方案调整。该方案与先前所述相同,但进行一些调整:将抗体稀释至以下浓度:30、10、3、1、0.3、0.1、0.03、0.01及0μg/ml。测定IC50值:使用原始CPM计数及IFN-γ浓度来测定各抗体的IC50值。经由使用程式「EZ-Rstats.」进行IC50值计算。使用六个个别反应者测定IC50值。在MLR中获得个别CPM计数及IFN-γ浓度,且对前面的候选物进行剂量滴定。表8:MLR中对于CPM与IFN-γ的IC50值**值为抗体浓度的log10。结论:初步筛选表明多种VISTA特异性抗体能够提高MLR细胞免疫反应。基于功效及变化将抗体分级且基于此等结果,选择VSTB112、VSTB116、VSTB95、VSTB50、VSTB53及VSTB60在剂量滴定实验中评估。在剂量滴定实验中,相较于其他五种抗体,VSTB60诱导较弱反应。葡萄球菌肠毒素B(SEB)活化分析:SEB为诱导特定Vβ+T细胞活化的细菌超抗原。分离周围血液单核细胞且与培养物中的SEB抗原一起培育,从而诱导稳固细胞激素产生。对前五种候选物进行此分析。10%AB培养基的制备、1mCi氚化胸苷的制备、可溶性VISTA抗体的制备及白血球的分离均如上文在MLR中描述般进行。SEB96孔盘设定:基于欲分析的样品数确定分析所需的反应细胞的适当数目。将反应群体以96孔U底盘每孔2.0×105个细胞接种。所有条件必须重复进行三次。如先前所述将细胞离心且以4×106个/毫升的浓度再悬浮于10%AB血清培养基中且向适当孔中添加50μl。添加50μl10%AB血清培养基,其含有浓度为40ng/ml的SEB抗原。在所述实验中,自SigmaAldrich(目录号S0812)获得SEB。孔中的最终浓度为10ng/ml。在37℃及5%CO2下培育细胞3天。在第三天,移出30μl上清液以分析IFN-γ产生。向各孔添加25μl1mCi/ml氚化胸苷溶液且在37℃及5%CO2下培育8小时。根据制造商的说明将细胞转移至96孔微闪烁盘中。根据制造商的说明使用微闪烁计数器计数。通过ELISA(eBioscience目录号88-7316-88)使用制造商的方案测定IFN-γ浓度。方案:资料分析。对于所有浓度的各抗体计算平均每分钟计数(CPM)或IFN-γ浓度。接受准则如先前所述执行。如所述进行IC50值测定。在SEB分析中获得个别CPM计数及IFN-γ浓度,且对前面的候选物进行剂量滴定。表9:SEB中对于CPM与IFN-γ的IC50值。**值为抗体浓度的log10。结论:在SEB分析中VISTA特异性抗体以剂量依赖方式提高细胞激素产生及增殖。来自SEB研究的IC50值一般类似于MLR稀释研究的结果。实施例10:抗原决定基分组(binning)分析方法:使用ProteOnXPR36系统(BioRad)执行抗原决定基分组。使用制造商关于胺偶合化学法(BioRad,目录号176-2410)的说明用两组6种单株抗体(mAb)涂布ProteOnGLC晶片(BioRad,目录号176-5011)。在室温下将过量竞争性mAb(250nM最终浓度)与人类VISTA(25nM最终浓度)一起预培育4小时,且在涂有涂布mAb组的晶片上一次操作6个,其中缔合时间为4分钟,继而解离5分钟。各操作后,用100mM磷酸将晶片再生。资料分析涉及通过配位体将所有感测器图谱分组及施加对准向导,其自动进行X及Y轴对准及假影移除。随后对资料施用Interspot校正。非竞争性mAb定义为结合信号相同或>A1信号(仅结合于人类VISTA)。竞争性mAb定义为结合信号<<A1信号(亦即仅结合于人类VISTA)。结果:在图23中所示的例示性感测器图谱中,将VSTB85抗体涂布于ProteonSPR晶片上且使与指定竞争者一起预培育的VISTA蛋白在晶片上经过。VSTB50为非竞争性抗体的实例,因为当操作VISTA/VSTB50复合物时可见阳性反应。与VISTA复合的GG8、VSTB49及VSTB51不结合于晶片上所涂布的VSTB85,因此分类为与VSTB85竞争VISTA上的相同结合位点。表10:mAb固定于感测器上Y=竞争(信号<<A1-仅人类VISTA)N=不竞争(信号>A1-仅人类VISTA)I=不确定(信号类似于A1-仅人类VISTA)实施例11:PROTEON亲和力测定使用抗IgGFc涂布的表面在ProteOn晶片上捕捉抗体。测试抗体与VISTA蛋白浓度在0.39nM至100nM范围内的人类及猕猴(VISTA)胞外域(ECD)的结合。使抗原与涂有抗体的晶片结合/缔合4分钟,随后监测解离30分钟。通过用100mM磷酸处理18秒进行两次使晶片再生。在25℃下操作所有实验且将数据拟合1:1朗格缪尔结合模型(Langmuirbindingmodel)。实施例12:抗VISTA处理在MB49鼠膀胱肿瘤模型中的作用方法:用MB49肿瘤细胞注射C57BL/6小鼠。形成肿瘤后,开始抗VISTA处理。随后监测肿瘤生长3次/周。根据IACUC法规,在肿瘤的任何尺寸达到15mm后,处死小鼠。对于各实验,融化MB49细胞的冷冻小瓶且在具有10%血清及青霉素/链霉素抗生素的RPMI1640(+L-Glut)中生长。培养三天后,使用StemProAccutase收集细胞且以5×106个细胞/毫升的浓度再悬浮于RPMI中,且每只小鼠注射50μl。6-8周龄雌性C57BL/6小鼠购自NationalCancer研究所。到达后,使其适应一天,随后刮去其右侧腹的毛且将其尾部刺上标记。随后三-五天后对其进行注射。肿瘤注射(皮内):在小鼠经刮毛侧腹皮内(i.d.)注射50μlMB49细胞悬浮液(约250,000个细胞)。监测肿瘤生长:使用电子测径规首先跨越最宽尺寸(L)且其次在第一量测的90°角度(W)量测肿瘤生长。肿瘤体积如下获得:体积=(L2*W2)/2。在肿瘤直径达到约5mm(体积约60mm3)后认为形成肿瘤。形成后,开始处理。在处理过程中,每周量测肿瘤生长三次且直至实验终止。抗VISTA处理:腹膜内注射10mg/kg嵌合13F3-mIgG2a单株抗体。注射时程为每周三次历时四周。小鼠安乐死:按照IACUC要求,在动物肿瘤的最长尺寸达到15mm后,使动物安乐死。分析功效:使用Excel进行资料管理且使用GraphPadPrism绘图来分析小鼠肿瘤体积。使用R统计计算软体的宏进行统计分析。实验设计展示于图24中。结果:雌性小鼠的Ch13F3-mIgG2a处理使得70%动物中产生完全肿瘤抑制(CR)且在30%动物(n=7)中产生部分缓解(PR)(表13及图25B)。相比之下,所有对照mIgG2a处理小鼠展示肿瘤进行性生长(6/6)(图25A)。此等资料展示抗VISTA处理可对肿瘤生长具有极大作用。表11:完全缓解(CR)与部分缓解(PR)雌性13F3IgG2a(n=7)CR5PR直至第32天,2人类VISTA序列展示于图26及27中,自前述Wang等人,2011修改,该文献的全部内容并入本文中。实施例13:使用氢/氘(H/D)交换研究进行抗VISTA抗体的抗原决定基定位为鉴别人类VISTA上针对VSTB50、60、95及112的抗原决定基,使用相应Fab进行溶液氢/氘交换质谱(HDX-MS)。为进行H/D交换,用于分析Fab扰动的程序类似于先前所述(Hamuro等人,J.Biomol.Techniques14:171-182,2003;Horn等人,Biochemistry45:8488-8498,2006),但进行一些修改。自IgG通过木瓜蛋白酶消化制备Fab且使用PierceFab制备套组(ThermoScientific,目录号44985)捕捉蛋白A。人类VISTA蛋白序列含有六个N连接的糖基化位点。为改良序列覆盖度,用PNGaseF将蛋白质去糖基化。在氘化水溶液中培育去糖基化VISTA蛋白预定时间,使得在可交换氢原子处并入氘。在4℃下,在46μL氧化氘(D2O)中,使氘化VISTA蛋白与VSTB50、VSTB60、VSTB95或VSTB112的任一Fab复合30秒、2分钟、10分钟及60分钟。通过降低pH值淬灭交换反应且用胃蛋白酶消化蛋白质。所鉴别肽的氘含量由LC-MS上的质量偏移监测。作为参考对照,类似地处理VISTA蛋白,除了其不与Fab分子复合以外。结合于Fab的区域据推断为相对不易交换因此相较于参考VISTA蛋白含有较高分率氘的彼等位点。约94%蛋白质可定位于特定肽。用VSTB50/VSTB60及VSTB95/VSTB112进行的VISTA的溶液HDX-MS扰动定位分别展示于图28上图及下图中。鉴别两个抗原决定基。抗VISTAVSTB50与VSTB60识别相同抗原决定基;VSTB95结合于VISTA上VSTB112所结合的另一抗原决定基区。抗VISTAVSTB50及60共有相同抗原决定基,其包含区段103NLTLLDSGL111(SEQIDNO:62)及136VQTGKDAPSNC146(SEQIDNO:63)(图28上图)。抗VISTAVSTB95及112似乎以类似抗原决定基为目标,该等抗原决定基包含区段27PVDKGHDVTF36(SEQIDNO:75)及54RRPIRDLTFQDL65(SEQIDNO:65)(图28下图)。有两个其他区段展示VSTB95及112产生弱扰动,包括残基39-52及118-134。然而,降低程度不如不同定位中的前述区域(27-36及54-65)强。尽管展示由VSTB95及112产生强扰动的一种肽100TMR102位于VISTA表面的另一表面上,但其距离抗原决定基区域27-36及54-65很远。此扰动可能归因于别位作用。此等HDX-MS结果提供抗VISTA抗体的肽层面抗原决定基。对于此两种抗原决定基不存在重迭抗原决定基区域。此等结果在其不彼此竞争方面符合前述竞争分组资料。实施例14:通过蛋白质结晶学确定人类VISTAECD:VSTB112FAB复合物的结构在致力于确定VISTA结构及描绘定义VISTA细胞外域(ECD)与第一抗体VSTB112的Fab片段之间的相互作用的抗原决定基及互补位中,使复合物结晶且确定结构,解析度为致力于确定与抗体VSTB112的Fab片段复合的人类VISTA中ECD的结构以确定VISTAECD自身的结构与定义用于此相互作用的抗原决定基/互补位。该结构揭示VISTA采用IgV折迭,其链拓扑学类似于TCRVα链。除桥接β夹层的背面及正面中的B与F股的标准二硫键以外,该结构揭示ECD具有两个额外二硫键,一个将CC'环系栓于前片,第二个在A'与G'股之间。尽管VISTA分子之间存在晶体接触,但其为少量的且基于此结构并无VISTAECD的二聚物的证据。VSTB112抗原决定基经展示包含VISTABC、CC'及FG环的部分以及正面β片最接近彼等环的残基(C'CFG)。互补位主要偏向重链相互作用,其中CDRL3产生最少接触。定义VISTA:VSTB112相互作用的抗原决定基/互补位VSTB112Fab在结合VISTAECD后埋藏的表面区域,其中埋藏的重链表面占此总数的VISTA与VSTB112轻链之间形成七个氢键及4个盐桥相互作用,且VISTA与VSTB112重链之间形成10个氢及2个盐桥相互作用。VSTB112识别前片股C'、C、F及G中FG环近端的残基以及BC、FG及CC'环中的残基(图29及30)。与CC'环的相互作用占与仅在FG环中具有残基E125及R127的Fab轻链的接触的大多数,从而产生额外轻链相互作用。对应于VISTAFG环的残基119至127占结合VSTB112后埋藏的表面区域的总共的38%。值得注意地,此环具有高极性,其包含以下序列-IRHHHSEHR-(SEQIDNO:76)。另外,VSTB112CDRH3中的W103很好地针对VISTA残基H122及H123的主链封装,且VISTAH121为与CDRH2中F55的芳族环的相互作用的边缘。通过结晶学及HDX鉴别的抗原决定基区域的比较展示于图31中。实施例15:通过抗VISTA抗体活化T细胞及单核球在两个试管内分析(混合白血球反应(MLR)及SEB(葡萄球菌肠毒素B))中评估抗VISTA抗体的功能作用。两个分析均量测T细胞增殖及细胞激素诱导作为其主要读取结果,但此等作用归因于不同机制。在MLR中,将来自两个不同人类供体之周血液单核细胞(PBMC)一起培育,一个供体的T细胞与另一供体的树突状细胞之间的主要组织相容复合体(MHC)错配引起T细胞增殖及干扰素(IFNγ)产生。在SEB分析中,将来自单一供体的PBMC与细菌超抗原一起培育,细菌超抗原直接将抗原呈递细胞(APC)表面上的MHCII级蛋白连接于T细胞上的T细胞受体(TCR),从而引起T细胞活化、增殖及细胞激素分泌。在两种分析中,作为VSTB174母分子的VSTB112展现对T细胞增殖及细胞激素产生的剂量依赖性诱导且在候选物中最有效(图21A-21D,表12)。表12.MLR分析读取结果的EC50值。VSTB112(VSTB174的母分子)为最有效分子。单核球活化分析表12中所示的分析资料用VSTB174的母分子VSTB112产生。为充分了解VSTB174的活性,进行单核球活化分析。结果展示将VSTB174与全PBMC一起培育诱导CD14+单核球上活化标记物(CD80及HLA-DR)上调,从而表明结合于已知表现高水准VISTA的免疫细胞亚群的抗体的作用(图32)。另一问题为对全PBMC中单核球活化的作用是否可由结合VISTA且具有IgG1Fc的任何抗体促进。抗体VSTB103及VSTB63以高亲和力(分别为KD6.36E-10及8.30E-10)结合于VISTA且与VSTB112及VSTB111类似地结合于表现VISTA蛋白的细胞。VSTB103与VSTB112在同一抗原决定基组,而VSTB63在不同抗原决定基组中;两种抗体均不促进单核球活化。综合而言,此等结果展示VSTB174可对T细胞活化/增殖发挥其作用的一种机制为经由NK细胞所促进的单核球活化。制备培养基将500mlRPMI1640(Corning,10-040-CV)与50ml人类AB血清(ValleyBiomedical公司,批号3C0405)、5ml青霉素/链霉素(Lonza,17-602E)(10,000U/ml)、5mlL-麸酰胺酸(100×)(Gibco,25030-081)及10mlHEPES(1M)(FisherBP299-100,批号-1)组合。将培养基在4℃下储存不超过14天。制备可溶性VISTA及对照抗体将抗体用10%AB血清培养基稀释至2×所要浓度,VSTB174:批号VSTB174.003。向96孔底盘(Falcon,353077)的适当孔中添加100μl适当抗体溶液。以100μl添加各种细胞群体后,各抗体的最终浓度为1、0.1或0.01g/ml。以1μg/ml的最终浓度添加IgG1对照抗体CNTO3930(批号6405,ENDO<0.1EU/mg)。分离PBMC。供体为至少18岁,大体上健康且自当地群体随机选择。将供体血液自分离管转移至50ml锥形瓶。在下方置放15mlFicoll1077(SIGMA,10771),小心使其不与血液混合。对每25ml血液进行此操作。在室温下在不进行制动下将细胞以1250g离心25分钟。在Ficoll与血清的界面处分离白血球且用40ml汉克氏平衡盐溶液(HBSS)稀释细胞。将细胞在4℃下以453g(1500rpm)离心10分钟。将细胞再悬浮于50mlHBSS中且通过将500μl转移至各别艾本德管(eppendorftube)中计数。另外,根据制造商的说明(目录号130-096-537)使用来自Miltenyi的泛单核球分离套组,通过在数个处理组中阴性选择来分离CD14+细胞。试管内培养设定基于欲分析的样品数确定分析所需的适当细胞数目。将反应群体以96孔U底盘每孔2.0×105个细胞接种。对于CD14阴性选择群体,接种0.5×105个细胞。所有条件重复进行三次。如上所述将细胞离心,对于全PBMC群体以2×106个/毫升的浓度且对于CD14阴性选择群体以0.5×106个/毫升的浓度再悬浮于10%AB血清培养基中且向适当孔中添加100μl以使各孔中的总体积达200l。在37℃及5%CO2下培育细胞1、2或3天。抗体染色及流式细胞术将96孔U底盘以453g离心5分钟且移除上清液。用200μlPBS洗涤细胞且如步骤5.5.1中离心。丢弃上清液且再悬浮于50μl含有以下抗体的PBS中:.CD14-APC(纯系HCD14)1:250(Biolegend目录号325608).HLA-DR-PECy7(纯系L243)1:250(Biolegend目录号307616).CD80-PE(纯系2D10)1:250(Biolegend目录号305208).HuFcR结合抑制剂(eBioscience目录号14-9161-73)在黑暗中在湿冰上培育20分钟。添加150μlPBS且如步骤5.5.1中离心。添加150lPBS缓冲液且经由FACS进行分析。在MiltenyiMACSQuant10参数流式细胞仪上操作样品且使用FlowJo9.7.5分析CD14+群体上HLA-DR及CD80的表现。使用萤光强度几何平均值(MFI)(定义一组数字的中心趋势的统计参数)作为用于处理比较的指定统计参数。统计分析所有统计在PrismGraphPad型号6中进行。在各时间点使用单因子ANOVA在各组间进行逐对比较,且对多样性进行图克校正(Tukeycorrection)。所有测试的p值均低于0.05且认为对比为显著的。对于所有曲线及表格,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。实施例16:抗VISTA抗体的ADCC及ADCP活性VSTB174具有IgG1Fc,其可赋予抗体依赖性细胞介导的细胞毒性(ADCC)及抗体依赖性细胞介导的吞噬作用(ADCP)活性。进行两种类型分析且展示VSTB174可能裂解或吞噬K562-VISTA细胞(图33-34),但K562骨髓瘤细胞系母细胞不会(资料未示)。VSTB174调节VISTA的抑制作用的另一作用机制可为表现高水准VISTA的细胞的裂解或吞噬,因此自局部微环境将其移除。实施例17:抗VISTA抗体的ADCP活性使用试管内吞噬作用分析来研究由抗人类VISTAmAb(VSTB173及VSTB174)提高巨噬细胞介导的异位表现VISTA的细胞的吞噬作用。将此等mAb选殖于不同Fc主链(IgG1WT(野生型)、IgG1PR(蛋白酶抗性)及IgG2σ)中且假定可能对提高吞噬作用具有不同活性。IgG1及IgG1PR主链能够结合于Fc受体且具有引起ADCP的潜力,而IgG2σ不结合于Fc受体且不能调节ADCP。在ADCP分析中用K562母细胞及K562-VISTA目标细胞测试抗VISTA抗体。如图35-36中所示,VSTB174、VSTB149、VSTB173及VSTB145提高K562-VISTA细胞的hMac吞噬作用。具有不结合Fc受体的IgG2σFc的VISTA抗体VSTB140或VSTB132正如所料不能提高吞噬作用。具有IgG1Fc的VISTAmAbVSTB174及VSTB173展示相较于具有IgG1PRFc的VSTB149及VSTB145吞噬作用更稳固(对于EC50值,参见表13及14)。表13.抗人类VISTAmAbEC50值。处理VSTB174VSTB149VSTB140EC500.07820.1142NA表14.抗人类mAbEC50值。处理VSTB173VSTB145VSTB132EC500.01460.1075NAVSTB174及VSTB173展示在最高浓度下微弱地提高K562母细胞的吞噬作用(图35-36),其可归因于K562细胞的VISTA低表现。其他抗VISTA抗体不能提高K562细胞的吞噬作用。在K562-VISTA吞噬作用分析中各以两个不同浓度测试阴性对照抗体,但其不诱导任何吞噬作用。此结果表明抗VISTA抗体介导的吞噬作用为特异性地且归因于K562-VISTA细胞的VISTA抗原表现。实施例18:其他抗VISTA抗体的ADCC活性为测试其诱导ADCC的能力,测试以下三种人类抗VISTA抗体:VSTB174(IgG1)VSTB149(IgG1PR)VSTB174.LF(IgG1LF(低海藻糖))。在两个各别实验中,以六个不同浓度在同一盘内测试各抗体,重复三次,获得总共六个资料点。10、1、0.1及0.01μg/mL的VSTB174、VSTB149及VSTB174.LF各展现可量测的ADCC活性,而仅LF抗体在0.001μg/mL下展现可量测的ADCC活性;在0.0001μg/mL下抗体均不展现ADCC。当此等抗体各具有IgG1或IgG1变体Fc时,此结果可预期。LF抗体展现增加的ADCC效能,其通过与常规IgG1抗体曲线(0.02381μg/mL)相比,LF抗体曲线的EC50值较小(0.002293μg/mL)来证明。IgG1PR抗体曲线的EC50值类似于常规IgG1曲线(0.01846μg/mL)。表15.如通过ADCC分析所测定,三种测试抗VISTA抗体的EC50值(μg/mL)。抗VISTA抗体EC50(μg/mL)VSTB174(IgG1)0.02381VSTB149(IgG1PR)0.01846VSTB174.LF(IgG1LF)0.002293在10、1、0.1及0.01μg/mL抗体浓度下,人类IgG1、人类IgG1PR及人类IgG1LF抗体均展示可量测的ADCC介导的杀灭作用,而仅LF抗体在0.001μg/mL抗体浓度下展示杀灭作用。抗VISTA抗体在0.0001μg/mL抗体浓度下均不展示杀灭作用。如EC50值中可见,相较于常规IgG1抗体或IgG1PR抗体,LF抗体展示约10倍有效ADCC杀灭作用。实施例19:VSTB174对人类及猕猴VISTA的亲和力通过表面电浆子共振(SPR)法在ProteOn仪器上测定VSTB174对人类及食蟹猕猴VISTA细胞外域(ECD)的亲和力。VSTB174对各蛋白质呈现极类似KD值,对于人类ECD为1.56E-10M,且对于猕猴VISTA为8.66E-11M。实施例20:在鼠肿瘤模型中VISTA抗体展现功效小鼠品系、试剂及肿瘤模型为进行活体内研究,使用回交于C57BL/6背景上的人类VISTA嵌入(knockin)(VISTA-KI)小鼠。使用接枝于小鼠FcIgG2a上的VSTB174可变区(VSTB123)产生抗人类VISTA抗体以使得能够在VISTA-KI小鼠中测试。在VISTAKI小鼠中评估MB49膀胱癌。除展现抗VISTA抗体疗法抑制野生型小鼠的肿瘤生长的已公开研究(LeMercier等人,2014)以外,已用替代性仓鼠抗体使用不同给药时程在野生型小鼠中及在用VSTB123处理的VISTA-KI小鼠中展现抗肿瘤功效。在VISTA-KI小鼠中MB49肿瘤模型中的活体内功效研究在雌性VISTA-KI小鼠中进行MB49功效研究,以在1-10mg/kg范围内的数个剂量测试VSTB123。在第0天向小鼠皮内注射250,000个MB49肿瘤细胞。在第6天,如图37中所示开始给药(10mg/kg同型对照mIgG2a或指定剂量VSTB123;10只小鼠/组)。如图37中所示,在较高与较低剂量下,VSTB123更有效。10mg/kg及7.5mg/kg的剂量等效,而在给予5或1mg/kg的小鼠中肿瘤生长更快速。实施例21:用抗VISTA抗体侦测人类肿瘤中的VISTA表现图1展示AML肿瘤细胞的VISTA表现-其及图17中的RNA序列表现资料支持如下想法:VISTA由AML细胞表现,且抗VISTA药物经由以此等用于免疫调节或抗体介导的杀灭的细胞为目标而有效。自来自外科切除术的肺肿瘤样品获得评估肺癌中的VISTA表现的资料。针对VISTA及多种其他标记物的表现将细胞解离及特性化。结果展示13/13肺肿瘤(鳞状癌或腺癌)含有CD14+VISTA+骨髓细胞(图38)。实施例22:使用抗VISTA抗体侦测肺肿瘤中的VISTA表现使用纯系GG8(一种抗人类VISTA小鼠IgG1)进行免疫组织化学分析。使用此mAb研究非小细胞肺癌(NSCLC)FFPE肿瘤切片中VISTA的染色。在染色前用标准抗原修复法处理FFPE肿瘤切片。以1:500稀释度使用GG8小鼠抗人类VISTA抗体。依序使用兔抗小鼠多株抗体及抗兔聚合物HRP侦测GG8结合。继而用苏木精对比染色,随后对肿瘤切片评分。肺癌中的VISTA表现主要受限于免疫浸润(图39中所示的实例)且高水准的VISTA阳性细胞存在于多个肺癌样品中。实施例23:与VSTB174的FAB片段复合的人类VISTA的细胞外域(ECD)的结构产生VISTA抗原变体且经纯化以用于结晶学。内部表现经his标记的重组VSTB174Fab且纯化。产生晶体且用于使用同步辐射收集VISTAECD:VSTB174Fab复合物的较高解析度资料,且使用同源建模及电子密度分析的组合解决结构确定(图29(上图))。通过X射线结晶学测定VISTAECD:VSTB174Fab复合物的结构,解析度为得到VISTAECD的第一结构且描绘VSTB174抗原决定基及互补位。VISTAECD采用IgV折迭,其拓扑学类似于CTLA-4ECD,但具有在β夹层的前片延伸的独特G'股。A'及G'另外经由A'股中的残基C12与G'股中的C146之间形成的二硫桥键以化学方式系栓。发现六个半胱胺酸参与三个分子内二硫键,且基于晶体接触,不存在二聚VISTA的证据。VSTB174识别前片股C'、C、F及G中在FG环近端的残基以及BC、FG及CC'环中的残基。本文中所引用的所有专利、公开申请案及参考文献的教示以全文引用的方式并入本文中。尽管本发明已参照其例示性具体实例特定展示及描述,但熟习此项技术者应了解,在不背离由随附权利要求涵盖的本发明的范畴的情况下,可在其中做出形式及细节的各种改变。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1