分析信号通路的活化状态的方法和利用此方法选择个性化药品的方法与流程
本发明涉及一种通过实时单分子蛋白-蛋白的相互作用分析来分析从受试者分离的细胞或组织中信号通路的活化状态的方法以及利用此方法选择个性化药品或预测药品的治疗效果的方法。
背景技术:
最近,对疾病的个性化诊断、预后预测以及治疗主要集中于基因分析。但是,包括癌症的特定疾病的发病原因是由于构成人体的细胞的异常活动,更具体而言是由于构成细胞并调节细胞的多种蛋白之间的异常相互作用而引起的。因此,仅通过基因分析来单独观察蛋白无法提供更多的指导。事实上,通过基因分析具有同样基因特征的患者,对靶向抗癌剂具有不同的易感性,并且他们的预后也不同。在单分子水平上蛋白-蛋白相互作用的分析,可提供关于细胞内信号网络如何变化的更准确信息,而且还能提供特定癌症的发展和特性以及其治疗方法的信息。
最近,通过引入个人的基因分析进行考虑个体患者的特性的个性化诊断及个性化药品的研究。但是,如上所述,因疾病的性质由蛋白-蛋白相互作用引起的细胞活动所决定,因此,需要研究通过蛋白相互作用形成的信号网络,为了相对于在基因水平上分析每个蛋白的零碎方法的更准确的理解。为了充分理解生命现象,在分子及相互作用的网络水平上理解信号转导是必要的。例如,即便具有相同基因突变的患者,对同样的靶向药品也会显示出不同的反应,因为细胞信号转导基于复杂的蛋白-蛋白相互作用。相同的癌症蛋白表达可能诱导不同的信号通路。
蛋白-蛋白相互作用的准确分析是诊断疾病、预后评价及药品开发的重要基础。常规技术基于测量活性和理解相互作用的方法验证蛋白的相互作用。例如,使用利用X射线结晶法等验证在原子水平上与相互作用相关的氨基酸残基或原子的方法、利用酵母双杂交体系等确认两个蛋白之间的二元相互作用的方法、通过免疫沉淀及质量分析来确定复合体相互作用的方法。除了这些生物体外方法之外,还使用荧光共振能量转移法(FRET,Fluorescence Resonance Energy Transfer)以及双分子荧光互补法(BiFC,Bimolecular Fluorescence Complementation)的细胞内分析方法。
但是,在色谱分析的情况下,因为蛋白质被纯化之后进行分析,在单一分子水平上很难确认与混合有其他蛋白等的实际细胞环境中类似的蛋白之间的相互作用。在酵母双杂交体系的情况下,因细胞的混合蛋白表达而引起的转录活性的影响,分析的准确度也会不同。FRET法是使用荧光转移至相邻部分的方法,因此,仅在产生荧光转移时蛋白之间的结合才有可信性,故有成功率低的缺点。尤其,蛋白的结合在短时间内以较弱的结合出现时,不断被提出由上述的方法是不能准确地测定的缺点。
因此,需要准确地分析蛋白之间的相互作用,进而在复杂的环境中预测疾病的途径,从而能找出并筛选个性化靶向药品的新的方法。
遍及本说明书,参考并引用了许多论文及专利文献。在本说明书中作为参考引用的论文及专利文献的公开内容,使得更加明确地说明本发明所属领域的技术水平及本发明的内容。
技术实现要素:
鉴于上述的问题,本发明人开发了以能同时实时分析信号路径上的靶蛋白和其他蛋白之间的蛋白-蛋白相互作用的方法为基础的分析细胞或组织中信号通路的活化状态的方法及利用此方法的选择个性化药品的方法。
因此,本发明的目的是提供一种分析从受试者分离的细胞或组织中信号通路的活化状态的方法。
本发明的另一目的是提供一种选择个性化药品的方法。
本发明的另一目的是提供一种预测对药品的治疗反应性的方法。
本发明的其他目的及优点从下面的本发明的详细说明、权利要求以及附图将会更加明显。
根据本发明的一个方面,提供了分析从受试者分离的细胞或组织中信号通路的活化状态的方法,其包括下述步骤:
(a)通过用包括第一蛋白的细胞或组织的提取物处理基板,使从受试者分离的信号通路中的第一蛋白固定在基板上;
(b)通过向基板提供与第一蛋白相互作用的荧光标记的第二蛋白,诱导形成第一蛋白与荧光标记的第二蛋白的复合体;以及
(c)基于第二蛋白的荧光标记的荧光信号来分析第一蛋白和第二蛋白之间的相互作用,以及信号通路的活化状态。
本发明人开发了一种基于同时实时分析信号通路中靶蛋白和其他蛋白之间的蛋白-蛋白相互作用的方法,分析细胞或组织中信号通路的活化状态的方法,以及利用此方法选择个性化药品的方法。
下面,将详细描述本发明。
(a)将第一蛋白固定在基板上
在步骤(a)中,通过用包括第一蛋白的细胞或组织的提取物处理基板,使信号通路中的第一蛋白固定在基板上。
根据本发明的示例性实施方式,第一蛋白的固定可通过将第一蛋白固定至预先固定在基板上的抗第一蛋白抗体而实现。在这种情况下,与抗体结合的第一蛋白的抗原决定部位和与第二蛋白结合的第一蛋白的结合部位优选间隔预定的距离。
根据本发明的另一示例性实施方式,基板是涂层聚乙二醇的石英载玻片。
包括第一蛋白的细胞或组织可为正常细胞或正常组织,但是也可以为异常细胞或异常组织。
根据本发明的示例性实施方式,细胞或组织的提取物是癌细胞或癌组织的提取物。本发明通过使用裂解从受试者(例如癌患者)中分离的癌细胞或癌组织而得到的细胞或组织的提取物,而没有复杂的预处理过程来进行分析,可以缩短时间和工作量。细胞提取物可以是细胞原液,或稀释的细胞质原液或稀释的细胞原液。
对于细胞溶解,可利用物理方法、化学方法、酶方法等而没有限制。
根据本发明的示例性实施方式,为了去除未固定在基板上的第一蛋白,在进行步骤(b)之前进行洗涤过程。洗涤可利用通常的洗涤缓冲液(例如,PBS)来进行。
根据本发明的示例性实施方式,第一蛋白是膜蛋白。
根据本发明的示例性实施方式,膜蛋白是受体。在这种情况下,本发明通过分析信号通路的起始点的受体以及与受体相互作用的多种蛋白之间的相互作用,可以确定活化的通路。
受体可以是受体酪氨酸激酶、Toll样受体以及G蛋白偶联受体,但不限于此。
根据本发明的示例性实施方式,受体酪氨酸激酶选自由表皮生长因子受体(EGFR)、人表皮生长因子受体2(HER2)、人表皮生长因子受体3(HER3)、人表皮生长因子受体4(HER4)以及肝细胞生长因子受体(HGFR,c-MET)组成的群。
根据本发明的示例性实施方式,当第一蛋白为受体酪氨酸激酶时,下面详细描述的第二蛋白可选自由ρ85α、STAT3、Grb2和PLCγ组成的组。例如,当第一蛋白为EGFR时,第二蛋白可选自由ρ85α、STAT3、Grb2和PLCγ组成的组。当第一蛋白为HER2或HGFR时,第二蛋白可选自由ρ85α、Grb2及PLCγ组成的组,并且当第一蛋白为HER3时,第二蛋白可为ρ85α。
(b)诱导第一蛋白和荧光标记的第二蛋白之间形成复合体
在步骤(b)中,向基板提供与第一蛋白相互作用的荧光标记的第二蛋白,以诱导形成第一蛋白和荧光标记的第二蛋白的复合体。
根据本发明的示例性实施方式,第二蛋白是位于第一蛋白下游的蛋白。
根据本发明的示例性实施方式,第二蛋白可以以包含在提取物中的形式提供至基板。例如,可以向基板提供裂解细胞而获得的细胞提取物,所述细胞以荧光标记的形式表达作为第一蛋白下游的蛋白的第二蛋白。为了获得包含荧光标记的第二蛋白的细胞提取物,可通过基因修饰细胞,在细胞中表达荧光标记的第二蛋白。例如,将编码第二蛋白的全长ORF或部分的多核苷酸引入编码荧光基因的载体来制备重组载体,接着利用重组载体转化适当的宿主细胞(例如,哺乳动物细胞)而表达荧光标记的第二蛋白。就转化的方法而言,可使用电穿孔、质粒融合、磷酸钙(CaPO4)沉淀、氯化钙(CaCl2)沉淀、利用碳化硅纤维进行搅拌、农杆菌介导的转化、PEG、硫酸葡聚糖、脂质体及干燥/抑制介导的转化方法等。作为另一例子,还可以利用物理化学方法将第二蛋白进行荧光标记。
荧光标记可以为,例如绿色荧光蛋白(GFP)、黄色荧光蛋白(YFP)、蓝色荧光蛋白(BFP)、青色荧光蛋白等。
根据本发明,当将包含第二蛋白的细胞提取物提供至附着有第一蛋白的基板的表面上时,则基板表面的第一蛋白将与第二蛋白以与共同存在第二蛋白和其他蛋白的细胞内环境类似的方式相互作用。这意味着本发明的分析方法可在与细胞内环境相同的条件下观察蛋白-蛋白相互作用。即,通过检测第二蛋白中标记的特定波段的荧光信号,可在与细胞内环境相同的环境下分析第一蛋白与第二蛋白之间的相互作用。在本发明中,因为第一蛋白和第二蛋白彼此相互作用,并且是信号通路中相邻的蛋白,因此通过本发明能分析实际细胞中信号通路的活化状态。
(c)通过分析第一蛋白和第二蛋白之间的相互作用来分析信号通路的活化状态。
在步骤(c)中,基于第二蛋白的荧光标记的荧光信号,来分析第一蛋白和第二蛋白之间的相互作用和信号通路的活化状态。
第一蛋白和第二蛋白之间的相互作用的分析可利用产生近场的光学装置测定由荧光标记的第二蛋白发出的特定波长的荧光信号来进行。即,利用全内反射显微镜等产生近场的光学装置来观察基板的表面,分析基板表面上的第一蛋白和荧光标记的第二蛋白之间的结合与分离的频率等的相互作用,可以确认第一蛋白和第二蛋白之间的相互作用。
根据本发明的示例性实施方式,利用全内反射显微镜进行第一蛋白和第二蛋白之间的相互作用的分析。在这种情况下,可在形成第一蛋白和第二蛋白的复合体的步骤中实时测量荧光信号。与常规的一般免疫沉淀方法不同,本发明将实时分析单分子蛋白-蛋白相互作用的免疫沉淀和荧光成像结合的方法在反应腔中实时进行未纯化的细胞或组织提取物的单分子成像,并且可实时确认单分子水平上的结合。
根据本发明的示例性实施方式,荧光信号的分析可以在预定的时间内对代表荧光标记的特定波长荧光信号进行积分和测量。即,通过全内反射显微镜测定到基板表面的波长变化时,可在预定的时间内对波长变化进行积分。
利用本发明的方法,可以确认(分析)从受试者,包括人受试者中分离的细胞或组织中信号通路中活化的通路。在下面的实施例中,利用来自癌症患者的各种癌细胞系和组织来分析已知与癌症密切相关的EGFR和其下游蛋白的ρ85α、STAT3、Grb2以及PLCγ之间的相互作用。确认了每个细胞系或癌组织与正常组织之间EGFR的活性水平存在差异(见实验例3和4)。进一步,在下面的实施例中,通过靶向各种癌细胞系,分析了EGFR之外的其他RTK和其下游蛋白之间的相互作用(见实验例5和6)。这种结果显示通过本发明的方法可以发现从各个受试者中分离的细胞或组织处于特别活化状态的信号通路,并且显示基于分析的信号通路的活化状态预测各个受试者的疾病的预后,选择适合各个受试者特性的药品(例如,靶向活化的信号通路的药品)等,个性化的预后预测及治疗是可能的。
根据本发明,本发明可选择与第一蛋白相互作用的一种蛋白作为第二蛋白,或也可使用如下面实验例3所描述的与第一蛋白相互作用的各种蛋白。例如,在分析第一蛋白与其各种下游蛋白(多种第二蛋白)之间的相互作用的情况下,可将多种第二蛋白同时或依次提供至基板。例如,在将第二蛋白依次提供至基板的情况下,首先在分析提供的第二蛋白和第一蛋白之间的相互作用完成之后,通过洗涤过程去除分析的第二蛋白,然后可进行其他的第二蛋白提供至基板的过程。
具体而言,根据本发明的示例性实施方式,在将各种第二蛋白依次提供至基板的情况下,本发明的方法在步骤(c)之后进一步包括将与在步骤(b)和(c)中分析相互作用使用的第二蛋白不同的蛋白(与第一蛋白相互作用)作为第二蛋白重复执行步骤(b)和(c)的步骤(d)。在这种情况下,在分析第二蛋白和第一蛋白之间的相互作用之后,可通过洗涤过程去除第二蛋白之后,将不同类型的第二蛋白提供至基板,再次分析与第一蛋白的相互作用。因为将第一蛋白固定在基板的过程只进行一次,就能分析与各种第二蛋白的相互作用,因此,使用少量的样品进行分析是可能的。考虑到人体组织的提取量非常有限并且不存在用于蛋白的扩增方法,比如PCR等,这非常有利。
在本发明中,可使用各种第一蛋白和各种第二蛋白进行步骤(a)至(c)。即,本发明可通过在将多种第一蛋白(靶蛋白)固定在基板上之后,通过处理与第一蛋白相互作用的多种第二蛋白(候选蛋白,例如第一蛋白的下游蛋白),分析第一蛋白与第二蛋白之间的相互作用。例如,在将各种第一蛋白固定在附着有各种抗体的基板上之后,将第一蛋白和第二蛋白分别设置为X轴和Y轴,并且基于荧光信号分析蛋白之间的相互作用。将第一蛋白的数量调整至平行线,以形成微流体通道。使用根据第一蛋白的数量的抗体,将微流体通道固定在基板上。通过第二蛋白的数量在垂直线上形成通道。可以使用双层结构,第二个微流体通道可堆叠在用作交叉反应点的第一个微流体通道的顶部。可选地,可在安装第二个微流通道之后,以可连接或可拆开的方式施加第一个微流体通道。根据本方法,由于独立反应腔中的独立反应,可分析相互作用的模式。图9是相互作用分析方法的示意图,并且图10显示了基于荧光信号,分析第一蛋白-第二蛋白之间的相互作用。红色信号表示活化程度最强的蛋白之间的结合。通过本发明,可以确认从各个患者提取的细胞或组织中活化的特定信号通路(特定蛋白之间的结合),因此,能提前预测各个患者对药物的耐性并且通过选择能够获得最佳治疗效果的靶向药品,使个性化治疗成为可能。
进一步,常规的基因分析是侧重于细胞信号转导上的节点(node),而本发明则注重连接节点的线。一个节段可拥有多个节点,一个上游蛋白可与多个下游蛋白关联,一个下游蛋白可与很多上游蛋白关联。本发明可以全方位地观察一个上游蛋白在细胞信号通路中如何会聚和分支。
根据发明的另一方面,本发明提供了选择个性化药品的方法,其包括下述步骤:
(a)通过上面提到的方法,分析从受试者分离的细胞或组织中信号通路的活化状态;以及
(b)检索靶向在步骤(a)中确认的活化的信号通路药品,选择检索到的药品作为个性化药品。
上面已经阐释了使用分析从上面提到的受试者中分离的细胞或组织中的信号通路的活化状态的方法的步骤(a)。
在步骤(b)中,基于步骤(a)的分析结果检索靶向活化的信号通路的药品。例如,在使用各种第一蛋白和各种第二蛋白进行分析从上面提到的受试者中分离的细胞或组织中的信号通路的活化状态的方法之后,确认了从受试者中分离的细胞或组织中活化的特定信号通路或特定蛋白之间的结合。然后检索靶向确认的信号通路或蛋白的药品,并且可将该药品选择作为个性化药品。
例如,就步骤(b)中选择个性化药品的方法而言,在从已知靶向步骤(a)中确认的活化的信号通路药品中选择个性化药品,或测试品在步骤(a)中确认的信号通路被活化的细胞系或组织中被处理之后,通过验证测试品是否抑制信号通路的活化,或候选药物是否抑制细胞系或组织的生长等的筛选过程,选择个性化药品。测试品可以使用低分子量化合物、高分子量化合物、核酸分子(例如DNA、RNA、PNA以及适配体)、蛋白、糖、脂质和天然物质等。
根据本发明的示例性实施方式,药品是抗癌剂。
根据本发明的另一方面,本发明提供了预测药品的治疗效果的方法,其包括下述步骤:
(a)通过使用上面提到的方法分析从要预测药品的治疗效果的人中分离的细胞或组织中的信号通路的活化状态;以及
(b)基于在步骤(a)中确认的有关信号通路的活化状态的分析信息,预测靶向信号通路的药品的治疗效果。
在步骤(a)中,从预测的人分离细胞或组织之后,分析分离的细胞或组织中的信号通路的活化状态。上面已经描述了步骤(a)中分析信号通路的活化状态的方法,而不再进一步阐释。
例如,在治疗癌症时,经常使用靶向特定信号通路(如,EGFR通路、HER2通路等)的抗癌剂进行治疗。但是,每个人被抗癌剂靶向的信号通路的活化程度不同,尤其,当抗癌剂靶向的信号通路处于失活状态,或活化程度较低时,难以从抗癌剂得到治疗效果。因此,在施用抗癌剂之前预测对抗癌剂的治疗效果并且选择适当的治疗方法和药物是重要的。利用本发明的方法,可提前预测抗癌剂的治疗效果。
在步骤(b)中,基于有关信号通路的活化状态分析信息,预测靶向信号通路的治疗剂的治疗效果。在下面的实验例6中,确认了每个癌细胞系的信号通路的活化程度有差异,并且靶向信号通路的抗癌剂的敏感性也有差异。通过这些结果,确认了基于根据本发明的方法分析的信号通路的活化信息,可提前预测靶向信号通路的靶向抗癌剂对受试者的治疗效果。
根据本发明的示例性实施方式,药品是抗癌剂,并且抗癌剂是靶向特定信号通路的靶向抗癌剂。
有益效果
下面总结了本发明的特点以及优点:
(i)本发明涉及分析从受试者中分离的细胞或组织中的信号通路的活化状态的方法,以及利用此方法选择个性化药品或预测对药品的治疗效果的方法。
(ii)本发明的方法是个性化诊断以及药品治疗的新方法,并且可分析靶向药品如何影响信号通路以及患者。
(iii)本发明通过分析特定疾病的信号如何会聚及分支,不仅能全方面地理解信号通路,而且通过确认在整个信号网络中哪个信号出现歪曲,而用作开发个性化药品的平台。最近出现了癌组织对靶向抗癌剂的耐性问题,但是预期,通过本平台可预测到耐性,并且设计针对耐性的二线药品,以大大降低癌症的复发。
附图说明
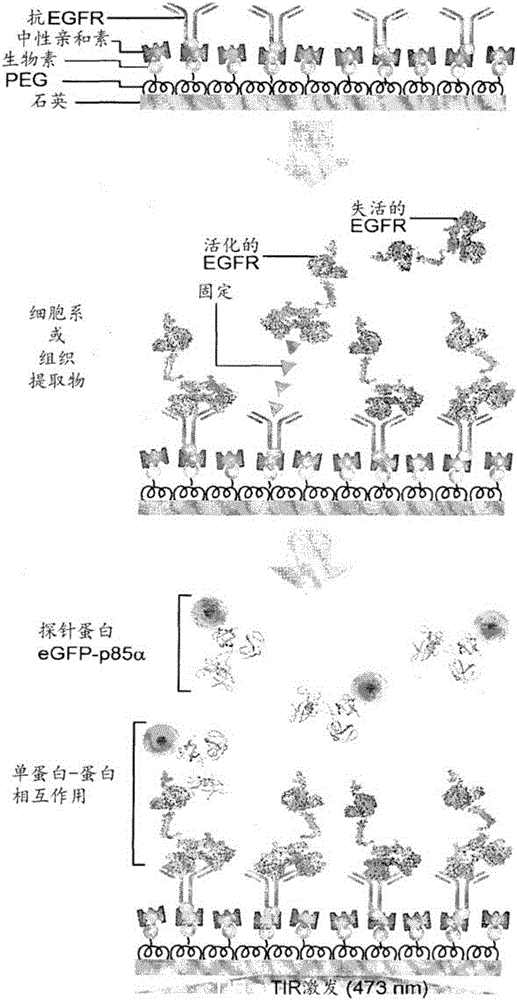
图1示出了在以下实验例中使用的实验是示意图。
图2示出了在以下实施例中使用的观测系统的构造图。
图3示出了对单分子荧光分子的观测以及定量化的结果。
图4示出了EGFR与其下游蛋白以及探针蛋白之间的替换而产生的荧光信号强度。
图5示出了活化的EGFR与失活的EGFR的荧光信号强度。
图6示出了在12种肺癌细胞系中EGFR和ρ85α之间的相互作用程度。
图7示出了基于各个细胞系中EGFR与其下游蛋白之间的相互作用程度的相对强度。
图8示出了来自同一患者的癌组织和正常组织中EGFR的活化程度。
图9示出了靶蛋白(第一蛋白)和候选蛋白(第二蛋白)之间的结合图。
图10示出了利用图9的方法测定的信号通路的荧光信号。
图11示出了各个乳腺癌细胞系中HER2和其下游蛋白之间以及HER3和其下游蛋白之间的相互作用程度的相对强度。
图12示出了基于各个肺癌细胞系中HGFR(c-MET)与其下游蛋白之间的相互作用程度的相对强度。
图13a示出了基于各个细胞系中EGFR和其下游蛋白之间、HGFR和其下游蛋白之间,以及HER2和其下游蛋白之间的相互作用程度的相对强度。
图13b示出了各个细胞系对作为EGFR靶向抗癌剂的吉非替尼(Gefitinib)的反应性。
图13c综合示出了与图13a示出的EGFR的Grb2的相互作用程度和图13b测定的各个细胞系对靶向抗癌剂的敏感性。
具体实施方式
下面通过实施例更加详细地阐释本发明。这些实施例仅仅为了更加详细地描述本发明,对本领域技术人员显而易见,本发明的范围并不局限于这些实施例。
实施例
实施例1.提取物缓冲液的制备
将150mM NaCl、1mM EDTA和l%(vol/vol)Triton100溶于蒸馏水中,以制备裂解缓冲液。制备2倍浓缩的原料缓冲液,储存在4℃冰箱中。制备细胞提取物之前,利用2倍浓缩的原料缓冲液以所述的最终浓度稀释裂解缓冲液。此时,分别添加蛋白酶抑制剂(Sigma P8340,Sigma)和磷酸酶抑制剂(P5726,Sigma),抑制细胞提取物中存在的蛋白酶和磷酸酶的功能。对每5mg/ml的细胞提取物的各抑制剂以1:100的浓度稀释。确定提取物的量,从而细胞系提取物或组织提取物的最终浓度为5mg/ml至10mg/ml。一般,将5×106个细胞溶解在200μl的裂解缓冲液中时,能制备约6mg/ml至10mg/ml的总蛋白量,并且将20mg的人肺组织溶解在1ml的裂解缓冲液中时,能制备10mg/ml至13mg/ml的总蛋白量。
实施例2.靶蛋白(第一蛋白)的制备
靶蛋白是指通过本发明分析特性的靶蛋白。在下述实验例中,作为致癌蛋白之一的EGFR、HER2、HER3或HGFR用作靶蛋白。直接从细胞系或实际患者的组织样品中提取使用没有经过荧光标记或利用Tag的提纯等过程的天然蛋白。为了从细胞系制备靶蛋白,重复进行将实施例1中制备的适量裂解缓冲液加入细胞系中,并且通过100-200μl的吸液管均匀释放聚集的细胞系的过程。所有反应在冰块上进行。然后,将制备的样品在冰上溶解30分钟。为了从组织中制备靶蛋白,利用手术刀将组织剪成小块,通过增加组织和裂解缓冲液接触面积使细胞容易裂解。这里,加入适量的裂解缓冲液,并且利用1ml吸液管混匀释放。然后,利用机械匀浆器(IKA,cat.No.3737000)将组织磨碎。反应30分钟后,将组织在10,000g×下4℃下保持10分钟,离心分离。去除沉淀的部分(pellet),只取溶液部分。此溶液部分包括要观察的靶蛋白和其它蛋白。然后,在进行所有实验期间,将提取物储存在冰中,以最稳定的状态储存蛋白。利用DC蛋白定量检测试剂盒(Bio-Rad,#500-0111)或蛋白定量试剂盒测定细胞或组织的提取物中的蛋白总量。
实施例3.探针蛋白(第二蛋白)的制备
探针蛋白使用与靶蛋白相互作用的伴侣蛋白作为荧光标记的蛋白。将整个探针蛋白(全长ORF)或预定结构域加入具有好的荧光特性的eGFP载体(pEGFP-C1载体,Clontech),以制备eGFP-探针蛋白形式的质粒。将质粒通过电穿孔方法注入HEK293细胞中,使探针蛋白表达,并且接着获取细胞,存储在-80℃下。制备探针蛋白的过程与实施例2中制备靶蛋白的过程相同。但是,因为探针蛋白附着有eGFP,因此,为了测定表达的探针蛋白的量,需利用荧光强度测定仪(Fluorometer;Perkin Elmer Enspire2300)检测表达的荧光蛋白的量,来定量包括了多少探针蛋白。
实施例4.靶蛋白的固定
利用全内反射荧光显微镜(TIRFM)进行了测量。为此,在由石英载玻片制作的基板上涂布用于捕获的聚乙二醇(PEG)以及生物素-PEG。为了洗涤,将在基板上形成的腔室用200μl的PBS连续洗涤两次,并且在每个腔室中分别注入50μl的中性亲和素(neutravidin)。将该中性亲和素蛋白通过结合基板表面上的生物素而附着至表面。使中性亲和素蛋白在室温下反应5分钟后,接着用上述方法洗涤。将针对靶蛋白的抗体(对于EGFP,EGFR Ab-10,克隆111.6生物素标记的鼠单克隆抗体;Thermo Scientific,#MS-378-B)注入在基板上并固定。之后,将包含靶蛋白的提取物(细胞提取物或组织提取物)注入至基板(浓度范围:0.1mg/ml至10mg/ml;反应时间;至少10分钟至30分钟)。然后,利用200μl的PBS连续洗涤2次(图1)。
实施例5.探针蛋白的注入及检测
将包含荧光标记的探针蛋白的细胞提取物注入至固定有适当浓度的实施例4的靶蛋白的基板上。在利用全内反射荧光显微镜的情况下,50nM eGFP是能正常观测的阈值浓度值。阈值浓度值可根据光学观测设备及基板的形式而改变(图1的最后步骤)。然后,利用全内反射显微镜观察基板。为了观测蛋白的相互作用,利用50ms的曝光时间测定短时间内发生的信号。图2是包括基板、显微镜以及分析程序的观测系统的构造图。
将注入探针蛋白的基板利用荧光显微镜实时记录约5秒(0.05秒曝光时间,100帧)。利用单分子荧光蛋白观测算法观测在预定帧上与表面的靶蛋白结合的探针蛋白的数量。一般而言,平均3至10帧产生一个图像,并且通过分析这图像测定单分子信号的数量。在测定帧数的过程中,首先通过实时分析单分子蛋白的相互作用,分析两个蛋白的相互作用的动力学(图3的第一张图)。当测量了两个蛋白多长时间结合或多长时间彼此分离时,就测定了平均帧数。在该实验中,5帧(250ms)测定为最适合的平均帧数(图3的第二张图),以25帧单位为准计算。例如通过平均1至5帧,之后25至29帧、50至54帧、75至79帧,总共形成4个数据点。
找到了最合适的平均帧的起点。这是基于表示阳性对照组(固定有靶蛋白的表面)和阴性对照组(只固定有一级抗体的表面)之间最大的差异的点进行的。从最合适的时间,测定第75帧(图3的第三张图)。在一个腔室中移动位置收集5个数据,以通过计算总平均值和标准偏差制作一个数据。改变靶蛋白的提取物的浓度,重复上述的过程,以比较各种样品中靶蛋白的活化程度。
实施例6.探针蛋白的替换
本发明的优点在于在一个制备的基板上能简单地施加各种探针蛋白(第二蛋白)。如EGFR蛋白具有各种下游信号通路,因此,测定多个信号通路对于确定生物信息传递的起到重要的作用。此外,靶蛋白只要制备一次即可,因此,具有可以使用少量细胞提取物或组织提取物的优点。下面详述探针蛋白的替换过程。一个探针蛋白的测定结束后,通过洗涤过程去除腔室中残留的蛋白,然后,注入其他探针蛋白,重复前面的测定过程。
一方面,检查前面的探针蛋白是否妨碍下一个探针蛋白的观测的结果。当引入下一个探针蛋白时,残留的第一个探针蛋白也已经通过竞争结合被分离(图4的最后一张图)。结果显示,通过仅替换探针蛋白,也可以在短时间内测定一个靶蛋白和多个探针蛋白。
实验例1.EGFR的活化状态分析
在本发明中,使用归类为最常见致癌膜蛋白中受体酪氨酸激酶(RTK)的表皮生长因子(EGFR),以研究实验的适用性,并且收集实际数据。根据上述方法进行实验过程。
使用表达正常的EGFR称为肺癌细胞系的NCI-H1666细胞系。EGFR是被称为EGF的配体磷酸化,以与下游信号蛋白相互作用。在本实验中,使用通过eGFP与ρ85α结合形成的eGFP-ρ85α作为探针蛋白,ρ85α是EGFR的代表性的下游信号蛋白磷酸肌醇(3-激酶(PI3K)的子单元。首先,将H1666细胞系分两组培养。通过无血清培养基将H1666细胞系饥饿24小时。此时,因为培养基没有营养,细胞停止生长,已知EGFR处在未磷酸化的状态。然后,用100ng/ml的EGF对一组细胞处理3分钟。这是对EGFR赋予活化信号的外部因素,使EGFR变成磷酸化状态。收集两个组的细胞系之后,观察两个细胞系的EGFR状态。
如图5所示,在具有磷酸化EGFR的细胞系中,图表的斜率陡,但是在失活的细胞系中,过程到了相对平缓的斜率(图5)。结果显示,通过本发明测定的斜率值可作为细胞中多少靶蛋白被活化的指标。
实验例2.利用ρ85α分析各种非小细胞肺癌细胞系的EGFR的活化程度
利用eGFP-ρ85α探测蛋白对总共12个非小细胞肺癌(NSCLC)细胞系(从American Type Culture Collection获得H1975、H1650、HCC827、H4006、H358、H1666、H2291及A549;从延世大学附属医院(Yonsei University Hospital)获得的HCC827-GR、H4006-ER、PC9及PC-GR)的EGFR的状态。大体上,EGFR通常通过外显子19缺失突变或外显子21点突变(L858R)始终以活化形态存在并导致癌症。本实验中使用的12个细胞系中H1975、H1650、HCC827、HCC827-GR、H4006、H4006-ER、PC9及PC9-GR是具有EGFR突变的癌细胞系,而其他4个细胞系是具有正常EGFR的癌细胞系。
按照上述的方法测定EGFR和ρ85α之间的反应性,以定量各个细胞系的EGFR的状态。测定了H4006(外显子19缺失)、H1975(外显子21突变)以及H2291(正常EGFR)细胞系的反应性,并且呈现在图中。如图6中的上图所示,确认了与具有正常EGFR的H2291细胞系相比,具有突变的EGFR的其他两个细胞系中EGFR的活化程度更高。此外,可看到H4006和H1975之间也存在着差异。
就12个NSCLC癌细胞系而言,测定EGFR的活化程度并且由热图表示。如图6的下图所示,将在H1975细胞系产生的信号归一化为“1”,并且获得剩下细胞系的信号强度的相对值。
在本发明中,可测量作为一种RTK的EGFR和作为其下游蛋白的ρ85α之间的相互作用的强度。此外,当选出合适的抗体时,除了EGFR外,本发明还可用于各种RTK,以测量各个细胞系中产生的靶蛋白的信号以及靶蛋白和探针蛋白之间的相互作用的程度。
实验例3.利用4种EGFR下游蛋白分析非小细胞肺癌细胞系的EGFR活化程度
通过采用实验例2中定量的信号强度利用多个探针蛋白分析EGFR的相对信号强度。如图7所示,观察到了从EGFR开始的各种信号通路对各个细胞系的作用,以及比较各个细胞系。结果确认了本发明有助于选择靶向特定的信号通路的抗癌剂。类似地,图7示出基于H1975细胞系,测量各个细胞系的相对信号值的结果。
实验例4.人癌症组织的特征分析
通过使用上面所述的所有方法确认了人癌症组织(肺癌)和正常组织之间的差异。肺癌组织是从乙支大学医院(Eulji University Hospital)获得的。通过使用10mg的组织提取物进行实验。通过利用本发明并且相对于H1975进行比较,测定了癌症组织和正常组织中EGFR的活化程度的差异。
如图8的下端所示,可以确认癌症组织和正常组织中EGFR的活化程度有很大的差异。该结果确认了,通过检查从各个患者提取的未知组织,并且验证活化的具体信号通路,可以为每个患者提供适当的治疗。
实验例5.各种RTK的活化状态分析
为了证明本发明还可以适用于除了上述实验例中的EGFR以外的其他RTK,对HER2、HER3以及HGFR(c-MET)进行了实验。使用Grb2、PLCγ以及ρ85α作为靶蛋白HER2和HGFR的探针蛋白,并且使用ρ85α作为HER3靶蛋白的探针蛋白。
对HER2/HER3而言,测定总共10个乳腺癌细胞系(从American Type Culture Collection获得的SKBR3、T47D、MDAMB231、MDAMB453、H1419、H1954及MCF7;从首尔大学附属医院获得的SKBR3LR9、SKBR3HR30及SNU21)中HER2和HER3的活化程度,并且用热图表示(图11)。图11是将在SKBR3细胞系测定的信号归一化为1后,用相对值表示剩下的细胞系的信号强度的结果。
对于HGFR而言,测定了总共15个NSCLC细胞系(从American Type Culture Collection获得的HCC827、H4006、H1650、H1975、H358、H1666、H2291及A549;从延世大学附属医院(Yonsei University Hospital)获得的PC9、HCC827-GR#13、H4006-ER、YU-01、YU-06、HCC827-GR#5及PC-GR)的活化程度,类似地,将HCC826的细胞系归一化为1后,用相对值表示剩下的细胞系的信号强度(图12)。
图11和图12的结果表示本发明并不局限于特定的RTK,也适用于包括RTK的所有受体。
实验例6.蛋白-蛋白相互作用(PPI)和药物反应相关关系的分析
利用本方法对总共15个NSCLC细胞系分析了蛋白-蛋白相互作用(PPL)和对作为EGFR靶向抗癌剂的吉非替尼的反应性之间的相关关系。图13c综合示出了图13a示出的EGFR和Grb2之间的相互作用程度和图13b中测定的各个细胞系对靶向抗癌剂的敏感性。图13c的横轴表示EGFR的信号往右侧逐渐增加,纵轴表示靶向抗癌剂的敏感性往上侧逐渐增加。
图13c显示了测定的EGFR的信号强度与对靶向抗癌剂的敏感性呈正相关。结果显示,针对未知的检查样品,通过利用本发明测定靶向抗癌剂针对的信号通路的活化程度,以提前预测对靶向抗癌剂的敏感性。
尽管已经详细描述了本发明的具体部分,但是对本领域的技术人员显而易见,这些具体的说明只是优选的实施方式而已,并不限制本发明的范围。因此,本发明的范围应由所附的权利要求以及其等同范围来限定。
- 还没有人留言评论。精彩留言会获得点赞!