一种快速生长微藻藻株高通量筛选系统和方法与流程
本发明属于生物技术领域,具体的说是一种基于凝胶液滴微流控技术中液滴微流控技术的单细胞水平快速生长微藻藻株的高通量筛选系统和方法。
背景技术:
微藻是一类古老的低等植物,广泛地分布在海洋、淡水湖泊等水域,可直接利用阳光、二氧化碳和含氮、磷等元素的简单营养物质快速生长。微藻细胞中含有多种高价值的营养成分和化工原料,细胞代谢产生的多糖、蛋白质、色素等,在医药工业、食品工业、动物饲料、环境检测及净化、生物技术以及可再生能源制造等方面有广泛应用。藻类养殖是人工控制下藻类繁殖、生长的生产过程,筛选出快速生长微藻藻株对于降低养殖成本、提高培养效率具有重大意义。
传统筛选方法多采用测序、PCR或是有特定响应机制的方法来进行藻株筛选,费时费力,既无法高效快速地获取单细胞,也不能对有特定表型藻株进行精确的高通量分离。发展单细胞水平快速生长微藻藻株的高通量筛选方法可以解决上述问题。微流控系统为其提供了强有力的技术支撑,其灵活、高通量、准确度高的操作检测系统为微藻藻株的高通量筛选提供了简单易操作的解决方案。
技术实现要素:
针对现有技术中存在的上述不足之处,本发明要解决的技术问题是提供一种基于凝胶液滴微流控技术的单细胞水平快速生长微藻藻株的高通量筛选系统和方法,为目前微藻生长表型筛选周期长、难于分离的技术瓶颈提供了解决方案。
本发明为实现上述目的所采用的技术方案是:一种快速生长微藻藻株高通量筛选系统,包括:
单分散单细胞包裹单元,用于驱动含分散于凝胶培养基中的细胞/颗粒在其 中的凝胶液滴单细胞包裹芯片中流动,通过含表面活性剂的油相剪切作用使分散相细胞液被挤压形成单分散单细胞液滴,并通过微管导出凝胶液滴于EP管并冷凝成单细胞凝胶微球;
中间处理单元,用于对单细胞凝胶微球进行增殖,并经浓缩使单细胞凝胶微球在显微镜观察下呈堆叠状态,将浓缩后的单细胞凝胶微球分散于黄原胶中;
再注入分选单元,用于对所需突变体进行筛选分离。
所述单分散单细胞包裹单元包括:
第一微量进样器,为两个,其中一个用于驱动含凝胶的培养液形成的分散相液体,另一个用于驱动油相和表面活性剂混合形成的连续相液体,通过微管分别连接凝胶液滴单细胞包裹芯片的两个入口;
凝胶液滴单细胞包裹芯片,用于通过其中的微通道生成微藻凝胶构成的单分散单细胞液滴;
EP管,通过微管将凝胶液滴单细胞包裹芯片出口的单分散单细胞液滴导入到EP管中;
冰水浴,用于对置于其中的EP管进行冷凝处理。
所述凝胶液滴单细胞包裹芯片由上下两层PDMS基片键合而成,内部包括宽100~200um,深30~70um的微通道网络,该微通道网络的入口包括含表面活性剂的油相进样口和含凝胶培养基的藻液进样口,含表面活性剂的油相进样口连通一个环状通道,并在所述环状通道的另一端与含凝胶培养基的藻液进样口所连通的通道汇合于单细胞单分散液滴包裹产生通道,并引出一条通道连通道收集出口。
所述再注入分选单元包括:
第二微量进样器,为三个,其中一个用于驱动分散相的分散于黄原胶中的单细胞凝胶微球,第二个用于驱动连续相的PBST,第三个用于驱动连续相的侧流PBST,通过微管分别连接再注入分选微流控芯片的三个入口;
再注入分选微流控芯片,用于通过其中的微通道收集凝胶微球;
电磁阀,连接再注入分选微流控芯片,用于在再注入分选微流控芯片的微通道中产生瞬时吸力;
图像采集单元,用于筛选过程的图像采集。
所述再注入分选微流控芯片由上下两层PDMS基片键合而成,内部包括宽100~150um,深80~150um的微通道网络,该微通道网络的入口包括PBST水相进样口、增殖后凝胶微球进样口和侧流水相入口,PBST水相进样口连通一个环状通道,并在所述环状通道的另一端与增殖后凝胶微球进样口所连通的通道汇合,汇合后引出的通道与分选通道连通,分选通道还连通侧流水相入口、电磁阀连通通道、废液口和收集通道口,所述电磁阀连通通道用于在电电磁阀开启的瞬间使凝胶微球在吸力的作用下流向收集通道,所述废液口和收集通道口所在的通道之间有细小的连通通道。
一种快速生长微藻藻株高通量筛选方法,包括以下步骤:
单细胞凝胶液滴包裹生成阶段:通过第一微量进样器将含凝胶的培养液形成的分散相液体,和油相和表面活性剂混合形成的连续相液体驱动到凝胶液滴单细胞包裹芯片中,生成单分散单细胞液滴;
离线收集培养阶段:通过微管使凝胶液滴单细胞包裹芯片的收集出口与置于冰水浴中的EP管连通,使单分散单细胞液滴导出至EP管中;并进行后处理,使处理完毕的凝胶微球重新分散于微藻培养基中,并置于微量培养瓶于恒温培养箱进行培养;
离线培养过程监测阶段:隔时采样,通过随机取样对微量培养瓶中的凝胶微球进行数据采集,并对有微藻细胞增殖的凝胶放大图片进行数据处理,以完成在单细胞水平的微藻生长监测;
凝胶微球的再注入及分选阶段:对收集培养完毕的凝胶微球做中间处理并作为分散相,以PBST作为连续相,通过第二微量进样器的驱动,使凝胶微球和PBST分别注入对应微通道,凝胶微球在连续相作用下在再注入分选微流控芯片的微通道内有序流动,有序流动的凝胶微球经过分选通道时,通过图像采集系 统对凝胶微球进行逐一识别判定,当某凝胶微球为所需生长表型时,开启电磁阀,使凝胶微球在瞬时吸力作用下流向收集通道口。
所述单细胞凝胶液滴包裹生成阶段包括以下步骤:
1)将微藻细胞洗涤,并用含凝胶的培养液调至OD值为0.5~0.8,形成悬浮成液分散相,油相和表面活性剂混合形成连续相;
2)将分散相液体驱动到经含凝胶培养基的藻液进样口,将连续相液体驱动到含表面活性剂的油相进样口,在凝胶液滴单细胞包裹芯片中的微通道中,连续生成微藻凝胶微液滴,部分液滴中包裹不超过一个微生物细胞;
3)通过凝胶液滴单细胞包裹芯片流体聚焦结构剪切形成单分散单细胞液滴。
所述后处理具体为:从单细胞单分散包裹芯片收集出的凝胶微球用冰水浴进行固化1-3小时,固化完成后,使用细胞过滤器除去凝胶微球外层的油相。
所述中间处理具体为:将收集培养完毕的凝胶微球浓缩至在显微镜下呈堆叠状态的浓度,并混悬于黄原胶中。
所述分选通道连通侧流水相口,在侧流水相作用下,默认分选通道中的液体流向废液通道。
本发明具有以下优点及有益效果:
1.本发明所构建的基于凝胶液滴的微藻藻株生长表型筛选方法有效地结合了基于液滴单细胞增殖的高准确性和其他检测筛选方法的高效率特点,为微藻筛选的高效、高准确率提供了系统和方法。
2.本发明通过凝胶液滴细胞包裹的方法,快速高通量地获取了单细胞,可很好地解决传统方法极难获取单细胞水平分析的技术瓶颈。
3.本发明基于电磁阀的分选系统操作简便、准确度高、耗时少,可以很好地满足特定表型藻株的筛选,尤其对于突变率较低的菌株,此系统和方法更为适用。
附图说明
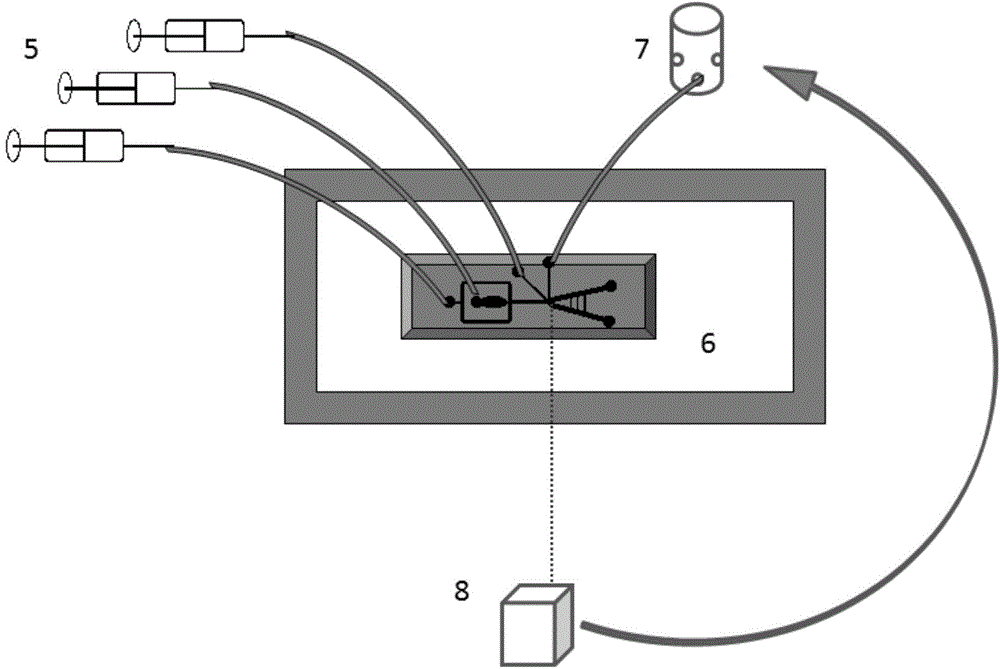
图1为单细胞水平快速生长微藻藻株高通量筛选系统组成图;
其中图A为单分散单细胞包裹单元,包括:1、第一微量进样器;2、凝胶液滴单细胞包裹芯片;3、EP管;4、冰水浴;
图B为再注入分选单元,包括:5、第二微量进样器;6、再注入分选微流控芯片;7、电磁阀;8、图像采集单元;
图2为凝胶液滴单细胞包裹芯片设计示意图;
其中,9、含表面活性剂的油相进样口;10、含凝胶培养基的藻液进样口;11、单细胞单分散液滴包裹产生通道;12、收集出口;
图3为再注入分选微流控芯片设计示意图;
其中,13、PBST水相进样口;14、增殖后凝胶微球进样口;15、侧流水相口入口;16、电磁阀连通通道;17、分选通道;18、废液口;19、收集通道口。
具体实施方式
下面结合附图及实施例对本发明做进一步的详细说明。
如图1所示,本实例所构建的基于液滴凝胶技术的雨生红球藻单细胞快速生长微藻藻株的高通量筛选系统和方法,该系统包括单分散单细胞包裹单元A和再注入分选单元B。单分散单细胞包裹单元A用于驱动含分散于凝胶培养基中的细胞/颗粒在其中的凝胶液滴单细胞包裹芯片2中流动,通过含表面活性剂的油相剪切作用使分散相细胞液被挤压形成单分散单细胞液滴,并通过微管导出凝胶液滴于EP管3并冷凝成单细胞凝胶微球。再注入分选单元B,用于对所需突变体进行筛选分离。在单分散单细胞包裹单元A和再注入分选单元B之间还包括中间处理单元,采用常规实验设备对单细胞凝胶微球进行增殖,并经浓缩使单细胞凝胶微球在显微镜观察下呈堆叠状态,将浓缩后的单细胞凝胶微球分散于黄原胶中。
单分散单细胞包裹单元A包括:第一微量进样器1,为两个,其中一个用 于驱动含凝胶的培养液形成的分散相液体,另一个用于驱动油相和表面活性剂混合形成的连续相液体,通过微管分别连接凝胶液滴单细胞包裹芯片2的两个入口;凝胶液滴单细胞包裹芯片2,用于通过其中的微通道生成微藻凝胶构成的单分散单细胞液滴;EP管3,通过微管将凝胶液滴单细胞包裹芯片2出口的单分散单细胞液滴导入到EP管3中;冰水浴4,用于对置于其中的EP管3进行冷凝处理。
所述再注入分选单元B包括:第二微量进样器5,为三个,其中一个用于驱动分散相的分散于黄原胶中的单细胞凝胶微球,第二个用于驱动连续相的PBST,第三个用于驱动连续相的侧流PBST,通过微管分别连接再注入分选微流控芯片6的三个入口。再注入分选微流控芯片6,用于通过其中的微通道收集凝胶微球。电磁阀7,连接再注入分选微流控芯片6,用于在再注入分选微流控芯片6的微通道中产生瞬时吸力。图像采集单元8,用于筛选过程的图像采集,可采用高速CCD或在实验中采用显微镜。
如图2所示,凝胶液滴单细胞包裹芯片2由上下两层PDMS基片键合而成,上层包括宽100~200um,深30~70um的微通道网络,下层为PDMS基片。上下基片清洗后使用等离子体进行键合。该微通道网络的入口包括含表面活性剂的油相进样口9和含凝胶培养基的藻液进样口10,含表面活性剂的油相进样口9连通一个环状通道,并在所述环状通道的另一端与含凝胶培养基的藻液进样口10所连通的通道汇合于单细胞单分散液滴包裹产生通道11,并引出一条通道连通道收集出口12。样品进行微生物富集预处理等后形成150μL悬浮液(其中含有培养基、液态凝胶、雨生红球藻微藻细胞)。油相加入适当浓度的表面活性剂,以两台微量进样泵作为驱动力,分别使其分别进入凝胶液滴单细胞包裹芯片2的微通道网络。流体在闭合的微通道网络内进行有序流动,形成单分散微生物细胞包裹液滴,并通过微管收集到置于冰水浴4的EP管3中,经一系列后处理,重新分散在培养基中控温培养,间隔时间采样,用随机取样的方法,对微量培养瓶中的凝胶微球进行取样,通过倒置显微镜的明场对样品进行放大采集图像, 再用图像处理软件对图像进一步处理,并对有雨生红球藻增殖的凝胶进行监测,据此完成单细胞雨生红球藻的生长机理监测。
增殖一段时间后的凝胶微球经再注入分选单元分离。如图3所示,再注入分选微流控芯片(6)由上下两层PDMS基片键合而成,上层包括宽100~150um,深80~150um的微通道网络,下层为PDMS基片,上下基片清洗后使用等离子体进行键合。该微通道网络的入口包括PBST水相进样口13、增殖后凝胶微球进样口14和侧流水相入口15,PBST水相进样口13连通一个环状通道,并在所述环状通道的另一端与增殖后凝胶微球进样口14所连通的通道汇合,汇合后引出的通道与分选通道17连通,分选通道17还连通侧流水相入口15、电磁阀连通通道16、废液口18和收集通道口19,所述电磁阀连通通道16用于在电电磁阀7开启的瞬间使凝胶微球在吸力的作用下流向收集通道19,所述废液口18和收集通道口19所在的通道之间有细小的连通通道。
为使亲水流体能更好地在微通道流动,使用之前采用亲水试剂对其进行亲水化处理。增至一段时间后的凝胶微球经浓缩,重新分散于黄原胶中,分散相加入适当浓度的PBST,侧流流体同样采用PBST,通过三台注射泵以适当速率比,使凝胶微球默认向废液通道流动,并接入电磁阀。当凝胶微球中单细胞雨生红球藻增殖速率超过某一阈值,即可判定为所需表型藻株,此时开启电磁阀,该凝胶微球在电磁阀的瞬间吸力作用下进入收集通道。
本发明方法,包括以下步骤:
单细胞凝胶液滴包裹生成阶段:通过第一微量进样器1将含凝胶的培养液形成的分散相液体,和油相和表面活性剂混合形成的连续相液体驱动到凝胶液滴单细胞包裹芯片2中,生成单分散单细胞液滴;
离线收集培养阶段:通过微管使凝胶液滴单细胞包裹芯片2的收集出口12与置于冰水浴4中的EP管3连通,使单分散单细胞液滴导出至EP管3中;并进行后处理,使处理完毕的凝胶微球重新分散于微藻培养基中,并置于微量培养瓶于恒温培养箱进行培养;
离线培养过程监测阶段:隔时采样,通过随机取样对微量培养瓶中的凝胶微球进行数据采集,并对有微藻细胞增殖的凝胶放大图片进行数据处理,以完成在单细胞水平的微藻生长监测;
凝胶微球的再注入及分选阶段:对收集培养完毕的凝胶微球做中间处理并作为分散相,以PBST作为连续相,通过第二微量进样器5的驱动,使凝胶微球和PBST分别注入对应微通道,凝胶微球在连续相作用下在再注入分选微流控芯片6的微通道内有序流动,有序流动的凝胶微球经过分选通道17时,通过图像采集系统8对凝胶微球进行逐一识别判定,当某凝胶微球为所需生长表型时,开启电磁阀7,使凝胶微球在瞬时吸力作用下流向收集通道口19。
所述单细胞凝胶液滴包裹生成阶段包括以下步骤:
1)将微藻细胞洗涤,并用含凝胶的培养液调至OD值为0.5~0.8,形成悬浮成液分散相,油相和表面活性剂混合形成连续相;
2)将分散相液体驱动到经含凝胶培养基的藻液进样口10,将连续相液体驱动到含表面活性剂的油相进样口9,在凝胶液滴单细胞包裹芯片2中的微通道中,连续生成微藻凝胶微液滴,部分液滴中包裹不超过一个微生物细胞;
3)通过凝胶液滴单细胞包裹芯片2流体聚焦结构剪切形成单分散单细胞液滴。
所述后处理具体为:从单细胞单分散包裹芯片收集出的凝胶微球用冰水浴进行固化1-3小时,优选2小时,固化完成后,使用细胞过滤器除去凝胶微球外层的油相。
所述中间处理具体为:将收集培养完毕的凝胶微球浓缩至在显微镜下呈堆叠状态的浓度,并混悬于黄原胶中。
所述分选通道17连通侧流水相口15,在侧流水相作用下,默认分选通道17中的液体流向废液通道18。
- 还没有人留言评论。精彩留言会获得点赞!