检测Vero细胞DNA的引物及方法与流程
本发明涉及生物检测领域。具体地说,本发明涉及Vero细胞DNA的检测引物及方法。
背景技术:
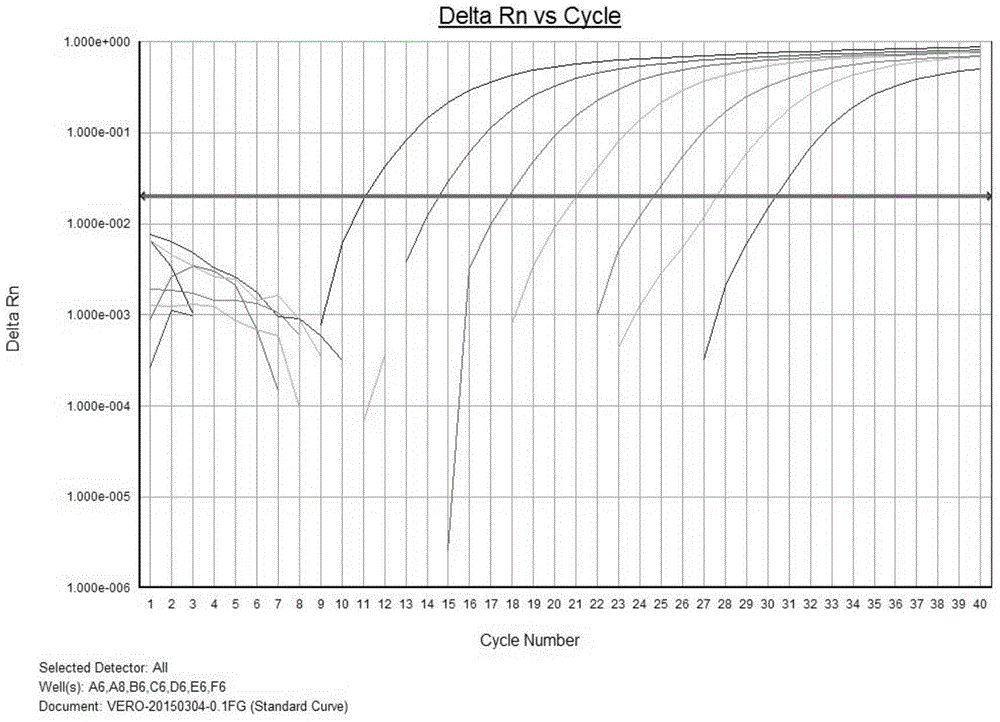
:Vero细胞是从非洲绿猴(CercopithecusAethiops)的肾脏上皮细胞中分离培养出来的非洲绿猴肾细胞,其是一种异倍体细胞,经猕猴肾细胞培养衍化后产生的,和著名的Hela细胞系、犬肾细胞(MDCK细胞)一样是常用的细胞系。Vero细胞用途十分广泛,可以:1.用于检查大肠杆菌毒素;2.作为培养病毒的细胞宿主;3.作为真核寄生虫的宿主细胞,尤其是锥体虫属。Vero细胞属于传代细胞系,易于培养,适合大规模生产,为WHO推荐的人用疫苗细胞基质之一。作为传代细胞系,以Vero细胞为基质生产疫苗的风险在于细胞残余DNA具有潜在的致瘤性。因此,建立准确定量制品中Vero细胞残留量的方法对于疫苗的安全性和质量控制至关重要。目前,WHO推荐的标准是每剂量制品中的终DNA含量必须小于10ng;美国FDA建议使用检测灵敏度达到10pg的检测方法检测制品中的DNA水平;而中国药典规定每剂量疫苗中的Vero细胞残留量必须小于100pg。这就要求具备高灵敏度的引物对以及检测试剂来检测Vero细胞DNA。在现有技术一般针对Vero细胞基因组中的一类长的串联重复序列设计引物和探针,所设计的引物对能够具备一定的检测灵敏度,但仅能达到1fg/μ,例如,胡广宏等设计的引物对灵敏度达到30fg/μl(SYBR-Green实时定量PCR用于Vero宿主细胞DNA残留量的检测,中国新药杂志,2012年,第21卷,第10期)和曹守春等(Vero细胞LTR基因的克隆及其DNA定量PCR检测方法的建立,中国生物制品学杂志,2011年,第24卷,第5期)设计的引物对灵敏度达到1fg/μl。然而,由于非洲绿猴与人基因组的同源性较高,现有技术中的引物对对于人来源基因的抗干扰性不强,并且现有技术中引物对的灵敏度也并不能令人满意。综上所述,本领域急需能够检测生物制品中Vero细胞DNA的新引物对和检 测方法,所述引物对和检测方法应具备高特异性、高灵敏度,并且应具备操作简便、标准统一等优点,从而能用于生物制品,特别是疫苗的质量控制。技术实现要素:本发明的目的是提供一种检测生物制品中Vero细胞DNA的引物对以及包含所述引物对的检测体系和检测试剂盒。本发明的另一目的是提供利用本发明的引物对检测生物制品中Vero细胞DNA的方法。在第一方面,本发明提供一种检测Vero细胞基因组DNA的引物对,所述引物对包括正向引物和反向引物,其中所述正向引物和反向引物结合于Vero细胞基因组DNA上SEQIDNO:1所示序列的第15-41位;其中的反向引物结合于SEQIDNO:1所示序列的第92-113位,并且所述引物对所扩增获得的扩增产物的长度为95-105bp。在优选的实施方式中,所述正向引物和反向引物的长度为22-27bp;优选27和22bp。在优选的实施方式中,所述正向引物和反向引物的Tm温度为58-60℃,并且正向引物的Tm与反向引物的Tm的差值的绝对值≤2℃。在具体的实施方式中,所述正向引物如SEQIDNO:2所示,所述反向引物如SEQIDNO:3所示。在第二方面,本发明提供一种检测试剂,所述检测试剂包含本发明第一方面所述的引物对。在具体的实施方式中,所述引物对中的正向引物如SEQIDNO:2所示,所述引物对中的反向引物如SEQIDNO:3所示。在具体的实施方式中,所述检测试剂还包含探针。在优选的实施方式中,所述探针如SEQIDNO:4所示。在优选的实施方式中,所述检测试剂的检测灵敏度为0.1fg/μl。在具体的实施方式中,所述检测试剂包含SEQIDNO:2所示正向引物、SEQIDNO:3所示反向引物、和SEQIDNO:4所示探针。在第三方面,本发明提供一种检测Vero细胞基因组DNA的方法,所述方法 包括:利用本发明第一方面所述的引物对或第二方面所述的检测试剂,对待测样品进行PCR,并检测PCR扩增产物。在第四方面,本发明提供一种PCR试剂盒,所述试剂盒中包括容器以及位于所述容器中的本发明第一方面所述的引物对。在优选的实施方式中,所述正向引物和反向引物的长度为22-27bp;优选27和22bp。在优选的实施方式中,所述正向引物和反向引物的Tm温度为58-60℃,并且正向引物的Tm与反向引物的Tm的差值的绝对值≤2℃。在优选的实施方式中,所述正向引物如SEQIDNO:2所示,所述反向引物如SEQIDNO:3所示。在优选的实施方式中,所述试剂盒中还装有探针。在优选的实施方式中,所述探针如SEQIDNO:4所示。在优选的实施方式中,所述试剂盒中还装有标准品对照。在第五方面,本发明提供一种PCR方法,包括步骤:在一PCR检测体系中,利用本发明第一方面所述的引物对扩增目标产物。在优选的实施方式中,所述正向引物和反向引物的长度为22-27bp;优选27和22bp。在优选的实施方式中,所述正向引物和反向引物的Tm温度为58-60℃,并且正向引物的Tm与反向引物的Tm的差值的绝对值≤2℃。在优选的实施方式中,所述正向引物如SEQIDNO:2所示,所述反向引物如SEQIDNO:3所示。在第六方面,本发明提供本发明第一方面所述的引物对或本发明第二方面所述的检测试剂的用途,用于检测待测对象中是否存在Vero细胞DNA。在优选的实施方式中,所述待测对象是疫苗制品。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示了Vero细胞基因组序列的Blast分析。图2显示了参考品的扩增曲线,其中利用的引物对如SEQIDNO:2和3所示。图3显示了参考品的标准曲线,其中利用的引物对如SEQIDNO:2和3所示。图4显示了以水作为对照的扩增曲线,其中利用的引物对如SEQIDNO:2和3所示。图5显示了以水作为对照的标准曲线,其中利用的引物对如SEQIDNO:2和3所示。图6显示了大肠杆菌DNA干扰实验的扩增曲线,其中利用的引物对如SEQIDNO:2和3所示。图7显示了大肠杆菌DNA干扰实验的标准曲线,其中利用的引物对如SEQIDNO:2和3所示。图8显示了CHODNA干扰实验的扩增曲线,其中利用的引物对如SEQIDNO:2和3所示。图9显示了CHODNA干扰实验的标准曲线,其中利用的引物对如SEQIDNO:2和3所示。图10显示了人DNA干扰实验的扩增曲线,其中利用的引物对如SEQIDNO:2和3所示。图11显示了人DNA干扰实验的标准曲线,其中利用的引物对如SEQIDNO:2和3所示。图12显示了人基因干扰实验的扩增曲线,其中利用的引物对如SEQIDNO:6和7所示。图13显示了人基因干扰实验的解离曲线,其中利用的引物对如SEQIDNO:6和7所示。图14显示了人基因干扰实验的扩增曲线,其中利用的引物对如SEQIDNO:9和10所示。图15显示了人基因干扰实验的解离曲线,其中利用的引物对如SEQIDNO:9和10所示。具体实施方式经过深入而广泛的研究,本发明人出乎意料地发现针对Vero细胞基因组DNA的SEQIDNO:1所示序列设计的引物,不仅能够高度灵敏地检测Vero细胞基因组DNA,还能区分CHO细胞、大肠杆菌细胞,特别是人的干扰性DNA;从而获得兼具灵敏度和特异性的检测Vero细胞基因组DNA的引物对以及检测方法。本发明方法操作简便快捷、特异性和灵敏性高。在此基础上完成了本发明。本发明的引物对本文所用的术语“引物”具有本领域技术人员常规理解的意义。本发明的Vero细胞基因组DNA特异性引物不是针对外源基因本身或病毒载体本身设计,而是针对Vero细胞基因组DNA的SEQIDNO:1所示序列设计的。换言之,本发明的引物可以特异性结合于Vero细胞基因组DNA上的SEQIDNO:1所示序列。鉴于本发明的教导和本领域的公知常识,本领域技术人员应该理解,针对SEQIDNO:1所示序列可以设计多种引物对。因此,本发明的引物对不限于实施例中具体得到的引物对。在具体的实施方式中,本发明的正向引物结合于SEQIDNO:1所示序列的第15-41位;反向引物结合于SEQIDNO:1所示序列的第92-113位,并且所述引物对所扩增获得的扩增产物的长度为95-105bp。在优选的实施方式中,所述正向引物和反向引物的长度为22-27bp;优选27和22bp。在优选的实施方式中,所述正向引物和反向引物的Tm温度为58-60℃,并且正向引物的Tm与反向引物的Tm的差值的绝对值≤2℃。在最优选的实施方式中,本发明的正向引物如SEQIDNO:2所示,反向引物如SEQIDNO:3所示。探针本文所用的术语“引物”具有本领域技术人员常规理解的意义,即,一小段单链DNA或者RNA片段,用于检测与其互补的核酸序列。鉴于本发明的教导和本领域的公知常识,本领域技术人员应该理解,在知晓引物对的前提下,本领域技术人员可以根据正向引物和反向引物结合位点之间的模板序列自主设计探针,并检测该探针与引物对的技术效果。在具体的实施方式中, 本领域普通技术人员可根据需要具体设计探针,所述探针可以处于液相中,也可以固定于固相上;可以在扩增前结合,也可以在扩增后结合。因此,本发明的探针并不限于实施例中具体公开的探针。本发明的引物对也不限于与实施例中具体公开的探针配对使用。在具体的实施方式中,本发明的探针如SEQIDNO:4所示。本发明的检测试剂本发明还提供一种检测Vero细胞基因组DNA的检测试剂,所述检测试剂包含本发明的引物对以及探针等实施PCR所需的其它成分,例如Taq酶、dNTP、Mg2+等等。在具体的实施方式中,本发明的检测试剂包含SEQIDNO:2所示正向引物、SEQIDNO:3所示反向引物、SEQIDNO:4所示探针。在具体的实施方式中,本发明检测试剂的检测灵敏度达到0.1fg/μL。在本发明的引物对或检测试剂的基础上,本发明进一步提供一种检测Vero细胞基因组DNA的方法,所述方法包括:利用本发明的引物对或检测试剂,对待测样品进行PCR,并检测PCR扩增产物。在本发明的引物对的基础上,本发明还提供一种PCR试剂盒,所述试剂盒中包括容器以及位于所述容器中的上述本发明引物对。在具体的实施方式中,本发明的PCR试剂盒还装有用于实施PCR的其它所需成分以及使用该试剂盒作PCR检测的使用说明书。在优选的实施方式中,所述试剂盒中还装有标准品对照。在本发明的引物对的基础上,本发明提供利用本发明的引物对扩增目标产物的PCR方法。本发明的优点包括:1.本发明的引物对或检测试剂能够高度灵敏地检测Vero细胞基因组DNA;2.本发明的引物对或检测试剂能够区分CHO细胞、大肠杆菌,特别是人类干扰性DNA;3.本发明的检测方法操作简便快捷、特异性和灵敏性高。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(ColdSpringHarborLaboratoryPress,2001)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。材料与方法1.DNA检测体系:2xTaqmanmix:含有Taq酶、dNTP、Mg2+、本发明引物及探针等成分。掺加标准品,阴性质控,DNA稀释液2.检测仪器:ABI7500。3.检测过程准备工作:将购买自中国科学院上海生命科学研究院的VERO细胞用takara基因提取试剂盒提取DNA,制成VERO基因组DNA(10ng/μL)做为参考品。用DNA稀释液将VERO基因组DNA参考品梯度稀释成以下7个浓度梯度,分别为100pg/μL,10pg/μL,1pg/μL,100fg/μL,10fg/μL,1fg/μL,0.1fg/μL。NTC为无样本阴性质控(超纯水)。检测体系:20μLTaqmanmix+10μL样品=30μL检测程序:实时荧光定量PCR反应程序优选为:95℃预变性10min;95℃15s,60℃1min,40个循环。实施例1.本发明引物对的设计及其灵敏度检验发明人根据SEQIDNO:1所示序列,设计了以下引物对和探针:正向引物:CTGCTCTGTGTTCTGTTAATTCATCTC(SEQIDNO:2);反向引物:AAATATCCCTTTGCCAATTCCA(SEQIDNO:3);探针:CCTTCAAGAAGCCTTTCGCTAAG(SEQIDNO:4);扩增产物:CTGCTCTGTGTTCTGTTAATTCATCTCACAGAGTTACATCTTTCCCTTCAAGAAGCCTTTCGCTAAGGCTGTTCTTGTGGAATTGGCAAAGGGATATTT(SEQIDNO:5)。发明人通过QPCR实验检验了上述引物对的性能,其中,QPCR体系为:18.2μLmix+0.6μL正向引物+0.6μL反向引物+0.6μL探针+10μLDNA;QPCR标准曲线为:VeroDNA标准品浓度为100pg/μL、10pg/μL、1pg/μL、100fg/μL、10fg/μL、1fg/μL、0.1fg/μL。实验结果如图2和图3所示。其中图2是参考品扩增曲线,扩增曲线显示出明显的指数增长期。图3是参考品标准曲线。由图3可知,当参考品浓度为100pg/μL、10pg/μL、1pg/μL、100fg/μL、10fg/μL、1fg/μL、0.1fg/μL时,绘制得到的标准曲线斜率为-3.24,相关系数(R2)=0.999,扩增效率为103.4%。标准曲线线性良好,检测灵敏度可达到0.1fg/μl。实施例2.本发明引物对的特异性检验抗干扰实验:步骤:用DNA稀释液将VeroDNA梯度稀释成浓度为200pg/μL、20pg/μL、2pg/μL、200fg/μL、20fg/μL、2fg/μL六个浓度梯度。将大肠杆菌/CHO/人三种 干扰DNA稀释成浓度为2ng/μL;其中,大肠杆菌DNA来源于中国食品药品检定研究院;CHODNA来源于中国食品药品检定研究院;人非小细胞肺癌细胞HCC827来源于中国科学院上海生命科学研究院,用takara基因提取试剂盒提取。QPCR体系:18.2μLmix+0.6μL正向引物+0.6μL反向引物+0.6μL探针+5μLVeroDNA+5μLH2O/大肠杆菌/CHO/人DNA实验结果如下表所示:DNAR2SlopeEVero+H2O0.999-3.55491%Vero+大肠杆菌0.999-3.58790%Vero+CHO0.999-3.57290%Vero+人0.999-3.56291%实验结果如图4-图11所示。从产生的曲线可以看出,大肠杆菌/CHO/人DNA污染对本发明的SEQIDNO:2和SEQIDNO:3所示引物对的检测结果明显没有造成影响。该引物对具备优异的特异性。对比例1.根据现有技术文献,胡广宏等(SYBR-Green实时定量PCR用于Vero宿主细胞DNA残留量的检测,中国新药杂志,2012年,第21卷,第10期)所述制备以下引物对和探针:正向引物:TGTCACAGAGTTACATCTTTCCC(SEQIDNO:6)反向引物:TTTCACCATAGCCATCTAAGAGG(SEQIDNO:7)扩增片段:TCTCACAGAGTTACATCTTTCCCTTCAAGAAGCCTTTCGCTAAGGCTGTTCTTGTGGAATTGGCAAAGGGATATTTGGAAGCCCATAGAGGGCTATGGTGAAA(SEQIDNO:8)利用以上引物对和4种人细胞来源的人基因组:HCC827、A549、T24、Hela为模板,进行抗干扰实验验证;其中,人非小细胞肺癌细胞HCC827、人肺癌细胞A549、人膀胱移行细胞癌细胞T24、人宫颈癌细胞Hela均来源中国科学院上海生命科学研究院,用takara基因提取试剂盒提取。检验结果如图12-13所示,人的基因对该引物对产生了明显的干扰。此外,根据该文献本身所述,使用Vero细胞基因组DNA作为检测标准品,其检测灵敏度和0.03pg/L(即,30fg/μl)。因此,该现有技术的引物对的灵敏度和特异性均无法令人满意。对比例2.根据现有技术文献,曹守春等(Vero细胞LTR基因的克隆及其DNA定量PCR检测方法的建立,中国生物制品学杂志,2011年,第24卷,第5期)所述制备以下引物对和探针:正向引物:TGCTCTGTGTTCTGTTAATTCA(SEQIDNO:9)反向引物:TCCCTTTGCCAATTCCACAAGAA(SEQIDNO:10)探针:CAAGAAGCCTTTCGCTAAG(SEQIDNO:11)扩增片段:TGCTCTGTGTTCTGTTAATTCATCTCACAGAGTTACATCTTTCCCTTCAAGAAGCCTTTCGCTAAGGCTGTTCTTGTGGAATTGGCAAAGGGA(SEQIDNO:12)利用以上引物对和4种人细胞来源的人基因组:HCC827、A549、T24、Hela为模板,进行抗干扰实验验证;其中,人非小细胞肺癌细胞HCC827、人肺癌细胞A549、人膀胱移行细胞癌细胞T24、人宫颈癌细胞Hela均来源中国科学院上海生命科学研究院,用takara基因提取试剂盒提取。检验结果如图14-15所示,人的基因对现有技术的引物对产生了明显的干扰。本对比例的结果,从而证实了文献(曹守春等,Vero细胞LTR基因的克隆及其DNA定量PCR检测方法的建立,中国生物制品学杂志,2011年,第24卷,第5期)的结论,即,其引物对经特异性验证结果显示,仅人二倍体细胞(MRC-5) DNA有明显扩增曲线,分析其原因主要是人二倍体细胞来源于人类,而人类亦有相似的LTR,因此出现交叉现象。综上所述,对比例的结果证明现有技术中根据该LTR设计的引物对往往无法具备优异的特异性。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用