二甲基四氢咔啉-3-甲酰-Ile-AA-OBzl、其合成、活性和应用的制作方法
本发明涉及(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-AA-OBzl,涉及它的制备方法、涉及它对荷S180小鼠肿瘤增长的抑制作用,因而本发明涉及它作为抗肿瘤药物的应用。本发明属于生物医药领域。
背景技术:
肿瘤是局部组织的细胞异常增生而形成的新生物。所有的恶性肿瘤总称为癌症。恶性肿瘤严重威胁着人类健康。在临床肿瘤的手术治疗、放疗和化疗中,化疗应用最广泛,发明疗效好和毒副作用低的抗肿瘤新药一直是药物研究的热点。在抗肿瘤新药研究中,发明人曾公开下面结构的化合物(式中AA为氨基酸残基)按4.45μmol/kg剂量腹腔单次给药,每天一次,连续给药7天具有抗肿瘤作用。发明人并不满意这种疗效。
为了找到好的先导化合物,发明人完成了大规模计算机轴助的虚拟筛选。最终发现(3s)-1,1-二甲基四氢-β-咔啉-3-甲酰-Ile是优秀的抗肿瘤先导化合物。又经过5年实验研究,发明人发现往(3s)-1,1-二甲基四氢-β-咔啉-3-甲酰-Ile的羧端引入AA-OBzl,得到的(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-AA-OBzl抗肿瘤的有效剂量可以大幅度降低。根据这些研究结果,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供下式的(3s)-1,1-二甲基-四氢-β-咔啉甲酰-Ile-AA-OBzl。
本发明的第二个内容是提供(3s)-1,1-二甲基-四氢-β-咔啉甲酰-Ile-AA-OBzl的合成方法,该方法包括:
(1)L-色氨酸在稀盐酸催化下与丙酮进行Pictet-Spengler缩合生成(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸;
(2)Boc-Ile与氨基酸苄酯偶联得到Boc-Ile-AA-OBzl;
(3)Boc-Ile-AA-OBzl在4N氯化氢的乙酸乙酯溶液中得到Ile-AA-OBzl;
(4)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与Ile-AA-OBzl残基偶联得到(3s)-1,1-二甲基-四氢-β-咔啉甲酰-Ile-AA-OBzl。
本发明的第三个内容是评价(3s)-1,1-二甲基-四氢-β-咔啉甲酰-Ile-AA-OBzl对荷S180小鼠肿瘤增长的抑制作用。
附图说明
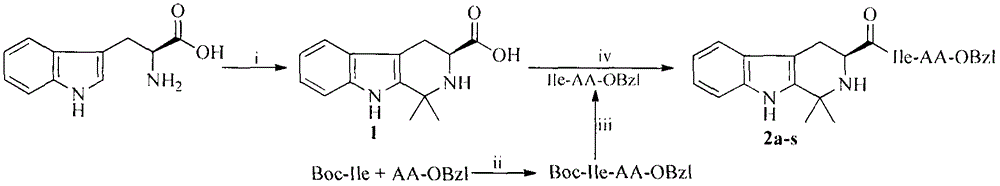
图1(3s)-1,1-二甲基-四氢-β-咔啉甲酰-Ile-AA-OBzl的合成路线.i)CH3COCH3,H2O,HCl;ii)二环己基碳二亚胺(DCC),1-羟基苯并三唑(HOBt),N-甲基吗啉(NMM),四氢呋喃(THF);iii)4N氯化氢的乙酸乙酯溶液;iv)二环己基碳二亚胺(DCC),1-羟基苯并三唑(HOBt),N-甲基吗啉(NMM),四氢呋喃(THF).2a中AA=Ala残基,2b中AA=Cys残基,2c中AA=Asp残基,2d中AA=Glu残基,2e中AA=Phe残基,2f中AA=Gly残基,2g中AA=Ile残基,2h中AA=Leu残基,2i中AA=Met残基,2j中AA=Asn残基,2k中AA=Pro残基,2l中AA=Gln残基,2m中AA=Arg残基,2n中AA=Ser残基,2o中AA=Thr残基,2p中AA=Val残基,2q中AA=Trp残基,2r中AA=Tyr残基,2s中AA=The残基。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸(1)
冰浴搅拌条件下,向4.08g(20mmol)L-色氨酸与80mL内酮的悬浮液中加入4mL浓盐酸,之后加入2mL蒸馏水,继续搅拌0.5h后。撤去冰浴室温反应24h,TLC监测原料点消失。反应液减压浓缩,残留物加入100mL乙醚,静置,滤出沉淀,得到5.22g(93%)标题化合物,为无色晶体。ESI-MS(m/e)245.1212[M+H]+。
实施例2制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Ala-OBzl(2a)
冰浴及搅拌下往281mg(1mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与20mL无水四氢呋喃的溶液中加入135mg(1mmol)N-羟基苯骈三氮唑,207mg(1mmol)二环己基羰二亚胺和281mg(1mmol)Ile-Ala-OBzl,用N-甲基吗啉调节反应液pH 9。冰浴反应0.5h,然后室温反应至TLC(石油醚∶丙酮=2∶1,Rf=0.24)监测反应完成。过滤除去生成的二环己基脲,滤液减压浓缩,所得的残留物用30mL乙酸乙酯溶解,乙酸乙酯溶液依次用饱和碳酸氢钠水溶液洗3次,饱和氯化钠水溶液洗3次,5%硫酸氢钾水溶液洗3次,饱和氯化钠水溶液洗3次,碳酸氢钠水溶液洗3次,饱和氯化钠水溶液洗3次,并用无水硫酸钠干燥12h。过滤,滤液减浓缩,残留物经过柱层析分离纯化(石油醚∶丙酮,梯度洗脱),得到139mg(27%)标题化合物,为淡黄色固体。Mp 201-202℃;(c=0.10,CH3OH);ESI-MS(m/e)519[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.90(s,1H),7.66(d,J=9.0Hz,1H),7.51(d,J=9.0Hz,1H),7.35(m,6H),7.15(m,2H),6.63(d,J=6.0Hz,1H),5.20(dd,J=12.0,21.0Hz,2H),4.66(t,J=9.0Hz,1H),4.39(t,J=9.0Hz,1H),3.77(dd,J=6.0,12.0Hz,1H),3.31(dd,J=6.0,18.0Hz,1H),2.68(dd,J=12.0,15.0Hz,1H),1.97(m,1H),1.60(m,2H),1.54(s,3H),1.47(s,3H),1.46(s,3H),1.24(m,1H),0.96(m,6H)。
实施例3制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Cys(Bzl)-OBzl(2b)
按照实施例2的方法从142mg(0.5mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与207mg(0.5mmol)Ile-Cys(Bzl)-OBzl得到71mg(22%)标题化合物,为黄色固体。Mp 182-183℃;(c=0.12,CH3OH);ESI-MS(m/e)641[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.83(s,1H),7.63(d,J=6.0Hz,1H),7.51(d,J=9.0Hz,1H),7.31(m,10H),7.15(m,2H),6.71(d,J=9.0Hz,1H),5.19(dd,J=3.0,18.0Hz,2H),4.85(d,J=6.0Hz,1H),4.39(t,J=9.0Hz,1H),3.77(dd,J=3.0,9.0Hz,1H),3.68(s,2H),3.32(dd,J=3.0,15.0Hz,1H),2.93(m,2H),2.69(t,J=15.0Hz,1H),2.00(m,1H),1.64(m,2H),1.54(s,3H),1.45(s,3H),1.26(m,2H),0.95(m,6H)。
实施例4制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Asp(OBzl)-OBzl(2c)
按照实施例2的方法从1.12g(4mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.70g(4mmol)Ile-Asp(OBzl)-OBzl得到681mg(26%)标题化合物,为淡黄色固体。Mp:91-92℃;(c=0.13 CH3OH);ESI-MS(m/e)653[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.80(s,1H),7.62(d,J=9.0Hz,1H),7.51(d,J=6.0Hz,1H),7.35(m,10H),7.15(m,2H),6.90(d,J=9.0Hz,1H),5.13(dd,J=3.0,18.0Hz,4H),4.99(m,1H),4.39(dd,J=6.0,9.0Hz,1H),3.76(dd,J=6.0,12.0Hz,2H),3.31(dd,J=6.0,15.0Hz,1H),3.02(m,2H),2.68(dd,J=12.0,15.0Hz,1H),1.95(m,1H),1.61(m,2H),1.54(s,3H),1.47(s,3H),1.20(m,2H),0.95(m,6H)。
实施例5制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Glu(OBzl)-OBzl(2d)
按照实施例2的方法从471mg(1.5mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与657mg(1.5mmol)Ile-Glu(OBzl)-OBzl得到208mg(21%)标题化合物,为黄色固体。Mp:167-168℃;(c=0.10 CH3OH);ESI-MS(m/e)667[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.99(s,1H),7.62(d,J=9.0Hz,1H),7.36(d,J=9.0Hz,1H),7.30(m,12H),7.14(m,2H),6.88(d,J=9.0Hz,1H),5.18(d,J=3.0Hz,2H),5.09(s,2H),4.67(m,1H),4.35(dd,J=6.0,9.0Hz,1H),3.75(dd,J=6.0,12.0Hz,1H),3.30(dd,J=6.0,15.0Hz,1H),2.68(dd,J=12.0,15.0Hz,1H),2.68(m,2H),1.95(m,1H),1.53(s,3H),1.47(s,3H),1.20(m,2H),0.91(m,6H)。
实施例6制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Phe-OBzl(2e)
按照实施例2的方法从1.70g(6mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与2.21g(6mmol)Ile-Phe-OBzl得到854mg(24%)标题化合物,为无色固体。Mp:144-145℃;(c=0.14 CH3OH);ESI-MS(m/e)594[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.81(s,1H),7.53(d,J=9.0Hz,1H),7.23(m,13H),6.40(d,J=6.0Hz,1H),5.17(dd,J=12.0,21.0Hz,2H),4.95(dd,J=6.0,12.0Hz,1H),4.30(t,J=9.0Hz,1H),3.71(dd,J=3.0,9.0Hz,1H),3.32(dd,J=6.0,15.0Hz,1H),3.15(m,2H),2.66(dd,J=9.0,15.0Hz,1H),1.96(m,1H),1.54(s,3H),1.48(s,3H),1.48(m,2H),1.14(m,1H),0.90(m,6H)。
实施例7制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Gly-OBzl(2f)
按照实施例2的方法从840mg(3mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与835mg(3mmol)Ile-Gly-OBzl得到300mg(20%)标题化合物,为无色固体。Mp:117-119℃;(c=0.10 CH3OH);ESI-MS(m/e)505[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.87(s,1H),7.70(d,J=9.0Hz,1H),7.50(d,J=6.0Hz,1H),7.36(m,5H),7.10(m,2H),6.90(t,J=6.0Hz,1H)5.26(s,1H),5.19(s,2H),4.43(t,J=9.0Hz,1H),4.12(m,2H),3.82(dd,J=6.0,12.0Hz,1H),3.29(dd,J=6.0,15.0Hz,1H),2.71(dd,J=12.0,15.0Hz,1H),2.02(m,1H),1.64(m,1H),1.56(s,3H),1.48(s,3H),1.22(m,1H),0.96(m,6H)。
实施例8制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Ile-OBzl(2g)
按照实施例2的方法从1.69g(6mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与2.00g(6mmol)Ile-Ile-OBzl得到838mg(25%)标题化合物,为无色固体。Mp:178-179℃;(c=0.12 CH3OH);ESI-MS(m/e)561[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.88(s,1H),7.62(d,J=9.0Hz,1H),7.51(d,J=6.0Hz,1H),7.34(m,6H),7.15(m,2H),6.49(d,J=9.0Hz,1H),5.20(dd,J=12.0,27.0Hz,2H),4.65(dd,J=6.0,9.0Hz,1H),4.36(t,J=9.0Hz,1H),3.76(dd,J=3.0,12.0Hz,1H),3.33(dd,J=3.0,15.0Hz,1H),2.68(dd,J=12.0,15.0Hz,1H),1.99(m,2H),1.63(m,1H),1.54(s,3H),1.47(s,3H),1.39(m,1H),1.20(m,2H),0.94(m,12H)。
实施例9制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Leu-OBzl(2h)
按照实施例2的方法从1.71g(6mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与2.01g(6mmol)Ile-Leu-OBzl得到775mg(23%)标题化合物,为无色固体。Mp:186-187℃;(c=0.14 CH3OH);ESI-MS(m/e)561[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.85(s,1H),7.61(d,J=9.0Hz,1H),7.51(d,J=6.0Hz,1H),7.37(m,6H),7.16(m,2H),6.49(d,J=6.0Hz,1H),5.19(dd,J=12.0,27.0Hz,2H),4.67(m,1H),4.34(t,J=9.0Hz,1H),3.75(d,J=9.0Hz,1H),3.33(dd,J=9.0,15.0Hz,1H),2.67(t,J=15.0Hz,1H),1.99(m,1H),1.67(m,5H),1.55(s,3H),1.47(s,3H),1.21(m,1H),0.94(m,12H)。
实施例10制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Met-OBzl(2i)
按照实施例2的方法从1.15g(4mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.41g(4mmol)Ile-Met-OBzl得到582mg(25%)标题化合物,为淡黄色固体。Mp:95-96℃;(c=0.12 CH3OH);ESI-MS(m/e)579[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.86(s,1H),7.63(s,1H),7.51(d,J=6.0Hz,1H),7.34(m,6H),7.16(m,2H),6.88(s,1H),5.22(dd,J=3.0,15.0Hz,2H),4.77(m,1H),4.36(t,J=9.0Hz,1H),3.32(dd,J=6.0,15.0Hz,1H),2.72(s,1H),2.50(m,2H),2.19(m,1H),2.09(s,3H),2.00(m,2H),1.81(m,1H),1.56(s,3H),1.49(s,3H),1.23(m,1H),0.93(m,6H)。
实施例11制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Asn-OBzl(2j)
按照实施例2的方法从142mg(0.5mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与175mg(0.5mmol)Ile-Asn-OBzl得到58mg(20%)标题化合物,为淡黄色同体。Mp:206-207℃;(c=0.10 CH3OH);ESI-MS(m/e)562[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=10.78(s,1H),8.52(d,J=6.0Hz,1H),7.84(d,J=6.0Hz,1H),7.44(s,1H),7.32(m,6H),6.97(m,2H),6.92(d,J=6.0Hz,1H),5.11(s,2H),4.68(d,J=6.0Hz,1H),4.37(t,J=9.0Hz,1H),3.65(s,1H),2.93(d,J=15.0Hz,1H),2.70(m,2H),1.71(m,2H),1.47(s,3H),1.36(s,3H),1.11(m,1H),0.81(m,6H)。
实施例12制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Pro-OBzl(2k)
按照实施例2的方法从845mg(3mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与958mg(3mmol)Ile-Pro-OBzl得到394mg(24%)标题化合物,为无色固体。Mp:217-218℃;(c=0.11 CH3OH);ESI-MS(m/e)545[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.85(s,1H),7.60(d,J=9.0Hz,1H),7.50(d,J=6.0Hz,1H),7.35(m,6H),7.15(m,2H),5.20(dd,J=12.0,21.0Hz,2H),4.71(t,J=9.0Hz,1H),4.62(t,J=6.0Hz,1H),3.96(m,1H),3.77(dd,J=6.0,12.0Hz,2H),3.32(dd,J=6.0,18.0Hz,1H),2.68(dd,J=9.0,15.0Hz,1H),2.25(m,1H),2.01(m,4H),1.61(m,2H),1.54(s,3H),1.46(s,3H),1.46(s,3H),1.20(m,1H),0.98(m,6H)。
实施例13制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Gln-OBzl(2l)
按照实施例2的方法从140mg(0.5mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与187mg(0.5mmol)Ile-Gln-OBzl得到69mg(20%)标题化合物,为淡黄色固体。Mp:114-115℃;(c=0.10 CH3OH);ESI-MS(m/e)576[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.93(s,1H),7.72(s,1H),7.48(d,J=6.0Hz,1H),7.30(m,7H),7.14(m,2H),6.24(s,1H),5.86(s,1H),5.18(dd,J=12.0,15.0Hz,1H),4.60(m,1H),4.38(t,J=6.0Hz,1H),3.80(m,1H),3.26(dd,J=3.0,15.0Hz,1H),2.69(t,J=15.0Hz,1H),2.30(m,3H),2.00(m,4H),1.57(m,1H),1.55(s,3H),1.47(s,3H),1.24(m,1H),0.95(m,6H)。
实施例14制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Arg(NO2)-OBzl(2m)
按照实施例2的方法从702mg(2.5mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.11g(2.5mmol)Ile-Arg(NO2)-OBzl得到375mg(23%)标题化合物,为无色固体。Mp:200-201℃;(c=0.12 CH3OH);ESI-MS(m/e)649[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=10.77(s,1H),8.53(d,J=6.0Hz,1H),7.84(d,J=9.0Hz,1H),7.36(m,6H),7.27(d,J=6.0Hz,1H),7.00(m,2H),5.75(s,1H),5.13(s,1H),4.36(t,J=9.0Hz,1H),3.64(m,1H),3.17(d,J=6.0Hz,1H),2.93(dd,J=3.0,15.0Hz,1H),2.43(m,1H),1.71(m,5H),1.56(m,1H),1.54(s,3H),1.47(s,3H),1.12(m,1H),0.85(m,6H)。
实施例15制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Ser-OBzl(2n)
按照实施例2的方法从1.12g(4mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.32g(4mmol)Ile-Ser-OBzl得到470mg(22%)标题化合物,为淡黄色固体。Mp:134-135℃;(c=0.10 CH3OH);ESI-MS(m/e)535[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.79(s,1H),7.68(d,J=6.0Hz,1H),7.49(d,J=6.0Hz,1H),7.33(m,6H),7.12(m,2H),5.23(s,2H),4.75(dd,J=3.0,6.0Hz,1H),4.35(t,J=9.0Hz,1H),4.01(m,2H),3.78(d,J=6.0Hz,1H),3.27(dd,J=6.0,18.0Hz,1H),2.69(t,J=6.0Hz,1H),1.98(m,1H),1.89(m,1H),1.61(m,1H),1.54(s,3H),1.46(s,3H),1.26(m,1H),1.22(s,3H),0.88(m,6H)。
实施例16制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Thr-OBzl(2o)
按照实施例2的方法从1.12g(4mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.36g(4mmol)Ile-Thr-OBzl得到542mg(25%)标题化合物,为无色固体。Mp:95-97℃;(c=0.11 CH3OH);ESI-MS(m/e)549[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.85(s,2H),7.48(d,J=9.0Hz,1H),7.34(m,6H),7.15(m,3H),5.13(dd,J=15.0,18.0Hz,2H),5.08(s,1H),4.68(dd,J=3.0,9.0Hz,1H),4.43(m,2H),3.85(dd,J=6.0,12.0Hz,1H),3.27(dd,J=6.0,15.0Hz,1H),2.76(dd,J=12.0,18.0Hz,1H),1.98(m,1H),1.64(m,1H),1.57(s,3H),1.50(s,3H),1.25(m,4H),0.99(m,6H)。
实施例17制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Val-OBzl(2p)
按照实施例2的方法从281mg(1mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与344mg(1mmol)Ile-Val-OBzl得到157mg(29%)标题化合物,为无色固体。Mp:191-192℃;(c=0.11 CH3OH);ESI-MS(m/e)547[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=7.88(s,1H),7.63(d,J=12.0Hz,1H),7.51(d,J=6.0Hz,1H),7.37(m,6H),7.33(d,J=6.0Hz,1H),7.15(m,2H),6.52(d,J=9.0Hz,1H),5.19(dd,J=12.0,27.0Hz,2H),4.61(dd,J=3.0,9.0Hz,1H),4.38(t,J=9.0Hz,1H),3.76(dd,J=3.0,12.0Hz,1H),3.33(dd,J=6.0,18.0Hz,1H),2.68(dd,J=9.0,15.0Hz,1H),2.24(m,1H),2.02(m,1H),1.61(m,1H),1.54(s,3H),1.46(s,3H),1.26(m,1H),0.97(m,12H)。
实施例18制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Trp-OBzl(2q)
按照实施例2的方法从140mg(0.5mmol)(3s)-1,1-二甲基-四氢-3-咔啉-3-羧酸与215mg(0.5mmol)Ile-Trp-OBzl得到62mg(20%)标题化合物,为淡粉色固体。Mp:101-103℃;(c=0.14 CH3OH);ESI-MS(m/e)547[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=8.23(s,1H),7.88(s,1H),7.53(d,J=9.0Hz,1H),7.49(d,J=6.0Hz,1H),7.34(m,5H),7.20(m,6H),6.94(s,1H),6.38(d,J=6.0Hz,1H),5.08(d,J=6.0Hz,2H),4.96(dd,J=6.0,9.0Hz,1H),4.34(m,1H),3.31(m,2H),3.24(dd,J=6.0,18.0Hz,1H),2.63(t,J=15.0Hz,1H),1.91(m,1H),1.76(m,1H),1.53(s,3H),1.44(s,3H),1.09(m,1H),0.89(m,6H)。
实施例19制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-Tyr-OBzl(2r)
按照实施例2的方法从424mg(3mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与1.21g(3mmol)Ile-Tyr-OBzl得到417mg(23%)标题化合物,为淡粉色固体。Mp:120-121℃;(c=0.13 CH3OH);ESI-MS(m/e)610[M+H]+;1H-NMR(300MHz,CDCl3):δ/ppm=8.00(s,1H),7.60(d,J=9.0Hz,1H),7.49(d,J=6.0Hz,1H),7.33(m,6H),7.13(m,2H),6.88(m,2H),6.65(m,2H),6.61(d,J=6.0Hz,1H),5.16(dd,J=12.0,24.0Hz,2H),4.91(dd,J=6.0,9.0Hz,1H),4.34(t,J=9.0Hz,1H),3.72(dd,J=6.0,12.0Hz,1H),3.23(dd,J=6.0,15.0Hz,1H),3.03(m,2H),2.65(dd,J=12.0,15.0Hz,1H),1.96(m,1H),1.52(s,3H),1.44(s,3H),1.23(m,1H),1.12(m,1H),0.89(m,6H)。
实施例20制备(3s)-1,1-二甲基-四氢-β-咔啉-3-甲酰-Ile-The-OBzl(2s)
按照实施例2的方法从71mg(0.25mmol)(3s)-1,1-二甲基-四氢-β-咔啉-3-羧酸与100mg(0.25mmol)Ile-The-OBzl得到32mg(21%)标题化合物,为淡黄色固体。Mp:111-113℃;(c=0.12 CH3OH);ESI-MS(m/e)547[M+H]+;1H-NMR(300MHz,DMSO-d6):δ/ppm=10.79(s,1H),8.57(d,J=6.0Hz,1H),7.86(d,J=9.0Hz,1H),7.81(d,J=6.0Hz,1H),7.37(m,6H),7.27(d,J=6.0Hz,1H),7.01(t,J=9.0Hz,1H),6.93(t,J=9.0Hz,1H),5.12(t,J=12.0Hz,1H),4.31(m,2H),3.65(dd,J=3.0,12.0Hz,1H),3.05(m,1H),2.90(dd,J=3.0,15.0Hz,1H),2.16(m,2H),2.02(m,1H),1.72(m,1H),1.47(s,3H),1.36(s,3H),1.14(m,1H),0.98(t,J=6.0Hz,3H),0.85(m,6H)。
实验例1评价化合物2a-s抑制S180小鼠肿瘤生长的活性
测定前将化合物2a-s和阿霉素溶用生理盐水溶解。无菌条件下取接种于ICR小鼠10天的S180肉瘤,加适量生理盐水配制成瘤细胞数为1×107个/mL的悬液,接种于健康雄性ICR小鼠前肢腋皮下,每只小鼠注射0.2mL,制造S180小鼠模型。肿瘤接种24h后,小鼠每日腹腔注射1次0.2mL化合物2a-s的生理盐水溶液,剂量为0.4μmol/kg,连续注射9天,或每日腹腔注射1次0.2mL生理盐水,连续注射9天,或每日腹腔注射1次0.2mL阿霉素的生理盐水溶液,剂量为2μmol/kg。实验进行至第10天,称小鼠体重,乙醚麻醉,剖取各组小鼠的肿瘤称重。结果列入表1。结果表明0.4μmol/kg化合物2a-s治疗的S180小鼠的瘤重显著轻于生理盐水治疗的S180小鼠的瘤重。此外,0.4μmol/kg化合物2c,g,i治疗的S180小鼠的瘤重与2μmol/kg阿霉素治疗的S180小鼠的瘤重没有显著差异。说明化合物2a-s具有良好的抗肿瘤活性。与发明背景中提到的已经公开的化合物相比,有效剂量降低了10倍,获得了意想不到的技术效果。
表1化合物对2a-s对S180荷瘤小鼠肿瘤生长的影响
n=15;a)和生理盐水比p<0.01;b)和生理盐水比p<0.01,和阿霉素比p>0.05。
- 还没有人留言评论。精彩留言会获得点赞!