植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及一种植物抗旱相关蛋白ZmNAC111及其编码基因与应用。
背景技术:
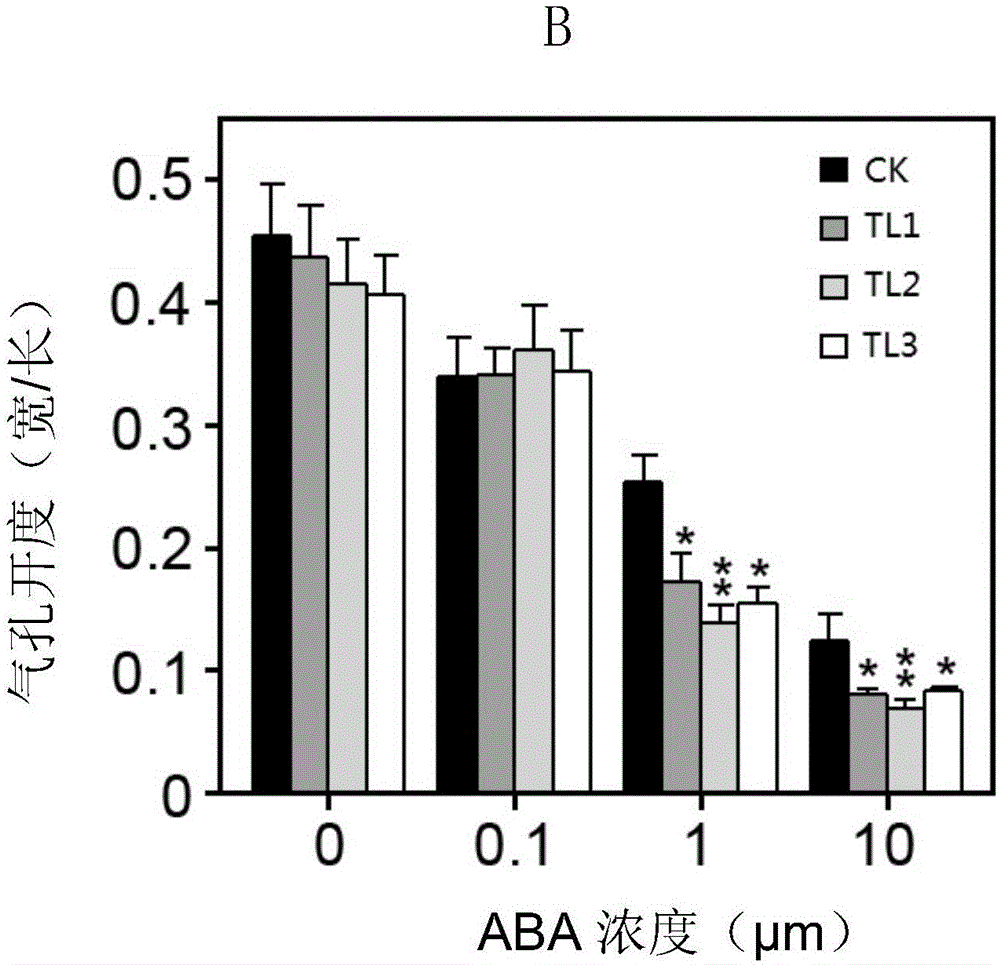
:植物在复杂多变的环境中生长发育,常受到逆境胁迫,其中干旱是影响和限制植物生长发育的主要逆境因子,甚至会导致植物死亡,严重影响农业生产。因此,培育抗旱作物品种一直是农业科学技术研究的主要目标之一。玉米(ZeamaysL.)是重要的粮食作物之一,对玉米进行抗旱基因挖掘对培育抗旱玉米品种并提高玉米产量具有重要意义。技术实现要素:本发明的一个目的是提供一种植物抗旱相关蛋白ZmNAC111及其编码基因。本发明所提供的与植物抗旱相关的蛋白质,来源于玉米(ZeamaysL.),名称为ZmNAC111,该蛋白质为如下a)或b)的蛋白质:a)由序列表中序列1所示的氨基酸序列组成的蛋白质;b)将序列表中序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与植物的抗逆性相关的由(a)衍生的蛋白质。上述序列表序列1所示的氨基酸由475个氨基酸残基组成。为了使上述(a)中的蛋白便于纯化,可在由序列表序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRPoly-His2-10(通常为6个)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述(b)中的蛋白可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的蛋白的编码基因可通过将序列表序列2的第157—1584位所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码上述蛋白质的DNA分子也是本发明保护的范围。所述DNA分子为如下1)或2)或3)或4)的DNA分子:1)编码区为序列表中序列2所示的DNA分子;2)编码区为序列表中序列2的第157位至第1584位所示的DNA分子;3)与1)或2)限定的DNA序列至少具有70%、至少具有75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且编码权利要求1所述蛋白质的DNA分子;4)在严格条件下与1)或2)或3)限定的DNA序列杂交且编码上述蛋白质的DNA分子。上述序列表序列2由1824个脱氧核苷酸组成,为编码所述蛋白的全长cDNA序列,其中的第157-1584位为编码区。上述严格条件可为如下:50℃,在7%十二烷基硫酸钠(SDS)、0.5MNa3PO4和1mMEDTA的混合溶液中杂交,在50℃,2×SSC,0.1%SDS中漂洗;还可为:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中杂交,在50℃,1×SSC,0.1%SDS中漂洗;还可为:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中杂交,在50℃,0.5×SSC,0.1%SDS中漂洗;还可为:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中杂交,在50℃,0.1×SSC,0.1%SDS中漂洗;还可为:50℃,在7%SDS、0.5MNa3PO4和1mMEDTA的混合溶液中杂交,在65℃,0.1×SSC,0.1%SDS中漂洗;也可为:在6×SSC,0.5%SDS的溶液中,在65℃下杂交,然后用2×SSC,0.1%SDS和1×SSC,0.1%SDS各洗膜一次。含有上述DNA分子的重组载体、表达盒、转基因细胞系、重组菌或重组病毒也是本发明保护的范围。可用现有的植物表达载体构建含有所述基因的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pROKII、pBin438、pCAMBIA1302、pCAMBIA2301、pCAMBIA1301、pCAMBIA1300、pBI121、pCAMBIA1391-Xa或pCAMBIA1391-Xb(CAMBIA公司)等。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3’端,如农杆菌冠瘿瘤诱导(Ti)质粒基因(如胭脂合成酶Nos基因)、植物基因(如大豆贮存蛋白基因)3’端转录的非翻译区均具有类似功能。使用所述基因构建重组植物表达载体时,在其转录起始核苷酸前可加上任何一种增强型启动子(如花椰菜花叶病毒(CAMV)35S启动子、玉米的泛素启动子(Ubiquitin))、组成型启动子或组织特异表达启动子(如种子特异表达的启动子),它们可单独使用或与其它的植物启动子结合 使用;此外,使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(GUS基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptII基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对methatrexate抗性的dhfr基因,赋予对草甘磷抗性的EPSPS基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。上述重组载体为pGZ或pSBIII;重组载体pGZ为将序列表序列2的第157—1584位所示的ZmNAC111替换载体pGKX的NotI和XhoI酶切位点间DNA片段(位于35S启动子下游),保持载体上其余序列不变。重组载体pSBIII为将序列表序列2的第157—1584位所示的ZmNAC111替换载体pSBⅡ的SmaI和HindⅢ酶切位点间DNA片段(位于Zmubi1启动子下游),保持载体上其余序列不变。上述蛋白质或上述DNA分子或上述的重组载体、表达盒、转基因细胞系、重组菌或重组病毒在调控植物抗逆性中的应用也是本发明保护的范围。上述应用中,调控植物抗逆性为提高植物抗逆性,所述抗逆性为抗旱性;所述植物为单子叶植物或双子叶植物。上述蛋白质或上述DNA分子或上述的重组载体、表达盒、转基因细胞系、重组菌或重组病毒在培育抗逆性转基因植物中的应用也是本发明保护的范围。上述应用中,所述抗逆性为抗旱性;所述植物为单子叶植物或双子叶植物。本发明的另一个目的是提供一种培育抗逆性转基因植物的方法,包括如下步骤:向目的植物中导入上述DNA分子,得到转基因植物;所述转基因植物的抗逆性高于所述目的植物。上述方法中,所述抗逆性为抗旱性;所述植物为单子叶植物或双子叶植物。上述方法中,上述DNA分子通过重组载体pGZ或pSBIII导入目的植物。在上述方法或应用中,所述双子叶植物具体可为拟南芥(Arabidopsisthaliana),所述单子叶植物具体可为玉米(ZeamaysL.)。上述抗旱性体现在如下:1)在干旱胁迫下转基因植物的存活率高于目的植物;2)在ABA胁迫下转基因植物的种子萌发迟于目的植物;3)在ABA胁迫下转基因植物的气孔关闭程度或速度高于目的植物;4)在干旱胁迫下转基因植物的净光合速率、气孔导度和/或蒸腾速率低于目的植物。本发明的实验证明,发现一种来源于玉米(ZeamaysL.)的新基因ZmNAC111,将其转入拟南芥或玉米,得到转基因植物,转基因植物的抗旱性高于未转基因的目的植物。表明,ZmNAC111及其编码的蛋白有抗旱的功能,在提高植物抗旱性的育种和研究中具有重要意义。附图说明图1为不同单体型编码的ZmNAC111蛋白的转录激活活性。图2为T3代转ZmNAC111拟南芥植株的RT-PCR产物的电泳结果。图3为T3代转ZmNAC111拟南芥植株经干旱处理并复水6天后的表型。图4为T3代转ZmNAC111拟南芥植株经干旱处理并复水6天后的存活率统计结果。图5为T3代转ZmNAC111拟南芥植株在ABA胁迫处理下的萌发表型。图6为T3代转ZmNAC111拟南芥植株在不同ABA浓度下气孔开度。图7为转ZmNAC111拟南芥正常生长条件下RNA-seq分析。图8为转ZmNAC111拟南芥干旱处理下RNA-seq分析。图9为T2代转ZmNAC111玉米植株的qPCR结果。图10为T2代转基因玉米植株经干旱处理并复水7天后的表型。图11为T2代转基因玉米植株经干旱处理并复水7天后的存活率统计结果。图12为T2代转ZmNAC111玉米植株光合作用。图13为转ZmNAC111玉米正常生长条件下RNA-seq分析。图14为转ZmNAC111玉米干旱处理下RNA-seq分析。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的生物材料信息如下:载体pGKX:文献:QinF,SakumaY,TranLS,MaruyamaK,KidokoroS,etal.(2008)ArabidopsisDREB2A-interactingproteinsfunctionasRINGE3ligasesandnegativelyregulateplantdroughtstress-responsivegeneexpression.PlantCell20:1693-1707.公众可 从中国科学院植物研究所获得;根癌农杆菌GV3101+pSoup菌株:文献:ScholthofHB,AlvaradoVY,Vega-ArreguinJC,CiomperlikJ,OdokonyeroD,etal.(2011)IdentificationofanARGONAUTEforantiviralRNAsilencinginNicotianabenthamiana.PlantPhysiol156:1548-1555,公众可从中国科学院植物研究所获得;载体pBI121:文献:QinF,KakimotoM,SakumaY,MaruyamaK,OsakabeY,etal.(2007)RegulationandfunctionalanalysisofZmDREB2AinresponsetodroughtandheatstressesinZeamaysL.PlantJ50:54-69,公众可从中国科学院植物研究所获得;根癌农杆菌GV3101菌株:文献:JingY,ZhangD,WangX,TangW,WangW,etal.(2013)ArabidopsischromatinremodelingfactorPICKLEinteractswithtranscriptionfactorHY5toregulatehypocotylcellelongation.PlantCell25:242-256,公众可从中国科学院植物研究所获得;哥伦比亚生态型拟南芥(Arabidopsisthaliana(Columbiaecotype)):文献:Yamaguchi-ShinozakiK,ShinozakiK(1994)Anovelcis-actingelementinanArabidopsisgeneisinvolvedinresponsivenesstodrought,low-temperature,orhigh-saltstress.PlantCell6:251-264.公众可从中国科学院植物研究所获得;根癌农杆菌LBA4404菌株:文献:Ishida,Y.,Hiei,Y.&Komari,T(2007)Agrobacterium-mediatedtransformationofmaize.Nat.Protoc.2:1614-1621.公众可从中国科学院植物研究所获得;玉米自交系A188:文献:Ishida,Y.,Hiei,Y.&Komari,T(2007)Agrobacterium-mediatedtransformationofmaize.NatureProtocol.2:1614-1621.公众可从中国科学院植物研究所获得。载体PSBI和PSBII:文献:Ishidaetal.,(2007)Agrobacterium-mediatedtransformationofmaize.NatureProtocol.2:1614-1621.公众可从JapanTobacco公司获得。玉米自交系B73:文献:Schnable,P.S.etal(2009)TheB73maizegenome:complexity,diversity,anddynamics.Science326:1112-1115.公众可从中国科学院植物研究所获得。实施例1、蛋白ZmNAC111及其编码基因的获得1、蛋白ZmNAC111及其编码基因克隆取玉米自交系B73种子,28℃下催芽三天后,将出芽的种子转移到营养土或营养液中培养三周,取全株于液氮中速冻、研磨,提取总RNA,进行反转录,获得cDNA,以该cDNA为模板,5’-ATGCCGAGAAGCGGCGGCG-3’和 5’-CTACTGCATCCCGATGTGGC-3’为引物进行PCR扩增。将扩增产物进行琼脂糖凝胶电泳,得到1.4kb的PCR扩增产物。经过测序,该PCR产物具有序列表序列2的第157—1584位所示核苷酸,其所示的基因命名为ZmNAC111,该基因编码的蛋白命名为ZmNAC111,该蛋白的氨基酸序列为序列表中序列1。其中序列2中,第1—156位为5’非编码区,第157—1584位为编码序列,第1585—1824位为3’非编码区。2、不同单体型编码的ZmNAC111蛋白的转录激活活性分析以携带不同基因型的耐旱型玉米自交系CIMBL55、CIMBL91、CIMBL19、CIMBL22、CIMBL123和敏感型玉米自交系Mo17、D863F、BY4944、SHEN5003以及参照玉米自交系B73的CDNA为模板,5’-ATGCCGAGAAGCGGCGGCG-3’和5’-CTACTGCATCCCGATGTGGC-3’为引物进行PCR扩增,将目的基因克隆并连接入酵母表达载体pGBKT7中,分别转化酵母菌株AH109(含有报告基因HIS3和ADE2),以转化空载体pGBKT7为对照,分别获得重组酵母菌株ZmNAC111-CIMBL55、ZmNAC111-CIMBL91、ZmNAC111-CIMBL19、ZmNAC111-CIMBL22、ZmNAC111-CIMBL123、ZmNAC111-Mo17、ZmNAC111-D863F、ZmNAC111-BY4944、ZmNAC111-SHEN5003、ZmNAC111-B73及pGBKT7-Control。将AH109重组酵母菌株涂到营养缺陷型培养基的板上,通过菌斑生长情况比较不同单体型编码的ZmNAC111蛋白的转录激活活性。结果如图1所示。十一个重组酵母菌株均能在SD/-Trp(单缺)培养基的板上生长。在SD/-T-H(两缺)、SD/-T-H-A(三缺)营养缺陷型培养基的板上,含有pGBKT7-Control质粒的酵母菌株不能正常生长,而重组酵母菌株均能够正常生长,表明:不同单体型编码的ZmNAC111蛋白具有相似的转录激活活性。实施例2、蛋白ZmNAC111及其编码基因的功能研究一、过表达基因ZmNAC111提高拟南芥抗旱性1、重组载体的构建重组载体pGZ为将序列表序列2的第157—1584位所示的ZmNAC111替换载体pGKX的NotI和XhoI酶切位点间DNA片段(位于35S启动子下游),保持载体上其余序列不变。2、重组根癌农杆菌的获得将重组载体pGZ转化根癌农杆菌GV3101+pSoup菌株,获得含有重组载体pGZ的重组农杆菌X(提取质粒,测序验证该质粒为pGZ,则该重组农杆菌为阳性克隆。);将载体pGKX转化根癌农杆菌GV3101菌株,获得含有载体pGKX的重组农杆菌CK(提取质粒,测序验证该质粒为pGKX,则该重组农杆菌为阳性克隆。)。3、转ZmNAC111拟南芥的获得将重组农杆菌X用花芽浸泡法转化野生型哥伦比亚生态型拟南芥,收获T1代种子;将T1代种子用含有30mg/L卡那霉素的MS培养基筛选并将抗性苗种植收种,获得T2代种子;将T2代种子用含有30mg/L卡那霉素的MS培养基筛选,挑选卡那霉素抗性分离比符合3:1的卡那霉素抗性苗种植,为T2代转ZmNAC111拟南芥。提取T2代转ZmNAC111拟南芥植株RNA,反转录得到cDNA为模板,用特异引物F1和R1对基因ZmNAC111的cDNA进行PCR扩增,以拟南芥中的基因Actin2为内参,引物为FC和RC。上述引物的序列如下:F1:5’-ATGCCGAGAAGCGGCGGCG-3’(序列表序列3);R1:5’-CTACTGCATCCCGATGTGGC-3’(序列表序列4);FC1:5’-GGTAACATTGTGCTCAGTGGTGG-3’(序列表序列5);RC1:5’-GCATCAATTCGATCACTCAGAG-3’(序列表序列6)。得到1428bp的为阳性T2代转ZmNAC111拟南芥。将阳性T2代转ZmNAC111拟南芥、收种,获得T3代转ZmNAC111拟南芥种子,将T3代种子用含有30mg/L卡那霉素的MS培养基筛选得到不再产生卡那霉素抗性分离的纯合T3代转ZmNAC111拟南芥株系3个,分别命名为TL1、TL2和TL3。采用同样的方法将重组农杆菌CK用花芽浸泡法转化野生型哥伦比亚生态型拟南芥,按照上述方法筛选,获得不再产生卡那霉素抗性分离的纯合T3代转空载体拟南芥,命名为CK。T1代表示转化当代所结的种子及由它所长成的植株;T2代表示T1代自交产生的种子及由它所长成的植株;T3代表示T2代自交产生的种子及由它所长成的植株。上述花芽浸泡法的具体步骤如下:取重组农杆菌X或CK接种于含有50mg/L卡那霉素、和5mg/L四环素的LB液体培养基中,于28℃振荡培养至OD600为0.8,25℃、5000转/分钟离心2分钟,除去上清液,用重悬溶液(溶剂为水,溶质蔗糖和silwet77的浓度分别为50g/L、0.02%(体积百分含量))重悬菌体,获得侵染液。用移液器将侵染液点在花蕾及生长点,用薄膜覆盖,保湿2天后,置于正常条件下生长,收获种子。提取上述获得的T3代转ZmNAC111拟南芥株系(TL1—TL3),T3代转空载体拟南芥(CK)植株的总RNA,反转录得到cDNA作为模板,用特异引物F1和R1对基因ZmNAC111的cDNA进行PCR扩增,以拟南芥中的基因Actin2为内参,引物为FC和RC。PCR扩增产物电泳结果如图2所示,T3代转ZmNAC111拟南芥株系均能扩增 1428bp的目标片段,CK植株中不表达目的基因ZmNAC111;表明,ZmNAC111在T3代转ZmNAC111拟南芥株系中得到表达,且表达量都很高。4、转ZmNAC111拟南芥的抗旱性表型分析取T3代转ZmNAC111拟南芥株系(TL1—TL3)、野生型拟南芥(CK)和T3代转空载体拟南芥株系苗龄7天的植株,转移到装有100g营养土的钵中,正常条件下生长25天后,进行干旱处理(即停止浇水),14天后,表型差异明显即CK株系莲座叶严重干枯而TL1—TL3株系莲座叶严重萎蔫时复水。复水6天后统计各株系植株的存活率(将表现为能正常生长和收种的植株定义为存活植株,将表现为严重受旱害且不能正常生长和收种的植株定义为死亡植株;存活率为各株系中存活植株数目占总植株数的百分比)。实验设3次重复,每次重复各株系的植株数不少于30株,取平均值进行统计分析。结果如表2、图3和图4所示,可以看出,在干旱处理后,T3代转ZmNAC111拟南芥株系(TL1—TL3)的存活率高于野生型拟南芥。T3代转空载体拟南芥株系(CK)与野生型拟南芥结果无显著差异。表2、转ZmNAC111拟南芥植株经干旱处理后的存活率(%)结果株系重复1重复2重复3平均值±标准差TL110075.0096.8890.62±8.62**TL287.5587.4578.1284.38±5.41**TL375.6290.6390.0085.42±4.02**CK25.0033.3325.0027.78±4.81注:*表示与CK结果相比在P<0.05差异显著,**表示与CK结果相比在P<0.01差异极显著。5、转ZmNAC111拟南芥在ABA胁迫处理下的萌发表型T3代转ZmNAC111拟南芥株系(TL1—TL3)、野生型拟南芥(CK)和T3代转空载体拟南芥株系种子分别在含0、0.5、1μMABA的MS培养基上生长5天,生长条件为16/8小时的光照/黑暗模式,22℃光照培养箱。实验设3次重复,每次重复各株系的种子数不少于30株,取平均值进行统计分析。5天后统计萌发率,结果如图5所示,A为表型观察,B为萌发率统计结果,可看成,野生型拟南芥100%的种子在1μMABA固体培养基都萌发(需要5天时间)时,过表达材料T3代转ZmNAC111拟南芥最高只有60.9%。但是T3代转ZmNAC111拟南芥继续培养均能萌发(需要7天时间)。野生型拟南芥和T3代转空载体拟南芥株系(CK)的结果无显著差异。表明,ZmNAC111在ABA胁迫下延缓种子萌发,其对ABA敏感。6、转ZmNAC111拟南芥在不同ABA浓度下气孔开度观察取正常生长21天左右的T3代转ZmNAC111拟南芥株系TL1、TL2、TL3和野生型拟南芥CK叶片,浸泡在气孔开度溶液(10mMKCl,100μMCaCl2和10mMMES,PH6.1)2h后,分别转移到含有0μΜ、0.1μΜ、1μΜ、10μΜABA的气孔开度溶液中浸泡2h后,观察它们的气孔开度变化。以T3代转空载体拟南芥为对照。结果如图6,A为表型观察,B为气孔开度统计结果,可以看到,在0μΜABA的气孔开度溶液中,T3代转ZmNAC111拟南芥和野生型拟南芥叶片的气孔开度没有明显差异,但是随着ABA浓度的增加,野生型植株的气孔开度变化较小,而T3代转ZmNAC111拟南芥的气孔开度明显变小,结果表明T3代转ZmNAC111拟南芥的ABA诱导的气孔关闭过程明显快于野生型植株。T3代转空载体拟南芥与野生型拟南芥无显著差异。因此,ZmNAC111在ABA胁迫下促进气孔关闭。7、转ZmNAC111拟南芥RNA-seq分析取T3代转ZmNAC111拟南芥(TL2—TL3)和T3代转空载体拟南芥株系(CK)苗龄21天的植株,进行台面干燥0h和1h处理,每个株系至少10棵苗,用TRIZOL(Biotopped)法分离出总RNA,然后用Nanodrop1000(ThermoScientificproduct,USA)测定浓度,合格后送北京贝瑞和康公司进行转录组测序,测序深度为3GB,最后用StrandNGS2.0软件进行数据分析。结果如图7,图8所示,表明,正常生长及干旱处理下的转基因拟南芥材料中,涉及到水分胁迫应答,脱落酸(ABA)胁迫应答及转录调控生物学途径的基因普遍调表达。上述结果表明,蛋白ZmNAC111及其编码基因具有调控植物抗旱性的功能,在植物中过表达蛋白ZmNAC111的编码基因,可以提高植物的抗旱性。二、过表达基因ZmNAC111提高玉米抗旱性1、重组载体的构建重组载体pSBIII为将序列表序列2的第157—1584位所示的ZmNAC111替换载体pSBⅡ的SmaI和HindⅢ酶切位点间DNA片段(位于Zmubi1启动子下游),保持载体上其余序列不变。2、重组根癌农杆菌的获得将重组载体pSBIII转化根癌农杆菌LBA4404菌株,获得含有重组载体pSBIII的重组农杆菌Y(提取质粒,测序验证该质粒为pSBIII,则该重组农杆菌为阳性克隆。)。采用同样的方法,将空载体pSBⅡ转化根癌农杆菌LBA4404,得到含有载体pSBⅡ 的重组农杆菌CK1。3、转基因玉米的获得将重组农杆菌Y用农杆菌介导的基因转化法转化玉米自交系A188,得到T0代植株,并种植于温室(16h-光照/8h-黑暗)。提取T2代转ZmNAC111玉米植株RNA,反转录得到cDNA,用特异引物F2和R2对基因ZmNAC111的cDNA进行PCR鉴定。上述引物的序列如下:F2:5’-CTACTATGACGACGACAACT-3’(序列表序列7);R2:5’-CACTCGCTTCCTCTTGTT-3’(序列表序列8);得到1125bp的为阳性T0代转ZmNAC111玉米。阳性T0代转ZmNAC111玉米自交后获得T1代种子;T1代植株再用同样的方法PCR鉴定后获得阳性植株,自交后获得T2代种子。提取T2代转ZmNAC111玉米的RNA,反转录得到cDNA,用特异引物F2和R2对基因ZmNAC111的cDNA进行qPCR定量,以玉米的基因Zmubi2为内参。以野生型玉米为对照。上述引物的序列如下:F2:5’-CTACTATGACGACGACAACT-3’(序列表序列7);R2:5’-CACTCGCTTCCTCTTGTT-3’(序列表序列8);FC2:5’-TGGTTGTGGCTTCGTTGGTT-3’(序列表序列9);RC2:5’-GCTGCAGAAGAGTTTTGGGTACA-3’(序列表序列10)。结果如图9所示,T2代转ZmNAC111玉米TML1、TML2和TML3的ZmNAC111表达量高于野生型玉米,表明T2代转ZmNAC111玉米TML1、TML2和TML3为阳性转基因玉米。上述T0代表示转化当代所长成的植株;T1代表示T0代自交产生的种子及由它所长成的植株;T2代表示T1代自交产生的种子及由它所长成的植株。上述农杆菌介导的基因转化法的具体步骤如下:重组农杆菌Y接种于含有25mg/L壮观霉素的YEB液体培养基中,于28℃振荡培养至OD600为0.5。取玉米幼胚放置于装满保存液的2mL离心管,46℃热处理3min,4℃、2000转/分钟离心10分钟。将准备好的重组农杆菌加入处理好的幼胚,22℃黑暗培养3天,转移到新的培养基上28℃黑暗培养7-10天。通过不同浓度草胺膦筛选,最后转移到分化培养基上,分化后转移到生根培养基上培养,一定大小后移入营养土中。将重组农杆菌CK1用农杆菌介导的基因转化法转化玉米自交系A188,培育,直 到得到T2代转空载体玉米。4、转ZmNAC111玉米的抗旱性表型分析取T2代转ZmNAC111玉米株系(TML1—TML3)及野生型玉米(WT)植株,转移到装有2500g营养土的钵中,正常条件下生长10天后,进行干旱处理(即停止浇水)20复水7天后统计各株系植株的存活率(将表现为能正常生长和收种的植株定义为存活植株,将表现为严重受旱害且不能正常生长和收种的植株定义为死亡植株;存活率为各株系中存活植株数目占总植株数的百分比)。实验设3次重复,每次重复各株系的植株数不少于15株,取平均值进行统计分析。以T2代转空载体玉米为对照。结果如表3、图10和图11所示,可以看出,干旱处理20天,T2代转ZmNAC111玉米株系叶片干枯程度小于野生型玉米,且统计存活率,T2代转ZmNAC111玉米存活率高于野生型玉米,T2代转空载体玉米与野生型玉米结果无显著差异。表3、转基因玉米植株经干旱处理后的存活率(%)结果株系重复1重复2重复3平均值±标准差TML180.0086.6787.6484.78±3.85**TML286.6773.3380.0080.00±6.67**TML380.0083.3382.6975.55±1.70**WT74.5477.6774.4428.89±3.85注:*表示与WT结果相比在P<0.05差异显著,**表示与WT结果相比在P<0.01差异极显著。因此,ZmNAC111可提高玉米抗旱性。5、转ZmNAC111玉米光合作用分析叶片净光合速率(Pn)、气孔导度(Gs)及蒸腾速率(Tr)采用Li6400便携式光合测定系统进行测定(LICOR-6400,Lincoln,NE)。于3叶期时测定T2代转ZmNAC111玉米株系(TML1—TML3)和野生型玉米植株(WT)第三片完全展开的叶片并进行停水处理,之后每隔一天测定一次,并记录相应的土壤含水量。每个转化时间随机测7株,重复两次,测定结果用平均值表示。结果如图12所示,A-D分别为光合速率的统计结果、气孔导度的统计结果、蒸腾速率的统计结果和水分利用效率的统计结果,可以看出,与野生型玉米相比,T2代转ZmNAC111玉米植株在干旱处理下光合速率、气孔导度、蒸腾速率变小,进而使得水分利用效率升高,存活率显著提高。6、转ZmNAC111玉米RNA-seq分析取T2代转ZmNAC111玉米的PCR阳性玉米株系(TML1—TML2)及野生型玉米 (WT)苗龄8天的植株,进行台面干燥0h和2h处理,每个株系至少3棵苗,用TRIZOL(Biotopped)法分离出总RNA,然后用Nanodrop1000(ThermoScientificproduct,USA)测定浓度,合格后送北京贝瑞和康公司进行转录组测序,测序深度为3GB,最后用StrandNGS2.0软件进行数据分析。结果如图13和图14所示,表明,正常生长及干旱处理下的转基因玉米材料中,涉及到水分胁迫应答,ABA胁迫应答及转录调控生物学途径的基因普遍调表达。上述结果表明,蛋白ZmNAC111及其编码基因具有调控植物抗旱性的功能,在植物中过表达蛋白ZmNAC111的编码基因,可以提高植物的抗旱性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺