一种抗草甘膦转基因籼稻的制备方法与流程
本申请涉及植物转基因技术领域,具体地,涉及抗草甘膦转基因籼稻的制备方法,该方法中使用的培养基和培养基组合,以及通过该方法制备的水稻幼苗、水稻植株、水稻种子或水稻组织。
背景技术:
水稻是我国乃至世界上的主要粮食作物,是全球近一半人口的主要热量来源,然而由于杂草危害直接造成的水稻产量损失巨大。伴随着人们对除草剂作用机理和代谢途径的了解和分子生物学技术的快速发展,通过现代生物技术培育抗除草剂的农作物,使田间化学除草技术和生物技术紧密结合,可以扩大高效与超高效低毒除草剂品种的应用范围,降低除草剂残留。
草甘膦(glyphosate)即N-(phosphonomethy)glycine,商品名农达(Roundup),是一种广泛应用于水旱地杂草防除的灭生性除草剂。草甘膦施用后可被植物迅速吸收,进入植物体内与磷酸烯醇丙酮酸竞争性地结合EPSPS(5-烯醇丙酮酰-莽草酸-3-磷酸合成酶)的活性位点,终止了芳香族氨基酸的合成途径,造成苯丙氨酸、酪氨酸和色氨酸等氨基酸的缺乏,最终导致植物死亡。草甘膦具有很好的传导性能,对世界上十大多年生、深根性难除杂草均有良好效果,是一种广谱灭生性除草剂。草甘膦进入土中遇金属二价离子形成络合物,通过微生物降解作用失去活性,即与土壤接触后失去其植物毒性;与土壤具有强的亲和力,在土壤中迁移性很小;在水中可发生明显的水解作用,迅速失去活性;同时由于人类和哺乳动物体内缺乏芳香族氨基酸合成途径,没有草甘膦的作用靶标酶,因此草甘瞵对人畜是没有毒性的。由于草甘膦具有高效低毒无残留,对人畜无毒,入土后迅速失活,不会造成土壤及地下水的污染的特点,研 制抗草甘膦水稻具有很高的商业价值。
以潮霉素为筛选剂的农杆菌介导法是目前水稻遗传转化的主要方法,但是利用该筛选方法培育出的转基因水稻会带入多余的筛选标记基因。而少量水稻除草剂抗性基因的转化主要集中在Bar基因的利用上。武长剑(1994)、朱常香等(2000)、王慧中等(2000)、施利利等(2004)相继利用原生质体、粳稻、籼稻以及水稻幼胚等不同材料不同方法将抗除草剂Bar基因转入水稻获得具有除草剂稳定抗性的水稻植株并进行了分子生物学检测证明抗除草剂基因的转入。
草甘膦是目前使用面积最大、使用范围最广的广谱性除草剂,相对于草丁膦,草甘膦具有价格便宜,在土壤中易分解、短残留、不易进入地下水等优点,在水稻免耕与少耕种植中起着关键性作用,培育抗草甘膦除草剂的水稻对生产抗除草剂水稻具有重要意义。
技术实现要素:
在一方面,本申请涉及用于筛选抗草甘膦的愈伤组织的筛选培养基,其包含N6培养基的大量元素、10倍B5培养基的微量元素和50-400mg/L草甘膦。
在第二方面,本申请涉及培养基组合,其包括上述筛选培养基和用于共培养农杆菌和愈伤组织的共培养基,所述共培养基包含3/10倍MS培养基的大量元素和1/2倍MS培养基的微量元素。
在一些实施方案中,所述培养基组合还包括悬浮培养基。在一些实施方案中,所述培养基组合还包括诱导水稻愈伤组织的诱导培养基。在一些实施方案中,所述培养基组合还包括对水稻愈伤组织进行继代培养的继代培养基。在一些实施方案中,所述培养基组合还包括对继代培养后的水稻愈伤组织进行预培养的预培养基。在一些实施方案中,所述培养基组合还包括对筛选后的抗草甘膦水稻愈伤组织进行分化培养的分化培养基。在一些实施方案中,所述培养基组合还包括用于对分化培养获得的再生苗进行生根培养的生根培养基。
在第三方面,本申请提供了抗草甘膦水稻愈伤组织的制备方法,包括以下步骤:
(1)利用包含抗草甘膦基因的农杆菌菌液在悬浮培养基中侵染水稻愈伤组织;
(2)将侵染后的愈伤组织转移到共培养基上进行共培养;
(3)将共培养后的愈伤组织转移到添加了草甘膦的筛选培养基上进行筛选培养,获得抗草甘膦的水稻愈伤组织。
在第四方面,本申请还涉及获得抗草甘膦的水稻幼苗的方法,其包括将通过上述方法获得的抗草甘膦水稻愈伤组织转入分化培养基进行分化培养,获得再生水稻幼苗。
在一些实施方案中,所述方法还包括将分化培养获得的再生苗转入生根培养基中培养,获得生根水稻幼苗。
在第五方面,本申请还涉及通过上述方法获得的水稻愈伤组织和水稻幼苗。
在第六方面,本申请还涉及通过上述愈伤组织或幼苗获得的水稻植株。
在第七方面,本申请还涉及通过上述水稻植株获得的水稻种子、水稻组织、及由所述水稻种子或水稻组织获得的深加工产品。
本发明的筛选培养基利用草甘膦作为筛选剂,培育出的水稻品种除了带有抗草甘膦除草剂的基因外不含有其它的筛选标记基因。
本申请的一些培养基组合采用了特定的培养基配方,可以提高各阶段的培养效率。
本发明的方法利用草甘膦作为筛选剂,培育出的水稻愈伤组织、水稻幼苗或由这些水稻愈伤组织或水稻幼苗获得的水稻植株除了带有抗草甘膦除草剂的基因外不含有其它的筛选标记基因。
通过上述水稻植株获得的水稻种子、水稻组织、及由所述水稻种子或水稻组织获得的深加工产品不含其它的筛选标记基因,对于其进一步的应用也更安全。
本申请的培养基、培养基组合、方法、水稻愈伤组织、水稻幼苗、水稻植株、水稻种子和水稻组织具有以下优势中的一种或多种:加快育种速度;效率高;操作简便;转基因植株拷贝数低;和遗传性状稳定等。
附图说明
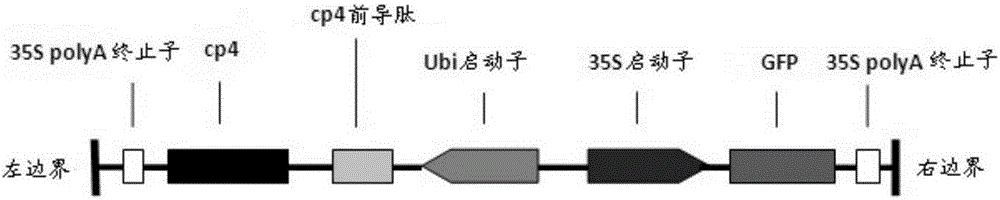
图1为农杆菌内T-DNA区示意图。
图2A-2B为转基因植株中外源基因(GFP)在组织中的表达图。图2A为外源基因(GFP)在转化水稻根部的表达图;图2B为外源基因(GFP)在转化水稻叶部的表达图。a:转化明恢63得到的苗;b:野生型明恢63;c:转化9311得到的苗;d:野生型9311。
图3A-3B为转基因植株中外源基因PCR扩增结果图。图3A:转化明恢63所得到的部分转基因植株PCR扩增图;图3B:转化9311所得到的部分转基因植株PCR扩增图。M:为2kB Marker分子量标准;1-14:本申请制备的转基因植株编号;N:阴性对照;P:阳性对照。
图4为转基因植株拷贝数检测图。转化籼稻品种明恢63以及9311植株DNA印迹检测图。每个样品分别来自于独立的转化事件。M:为DNA Molecular Weight Marker III分子量标准;N:阴性对照;1-3:转化明恢63得到的独立转基因植株,4-6:转化9311得到的独立转基因植株。
具体实施方式
在本发明的一方面,本申请涉及筛选培养基,其用于筛选抗草甘膦的愈伤组织,其包含N6培养基的大量元素、10倍B5培养基的微量元素和50-400mg/L草甘膦。
在一些实施方案中,所述筛选培养基含有100-400mg/L的草甘膦。在一些实施方案中,所述筛选培养基含有100-300mg/L的草甘膦。在一些实施方案中,所述筛选培养基含有150-300mg/L的草甘膦。在一些实施方案中,所述筛选培养基含有150-200mg/L的草甘膦。在一些实施方案中,所述筛选培养基含有200-300mg/L的草甘膦。在一些实施方案中,所述筛选培养基含有50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390或400mg/L的草甘膦。
在一些实施方案中,所述筛选培养基还包含250mg/L羧苄青霉素。在一些实施方案中,所述筛选培养基还包含N6培养基的铁盐。在一些 实施方案中,所述筛选培养基还包含B5培养基的有机质。在一些实施方案中,所述筛选培养基还包含200-600mg/L谷氨酸。在一些实施方案中,所述筛选培养基还包含300-800mg/L脯氨酸。在一些实施方案中,所述筛选培养基还包含2-3mg/L 2,4-D。在一些实施方案中,所述筛选培养基还包含30g/L麦芽糖。在一些实施方案中,所述筛选培养基还包含7g/L琼脂。在一些实施方案中,所述筛选培养基的pH值为5.8。
在一方面,本申请涉及培养基组合,其包括上述筛选培养基和用于共培养农杆菌和愈伤组织的共培养基,所述共培养基包含3/10倍MS培养基的大量元素和1/2倍MS培养基的微量元素。
在一些实施方案中,所述共培养基还包含N6培养基的铁盐。在一些实施方案中,所述共培养基还包含N6培养基的有机质。在一些实施方案中,所述共培养基还包含800mg/L水解酪蛋白。在一些实施方案中,所述共培养基还包含2-3mg/L 2,4-D。在一些实施方案中,所述共培养基还包含20g/L麦芽糖。在一些实施方案中,所述共培养基还包含10g/L葡萄糖。在一些实施方案中,所述共培养基还包含200mg/L乙酰丁香酮。在一些实施方案中,所述共培养基还包含7g/L琼脂。在一些实施方案中,所述共培养基的pH值为5.2。
在一些实施方案中,本申请的培养基组合还包括悬浮培养基,所述悬浮培养基包含AA培养基的大量元素、微量元素、铁盐、甘氨酸、肌醇和烟酸硫胺素。
在一些实施方案中,所述悬浮培养基还包含100-300mg/L天冬氨酸。在一些实施方案中,所述悬浮培养基还包含500-1000mg/L谷氨酸。在一些实施方案中,所述悬浮培养基还包含100-300mg/L精氨酸。在一些实施方案中,所述悬浮培养基还包含2mg/L 2,4-D。在一些实施方案中,所述悬浮培养基还包含20g/L麦芽糖。在一些实施方案中,所述悬浮培养基还包含10g/L葡萄糖。在一些实施方案中,所述悬浮培养基还包含200mg/L乙酰丁香酮。在一些实施方案中,所述悬浮培养基的pH值为5.2。
在一些实施方案中,本申请的培养基组合还包括诱导水稻愈伤组织的诱导培养基,其中所述诱导培养基包含N6培养基的大量元素和10倍 B5培养基的微量元素。在一些实施方案中,所述诱导培养基还包含N6培养基的铁盐。在一些实施方案中,所述诱导培养基还包含B5培养基的有机质。在一些实施方案中,所述诱导培养基还包含200-600mg/L谷氨酸。在一些实施方案中,所述诱导培养基还包含300-800mg/L脯氨酸。在一些实施方案中,所述诱导培养基还包含300-800mg/L水解酪蛋白。在一些实施方案中,所述诱导培养基还包含2-3mg/L 2,4-D。在一些实施方案中,所述诱导培养基还包含30g/L麦芽糖。在一些实施方案中,所述诱导培养基还包含3g/L Phytagel。在一些实施方案中,所述诱导培养基的pH值为5.8。
在一些实施方案中,本申请的培养基组合还包括对水稻愈伤组织进行继代培养的继代培养基,其中所述继代培养基包含N6培养基的大量元素和10倍B5培养基的微量元素。在一些实施方案中,所述继代培养基还包含N6培养基的铁盐。在一些实施方案中,所述继代培养基还包含B5培养基的有机质。在一些实施方案中,所述继代培养基还包含200-600mg/L谷氨酸。在一些实施方案中,所述继代培养基还包含300-800mg/L脯氨酸。在一些实施方案中,所述继代培养基还包含300-800mg/L水解酪蛋白。在一些实施方案中,所述继代培养基还包含2-3mg/L 2,4-D。在一些实施方案中,所述继代培养基还包含30g/L麦芽糖。在一些实施方案中,所述继代培养基还包含3g/L Phytagel。在一些实施方案中,所述继代培养基的pH值为5.8。
在一些实施方案中,本申请的培养基组合还包括对继代培养后的水稻愈伤组织进行预培养的预培养基,其中所述预培养基包含N6培养基的大量元素和10倍B5培养基的微量元素。在一些实施方案中,所述预培养基还包含N6培养基的铁盐。在一些实施方案中,所述预培养基还包含B5培养基的有机质。在一些实施方案中,所述预培养基还包含200-600mg/L谷氨酸。在一些实施方案中,所述预培养基还包含300-800mg/L脯氨酸。在一些实施方案中,所述预培养基还包含300-800mg/L水解酪蛋白。在一些实施方案中,所述预培养基还包含2-3mg/L 2,4-D。在一些实施方案中,所述预培养基还包含30g/L麦芽糖。在一些实施方案中,所述预培养基还包含200mg/L乙酰丁香酮。在一些实施方案中, 所述预培养基还包含3g/L Phytagel。在一些实施方案中,所述预培养基的pH值为5.8。
在一些实施方案中,本申请的培养基组合还包括对筛选后的抗草甘膦水稻愈伤组织进行分化培养的分化培养基,其中所述分化培养基包含N6培养基的大量元素、10倍B5培养基的微量元素和50-400mg/L草甘膦。在一些实施方案中,所述筛选培养基还包含250mg/L羧苄青霉素。在一些实施方案中,所述分化培养基还包含N6培养基的铁盐。在一些实施方案中,所述分化培养基还包含B5培养基的有机质。在一些实施方案中,所述分化培养基还包含300-800mg/L脯氨酸。在一些实施方案中,所述分化培养基还包含800-1000mg/L水解酪蛋白。在一些实施方案中,所述分化培养基还包含2mg/L 6-苄氨基腺嘌呤。在一些实施方案中,所述分化培养基还包含2mg/L 6-糖基氨基嘌呤。在一些实施方案中,所述分化培养基还包含0.2mg/L萘乙酸。在一些实施方案中,所述分化培养基还包含0.2mg/L吲哚乙酸。在一些实施方案中,所述分化培养基还包含20g/L麦芽糖。在一些实施方案中,所述分化培养基还包含10g/L蔗糖。在一些实施方案中,所述分化培养基还包含3g/L Phytagel。在一些实施方案中,所述分化培养基的pH值为6.0。
在一些实施方案中,本申请的培养基组合还包括用于对分化培养获得的再生苗进行生根培养的生根培养基,其中所述生根培养基包含MS培养基。在一些实施方案中,所述生根培养基还包含20g/L蔗糖。在一些实施方案中,所述生根培养基还包含3g/L Phytagel。在一些实施方案中,所述生根培养基的pH值为5.8。
在一方面,本申请涉及抗草甘膦水稻愈伤组织的制备方法,其包括以下步骤:
(1)利用包含抗草甘膦基因的农杆菌菌液在悬浮培养基中侵染水稻愈伤组织;
(2)将侵染后的愈伤组织转移到共培养基上进行共培养;
(3)将共培养后的愈伤组织转移到添加了草甘膦的筛选培养基上进行筛选培养,获得抗草甘膦的水稻愈伤组织。
在一些实施方案中,所述水稻为籼稻。在一些实施方案中,所述水 稻为品种9311和/或品种明恢63。
在一些实施方案中,所述农杆菌为农杆菌EHA105。在一些实施方案中,所述抗草甘膦基因为Epsps-CP4基因。在一些实施方案中,所述农杆菌还包含GFP基因。在一些实施方案中,所述农杆菌包含与所述Epsps-CP4基因可操作地连接的Ubi启动子。在一些实施方案中,所述农杆菌包含于所述GFP基因可操作地连接的35S启动子。在一些实施方案中,其中侵染用农杆菌菌液浓度为OD600=0.05-0.8。在一些实施方案中,侵染时间为10-15分钟。
在一些实施方案中,所述共培养基为上述培养基组合中的共培养基。在一些实施方案中,所述共培养的条件为20-28℃暗条件下3-4天。
在一些实施方案中,其中所述筛选培养基为上述筛选培养基;任选地所述筛选培养的条件为28℃暗条件下4-6周。
在一些实施方案中,所述方法还包括在诱导培养基上诱导水稻愈伤组织。在一些实施方案中,所述诱导培养基为上述培养基组合中的诱导培养基。在一些实施方案中,所述诱导培养的条件为28-36℃暗条件下2-4周。
在一些实施方案中,所述方法还包括将诱导得到的水稻愈伤组织在继代培养基上进行愈伤组织继代培养。在一些实施方案中,所述诱导培养基为上述培养基组合中的继代培养基。在一些实施方案中,所述继代培养的条件为28-36℃暗条件,每2周一个继代周期。
在一些实施方案中,所述方法还包括将继代培养获得的愈伤组织转移到预培养基上进行预培养。在一些实施方案中,所述预培养基为上述培养基组合中的预培养基。在一些实施方案中,所述预培养的条件为28℃暗条件下3-6天。
在一些实施方案中,本申请涉及获得抗草甘膦的水稻幼苗的方法,其包括将通过上述方法获得的抗草甘膦水稻愈伤组织转入分化培养基进行分化培养,获得再生水稻幼苗。在一些实施方案中,所述分化培养基为上述培养基组合中的分化培养基。在一些实施方案中,所述分化培养的条件为28℃、16小时光/8小时暗。
任选地所述方法还包括将分化培养获得的再生苗转入生根培养基中 培养,获得生根水稻幼苗。在一些实施方案中,所述生根培养基为上述培养基组合中的生根培养基;在一些实施方案中,所述生根培养的条件为16小时光/8小时暗的光周期。
本申请中使用的基础培养基配方在表1-4中列出。
表1 N6培养基的配方
表2 B5培养基的配方
表3 MS培养基的配方
表4 AA培养基的配方
在上述实施方案中的任一项中,本申请的抗草甘膦基因为根据US RE39247E中公开的cp4的蛋白序列进行密码子优化而得。在一具体实施方案中,cp4蛋白质具有序列表中SEQ ID NO:2所描述的氨基酸序列。在一具体实施方案中,本申请的抗草甘膦基因具有序列表中SEQ ID NO:1所描述的核苷酸序列。
以下实施例用于说明本申请,但不用来限制本申请的范围。在不背离本申请精神和实质的情况下,对本申请组分、方法、步骤或条件所作的修改或替换,均属于本申请的范围。
实施例
实施例1抗草甘膦转基因水稻的制备
1.诱导愈伤组织
(1)取9311或明恢63水稻成熟种子,去壳后用75%的乙醇消毒0.5-1分钟;
(2)40%(V/V)的次氯酸钠溶液(NaClO)消毒10-15分钟;
(3)灭菌水冲洗3次;
(4)将消毒好的种子接种于诱导培养基上;
(5)28-36℃暗培养30天。
2.愈伤组织的继代培养
挑选外表嫩黄色、表面干燥、质地紧实的愈伤组织放置于继代培养基上,28-36℃暗培养,每2周为一个周期进行继代培养。
3.愈伤组织的预培养
挑选外表嫩黄色、表面干燥、质地紧实的颗粒状愈伤组织放置于预培养基上,28℃暗培养3-6天。
4.农杆菌的准备
1)于无菌工作台上,将-70℃冰箱中保存的含抗草甘膦基因Epsps-CP4的(根据US RE39247E中公开的cp4的蛋白序列进行密码子优化而得)表达载体的农杆菌菌株取出,用酒精灯灼烧灭菌金属接种环,冷却后蘸取少量农杆菌,在含50mg/L卡那霉素和20mg/L利福平的平板培养基上划线;
2)将划线平板培养基用Parafilm封口膜封好,置于28℃培养箱中培养两天;
3)用已灭菌的接种环蘸取少量LB划线平板上生长的农杆菌,接种于含50mg/L卡那霉素和20mg/L利福平的LB液体培养基,置无菌的50ml离心管中,放入28℃摇床震荡培养20小时;
4)将菌液离心,除去上清液;
5)用移液器吸取悬浮培养基添加到去除了上清液的上述50ml离心管中,调整OD600值至0.05-0.8。
5.农杆菌侵染
1)将上述含有农杆菌的悬浮培养基倒入装有经过预培养的愈伤组织的三角瓶至完全浸没愈伤,浸泡10-15分钟;
2)倒掉悬浮培养基,将侵染后的愈伤组织转移至装有灭菌滤纸的培养皿中,吸干愈伤组织表面多余的菌液;
3)将吸干的愈伤组织转移到共培养基上,放置于20-28℃的培养箱中暗培养3-4天。
6.水洗
1)将共培养后的愈伤组织转移至无菌三角瓶中;
2)倒入灭菌水至完全侵没愈伤组织,摇晃2-3分钟,倒掉洗涤水;
3)重复上述2)步骤2-3次直至洗涤水呈澄清状态,倒掉洗涤水;
4)加入含500mg/L羧苄青霉素的灭菌水浸泡愈伤,轻微晃动后静置30分钟;
5)倒掉浸泡液体,将愈伤组织转入装有灭菌滤纸的培养皿中,吸干水分。
7.筛选
将吸干水分的愈伤组织转移到筛选培养基上,28℃暗培养2-3个周期,每个周期为2周。比较不同草甘膦浓度筛选效果(如表5所示)。当草甘膦浓度为50mg/L时,生成的抗性愈伤经PCR检测阳性率为23.77%(9311)、30%(明恢63);当草甘膦浓度提高到100mg/L时,PCR检测阳性率达93.28%(9311)、85.71%(明恢63);当草甘膦浓度达到400mg/L时,PCR检测阳性率达100%。因此,本申请所述的选择培养基中草甘膦的添加量为终浓度范围在50-400mg/L之间。
表5 不同草甘膦浓度对9311转化的实验例
表6 不同草甘膦浓度对明恢63转化的实验例
8.分化
将筛选阶段生成的抗性愈伤转入分化培养基上,28℃、16小时光/8小时暗的光周期条件培养。
9.生根培养
将分化形成的再生小苗转入含生根培养基的培养盒中,16小时光/8小时暗的光周期条件培养至长出白色的新根。
10.炼苗及移栽
幼苗生根长成后,打开生根培养盒,置室内光线充足处炼苗;2-3天后将苗取出,洗净根部的残留培养基,移栽至穴盘置温室中,待长出新叶后移栽到盆钵中栽培。
实施例1中使用的培养基配方在以下列出。
诱导培养基包含N6培养基的大量元素、10倍B5培养基的微量元素、N6培养基的铁盐、B5培养基的有机质、200-600mg/L谷氨酸、300-800mg/L脯氨酸、300-800mg/L水解酪蛋白、2-3mg/L 2,4-D、30g/L麦芽糖和3g/L Phytagel,pH值为5.8。
继代培养基包含N6培养基的大量元素、10倍B5培养基的微量元素、N6培养基的铁盐、B5培养基的有机质、200-600mg/L谷氨酸、300-800mg/L脯氨酸、300-800mg/L水解酪蛋白、2-3mg/L 2,4-D、30g/L麦芽糖和3g/L Phytagel,pH值为5.8。
预培养基包含N6培养基的大量元素、10倍B5培养基的微量元素、N6培养基的铁盐、B5培养基的有机质、200-600mg/L谷氨酸、300-800mg/L脯氨酸、300-800mg/L水解酪蛋白、2-3mg/L 2,4-D、30g/L麦芽糖、200mg/L乙酰丁香酮和3g/L Phytagel,pH值为5.8。
悬浮培养基包含AA培养基的大量元素、微量元素和铁盐,以及100-300mg/L天冬氨酸、500-1000mg/L谷氨酸、100-300mg/L精氨酸、2mg/L 2,4-D、20g/L麦芽糖、10g/L葡萄糖和200mg/L乙酰丁香酮,pH值为5.2。
共培养基包含3/10倍MS培养基的大量元素、1/2倍MS培养基的微量元素、N6培养基的铁盐、N6培养基的有机质、800mg/L水解酪蛋白、2-3mg/L 2,4-D、20g/L麦芽糖、10g/L葡萄糖、200mg/L乙酰丁香 酮和7g/L琼脂,pH值为5.2。
筛选培养基包含N6培养基的大量元素、10倍B5培养基的微量元素、N6培养基的铁盐、B5培养基的有机质、200-600mg/L谷氨酸、300-800mg/L脯氨酸、2-3mg/L 2,4-D、30g/L麦芽糖、250mg/L羧苄青霉素、50-400mg/L草甘膦和7g/L琼脂,pH值为5.8。
分化培养基包含N6培养基的大量元素、10倍B5培养基的微量元素、N6培养基的铁盐、B5培养基的有机质、300-800mg/L脯氨酸、800-1000mg/L水解酪蛋白、2mg/L 6-苄氨基腺嘌呤、2mg/L 6-糖基氨基嘌呤、0.2mg/L萘乙酸、0.2mg/L吲哚乙酸、20g/L麦芽糖、10g/L蔗糖、50-400mg/L草甘膦和3g/L Phytagel,pH值为6.0。
生根培养基包含MS培养基、20g/L蔗糖、3g/L Phytagel,pH值为5.8。
实施例2转基因9311水稻的鉴定
1.转基因水稻中外源基因GFP在组织中的表达观察
取实施例1的转基因9311和明恢63水稻植株根和叶片进行外源基因(GFP)在组织中的表达观察,在荧光下呈亮绿色,说明外源基因成功表达,否则为阴性材料,阴性材料与阳性材料相比,在荧光下为显色。结果见图2A,图2B。
2.转基因植株中外源基因阳性检测
取实施例1的转基因植株叶片,在DNA水平上做外源基因的阳性检测。步骤如下:叶片抽提总DNA,DNA抽提方法为CTAB法(Murray et al,Rapid isolation of high molecular weight plant DNA.Nucleic Acids Res,1980,8:4321-4325)。将得到的DNA作为模板做普通PCR。
通过PCR方法利用Epsps-CP4引物进行阳性检测。Epsps-CP4引物序列为:
CP4-L:TCAATAGCAGCAACCTCTC;
CP4-R:ATAGTCCTCACGCCATCA。
PCR反应总体积为20μl,具体配法是:模板100ng,10×PCR缓冲 液2μl,10mM dNTP 1.6μl,2.5mM Mg2-1.5μl,正向引物、反向引物各0.4μl,TAQ酶0.2μl,加水到20μl。PCR反应条件如下:①94℃预变性4分钟,②94℃变性1分钟,③56℃退火1分钟,④72℃延伸2.5分钟,⑤从②-④循环32次,⑥72℃延伸10分钟,⑦4℃保存。PCR产物在1%的琼脂糖凝胶上电泳检测。因为Epsps-CP4基因为本申请遗传转化载体所特有,这样能扩增出Epsps-CP4基因特异带的转基因植株即为阳性植株,否则即为阴性材料。实施例3制得的转基因水稻的基因检测结果如图3所示。
表7 28℃条件下诱导/继代所得愈伤的转化实验例
表8 32℃条件下诱导/继代所得愈伤的转化实验例
表9 36℃条件下诱导/继代所得愈伤的转化实验例
表10 不同预培养天数的转化实验例
表11 共培养4天的转化实验例
表12 共培养3天的转化实验例
表13 不同农杆菌菌液浓度侵染的转化实验例
表14 转化效率实验例
3.转基因植株拷贝数检测
为了检测转基因植株中的拷贝数,选取经实时PCR检测为单拷贝的样本,采用DNA印迹方法对转基因植株进行更精确的分析。参照Lu et al.Localization of pms3,a gene for photoperiod-sensitive genic male sterility,to a 28.4-kb DNA fragment.Mol Genet Genomics,2005,273:507-511所述的方法进行DNA印迹。在37℃条件下,用适当的核酸内切酶消化总DNA过夜,然后在1%(w/v)的琼脂糖凝胶上分离并转移到硝酸纤维膜上。使用Roche公司的地高辛标记和检测试剂盒(DIG High Primer DNA Labeling and Detection Starter Kit I),参照厂商的说明书,进行探针标记和杂交。结果显示检测的植株都是单拷贝。这表明了外源基因已经稳定地整合到了植物基因组上。转基因植株DNA印迹检测结果如图4所示。
本说明书中提及的所有出版物和专利申请通过引用并入本文,其引用程度如同单独指出通过引用并入的每个出版物或专利申请。
本领域技术人员将认识到,或仅仅使用常规实验即能够确定本文所描述的具体实施方案的许多等同形式。本发明的范围并不旨在限制于以上描述。替代性方法和材料以及另外的应用对于本领域技术人员来说将是显而易见的,并且旨在包括在权利要求书所限定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!