一株高产红曲色素中间产物的红色红曲菌突变株及其用途的制作方法
本发明属于分子生物学与生物技术领域,涉及一株高产红曲色素中间产物的红色红曲菌(Monascus ruber)工程菌的筛选及其应用。
背景技术:
红曲菌(Monascus spp.)又称为红曲霉,是我国及东南亚国家传统的食品发酵微生物,主要用于红曲的生产。红曲是红曲菌发酵米饭后的产物,根据用途不同,红曲可分为色曲、功能曲以及酿酒曲3类,其中色曲是GB2760中允许使用的微生物源天然食品添加剂。此外,红曲菌还可产生多种有益次级代谢产物,如降血脂药物莫纳可林K、降血压药物γ-氨基丁酸和食品着色剂红曲色素(Monascus pigments)等。
红曲色素是红曲菌分泌的次级代谢产物,属于嗜氮酮类化合物,主要包括红、橙和黄3类色素组分,目前至少已有鉴定出90多种红曲色素。红曲色素除具着色功能外,部分红曲色素还具有抗氧化、消炎和抗癌等生物活性,也有报道称红曲色素还可作为太阳能电池原料。红曲色素在食品、医药、工业等领域展现了良好应用前景,潜在经济价值巨大。
红曲色素由聚酮合成途径(polyketone synthesis)合成,但合成途径目前仍存争议。近年来,通过基因敲除技术构建突变株,分析红曲色素合成基因簇基因功能,不仅为解析红曲色素的合成途径提供了重要研究材料,也为获取高品质色素产物(包括中间产物)提供了技术保障。本发明以红色红曲菌M7(CCAM 070120)为出发菌株,利用农杆菌介导转化,通过基因敲除技术筛选得到一株可大量分泌M7PKS-1[2,4-二羟基-6-(4-羟基-2-氧代戊基)-3-甲基苯甲醛]的突变株。M7PKS-1属苯甲醛类衍生物,分子量为252,最大摩尔吸光系数为17640,具备近紫外吸收特性,仅存在于野生菌红色红曲菌M7生长早期(3-9天),为红曲色素生物合成途径中的重要初始中间产物,该菌株高产M7PKS-1的特征,既可用于红曲色素的合成途径分析,也可用于生产高品质的红曲色素,还可用于开发防晒剂,具有良好的商业和科研价值。
技术实现要素:
本发明目的在于采用农杆菌介导的基因敲除技术,筛选得到了一株高产M7PKS-1的基因缺失突变株;并建立了固体发酵法获取高产量M7PKS-1的方法。
为实现上述目的,本发明采取的技术方案为:一株高产红曲色素中间产物的突变株,其特征在于,所述菌株保藏在中国典型培养物保藏中心,其保藏号为CCTCC M2015074,菌株保藏名为Monascus ruber ISM,分类命名为红色红曲菌(M.ruber)ΔMpigJ-R。
本发明的红色红曲菌ΔMpigJ-R的形态学特征为:菌株ΔMpigJ-R在PDA培养基中28℃培养3天即可见清晰的直径约2cm白色菌落,菌落扁平开展,无褶皱,气生菌丝浓密,菌落生长至10天左右背面呈浅黄色。
所述菌株ΔMpigJ-R是以红色红曲菌M7为出发菌株,通过基因敲除技术筛选得到的。
具体方法如下:通过Double-joint PCR方法得到的MpigJ基因序列同源臂和筛选标记hph(潮霉素B抗性基因)的重组片段,其中MpigJ基因序列的同源臂位于筛选标记hph两侧,即为MpigJ敲除盒重组片段;然后通过根瘤农杆菌介导,将MpigJ敲除盒重组片段转入到红 色红曲菌M7的孢子中,MpigJ敲除盒两段同源臂与基因组上目的基因MpigJ相对应的同源序列发生双交换重组,使抗性基因hph置换原有的基因编码区,在筛选敲除子过程中,筛选到一株形态特征变化明显的突变株,即本发明所述菌株,并经验证ΔMpigJ-R菌株的基因型为ΔMpigJ-hph-ΔMpigK-ΔMpigL-ΔMpigM-ΔMpigN-ΔMpigP-ΔMpigQ-ΔMpigR,所用引物见表1,验证步骤如下:
1)DNA水平的验证。分别取红色红曲菌M7及ΔMpigJ-R 100μL红曲菌孢子悬浮液(105cfu/mL)接种到铺有玻璃纸的PDA平板上,28℃培养3-5天,收集菌丝,CTAB法抽提红色红曲菌M7及ΔMpigJ-R基因组DNA。以基因组DNA为模板PCR验证ΔMpigJ-R菌株基因背景。
2)RNA水平的验证。分别取红色红曲菌M7及ΔMpigJ-R 100μL红曲菌孢子悬浮液(105cfu/mL)接种到铺有玻璃纸的PDA平板上,28℃培养3-5天,收集菌丝,Trozlo法抽提红色红曲菌M7及ΔMpigJ-R基因组RNA。将所抽提RNA反转为cDNA,以cDNA为模板PCR分析ΔMpigJ-R菌株的基因表达水平。
表1ΔMpigJ-R菌株基因背景的验证所用引物
本发明所述红色红曲菌ΔMpigJ-R产物M7PKS-1的分析
1)菌株选择:红色红曲菌ΔMpigJ-R(CCTCC M2015074)。
2)菌株活化:将上述菌株接种于含有质量百分比为1.5%的琼脂固体PDA斜面上,28℃下静置培养10天。
3)固态发酵:将步骤2)中培养的菌株,在无菌条件下以5mL无菌水洗涤孢子,置于28℃摇床以150转/min振荡30min-1h,将孢子打散。按1%的接种量接种ΔMpigJ-R孢子液(105cfu/mL)于50g米饭培养基中,28℃静置培养7-15天。
4)M7PKS-1的提取纯化:发酵结束后,将样品于40℃烘干至恒重后磨碎,以80%乙醇,1:5料液比,超声提取30min。提取液于12000转/min离心10min,收集上清液,通过反相高效液相色谱的外标定量法,分析固体发酵样品中的M7PKS-1产量可达10mg/g。
5)步骤4)所述的反相高效液相色谱条件为,流动相为乙腈:水=1:1,流速为0.8mL/min,柱温为30℃,M7PKS-1的保留时间为5.3min,检测波长为294nm。
本发明利用分子生物学技术获得并公开了工程菌株红色红曲菌ΔMpigJ-R,该菌株红曲色素基因簇中的基因型为ΔMpigJ-∷hph-ΔMpigK-ΔMpigL-ΔMpigM-ΔMpigN-ΔMpigP-ΔMpigQ-ΔMpigR,菌株保藏号为CCTCC M2015074,该菌株的产物M7PKS-1在发酵红曲米中的产量可达10mg/g。该产物也存在于野生菌红色红曲菌M7的生长早期(3-9天),是红曲色素合成途径中的重要初始产物,可用于红曲色素的合成途径分析。此外,该产物最大紫外-可见吸收波长为294nm,其最大摩尔吸光系数为17640,具备近紫外吸收特性,还可用于开发紫外吸收剂,具有良好的商业和科研价值。
附图说明
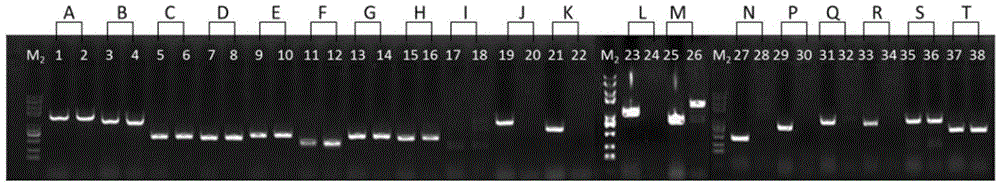
图1以基因组DNA为模板,红色红曲菌M7及ΔMpigJ-R色素合成基因簇相关基因的扩增结果。单数条带(即条带1,3,5,7,9,11,13,15,17,19,21,23,25,27,29,31,33,35,37)均为以M7基因组为模板扩增产物,偶数条带(即条带2,4,6,8,10,12,14,16,18,20,22,24,26,28,30,32,34,36,38)均为以ΔMpigJ-R基因组为模板扩增产物。
图2以cDNA为模板,红色红曲菌M7及ΔMpigJ-R色素合成基因簇相关基因的扩增结果。左侧条带均为以M7基因组为模板扩增产物,右侧条带均为以ΔMpigJ-R基因组为模板扩增产物。
图3本发明所述一株高产红曲色素中间产物突变株ΔMpigJ-R的产物M7PKS-1的的质谱图。
图4本发明所述一株高产红曲色素中间产物突变株ΔMpigJ-R的产物M7PKS-1的化学结构式。
图5在PDB液态发酵培养条件下的芳香醇脱氢酶缺失突变株ΔMpigE中添加M7PKS-1可显著增加黄色素FK17-P2b2的产量。
图6在PDB液态发酵培养条件下的芳香醇脱氢酶缺失突变株ΔMpigE中添加M7PKS-1可显著增加黄色素monasfluore A的产量。
图7所述红色红曲菌ΔMpigJ-R与出发菌株红色红曲菌M7(CCAM 070120)在PDB液态发酵培养条件下胞内M7PKS-1的含量差异。
图8所述红色红曲菌ΔMpigJ-R与出发菌株红色红曲菌M7(CCAM 070120)在PDB液态发酵培养条件下胞外M7PKS-1的含量差异。
具体实施方式
微生物来源
实施例中的出发菌株红色红曲菌(Monascus ruber)M7已于2005年保藏于中国典型培养物保藏中心,其保藏号为CCAM 070120。
所述转化培养基包括以下组份。
1)10×常量元素溶液(1L):NH4NO3,5g,NaCl,3g,CaCl2·2H2O,0.1g,MgSO4·7H2O,6g,KH2PO4,1.36g。4℃保存。
2)200×微量元素溶液(100mL):CuSO4·5H2O,10mg,ZnSO4·7H2O,10mg,H3BO3,10mg,Na2MoO4·2H2O,10mg。4℃保存。
3)1000×铁盐溶液(100mL):Na2-EDTA·2H2O,0.130g,FeSO4·7H2O,0.100g。4℃保存。
4)1mol/L 2-N-吗啉基乙磺酸(MES)溶液:MES 9.8g,用去离子水溶解,以2mol/L NaOH调pH至5.5,定容至50mL,过滤除菌,分装至无菌离心管,-20℃保存。
5)0.1mol/L乙酰丁香酮(AS)全称溶液:AS 0.196g,用10mL二甲基亚砜溶解,分装至无菌离心管,-20℃保存。
6)20%葡萄糖溶液:2g葡萄糖溶于去离子水中,定容至10mL,115℃灭菌备用。
所述诱导培养基(Induction medium,IM)(100mL):10×IM大量元素溶液,10mL,200×微量元素溶液,0.5mL,1000×铁盐溶液,0.1mL,50%甘油,1mL,121℃灭菌20min。使用前补加如下试剂:1mol/L MES,1mL,20%葡萄糖,1ml,0.1mol/L AS,0.2mL。
所述共培养培养基Cocultivation medium(Co-IM)(100mL):10×IM常量元素溶液,10mL,200×微量元素溶液,0.5mL,1000×铁盐溶液,0.1mL,50%甘油,1mL,琼脂粉,2g,121℃灭菌20min。使用前补加如下试剂:1mol/L MES,1mL,20%葡萄糖,0.5mL,0.1mol/L AS,0.4mL。
所述抗性筛选培养基:
100g/L头孢霉素(Cefalothin Sodium,CS):2.5g CS溶于25mL去离子水中,过滤除菌,分装至无菌离心管,现配现用。
土豆固体(PDA)培养基(1L):土豆200g,葡萄糖20g,琼脂15g,121℃灭菌20min。使用前加入潮霉素B溶液和头孢霉素溶液,使其终浓度分别为30mg/L和0.5g/L。
所述发酵培养基:
1)土豆液体(PDB)培养基(1L):土豆200g,葡萄糖20g,琼脂15g,121℃灭菌20min。
2)米饭培养基:称取优质大米200g,以1L去离子水浸泡2h,沥干水分,分装至250mL三角瓶中,每瓶50g,121℃灭菌20min,趁热将米粒打散备用。
红色红曲菌基因组DNA的提取:
1)取1-2g培养3-4天的菌丝,放入-80℃预冷研钵中加液氮迅速研磨成粉末,在粉末融化前按0.2g/mL的比例加入65℃预热的5%CTAB提取缓冲液,继续研磨至完全融化,转入已灭菌的离心管,65℃水浴30min,其间每10min取出摇匀一次。
2)取出样品后,冷却至室温,加入等体积的苯酚/氯仿(1:1),充分混匀,12000转/min离心10min。
3)转移上清于新的1.5mL离心管中,加入等体积氯仿,充分混匀,12000转/min离心10min。
4)转移上清于新的1.5mL离心管中,加入1/10体积3mol/L的醋酸钠和0.6倍体积的异丙醇,充分混匀后,-20℃沉淀30min以上,12000转/min离心10min。
5)弃上清,沉淀用500μL 75%乙醇洗涤,12000转/min离心5min,弃上清。重复洗涤一次。
6)沉淀晾干后加入50μL TE溶解,加5μL RNase(10mg/mL)37℃处理2h。凝胶电泳检测其质量,4℃短期保存,或-20℃长期保存。
5%CTAB提取缓冲液(100mL):CTAB(cetyltrimethylammonium bromide)5g,PVP(polyvinylpyrrolidone)40,2g,NaCl,8.2g,0.5mol/L EDTA(pH8.0),4mL,1mol/L Tris-HCl(pH8.0),10mL。
红色红曲菌总RNA的提取:
1)液氮预冷研钵,取0.1g菌丝体放入研钵中,液氮研磨成粉末,转入灭过菌的1.5mL离心管内。
2)加入1mL的Trizol Reagent,使其覆盖粉末,剧烈震荡使其混匀,静置5min。
3)加入250μL三氯甲烷,颠倒离心管,充分混匀,静置5min,4℃,12000转/min离心15min。
4)将上清转移到新的1.5mL离心管中,加入等体积的异丙醇,颠倒混匀,-20℃放置15min,4℃,12000转/min离心10min,弃上清,管底的白色沉淀即为RNA。
5)加入75%(v/v)乙醇500μL洗涤沉淀,4℃,7500转/min离心5min。重复一次。
6)将管底液体吸除干净,将离心管置于超净台上自然挥干5min,加入20μL DEPC(焦碳酸二乙酯)水溶解RNA。凝胶电泳及紫外分光光度计分析RNA的含量及纯度。
红色红曲菌RNA反转录:
1)模板RNA混合液(6μL):取一PCR管,加入含1μg RNA的溶液,50μmol/L oligo(dT)1μL,DEPC水补足至6μL。
2)70℃保温10min后迅速冰上急冷2min以上,离心数秒使其聚集于管底部。
3)反转录反应液(10μL):模板RNA混合液6μL,5×M-MLV buffer 2μL,10μmol/L dNTP0.5μL,40U/mL Rnase inhibitor 0.25μL,RTase M-MLV(Rnase H-)0.25μL,DEPC水补足至10μL。
4)42℃保温1h,70℃保温15min后迅速冰上冷却,得到的cDNA溶液-70℃保存。
高产红曲色素中间产物M7PKS-1的菌株ΔMpigJ-R的筛选及验证:以潮霉素B(hph)为筛选标记,包括敲除盒的构建、敲除载体的构建、农杆菌介导的红曲转化三个步骤。
敲除盒的构建:
采用Double-joint PCR技术,将MpigJ的ORF区域的5’-同源臂(5’-UTR)和3’-同源臂(3’-UTR)分别连接在hph基因的两端。
从红色红曲菌M7基因组中克隆MpigJ基因的5’-同源臂和3’-同源臂,从质粒pSKH中克隆hph,采用Double-joint PCR融合3个片段,获得MpigJ敲除盒,融合体系是:2.5μL 10×Easy Taq BufferⅠ,1μL 10mmol/L dNTPs,0.2μL 5U/μL Easy Taq DNA Polymerase,5’-同源臂、hph、3’-同源臂纯化产物共600ng,按1:2:1(摩尔比)的比例加入融合体系,补水至25μL。Double-joint PCR程序是:94℃4min;(94℃30s,58℃4min,72℃4min)×15cycles;72℃7min。以融合PCR产物(敲除盒)为模板,敲除盒两端的引物5F/3R进行敲除盒的富集。PCR程序是:94℃4min;(94℃30s,55℃30s,72℃4min)×30cycles;72℃7min。0.8%(g/v)琼脂糖凝胶分离PCR产物,切胶回收敲除盒。引物序列表2所示:
表2构建ΔMpigJ敲除盒所用引物
实施例中的出发菌株红色红曲菌(Monascus ruber)M7已于2005年保藏于中国典型培养物保藏中心,其保藏号为CCAM 070120。本发明公开的工程菌红色红曲菌ΔMpigJ-R已于2015年1月29日保藏于中国典型培养物保藏中心,其保藏号为CCTCC M2015074,菌株保藏名为Monascus ruber ISM。
所述红色红曲菌ΔMpigJ-R所产红曲色素中间产物M7PKS-1的制备:
样品粗提取:称取固态发酵样品1g(干重),粉碎,加入10mL 80%乙醇超声提取30min,5000转/min离心5min,将上清转移至旋转蒸发瓶中,旋蒸直至将溶剂完全蒸干。加入5mL50%乙腈溶解旋蒸瓶中固体残留物,分装于2mL离心管中,12000转/min离心,上清液即为样品提取液。
固相萃取分离纯化:1)先后以1mL甲醇和1mL去离子水活化C18固相萃取小柱;2)取上述样品粗提取液500μL转入活化后的固相萃取小柱,加压使样品进入吸附剂;3)加入4mL去离子水洗涤弱保留干扰化合物;4)加入4mL40%甲醇水溶液洗脱,将洗脱液转移至旋转蒸发瓶中,旋蒸直至将溶剂完全蒸干,所得粉末称重后分装至1.5mL离心管中,-20℃保存,用于制备M7PKS-1。
半制备型HPLC色谱条件:Inertsil ODS-3色谱柱(4.6mm×250mm,10μm);柱温:30℃;流动相:酸水(去离子水中含5‰的H3PO4)/乙腈/水=5:50:45(v/v);流速:3.0mL/min;PDA检测器;检测波长:294nm。
HPLC分析条件:Inertsil ODS-3C18色谱柱(4.6mm×250mm,5μm);流动相为乙腈/水=50:50(V/V);流速0.8mL/min;柱温25℃;检测波长294nm。
所述红色红曲菌ΔMpigJ-R所产红曲色素中间产物M7PKS-1的结构鉴定。
采用质谱和核磁共振法鉴定了M7PKS-1的结构,质谱图谱见图3,1H谱、13C谱数据见表3。结果显示,M7PKS-1的相对分子质量为252,化学结构式如图4所示。
表3M7PKS-1的1H谱和13C谱数据
所述红色红曲菌ΔMpigJ-R所产红曲色素中间产物M7PKS-1对红曲色素合成的影响:
接种30μL新鲜红色红曲菌ΔMpigE孢子液及1mL 0.1g/mL M7PKS-1溶液至30mL PDB培养基中,28℃,120转/min振荡培养15天。HPLC检测M7PKS-1对ΔMpigE菌株(芳香醇脱氢酶缺失突变株)产色素能力的影响。ΔMpigE菌株为红色红曲菌M7芳香醇脱氢酶缺失突变株,该突变株只能产生五种黄色素,有利于M7PKS-1的功能分析。图5和图6说明在发酵的过程中添加少量的M7PKS-1,即可显著增加不同种类红曲黄色素的产量。
所述红色红曲菌ΔMpigJ-R(CCTCC M2015074)与出发菌株红色红曲菌M7(CCAM070120)在PDB液态发酵培养条件下,色素中间产物M7PKS-1的含量差异。图7,图8分别分析了红色红曲菌M7和ΔMpigJ-R胞内、胞外M7PKS-1的含量,结果说明在出发菌株红色红曲菌M7中M7PKS-1仅存在于发酵初期,而在所述菌株ΔMpigJ-R中大量积累,其最高含量是出发菌株最高含量的4倍,通过固态发酵,HPLC测定该产物的含量可达10mg/g。
本发明利用生物工程技术获得并公开了红色红曲菌工程菌株(ΔMpigJ-∷hph-ΔMpigK-ΔMpigLΔ-MpigM-ΔMpigN-ΔMpigP-ΔMpigQ-ΔMpigR,CCTCC M 2015074),与初始菌株红色红曲菌M7(CCAM 070120)相比,该突变株可以大量分泌红曲色素中间产物M7PKS-1[2,4-二羟基-6-(4-羟基-2-氧代戊基)-3-甲基苯甲醛],其固体发酵产量可达10mg/g。M7PKS-1为苯甲醛类衍生物,是红曲色素合成途径中的重要初始产物,其最大紫外-可见吸收波长为294nm,最大摩尔吸光系数为17640,具备近紫外吸收特性,适用于开发紫外吸收剂。该菌株高产M7PKS-1的特征,既可用于红曲色素的合成途径研究,也可用于高品质红曲色素的生产,还可用于开发紫外吸收剂产品,具有良好的商业和科研价值。
- 还没有人留言评论。精彩留言会获得点赞!