一种新的三萜化合物及其制备方法和医药用途与流程
本发明属于药物
技术领域:
,具体涉及从补骨脂干燥成熟果实中分离得到的一种具有肝脏保护作用的三萜化合物及其制备方法。
背景技术:
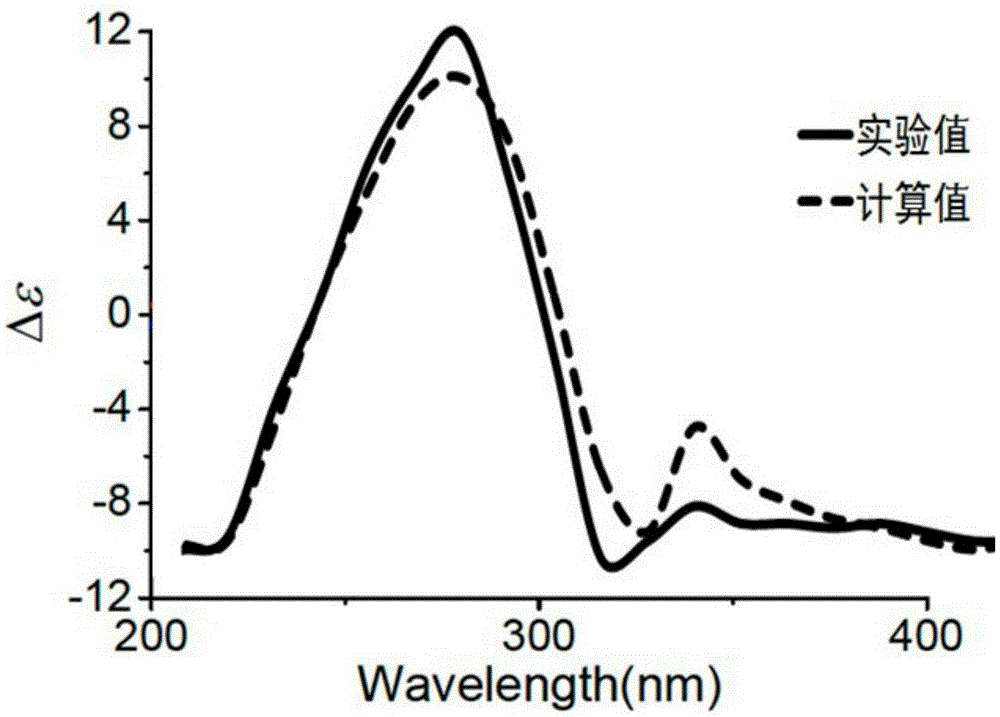
:补骨脂为豆科植物补骨脂PsoraleacorylifoliaL.的干燥成熟果实,始载于《雷公炮灸论》,具有补肾助阳、纳气、止泻的功效。历代中医用于肾虚、冷泻、遗滑精、小便频数、腰膝冷痛;外治用于皮肤病、白癜风等。补骨脂临床应用广泛,2010年版《中华人民共和国药典》收录含补骨脂的中成药有20余种。补骨脂化学化成分的研究最早见于1910年。自1933年从补骨脂中分离得到第一个纯品补骨脂(Psoralen),至今已分离鉴定了四十余种成分。近年来,又从中分得许多新的香豆素、黄酮及其他成分。目前,国内外学者对其化学成分研究较多,主要成分为香豆素类,黄酮类和三萜类化合物。(1)香豆素类:有呋喃香豆素如补骨脂素(Psoralen)和异补骨脂素(Isopsoralen)。拟雌内酯类如补骨脂定(Psoralidin)和双轻异补骨脂定(Eorylidin)。(2)黄酮类化合物,如查尔酮类:补骨脂甲素(Ocrylioflni)和补骨脂乙素(Eorylioflinin)。二氢黄酮类:补骨脂二氢黄酮(Bavaehin)、补骨脂二氢甲醚(Bavaehinin)和异补骨脂二氢黄酮(Isobavaehin)。异黄酮类:补骨脂异黄酮(Eorylin)和补骨脂醇黄酮体化合物。(3)单萜酚类:补骨脂酚(Bakuehiol)。(4)三萜类。(5)其它类成分有豆甾醇、β-谷甾醇葡萄糖苷、三十烷、葡萄糖、棉子糖、对轻基苯甲酸、树酯、结构未定的补骨脂醛、两种葡萄糖苷等三十余种物质。技术实现要素:本发明的目的是提供一种从补骨脂干燥成熟果实中分离得到的一种具有肝脏保护作用的三萜化合物及其制备方法。本发明的上述目的是通过下面的技术方案得以实现的:具有下述结构式的化合物(Ⅰ),所述的化合物(Ⅰ)的制备方法,包含以下操作步骤:(a)补骨脂干燥的成熟果实粉碎,用85%乙醇热回流提取,合并提取液,浓缩至无醇味,依次用石油醚、乙酸乙酯和水饱和的正丁醇萃取,分别得到石油醚萃取物、乙酸乙酯萃取物和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用大孔树脂除杂,依次用15%乙醇和75%乙醇洗脱,收集75%乙醇洗脱液,减压浓缩得75%乙醇洗脱物浸膏;(c)步骤(b)中75%乙醇洗脱浸膏用正相硅胶分离,依次用体积比为80:1、50:1、30:1、15:1和1:1的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分4用正相硅胶进一步分离,依次用体积比为20:1、12:1和5:1的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2用十八烷基硅烷键合的反相硅胶分离,用体积百分浓度为70%的甲醇水溶液等度洗脱,收集8-10个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(Ⅰ)。进一步地,所述大孔树脂为AB-8型大孔吸附树脂。药物组合物,其中含有治疗有效量的所述的化合物(Ⅰ)和药学上可接受的载体。所述的化合物(Ⅰ)在制备肝脏保护的药物中的应用。所述的药物组合物在制备肝脏保护的药物中的应用。本发明化合物用作药物时,可以直接使用,或者以药物组合物的形式使用。该药物组合物含有治疗有效量的本发明化合物(Ⅰ),其余为药物学上可接受的、对人和动物无毒和惰性的可药用载体和/或赋形剂。所述的可药用载体或赋形剂是一种或多种选自固体、半固体和液体稀释剂、填料以及药物制品辅剂。将本发明的药物组合物以单位体重服用量的形式使用。本发明药物可通过口服或注射的形式施用于需要治疗的患者。用于口服时,可将其制成片剂、缓释片、控释片、胶囊、滴丸、微丸、混悬剂、乳剂、散剂或颗粒剂、口服液等;用于注射时,可制成灭菌的水 性或油性溶液、无菌粉针、脂质体或乳剂等。说明书附图图1为化合物(Ⅰ)结构式;图2为化合物(Ⅰ)理论ECD值与实验ECD值比较;图3为化合物(Ⅰ)NOESY谱图。具体实施方式下面结合实施例进一步说明本发明的实质性内容,但并不以此限定本发明保护范围。尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。实施例1:化合物(Ⅰ)分离制备及结构确证试剂来源:乙醇、石油醚、乙酸乙酯、正丁醇、二氯甲烷为分析纯,购自上海凌峰化学试剂有限公司,甲醇,分析纯,购自江苏汉邦化学试剂有限公司。制备方法:(a)补骨脂干燥的成熟果实(8kg)粉碎,用85%乙醇热回流提取(25L×3次),合并提取液,浓缩至无醇味(6L),依次用石油醚(6L×3次)、乙酸乙酯(6L×3次)和水饱和的正丁醇(6L×3次)萃取,分别得到石油醚萃取物、乙酸乙酯萃取物(355g)和正丁醇萃取物;(b)步骤(a)中乙酸乙酯萃取物用AB-8型大孔树脂除杂,依次用15%乙醇(8L)和75%(12L)乙醇洗脱,收集75%乙醇洗脱液,减压浓缩得75%乙醇洗脱物浸膏(136g);(c)步骤(b)中75%乙醇洗脱浸膏用正相硅胶分离,依次用体积比为80:1(8个柱体积)、50:1(8个柱体积)、30:1(6个柱体积)、15:1(8个柱体积)和1:1(5个柱体积)的二氯甲烷-甲醇梯度洗脱得到5个组分;(d)步骤(c)中组分4(31g)用正相硅胶进一步分离,依次用体积比为20:1(8个柱体积)、12:1(10个柱体积)和5:1(6个柱体积)的二氯甲烷-甲醇梯度洗脱得到3个组分;(e)步骤(d)中组分2(11g)用十八烷基硅烷键合的反相硅胶分离,用体积百分浓度为70%的甲醇水溶液等度洗脱,收集8-10个柱体积洗脱液,洗脱液减压浓缩得到纯的化合物(Ⅰ)(23mg)。结构确证:白色粉末,易溶于氯仿、乙酸乙酯、丙酮和甲醇;HR-ESIMS显示[M+Na]+为m/z495.3512,结合核磁特征可得分子式为C30H48O4,不饱和度为7。核磁共振氢谱数据δH(ppm,DMSO-d6,400MHz):H-1(1.55,m),H-1(1.86,m),H-2(2.32,ddd,J=1.7,6.4,14.0),H-2(2.74,dt,J=6.4,14.0),H-3(3.93,m),H-5(1.73,m),H-6(1.17,m),H-6(2.07,m),H-7(0.95,m),H-7(1.58,m),H-8(1.60,m),H-11(1.38,m),H-11(1.60,m),H-12(1.35,m),H-12(1.40,m),H-15(1.61,m),H-15(1.75,m),H-16(1.35,m),H-16(1.97,m),H-17(2.23,m),H-18(0.96,s),H-19(0.78,d, J=4.0),H-19(0.58,d,J=4.0),H-20(1.76,m),H-21(3.41,dd,J=11.6,2.4),H-21(3.96,d,J=11.6),H-22(1.52,m),H-22(2.07,m),H-24(2.91,s),H-26(1.31,s),H-27(1.28,s),H-28(1.09,s),H-29(0.91,s),H-30(1.04,s);核磁共振碳谱数据δC(ppm,DMSO-d6,400Hz):33.6(CH2,1-C),37.7(CH2,2-C),64.7(CH,3-C),50.4(C,4-C),48.6(CH,5-C),26.8(CH2,6-C),21.7(CH2,7-C),49.1(CH,8-C),21.1(C,9-C),26.1(C,10-C),26.1(CH2,11-C),35.6(CH2,12-C),45.3(C,13-C),48.2(C,14-C),32.4(CH2,15-C),27.6(CH2,16-C),44.1(CH,17-C),18.8(CH3,18-C),29.8(CH2,19-C),37.7(CH,20-C),70.2(CH2,21-C),36.7(CH2,22-C),219.1(C,23-C),86.5(CH,24-C),74.3(C,25-C),28.7(CH3,26-C),24.0(CH3,27-C),21.0(CH3,28-C),19.6(CH3,29-C),22.4(CH3,30-C);碳原子标记参见图1。13CNMR谱显示有30个碳原子,包括6个甲基,11个亚甲基,6个次甲基,5个季碳,1个含氧叔碳和1个羰基碳。1HNMR谱表明有6个共振甲基信号(δH0.91,s;0.96,s;1.04,s;1.09,s;1.28,s;1.31,s),1个含氧亚甲基(δH3.96,d,J=11.6Hz;3.41,dd,J=11.6,2.4Hz),和2个含氧次甲基(δH3.93,m;2.91,d,J=9.2Hz)。C-21(δH3.41,3.96;δC70.2)和C-24(δH2.91;δC86.5)的核磁共振化学位移表明21,24位碳连有环氧结构,HMBC谱中H-21与C-24的相关峰进一步确定了此结构。综合1H-1HCOSY相关谱、HMBC谱和NOESY谱(图3),以及文献关于相关类型核磁数据,可基本确定该化合物如图1所示,立体构型进一步通过ECD试验确定,理论值与实验值基本一致(图2)。因此,最终确定该化合物结构如图1所示。实施例2:化合物(Ⅰ)药理作用试验一、材料和仪器HL7702肝细胞株由中国科学院上海生命科学研究所提供。化合物(Ⅰ)为自制(纯度大于98%)。高糖DMEM培养基、高糖DMEM/F12=1:1培养基、胎牛血清均购于HycLone。EDTA购于上海试剂一厂。台盼蓝购于北京化工厂。无糖DMEM培养基购于Gibco。胰酶、MTT、DMSO均购于Amresco。LDH释放法检测试剂盒购于GENMDE。ALT生化检测试剂盒、AST生化检测试剂盒、LDH生化检测试剂盒均购于美国贝克曼试剂有限公司。Western及IP细胞裂解液、PMSF、BCA蛋白浓度测定试剂盒、MDA检测试剂盒均购于碧云天生物研究所。CO2培养箱,SheL-Lab2300;电热恒温孵育箱,上海跃进医疗器械厂;缺氧培养盒,长沙长锦科技有限公司;酶标仪,美国BioTekEpoch;全自动生化仪,BeckmanLX20;离心机,德国Eppendorfcentrifμge5415D。二、试验方法1、细胞分组将细胞分为6组,每组6个复孔:(1)正常培养组(N组):完全培养基,正常条件下培养;(2)缺血再灌注组(IR组):完全培养基正常条件下培养1h后,模拟缺氧8h,再灌注4h;(3)化合物(Ⅰ)组:RE1组:化合物(Ⅰ)0.5ng/mL预处理1h;RE2组:化合物(Ⅰ)5ng/mL预处理1h;RE3组:化合物(Ⅰ)50ng/mL预处理1h;模拟缺氧8h,再灌注4h;(4)生理盐水组(NS组):以与化合物(Ⅰ)同等体积的生理盐水预处理1h,模拟缺氧8h,再灌注4h。2、化合物(Ⅰ)的预处理(1)化合物(Ⅰ)的配制:将1mg化合物(Ⅰ)溶解于500mL生理盐水中。移液枪吸取2.5mL于第一支离心管中,用生理盐水稀释至10mL配制成浓度为500ng/mL的化合物(Ⅰ)溶液。从第一支离心管中吸取1mL至第二支离心管中,用生理盐水稀释至10mL配制成浓度为50ng/mL的化合物(Ⅰ)溶液。从第二支离心管中吸取1mL至第三支离心管中,用生理盐水稀释至10mL配制成浓度为5ng/mL的化合物(Ⅰ)溶液。作好标记。(2)化合物(Ⅰ)预处理:正常培养组和缺血再灌注组以每孔100μL新鲜的完全培养基更换。RE1组每孔加入5ng/mL的化合物(Ⅰ)溶液10μL和新鲜的完全培养基90μL,RE2组每孔加入50ng/mL的化合物(Ⅰ)溶液10μL和新鲜的完全培养基90μL,RE3组每孔加入500ng/mL的化合物(Ⅰ)溶液10μL和新鲜的完全培养基90μL。生理盐水组每孔加入生理盐水10μL和新鲜的完全培养基90μL。轻轻摇动96孔板,使药液充分混混匀,放入CO2培养箱中孵育1h。3、肝细胞体外模拟缺血再灌注损伤模型的建立:(1)体外模拟缺血过程:预处理时间结束后,从细胞培养箱中取出第一块96孔板,正常培养组每孔用100μL完全培养基更换,放入CO2培养箱中继续培养8h。从CO2培养箱中取出第二块96孔板,缺血再灌注组、化合物(Ⅰ)预处理组和生理盐水组每孔用100μL无糖DMEM培养基置换完全培养基,放入缺氧培养盒中,培养盒中放入盛有50mL灭菌水的无菌小瓶保持饱和湿度。将缺氧培养盒放入37℃恒温孵育箱中,进气口连接94%N2-5%CO2-1%O2混合气体,出气口连接氧气检测仪。以2L/min的气体流量通入混合气体,当氧气检测仪显示出气口氧气浓度<1%时,调节混合气体流量300mL/min维持出气口氧气浓度<1%。以此模拟缺血过程8h。(2)体外模拟再灌注过程:从CO2培养箱中取出第一块96孔板,正常培养组每孔更换100μL新鲜的完全培养基,放入CO2培养箱中继续培养4h。从缺氧培养盒中取出第二块96 孔板,缺血再灌注组、化合物(Ⅰ)预处理组和生理盐水组每孔用100μL新鲜的完全培养基置换无糖DMEM培养基,放入CO2培养箱中正常条件下(37℃、5%CO2、95%空气、饱和湿度)培养4h,模拟再灌注过程。3、指标检测3.1MTT法检测肝细胞活力(1)MTT溶液配制:用电子微量天平称取250mgMTT,放入小烧杯中,加入50mLPBS搅拌30min,使之充分溶解,即为浓度为5mg/mL的MTT溶液。在超净工作台中用0.22μm微孔滤器除菌,分装为每支1mL,4℃避光保存备用。(2)细胞准备:按上述方法进行细胞分组,并另设调零孔。并按上述方法进行化合物(Ⅰ)预处理和体外模拟缺血再灌注过程。(3)呈色:终末时间点每孔加入5mg/mL的MTT溶液20μL,放入37℃、5%CO2、95%空气、饱和湿度的CO2培养箱中继续培养4h。终止培养,小心吸弃孔内上清液,每孔加入100μLDMSO溶液,微量振荡器上振荡10min,使结晶物充分溶解。(4)比色:选择570nm波长,在酶标仪上测定各孔吸收度(A),记录结果。实验重复2次。3.2乳酸脱氢酶释放法细胞繁殖与毒性检测按GENMED乳酸脱氢酶释放法细胞繁殖与毒性定量检测试剂盒说明书操作,实验重复2次。(1)按上述方法准备待测细胞,并另设无细胞的培养液(背景空对照孔)和未处理的后续裂解的细胞(样品最大酶活性对照孔),作好标记。(2)到规定的检测时间点前1小时,从CO2培养箱中取出待测的96孔细胞培养板,加入10μLGENMED裂解液到未处理的后续裂解的细胞孔里,同时加入10μLGENMED补充液到其余所有检测孔里。放回CO2培养箱中继续培养1小时即规定检测时间。(3)从CO2培养箱中取出待测的96孔细胞培养板,放入孔板离心机离心10min,速度为250g。(4)分别小心移取50μL上清液到新的96孔板的相应孔里,同时作好标记。(5)混匀GENMED反应液,每孔分别加入50μLGENMED反应液,再分别每孔加入10μLGENMED显色液,摇动96孔板混匀。(6)在室温下孵育30min,避免光照。(7)每孔分别加入10μLGENMED终止液。(8)即刻放进酶标仪里测定光吸收度(A),选择波长570nm。(9)根据以下公式计算细胞死亡率:处理样品实际吸光读数=处理样品孔吸光读数-样品对照孔吸光读数-背景空对照孔吸光读数样品细胞最大酶活性的实际吸光读数=样品最大酶活性对照孔吸光读数-样品对照孔吸光读数-背景空对照孔吸光读数细胞死亡率=(处理样品实际吸光读数÷样品细胞最大酶活性的实际吸光读数)×100%3.3肝细胞功能指标的测定:按上述方法进行细胞分组、预处理和模拟缺血再灌注损伤。到终末时间点分别将各孔细胞培养上清液100μL收集于Ep管中,每管分别加入100μL完全培养基稀释至200μL,室温下离心5min,速度为1200r/min。取上清液在全自动生化仪下检测ASL、ALT和LDH水平。实验重复2次。三、结果及结论1、化合物(Ⅰ)预处理对缺血再灌注损伤肝细胞活力的影响IR组肝细胞活力比N组明显下降(P<0.05),表明体外模拟缺血再灌注过程成功地造成了肝细胞缺血再灌注损伤。给予5ng/ml化合物(Ⅰ)预处理1小时,缺血再灌注损伤肝细胞的活力较缺血再灌注组和生理盐水组增强(P<0.05),但未能恢复到正常组肝细胞活力水平(P<0.05),生理盐水组则与缺血再灌注组差异无统计学意义(P>0.05)。而0.5ng/ml和50ng/ml浓度的化合物(Ⅰ)预处理1小时,均未能增强缺血再灌注损伤肝细胞的活力(P>0.05),其肝细胞活力与生理盐水组之间差异也无统计学意义(P>0.05)。结果见表1(▲表示与N组比较,P<0.05,差异有统计学意义;★表示与IR组和NS组比较,P<0.05,差异有统计学意义)。2、化合物(Ⅰ)预处理对肝细胞缺血再灌注损伤的细胞繁殖和毒性的影响与正常组相比,体外模拟缺血再灌注损伤使细胞死亡率>90%。给予5ng/ml化合物(Ⅰ)预处理1小时,肝细胞死亡率下降约35%,差异有统计学意义(P<0.05),但其细胞死亡率仍比正常组高约50%,差异有统计学意义(P<0.05);而生理盐水组肝细胞死亡率比缺血再灌注组虽略有下降(约为8%),但差异无统计学意义。0.5ng/ml和50ng/ml浓度的化合物(Ⅰ)预处理1小时,肝细胞死亡率比缺血再灌注组分别降低6%和13%,但差异无统计学意义(P>0.05);而与生理盐水组的肝细胞死亡率相近(P>0.05)。结果见表2(▲表示与N组比较,P<0.05,差异有统计学意义;★表示与IR组和NS组比较,P<0.05,差异有统计学意义)。3、化合物(Ⅰ)预处理对缺血再灌注损伤肝细胞肝功能指标的影响与正常组比较,缺血再灌注损伤组细胞培养上清液中的ALT水平未见明显升高(P>0.05);而AST、LDH水平以及AST/ALT比值显著升高,差异有统计学意义(P<0.05)。给予5ng/ml化合物(Ⅰ)预处理1小时,肝细胞培养上清液中的AST、LDH水平以及AST/ALT比值较缺血再灌注组和生理盐水组降低,但仍较正常组高(P<0.05);而ALT水平与缺血再灌注组 和生理盐水组比较,差异无统计学意义(P>0.05)。生理盐水组细胞培养上清液中的ALT、AST、LDH水平以及AST/ALT比值与缺血再灌注组之间差异无统计学意义(P>0.05)。0.5ng/ml和50ng/ml化合物(Ⅰ)预处理1小时,均未能使肝细胞培养上清液中的AST、LDH水平降低(P>0.05)。结果见表3(▲表示与N组比较,P<0.05,差异有统计学意义;★表示与IR组和NS组比较,P<0.05,差异有统计学意义)。本研究显示,化合物(Ⅰ)(RE2组)使肝细胞对之后经历的缺血再灌注损伤的耐受力增强,表现为肝细胞活力增强,细胞死亡率降低。以上结果提示,化合物(Ⅰ)预处理能够减轻人肝细胞缺血再灌注损伤,起到肝细胞保护作用。表1MTT法检测化合物(Ⅰ)预处理对缺血再灌注损伤肝细胞活力的影响组别样本数nA值N组62.222±0.135IR组61.585±0.113▲RE1组61.509±0.073▲RE2组62.076±0.144▲★RE3组61.569±0.118▲NS组61.484±0.085▲表2LDH释放法肝细胞繁殖与毒性定量检测细胞死亡率组别样本数n细胞死亡率N组50.000±0.145IR组50.915±0.076▲RE1组50.851±0.157▲RE2组50.531±0.058▲★RE3组50.791±0.065▲NS组50.834±0.107▲表3肝细胞培养上清液中ALT、AST、LDH水平的变化(n=5)组别ALTASTAST/ALTLDHN组14.0±1.5821.1±0.841.53±0.13100.8±9.52IR组12.8±0.8433.0±2.24▲2.58±0.07▲247.2±13.76▲RE1组14.0±1.5833.0±1.58▲2.37±0.16▲260.0±11.77▲RE2组14.0±1.5827.2±0.84▲★1.96±0.24▲★204.0±8.60▲★RE3组13.8±0.8432.8±2.17▲2.38±0.17▲239.6±6.54▲NS组12.8±0.8431.2±0.84▲2.45±0.22▲249.2±8.87▲实施例3片剂的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:9的比例加入赋形剂,制粒压片。实施例4口服液的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规口服液制法制成口服液。实施例5胶囊剂或颗粒剂的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按其与赋形剂重量比为1:9的比例加入赋形剂,制成胶囊或颗粒剂。实施例6注射液的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,按常规加注射用水,精滤,灌封灭菌制成注射液。实施例7无菌粉针的制备:按实施例1方法先制得化合物(Ⅰ),以及利用有机酸如酒石酸、或柠檬酸或甲酸或乙二酸等、无机酸如盐酸或硫酸或磷酸制成的盐,将其溶于无菌注射用水中,搅拌使溶,用无菌抽滤漏斗过滤,再无菌精滤,分装于安瓿中,低温冷冻干燥后无菌熔封得粉针剂。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1