一种抗人降钙素原蛋白N末端抗原表位的单克隆抗体7H8的制备的制作方法
本发明属于生物技术领域,涉及一种单克隆抗体,具体涉及一种分泌抗人PCT蛋白N末端抗原表位的单克隆抗体的杂交瘤细胞及其特异性单克隆抗体的制备。
背景技术:
降钙素原(procalcitonin, PCT)来源于人第11 号染色体上的降钙素I基因,该基因在甲状腺C细胞内翻译表达降钙素原前体(proprocalcitonin)后,被内源性多肽酶剪切掉N端25个氨基酸的信号肽,成为含有116个氨基酸的无激素活性的降钙素前肽物质,即为降钙素原(PCT)。PCT由N末端(1-57aa)-降钙素(60-91aa)-钙抑肽(96-116aa)三部分组成,分别由2肽(-Lys-Arg-)及4肽(-Gly-Lys-Lys-Arg-)连接,相对分子质量约为13 KDa,PCT再经过一系列细胞内蛋白酶加工水解成包含32个氨基酸的具有激素活性的多肽,即为降钙素(calcitonin, CT)。目前为止,关于降钙素原的基础研究很少,其来源和病理生理作用仍未明确,在体内的生物学功能也不得而知。但是,根据PCT在血清中的含量变化与炎症反应的相关性,PCT被应用于多种临床检测和观察中。
在正常生理情况下,甲状腺外的降钙素I基因表达受到抑制,仅限于在甲状腺和肺细胞中表达,因此,在健康人血中PCT含量极少,通常低于0.10 ng/mL。严重真菌、细菌、寄生虫感染以及脓毒症和多脏器功能衰竭等会诱导全身多种组织和细胞中的降钙素I基因表达,导致血清中PCT的含量会迅速升高,PCT浓度甚至会蹿升至正常水平的数百至万倍,但CT的含量则保持不变或略有增高。然而,过敏和病毒感染以及自身性免疫疾病不会引起血液中PCT升高,局部细菌感染和慢性炎症同样不会导致PCT水平的明显变化。因此,PCT是重要的炎症标志物,能够区分细菌感染与病毒感染、自身免疫疾病引起的炎症反应。并且,与其他的炎症指示因子相比,PCT具有更好的灵敏性和特异性。PCT在感染后2小时即可以检测到,感染后6-12小时达到峰值,12-24h为平台期,24h后浓度下降,半衰期较长,为20-24小时,能在一段时间维持在高水平。同时PCT水平与感染程度正相关,PCT浓度越高意味着受感染程度越严重,因此PCT水平对炎症的发生发展的诊断以及治疗预后等方面都具有重要意义。其他炎症因子如IL-6、IL-10、TNF-α在感染后2小时达到峰值,并迅速下降,不易被检测到;而C反应蛋白(CRP)在感染后24-48小时才达到峰值,且炎症控制后浓度仍保持较高水平,不利于早期诊断和治疗评价。在临床诊断治疗中,传统检测指标如体温、白细胞计数(WBC)的灵敏性和特异性均不高,而PCT与过去的生物学标记物相比,其具有较为理想的准确性和特异性,是一个理想的感染检测标志物,有助于临床的早期诊断和制定合理的治疗方案。
PCT检测炎症的方法已获得美国食品药品管理局(FDA)的许可。早期,检测PCT主要使用凝胶层析分析法和高效液相色谱法,这两种方法不仅费时,且操作要求高,不易自动化。近年来,PCT的检测多采用免疫学方法进行,具有特异性强、灵敏度高和容易操作等优点,包括双抗夹心免疫化学发光法、胶体金法和放射免疫法等。所有这些免疫学方法的前提都是制备针对PCT的特异性单克隆抗体,在健康人血浆中PCT含量极低,在 0.2 ng/mL 以下,因此,对所制备抗体的亲和力等参数要求很高。且目前检测体系所用的抗体均来自国外大公司,价格昂贵。因此,制备 PCT 特异性单克隆抗体,为 PCT 的免疫检测提供关键原料,对于扩大其临床应用,降低医疗成本,具有重要意义。
技术实现要素:
目前,国内自主研发的针对PCT蛋白的单克隆抗体,主要是使用合成的预测表位肽段作为抗原免疫小鼠,经过杂交瘤技术获得的,使用的抗原肽段分别是34-60aa以及75-88aa序列,均与降钙素序列(60-91aa)存在交叉,因此不能够区分PCT及CT。本发明的目的是筛选出特异性识别PCT蛋白N末端的氨基酸序列的单克隆抗体,减少交叉反应,使其可以广泛的应用于PCT的临床检测及基础研究中。
针对现有技术的不足,本发明经过反复试验,利用原核表达技术,表达并纯化人PCT全长蛋白,纯化后的人PCT蛋白具有很高的纯度,Western blot实验显示该蛋白具有很强的免疫反应性。纯化后的人PCT蛋白免疫BALB/c小鼠,通过杂交瘤技术,筛选到13株分泌抗人PCT蛋白单克隆抗体的杂交瘤细胞,经鉴定,其中1株识别的位点位于PCT蛋白N末端4-18aa序列。本发明对这株杂交瘤细胞(杂交瘤细胞株7H8)进行了生物学特性鉴定。
本发明提供的技术方案是:筛选一种分泌抗人PCT蛋白N末端抗原表位的单克隆抗体的杂交瘤细胞,该杂交瘤细胞(杂交瘤细胞株7H8)已于2015年 9 月 15 日为中国典型培养物保藏中心(武汉)CCTCC所保藏(保藏地址是:中国武汉武汉大学,邮编:430072),其保藏号为CCTCC NO:C2015155,经检测存活。该细胞是圆形的半贴壁细胞(用弯管可以将细胞从瓶壁上吹下来,收集细胞不需要胰酶消化,如果有细胞悬浮存在也是正常),细胞分裂倍增的时间是16-18小时。
同时,本发明还提供一种抗人PCT蛋白N端氨基酸序列的单克隆抗体的杂交瘤细胞的制备方法,该方法包括如下步骤:
(1)将人PCT蛋白与弗氏完全佐剂充分乳化,采用皮下免疫方法,以每只小鼠免疫蛋白浓度分别为30 µg、50 µg、100 µg和150 µg四个梯度的剂量,每个梯度免疫3只6~8周龄BALB/c雌性小鼠;
(2)两周后进行第2次免疫,将人PCT蛋白与弗氏不完全佐剂充分乳化,采用与步骤(1)中同样的剂量和方法加强免疫BALB/c小鼠;
(3)2周后进行第3次免疫,免疫剂量与方法同第2次免疫;
(4)融合前3 d用不加佐剂的人PCT抗原,采用脾下加强免疫,每只剂量为100 μg;
(5)融合前1 d用不加佐剂的人PCT抗原加强免疫,每只剂量50 μg;
(6)小鼠断尾进行尾尖采血,4 ℃,4000 g离心5 min,取上清,间接ELISA法检测血清效价,选取血清效价大于1,000,000 的小鼠准备进行细胞融合试验;
(7)选择生长状态良好的SP2/0骨髓瘤细胞与免疫小鼠的脾脏细胞以1:5~1:10混合,1500 g离心5 min,弃上清;
(8)轻摇离心管使细胞均匀分散,缓缓加入1 mL 37 ℃预热的PEG 1500并轻轻混匀1.5 min,然后加入20 mL 1640培养基;
(9)800 g离心5 min后弃上清,细胞中加入含有20%血清的HAT-1640培养基并混匀;
(10)将混匀的细胞均匀铺于96孔板中,在37 ℃,5% CO2的细胞培养箱中培养5~7 d后观察融合效果并换液;
(11)换液后第4 d用间接ELISA方法检测杂交瘤细胞上清液,选择阳性值高且细胞集落数目少的孔,通过有限稀释法进行亚克隆,每孔细胞数目理论值为1~2个;
(12)经过3~4次亚克隆后,即获得能够稳定分泌抗体的杂交瘤细胞株,筛选出的阳性杂交瘤细胞可用于制备抗人PCT蛋白单克隆抗体。
(13) 进一步筛选和鉴定能够分泌识别的表位位于PCT蛋白的N末端氨基酸,而不识别降钙素(CT)的氨基酸序列的单克隆抗体的杂交瘤细胞株。
本发明还提供所述的杂交瘤细胞分泌的单克隆抗体。
本发明还提供所述的单克隆抗体在制备PCT蛋白检测的试剂盒中的应用。
所术的应用,其中检测PCT蛋白的方法采用双抗夹心ELISA法。
本发明提供一种针对降钙素原PCT蛋白N末端抗原表位的单克隆抗体的制备方法。本发明所获得的单克隆抗体是使用全长PCT蛋白作为抗原免疫小鼠后通过杂交瘤技术筛选得到的,经鉴定其识别的表位位于PCT蛋白的N末端氨基酸,不识别降钙素(CT)的氨基酸序列,因此能够有效避免与降钙素之间的交叉反应性,特异性识别PCT蛋白,为双抗夹心免疫化学发光法检测PCT蛋白提供一种新的配对单克隆抗体,对降低PCT检测的假阳性率、提高检测的特异性具有重要的意义。与现有技术相比,本发明具有以下有益效果:
(1)本发明人通过在大肠杆菌中原核表达密码子优化后的人PCT全基因序列,使其表达于胞浆上清中,通过本实验室的特异性亲和纯化等技术,可以简化人重组PCT蛋白的纯化过程,纯化后人PCT蛋白保持其天然活性,最大限度保证了蛋白空间构象的完整性,将其作为抗原免疫BALB/c小鼠,筛选获得的抗体可以更好的识别临床血清中天然PCT蛋白。
(2)经过细胞融合及亚克隆筛选,获得了7H8单克隆抗体,通过使用PCT全氨基酸序列截短合成的肽段,利用ELISA法对获得的单克隆抗体进行表位鉴定,精准的确定了该抗体识别的序列是人PCT蛋白N末端(4-18aa)表位序列,Western blot和ELISA检测结果显示,7H8单克隆抗体具有很好的特异性、稳定性和灵敏度。
(3)对7H8抗体进行HRP酶标记,建立双抗夹心ELISA法,对临床血清样品进行检测,能捕获血清样品中的天然PCT蛋白,表明用自主研发的抗体用于临床检测具有可行性,为开发PCT诊断试剂盒提供了一种很好的新材料。
附图说明
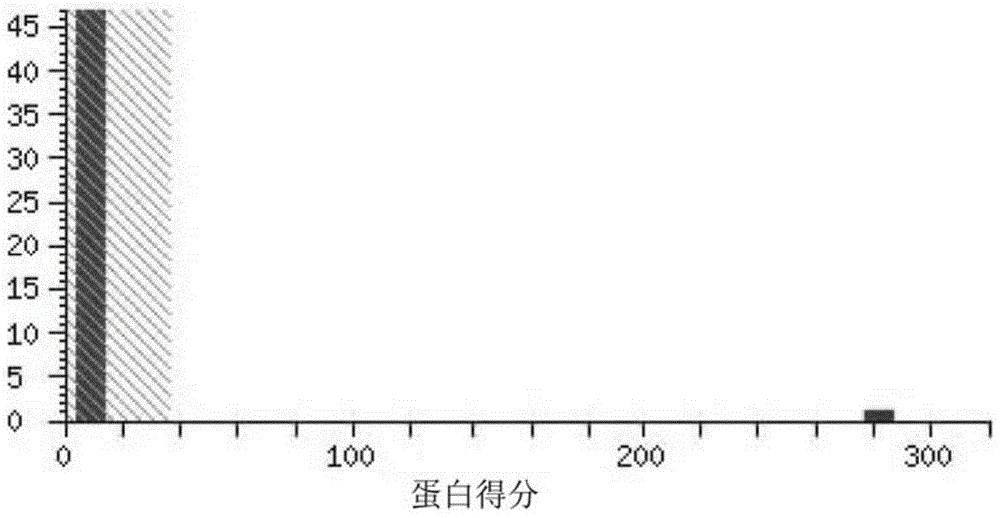
图1. 原核表达的人PCT融合蛋白质谱鉴定,软件分析结果显示,Protein score为282,与PCT蛋白匹配度很高,结果可靠。
图2. PCT蛋白纯化后鉴定,lane M:蛋白质相对分子质量标准品; lane 1:30% 硫酸铵沉淀样品;lane 2 ~ 5:Ni-IDA resin 纯化后的蛋白;Lane 6:分子筛层析纯化后的蛋白。
图3. PCT蛋白纯化后鉴定,图3(A):SDS-PAGE鉴定结果;图3 (B):Western blot鉴定结果,lane M:蛋白质相对分子质量标准品; Lane 1:分子筛层析纯化后的蛋白。
图4. 7H8单克隆抗体亚型鉴定,7H8单克隆抗体亚型为 IgG1 亚类。
图5. 单克隆抗体纯化后鉴定,图5(A):SDS-PAGE 鉴定图,lane M:蛋白质相对分子质量标准;lane 1:未煮沸的纯化前腹水;lane 2:煮沸的纯化前腹水;lane 3:未煮沸的纯化后单克隆抗体;lane 4:煮沸的纯化后单克隆抗体;图5(B):免疫特异性鉴定,lane M:蛋白质相对分子质量标准;lane 1:重组 PCT蛋白。
图6. 7H8抗体稳定性检测,将纯化后的单抗 7H8 分别置于-80 ℃、 -20 ℃、4 ℃和37℃的环境中,于1、2、3、9、27、60天取样,间接 ELISA 检测其效价变化,结果显示:放于37℃的7H8抗体在一个月后效价才开始下降,4℃条件下60天依然稳定。
具体实施方式
下面通过具体实施方式的详细描述来进一步阐明本发明,但并不是对本发明的限制,仅仅作示例说明。
本实施例所用材料如下:
(1)菌种、序列和细胞株:大肠杆菌E.coli Top 10、ER2566菌株由本实验室保存,密码子优化的PCT全基因序列、SP 2/0小鼠骨髓瘤细胞由厦门大学公共卫生学院夏宁邵教授惠赠。
(2)主要试剂:HRP-羊抗兔由厦门大学夏宁邵教授惠赠;标准PCT多克隆抗体购自Proteintech公司;蛋白质相对分子质量标准购自Thermo公司;弗氏佐剂购自美国sigma公司;HT、HAT培养基添加剂购自美国sigma公司;1640培养基购自Gibco公司。
(3)临床血清样品:由湖南省人民医院检验科收集。
本发明通过以下方法制备得到分泌抗人PCT蛋白单克隆抗体的杂交瘤细胞:
(1)基因序列
由厦门大学惠赠的人PCT全基因序列,是将基因密码子置换为大肠杆菌偏爱的密码子,使其更加容易在大肠杆菌中表达,优化后的核苷酸序列为如SEQ ID NO: 1所示;
表位定位的 4-18 aa 多肽序列为如SEQ ID NO:2所示。
(2)重组PCT蛋白菌株诱导表达
挑取筛选的单克隆菌株,接种到5 mL LB液体培养基中(含有100 μg/mL硫酸卡那霉素(Kan+)37 ℃培养至OD600值达到0.6,加入终浓度为0.4 mmol/L的IPTG进行诱导表达,同时以转化空质粒的菌株进行诱导作为阴性对照,其它培养条件与试验组一致。37 ℃诱导培养4 h,室温12000 g离心1min,收集菌体。分别制备蛋白样品,用12%的SDS-PAGE分析重组蛋白的表达情况。结果显示:在试验组中可以观察到一条相对较粗的蛋白条带,其大小与理论基本一致,而在对照组中没有出现这一条带,说明重组人PCT蛋白在重组菌株中可能获得了高效表达。
(3)质谱法检测重组蛋白性质
重组蛋白经过质谱仪分析后,将得到的数据输入数据库进行匹配分析,结果显示检测蛋白与数据库中PCT蛋白相符。软件分析结果显示,Protein score为282,说明匹配度很高,结果可靠;质谱结果还显示PCT重组蛋白的相对分子质量约为13kD,与天然PCT蛋白的相对分子质量大小符合,这也进一步提高了PCT重组蛋白的可信度(图1)。
(4)目的蛋白大量表达与蛋白纯化
从平板上挑取单菌落接种到50 mL LB(Kan+)培养基中培养12 h,然后接种1% 的重组菌到2 L LB培养基(Kan+)中培养。待菌液OD600值达到0.6后,加入IPTG进行诱导表达(终浓度为0.4 mmol/L)。37℃培养4 h后,12000 g离心10 min收集菌体。加入100 mL裂解液(50 mmol/L Tris·HCl,1 mmol/L EDTA,100 mmol/L NaCl,pH 8.0),10 mm 探头200 W功率在冰上超声破碎菌体。将离心收集的上清放入烧杯,按公式V3=V*(100-Q1)/(Q1-Q2)(V代表上清体积;Q1 代表此次的硫酸铵浓度;Q2代表前一次硫酸铵浓度;V3代表加入的饱和硫酸铵体积)缓慢滴入饱和硫酸铵(pH 7.4),在冰上搅拌30 min,4 ℃静置2 h。4 ℃,12 000 g,离心10 min,用PBS(pH 7.4)将沉淀溶解。依次做20%到80%七个梯度初步纯化重组PCT蛋白,收集样品SDS-PAGE鉴定。
用5到10倍柱体积的 buffer 0(50 mM NaH2PO4,300 mM NaCl,pH 8.0)以1 mL/min的速度平衡His-taq柱,然后PBS溶解的重组PCT蛋白以相同速度过柱,再用buffer 0溶解的20、50、100、250 mM 咪唑梯度洗脱重组蛋白,洗脱液于4 ℃用 PBS(pH 7.4)透析去除咪唑,收集样品 SDS-PAGE 鉴定。
以0.5 mL/min的流速,用10倍柱床体积的流动相PBS(pH 7.0)平衡TSK-GEL G3000 SW层析柱至280 nm吸收值无明显变化,将检测器吸收值归零,在上样环中注入样品2 ml,以0.5 mL/min的流速过柱,收集280 nm处吸收值大于0.5 AU的蛋白峰。SDS-PAGE分析收集的蛋白峰(图2)。
纯化后人PCT蛋白样品经过电泳后,SDS-PAGE检测结果显示目的蛋白主要溶解在上清中,沉淀于30%的饱和硫酸铵中。人PCT蛋白经过His-taq柱和TSK-GEL G3000 SW层析柱纯化后,在SDS-PAGE电泳图上只观察到一条蛋白条带(图3A),说明纯度有了极大的提高,用Bandscan软件分析蛋白的纯度超过了99%。
对纯化后蛋白进行Western blot分析。将纯化蛋白转膜后,用含5%的脱脂奶的TN(50 mmol/L Tris·HCl,150 mmol/L NaCl, pH7.5)缓冲液封闭2 h。加入按1:2000的比例用脱脂奶稀释PCT多克隆抗体,37℃反应2 h。用TNT缓冲液(50 mmol/L Tris·HCl,150 mmol/L NaCl,0.05%Tween-20,pH7.5)洗膜三次,每次10 min,加入HRP酶标羊抗兔,室温反应2 h。用TNT洗膜三次,每次10 min,用HRP-DAB显色试剂盒显色。Western blot结果显示,表达的重组蛋白与Proteintech公司的PCT兔源多克隆抗体发生特异性反应(图3B),进一步说明人PCT基因在大肠杆菌中获得了高效表达,而且具有良好的抗原性。
(5)动物免疫与血清效价检测
将纯化后的PCT蛋白用PBS缓冲液透析后,稀释至每只小鼠免疫蛋白浓度分别为30 µg、50 µg、100 µg和150 µg四个梯度,每个梯度免疫3只小鼠,1:1加入弗氏完全佐剂充分乳化。采用皮下多点免疫的方法,对每只小鼠分别以每只500 µl的剂量进行初次免疫;两周后,进行再次免疫时1: 1加入蛋白溶液和弗式不完全佐剂,充分乳化后以同样剂量免疫小鼠,一共加强免疫2次,每次间隔2周。在每次免疫的前一天收集小鼠血清进行间接ELISA,以检测PCT重组蛋白的免疫原性及血清抗体效价。
第三次免疫8 d后,小鼠尾静脉采血,4 ℃,4 000 g离心5 min,取上清,间接ELISA法检测血清效价,选取血清效价高于1, 000, 000的小鼠,在融合前4 d再加强一次免疫,在脾脏注射30 µg PCT蛋白,2 d后尾静脉注射20 µg蛋白。
(6)细胞融合、阳性杂交瘤细胞筛选与亚克隆
选择生长状态良好的SP2/0骨髓瘤细胞与免疫小鼠的脾脏细胞以1:5~1:10混合,1500 g离心5 min,弃上清。轻摇离心管使细胞均匀分散,缓缓加入1 mL 37 ℃预热的PEG 1500并轻轻混匀,融合90s后加入20 mL 1640培养基终止。800 g离心5 min后弃上清,在细胞沉淀中加入20%血清的HAT-1640培养基并混匀。
混匀细胞均匀铺于96孔板中,在37 ℃,5% CO2 培养箱中培养5~7 d后观察融合效果并换液。换液后第4 d用间接ELISA方法检测杂交瘤细胞上清液,选择阳性值高且细胞集落数目少的孔,通过有限稀释法进行亚克隆,每孔细胞数目理论值为1~2个。经过3~4次亚克隆后,即获得能够稳定分泌抗体的杂交瘤细胞株,将此细胞株部分用于单克隆抗体的生产,部分于液氮罐内冻存。
融合7 d后通过观察和计算得到本次细胞的融合率为80.1%,融合10 d后通过间接ELISA法测得阳性克隆率为31.2%。采用间接ELISA和有限稀释法筛选阳性杂交瘤细胞,经过3~4次亚克隆后,获得了13株能够稳定分泌抗人PCT蛋白单克隆抗体的细胞株。
(7)单克隆抗体的产生与纯化
取 8-10 周龄 BALB/c 小鼠,先腹腔注射无菌石蜡油,每只 0.5 mL。7 d 后向腹腔内注入杂交瘤细胞,调整细胞密度为 1×106 - 2×106 /mL,每只小鼠大约注射 0.5mL。8-10 d 后即开始采集腹水。将采集好的腹水 1:1(V/V) 缓慢加入饱和硫酸铵,冰上搅拌 30 min,4 ℃,12000 g 离心 10 min 后弃上清。沉淀用一定体积的 PBS 溶解,移至透析袋中透析平衡至 20 倍体积的 Binding buffer(Protein A Sefinose Kit 中提供)中以除去高浓度的离子,然后用蛋白 A 柱纯化。将纯化前与纯化后的腹水抗体经 SDS-PAGE电泳,纯化后的抗体,出现了三条带:50kDa 的重链、25kDa 的轻链和约 100kDa 大小的条带,但不煮沸时主要为 100 kDa 的条带,煮沸后重链条带明显变强,100 kDa 的条带变弱,且大小是重链的两倍,煮沸前后轻链条带强弱相差不大(图5),因此,100 kDa 的条带为重链与重链的聚合体,原因是两条重链间的二硫键没有完全破坏。从凝胶上看不到其它杂蛋白条带,这说明经亲和柱层析后,单克隆抗体达到了相当高的纯度,可以用于后续实验。
(8)单抗抗原表位的分析
对原核表达的 PCT 全氨基酸序列的N-端进行截短合成,每15个氨基酸一条肽链,每条肽链与前一条肽链重复5个氨基酸,全长共合成12条肽链,截短合成蛋白分别命名为1R、2R、3R、4R、5R、6R、7R、8R、9R、10R、11R、12R,利用间接 ELISA 对单克隆抗体的表位进行定位。
将截短合成的12条多肽链用 CB 液(15mmol/L Na2CO3,35mmol/L NaHCO3)稀释至浓度为 100ug/mL,包被 ELISA 板,37℃4h,再4℃ 过夜。洗板一次,加入 ED 封闭液37℃孵育2h后,洗板5次,加入100 ug/ml的单克隆抗体,37℃ 孵育 60min 后,洗板 5 次,加入HRP-羊抗鼠二抗,37℃ 孵育30 min,洗板5次,最后加入TMB底物显色剂,37℃ 反应 10 min,加入终止液,450nm/630nm 双波长检测。通过筛选,7H8与第2条肽链反应明显,与其他肽链都未能出现特异性,说明 7H8 识别的表位为人PCT蛋白N端4-18aa之间,即成功获得针对人PCT蛋白N末端抗原表位的单克隆抗体。筛选的其他株抗体主要是针对43-69aa和75-88aa表位。
(9)单克隆抗体亚型鉴定
将纯化的 PCT 蛋白用1× CB 缓冲液(15mmol/L Na2CO3,35mmol/L NaHCO3)稀释至浓度为 1ug/mL,包被 ELISA 板,4℃ 过夜。洗板一次后,加入 ED 封闭液,37℃ 2h 后,洗板 5 次,加入杂交瘤细胞上清,37℃ 孵育 30min 后,洗板 5 次,加入 HRP-羊抗鼠二抗(IgG、 IgG1、 IgG2a、 IgG2b、 IgG3、 IgM),37℃ 孵育 30min,洗板 5 次,最后加入 TMB 底物显色剂,37℃ 反应 10min,加入终止液,450/630nm 双波长检测。结果显示:7H8单克隆抗体为 IgG1 亚类(图4)。
(10)杂交瘤细胞系与单克隆抗体稳定性的鉴定
对7H8分别进行体外传20代和液氮冻存3个月后再复苏处理,间接ELISA检测培养上清中抗人PCT McAb的效价。腹水单抗分别置于37 ℃、4 ℃、-20℃和-80℃的环境中。于1、2、3、9、27、60天取样,间接 ELISA 检测其效价变化。以-20 ℃保存的样品作为阳性对照,小鼠血清作为阴性对照。
本发明筛选获得的杂交瘤细胞体外传20代后,采用间接ELISA检测细胞上清中单克隆抗体的效价,其效价基本保持不变,仍然可以达到1×104。将冻存于液氮中的杂交瘤细胞复苏培养来生产单克隆抗体,结果也发现,冻存3个月后其效价也基本没变,可以达到1×104,说明获得的杂交瘤细胞系稳定性好。腹水单抗分别置于37 ℃、4 ℃、-20℃和-80℃的环境中,37℃的7H8抗体在一个月后效价才开始下降,4℃条件下60天依然稳定(图6)。说明单抗的稳定性好,完全符合商用抗体的货架期稳定性要求,具有良好的应用前景。
(11)单克隆抗体的效价、特异性及适用范围的鉴定
用1 μg/mL的人PCT蛋白包被96孔酶标板,用间接ELISA方法检测纯化抗体效价。以阳性值与阴性值的比值大于2.0的最大抗体稀释倍数确定为抗体效价。结果表明,杂交瘤细胞培养上清液的抗体效价为1×104,腹水的抗体效价为1×106,腹水效价明显高于上清效价。
为了研究7H8的适用范围,用重组PCT蛋白、重组Cys蛋白、重组NGAL蛋白、P27蛋白、重组GAPDH蛋白、pp65蛋白和重组HFABP蛋白作为抗原,PBS缓冲液作为阴性对照,进行ELISA检测,一抗7H8抗体孵育的最终浓度为100 ng/mL。结果显示7H8单抗只与PCT蛋白发生特异性反应,而且反应值特别明显,说明7H8具有高度的特异性。
(12)单抗相对亲和力测定
以 PCT 抗原竞争结合 7H8 抗体测定亲和力常数(1) ①反应系统中抗PCT单抗7H8 的初始浓度为1 ug/mL,PCT 抗原的初始浓度从 1 ug/mL往下倍比稀释, 形成8个反应系统,在 37 ℃反应1 h; ②以每孔100 uL将反应液以双孔加入到包被了 PCT 抗原的免疫反应板,37 ℃孵育1 h后洗板5次; ③加入100 uL羊抗鼠二抗酶结合物溶液37℃反应1 h,洗板5次,加入底物显色 10 min后加入终止液,测定OD = 450 nm/630 nm 计算各个反应系统的抗原结合率推算亲和力常数。(2)改变条件重复(1)实验测定亲和力常数。
将实验方法中的抗体初始浓度改成 2 ug/mL ,抗原的初始浓度从 10 ug/ml往下倍比稀释, 建立反应系统,按照⑴中的步骤②、③检测抗原结合率,并推算亲和力常数。从实验结果显示需要抗原远远过量才能对抗体形成竞争抑制,可以直接用抗原初始浓度i0对B/(1-B)作图求得斜率(亲和力常数)为 k = 1.43 ( r = 0.8702),具有作为免疫诊断试剂原材料的潜力。改变条件按照形成反应系列测得的结果,直接用抗原初始浓度i0对B/(1-B)作图求得斜率(亲和力常数),得出Kd值为0.4461,实验结果比抗原、抗体浓度未提高时降低了近 4 倍。
(13)HRP酶标抗体与双抗夹心ELISA法检测人PCT蛋白
① 7H8的HRP酶标:纯化后的单克隆抗体透析,4℃搅拌透析2h,换液2次;将HRP平衡到室温,取HRP和NaIO4 分别加水溶解后,再将NaIO4溶液缓慢加入HRP溶液中,溶液由棕色转变成绿色,置于4℃避光活化30 min;将乙二醇加入HRP和NaIO4 混合液中,室温避光终止30 min,至溶液由绿色变为棕色;将活化的HRP加入透析的抗体中,4℃避光透析2h,换液2次;配制20mg/ml的硼酸氢钠溶液,加入HRP酶体积1/10的NaBH4 溶液,4℃放置 2h,每隔30min混匀一次;用等体积的饱和硫酸铵沉淀HRP标记抗体离心10min后沥干; 50%甘油溶解沉淀蛋白,-20℃保存。间接 ELISA 法测定HRP标记抗体活性。结果显示:7H8抗体的酶标效果很好,显色明显。
② 双抗夹心ELISA法检测人PCT蛋白:将Proteintech公司的PCT多克隆抗体作为捕获抗体包被,HRP标记7H8抗体作为二抗,检测人重组PCT蛋白。每孔中加入100 ul多克隆抗体溶液(10ug/ml,溶于PBS),将捕获抗体包被在酶标板表面。37℃孵育2h或4℃过夜。洗板 1 次;加入 200 µL ED封闭液(0.25% Casein),37 ℃放置2 h,洗板5次;加入纯化的人PCT蛋白和临床血清样品,人PCT重组抗原用1×PBS(pH 7.45)稀释至浓度为100 µg/mL,再按1:10,1:100,1:1000,1:10000,1:100000梯度稀释,PBS缓冲液为阴性对照,设置双孔对照,每孔加入样品100 µL,37 ℃放置2 h,洗板5次;用ED封闭液按 1: 5000稀释HRP标记7H8单抗,每孔加入100 µL稀释后的HRP-7H8,37 ℃ 孵育30 min,洗板5次;加入100 µL TMB 底物显色液,37 ℃避光显色10 min;加入50µL终止液终止反应;酶标仪上使用450 nm/630 nm双波长检测各孔的OD值。结果显示,双抗夹心ELISA法检测血清样品中PCT阳性与医院检测结果一致,且对纯化的人PCT蛋白可达检测到0.1µg/mL,阴性对照OD450低于0.1,表明7H8抗体对PCT有很好的识别作用,灵敏度高,为后续PCT诊断试剂盒的研究提供了很好的材料。
自1982年Fukushi H首次制备了AIV亚型单克隆抗体以来,单克隆抗体技术以其特有的高灵敏性和特异性而得到了广泛的应用。单克隆抗体技术中影响细胞融合的因素有很多,免疫效果尤为重要。将纯化后的人PCT蛋白用皮下多位点免疫刺激小鼠的免疫系统。三次皮下免疫后,小鼠血清稀释百万倍的效价仍可明显检测为阳性,随后进行脾脏注射免疫和尾静脉注射免疫,这样就使得小鼠体内的B淋巴细胞保持一种高度活跃的状态。本发明通过动物免疫这一关键步骤的把握,保证了较好的阳性克隆率。细胞融合后生长到孔底面积的1/2~1/3时进行亚克隆,避免了阳性细胞漏检和染色体丢失情况的发生。采用操作简便的有限稀释法,确保了杂交瘤细胞系的稳定性和抗体分泌效价高的特点。经过4次克隆化后,获得的杂交瘤细胞阳性率均为100%。在进行细胞亚克隆时最好在HT-1640培养基中添加饲养细胞或细胞生长因子,以防杂交瘤细胞在培养过程中因状态不好而死亡。
目前,单克隆抗体的纯化方法有很多,如辛酸-硫酸铵法、亲和层析、离子交换层析、凝胶过滤法及高效液相层析法等。本发明采用先饱和硫酸铵分级沉淀初步纯化再用Protein A柱纯化抗体,纯化后的单抗腹水抗体效价达1×106。而杂交瘤细胞培养的上清经硫酸铵沉淀后就可以达到很高的纯度,完全可以满足实验室使用要求和商品化要求,因为细胞分泌的主要是单克隆抗体。由于细胞培养血清价格比较高,产生的抗体效价又比较低,因此在生产抗体的过程中,可以采取先培养一定量的杂交瘤细胞,然后利用小鼠诱导腹水生产抗体,这样生产抗体不但效价高,而且生产成本可以大大降低。本实验筛选得到的7H8单克隆抗体能特异性识别人PCT蛋白N末端4-18aa序列,且能捕获血清样品中天然PCT蛋白,这为后续临床炎症感染中PCT的检测提供了一个新的材料。杂交瘤细胞系及单抗稳定性检测结果说明,单抗的杂交瘤细胞系和单抗的稳定性好,长期保存不会使抗体效价降低。多项数据表明7H8分泌的单克隆抗体能广泛应用于多种生物和组织的细胞生物学和免疫学试验,具有良好应用前景和商业价值。
<110>湖南师范大学
<120>一种抗人降钙素原蛋白N末端抗原表位的单克隆抗体7H8的制备
<160> 2
<210> 1
<211> 378
<212> DNA
<400> 1
ATGCACCACCACCCCCACCACGGATCTGCACCATTCCGTTCTGCCCTGGAGAGCTCTCCAGCAGATCCGGCAA
CACTGAGTGAAGACGAAGCGCGCCTTCTGCTGGCTGCACTGGTGCAGGACTATGTGCAGATGAAGGCCAGTGA
GCTGGAGCAGGAGCAAGAGCGTGAGGGTTCCAGCCTGGATAGCCCACGTTCTAAGCGTTGCGGTAATCTGAGT
ACCTGCATGCTGGGCACCTACACGCAGGACTTCAACAAGTTCCACACGTTCCCACAAACTGCAATCGGTGTTG
GTGCACCTGGTAAGAAGCGTGACATGTCCAGCGACCTGGAGCGTGACCATCGCCCTCATGTTAGCATGCCACA
GAATGCCAACTAA
<210> 2
<211> 15
<212> 多肽
<400> 2
PFRSA LESSP ADPAT
- 还没有人留言评论。精彩留言会获得点赞!