基于可变结构域VL和VHH衍生物的高亲和力和聚集稳定的抗体的制作方法
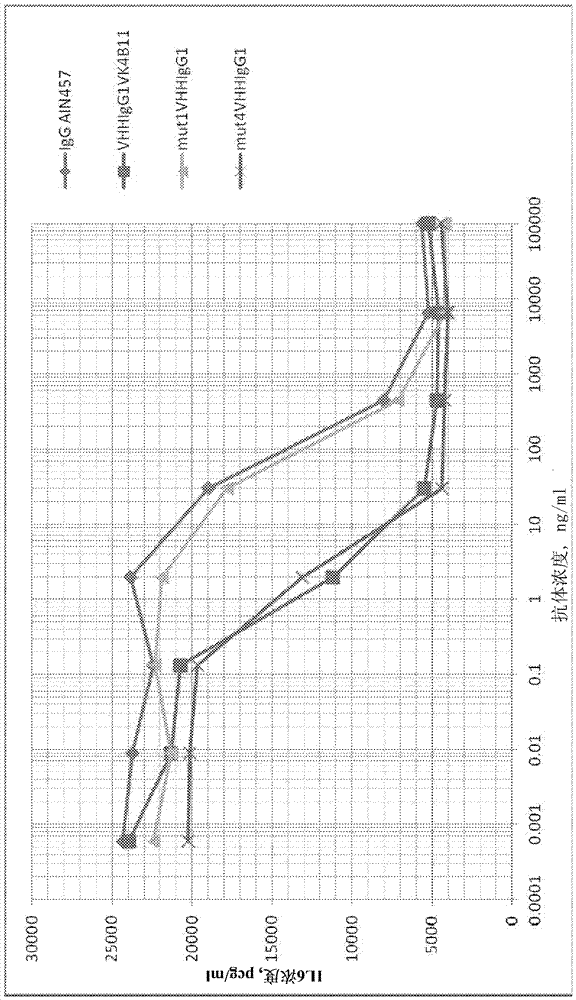
【引言】抗体,也称作免疫球蛋白(ig),为可溶性血液糖蛋白或组织液糖蛋白,其在脊椎动物体液免疫中发挥关键作用。抗体由b细胞在响应各种结构的外来生物和化学物质(抗原)时产生。由于对某些抗原具有高特异性和高亲和力,而且由于针对无限数目的抗原库均可产生抗体的能力,所以抗体及其衍生物是基础医学研究和应用医学研究两者中所使用的最重要试剂中的一类。经典抗体[1,2]由大的多聚体蛋白质(igg~150kda)表示,其包含两个相同重h-链(一个可变vh结构域,三个恒定结构域ch1、ch2和ch3,以及一个位于ch1和ch2之间的铰链结构域)和两个相同轻l-链(由可变结构域vl和恒定结构域cl组成)。上述链由非共价键和共价键(二硫键)连接为一个四链分子。木瓜蛋白酶可用于将抗体分子分解为两个片段:fab(抗原结合片段)和fc(可结晶片段)。因此,所述分子的一个区域(fab)定义其抗原相关特异性,而另一区域(fc)执行旨在消除抗原的效应器功能[3,4]。h-链的ch1结构域和ch2结构域由铰链区隔开,该铰链区确保了fab区的流动性以及igg分子与暴露于细胞上的ig效应器受体之间的相互作用。ch2结构域包含与介导细胞活化(adcc和adcp)的fcγ受体结合的区域以及与补体系统分子(cdc)结合的区域。此外,该结构域还包含一个位点,该位点是所有免疫球蛋白同种型用于连接糖类的连接点。ch3-结构域几乎完全决定了igg二聚体的稳定性,并与细胞表面上的fcrn受体相互作用,从而确定了抗体药代动力学性质以及其在体内的代谢和分布。重链可变结构域(vh)和轻链可变结构域(vl)的互补决定区(cdr)的组合形成抗原结合片段,同时,可变结构域和恒定结构域的骨架区并不直接参与抗原识别。经典抗体的最小fab衍生物为单链构建物,在该构建物中,重链和轻链的可变结构域与接头序列(scfv)相连接。在骆驼科动物(骆驼、美洲驼、小羊驼)的血液中已发现大量具有简化结构的特定非经典抗体,该发现极具价值[5]。此类抗体(重链抗体,hcab)是由二聚体单一截短重链(无ch1结构域)构成,完全不含轻链。hcab的抗原结合片段仅由一个重链可变结构域(vhh)形成,该vhh通过铰链区连接至fc结构域。vhh更常称作单域抗体,“纳体”,“微型抗体”,或“纳米抗体”。除了尺寸较小(12~15kda)之外,与经典igg抗体相比,此类分离的单域结构似乎具有许多优点,即聚集、化学和热稳定性。vhh抗体可在细菌和酵母细胞中成功克隆和表达。由于具有上述特性,这些抗体的研发方向有治疗方向(ablynx公司),以及实验室和工业色谱方向(captureselect亲和力产品)。通过由骆驼科家族的各种代表性动物获得的血清中的免疫球蛋白的电泳分析[5]首次发现包含单一ig重链二聚体的重链抗体。hcab的相对比例(占所有igg的相对比例)在美洲驼和小羊驼的约15~25%至骆驼的约60~80%[6]之间变化。据推测,非经典hcab(至少在骆驼科的情况下)源自于经典抗体基因的较近期进化。在hcab和经典抗体的情况下,ch2和ch3两个重链恒定结构域高度保守。在hcab中不存在与经典抗体的第一恒定结构域ch1相对应的结构域。单峰骆驼基因组含有由约50个vh-生殖基因和40个vhh-生殖基因组成的基因簇(claster),其后跟随有d区段、j区段的多个基因以及编码恒定区(cμ、cγ、cε和cα)的基因。显然,cγ-基因中的一些用于形成hcab(突变导致ch1-结构域的缺失),而其它用于生成经典抗体(保留ch1结构域)。d区段和j区段的相同基因可随机连接一个vh-基因或一个vhh-基因。这表明vh-基因和vhh-基因位于同一基因座[7~10]。非经典抗体的可变结构域(vнh)和经典抗体的可变结构域(vн)的组织结构非常相似,正如人igg3亚类的vн-结构域与骆驼科动物的vн和vнh具有高同源性一样。在上述两种情况中,可变结构域均包含围绕三个高度可变互补决定区(cdr)的四个保守骨架区fr。此外,在上述两种情况中,免疫球蛋白可变结构域的典型三维结构均由两个β-层形成,其中一个包含4个氨基酸序列,而另一个包含5个氨基酸序列[11,12]。该结构中的所有三个cdr在可变结构域的一侧形成簇,在该处,所述cdr参与抗原识别并位于连接β-结构的环上。然而,存在数个涉及单域vнh功能性的重要区别。因此,vнh的cdr1和cdr3显著增大。vнh的互补决定区通常在两个片段中同时(通常在cdr1和cdr3中,较少情况下在cdr2和cdr3中)含有半胱氨酸残基。vнh晶体结构的研究已显示这些半胱氨酸残基形成二硫键,并为这些抗体的环形结构提供额外稳定性[12]。vнh的最强大且可再现的区别特征由以下代表:在第二骨架区中,由四个亲水性氨基酸残基置换疏水性氨基酸残基(根据kabat编号,为val37phe、gly44glu、leu45arg、trp47gly[13])。vн-结构域的骨架区高度保守,富含疏水性氨基酸残基,并且对于与轻链可变区vl的连接是必要的。vнh-结构域在该方面差异巨大:以亲水性氨基酸对疏水性氨基酸的置换使得vнh与vl的结合变得不可能。这些置换还解释了vнh(纳米抗体)作为重组蛋白质获得时的高溶解性[14]。нсаb和经典抗体的所有可能的互补位(抗体的抗原结合部分)之间似乎可能存在显著差异。因为这两种抗体类型共存于相同有机体内,所以可认为它们为彼此互补而非竞争。例如,在针对完全相同的动物进行免疫时,关于抗原物质的各种表位,上述两种抗体类型可以平行生成、排他生成或以不同比例生成的事实已被反复指出。尽管推测与经典的双域抗体相比,单域抗体的可能互补位种类较少,但许多出版物已明确表明,针对相当宽范围抗原的最为全面的各种表位均能获得нсаb[15]。显然,这归因于增大的cdr1和cdr3区。我们还应注意vнh中的令人惊讶地大量(与经典抗体的可变结构域相比)的体细胞超突变,这可能是在免疫期间的抗体亲和力成熟过程中积累的[16]。x射线衍射分析表明vнh的抗原结合环区能够形成经典可变结构域通常无法形成的结构[12,16]。在经典抗体的vн-和vl-结构域的情况下,所有6个cdr对于抗原结合发挥几乎相同的作用;然而,在vнh的情况下,cdr3通常对于互补位的形成最为重要。已表明vнh中(而非vн或vl中)的cdr3能够形成极其长的指状结构,该结构可深入至抗原结构中,并且特别地,检测酶的活性位点[12]。vнh的抗原结合区的小尺寸及其形成通常无法形成的互补位的能力解释了如何可获得能够识别经典抗体无法获得的表位的hcab(例如,生产出有效抑制酶的抗体)[17]。对于与经典igg抗体相比的所有高潜力唯一特异性,由于单域vнh在有机体内快速消除形式,因此其治疗用途有时受到限制。存在数种设计用于改善vнh结构的药代动力学的方法,包括与peg的化学偶联以及与介导清除降低的多肽(例如具有长达三周的半衰期的hsa或fc融合蛋白)的共价结合[18,19,20]。已成功地使用通过重组技术结合至vнh以及能够与人体血液内的所述成分(hsa和igg)进行高亲和力非共价相互作用的小肽[21]。然而,这些方法的技术效果和免疫原性仍存在问题,并且其在临床或早期研究阶段中的使用可行性目前仍在调查研究中。另外,在将抗体用做药剂方面的最大限制在于其聚集和化学稳定性、亲和力以及免疫原性。因为大多数单克隆抗体基于鼠类抗体获得,所以在人体中定期使用此类抗体引发对于抗体治疗的免疫应答(例如,过敏反应)。这些类型的免疫应答最终至少导致缺乏疗效,并且在最坏情况下还可导致潜在过敏反应。另一方面,聚集或化学不稳定的治疗性抗体降低药物产品相对于时间的治疗特性,并可能增加其在对人类患者给药时的免疫原性。根据上述内容,开发具有改善的(与先前已知抗体相比较)功能特征和治疗特征,尤其是具有提高的聚集性、化学和热稳定性以及改善的亲和力,且将同时易于工业规模化获得的基于vнh的抗体是重要的。【发明背景】本发明的背景提供与含vнh结构域的各种抗体构建物相关的信息。pct/ep2008/066368公开描述了包含与fc-片段连接的单独可变结构域的抗体。纳体可用作具有fc的可变结构域,而所述fc获自ige类型抗体。所述结构域和fc片段可通过位于铰链结构域内的接头连接。专利申请us2009/0202979公开了包含与人类抗体恒定区直接连接的完整vнн抗体或其部分的抗体。此外,已知氨基酸置换影响抗体的物化和生物性质。例如,申请us20110028348描述了在35、45、47、93~100以及100a位引入氨基酸置换以改善所获抗体亲水性的重链可变结构域。如今,已开发出优化已分离vнн和vн单域的结构来降低其免疫原性并改善其聚集稳定性的方法。因此,vincke等人[22]已发现特征氨基酸中的glu-49→gly和arg-50→leu置换导致获得稳定性更高但溶解性更低的新的结构域。骨架区中的其它置换fr-2phe-42→val和gly/ala-52→trp对于抗体与抗原的亲和力至关重要,其归因于h3-环的重新定向,以使得解离常数增加6~10倍(6.85×10-31/s)。phe-42→val置换引起所获得抗体的稳定性降低。vн序列中的gly-49和leu-50置换导致所述结构域的稳定性降低,而vнн中的glu-49和arg-50人源化允许获得稳定的可变结构域。从文献可知,在中和经典vнн构象的遮蔽效应的短hcdr3区的存在下,并在引入vн特征性trp-47→gly-47置换以及tyr-37→val-37、glu-4→gly-44和arg-45→leu-45后,分离的vнн结构域可重新生成与vj结构域相结合的能力[24]。多项研究已证实经典igg结构的治疗性抗体的聚集稳定性的增强与其免疫原性的降低之间的关系,并在hermeling等人2004年发表的综述[25]中总结。然而,尚不存在显示包含vнн结构域但与全长人igg内的轻链的可变结构域连接的抗体。因此,需要开发将具有改善的稳定性和亲和力、良好的表达和低免疫原性的抗体新形式。此外,此前未有关于开发将具有以下特征的此类分子的方法的描述:易于获取;具有改善的聚集稳定性、提高的亲和力和哺乳动物细胞培养物中的高表达水平。根据前述内容,本发明首次描述了包含vнн衍生物的抗体,其能够与全长人igg的轻链可变结构域结合,导致形成与天然抗体类似(并因此具有低免疫原性)但具有改善的聚集稳定性、提高的亲和力和治疗性单克隆抗体结构的构建物。【附图】图1:基于vнн的抗聚集抗体的开发和优化流程图。图2:用包含各种氨基酸置换的vhhigg1抗体进行的sds-page。图3:美洲驼组合fab文库的合成流程图。图4:用于克隆噬菌体展示fab文库的噬菌粒。图5a-c:对vннfab克隆在与il-17a结合方面的比较动力学参数进行测试时所获得的传感图:图5a:在特异性抗人il-17a的fab内的美洲驼可变vhh结构域的序列。图5b:在特异性抗人il-17a的3vhhfab内的美洲驼轻链可变结构域的序列。图5c:对vннfab克隆在与il-17a结合方面的比较动力学参数进行测试时所获得的传感图。图6a:三种不同vнн突变体的氨基酸序列。图6b:三种vнh突变体的聚集稳定性。图6c:三种vнн突变体的亲和力。图7:通过使用vннigg1vk4b11、mut1vннigg1和mut4vннigg1拮抗剂抑制il-17a从而抑制il-6产生的细胞试验。图8:含人轻链的mut4vннfab的嵌合变体的分离。图9:通过使用mut4vнhigg1vk3c8、mut4vнhigg1vk1a7和mut4vнhigg1vk4e12拮抗剂抑制il-17a从而抑制il-6产生的细胞试验。图10:包含在m4vнhc8的44和45位具有突变的抗体的产物在变性剂条件下进行的蛋白电泳。图11:通过使用包含fr2中44和45位的突变的m4vhhc8拮抗剂抑制il-17a从而抑制il-6产生的对比细胞试验。图12:显示m4vнhc8的fr2中44和45位上决定轻链和重链可变结构域相互作用的不同突变的稳定性和功能特性的图。图13a:bcd109与各种来源的il-17a相互作用的动力学参数测定(使用octetred96设备进行试验)。图13b:bcd109与各种来源的il-17a相互作用的动力学参数所获得的结果(使用octetred96设备进行试验)图14:用bcd109抗体在热应力施加前后所获得的色谱图。【定义】除非本申请中另有说明,本文所使用的“单克隆抗体”涉及从美洲驼获得的抗体、嵌合抗体、人源化抗体、或全人源抗体。根据本发明的单克隆抗体可使用例如重组技术、噬菌体展示技术、合成技术或者这些技术或现有技术所熟知的其它技术的组合生产。“单克隆抗体”是指从包括,例如,任何真核克隆、原核克隆或噬菌体克隆的单拷贝或克隆获得,而非从其生产方法获得的抗体。“单克隆抗体”可以为完整抗体(具有完全或全长fc区)、实际上的完整抗体、包含抗原结合区的抗体部分或片段,例如:来自美洲驼抗体、嵌合抗体、人源化抗体或人抗体的fab片段、fab'片段或f(ab')2片段。“fab”片段包含轻链可变结构域和轻链恒定结构域,以及重链可变结构域和第一重链恒定结构域(сн1)。“f(ab')2”抗体片段包含由c端区域处的铰链连接半胱氨酸残基主要以共价方式结合的一对fab片段。抗体片段之间的其它化学键也为现有技术所熟知。此外,如本文使用的“单克隆抗体”可以为单链fv,该单链fv可通过将编码vнh和vl的dna与接头序列相结合来获得。只要蛋白质保持特异性结合至靶标或优选结合至靶标(例如表位或抗原)的能力,其均由术语“抗体”所涵盖。抗体既可糖基化,也可不糖基化,并且这些均在本发明的范围内。如本文所使用的术语“衍生物”或抗体“变体”是指通过在亲本抗体序列中添加、缺失和/或置换一个或更多个氨基酸残基后产生的异于亲本序列的氨基酸序列的分子。在优选实施方式中,抗体含有至少一个(例如1至约10个,优选2、3、4、5、6、7或8个)在亲本抗体的fr-区或cdr-区中的氨基酸置换。本申请将变体抗体序列的同一性或同源性定义为,在将变体抗体序列与亲本抗体序列进行比对并在必要时切割以实现最大百分比同一序列后,变体抗体序列中与亲本抗体中的残基完全相同的氨基酸残基所占的百分比。抗体衍生物(衍生自亲本抗体)保持其与亲本抗体结合至相同抗原(或者优选地,结合至相同表位)的能力,或者优选地,表现出至少一种优于亲本抗体的特性或生物活性。例如,与亲本抗体相比,所述抗体优选具有更佳的聚集稳定性、更强的亲和力、改善的药代动力学、或者提高的抗原生物活性抑制能力。本文所使用的术语“vнh衍生物”是指通过将亲本抗体序列中的一个或更多个氨基酸残基置换后产生的异于亲本vнh抗体序列的氨基酸序列的vнh抗体衍生物。在优选实施方式中,vнh抗体含有至少一个(例如1至约10个,优选2、3、4、5、6、7或8个)在亲本抗体fr-区或cdr-区中的氨基酸置换。抗体衍生物保持其与亲本抗体结合至相同抗原(或者优选地,结合至相同表位)的能力,或者优选地,表现出至少一种优于亲本抗体的特性或生物活性。例如,与亲本抗体相比,所述抗体优选具有更佳的聚集稳定性、更强的亲和力、改善的药代动力学、或者提高的抗原生物活性抑制能力。本文所使用的“亲本vнh抗体”或“初始vнh抗体”,或“野生vнh抗体”是指分离自免疫或未免疫骆驼科动物且由用于产生vнh变体的氨基酸序列编码的vнh抗体。虽然亲本抗体可具有源于骆驼科的骨架序列(就vнh可变结构域而言),但是优选地,其轻链可变结构域的骨架序列完全或基本上为人源序列。如本文所使用的“亲本”、“初始”或“野生”抗体是指由用于产生变体的氨基酸序列编码的抗体。虽然亲本抗体可具有源于骆驼科的骨架序列(就vнh可变结构域而言),但是优选地,其轻链可变结构域的骨架序列完全或基本上为人源序列。如本文所使用的术语“特异性结合”是指这样一种情形:其中特异性结合过程中所涉及的一方不与其特异性结合对象之外的分子显著结合。该术语还适用于,例如,根据本发明的抗体的抗原结合位点对若干抗原所带的特定表位具有特异性的情况;在此情况下,所述具有抗原结合位点的特异性抗体将能够与各种带有表位的抗原特异性结合。因此,根据本发明的单克隆抗体虽然与人il-17(il-17a)特异性结合,但是其不与人il-17b、il-17c、il-17d或il-17e特异性结合。此外,本发明的单克隆抗体虽然特异性结合人il-17和来自食蟹猴的il-17,但其既不与大鼠il-17特异性结合,也不与鼠科il-17特异性结合。如本文所使用的术语“优选结合”是指这样一种情形:其中如根据从现有技术已知的步骤所测量(例如,使用octet装置所获得的竞争性elisa或kd测量),抗体与特定抗原的结合比其与任何其它抗原的结合至少多20%,优选多约50%,或为其2倍、20倍、50倍或100倍。抗体可优选结合抗原内的一个表位,但不结合同一抗原的另一表位。因此,本发明的抗体优选结合人il-17,但不结合兔il-17。如本文所使用的术语“表位”是指可被抗体识别并通过抗体的一个或几个抗原结合位点与抗体结合的分子部分。表位通常包括分子例如氨基酸或糖侧链的化学表面活性基团,并具有特定的三维结构特征。“抑制表位”和/或“中和表位”表示如下表位:如在完整抗原分子和结合对于所述表位特异性的抗体的情况下,导致上述分子或含有该分子的有机体的活性发生体内或体外损失或减少。如本文所使用的术语“表位”还指在动物中(优选在例如小鼠和人的哺乳动物中)具有抗原活性和/或免疫原活性的多肽片段。如本文所使用的术语“抗原表位”指可特异性结合抗体并可通过从现有技术熟知的任何技术(例如,借助标准免疫测定法)检测的多肽片段。抗原表位并非一定为免疫原性的,但其可具有免疫原性。如本文所使用的“免疫原性表位”定义为,如通过现有技术的任何方法所测定的,激发动物中的抗体应答的多肽片段。“非线性表位”或“构象表位”含有与表位特异性抗体结合的抗原蛋白质内的不相邻的多肽(氨基酸)。如本文所使用的,提及根据本发明的抗体时所表述的“功能活性”或“功能特征”,或者术语“生物活性”或“活性”可互换,并且包括但不限于:表位/抗原亲和力和特异性;在体内或体外中和il-17或作为il-17拮抗剂的能力;ic50;所述抗体的抗体稳定性和体内免疫原性。由现有技术鉴定的其它生物学性质或抗体特征包括例如交叉反应性(即与靶肽的非人同源物或与其它蛋白质或靶标的反应),以及在哺乳动物细胞中保持高的蛋白质表达水平的能力。上述特性或特征可通过使用现有技术中公认的步骤进行观察、测量或评估,所述步骤包括但不限于elisa、竞争性elisa、octet分析、体外或体内(无限制)中和测定、受体结合、细胞因子或生长因子的产生和/或释放、从包括人、灵长类动物或任何其它来源的各种来源获得的组织切片的信号转导和免疫组化研究。如本文所使用的“单克隆抗体”群是指同源或基本同源的抗体群(即至少96%或96%,但更优选不小于约97%或98%,或进一步优选至少99%的该群中的抗体将在elisa中竞争相同抗原/表位,或进一步优选在氨基酸序列方面相同的抗体)。天然的全长抗体由包含经由二硫键连接的四条多肽链(两条全长约为50~70kda的重h链,和两条全长约为25kda的轻l链)的免疫球蛋白分子代表。每条链的氨基端部分包括约100~110或更多个用于结合抗原的氨基酸的可变结构域。每条链的羧基端结构域确定主要用于负责效应器功能的恒定区。轻链分为κ和λ两类,并且具有特异性恒定区。每条轻链的特征在于包括一个n端轻链可变区(下文称为vl或vk)和一个由单个结构域构成的轻链恒定区(cl或ck)。重链分类为γ、δ、α、μ和ε,并且分别定义了下面这些类别的免疫球蛋白:igg、igm、iga、igd和ige。它们中的一些可另外划分成例如igg1、igg2、igg3、igg4、iga1和iga2的亚类(同种型)。每种重链类型的特征在于特异性恒定区fc。每条重链包括一个n端可变区(下文称为vн)和恒定区cн。igg、igd和iga的重链恒定区由三个结构域构成(cн1、cн2和сн3),而igm和ige的重链恒定区由四个结构域构成(cн1、cн2、cн3和сн4)。vн、vнh和vl也可分为所谓的高变区(互补决定区,cdr),高变区分散于更为保守的骨架区(fr)之间。每个可变结构域包括三个cdr和各fr从n端至c端的位置顺序如下:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。在本申请中,3个重链cdr称为“hcdr1、hcdr2和hcdr3”,而3个轻链cdr称为“lcdr1、lcdr2和lcdr3”。cdr包含了与抗原特异性相互作用的大部分氨基酸残基。cdr残基根据kabat编号方案编号和定位。术语“抗原”是指抗体对其可具有反应性的抗原靶,在本文中,其以与专业人员在本
技术领域:
中对其使用时的相同的方法使用,并且包括但不限于多肽、肽、多糖、糖蛋白、多核苷酸(例如dna)或化学抗原、受体或白介素。所述白介素可包括各组的白介素,例如白介素1(α和β)、白介素2、白介素3、白介素4、白介素5、白介素6、白介素7、白介素8、白介素9、白介素10、白介素11、白介素17、白介素18和白介素33。术语“抗原”还可用于描述为了生产本发明抗体的目的而用于动物(例如,美洲驼)免疫的物质。在那种情况下,“抗原”可具有更广泛的意义,并可涵盖抗原的纯化形式以及未纯化或未完全分离形式,或纯化的抗原产品,例如细胞、细胞裂解物、或上清液、细胞碎片,例如,添加了与蛋白质载体偶联的半抗原的细胞膜等。用于免疫的抗原不一定表示与本发明抗体能够最终结合的抗原靶在结构上相同的抗原。一般而言,用于免疫的抗原为抗原靶的缩减版本,例如,含有免疫原性表位的片段。关于用于免疫的抗原的更多细节描述于文献中,并且对于本
技术领域:
中的专业人员而言可能是熟悉的。每对轻链/重链的可变区形成抗体的抗原结合位点。因此,完整的igg抗体具有两个结合位点。除双功能抗体或双特异性抗体之外,上述两个结合位点完全相同。根据本申请,如本文所使用的“抗原结合区”或“抗原结合位点”,或“抗原结合结构域域”可互换,其指包含与抗原相互作用且赋予抗体对于抗原的特异性及亲和力的氨基酸残基的抗体区。该抗体片段包括维持抗原结合残基的适当构象所需的骨架氨基酸残基。优选地,本发明抗体的vнh抗原结合区或整个抗原结合区的cdr完全源自骆驼科家族或基本上为骆驼科来源,并且包含为了改善抗体的特定性质(如kd、koff或ic50)而改变(例如用各种氨基酸残基置换(例如,参考表6))的特定氨基酸残基。优选地,根据本发明的抗体骨架区为骆驼科来源或人来源,或者基本上为人来源(例如至少80%、85%、90%、95%、96%、97%、98%或99%的人来源),并且符合kabat编号方案。“抗体片段”可由抗体片段或具有全长抗体活性的抗体片段代表。所述抗体片段可由f(ab')2、f(ab)2、fab'、fabfv和scfv代表。“白介素17”,也称为“il-17”或“il-17а”,是一种20-30kd的同源二聚体糖蛋白。人il-17基因编码由155个氨基酸构成并具有19个氨基酸的信号序列和136个氨基酸的成熟片段的蛋白。人il-17a的氨基酸序列与兔、小鼠和大鼠的氨基酸序列的相似度分别为80%,63%和58%。人il-17a的氨基酸序列与食蟹猴il-17a的同一性为97%。如本文所使用的,涉及本发明的抗il-17单克隆抗体(下文称为“本发明抗体”)时应用的术语“抗体”表示单克隆抗体。如本文所使用的,关于本发明抗体的活性的术语“抑制”或“中和”应表示显著阻断、防止、限制、减慢、停止、降低或逆转例如抑制对象的发展或严重性的能力,包括但不限于,生物学活性(例如il-i7活性)或特性、疾病或病症。根据本发明的抗体与il-17的结合导致il-17活性的抑制或中和优选为至少20%、30%、40%、50%、60%、70%、80%、90%、95%或更高。关于核酸或蛋白质产物(例如抗体)的术语“分开”或“分离”是指将核酸分子或蛋白质分子与至少一种通常与天然来源结合的污染物质分开并鉴定。优选地,“分离抗体”是指基本不含具有特定抗原特异性的其它抗体的抗体(例如,本发明药物组合物含有与il-17a特异性结合的分离抗体并且基本上不含与il-17a之外的抗原特异性结合的抗体)。如本文所使用的“kabat编号方案”或“根据kabat编号”是指用于对抗体重链和轻链可变区中比其它氨基酸残基更为可变(即高变)的氨基酸残基进行编号的系统(kabat等人.ann.nyacad.sci.,190:382-93(1971);kabat等人.sequencesofproteinsofimmunologicalinterest,第5版,u.s.departmentofhealthandhumanservices,nih公开号91-3242(1991))。多核苷酸若与其它多核苷酸具有功能性连接,则称为“功能性结合”。例如,如果启动子或增强子影响序列转录,则其功能性结合至编码序列上。如果两条多肽的编码多核苷酸(优选它们位于相同开放阅读框中)功能性结合,则其中一条多肽“功能性结合”至另一条多肽上。如本文所使用的术语“dna构建物”是指编码本发明抗体的dna或其片段。通常而言,在开放阅读框内,将编码抗体(例如本发明抗体)的dna或其片段功能性(可操作地)结合至编码另一多肽(例如,另一细胞因子受体例如il-2受体的结构域或区)的至少一个其它dna片段上,然后将其插入合适的表达载体中。一般情况下,dna构建物通过这样一种方式形成:将编码特定抗体位点的几种dna片段在阅读框内功能性关联,从而获得编码完整抗体或其功能性片段的固体构建物。例如,dna构建物将从n末端至c末端编码抗体。此类抗体可进行表达、分离和评估它们的活性。术语“载体”是指以合成方式并经由生物技术获得且含有本领域中已知的某组序列功能元素的核酸。某些载体在引入宿主细胞后,可在宿主细胞内自主复制,而其它载体可整合进入宿主细胞基因组,并随宿主基因组一起复制。此外,一些载体可介导其功能性结合的基因的表达。在本申请中,此类载体称为“重组表达载体”(或“表达载体”)。示例性载体从现有技术熟知。如本文所使用的术语“细胞”、“宿主细胞”、“细胞系”和“细胞培养物”可互换,并且指作为任何分离的根据本发明的多核苷酸或任何(一个或多个)含有本发明抗体序列的重组载体的接受者的单个细胞或细胞培养物。宿主细胞包含从单个宿主细胞获得的各代细胞;由于天然、偶然或预期突变和/或变异,各代细胞可无需与原代宿主细胞完全相同(就形态或全dna补体而言)。宿主细胞包括用重组载体或表达根据本发明的多核苷酸或其重链或轻链的单克隆抗体转化、转导或感染的细胞。含有根据本发明的重组载体(无论是否整合入宿主染色体中)的宿主细胞也可称为“重组宿主细胞”。本发明所使用的优选宿主细胞为cho细胞(例如,атссcrl-9096)、ns0细胞、sp2/0细胞、cos细胞(атсс,例如,crl-1650、crl-1651)和hela细胞(атссccl-2)。本发明所使用的其它宿主细胞包括植物细胞、酵母细胞、其它哺乳动物细胞和原核细胞。抗体和抗原靶(抗原)之间的术语“特异性结合”是指免疫特异性。如果抗体与一抗原表位的结合强度高于与其它抗原表位的结合强度,则可称抗体可特异性结合该抗原靶。特异性结合不排除与带有相似抗原表位的其它抗原的交叉反应性。本发明的抗体中的vl结构域既可为λ型vl,也可为κ型vl。术语“vl结构域”涵盖了含有一个或更多个氨基酸置换、插入或缺失的vlλ同种型和vlκ同种型两者。术语“药物组合物”涵盖了含有治疗有效量的本发明抗体以及赋形剂(例如载体(carriers)、稀释剂、载体(vehicles)、溶剂和其它赋形剂)的制剂和/或组合物。术语“使用”或“治疗”适用于使用本发明的抗体或含有其的药物组合物来治疗、减轻疾病的病程、加速由本发明的抗体可结合的受体所介导的疾病或病症的缓解或降低其复发率的能力。技术实现要素:本发明提出一种具有提高的亲和力和改善的聚集稳定性的人源化单克隆抗体,优选igg类型抗体,其中可变结构域由vнh衍生物与轻链可变结构域vl的结合代表。在一个实施方式中,本发明抗体的vнh衍生物可包含44x245x3位上的氨基酸置换,其中x2=g、a、v、s、t;x3=a、v、t、h;或其组合(44和45表示氨基酸置换位置)。下文中,氨基酸置换位置使用kabat编号方案(http://www.bioinf.org.uk/abs/)来表示。另一实施方式涉及本发明的抗体,其与含有分离自免疫动物的vнh的初始igg抗体相比,具有改善的vнh衍生物的聚集稳定性,其中免疫动物可来自骆驼科。本发明的另一实施方式涉及包含vнh衍生物的抗体,所述vнh衍生物是分离自来自骆驼科家族的免疫动物的抗体的重链可变结构域。本文中vнh衍生物可具有在任何位置上的人典型的额外氨基酸置换,除了在44和45位上的如下置换之外:a)44x2,其中x2=g、a、v、s、t;b)45x3,其中x3=a、v、t、h;或其组合。另一实施方式涉及含有vнh衍生物的本发明的抗体,所述vнh衍生物可由分离自源于骆驼科家族的未免疫动物的重链可变结构域代表。本文中vнh衍生物可具有在任何位置上的人典型的额外氨基酸置换,除了在44和45位上的如下置换之外:a)44x2,其中x2=g、a、v、s、t;b)45x3,其中x3=a、v、t、h;或其组合。另一实施方式涉及包含轻链可变结构域vl的本发明的抗体,所述轻链可变结构域vl是人抗体的衍生物。在本发明的另外的实施方式中,所述轻链可变结构域vl是动物抗体的人源化片段。另一实施方式涉及本发明的抗体,其包含含有半胱氨酸-44(kabat编号方案)的vнh衍生物和含有半胱氨酸-100(kabat编号方案)的轻链可变结构域vl。本发明的另一实施方式涉及以下任一同种型的抗体:igg1、igg2、igg3或igg4。另一实施方式涉及包含作为igg的一部分的非天然的修饰fc的本发明抗体。另一实施方式涉及具有如下聚集稳定性的本发明的抗体:当以高于10mg/ml的浓度使用并在4℃的温度下储存>6个月后,溶液中聚集物含量增加不超过其初始含量的5%。在本发明的另一实施方式中,抗体具有如下聚集稳定性:当以高于10mg/ml的浓度使用并在37℃的温度下储存>2周后,溶液中聚集物含量增加不超过其初始含量的5%。本发明的另一额外的实施方式涉及具有如下聚集稳定性的抗体:当以高于10mg/ml的浓度使用并在42℃的温度下储存>48h后,溶液中聚集物含量增加不超过其初始含量的5%。本发明的又一额外的实施方式涉及具有如下聚集稳定性的抗体:当以高于10mg/ml的浓度使用并在50℃的温度下储存>6h后,溶液中聚集物含量增加不超过其初始含量的5%。一个实施方式涉及解离常数kd≤10-9m的抗体。另一实施方式涉及本发明的抗体,其具有抗体-抗原相互作用缔合常数kon(1/ms)≥1051/ms。本发明的又一实施方式涉及具有抗体-抗原解离常数dis(1/s)≤10-41/s的抗体。此外,本发明提出一种抗体片段。该抗体片段可由轻链、重链、为抗体序列(包括生物特异性抗体变体)的一部分的轻链和/或重链的可变结构域代表。本发明的另一实施方式涉及抗体片段,所述抗体片段由轻链、重链、为fab的部分的轻链和/或重链的可变结构域代表。本发明的抗体片段可由轻链、重链、为scfv的部分的轻链和/或重链的可变结构域代表。此外,本发明提出生产本发明抗体的方法。所述抗体的生产方法可包括选自以下的阶段:本领域所熟知的定向诱变、展示方法、遗传工程、生物化学和高性能生物技术方法,其可包括在骆驼科抗体的vнh结构域的不同位置上的定向诱变方法。此外,本发明提供一种编码所要求保护的抗体或其片段的dna构建物,以及一种包括一个或多个本发明的dna构建物的表达载体。此外,本发明提出一种包括所述表达载体或dna构建物的细胞系。此外,本发明提出一种人源化单克隆抗体或其片段的生产方法,该方法涉及将细胞系在足以获得所述抗体或其片段的条件下在培养基中培养,然后对所获得的抗体或其活性片段进行分离和纯化。此外,本发明提出一种含有抗体或其片段的药物组合物,该抗体或其片段与一种或多种药学上合适的赋形剂、稀释剂或载体结合。专用生物技术指南中(例如在[25]中)描述了组合物获取技术的细节。本发明的另一实施方式涉及一种与人il-17a特异性结合的活性分子内的抗体或其片段,其中所述抗体或其片段包含含有三个高变区hcdr1、hcdr2和hcdr3的骆驼科重链可变结构域(vнh)的衍生物;其中:hcdr1包含seqidno:1的氨基酸序列:g-t-f-a-t-х32-х33-х34-х35(根据kabat指数编号),其中х32是选自s、n、k、r、e、w、q、d、a、v和f的氨基酸;х33是选自p和s的氨基酸;х34是选自m和i的氨基酸;х35是选自g、n、s、a、l、i、r、v和q的氨基酸;hcdr2包含seqidno:2的氨基酸序列:х50-i-x52-х52a-s-g-х55-d-r-i-y-a-d-s-v-k-g,其中:х50是选自a、g和l的氨基酸;х52是选自s、d和e的氨基酸;х52a是选自p和a的氨基酸;х55是选自g、s、t、l、r、d、e、k、a和w的氨基酸;hcdr3包含seqidno:3的氨基酸序列:с-а-x94-x95-x96-x97-f-x99-x100-x100a-x100b-x100c-x100d-x100e-x100f–d-y–d-s,其中x94是选自k、s、t、v、d和g的氨基酸;x95是选自r和k的氨基酸;x96是选自g、r、y、h、d、w和k的氨基酸;x97是选自r、a、v、s、l和h的氨基酸;x99是选自d、e、g、a、r、v、k和q的氨基酸;x100是选自g、s和n的氨基酸;x100a是选自g、t、p、v、r、n和k的氨基酸;x100b是选自v、s、t、l、y、a、h、g和i的氨基酸;x100c是选自y、w和s的氨基酸;x100d是选自r、v、l、y、a、w、k、g、q和i的氨基酸;x100e是选自t、l、a和s的氨基酸;x100f是选自t、l、g、p、n、a、q、f、i和d的氨基酸;b)人抗体的轻链可变结构域(vl)或人源化抗体的轻链可变结构域。替代的实施方式涉及抗体或其片段,所述抗体或其片段与人il-17a特异性结合并包含含有三个高变区的重链可变结构域(vнh)的衍生物,其中:hcdr1包含g-t-f-a-t-s-p-m-g的氨基酸序列(seqidno:4);hcdr2,包含a-i-s-p-s-g-g-d-r-i-y-a-d-s-v-k-g的氨基酸序列(seqidno:5);hcdr3包含с-а-v-r-r-r-f-d-g-t-s-y-y-t-g-d-y-d-s的氨基酸序列(seqidno:6);b)人抗体的轻链可变结构域(vl)或人源化抗体的轻链可变结构域。替代的实施方式涉及抗体,所述抗体与人il-17a特异性结合并包含含有seqidno:7的氨基酸序列的重链可变结构域(vhh)的衍生物,以及人抗体的轻链可变结构域(vl)或人源化抗体的轻链可变结构域。替代的实施方式涉及抗体或其片段,所述抗体或其片段与人il-17a特异性结合并包含vнh衍生物,其中所述可变结构域包含与seqidno:7具有至少90%同一性的氨基酸序列。替代的实施方式涉及抗体,所述抗体与人il-17a特异性结合并包含含有seqidno:7的氨基酸序列的vнн衍生物;以及含有seqidno:8的氨基酸序列的人抗体的轻链可变结构域(vl)。替代的实施方式涉及抗体或其片段,所述抗体或其片段与人il-17a特异性结合并包含vнн衍生物及人抗体的轻链可变区(vl),其中所述可变区包含与seqidno:8具有至少90%同一性的氨基酸序列。替代的实施方式涉及抗体,所述抗体与人il-17a特异性结合并包含含有seqidno:9氨基酸序列的重链,以及包含seqidno:10序列的人抗体轻链可变结构域(vl)。另一实施方式涉及抗体,所述抗体与人il-17a特异性结合并包含重链和轻链,其中所述链含有与seqidno:9和/或seqidno:10具有至少90%同一性的氨基酸序列。替代的实施方式涉及与人il-17a特异性结合的本发明的抗体,其中所述抗体具有kd≤10-10m的特征性的与人il-17a的结合亲和力。另一实施方式涉及与人il-17a特异性结合的抗体,其中对于人il-17a的动力学缔合常数kon(1/ms)为至少1051/ms。另一实施方式涉及与人il-17a特异性结合的抗体,其中对于人il-17a的动力学解离常数dis(1/c)不大于10-51/s。替代的实施方式涉及抗体,所述抗体与人il-17a特异性结合,并且相对于通过任何特异性活性试验检测的任何参数,其对人il-17a的活性抑制不小于50%。替代的实施方式涉及与人il-17a特异性结合的抗体,其中所述抗体产自哺乳动物、酵母或细菌细胞。替代的实施方式涉及抗体,所述抗体与人il-17a特异性结合,并且与天然fc相比较,在fc区含有一个或更多个额外的氨基酸置换,其中与具有天然fc的抗体相比较,所述置换改善了抗体的物理化学性质和药代动力学性质,并且不导致抗体与il-17a结合能力的损失。替代的实施方式提出一种dna构建物,该dna构建物编码与人il-17a特异性结合的抗体。此外,本发明提出包含一个或更多个dna构建物的表达载体,所述dna构建物编码与人il-17a特异性结合的抗体。此外,提出包括载体的宿主细胞,用于获得与人il-17a特异性结合的抗体。此外,本发明提出用于生产与人il-17a特异性结合的抗体的方法,其特征在于,将含有dna构建物的宿主细胞在适于获得所述抗体或其片段的条件下在培养基中培养,并进一步对所述抗体或其活性片段进行分离和纯化。此外,提出药物组合物,该药物组合物包含与人il-17a特异性结合的抗体,以及一种或更多种药学上合适的赋形剂、稀释剂或载体。所述组合物可进一步包含选自tnf-α抑制剂的活性药物成分。所述组合物可用于治疗il-17a介导的疾病或病症。il-17a介导的疾病或病症选自:类风湿性关节炎、骨关节炎、青少年慢性关节炎、脓毒性关节炎、莱姆关节炎(lymearthritis)、银屑病关节炎、反应性关节炎、脊柱关节病、系统性红斑狼疮、克罗恩病(crohn’sdisease)、溃疡性结肠炎、炎性肠病、胰岛素依赖型糖尿病、甲状腺炎、哮喘、过敏性病症、银屑病、皮炎、系统性硬化症、移植物抗宿主病、移植排斥、与器官移植有关的急性或慢性免疫疾病、肉状瘤病、动脉粥样硬化、弥散性血管内凝血、川崎病(kawasakidisease)、格雷夫斯病(graves’disease)、肾病综合征、慢性疲劳综合征、韦格纳病(wegener'sdisease)、亨-舍紫癜(henoch-schonleinpurpura)、伴有肾损害的显微镜下多血管炎、慢性活动性肝炎、葡萄膜炎、脓毒性休克、中毒性休克综合征、脓毒症综合征、恶病质、感染、入侵、获得性免疫缺陷综合征、急性横贯性脊髓炎、亨廷顿舞蹈病(huntingtonchorea)、帕金森病(parkinsondisease)、阿尔茨海默病(alzheimerdisease)、中风、原发性胆汁性肝硬化、溶血性贫血、恶性肿瘤、心力衰竭、心肌梗死、艾迪生病(addisondisease)、多腺性自身免疫综合征i型和ii型、施密特综合征(schmidt'ssyndrome)、急性呼吸窘迫综合征、脱发、斑形脱发、血清反应阴性关节病、关节病、莱特尔综合征(reiter'ssyndrome)、银屑病性关节病、与溃疡性结肠炎有关的关节病、肠病性滑膜炎、与衣原体、耶尔森氏菌属和沙门氏菌属有关的关节病、脊柱关节病、动脉粥样化病/冠状动脉硬化、特应性变态反应、自身免疫性大疱病、天疱疮、落叶状天疱疮、类天疱疮、线状iga疾病、自身免疫性溶血性贫血、coombs阳性溶血性贫血、获得性恶性贫血、青少年恶性贫血、肌痛性脑脊髓炎/慢性疲劳综合征、慢性活动性肝炎症、颅巨细胞动脉炎、原发性硬化性肝炎、隐源性自身免疫性肝炎、获得性免疫缺陷综合征(aids)、aids相关疾病、乙肝、丙肝、常见变异型免疫缺陷病(常见变异型低丙球蛋白血症)、扩张型心肌病、女性不育、卵巢功能不全、卵巢早衰、肺纤维化、隐源性纤维化性肺泡炎、炎症后间质性肺病变、间质性肺炎、与间质性肺病相关的结缔组织病、与间质性肺病相关的混合性结缔组织病、与间质性肺病相关的系统性硬皮病、与间质性肺病相关的类风湿性关节炎、与肺病相关的系统性红斑狼疮、与肺病相关的皮肌炎/多肌炎、与肺病相关的舍格伦病(sjogrendisease)、与肺病相关的强直性脊椎炎、弥漫性肺血管炎、与肺病相关的含铁血黄素沉着症、药物引起的间质性肺病、纤维化、辐射诱导的纤维化、闭塞性细支气管炎、慢性嗜酸细胞性肺炎、伴有淋巴细胞浸润的肺病、感染后间质性肺病变、痛风性关节炎、自身免疫性肝炎、i型自身免疫性肝炎(经典自身免疫性或类狼疮性肝炎)、ii型自身免疫性肝炎(与抗lkm抗体相关)、自身免疫性低血糖症、伴有角质肥厚的b型胰岛素抵抗、甲状旁腺机能减退、急性移植相关的免疫疾病、慢性移植相关的免疫疾病、骨关节病、原发性硬化性胆管炎、i型银屑病、ii型银屑病、特发性白细胞减少症、自身免疫性中性白细胞减少症、nos-肾疾病、肾小球性肾炎、显微镜下肾多血管炎、莱姆病、盘状红斑狼疮、特发性的nos男性不育、抗精子免疫、多发性硬化(所有类型)、交感性眼炎、结缔组织病继发的肺动脉高压症、古德帕斯丘综合征(goodpasturesyndrome)、结节性多动脉炎的肺表现、急性风湿热、类风湿性脊椎炎、斯蒂尔病(still'sdisease)、系统性硬皮病、舍格伦综合征(sjogren'ssyndrome)、高安病(takayasudisease)/关节炎、自身免疫性血小板减少症、特发性血小板减少症、自身免疫性甲状腺病、甲状腺机能亢进、自身免疫性甲状腺机能减退(桥本病,hashimotodisease)、萎缩性自身免疫性甲状腺机能减退、原发性粘液水肿、晶状体源性葡萄膜炎、原发性血管炎、白癜风、急性肝病、慢性肝病、酒精性肝硬化、酒精诱导的肝损伤、胆汁淤积、特质性肝疾病、药物引发的肝炎、非酒精性脂肪性肝炎、过敏症和哮喘、b组链球菌感染(groupbstreptococcalinfection,gbs)、精神障碍(包括抑郁症和精神分裂症)、th1-和th2-介导的疾病、急性和慢性疼痛(各种形式)、恶性肿瘤(例如肺癌、乳腺癌、胃癌、膀胱癌、结肠直肠癌、胰腺癌、卵巢癌、前列腺癌和造血系统恶性肿瘤(白血病和淋巴瘤))、无β脂蛋白血症、手足发绀、急性和慢性感染及侵染、急性白血病、急性淋巴细胞白血病、急性髓细胞白血病、急性或慢性细菌感染、急性胰腺炎、急性肾衰竭、腺癌、心房异位、aids痴呆复合征、酒精引发的肝炎、过敏性结膜炎、过敏性接触性皮炎、过敏性鼻炎、同种异体移植排斥、α-i抗胰蛋白酶缺乏症、肌萎缩侧索硬化症、贫血、心绞痛、前角细胞变性、抗-cd3治疗、抗磷脂综合征、抗受体的超敏反应、主动脉瘤和外周动脉瘤、主动脉夹层、高动脉压、冠状动脉硬化、动静脉瘘、共济失调、心房纤颤(恒定或阵发的)、心房扑动、房室阻断、b-细胞淋巴瘤、骨移植排斥、骨髓移植(bmt)排斥、束支传导阻滞、伯基特淋巴瘤(burkittlymphoma)、烧伤、心律失常、心肌顿抑综合征、心脏肿瘤、心肌病、对旁路的炎性应答、软骨移植排斥、大脑皮层变性、小脑病症、混乱或多灶性房性心动过速、化疗引发的疾病、慢性髓细胞性白血病(cml)、慢性酒精成瘾、慢性炎性疾病、慢性淋巴细胞白血病(cll)、慢性阻塞性肺病、慢性水杨酸盐中毒、结肠直肠癌、充血性心力衰竭、结膜炎、接触性皮炎、肺侧心、冠状动脉疾病、克-雅病(creutzfeldt-jakobdisease)、培养阴性脓毒症、囊性纤维化、细胞因子疗法引发的病症、拳击手脑病、脱髓鞘病、登革出血热、皮炎、皮肤病、多尿症(diabetes)、糖尿病(diabetesmellitus)、多尿症相关的动脉粥样硬化血管疾病、弥漫性路易体病(diffuselewybodydisease)、充血性扩张型心肌病、基底神经节疾病、中年唐氏综合征(down'ssyndromeinmiddleage)、中枢神经系统多巴胺阻滞剂引发的运动障碍、药物敏感性、湿疹、脑脊髓炎、心内膜炎、内分泌病、会厌炎、爱-巴病毒感染(epstein-barrviralinfection)、红斑性肢痛症、锥体外系综合征和小脑综合征、家族性嗜红细胞性淋巴组织细胞增生症、胎儿胸腺移植排斥、弗里德希氏共济失调(friedreich'sataxia)、外周动脉疾病、真菌败血症、气性蜂窝织炎、胃溃疡、肾小球性肾炎、任何器官或组织的移植排斥、革兰氏阴性脓毒症、革兰氏阳性脓毒症、由细胞内有机体引起的肉芽肿、毛细胞白血病、哈-施病(hallervorden-spatzdisease)、桥本甲状腺炎(hashimoto'sthyroiditis)、枯草热、心脏移植排斥、血色素沉着病、血液透析、溶血性尿毒综合征/血栓性血小板减少性紫癜、出血、甲肝、束支心律失常、hiv感染/hiv神经病、霍奇金病(hodgkindisease)、运动机能亢进性运动疾病、超敏反应、超敏性相关的肺炎、高血压、运动机能减退性运动障碍、下丘脑-垂体-肾上腺轴的检查、特发性艾迪生病(idiopathicaddison'sdisease)、特发性肺纤维化、抗体介导的细胞毒性、衰弱、婴儿型肌肉萎缩、主动脉炎症、甲型流感病毒、暴露于电离辐射、虹膜睫状体炎/葡萄膜炎/视神经炎、缺血/再灌注引发的病症、缺血性中风、幼年型类风湿性关节炎、幼年型脊髓性肌萎缩、卡波西肉瘤(kaposi'ssarcoma)、肾移植排斥、军团杆菌病、利什曼病、麻风病、皮质脊髓束损伤、脂肪水肿、肝脏移植排斥、淋巴水肿、疟疾、恶性淋巴瘤、恶性组织细胞病、恶性黑色素瘤、脑膜炎、脑膜炎球菌血症、代谢疾病/特发性疾病、偏头痛、多系统线粒体疾病、混合性结缔组织病、单克隆丙种球蛋白病、多发性骨髓瘤、多系统变性症(menceldejerine-thomasshi-drager和machado-joseph)、重症肌无力、胞内鸟分枝杆菌、结核分枝杆菌、骨髓增生异常综合征、心肌梗死、心肌缺血性疾病、鼻咽癌、新生儿慢性肺疾病、肾炎、肾病、神经变性疾病、神经源性肌萎缩i型、中性白细胞减少性发热、非霍奇金淋巴瘤(non-hodgkin’slymphoma)、腹部主动脉分支闭塞、动脉阻塞性疾病、治疗、睾丸炎/附睾炎、睾丸炎/输精管吻合术、器官巨大症、骨质疏松症、胰腺移植排斥、胰腺癌、副肿瘤性疾病/肿瘤相关的高钙血症、甲状旁腺移植排斥、盆腔炎症性疾病、常年性鼻炎、心包疾病、周边动脉粥样硬化(动脉粥样硬化)疾病、外周血管疾病、腹膜炎、恶性贫血、卡氏肺囊虫肺炎、poems综合征(多神经病、器官巨大症、内分泌病、单克隆浆细胞增生性病症和皮肤变化)、灌注后综合征、泵头综合征、心脏切开术后梗塞后综合征、子痫前期、进行性核上性麻痹、原发性肺动脉高血压、放射疗法、雷诺现象和疾病(raynaud'sphenomenonanddisease)、雷诺病(raynoud'sdisease)、雷夫叙姆病(refsum'sdisease)、常规窄qrs心动过速、肾血管性高血压、再灌注损伤、限制性心肌病、肉瘤、硬皮病、老年性舞蹈症、路易体痴呆(dementiawithlewybodies)、血清反应阴性关节炎、休克、镰状细胞病、皮肤同种异体移植排斥、皮肤变化、小肠移植排斥、实体瘤、特异性心律失常、脊髓性共济失调、脊髓小脑退化、链球菌肌炎、小脑结构损伤、亚急性硬化性全脑炎、晕厥、心血管梅毒、全身性过敏反应、综合全身炎症反应综合征、全身发病型幼年类风湿性关节炎、t细胞或faball、毛细管扩张、血栓闭塞性脉管炎、血小板减少症、毒性、移植、外伤/出血、iii型超敏反应、iv型超敏反应、不稳定心绞痛、尿毒症、尿脓毒病、荨麻疹、心脏瓣膜病、静脉曲张、血管炎、静脉疾病、静脉血栓形成、心室纤维性颤动、病毒和真菌感染、病毒性脑炎(vitalencephalitis)/无菌性脑膜炎、病毒性嗜红细胞综合征(vitalhemophagocyticsyndrome)、韦尼克-科尔萨科夫综合征(wernicke-korsakoffsyndrome)、威尔逊病(wilson'sdisease)、任何器官或组织的异种移植排斥、急性冠状动脉综合征、急性特发性多神经炎、急性炎症性脱髓鞘性神经根神经病、急性缺血、成人斯蒂尔病(adult-onsetstillsdisease)、斑形脱发、过敏性反应、抗磷脂抗体综合征、再生障碍性贫血、冠状动脉硬化、特应性湿疹、特应性皮炎、自身免疫皮炎、与链球菌感染相关的自身免疫性疾病、自身免疫性肠病、自身免疫性听力丧失、自身免疫性淋巴细胞增生综合征(alps)、自身免疫性心肌炎、自身免疫性卵巢早衰、睑缘炎、支气管扩张、大疱性类天疱疮、心血管疾病、灾难性抗磷脂综合征、乳糜泻、颈椎病、慢性缺血、疤痕性类天疱疮、具有多发性硬化风险的临床孤立综合征(cis)、结膜炎、儿童期发作的精神病症、慢性阻塞性肺病(copd)、泪囊炎、皮肌炎、糖尿病性视网膜病、糖尿病、椎间盘突出、椎间盘脱出、药物引发的免疫性溶血性贫血、心内膜炎、子宫内膜异位症、眼内炎、巩膜外层炎、多形性红斑、严重多形性红斑、妊娠期类天疱疮、吉兰-巴雷综合征(guillain-barresyndrome,gbs)、枯草热、休斯综合征(hughessyndrome)、特发性帕金森病、特发性间质性肺炎、ige介导的变态反应、自身免疫性溶血性贫血、包涵体肌炎、感染性眼部炎性疾病、炎性脱髓鞘病、炎性心脏病、炎性肾病、特发性肺纤维化/常见间质性肺炎、虹膜炎、角膜炎、干燥性角结膜炎、库斯莫尔病(kussmauldisease)或库-梅病(kussmaul-meierdisease)、兰德里麻痹(landrypalsy)、朗格汉斯细胞组织细胞增生症(langerhans'cellhistiocytosis)、大理石色皮、黄斑变性、显微镜下多血管炎、别赫捷列夫病(bechterewdisease)、运动神经元疾病、粘膜类天疱疮、多发性器官衰竭、重症肌无力、脊髓发育不良综合征、心肌炎、神经根病症、神经病、非甲非乙型肝炎、视神经炎、骨质溶解症、卵巢癌、少关节型jia、外周动脉闭塞性疾病、周围性血管疾病、周围动脉疾病(pad)、静脉炎、结节性多动脉炎、多软骨炎、风湿性多肌痛、白发病、多关节型幼年特发性关节炎、多发性内分泌缺乏、多肌炎、风湿性多肌痛(pmr)、泵后综合征、原发性帕金森综合征、前列腺癌和直肠癌以及造血系统恶性肿瘤(白血病和淋巴瘤)、前列腺炎、纯红细胞再生障碍、原发性肾上腺机能不足、复发性视神经脊髓炎、再狭窄、风湿性心脏病、sapho(滑膜炎、痤疮、脓疱病、骨肥大和骨炎)、硬皮病、继发性淀粉样变性、休克肺、巩膜炎、坐骨神经痛(ischias)、继发性肾上腺机能不足、硅相关的结缔组织病、斯-威病(sneddon-wilkinsondisease)、强直性脊柱炎、史-约综合征(stevens–johnsonsyndrome)、全身炎症反应综合征、颅动脉炎、弓形体鼻炎、中毒性表皮坏死松解症、横贯性脊髓炎、traps(肿瘤坏死因数受体相关的周期性综合征)、i型变态反应、ii型糖尿病、荨麻疹、常见间质性肺炎、血管炎、春季结膜炎、病毒性视网膜炎、福-小-原综合征(vogt-koyanagi-haradasyndrome,vkh综合征)、湿性黄斑变性、伤口愈合和耶尔森氏菌属或沙门氏菌属相关的关节病。可以治疗有效量给予包含与人il-17a特异性结合的抗体的药物组合物以治疗il-17a介导的疾病或病症。本发明还提出使用与人il-17a特异性结合的抗体治疗il-17a介导的疾病或病症的方法。所述治疗方法还可涉及tnf-α抑制剂的给药。其它实施例用于阐明本发明,但不意在将本发明局限于那些实施例本身。本申请的描述包括所引用的所有信息来源。【实施例】实施例1:获得基于vнн的抗体的流程图图1为基于vнн的抗体的获得和优化流程图。实施例2:在悬浮哺乳动物细胞培养物中的产生重组抗原和抗体根据已发表方案[26,27],在获取自中国仓鼠卵巢细胞(cho-k1)的确立细胞系中产生抗体和抗原。使用组成性表达ebna1蛋白质(爱-巴病毒核抗原1)的基因的细胞。悬浮培养在使用来自lifetechnologiescorporation的无血清培养基的定轨振荡器上的摇瓶中、并根据制造商指南进行。为了瞬时表达,借助线型聚乙烯亚胺(peimax,polysciences)将2×106/ml浓度的细胞进行转染。dna/pei的比率为1:3~1:10。在转染后5~7天,在2000g下将细胞培养物离心20min,并通过0.22μm过滤器过滤。之后,通过亲和hplc从培养液中分离出靶蛋白。通过profinityimac负载镍的树脂(bio-rad)从培养液中分离并纯化c末端区域中含有6个组氨酸的重组il-17a蛋白质。在纯化步骤之前,将nicl2加入培养液中,并使其浓度达到1mm。然后,将5ml的profinityimac负载镍的(树脂)加入培养液中,并在室温下通过振荡器混合1小时。将吸附剂转移入5mlthermoscientific聚丙烯柱内,并使用5倍柱体积的pbs洗脱以除去非特异性结合的组分。使用0.3m咪唑(ph8)和150mmnacl洗脱结合的抗原。然后借助snakeskin透析管技术将上述蛋白透析进入pbs(ph7.4)中、将其过滤(0.22μm)、转移至管中并保存于-70℃下。通过sds-page(图2)来评估所获得的蛋白质的纯度。使用1mlhitraprproteinaff柱(gehealthcare)并根据上述用于il-17a-fc的步骤,对测试和对照igg1抗体进行纯化。通过sds-page(图2)来评估所获得的蛋白纯度。实施例3:使用人il-17的美洲驼免疫和噬菌体展示美洲驼抗体的fab文库的生成借助抗原物质的皮下给药对美洲驼连续进行5次免疫,所述抗原物质混合有等体积的完全弗氏佐剂(第一次注射)或不完全弗氏佐剂(除第一次之外的所有注射)。重组蛋白混合物(每次注射各蛋白0.2mg)用作抗原,其中之一为人il-17a(来自r&dsystems的试剂盒)。第二次注射(免疫阶段)在第一次注射三周后实施;其它三次免疫的实施间隔为两周。从第三次注射开始,每次注射后均采集血液样品(50ml)。使用含1mmedta的pbs将采集血样2倍稀释。然后将35ml的稀释血样置于15ml的-1077介质(sigma,密度为1.077g/ml)上,并在800g下离心20min。从血浆/histopaque介质的相间区域选取单核细胞(淋巴细胞和单核细胞),并使用含1mmedta的pbs洗涤。使用rneasyminikit根据其方案(qiagen)从美洲驼单核细胞中分离总rna。使用nanovue(gehealthcare)进行rna浓度测定;借助1.5%琼脂糖凝胶电泳检测已分离的rna的质量。使用mmlvrt试剂盒(evrogen)根据建议方案用mmulv逆转录酶和随机六聚体引物进行逆转录反应。将逆转录产物用作两阶段聚合酶链式反应中的基质,以获得侧翼具有限制性位点的可变结构域的基因;反应使用寡核苷酸试剂盒并通过[27,28,29]的方案来实施。此外,借助图3中所示的依序的限制、连接和扩增反应,将编码轻链和重链的可变结构域的基因一起放入一个片段中。重链基因分别单独与κ和λ轻链基因连接。在该情况下,所有反应中的基质分子的估计计数均不小于1011。所获得的dna产物(vl-ck-vh)用nhei/eco91i限制性内切酶处理,并连接到原始噬菌粒ph5中。噬菌粒结构呈现于图4。将连接产物转化至根据方案[30]制备的ss320电感受态细胞内。全部所构建的κ和λfab文库分别为5.1×108和3.7×108。天然噬菌体展示文库的产物根据先前描述的步骤[31]来制备。实施例4:选择噬菌体展示抗体的fab文库使用重组人il-17a(来自r&dsystems的试剂盒)从噬菌体fab展示文库中选择特异性抗il17a噬菌体展示fab抗体;一系列选择循环如上所述实施[27,31,32]。为通过淘选法(panningmethod)实施选择过程,在4℃下使50mm碳酸盐缓冲液(ph9.5)中的人il-17a过夜吸附在highsorb管(nunc)的表面上。进一步使用pbs(ph7.4)冲洗该管,然后使用含pbs(ph7.4)-脱脂牛奶(0.5%重量/体积)的溶液封闭1小时。然后,将置于pbs(ph7.4)-脱脂牛奶(0.5%重量/体积)中的2~4ml的噬菌体溶液(每ml有1012个噬菌体颗粒)与抗原一起移入上述管内,并将该体系在搅拌下温育1小时。通过一系列pbs(ph7.4)-tween20(0.1%体积/体积)冲洗循环去除未结合的噬菌体。其中,冲洗循环次数自第一轮至第三轮增加—分别为20-30-40次。将保持结合的噬菌体颗粒用100mmgly-hcl溶液(ph2.5)在搅拌下进行15min洗脱,并随后用1mtris-hcl(ph7.6)中和。使用所获得的噬菌体感染е.colitg1细菌;进一步分离噬菌体并用于下一轮循环。在第二轮和第三轮选择后,用于多克隆噬菌体产物实施的elisa已显示显著富集。将富含人fab的克隆汇集物(pooledclone)再次克隆至在重链的ch1基因的c末端上含有myc标签和his6标签的表达质粒ll内。实施例5:与人il-17a特异性结合的fab分析使用elisa测定所研究的fab片段与人il-17a的结合。将具有已发表ain457序列(novartis)的fab用作阳性对照。将elisa板的孔(nuncimmunomaxisorp)涂覆50μl(在1倍涂覆碳酸盐缓冲液中为0.5μg/ml)的il-17a-fc,然后将其密闭并在4℃下温育过夜。所有后续步骤均使用例如genetixq-pix2xt(moleculardevices)和tecanfreedomevo200(tecan)的高性能系统根据标准elisa方案进行。通过加入阻断缓冲液bb(pbs中200μl0.5%脱脂牛奶)来阻断非特异性结合。将板在振荡器上室温温育1h。在用pbs-tween冲洗后,在各孔内涂覆50μl的与等体积bb混合的含测试fab的细胞上清液。将板于振荡器上室温下温育1小时;进一步,使用pbs-tween缓冲液将各孔板冲洗5次。冲洗后,将各孔涂覆(50μl/孔)在pbs-tween(1:5000)中的与抗人fab-hrp偶联的第二抗体(pierce-thermoscientific)。将板转移至旋转振荡器上(在室温下振荡50分钟),然后如上所述使用pbs-tween缓冲液冲洗5次。通过加入тмв(100μl/孔)直至饱和(平均3~5min)获得比色信号;通过加入终止溶液(100μl/孔,10%硫酸)来阻止进一步显色。使用适当的tecan-sunrise板读取器(tecan)在450nm处测定吸光度。抗体结合性与所产生的信号成比例。对于色度信号超出基线信号大于5倍的那些克隆,通过竞争性elisa对其进行了测试,以揭示阻断il-17a配体和受体之间相互作用的拮抗性fab。实施例6:阻断il-17a配体和il17r受体的相互作用的竞争性elisa竞争性elisa技术用于测试之前选择的特异性抗人il-17a的fab的拮抗能力。将具有已发表ain457序列(novartis)的fab用作阳性拮抗剂对照。将elisa板的孔(nuncimmunomaxisorp)涂覆50μl/孔的il-17ra-fc受体(r&dsystems;在1倍涂覆碳酸盐缓冲液中为1μg/ml溶液),并将其在4℃下温育过夜。所有后续步骤均使用例如genetixq-pix2xt(moleculardevices)和tecanfreedomevo200(tecan)的高性能系统根据标准elisa方案实施。通过加入阻断缓冲液bb(pbs中200μl0.5%脱脂牛奶)来阻断非特异性结合。将板于振荡器上室温下温育1小时。与此平行,在非结合96孔板中,将50μl的含测试fab的细胞上清液与50μl的il-17a-his6-flag(在用pbs-tween稀释的1%牛奶中为0.4μg/ml)混合。将该板在振荡器上以500rpm在37℃下温育1小时。在用bb溶液对含有il-17ra-fc受体的板进行冲洗后,以每孔90μl的量在其上涂覆fab和il-17a-his6-flag的反应混合物。将板在振荡下室温下温育45min,并使用pbs-tween缓冲液将各孔冲洗5次。此外,添加50μl/孔的1μg/ml抗flag鼠m2抗体(sigma),并将板在室温下温育45min。温育后,使用pbs-tween将各板孔冲洗5次,然后将其涂覆50μl/孔的以1:5000在pbs-tween内稀释的与抗鼠igghrp偶联的第二抗体(pierce-thermoscientific)。如上所述,将板在旋转振荡器上室温温育45min并用pbs-tween冲洗5次。通过加入тмв(100μl/孔)直至饱和(平均3~5min)获得比色信号;通过加入终止溶液(100μl/孔,10%硫酸)来阻止进一步显色;使用适当的tecan-sunrise板读取器(tecan)在450nm处测定吸光度。抗体结合性与所产生的信号成比例。将展现与对照fab抗体ain457相对应的阻断水平的那些克隆标记为阳性,并用于进一步试验。根据appliedbiosystems3130基因分析仪(appliedbiosystems)上的标准方案对阳性克隆的可变结构域基因进行测序,之后对其进行适当的分析。选择含有3vннfab可变结构域的克隆用于进一步研究(图5b)。此外,已发现3vннfab克隆以与结合有23个各种序列的轻链结构域代表,其中三个显示于图5b中。这说明其相对结构抗性以及具体是vнн结构域而非轻链有助于il-17a结合的事实。实施例7:抗il-17avннfab候选物的比较koff(kdiss)筛选使用pallfortebiooctetred96系统对抗il-17afab候选物实施比较koff筛选。将抗fabch1生物传感器在包含10mmpbs(ph7.2~7.4)、0.1%tween-20和0.1%bsa的工作缓冲液中再水化30min。将10倍工作缓冲液加入e.coli上清液的测试样品中,直至1倍最终浓度。然后,将抗fabch1生物传感器浸入含候选抗体的fab片段的e.coli上清液中,并在4℃的温度下温育12小时。将涂覆fab片段的传感器转移入盛有工作缓冲液的孔中,并设定基线(60秒)。然后,将传感器转移入盛有分析物溶液(il-17a,30μg/ml)的孔中,以实现抗原-抗体结合(300秒)。在此之后,使传感器返回入盛有工作缓冲液的孔中,用于进一步解离(300秒)。每次测试后,通过将用过的传感器三次置于再生缓冲液(gly-hcl,рh1.7)中使其经受再生,并随后适用于进一步实验。所得曲线使用octet数据分析(7.0版)根据标准步骤采用1:1相互作用模型进行分析。抗il-17afab候选物的koff筛选的所得结果呈现于图5c和表1中。其展现所有单一vннfab均与人il-17a进行特异性且高亲和力结合,其中3vннfab显示非常快的kon和超出设备检测限的非常低的kdis(1/c)。表1.vннfab对人il-17a的亲和力kd(m)kon(1/mc)kdis(1/c)1vhh2.485e-082.498e046.206e-042vhh1.352e-081.628e052.201e-033vhhvk4b11--<2.272e-06因此,根据所获得的分析结果,选择3vннvk4b11候选物用于进一步研究。实施例8:vнн可变结构域的fr1和fr2中具有突变的vннigg1抗体的生成如实施例3中所述,将3vннvk4b11候选物的轻链vнн和重链vнн的可变结构域的基因克隆至pee-hc和pee-lc质粒中,以在cho-ebna细胞中共同瞬时表达。进一步,根据方案[定点诱变试剂盒(neb)]和文献[34]中描述的步骤,使用pfuultrahs聚合酶(stratagene)借助寡核苷酸定向诱变在44位和45位(kabat编号方案)上引入置换。将质粒pee-3vнн用作基质。将pcr产物用低熔点琼脂糖片段化并使用适当的柱进行纯化。连接后,将dna转化至e.coli。选择具有正确序列的突变克隆后,将3vнн中具有突变的质粒与pee-lcvk4b11共转染(参见图6a和表2)。表2.3vннfabvk4b11突变克隆的样品名称相较于初始3vhhfabvk4b11的突变mut1e44g,r45lmut2s11l,e44g,r45lmut3r45lnut4s11,e44g实施例9:vнн可变结构域的fr1和fr2中含有突变的vннfab抗体的动力学参数的比较分析根据标准方案,使用pallfortebiooctetred96系统对于抗il-17avннfab候选物实施比较koff筛选(参见实施例8)。与天然3vннfab相比,mut1、mut2和mut4的koff显著降低,而mut3的koff降低较为不显著(图6b)。实施例10:vнн可变结构域的fr1和fr2中含有突变的全长3vннigg1vk4b11抗体的热聚集特性的比较分析使用以下步骤,对于抗il-17avннigg1候选物的聚集特性实施比较分析。将在pbs缓冲液中的vннigg1抗体的制备物(10mg/ml)于50℃下加热6小时。借助尺寸排阻hplc对由热应力引起的聚集进行评估。该试验通过使用具有tosohtskgelguardswxl预柱,6.0mm×4.0cm(粒径7μm,产品编号08543)的tosohtsk-gelg3000swxl柱,7.8mm×30cm,产品编号08541的1100hplc系统(agilent)来实施。使用含有50mm磷酸钠缓冲液和0.3mnacl(ph7.0)的流动相在0.5ml/min的流速下实施等度洗脱,其中检测波长为214nm和280nm。抗体样品用pbs(ph7.5)稀释至~1mg/ml的浓度。注射体积为10μl。测试前,使用凝胶过滤标准混合物(bio-rad,产品编号151-1901)对色谱柱进行校准。图6c中呈现的色谱图和汇总表3展现在热应力下,所有突变体都发生各种程度的聚集,其中观察到天然变体的稳定性最小,而含有经典vн结构常见的e44g+r45l置换的mut1显示出最大的稳定性。此外,使用thermofluor步骤(也称热转移测定)对所获得的制备物的热稳定性实施比较研究,该步骤用于测定蛋白质熔点,用于测量其在与未折叠蛋白的疏水性表面结合的特异性染料宝石橙(syproorange)的荧光下的改变[35]。使用stepone实时pcr系统(appliedbiosystems)设备和推荐方案研究突变产物。研究结果显示于表3。它们与热应力试验中所获得的结果关联性相当高,其证实了mut1和mut4与野生3vннigg1vk4b11相比较的稳定性。表3.突变体的热稳定性研究实施例11:抗il17a3vннigg1vk4b11突变体阻断il-17a诱导il-6产生的能力的细胞试验使用il-17诱导由人ht1080细胞(atcc:ccl-121)产生il-6的能力来分析vннigg1候选物mut1和mut4关于人重组il-17a的中和活性。在添加10%灭活胎牛血清、庆大霉素和谷氨酰胺的dmem培养基中使细胞生长。将5×104个细胞/孔的等分样品接种于96孔培养板中。允许细胞附着5小时。将40ng/ml重组il-17和20ng/mltnf-α的混合物与vннigg1稀释液在37℃下一起温育1小时。然后,向细胞添加细胞因子/抗体混合物并放置过夜。由ht1080细胞培养物产生的il-6的量与il-17的添加量成比例。通过elisa技术,使用duosetelisa开发系统的人il6(rdsystem,产品编号dy206)评估细胞上清液样品中释放的il-6的量。由vннigg1候选物与ain457(来自novartis的抗il-17a抗体)相比较的拮抗特性评估所获得的结果呈现于图7中。mut1的ic50值几乎比天然变体的高30倍,而mut4变体几乎完全维持其抑制能力。mut4候选物的ic50值为30±10pm。基于本研究中所获得的结果和总体物理化学及生物学特性,选择所述候选物以用于进一步开发和优化。实施例12:包含人轻链的mut4vннfab抗体的基因工程根据适当的方案(qiagen),使用rneasymini试剂盒分离从55名人类供体收集的b淋巴细胞的总rna。使用nanovue试剂盒(gehealthcare)测定rna浓度,并通过1.5%琼脂糖凝胶电泳对已分离的rna的质量进行测试。使用mmlvrt试剂盒(evrogen),根据建议方案用mmulv逆转录酶和随机六聚体引物进行逆转录反应。将逆转录产物用作两阶段聚合酶链式反应的基质,以获得侧翼具有限制性位点的可变结构域基因;反应使用寡核苷酸试剂盒和描述于[27]中的方案来实施。如上所指出的,根据描述于wo93/06213中的步骤基于噬菌粒ph5生成抗il-17a特异性的嵌合fab。借助如图8中所显示的依序的限制、连接和扩增反应,将编码人轻链可变结构域的基因和编码mut4vнн可变结构域的基因一起放入一个片段中。在该情况下,所有反应中的基质分子的估计计数均不小于1012。所获得的dna产物(vl-ck-vн)用nhei/eco91i限制性内切酶处理并连接到原始噬菌粒ph5中。将连接产物转化至根据[30]中所描述的方案制备的ss320电感受态细胞内。基于混合κ和λ人链的所有嵌合mut4vннfab文库的转化体数为2.8×109。嵌合噬菌体展示fab文库根据以上[27]所描述的步骤来制备。噬菌体展示嵌合fab文库的选择在上述条件(参见实施例5)下实施,除了将已结合il17a的噬菌体抗体在20μg/ml溶解il-17a的存在下于37℃的温度下进一步温育12小时。在对il-17a的第二轮选择后,观察到文库的显著富集。将所得富集的嵌合mut4vннfab文库的克隆汇集物根据标准方案(参见实施例6)用于筛选il-17a。使最终阳性克隆进行测序。图8b显示来自高亲和力mut4vннfab的4个人轻链可变结构域序列vk1a7、vk3cl8、vk3cl18和vk4cle12。这些序列属于包含最小数量的体细胞突变的不同κ人种系vk1、vk3和vk4。应当注意,虽然人序列vk4cle12显示出与之前选择的美洲驼轻链vk4b1的高度同源性,但两者之间仍然具有特征性差异。实施例13:含有各种轻链变体的全长mut4vннigg1抗体的热聚集特性的比较分析如实施例3中所述,将mut4vнн候选物的重链vнн可变结构域基因克隆至pee-hc质粒中,并将人轻链可变结构域基因vk1a7、vk3cl8、vk3cl18、vk3a4和vk4e12克隆至pee-lc质粒中,以用于在cho-ebna细胞中共同瞬时表达。此外,还将获得的抗体暴露于热应力下,并如实施例9中所示来研究其聚集分布。将所获得的结果呈现于汇总表中(表4)。表4.mut4vннigg1全长抗体的热稳定性此外,使用与实施例11中所描述的类似的thermofluor步骤进行所获得产物的热稳定性比较研究。基于所获得的数据,可作出所选择的含人轻链的mut4vнн对比含vvk4b11美洲驼轻链的天然变体更加稳定的结论。因此,该比较研究表明mut4vннigg1vk1a7和mut4vннigg1vk3cl8组合具有最佳的聚集稳定性参数。实施例14:使用mut4vннigg1vk3c8和mut4vннigg1vk1a7阻断il-17a诱导il-6产生的能力的细胞试验使用il-17诱导由人ht1080细胞(atcc:ccl-121)产生il-6的能力来分析vннigg1候选物mut4vннigg1vk3c8和mut4vннigg1vk1a7关于人重组il-17a的中和能力(参见实施例12)。图9显示该阻断试验所获得的结果。应当注意,mut4vннigg1vk1a7变体(其特征为最大稳定性)展现显著的ic50值降低,而mut4vннigg1vk3c8变体(中等稳定性)展现比对更稳定的mut4vннigg1vk1a7变体所观察的高出数倍的抑制能力。实施例15:在vнн可变结构域的fr2中44位和45位上含各种突变的mut4vннigg1全长抗体的基因工程及其聚集和功能特性的比较分析为了进一步改善聚集稳定性,使用寡核苷酸定向诱变方法在mut4vннigg1vk3c8候选物(下称m4vннc8)的vнн的fr2区中44位和45位上引入置换。该研究不包含在44位上为芳香族氨基酸、脂肪族氨基酸或正电荷氨基酸(positiveaminoacid)的变体,因为它们是潜在免疫原性的并且结构上不允许。所述变体如实施例3中所述进行瞬时表达(图8)。虽然不同实验之间不同突变体的产物的量不同,但是应该注意,同一实验内所有置换的产率大小相当。使所获得的突变变体暴露于热应力。表5展现针对不同突变体获得的结果。可以看出,较为不稳定的突变体是44g45g和44g45d,其稳定性小于m4vннc8内的初始44g45r组合。诸如44g45n、44v45t、44d45t、44t45t和44d45v的突变体显著保持其稳定性。所有其它组合均展现导致提高m4vннc8的聚集稳定性的叠加效应,并且最为稳定的是45位上含芳香族或脂肪族基团的突变体。然而,诸如44g45v、44g45t、44v45v、44a45v、44t45v、44a45t和44s45t的在上述两个位置上均含有小的亲水性氨基酸和疏水性氨基酸的突变体也展现显著的稳定性。表5.在m4vннc8的fr2区的44位和45位上包含置换的突变体的瞬时表达和热应力研究所获得的结果*不同批次间误差高达5%;**取决于实验而显著变化;同一批次内的产物提供更准确的比较;***不同批次间误差高达50%。为评估如实施例12中所述的细胞试验中的中和活性,用各种突变体进行实验(图11)。试验结果如表5中显示。其显示,vннfr2的44位和45位上小氨基酸展现高拮抗活性,而45位上引入的大氨基酸(脂肪族和芳香族)导致ic50降低10倍。图12呈现含有决定重链和轻链的可变结构域相互作用的各种氨基酸置换的突变体的稳定性和功能特性的图。实施例16:cdr抗il17a3vнн结构域的扫描诱变使用定点诱变试剂盒(neb)借助nnk随机化技术[26]根据方案在候选物的cdr的单个位置插入突变。将质粒pll-fab用作基质。pcr产物用低熔点琼脂糖片段化,并使用适当的柱纯化。连接后,将dna转化至e.coli表达菌株bl21gold(stratagene)。然后,如上所述,通过96孔板在所获得的各克隆上增添fab表达物。通过在上述条件下的elisa并使用高性能genetixq-pix2xt和tecanfreedomevo200系统,分析含有突变fab臂的上清液。被固定的il-17a的浓度为0.2μg/ml。使用1:5000稀释的山羊抗人igg(fab')2(hrp)缀合物(pierce)和tmb+h2o2/h2so4染料对结合的fab臂染色;在450nm波长处测定吸收。通过扫描诱变获得的结果呈现于表6中。该表显示与野生型序列相比,cdr内置换对应于突变fab/人il-17结合信号的≤30%下降。因此,此类各突变体或其任何组合均属于本发明领域。表6.扫描诱变因此,针对允许氨基酸置换的bcd109抗体cdr氨基酸位置进行筛选。其展现目前的氨基酸置换组不显著改变抗体对人il-17的亲和力。所述置换组可用于改善候选物的各种特性。实施例17:bcd109候选物的基因工程及其与各种来源的il-17a的亲和力评估通过将不改变稳定性或ic50(未提供数据)的人源化突变q5v和r89v引入vнн,以及在cн2结构域fcigg1中引入三个添加的突变(additivemutation)232y/234t/236e,从含有44g45t突变的m4vhhc8(在实施例16中描述)获得bcd109抗体,意欲改善抗体药代动力学。该抗体已经瞬时表达。采用octetred96系统(fortebio)研究bcd109与人、猴和大鼠il-17a的结合亲和力。根据制造商手册中所述的标准方案,将bcd109非特异性地固定于胺反应性二代传感器(ar2g)表面上。所述试验在30℃的温度下并使用含0.1%tween-20和0.1%bsa的pbs作为工作缓冲液来进行。使用所述工作缓冲液以2为渐增量,将人、猴和大鼠il-17a从126nm的浓度滴定至2nm的浓度。使用octet数据分析软件(7.0版)根据标准步骤并使用1:1相互作用模型分析结合曲线(扣除参考信号后)。结果呈现于图13a中。可以看出,bcd109以pm亲和力与人和猴il-17a结合(图13b)。此外,所述候选物不与大鼠il-17a相互作用(未呈现曲线)。实施例18:在热应力下的bcd109的聚集稳定性测定根据实施例9中所述方案将在pbs中的10mg/ml的bcd109制备物于50℃的温度下加热6小时。图14中所示结果显示bcd109抗体在热应力下保持稳定:聚集物含量小于5%。实施例19:含有本发明抗体的药物组合物的获取将bcd109抗体以50mg/ml的浓度溶解于适量的注射用水中,并使用柠檬酸将其ph调至5.5。溶液经过滤(过滤除菌)并密封在安瓿中。所获得的产品在6个月内保持稳定,未出现沉淀。或者,将bcd109溶解于含有甘露糖醇作为冻干保护剂的水中、将其过滤(过滤灭菌)并随后使其经受冷冻干燥。将所获得的粉末分配至无菌小瓶。用橡胶塞塞住小瓶并用铝盖密封。所述抗体产物可使用注射用水从冻干物中恢复。参考文献:1、porterr.r.1973.structuralstudiesofimmunoglobulins(免疫球蛋白的结构研究).science.180,713–716.2、padlane.a.1994.anatomyoftheantibodymolecule(抗体分子解析).mol.immunol.31,169–217.3、dwekr.a.,suttonb.j.,perkinss.j.,rademachert.w.1984.structure–functionrelationshipsinimmunoglobulins(免疫球蛋白的结构-功能关系).biochem.soc.symp.49,123–136.4、burtond.r.1985.immunoglobuling:functionalsites(免疫球蛋白g:功能位点).mol.immunol.22,161–206.5、hamerscastermanc.,atarhoucht.,muyldermanss.,robinsong.,hamersc.,bajyanasongae.,bendahmann.,hamersr.1993.naturallyoccurringantibodiesdevoidoflightchains(天然存在的无轻链抗体).nature.363,446–448.6、s.v.tillibmolecularbiology,2011,45,no.1,77–85.camelnanlantibodies–efficientinstrumentforinvestigations,diagnosticsandtherapy(骆驼纳米抗体—研究、诊断和治疗的有效工具).7、nguyenv.k.,hamersr.,wynsl.,muyldermanss.1999.lossofspliceconsensussignalisresponsiblefortheremovaloftheentirech1domainofthefunctionalcameligg2aheavy–chainantibodies(剪接共有信号的缺失为造成功能性骆驼igg2a重链抗体的cн1结构域整体移除的原因).mol.immunol.36,515–524.8、woolvenb.p.,frenkenl.,vanderlogtp.,nichollsp.j.1999.thestructureofthellamaheavychainconstantgenesrevealsamechanismforheavy–chainantibodyformation(美洲驼重链恒定基因的结构揭示重链抗体的形成机制).immunogenetics.50,98–101.9、nguyenv.k.,hamersr.,wynsl.,muyldermanss.2000.camelheavy–chainantibodies:diversegermlinevhhandspecificmechanismsenlargetheantigen–bindingrepertoire(骆驼重链抗体:不同种系vнн和特定机制扩大抗原结合库).emboj.19,921–931.10、degenste.,saerensd.,muyldermanss.,conrathk.2006.antibodyrepertoiredevelopmentincamelids(骆驼科动物中抗体库的开发).develop.comp.immunol.30,187–198.11、muyldermanss.,cambillauc.,wynsl.2001.recognitionofantigensbysingle–domainantibodyfragments:thesuperfluousluxuryofpaireddomains(通过单域抗体片段的抗原识别:配对结构域的无谓奢侈).tibs.26,230–235.12、degenste.,silencek.,decannierek.,lorisr.,kinnej.,muyldermanss.2006.molecularbasisforthepreferentialcleftrecognitionbydromedaryheavychainantibodies(通过单峰骆驼重链抗体识别优先裂隙的分子学基础).proc.natl.acad.sci.usa.103,4586–4591.13、kabate.,wut.t.,perryh.m.,gottesmank.s.,foellerc.1991.sequenceofproteinsofimmunologicalinterest(免疫学方面蛋白质的序列).uspublichealthservices.nih,bethesda,md,出版号91–3242.14、nguyenv.k.,desmytera.,muyldermanss.2001.functionalheavy–chainantibodiesincamelidae(骆驼科中的功能性重链抗体).adv.immunol.79,261–296.15、muyldermanss.,baralt.n.,retamozzov.c.,等人2009.camelidimmunoglobulinsandnanobodytechnology(骆驼科动物免疫球蛋白和纳米抗体技术).vet.immunol.immunopathol.128(1–3),178–183.16、degenste.,silencek.,decannierek.,lorisr.,kinnej.,wynsl.,muyldermanss.2005.stronginvivomaturationcompensatesforstructurallyrestrictedh3loopsinantibodyrepertoires(激烈体内成熟补偿抗体库内的结构受限h3环).j.biol.chem.280,14114–14121.17、lauwereysm.,ghahroudim.,desmytera.,kinnej.,holzerw.,degenste.,wynsl.,muyldermanss.1998.potentenzymeinhibitorsderivedfromdromedaryheavychainantibodies(衍生自单峰骆驼重链抗体的有效酶抑制剂).emboj.17,3512–3520.18、kontermannre.2009strategiestoextendplasmahalf-livesofrecombinantantibodies(延长重组抗体的血浆半衰期的策略).biodrugs.;23(2):93-109.19、kencoppieters,torstendreier,karensilence,hansdehaard,marclauwereys,petercasteels,elsbeirnaert,heidijonckheere,2006formattedanti-tumornecrosisfactoralphavhhproteinsderivedfromcamelidsshowsuperiorpotencyandtargetingtoinflamedjointsinamurinemodelofcollagen-inducedarthritis(衍生自骆驼科动物的改造型抗肿瘤坏死因子αvнн蛋白显示对胶原诱导性关节炎鼠类模型的发炎关节的高效力和靶向性).arthritis&rheumatology.;54(6):1856-66.20、gabriellerichard,ashleyjmeyers,michaeldmclean,mehdiarbabi-ghahroudi,rogermackenzie,jchristopherhall2013.invivoneutralizationofα-cobratoxinwithhigh-affinityllamasingle-domainantibodies(vhhs)andavhh-fcantibody(用高亲和力美洲驼单域抗体(vнh)和vнн-fc抗体对α-神经毒素的体内中和).plosone22;8(7):e69495.21、janterjeandersen,mariagonzalez-pajuelo,stianfoss,olej.b.landsverk,déborapinto,alexanderszyroki,hansj.dehaard,michaelsaunders,petervanlandschootingersandlie2012,selectionofnanobodiesthattargethumanneonatalfcreceptor(靶向人新生儿fc受体的纳米抗体的选择).scientificreports,3,1118.22、vinckec1,lorisr,saerensd,martinez-rodriguezs,muyldermanss,conrathk.2009generalstrategytohumanizeacamelidsingle-domainantibodyandidentificationofauniversalhumanizednanobodyscaffold(骆驼科动物单域抗体人源化的一般策略和通用人源化纳米抗体骨架的鉴定).jbiolchem.jan30;284(5):3273-84.23、barthelemypa,raabh,appletonba,bondcj,wup,wiesmannc,sidhuss.2008comprehensiveanalysisofthefactorscontributingtothestabilityandsolubilityofautonomoushumanvhdomains(自主人vн结构域的稳定性和溶解性影响因素的综合分析).jbiolchem.feb8;283(6):3639-54.24、conrathk,vinckec,stijlemansb,schymkowitzj,decannierek,wynsl,muyldermanss,lorisr.antigenbindingandsolubilityeffectsupontheveneeringofacamelvhhinframework-2tomimicavh(在骆驼vнн的骨架区2进行表面残基遮蔽以模拟vн时对抗原结合性和溶解性的影响).jmolbiol.2005jul1;350(1):112-25.25、hermelings,crommelindj,schellekensh,jiskootw(2004)structure–immunogenicityrelationshipsoftherapeuticproteins(治疗性蛋白质的结构-免疫原性关系).pharmres21:897–903.26、handbookofpharmaceuticalmanufacturingformulations.volume6.sterileproducts(药物生产配方手册.第六卷.无菌产品)/sarfarazk.niazi,2004.27、j.dehaardh.,vanneern.,annekereurs,e.huftons.,rooversr.,henderikxp.,debrulnea.,arendsj.-w.andhoogenboomh.alargenon-immunizedhumanfabfragmentphagelibrarythatpermitsrapidisolationandkineticanalysisofhighaffinityantibodies(允许高亲和力抗体的快速分离和动力学分析的大型非免疫人fab片段噬菌体文库).jbiolchem.1999年6月25号274(26):18218-30.28、wo2010/001251.29、koch-noltef.,reyeltj.,b.,schwarzn.,scheupleinf.,rothenburgs.,haagf.,alzogarayv.,cauerhffa.andgoldbaumf.singledomainantibodiesfromllamaeffectivelyandspecificallyblocktcellecto-adp-ribosyltransferaseart2.2invivo(来自美洲驼的单域抗体有效且特异性地在体内阻断t细胞胞外-adp-核糖基转移酶art2.2).fasebj.,2007年11月;21(13):3490-8.30、sidhus.,lowmanh.,cunninghamb.,wellsj.phagedisplayforselectionofnovelbindingpeptides(用于选择新型结合肽的噬菌体展示).j.methodsenzymol.2000;328:333-63.31、marksj.,hoogenboomh.,bonnertt.,mccaffertyj.,griffithsa.,winterg.by-passingimmunization:humanantibodiesfromv-genelibrariesdisplayedonphage(旁路免疫:来自在噬菌体上展示的v基因文库的人抗体).jmolbiol.1991年12月5号;222(3):581-97.32、vaughant.,williamsa.,pritchardk.,osbournj.,popea.,earnshawj.,mccaffertyj.,hoditsr.,wiltonj.andjohnsonk.humanantibodieswithsub-nanomolaraffinitiesisolatedfromalargenon-immunizedphagedisplaylibrary(分离自大的未免疫噬菌体展示文库的具有亚纳摩尔级亲和力的人抗体).natbiotechnol.1996年3月;14(3):309-14.33、environmicrobiol.2006年2月;72(2):1141-7;mabs.2012年5-6月;4(3):341-8.34、cummingsm.,farnumm.和nelenm.universalscreeningmethodsandapplicationsof(通用筛选方法和的应用).jbiomolscreen200611(7):854-863。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1