人源化百日咳抗体及其用途的制作方法
本申请要求2014年3月31日提交的美国临时申请号61/973,141和2014年9月5日提交的美国临时申请号62/046,403的权益,所述美国临时申请各自的内容以引用的方式整体且出于所有目的并入本文。
对以ASCII文件提交的表格或计算机程序列表附件形式的“序列表”的引用
书写于文件T9333-522001WO_ST25.TXT中的序列表据此以引用的方式并入,该文件创建于2015年3月31日、26,452字节、机器格式IBM-PC、MS Windows操作系统。
发明领域
本发明部分涉及结合百日咳毒素蛋白的人源化抗体以及其作为治疗剂的用途。具体地说,本发明部分涉及源自鼠抗体1B7和11E6的结合百日咳毒素蛋白的人源化抗体。
背景
百日咳博德特氏杆菌(Bordetella pertussis,B.pertussis)是感染上呼吸道、引起不可控制的剧烈咳嗽的革兰氏阴性细菌。根据世界卫生组织,百日咳博德特氏杆菌感染每年造成全世界估计300,000例死亡,主要在年幼的未接种的婴儿中。患有百日咳的婴儿往往需要在儿科重症监护病房住院,并且他们的治疗通常涉及机械通气。成人中的百日咳通常导致被称为“百日咳(cough of 100 days)”的慢性咳嗽。百日咳的发病率由于未接种疫苗和疫苗接种不足的个体(包括尚未完全接种的婴儿)、免疫力已随时间推移减弱的个体以及无症状携带者的暴露而增加。
整个美国最近的新闻报道表明,在20世纪90年代引入的百日咳疫苗不提供长期保护。不存在用于百日咳的批准的治疗。抗生素治疗对百日咳的病程不具有主要作用,因为虽然治疗可从呼吸道消除百日咳博德特氏杆菌细菌,但它不中和百日咳毒素蛋白。因此,仍然需要针对百日咳的更有效的疗法。
此外,在发展中世界,获得现有百日咳疫苗(然而有缺陷的)是不一致的和非常困难的。
天然存在的抗体是包含四条多肽链的多聚体蛋白。所述多肽链中的两个被称为重链(H链),并且所述多肽链中的两个被称为轻链(L链)。免疫球蛋白重链和轻链通过链间二硫键连接。免疫球蛋白重链通过链间二硫键连接。轻链由一个可变区(VL)和一个恒定区(CL)组成。重链由一个可变区(VH)和至少三个恒定区(CH1、CH2和CH3)组成。可变区决定抗体的特异性。每个可变区包含由四个相对保守的框架区(FR)侧接的三个高变区(还称为互补决定区(CDR))。被称为CDR1、CDR2和CDR3的三个CDR促进抗体结合特异性。天然存在的抗体已被用作工程化抗体如人源化抗体的起始材料。
已经开发了结合百日咳毒素蛋白的抗体,但是这些抗体在患者中的有效性是最小的或不明确的。仍然需要针对百日咳毒素蛋白的具有增加的功效和减少的副作用的改进的抗体以用作治疗剂。
概述
因此,在不同方面,本发明涉及一种或多种结合和/或中和百日咳毒素蛋白的人源化抗体以及所述抗体在治疗或预防百日咳中的用途。
一方面,本发明涉及一种结合百日咳毒素蛋白的人源化1B7抗体。所述人源化1B7抗体包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区。在不同实施方案中,所述人源化1B7抗体包含免疫球蛋白重链可变区,其包含选自SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6的氨基酸序列;以及免疫球蛋白轻链可变区,其包含选自SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11和SEQ ID NO:12的氨基酸序列。
另一方面,本发明涉及一种结合百日咳毒素蛋白的人源化11E6抗体。所述人源化11E6抗体包含免疫球蛋白重链可变区,其包含选自SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18的氨基酸序列;以及免疫球蛋白轻链可变区,其包含选自SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23和SEQ ID NO:24的氨基酸序列。
在不同实施方案中,所述人源化1B7和11E6抗体显示改进的特性。在一个实施方案中,所述人源化1B7抗体结合百日咳毒素蛋白的KD为小于约3nM、或约2nM、或约1nM、或约0.5nM。在另一个实施方案中,所述人源化11E6抗体结合百日咳毒素蛋白的KD为小于约12nM、或约10nM、或约8nM、或约6nM、或4nM、或2nM、或约1nM、或约0.5nM。
在不同实施方案中,本发明还提供用于制备所述人源化1B7和11E6抗体的核酸、表达载体、宿主细胞以及方法。本发明还提供包含所述人源化1B7和/或11E6抗体的药物组合物。
一方面,本发明的方法涉及治疗具有百日咳博德特氏杆菌的患者,所述方法包括向所述患者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物。在一个实施方案中,人源化1B7抗体和人源化11E6抗体被共同施用至患者,从而产生协同作用。在另一个实施方案中,所述方法包括向所述患者施用人源化1B7抗体和/或人源化11E6抗体连同抗微生物剂。在另一实施方案中,本发明的方法涉及通过向受试者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物来在所述受试者中预防百日咳博德特氏杆菌感染。
在一些实施方案中,本发明的方法涉及通过针对患者、包括尚待疫苗接种的婴儿预防性地施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物来预防百日咳的发作。
在一个实施方案中,本发明的方法包括降低患者中的白血细胞计数。在另一个实施方案中,本发明的方法包括降低患者中咳嗽的持续时间和/或频率。在另一实施方案中,本发明的方法包括降低患者的鼻咽和肺中百日咳博德特氏杆菌的水平。在另一个实施方案中,本发明的方法中和百日咳毒素蛋白。
另一方面,本发明的方法涉及治疗具有副百日咳博德特氏杆菌的患者,所述方法包括向所述患者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物。另一方面,本发明的方法涉及通过向受试者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物来在所述受试者中预防副百日咳博德特氏杆菌感染。
本发明的其他方面和实施方案将由以下详述和实施例而显而易见。
附图描述
图1示出在还原和非还原条件下人源化hu1B7抗体的SDS PAGE凝胶。
图2示出人源化hu1B7抗体的尺寸排阻色谱。
图3示出在还原和非还原条件下人源化hu11E6抗体的SDS PAGE凝胶。
图4示出人源化hu11E6抗体的尺寸排阻色谱。
图5示出(从左至右)人源化hu1B7A抗体(第三条线)、hu11E6A(第一条线)和两种抗体的混合物(第二条线)的尺寸排阻色谱。结果以mL对mAu进行测量,并且将所有线与预期分子量(MW,垂直黑线)进行比较。
图6A至图6D示出人源化hu11E6抗体、人源化hu1B7抗体、鼠m11E6抗体和鼠m1B7抗体的绘制为温度(℃)对荧光的热解折叠。图6A示出hu11E6抗体(hu11E6-15x)的热解折叠。顶部线对应于10uM hu11E6-15x,从顶部的第二条线对应于20uM hu11E6-15x,从底部的第二条线对应于5uM hu11E6-15x,并且底部线对应于PBS。图6B示出hu1B7抗体的热解折叠。顶部线对应于20uM hu1B7,从顶部的第二条线对应于10uM hu1B7,从底部的第二条线对应于5uM hu1B7,并且底部线对应于PBS。图6C示出m11E6抗体的热解折叠。顶部线对应于3uM m11E6,从顶部的第二条线对应于1.5uM m11E6,从底部的第二条线对应于0.75uM m11E6,并且底部线对应于PBS。图6D示出m1B7抗体的热解折叠。顶部线对应于3uM m1B7,从顶部的第二条线对应于1.5uM m1B7,从底部的第二条线对应于0.75uM m1B7,并且底部线对应于PBS。
图7示出百日咳毒素(PTx)ELISA测定的结果,所述测定比较人源化hu1B7和hu11E6抗体对比小鼠m1B7和m11E6抗体的PTx结合亲和力。结果被示出为抗体浓度(nM)对标准化吸光度。
图8示出竞争性ELISA测定的结果,所述测定测定在两个不同实验室产生的人源化hu1B7和hu11E6抗体的PTx结合亲和力。结果被示出为PTx浓度对吸光度。
图9示出CHO细胞体外保护测定的结果,所述测定测量人源化hu1B7和hu11E6抗体中和百日咳毒素蛋白的能力。结果以摩尔比(mol mAb/mol PTx)示出。
图10示出PTx毒素ELISA测定的结果,连同人源化hu1B7和hu11E6抗体的混合物的EC50(μg/mL)值。将所述抗体混合且在4℃下储存1分钟、1小时和22小时。结果被示出为抗体浓度(μg/mL)对标准化吸光度。
图11展示人源化hu11E6抗体、人源化hu1B7抗体以及人源化hu1B7抗体与人源化hu11E6抗体的混合物的消除(β)半衰期(t1/2β)。所有半衰期均在小鼠中测定。
图12示出PTx毒素ELISA测定的结果,所述测定测定热处理对人源化hu1B7A抗体的活性的作用。具体地说,将50μg/mL的抗体在50℃或在70℃下在PBS中在冰上孵育30分钟,并且在冰上淬灭1分钟。结果被测量为抗体浓度(μg/mL)对吸光度。
图13示出PTx毒素ELISA测定的结果,所述测定测定热处理对人源化hu11E6A抗体的活性的作用。具体地说,将50μg/mL的抗体在50℃或在70℃下在PBS中在冰上孵育30分钟,并且在冰上淬灭1分钟。结果被测量为抗体浓度(μg/mL)对吸光度。
图14示出PTx毒素ELISA测定的结果,连同人源化hu1B7A抗体、人源化hu11E6A抗体以及所述两种抗体的混合物的EC50(μg/mL)值。结果被示出为抗体浓度(μg/mL)对标准化吸光度。
图15示出人源化11E6和1B7抗体在治疗感染百日咳博德特氏杆菌D420菌株的小鼠中的功效(如通过重量增加%所测量)。将小鼠用PBS、P-IVIG、鼠m1B7抗体、ch1B7抗体、人源化hu1B7抗体、鼠m11E6抗体、ch11E6抗体、人源化hu11E6抗体或人源化hu1B7与hu11E6抗体的混合物处理,并且在感染后10天时测量它们的体重。未感染的首次接受试验的小鼠充当基线对照。
图16A和图16B示出人源化11E6和1B7抗体在治疗感染百日咳博德特氏杆菌D420菌株的小鼠中的功效(如通过白细胞计数/50μL血液所测量)。将小鼠用PBS、P-IVIG、鼠m1B7抗体、ch1B7抗体、人源化hu1B7抗体、鼠m11E6抗体、ch11E6抗体、人源化hu11E6抗体或人源化hu1B7与hu11E6抗体的混合物处理,并且在感染后3天和10天时评估它们的血液白细胞计数。未感染的首次接受试验的小鼠充当基线对照。
图17示出人源化11E6和1B7抗体在降低百日咳博德特氏杆菌细菌的小鼠肺定殖中的功效。
图18A和图18B示出人源化11E6和1B7抗体的混合物对百日咳博德特氏杆菌感染的狒狒的治疗作用。具体地,评定了白血细胞计数和咳嗽计数。
图19示出来自用人源化11E6和1B7抗体治疗的百日咳博德特氏杆菌感染的狒狒的肺的病理切片。
图20A和图20B示出人源化11E6和1B7抗体的混合物对百日咳博德特氏杆菌感染的狒狒的治疗作用。具体地,评定了白血细胞计数和鼻洗液细菌计数。
图21A和图21B分别示出人源化11E6和1B7抗体在两只百日咳博德特氏杆菌感染的狒狒(即,狒狒#12913和15913)中的抗体血清浓度和抗体半衰期。在图21A的Y轴上示出的定时是如在图20A和20B中所示(即在时间=0时感染,在3天时治疗)。
详述
本发明部分地基于表现出改进的生物活性的人源化1B7和11E6抗体的发现。由于这些抗体针对百日咳毒素蛋白的结合和/或中和活性,所以它们适用于治疗感染百日咳博德特氏杆菌细菌的患者。将所公开的抗体工程化以靶向具有高特异性的百日咳毒素蛋白,而在患者中引起最小副作用。此外,所公开的抗体表现出增强的稳定性和长体内半衰期。在下文更详细地论述本发明的各种特征和方面。
如本文所用,除非另外指示,否则术语“抗体”意指完整抗体(例如,完整单克隆抗体)或抗体的抗原结合片段(例如,单克隆抗体的抗原结合片段),包括已进行修饰、工程化或化学缀合或为人抗体的完整抗体或抗原结合片段。已进行修饰或工程化的抗体的实例是嵌合抗体、人源化抗体和多特异性抗体(例如,双特异性抗体)。抗原结合片段的实例包括Fab、Fab’、F(ab’)2、Fv、单链抗体(例如scFv)、微抗体以及双抗体。缀合至毒素部分的抗体是化学缀合抗体的实例。
结合百日咳毒素蛋白的抗体
一方面,本发明涉及结合百日咳毒素蛋白的人源化1B7抗体和人源化11E6抗体。在各种实施方案中,人源化抗体是已进行改变以增加其与人抗体的相似性的非人抗体。在一些实施方案中,人源化抗体是遗传工程化的抗体,其中来自非人(例如小鼠)抗体(“供体抗体”,其也可是大鼠、仓鼠或其他非人物种)的至少一个CDR(或其功能片段)被接枝至人抗体(“受体抗体”)。在一些实施方案中,接枝多于一个小鼠CDR(例如,接枝所有六个小鼠CDR)。受体抗体的序列可以是例如成熟人抗体序列(或其片段)、人抗体序列的共有序列(或其片段)或种系区序列(或其片段)。因此,在一些实施方案中,人源化抗体可以是具有来自供体抗体的一个或多个CDR以及可变区框架(FR)的抗体。FR可形成人抗体内的恒定区的一部分。
此外,为了保留高结合亲和力,人受体序列中的氨基酸可被来自供体序列的相应氨基酸置换,例如其中:(1)氨基酸是在CDR中;(2)氨基酸是在人框架区中(例如,所述氨基酸紧邻所述CDR中的一个)。参见以引用的方式并入本文的美国专利号5,530,101和5,585,089,提供这些专利用于构建人源化抗体的详细说明。确实,例如人框架区中的残基的这种选择通常是人源化抗体合意性的中心。虽然人源化抗体通常并入来自小鼠抗体的所有六个CDR(例如,如由Kabat所定义,但通常还包含如由Chothia定义的高变环H1),但是它们还可被制备为具有更少CDR和/或少于完整小鼠CDR序列(例如,CDR的功能片段)。
在各种实施方案中,人源化轻链可变区融合至轻链恒定区(例如人κ或λ轻链)。在各种实施方案中,人源化重链可变区融合至重链恒定区,包括各自的各种同种异型和同种型。例如,重链恒定区可源自任何免疫球蛋白类型(例如,IgG、IgM、IgA、IgD或IgE)。在一些实施方案中,使用IgG。对于IgG,恒定区可来自IgG1、IgG2、IgG3或IgG4。在一些实施方案中,使用IgG1。此外,存在每种IgG的可选择的许多同种型,一些是天然存在的并且一些是天然存在的同种型的衍生物。所选择的IgG的类型将决定抗体的效应子功能(例如,调理吞噬、补体结合等)。
一方面,本发明涉及人源化1B7抗体,该人源化1B7抗体结合百日咳毒素蛋白并且包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区。该免疫球蛋白重链可变区包含选自以下的氨基酸序列:
1B7:
QVQLQQPGSELVRPGASVKLSCKASGYKFTSYWMHWVKQRPGQGLEWIGNIFPGSGSTNYDEKFNSKATLTVDTSSNTAYMQLSSLTSEDSAVYYCTRWLSGAYFDYWGQGTTLTVSS(SEQ ID NO:1)
cdr1B7:
QVQLVQSGAEVKKPGASVKVSCKASGYKFTSYWMHWVRQAPGQGLEWIGNIFPGSGSTNYDEKFNSRVTLTVDTSTSTAYMELSSLRSEDTAVYYCTRWLSGAYFDYWGQGTTVTVSS(SEQ ID NO:2)
abb1B7:
QVQLVQSGAEVKKPGASVKVSCKASGYKFTSYWMHWVRQAPGQGLEWIGNIFPGSGSTNYAQKFQGRVTLTVDTSTSTAYMELSSLRSEDTAVYYCTRWLSGAYFDYWGQGTTVTVSS(SEQ ID NO:3)
sdr1B7:
QVQLVQSGAEVKKPGASVKVSCKASGYKFTSYWMHWVRQAPGQGLEWIGNIFPGSGSTNYAQKFQGRVTLTVDTSTSTAYMELSSLRSEDTAVYYCTRWLSGAYFDYWGQGTTVTVSS(SEQ ID NO:4)
fra1B7:
QVQLQQSGSELKKPGASVKISCKASGYKFTSYWMHWVKQRPGQGLEWIGNIFPGSGSTNYDEKFNSRVTLTVDTSTSTAYMELSSLRSEDTAVYYCTRWLSGAYFDYWGQGTTLTVSS(SEQ ID NO:5)
ven1B7:
QVQLVQSGAELVKPGASVKLSCKASGYKFTSYWMHWVKQRPGQGLEWIGNIFPGSGSTNYDEKFNSKATLTVDTSTSTAYMELSSLRSEDTAVYYCTRWLSGAYFDYWGQGTTLTVSS(SEQ ID NO:6)
该免疫球蛋白轻链可变区包含选自以下的氨基酸序列:
1B7:
QIVLTQSPALMSASPGEKVTMTCSASSSVSFMYWYQQKPRSSPKPWIY
LTSNLPSGVPARFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSHPPTFGSGTKLEIK(SEQ ID NO:7)
cdr1B7:
QIVLTQSPDFQSVTPKEKVTITCSASSSVSFMYWYQQKPDQSPKPLIYLTSNLPSGVPARFSGSGSGTSYTLTINSLEAEDAATYYCQQWSSHPPTFGSGTKVEIK(SEQ ID NO:8)
abb1B7:
QIVLTQSPDFQSVTPKEKVTITCRASSSVSFMYWYQQKPDQSPKPLIYLTSNLPSGVPARFSGSGSGTDYTLTINSLEAEDAATYYCQQWSSHPPTFGSGTKVEIK(SEQ ID NO:9)
sdr1B7:
QIVLTQSPDFQSVTPKEKVTITCRASSIVSFLYWYQQKPDQSPKPLIYLASNLPSGVPARFSGSGSGTDYTLTINSLEAEDAATYYCQQWSSHPPTFGSGTKVEIK(SEQ ID NO:10)
fra1B7:
QIVLTQSPATLSVSPGERVTLTCSASSSVSFMYWYQQKPGRAPKPLIYLTSNLPSGVPARFSGSGSGTSYTLTINSLEAEDAATYYCQQWSSHPPTFGSGTKLEIK(SEQ ID NO:11)
ven1B7:
QIVLTQSPDFMSATPGEKVTMTCSASSSVSFMYWYQQKPRQSPKPWIYLTSNLPSGVPARFSGSGSGTDYTLTINSMEAEDAATYYCQQWSSHPPTFGSGTKLEIK(SEQ ID NO:12)
所公开的1B7重链中的任一个可与所公开的1B7轻链中的任一个配对。作为说明,以下对可并入本发明组合物和方法的抗体中:SEQ ID NO:1/SEQ ID NO:7;SEQ ID NO:1/SEQ ID NO:8;SEQ ID NO:1/SEQ ID NO:9;SEQ ID NO:1/SEQ ID NO:10;SEQ ID NO:1/SEQ ID NO:11;SEQ ID NO:1/SEQ ID NO:12;SEQ ID NO:2/SEQ ID NO:7;SEQ ID NO:2/SEQ ID NO:8;SEQ ID NO:2/SEQ ID NO:9;SEQ ID NO:2/SEQ ID NO:10;SEQ ID NO:2/SEQ ID NO:11;SEQ ID NO:2/SEQ ID NO:12;SEQ ID NO:3/SEQ ID NO:7;SEQ ID NO:3/SEQ ID NO:8;SEQ ID NO:3/SEQ ID NO:9;SEQ ID NO:3/SEQ ID NO:10;SEQ ID NO:3/SEQ ID NO:11;SEQ ID NO:3/SEQ ID NO:12;SEQ ID NO:4/SEQ ID NO:7;SEQ ID NO:4/SEQ ID NO:8;SEQ ID NO:4/SEQ ID NO:9;SEQ ID NO:4/SEQ ID NO:10;SEQ ID NO:4/SEQ ID NO:11;SEQ ID NO:4/SEQ ID NO:12;SEQ ID NO:5/SEQ ID NO:7;SEQ ID NO:5/SEQ ID NO:8;SEQ ID NO:5/SEQ ID NO:9;SEQ ID NO:5/SEQ ID NO:10;SEQ ID NO:5/SEQ ID NO:11;SEQ ID NO:5/SEQ ID NO:12;SEQ ID NO:6/SEQ ID NO:7;SEQ ID NO:6/SEQ ID NO:8;SEQ ID NO:6/SEQ ID NO:9;SEQ ID NO:6/SEQ ID NO:10;SEQ ID NO:6/SEQ ID NO:11;以及SEQ ID NO:6/SEQ ID NO:12。
在一个实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:2的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:8的氨基酸序列。
在一个实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:3的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:9的氨基酸序列。
在一个实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:4的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:10的氨基酸序列。
在一个实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:5的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:11的氨基酸序列。
在一个实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:6的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:12的氨基酸序列。
在其他实施方案中,人源化1B7抗体包含免疫球蛋白重链可变区,该免疫球蛋白重链可变区包含与SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5或SEQ ID NO:6的整个可变区、互补决定区或框架区序列具有至少约50%同一性、约51%同一性、约52%同一性、约53%同一性、约54%同一性、约55%同一性、约56%同一性、约57%同一性、约58%同一性、约59%同一性、约60%同一性、约61%同一性、约62%同一性、约63%同一性、约64%同一性、约65%同一性、约66%同一性、约67%同一性、约68%同一性、约69%同一性、约70%同一性、约71%同一性、约72%同一性、约73%同一性、约74%同一性、约75%同一性、约76%同一性、约77%同一性、约78%同一性、约79%同一性、约80%同一性、约81%同一性、约82%同一性、约83%同一性、约84%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约89%同一性或约90%同一性的氨基酸序列。
在其他实施方案中,人源化1B7抗体包含免疫球蛋白轻链可变区,该免疫球蛋白轻链可变区包含与SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11或SEQ ID NO:12的整个可变区、互补决定区或框架区序列具有至少约50%同一性、约51%同一性、约52%同一性、约53%同一性、约54%同一性、约55%同一性、约56%同一性、约57%同一性、约58%同一性、约59%同一性、约60%同一性、约61%同一性、约62%同一性、约63%同一性、约64%同一性、约65%同一性、约66%同一性、约67%同一性、约68%同一性、约69%同一性、约70%同一性、约71%同一性、约72%同一性、约73%同一性、约74%同一性、约75%同一性、约76%同一性、约77%同一性、约78%同一性、约79%同一性、约80%同一性、约81%同一性、约82%同一性、约83%同一性、约84%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约89%同一性或约90%同一性的氨基酸序列。
一方面,本发明涉及人源化11E6抗体,所述抗体结合百日咳毒素蛋白并且包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区。该免疫球蛋白重链可变区包含选自以下的氨基酸序列:
11E6:
EVKVVESGGGLVQPGGSLRLSCTTSGFTFTDYYVSWVRQPPGKALEWLGFIRNKVNGYTTEFSSSVKGRFTISRDNSQSILYLQMNTLRVEDSATYYCARVSYYGRGWYFDYWGQGTTLTVSS(SEQ ID NO:13)
cdr11E6:
EVQVVESGGGLVQPGRSLRLSCTTSGFTFTDYYVSWVRQAPGKALEWLGFIRNKVNGYTTEFSSSVKGRFTISRDNSKSILYLQMNSLKIEDTAVYYCARVSYYGRGWYFDYWGQGTTVTVSS(SEQ ID NO:14)
abb11E6:
EVQVVESGGGLVQPGRSLRLSCTTSGFTFTDYYVSWVRQAPGKALEWVGFIRNKVNGYTTEFAASVRGRFTISRDNSKSILYLQMNSLKIEDTAVYYCARVSYYGRGWYFDYWGQGTTVTVSS(SEQ ID NO:15)
sdr11E6:
EVQVVESGGGLVQPGRSLRLSCTTSGFTFTDYYVSWVRQAPGKALEWVGFIRNKVNGYTTEFAASVRGRFTISRDNSKSILYLQMNSLKIEDTAVYYCARVSYYGRGWYFDYWGQGTTVTVSS(SEQ ID NO:16)
fra11E6:
EVQVVESGGGLVQPGGSLRLSCTTSGFTFTDYYVSWVRQPPGKALEWLGFIRNKVNGYTTEFSSSVKGRFTISRDNSKSTLYLQMNTLRVDDTAVYYCARVSYYGRGWYFDYWGQGTTLTVSS(SEQ ID NO:17)
ven11E6:
EVQVVESGGGLVQPGRSLRLSCTTSGFTFTDYYVSWVRQAPGKALEWLGFIRNKVNGYTTEFSSSVKGRFTISRDNSKSILYLQMNSLKIEDTAVYYCARVSYYGRGWYFDYWGQGTTLTVSS(SEQ ID NO:18)
该免疫球蛋白轻链可变区包含选自以下的氨基酸序列:
11E6:
DIVMTQSTSSLSASLGDRVTISCRASQDIDNYLSWFQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISSLDQEDIATYFCQQGNTFPWTFGGGTKLEIK(SEQ ID NO:19)
cdr11E6:
DIVMTQSPSSLSASVGDRVTISCRASQDIDNYLSWFQQKPGGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDIATYFCQQGNTFPWTFGGGTKVEIK(SEQ ID NO:20)
abb11E6:
DIVMTQSPSSLSASVGDRVTITCRASQDIDNYLSWFQQKPGGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDIATYFCQQGNTFPWTFGGGTKVEIK(SEQ ID NO:21)
sdr11E6:
DIVMTQSPSSLSASVGDRVTITCRASQDIDNYLSWFQQKPGGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDIATYFCQQGNTFPWTFGGGTKVEIK(SEQ ID NO:22)
fra11E6:
DIVMTQSPSSLSASVGDRVTISCRASQDIDNYLSWFQQKPGGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDIATYFCQQGNTFPWTFGGGTKLEIK(SEQ ID NO:23)
ven11E6:
DIVMTQSPSSLSASVGDRVTISCRASQDIDNYLSWFQQKPGGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDIATYFCQQGNTFPWTFGGGTKLEIK(SEQ ID NO:24)
所公开的11E6重链中的任一个可与所公开的11E6轻链中的任一个配对。作为说明,以下对可并入本发明组合物和方法的抗体中:SEQ ID NO:13/SEQ ID NO:19;SEQ ID NO:13/SEQ ID NO:20;SEQ ID NO:13/SEQ ID NO:21;SEQ ID NO:13/SEQ ID NO:22;SEQ ID NO:13/SEQ ID NO:23;SEQ ID NO:13/SEQ ID NO:24;SEQ ID NO:14/SEQ ID NO:19;SEQ ID NO:14/SEQ ID NO:20;SEQ ID NO:14/SEQ ID NO:21;SEQ ID NO:14/SEQ ID NO:22;SEQ ID NO:14/SEQ ID NO:23;SEQ ID NO:14/SEQ ID NO:24;SEQ ID NO:15/SEQ ID NO:19;SEQ ID NO:15/SEQ ID NO:20;SEQ ID NO:15/SEQ ID NO:21;SEQ ID NO:15/SEQ ID NO:22;SEQ ID NO:15/SEQ ID NO:23;SEQ ID NO:15/SEQ ID NO:24;SEQ ID NO:16/SEQ ID NO:19;SEQ ID NO:16/SEQ ID NO:20;SEQ ID NO:16/SEQ ID NO:21;SEQ ID NO:16/SEQ ID NO:22;SEQ ID NO:16/SEQ ID NO:23;SEQ ID NO:16/SEQ ID NO:24;SEQ ID NO:17/SEQ ID NO:19;SEQ ID NO:17/SEQ ID NO:20;SEQ ID NO:17/SEQ ID NO:21;SEQ ID NO:17/SEQ ID NO:22;SEQ ID NO:17/SEQ ID NO:23;SEQ ID NO:17/SEQ ID NO:24;SEQ ID NO:18/SEQ ID NO:19;SEQ ID NO:18/SEQ ID NO:20;SEQ ID NO:18/SEQ ID NO:21;SEQ ID NO:18/SEQ ID NO:22;SEQ ID NO:18/SEQ ID NO:23;以及SEQ ID NO:18/SEQ ID NO:24。
在一个实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:14的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:20的氨基酸序列。
在一个实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:15的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:21的氨基酸序列。
在一个实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:16的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:22的氨基酸序列。
在一个实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:17的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:23的氨基酸序列。
在一个实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,其包含SEQ ID NO:18的氨基酸序列;以及免疫球蛋白轻链可变区,其包含SEQ ID NO:24的氨基酸序列。
在其他实施方案中,人源化11E6抗体包含免疫球蛋白重链可变区,该免疫球蛋白重链可变区包含与SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18的整个可变区、互补决定区或框架区序列具有至少约50%同一性、约51%同一性、约52%同一性、约53%同一性、约54%同一性、约55%同一性、约56%同一性、约57%同一性、约58%同一性、约59%同一性、约60%同一性、约61%同一性、约62%同一性、约63%同一性、约64%同一性、约65%同一性、约66%同一性、约67%同一性、约68%同一性、约69%同一性、约70%同一性、约71%同一性、约72%同一性、约73%同一性、约74%同一性、约75%同一性、约76%同一性、约77%同一性、约78%同一性、约79%同一性、约80%同一性、约81%同一性、约82%同一性、约83%同一性、约84%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约89%同一性或约90%同一性的氨基酸序列。
在其他实施方案中,人源化11E6抗体包含免疫球蛋白轻链可变区,该免疫球蛋白轻链可变区包含与SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23和SEQ ID NO:24的整个可变区、互补决定区或框架区序列具有至少约50%同一性、约51%同一性、约52%同一性、约53%同一性、约54%同一性、约55%同一性、约56%同一性、约57%同一性、约58%同一性、约59%同一性、约60%同一性、约61%同一性、约62%同一性、约63%同一性、约64%同一性、约65%同一性、约66%同一性、约67%同一性、约68%同一性、约69%同一性、约70%同一性、约71%同一性、约72%同一性、约73%同一性、约74%同一性、约75%同一性、约76%同一性、约77%同一性、约78%同一性、约79%同一性、约80%同一性、约81%同一性、约82%同一性、约83%同一性、约84%同一性、约85%同一性、约86%同一性、约87%同一性、约88%同一性、约89%同一性或约90%同一性的氨基酸序列。
同源性或同一性可以在本领域中的技能内的各种方式测定,例如使用可公开获得的计算机软件,如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。使用由程序blastp、blastn、blastx、tblastn和tblastx所采用的算法进行的BLAST(基本局部比对搜索工具)分析(Karlin等人,(1990)PROC.NATL.ACAD.SCI.USA 87,2264-2268;Altschul,(1993)J.Mol.Evol.36,290-300;Altschul等人,(1997)Nucleic Acids Res.25,3389-3402,以引用的方式并入)被定制用于序列相似性搜索。由BLAST程序使用的方法是首先考虑查询序列与数据库序列之间的相似区段,,然后评估所鉴别的所有匹配的统计显著性,并且最终仅总结满足预先选择的显著性阈值的那些匹配。关于序列数据库的相似性搜索中的基本问题的论述,参见Altschul等人,(1994)Nature Genetics 6,119-129,其以引用的方式完全并入。本领域技术人员可确定用于测量比对的适当参数,包括在所比较序列的全长上实现最大比对所需的任何算法。用于直方图、说明、比对、期望值(即,用于报告针对数据库序列的匹配的统计显著性阈值)、截断、矩阵和过滤器的搜索参数均为默认设置。由blastp、blastx、tblastn和tblastx使用的默认计分矩阵是BLOSUM62矩阵(Henikoff等人,(1992)Proc.Natl.Acad.Sci.USA 89,10915-10919,以引用的方式完全并入)。可以将4个blastn参数调整如下:Q=10(空位产生罚分);R=10(空位延伸罚分);wink=1(查询过程中在每个第wink.sup.位上产生字命中(word hit));并且gapw=16(设置在其内产生空位比对的窗口宽度)。等效的Blastp参数设置可以是Q=9;R=2;wink=1;并且gapw=32。还可使用NCBI(国家生物技术信息中心)BLAST高级选项参数(例如:-G,开放空位的成本[整数]:对于核苷酸默认值=5/对于蛋白质默认值是11;-E,延伸空位的成本[整数]:对于核苷酸默认值=2/对于蛋白质默认值是1;-q,核苷酸错配罚分[整数]:默认值=-3;-r,核苷酸匹配奖分[整数]:默认值=1;-e,期望值[实数]:默认值=10;-W,字长[整数]:对于核苷酸默认值=11/对于megablast默认值是28/对于蛋白质默认值是3;-y,对于blast延伸的位下降(Dropoff)(X):对于blastn默认值=20/对于其他默认值是7;-X,对于空位比对的X下降值(以位计):对于所有程序默认值=15,不可适用于blastn;以及-Z,对于空位比对的最终X下降值(以位计):对于blastn默认值是50,对于其他默认值是25)进行搜索。还可使用对于成对蛋白质比对的ClustalW(默认参数可包括,例如,Blosum62矩阵并且空位开放罚分=10并且空位延伸罚分=0.1)。在GCG程序包10.0版本中可获得的序列之间的Bestfit比较使用DNA参数GAP=50(空位产生罚分)和LEN=3(空位延伸罚分),并且蛋白质比较中的等效设置为GAP=8和LEN=2。
在前述实施方案的每个中,本文考虑免疫球蛋白重链可变区序列和/或轻链可变区序列可包含相对于SEQ ID NO:1-24的氨基酸改变(例如,氨基酸取代、缺失或插入)。例如,免疫球蛋白重链可变区序列和/或轻链可变区序列可包含独立地选自相对于SEQ ID NO:1-24的取代、缺失或插入的约1至约50个突变、约1至约40个突变、约1至约35个突变、约1至约30个突变、约1至约25个突变、约1至约20个突变、约1至约15个突变或约1至约10突变。在各种实施方案中,该免疫球蛋白重链可变区序列和/或轻链可变区序列具有相对于SEQ ID NO:1-24的约1个突变、约2个突变、约3个突变、约4个突变、约5个突变、约6个突变、约7个突变、约8个突变、约9个突变、约10个突变、约11个突变、约12个突变、约13个突变、约14个突变、约15个突变、约16个突变、约17个突变、约18个突变、约19个突变、约20个突变、约21个突变、约22个突变、约23个突变、约24个突变、约25个突变、约26个突变、约27个突变、约28个突变、约29个突变、约30个突变、约31个突变、约32个突变、约33个突变、约34个突变、约35个突变、约36个突变、约37个突变、约38个突变、约39个突变、约40个突变、约41个突变、约42个突变、约43个突变、约44个突变、约45个突变、约46个突变、约47个突变、约48个突变、约49个突变或约50个突变。可并入的说明性氨基酸包括亲水性氨基酸残基,其可包括选自精氨酸(R)和赖氨酸(K)的极性且带正电荷的亲水性残基,选自天冬酰胺(N)、谷氨酰胺(Q)、丝氨酸(S)、苏氨酸(T)、脯氨酸(P)和半胱氨酸(C)的极性且中性电荷的亲水性残基,选自天冬氨酸(D)和谷氨酸(E)的极性且带负电荷的亲水性残基,或包括组氨酸(H)的芳香族、极性且带正电荷的亲水性残基;疏水性氨基酸残基,其可包括选自甘氨酸(G)、丙氨酸(A)、亮氨酸(L)、异亮氨酸(I)、甲硫氨酸(M)或缬氨酸(V)的疏水性、脂肪族氨基酸,或选自苯丙氨酸(F)、色氨酸(W)或酪氨酸(Y)的疏水性、芳香族氨基酸。
抗体结合特异性表位的能力可通过平衡解离常数(KD)来进行描述。在某些实施方案中,本发明提供人源化1B7抗体,该抗体结合百日咳毒素蛋白的KD为约20nM或更低、或约15nM或更低、或约10nM或更低、或约5nM或更低。在一个实施方案中,人源化1B7抗体结合百日咳毒素蛋白的KD为约5nM或更低或约3nM或更低。在示例性实施方案中,人源化1B7抗体结合百日咳毒素蛋白的KD为约5nM、约4.5nM、约4nM、约3.5nM、约3nM、约2.5nM、约2nM、约1.5nM、约1nM或约0.5nM。
在某些实施方案中,本发明提供人源化11E6抗体,该抗体结合百日咳毒素蛋白的KD为约20、约19、或约18、或约17、或约16、或约15nM或更低。在一个实施方案中,人源化11E6抗体结合百日咳毒素蛋白的KD为12nM或更低。在示例性实施方案中,人源化1B7抗体结合百日咳毒素蛋白的KD为约15nM、约14.5nM、约14nM、约13.5nM、约13nM、约12.5nM、约12nM、约11.5nM、约11nM、约10.5nM、约10nM、约9.5nM、约9nM、约8.5nM、约8nM、约7.5nM、约7nM、约6.5nM、约6nM、约5.5nM、约5nM、约4.5nM、约4nM、约3.5nM、约3nM、约2.5nM、约2nM、约1.5nM、约1nM或约0.5nM。
在一些实施方案中,本文描述的人源化抗体与能够结合百日咳毒素蛋白的抗体竞争。在该人源化抗体与抗体(竞争者抗体)竞争结合百日咳毒素蛋白的情况下,本发明的人源化抗体将竞争者抗体的结合抑制(完全地或部分地)至可测量的程度。结合的抑制可通过本领域中已知的任何方法来测量。一般来说,如果在人源化抗体存在下,竞争者抗体与抗原的结合被减少至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%或至少约90%,则认为人源化抗体竞争性地抑制竞争者抗体的结合(例如,如由Sato等人,(1990),Infection and Immunity,58(10):3369-3374所描述的小鼠1B7或11E6抗体,或如由Maynard等人,美国专利号8,653,243所描述的人源化1B7抗体,这些文献以引用的方式整体并入本文)。因此,在一些实施方案中,本文提供的抗体与如由Sato等人,(1990),Infection and Immunity,58(10):3369-3374所描述的小鼠1B7或11E6抗体竞争性地结合百日咳毒素蛋白。在其他实施方案中,本文提供的抗体抑制(完全地或部分地)小鼠1B7或11E6抗体的结合。在一些另外实施方案中,本文提供的抗体在竞争测定中使小鼠1B7或11E6抗体的结合减少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%。
虽然在实施方案中说明的实施方案可包含成对可变区、成对全长抗体链或成对CDR1、CDR2和CDR3区(一个来自重链且一个来自轻链),但熟练的技术人员将认识到替代实施方案可包含单一重链可变区或单一轻链可变区、单一全长抗体链、或来自一个抗体链(重链或轻链)的CDR1、CDR2和CDR3区。
抗体的产生
本文描述了用于产生本发明的抗体的方法。例如,编码轻链可变区和/或重链可变区的DNA分子可使用本文提供的序列信息来化学合成。合成DNA分子可连接至其他适当的核苷酸序列(包括,例如恒定区编码序列和表达控制序列),以产生编码所需抗体的基因表达构建体。可替代地,本文提供的序列可使用合成核酸探针,通过杂交技术或聚合酶链式反应(PCR)技术来从杂交瘤中进行克隆。
编码所需抗体的核酸可并入(连接)至表达载体中,所述表达载体可通过转染、转化或转导技术引入到宿主细胞中。例如,编码所需抗体的核酸可通过逆转录病毒转导并入宿主细胞中。示例性宿主细胞是大肠杆菌(E.coli)细胞、中国仓鼠卵巢(CHO)细胞、人胚肾293(HEK293)细胞、海拉(HeLa)细胞、幼仓鼠肾(BHK)细胞、猴肾细胞(COS)、人肝细胞癌细胞(例如,Hep G2)以及不另外地产生IgG蛋白的骨髓瘤细胞。转化的宿主细胞可在容许所述宿主细胞表达编码免疫球蛋白轻链可变区和/或重链可变区的基因的条件下进行生长。
具体表达和纯化条件将取决于所采用的表达系统而不同。例如,如果基因有待在大肠杆菌中表达,则首先通过将工程化的基因定位在适合的细菌启动子(例如Trp或Tac)和原核信号序列下游来将所述基因克隆至表达载体中。所表达的分泌性蛋白积聚在折射体或包涵体中,并且可在通过弗氏压碎器或超声处理破坏细胞之后收获。然后使折射体溶解,并且使蛋白质通过本领域中已知的方法再折叠且裂解。
如果工程化的基因有待在真核宿主细胞(例如,CHO细胞)中表达,则首先将工程化的基因插入含有适合的真核启动子、分泌信号、IgG增强子以及各种内含子的表达载体中。该表达载体任选地含有编码恒定区的全部或一部分的序列,从而使得能够表达重链或轻链的全部或一部分。可使用转染、转化或转导技术将基因构建体引入真核宿主细胞中。该宿主细胞表达VL或VH片段、VL-VH异二聚体、VH-VL或VL-VH单链多肽、完整免疫球蛋白重链或轻链或其部分,其各自可连接至具有另一功能的部分。在一些实施方案中,将宿主细胞用表达多肽的单一载体转染,该多肽表达重链(例如,重链可变区)或轻链(例如,轻链可变区)的全部或一部分。在其他实施方案中,将宿主细胞用编码(a)包含重链可变区的多肽和包含轻链可变区的多肽,或(b)整个免疫球蛋白重链和整个免疫球蛋白轻链的单一载体转染。在仍然其他实施方案中,将宿主细胞用多于一种表达载体共转染(例如,表达包含重链或重链可变区的全部或一部分的多肽的一种表达载体,和表达包含轻链或轻链可变区的全部或一部分的多肽的另一种表达载体)。
包含免疫球蛋白重链可变区或轻链可变区的多肽可通过在容许表达该多肽的条件下生长用编码所述可变区的表达载体转染的宿主细胞来产生。在表达之后,可使用本领域中熟知的技术,例如亲和标签如谷胱甘肽-S-转移酶(GST)和组氨酸标签或通过色谱法(作为非限制性实例,基于大小、电荷和/或特异性结合)来收获和纯化所述多肽。
结合百日咳毒素蛋白的单克隆抗体或所述抗体的抗原结合片段可通过生长用以下各项转染、转化或转导的宿主细胞来产生:(a)编码完整或部分的免疫球蛋白重链的表达载体和编码完整或部分的免疫球蛋白轻链的单独表达载体;或(b)在容许所述两个链表达的条件下编码两个链(例如,完整或部分的重链和轻链)的单一表达载体。可使用本领域中已知的技术,例如蛋白A、蛋白G、亲和标签如谷胱甘肽-S-转移酶(GST)标签和组氨酸标签或通过色谱法来收获且纯化所述完整抗体(或抗原结合片段)。从单一表达载体或从两个单独的表达载体表达该重链和该轻链处于本领域技术人员的能力范围之内。
抗体修饰
存在本领域中已知的用于降低或消除抗体和抗体片段的抗原性的标准方法。当抗体有待施用至人时,该抗体优选地是“人源化的”以降低或消除人体内的抗原性。考虑人源化抗体具有与其来源的非人源化小鼠抗体至少相同或基本上相同的抗原亲和力。
然而,应注意虽然人源化方法是本领域中已知的,但这类人源化方法经常受亲和力降低(例如,相对于原始鼠抗体)阻碍。不希望受理论限制,这可能是由于以下事实:CDR不由人框架维持可工作构型。在这种情况下,对人框架序列进行少量变化。这些单独氨基酸变化在不造成与人抗体结构的显著偏差的情况下改进亲和力,以使得抗体继续类似于人抗体。以所述方式,抗体可出于治疗目的用于人体中而不诱导免疫应答。氨基酸改变的选择以及有待进行的特定变化是本发明的一部分。
在一种人源化方法中,产生嵌合蛋白,其中小鼠免疫球蛋白恒定区被人免疫球蛋白恒定区置换。参见例如,Morrison等人,1984,Proc.Nat.Acad.Sci.81:6851-6855;Neuberger等人,1984,Nature 312:604-608;美国专利号6,893,625(Robinson);5,500,362(Robinson);以及4,816,567(Cabilly)。例如,在一些实施方案中,SEQ ID NO:1或SEQ ID NO:7或SEQ ID NO:13或SEQ ID NO:19中的任一个可以是与人恒定区配对的可变区。
在被称为CDR接枝的方法中,轻链可变区和重链可变区的CDR被接枝至来自另一物种的框架中。例如,参与抗原结合的鼠CDR和非-CDR残基可被接枝至人序列中。还可以接枝参与维持组合位点结构的残基和参与维持VL:VH接触的残基。CDR接枝描述于美国专利号7,022,500(Queen);6,982,321(Winter);6,180,370(Queen);6,054,297(Carter);5,693,762(Queen);5,859,205(Adair);5,693,761(Queen);5,565,332(Hoogenboom);5,585,089(Queen);5,530,101(Queen);Jones等人(1986)Nature 321:522-525;Riechmann等人(1988)Nature 332:323-327;Verhoeyen等人(1988)Science 239:1534-1536;以及Winter(1998)FEBS Lett 430:92-94。
在被称为缩短CDR的接枝的一种方法中,参与抗原结合的缩短CDR(如由Padlan等人,(1995)Faseb J 9:133-139所定义)和非CDR残基被移植至人序列中。还可以接枝参与维持组合位点结构的残基和参与维持VL∶VH接触的残基。
用于降低免疫原性的其他方法包括“SDR-转移”、“镶饰”和“Frankensteining”。参见例如,Padlan等人,(1995)Faseb J 9:133-139;Wu等人,(1992)Mol Immunol 29:1141-1146;以及Padlan等人,(1991)Mol Immunol 28:489-498。在SDR转移方法中,参与抗原结合的残基(即,特异性决定残基或SDR)被移植至人序列中。还可以移植参与维持组合位点结构的残基和参与维持VL∶VH接触的残基。在镶饰方法中,鼠抗体中的表面可及氨基酸残基被更频繁地在人抗体中的相同位置处发现的氨基酸残基置换。例如,暴露于溶剂的框架残基被来自人序列的其同源物置换。保留参与抗原结合的CDR和非CDR残基。在Frankensteining方法中,将CDR移植至从最相似的人框架区构建的复合序列中。还可以移植参与维持组合位点结构的残基和参与维持VL∶VH接触的残基。
任何适合的方法(包括上述方法中的任一种)可用于降低或消除抗体的人免疫原性。
此外,有可能在小鼠中产生完全人抗体。缺乏任何非人序列的完全人mAb可通过在例如Lonberg等人,Nature 368:856-859,1994;Fishwild等人,Nature Biotechnology 14:845-851,1996;和Mendez等人,Nature Genetics 15:146-156,1997中提及的技术从人免疫球蛋白转基因小鼠进行制备。还可通过在例如Knappik等人,J.Mol.Biol.296:57-86,2000;和Krebs等人,J.Immunol.Meth.254:67-84 2001)中提及的技术从噬菌体展示文库制备和优化人mAb。
如果所述抗体用作治疗剂,则可使用标准体外缀合化学将其缀合至效应剂如小分子或放射性核素。如果效应剂是多肽,则可将抗体化学缀合至效应子或连接至效应子作为融合蛋白。融合蛋白的构建在在本领域技术人员的技能内。
使用抗体的方法
一方面,本发明的方法涉及治疗具有百日咳博德特氏杆菌的患者,所述方法包括向所述患者施用人源化1B7抗体(例如以有效量)和/或人源化11E6抗体(例如以有效量)或包含所述一种或多种抗体的药物组合物。
另一方面,本发明的方法涉及一种预防百日咳博德特氏杆菌感染的方法,所述方法包括向患者施用人源化1B7抗体(例如以有效量)和/或人源化11E6抗体(例如以有效量)或包含所述一种或多种抗体的药物组合物,并且在一些实施方案中,所述患者处于百日咳博德特氏杆菌感染的风险(例如,所述患者是疫苗接种前婴儿和/或所述患者已暴露于百日咳毒素)。
白细胞增多或白血细胞计数升高是百日咳博德特氏杆菌感染的特征。在一个实施方案中,本发明的方法包括降低患者中的白血细胞计数。在一个实施方案中,本发明的方法产生白细胞增多的消退加速。在另一个实施方案中,本发明的方法产生在感染过程期间最大白血细胞计数的降低。
在各种实施方案中,本发明的方法产生患者中百日咳的改善。在一个实施方案中,患者的咳嗽症状得以改善。例如,所述方法降低患者中咳嗽的频率或咳嗽次数(或咳嗽发作)。在各种实施方案中,所述方法使咳嗽次数或咳嗽发作减少至少约1次/小时、至少约2次/小时、至少约3次/小时、至少约4次/小时、至少约5次/小时、至少约6次/小时、至少约7次/小时、至少约8次/小时、至少约9次/小时、至少约10次/小时、至少约15次/小时、至少约20次/小时、至少约25次/小时、至少约30次/小时、至少约35次/小时、至少约40次/小时、至少约45次/小时、至少约50次/小时、至少约55次/小时、至少约60次/小时、至少约65次/小时、至少约70次/小时、至少约75次/小时、至少约80次/小时、至少约85次/小时、至少约90次/小时、至少约95次/小时或至少约100次/小时。在另一个实例中,所述方法减少患者中咳嗽的持续时间。例如,所述方法使感染过程期间咳嗽的持续时间减少至少约三个月、约两个月、约一个月、约4周、约3周、约2周、约1周、约5天、约4天、约3天、约2天或约1天。在另一实施方案中,喘息的次数在患者中减少。
在另一实施方案中,本发明的方法降低患者的鼻咽中百日咳博德特氏杆菌细菌的水平。在另一实施方案中,本发明的方法降低患者的肺中百日咳博德特氏杆菌细菌的水平(例如,细菌肺定殖)。例如,所述方法使鼻咽和/或肺中的百日咳博德特氏杆菌水平降低约95%、约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%、约10%或约5%。
在一个实施方案中,本发明的方法产生百日咳毒素蛋白的中和(抑制或拮抗)。例如,本发明的抗体可结合百日咳毒素蛋白以便部分或完全抑制百日咳毒素蛋白的一种或多种生物活性。中和抗体可抑制或阻断的百日咳毒素蛋白的生物活性之一是百日咳毒素蛋白结合细胞受体的能力。百日咳毒素蛋白的受体结合区由分别被称为亚基S2、亚基S3、亚基S4和亚基S5的四个多肽亚基组成。由百日咳毒素蛋白的亚基S2、S3、S4和S5结合的细胞受体的实例是N连接的唾液酸糖蛋白家族的成员如胎球蛋白、结合珠蛋白(haptoblobin)和转铁蛋白。在一个示例性实施方案中,本发明的人源化抗体防止百日咳毒素蛋白结合其细胞受体。在另一个实施方案,本发明的人源化抗体改变百日咳毒素的细胞内运输步骤,以使得所述毒素不会到达细胞胞质。百日咳毒素蛋白的可通过本发明的抗体抑制的另一种重要活性是百日咳毒素蛋白作为针对G蛋白的ADP核糖基酶的酶活性。百日咳毒素蛋白中赋予作为ADP核糖基酶的酶活性的亚基是亚基S1。在一些实施方案中,百日咳毒素蛋白是百日咳海参毒素。在本文被称为百日咳毒素蛋白的百日咳海参毒素包含所有五个百日咳毒素蛋白亚基。在其他实施方案中,百日咳毒素蛋白是截短的百日咳毒素蛋白。如在本文提及的截短的百日咳蛋白包含百日咳毒素蛋白亚基(即,S1、S2、S3、S4和S5)中的至少一个。各种形式的百日咳毒素蛋白描述于例如美国专利号8,653,243中,所述专利以引用的方式整体并入本文。
在各种实施方案中,本发明的组合物和方法适用于治疗或预防百日咳感染的任何阶段。例如,百日咳的潜伏期通常是7–10天,范围是4–21天,并且很少可以是长达42天。在各种实施方案中,本发明的组合物和方法通过使感染更难以发生来增加潜伏期的长度。该疾病的临床病程被分成三个阶段。第一阶段,卡他性阶段,特征在于鼻炎的发病隐袭、打喷嚏、低热和温和、偶尔咳嗽,类似于感冒。咳嗽逐渐变得更严重,并且在1-2周之后,第二或阵发性阶段开始。在各种实施方案中,本发明的组合物和方法减少卡他性阶段的长度并且任选地防止它进展至阵发性阶段。在各种实施方案中,本发明的组合物和方法治疗鼻炎、打喷嚏、低热和咳嗽中的一种或多种。其正是在通常疑似诊断百日咳的阵发性阶段期间。典型地,患者具有大量、快速咳嗽的突发或阵发,显然是由于将稠厚粘液从气管支气管树驱逐出的困难所致。在阵发结束时,长吸气努力通常伴随特征性高声喘息。在这种发作中,患者可能变得发绀。儿童和婴幼儿尤其出现非常不适和痛苦。在发作之后通常是呕吐和疲惫。在各种实施方案中,本发明的组合物和方法减少阵发的量和/或频率。在各种实施方案中,本发明的组合物和方法防止患者变得发绀。阵发性发作更频繁地在夜间发生,平均每24小时15次发作。在此阶段的最初1或2周,发作频率增加,对于2至3周保持在相同水平,且然后逐渐降低。阵发性阶段通常持续1至6周,但可能持续长达10周。在各种实施方案中,本发明的组合物和方法减少此阶段的长度。在恢复期,恢复是逐渐的。咳嗽变得阵发性降低且在2至3周消失。在各种实施方案中,本发明的组合物和方法加速此阶段的发作和/或减少其持续时间。此外,在各种实施方案中,本发明的组合物和方法预防或减少阵发的复发,所述复发可能与随后呼吸道感染一起发生。在各种实施方案中,本发明的组合物和方法预防或减少一种或多种以下发作:继发性细菌性肺炎、神经系统并发症如癫痫和脑病、缺氧、中耳炎、脱水、气胸、鼻出血、硬脑膜下血肿、疝、直肠脱垂、睡眠困难、尿失禁、肺炎以及肋骨骨折。此外,在一些实施方案中,本发明的组合物和方法减少或预防坏死性细支气管炎、肺炎(例如,来自百日咳博德特氏杆菌)、肺水肿、肺高血压症和死亡。
在一个实施方案中,本发明的方法涉及将人源化1B7抗体和人源化11E6抗体共同施用至患者。在一些实施方案中,共同施用产生协同作用。共同施用人源化1B7抗体和人源化11E6抗体可以是同时的或顺序的。
在一些实施方案中,人源化1B7抗体和人源化11E6抗体被同时施用至受试者。如本文所用的术语“同时”意指人源化1B7抗体和人源化11E6抗体以不超过约60分钟、如不超过约30分钟、不超过约20分钟、不超过约10分钟、不超过约5分钟或不超过约1分钟的时间间隔施用。施用人源化1B7抗体和人源化11E6抗体可通过同时施用单一制剂(例如包含人源化1B7抗体和人源化11E6抗体的制剂)或单独试剂(例如,包含人源化1B7抗体的第一制剂和包含人源化11E6抗体的第二制剂)来进行。
共同施用不要求治疗剂同时施用,如果它们的施用的定时是使得人源化1B7抗体和11E6抗体的药理学活性在时间上重叠,从而施加组合治疗作用。例如,人源化1B7抗体和人源化11E6抗体可顺序地施用。如本文所用的术语“顺序地”意指人源化1B7抗体和人源化11E6抗体以超过约60分钟的时间间隔施用。例如,人源化1B7抗体和人源化11E6抗体的顺序施用之间的时间可以是超过约60分钟、超过约2小时、超过约5小时、超过约10小时、超过约1天、超过约2天、超过约3天或超过约1周间隔。任选的施用时间将取决于代谢速率、排泄速率和/或所施用的人源化1B7抗体和人源化11E6抗体的药代动力学活性。
例如,在一些实施方案中,本发明的抗体在血清浓度方面具有施用后至少约30、或约35、或约40、或约45、或约50、或约55、或约60、或约65、或约70、或约75、或约80小时或至少约1天、约2天、约3天、约4天、约5天、约6天、约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、或约25天的峰值(例如,β半衰期)。在一些实施方案中,本发明的抗体具有延长的半衰期。在一些实施方案中,本发明的抗体具有约200、或约225、或约250、或约275、或约300小时或约7天、约8天、约9天、约10天、约11天、约12天、约13天、约14天、约15天、约16天、约17天、约18天、约19天、约20天、约21天、约22天、约23天、约24天、约25天、约26天、约27天、约28天、约29天、约30天、约31天、约32天、约33天、约34天、或约35天,例如约1或约2周、或约3周、约4周、或约5周的体内半衰期。
因此,在一些实施方案中,患者可接受本发明抗体的第一施用(例如,输注或肌内(IM)注射)作为治疗方法的一部分,并且可在本发明的抗体的血清浓度和/或体内半衰期的峰值之后接受另一施用(例如,输注或肌内注射)(例如,所述另一施用的剂量可与所述第一施用相同或可更低,例如,维持剂量)。在一些实施方案中,所述另一施用是距所述第一施用约一天,或距所述第一施用约一周。在一些实施方案中,本发明的方法提供每周(或约每5或6或7或10天)约1-3(例如,约1、约2或约3)个剂量(例如,IV剂量或IM剂量)的本发明的抗体。在一些实施方案中,本发明的方法在血清中维持约5μg/mL、约10μg/mL、约20μg/mL、约25μg/mL、约50μg/mL、约75μg/mL、或约100μg/mL、或约125μg/mL、或约150μg/mL、或约175μg/mL、或约200μg/mL、或约225μg/mL、或约250μg/mL、或约300μg/mL的抗体水平的治疗窗。在一些实施方案中,本发明的方法允许不频繁给药和/或较少给药(例如,允许较少且不太频繁的给药的较长半衰期)。
可首先施用人源化1B7抗体或人源化11E6抗体。例如,可在施用人源化11E6抗体的时间之后向受试者施用人源化1B7抗体。在这种情况下,通常合乎需要的是在约50%(例如,在约40%、约30%、约20%、约10%或约5%)的人源化11E6抗体被受试者代谢或排泄的时间或在人源化11E6抗体已达到约50%、约60%、约70%、约80%、约90%或约100%的其药代动力学活性的时间之前施用人源化1B7抗体。在另一个实例中,可在施用人源化11E6抗体之前向受试者施用人源化1B7抗体。在这种情况下,通常合乎需要的是在约50%(例如,在约40%、约30%、约20%、约10%或约5%)的人源化1B7抗体被受试者代谢或排泄的时间或在所施用的人源化1B7抗体已达到约50%、约60%、约70%、约80%、约90%或约100%的其药代动力学活性的时间之前施用人源化11E6抗体。
共同施用也不要求治疗剂通过同一施用途径施用至患者。而是,每种治疗剂可通过任何适当的途径例如胃肠外或非胃肠外来施用。在一个实施方案中,所述治疗剂可口服施用至受试者。在另一个实施方案中,所述治疗剂可胃肠外施用,包括例如静脉内、肌内、腹膜内、皮下和关节内注射和输注等。在一个实施方案中,所述治疗剂可通过肌内注射施用至受试者。
在另一个实施方案中,所述方法包括向患者施用人源化1B7抗体和/或11E6抗体连同抗微生物剂。预期共同施用人源化1B7抗体和/或11E6抗体连同抗微生物剂产生协同作用。可用于本发明的说明性抗微生物剂包括但不限于阿奇霉素、克拉霉素、红霉素、三甲氧苄二氨嘧啶-磺胺甲噁唑、罗红霉素、酮内脂(例如,泰利霉素)、氨苄西林、阿莫西林、四环素、氯霉素、氟喹诺酮(例如,环丙沙星、左氧氟沙星、氧氟沙星、莫西沙星)以及头孢菌素。在一个实施方案中,抗微生物剂是红霉素。
在各种实施方案中,本发明的方法治疗人患者。在一个实施方案中,人患者是婴儿。在一个实施方案中,人患者是新生儿。在另一个实施方案中,人患者是小于四周、小于三周、小于两周、小于一周、小于六天、小于五天、小于四天、小于三天、小于两天或小于一天的新生儿。在一些实施方案中,所述人是一个月大、两个月大、三个月大、四个月大、五个月大或六个月大。在一些实施方案中,人具有在约6至约18个月、约18至约36个月、约1至约5岁、约5至约10岁、约10至约15岁、约15至约20岁、约20至约25岁、约25至约30岁、约30至约35岁、约35至约40岁、约40至约45岁、约45至约50岁、约50至约55岁、约55至约60岁、约60至约65岁、约65至约70岁、约70至约75岁、约75至约80岁、约80至约85岁、约85至约90岁、约90至约95岁或约95至约100岁范围内的年龄。
另一方面,本发明的方法预防先前暴露于百日咳博德特氏杆菌细菌的受试者的百日咳博德特氏杆菌感染,该方法包括向受试者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物。在各种实施方案中,该方法提供在预防暴露于百日咳博德特氏杆菌细菌的受试者的百日咳博德特氏杆菌感染方面的有效预防性治疗。
在一些实施方案中,本发明的抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)用于先前尚未针对所述细菌疫苗接种的受试者中的预防性应用。在一个实施方案中,本发明的抗体在受试者接受百日咳疫苗接种之前作为预防性治疗施用至所述受试者。在各种实施方案中,本发明的抗体用于小于一岁、小于十一个月、小于十个月、小于九个月、小于八个月、小于七个月、小于六个月、小于五个月、小于四个月、小于三个月、小于二个月、小于一个月、小于四周、小于三周、小于二周、小于一周、小于六天、小于五天、小于四天、小于三天、小于两天或小于一天的受试者的预防性治疗中。因此,在一些实施方案中,本发明的方法涉及桥接婴儿患者中出生与疫苗接种之间的时间。
在各种实施方案中,本发明的方法治疗或预防先前针对百日咳博德特氏杆菌细菌疫苗接种的受试者的百日咳博德特氏杆菌感染。在一个实施方案中,所述受试者是用DtaP(例如,INFANRIX(具有三种抗原,主要是百日咳毒素(PT)和FHA)、TRIPEDIA(其包含相等量的两种组分,FHA和PT)和DAPTACEL(其包含五种组分,PT、FHA、百日咳杆菌粘附素以及2型和3型菌毛))疫苗接种的婴儿或儿童。在另一实施方案中,所述受试者是用百日咳加强疫苗Tdap(例如BOOSTRIX(具有三种百日咳抗原(PT、FHA和百日咳杆菌粘附素),相较于INFANRIX以减少的量)和ADACEL(具有与DAPTACEL相同的五种百日咳组分,但具有减少量的PT)疫苗接种的成人。在其他实施方案中,本发明的患者可以或可以未接受以下百日咳组合疫苗中的任一种:PEDIARIX、PENTACEL或KINRIX。
预期本发明的人源化抗体还可充当用于疫苗接种如DtaP或Tdap的佐剂。此外,在各种实施方案中,本发明的方法治疗或预防先前尚未针对百日咳博德特氏杆菌细菌疫苗接种的受试者的百日咳博德特氏杆菌感染。
在各种实施方案中,本发明的组合物和方法补充或代替用帕利珠单抗(SYNAGIS)治疗。
在各种实施方案中,本发明的组合物和方法可治疗具有不同菌株作为其病因学的百日咳感染,包括作为非限制性实例,百日咳杆菌粘附素阴性百日咳。
此外,副百日咳博德特氏杆菌是紧密相关的物种百日咳博德特氏杆菌。两种细菌与人中百日咳的爆发相关并且产生类似的毒力因子。百日咳博德特氏杆菌和副百日咳博德特氏杆菌的共感染并不罕见。因此,在本发明的一方面,本发明的方法涉及治疗具有副百日咳博德特氏杆菌的患者,所述方法包括向所述患者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物。在本发明的另一方面,本发明的方法预防先前暴露于副百日咳博德特氏杆菌细菌的受试者的副百日咳博德特氏杆菌感染,所述方法包括向所述受试者施用人源化1B7抗体和/或人源化11E6抗体或包含所述一种或多种抗体的药物组合物。
在各种实施方案中,当在感染后约3个月时将人源化1B7抗体和/或人源化11E6抗体施用至患者时,本发明的方法有效于治疗百日咳博德特氏杆菌感染和/或副百日咳博德特氏杆菌感染。在其他实施方案中,当在感染后约2个月、约1个月、约4周、约3周、约2周、约7天、约6天、约5天、约4天、约3天、约2天或约1天时将人源化1B7抗体和/或人源化11E6抗体施用至患者时,本发明的方法有效于治疗百日咳博德特氏杆菌感染和/或副百日咳博德特氏杆菌感染。在一个实施方案中,人源化1B7抗体和/或人源化11E6抗体在感染当天施用至患者。
如本文所用,“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”意指治疗哺乳动物,例如人中的疾病。在各种实施方案中,这包括:(a)抑制所述疾病,即阻止其发展和/或(b)减轻所述疾病,即引起疾病状态的消退。
药物组合物和施用
可施用本发明的药物组合物以用于治疗性和/或预防性治疗。出于这类用途,抗体优选地与药学上可接受的载体组合。如本文所用,“药学上可接受的载体”意指适合用于与人类和动物的组织相接触而无过度毒性、刺激、过敏反应或其他问题或并发症,与合理的益处/风险比相称的缓冲剂、载体和赋形剂。载体在与制剂的其他成分可相容并且对接受者无害的意义上必须是“可接受的”。药学上可接受的载体包括与药物施用相容的缓冲剂、溶剂、分散介质、包衣剂、等渗及吸收延迟剂等。所述介质和试剂用于药学活性物质在本领域中是已知的。
含有抗体的药物组合物(如本文公开的那些)可以剂量单位形式呈递并且可通过任何适合的方法来制备。药物组合物应被配制为与其预定的施用途径相容。施用途径的实例包括口服、鼻内、肺部、静脉内(IV)、真皮内、吸入、经皮、局部、经粘膜、皮下、肌内(IM)、腹膜内以及经直肠施用。在一个实施方案中,施用本发明的抗体的途径是IV输注。在另一个实施方案中,施用本发明的抗体的途径是IM注射。
有用的制剂可通过药物领域中熟知的方法来制备。例如,本发明的药物组合物可被配制为胶体分散系统、大分子复合物、纳米胶囊、微球、珠粒、水包油型乳液、胶束、混合胶束或脂质体。例如,参见Remington′s Pharmaceutical Sciences,第18版(Mack Publishing Com pany,1990)。
适用于胃肠外施用的制剂组分包括无菌稀释剂,如注射用水、生理盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如EDTA;缓冲剂,如乙酸盐、柠檬酸盐或磷酸盐;以及用于调整张力的试剂,如氯化钠或右旋糖。
对于静脉内施用,适合的载体包括生理盐水、抑菌水、Cremophor ELTM(BASF,Parsippany,NJ)或磷酸盐缓冲盐水(PBS)。所述载体应是在制造和储存条件下稳定的,并且应针对微生物进行保存。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)及其适合混合物。
本文提供的组合物(单独地或与其他适合的组分组合)可被制成为待经由吸入施用的气雾剂制剂(即,“雾化”)。气雾剂制剂可被置于加压可接受的推进剂中,如二氯二氟甲烷、丙烷、氮等。
药物制剂优选地是无菌的。灭菌可例如通过经由无菌过滤膜过滤来完成。在组合物被冻干的情况下,则可在冻干和复原之前或之后实施过滤灭菌。
药物制剂优选地呈单位剂型。在所述形式中,制剂被细分含有适当量的活性组分的单位剂量。单位剂型可以是包装制剂,所述包装含有个别量的制剂,如在小瓶或安瓿中的包装片剂、胶囊和粉剂。此外,单位剂型可以是胶囊、片剂、扁囊剂或锭剂自身,或它可以是适当数目的呈包装形式的任何这些单位剂型。所述组合物还可含有其他相容的治疗剂。例如,所述组合物可另外地包含本文描述的抗微生物剂。
组合施用考虑共同施用(使用分开的制剂或单一药物制剂),和以任何顺序连续施用,其中优选地存在两种(或所有)活性剂同时发挥其生物活性的时间段。在一个实施方案中,本发明的药物组合物包含人源化1B7抗体的制剂。在另一个实施方案中,本发明的药物组合物包含人源化11E6抗体的制剂。在另一实施方案中,本发明的药物组合物包含人源化1B7抗体和人源化11E6抗体两者的共制剂。
应了解根据本发明待施用的抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)的实际剂量将根据例如具体剂型和施用模式而变化。可修改所述抗体的作用的许多因素(例如,体重、性别、饮食、施用时间、施用途径、排泄速率、受试者的状况、药物组合、遗传倾向和反应敏感性)可由本领域的技术人员考虑在内。施用可在最大耐受剂量内连续进行或以一个或多个离散剂量进行。用于给定组病状的最佳施用速率可由本领域的技术人员使用常规剂量施用测试来确定。
抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)的单个剂量可以每单位剂型含有例如约0.01mg至约1,000mg、约0.01mg至约950mg、约0.01mg至约900mg、约0.01mg至约850mg、约0.01mg至约800mg、约0.01mg至约750mg、约0.01mg至约700mg、约0.01mg至约650mg、约0.01mg至约600mg、约0.01mg至约550mg、约0.01mg至约500mg、约0.01mg至约450mg、约0.01mg至约400mg、约0.01mg至约350mg、约0.01mg至约300mg、约0.01mg至约250mg、约0.01mg至约200mg、约0.01mg至约150mg、约0.01mg至约100mg、约0.1mg至约90mg、约0.1mg至约80mg、约0.1mg至约70mg、约0.1mg至约60mg、约0.1mg至约50mg、约0.1mg至约40mg活性成分、约0.1mg至约30mg、约0.1mg至约20mg、约0.1mg至约10mg、约0.1mg至约5mg、约0.1mg至约3mg、约0.1mg至约1mg或每单位剂型约5mg至约80mg的单位剂型施用。例如,单位剂型可以是约0.01mg、约0.02mg、约0.03mg、约0.04mg、约0.05mg、约0.06mg、约0.07mg、约0.08mg、约0.09mg、约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg或约1,000mg,包括其之间的所有值和范围。
在一个实施方案中,抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)以约0.01mg至约100mg每日的量,约0.01mg至约1,000mg每日、约0.01mg至约950mg每日、约0.01mg至约900mg每日、约0.01mg至约850mg每日、约0.01mg至约800mg每日、约0.01mg至约750mg每日、约0.01mg至约700mg每日、约0.01mg至约650mg每日、约0.01mg至约600mg每日、约0.01mg至约550mg每日、约0.01mg至约500mg每日、约0.01mg至约450mg每日、约0.01mg至约400mg每日、约0.01mg至约350mg每日、约0.01mg至约300mg每日、约0.01mg至约250mg每日、约0.01mg至约200mg每日、约0.01mg至约150mg每日、约0.1mg至约100mg每日、约0.1mg至约95mg每日、约0.1mg至约90mg每日、约0.1mg至约85mg每日、约0.1mg至约80mg每日、约0.1mg至约75mg每日、约0.1mg至约70mg每日、约0.1mg至约65mg每日、约0.1mg至约60mg每日、约0.1mg至约55mg每日、约0.1mg至约50mg每日、约0.1mg至约45mg每日、约0.1mg至约40mg每日、约0.1mg至约35mg每日、约0.1mg至约30mg每日、约0.1mg至约25mg每日、约0.1mg至约20mg每日、约0.1mg至约15mg每日、约0.1mg至约10mg每日、约0.1mg至约5mg每日、约0.1mg至约3mg每日、约0.1mg至约1mg每日、或约5mg至约80mg每日的量施用。在各种实施方案中,该抗体以约0.01mg、约0.02mg、约0.03mg、约0.04mg、约0.05mg、约0.06mg、约0.07mg、约0.08mg、约0.09mg、约0.1mg、约0.2mg、约0.3mg、约0.4mg、约0.5mg、约0.6mg、约0.7mg、约0.8mg、约0.9mg、约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg或约1,000mg(包括其之间的所有值和范围)的每日剂量施用。
在一些实施方案中,抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)的适合剂量在约0.01mg/kg至约100mg/kg受试者体重的范围内,例如,约0.01mg/kg、约0.02mg/kg、约0.03mg/kg、约0.04mg/kg、约0.05mg/kg、约0.06mg/kg、约0.07mg/kg、约0.08mg/kg、约0.09mg/kg、约0.1mg/kg、约0.2mg/kg、约0.3mg/kg、约0.4mg/kg、约0.5mg/kg、约0.6mg/kg、约0.7mg/kg、约0.8mg/kg、约0.9mg/kg、约1mg/kg、约1.1mg/kg、约1.2mg/kg、约1.3mg/kg、约1.4mg/kg、约1.5mg/kg、约1.6mg/kg、约1.7mg/kg、约1.8mg/kg、1.9mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg、约15mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg、约50mg/kg、约55mg/kg、约60mg/kg、约65mg/kg、约70mg/kg、约75mg/kg、约80mg/kg、约85mg/kg、约90mg/kg或约100mg/kg体重,包括其间的所有值和范围。在其他实施方案中,抗体的适合剂量在约0.01mg/kg至约100mg/kg体重的范围内、在约1mg/kg至约100mg/kg体重的范围内、在约1mg/kg至约90mg/kg体重的范围内、在约1mg/kg至约80mg/kg体重的范围内、在约1mg/kg至约70mg/kg体重的范围内、在1mg/kg至约60mg/kg体重的范围内、在1mg/kg至约50mg/kg体重的范围内、在1mg/kg至约40mg/kg体重的范围内、在1mg/kg至约30mg/kg体重的范围内、在1mg/kg至约20mg/kg体重的范围内、在约5mg/kg至约50mg/kg体重的范围内、在约5mg/kg至约40mg/kg体重的范围内、在约5mg/kg至约30mg/kg体重的范围内、在约5mg/kg至约20mg/kg体重的范围内,包括其间的所有值和范围。
根据本发明的某些实施方案,抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)可例如每日多于一次、约一次/天、约每隔一天、约每隔两天、约一周一次、约每两周一次、约每月一次、约每两个月一次、约每三个月一次、约每六个月一次或约每年一次。
抗体可在多种场合施用。单个剂量之间的间隔可以是每周、每月或每年。间隔也可以是无规律的,如由测量受试者中抗体的血液水平所指示。在一些实施方案中,抗体可作为缓释制剂施用,在这种情况下需要较低的施用频率。
在一些方法中,本发明的抗体以实现1-1000μg/ml且在一些方法中25-300μg/ml的血浆或血清抗体浓度的剂量施用。例如,本发明的抗体可以实现约1-1000μg/ml、1-900μg/ml、1-800μg/ml、1-700μg/ml、1-600μg/ml、1-500μg/ml、1-400μg/ml、1-300μg/ml、1-200μg/ml、1-100μg/ml、10-500μg/ml、10-400μg/ml、10-300μg/ml、10-200μg/ml、10-100μg/ml、100-400μg/ml、100-300μg/ml或100-200μg/ml(包括其间的所有值和范围)的血浆或血清水平的剂量施用。例如,本发明的抗体可以实现约1μg/ml、约5μg/ml、约10μg/ml、约15μg/ml、约20μg/ml、约25μg/ml、约30μg/ml、约35μg/ml、约40μg/ml、约45μg/ml、约50μg/ml、约55μg/ml、约60μg/ml、约65μg/ml、约70μg/ml、约75μg/ml、约80μg/ml、约85μg/ml、约90μg/ml、约95μg/ml、约100μg/ml、约105μg/ml、约110μg/ml、约115μg/ml、约120mgμg/ml、约125μg/ml、约130μg/ml、约135μg/ml、约140μg/ml、约145μg/ml、约150μg/ml、约155μg/ml、约160μg/ml、约165μg/ml、约170μg/ml、约175μg/ml、约180μg/ml、约185μg/ml、约190μg/ml、约195μg/ml、约200μg/ml、约205μg/ml、约210μg/ml、约215μg/ml、约220mgμg/ml、约225μg/ml、约230μg/ml、约235μg/ml、约240μg/ml、约245μg/ml、约250μg/ml、约255μg/ml、约260μg/ml、约265μg/ml、约270μg/ml、约275μg/ml、约280μg/ml、约285μg/ml、约290μg/ml、约295μg/ml或约300μg/ml的血浆或血清水平的剂量施用。
在一些方法中,本发明的抗体(例如人源化hu1B7抗体和/或hu11E6抗体)实现至少约1EU/ug、至少约2EU/ug、至少约3EU/ug、至少约4EU/ug、至少约5EU/ug、至少约6EU/ug、至少约7EU/ug、至少约8EU/ug、至少约9EU/ug、至少约10EU/ug、至少约15EU/ug、至少约20EU/ug、至少约25EU/ug、至少约30EU/ug、至少约35EU/ug、至少约40EU/ug、至少约45EU/ug、至少约50EU/ug、至少约55EU/ug、至少约60EU/ug、至少约65EU/ug、至少约70EU/ug、至少约75EU/ug、至少约80EU/ug、至少约85EU/ug、至少约90EU/ug、至少约95EU/ug、至少或约100EU/ug的效力。在一些方法中,本发明的抗体(例如,人源化hu1B7抗体和/或hu11E6抗体)实现至少约1EU/ml、至少约2EU/ml、至少约3EU/ml、至少约4EU/ml、至少约5EU/ml、至少约6EU/ml、至少约7EU/ml、至少约8EU/ml、至少约9EU/ml、至少约10EU/ml、至少约15EU/ml、至少约20EU/ml、至少约25EU/ml、至少约30EU/ml、至少约35EU/ml、至少约40EU/ml、至少约45EU/ml、至少约50EU/ml、至少约55EU/ml、至少约60EU/ml、至少约65EU/ml、至少约70EU/ml、至少约75EU/ml、至少约80EU/ml、至少约85EU/ml、至少约90EU/ml、至少约95EU/ml、至少或约100EU/ml的效力。EU代表当量,如由WHO多克隆血清标准所定义。在各种实施方案中,本发明的抗体能够在至少约1天、约2天、约3天、约4天、约5天、约6天、约1周、约2周、约3周、约4周、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月或约12个月之后维持效力。
剂量和频率取决于因素如施用途径、剂量的量、所治疗的疾病以及抗体在患者中的半衰期而变化。施用的剂量和频率可取决于治疗为预防性还是治疗性而变化。在预防性应用中,经长时间段以相对低频率的时间间隔施用相对低的剂量。在治疗性应用中,有时需要相对较短间隔下的相对较高剂量直到疾病进展减弱或终止为止,并且优选地直到患者展示疾病症状的部分或完全改善为止。此后,可向患者施用预防方案。说明性给药频率是每天一次、每天两次、每天三次、每周一次和每两周一次。在一些实施方案中,给药每两周一次。
本发明还提供可简化本文描述的任何药剂(例如,有或无各种组合药剂的人源化抗体)的施用的试剂盒。本发明的说明性试剂盒包括呈单位剂型的本文所述的任何组合物。在一个实施方案中,所述单位剂型是容器,如可为无菌的预填充的注射器,其含有本文描述的任何药剂和药学上可接受的载体、稀释剂、赋形剂或媒介物。试剂盒还包括说明本文所述的任何药剂的使用的标记或印刷说明书。试剂盒还可包括用于施用位置的眼睑扩张器、局部麻醉剂和清洁剂。试剂盒还可包括本文所述的一种或多种另外的药剂。在一个实施方案中,试剂盒包括含有有效量的本发明的组合物和有效量的另一种组合物(如本文所述的那些)的容器。
在一些实施方案中,试剂盒包括呈单位剂型的预填充的注射器(例如,注射器笔)。在各种实施方案中,试剂盒适合于远离传统医疗中心使用,例如在现场使用,例如在第三世界使用。
实施例
以下实施例仅是说明性的,并且不意图以任何方式限制本发明的范围或内容。
实施例1人源化11E6重链可变区和轻链可变区的筛选和评估
产生了编码嵌合11E6重链的表达质粒构建体。该构建体编码具有小鼠可变区、接着人恒定区的抗体。具体地说,该构建体编码融合至人IgG1重链恒定区的SEQ ID NO:13。类似地,产生了编码嵌合11E6轻链的表达质粒构建体。该构建体编码融合至人κ轻链恒定区的SEQ ID NO:19。这两种表达构建体还编码启动子、5’非翻译序列和异源信号肽以用于在CHO细胞中表达且从CHO细胞分泌。
产生了编码嵌合11E6重链的表达质粒构建体。该构建体编码具有小鼠可变区、接着人恒定区的抗体。具体地说,该构建体编码融合至人IgG1重链恒定区的SEQ ID NO:13。类似地,产生了编码嵌合11E6轻链的表达质粒构建体。该构建体编码融合至人κ轻链恒定区的SEQ ID NO:19。这两种表达构建体还编码启动子、5’非翻译序列和异源信号肽以用于在CHO细胞中表达且从CHO细胞分泌。
以类似方式,编码人源化11E6重链的四种表达质粒是利用SEQ ID NO:14、15、17和18构建的。这些分别被指定为H1、H2、H3和H4。编码人源化11E6轻链的三种表达质粒是利用SEQ ID NO:20、21和23构建的。这些分别被指定为L1、L2和L3。
将重链和轻链嵌合表达质粒共转染至CHO细胞中,其然后将双价嵌合抗体分泌至组织培养基中。类似地,将人源化重链和轻链构建体的所有12种组合共转染至CHO细胞中。具体地说,将H1与L1、L2、L3和L4一起共转染;将H2与L1、L2、L3和L4一起共转染;并且将H3与L1、L2、L3和L4一起共转染。从每种转染收集培养基,定量样品中的抗体水平,并且通过ELISA测定与百日咳毒素的结合。两种嵌合构建体和所有12种人源化组合产生特异性地结合百日咳毒素的抗体。H1和H4与L2和L3的组合产生最高ELISA信号。H4与L3的组合被选择用于进一步评估。
用百日咳毒素结合竞争测定来测定亲本鼠抗体、嵌合抗体、H4/L3抗体的解离常数(Kd)。在这种测定中,使增加浓度的百日咳毒素暴露于恒定量的抗体。然后通过ELISA定量剩余的未结合抗体的量。三种抗体的解离常数是几乎相同的。
因此,11E6抗体是人源化的而无对比亲本鼠抗体的任何亲和力损失。
实施例2人源化1B7重链可变区和轻链可变区的筛选和评估
用1B7嵌合序列以及人源化1B7重链和轻链的20种组合来进行相同评估。产生分别编码1B7嵌合重链和轻链SEQ ID NO:1和7的表达质粒。制备了编码SEQ ID NO:2、3、5和6的四种1B7人源化重链的表达质粒,其分别被指定为H1、H2、H3、H4。制备了编码SEQ ID NO:8、9、11、12和10的五种1B7人源化轻链的表达质粒,其分别被指定为L1、L2、L3、L4和L5。对于每种表达质粒,启动子、5’非翻译区、信号肽和恒定区(IgG1和κ)与用于实施例1中的11E6构建体相同。
将编码嵌合重链和轻链的质粒共转染至CHO细胞中以产生嵌合1B7抗体。用于人源化1B7重链和轻链的每种组合的质粒也被共转染至CHO细胞中以产生20种不同的人源化1B7抗体。然后经由如在实施例1中用11E6所进行的百日咳毒素结合ELISA来评估所述抗体。H1和H2与L3和L4的组合产生最高ELISA信号。选择H2/L3用于进一步发展的组合。在百日咳毒素竞争测定中,亲本鼠1B7抗体和H2/L3人源化1B7抗体的解离常数分别是0.15和0.16nM。
因此,1B7抗体是人源化的而无对比亲本鼠抗体的任何亲和力损失。
实施例3:结合百日咳毒素蛋白的人源化抗体的构建
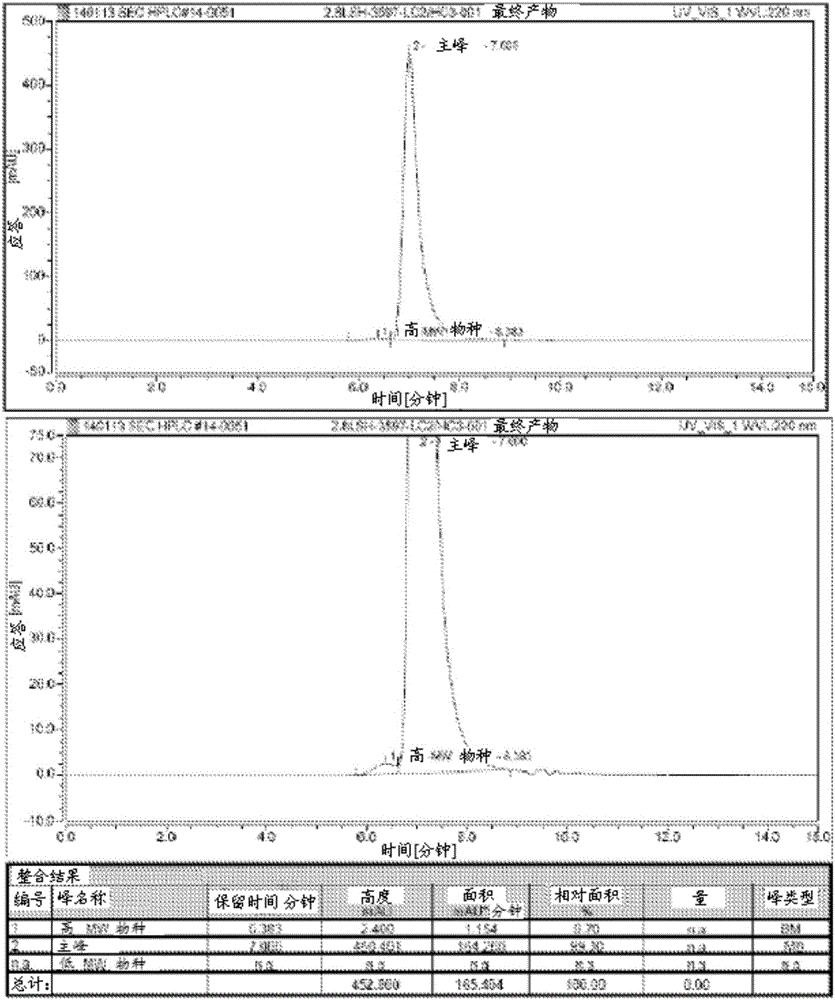
在以上实施例1和2中鉴别的两种人源化抗体是在CHO细胞中产生的。具体地说,对于每种抗体,制备了两种逆转录病毒载体,一种编码重链且第二种编码轻链。对于每种抗体,所述逆转录病毒载体对用于重复地转导和遗传上修饰CHO细胞的非克隆池。然后将重组CHO细胞在摇瓶中生长持续两周。经由蛋白质A柱从CHO细胞组织培养基纯化每种抗体。使用SDS-PAGE凝胶对人源化hu1B7和hu11E6抗体进行分析(参见图1和3)。此外,还通过尺寸排阻色谱法对人源化hu1B7和hu11E6抗体以及所述两种抗体的混合物进行了分析(参见图2、4和5)。具体地说,将500μL的于PBS中的抗体(100μg/mL)在4℃下孵育24小时并且将样品在具有PBS缓冲液的S200柱上运行。
使用SDS-PAGE凝胶对人源化hu1B7和hu11E6抗体进行分析(参见图1和3)。此外,还通过尺寸排阻色谱法对人源化hu1B7和hu11E6抗体以及所述两种抗体的混合物进行了分析(参见图2、4和5)。具体地说,将500μL的于PBS中的抗体(100μg/mL)在4℃下孵育24小时并且将样品在具有PBS缓冲液的S200柱上运行。
对于人源化hu1B7抗体获得以下结果:浓度:5.78mg/mL(使用1.64(mg/mL)-1的A280吸光度系数);内毒素<0.25EU/mL(<0.04EU/mg);并且生物负载<0.2CFU/mL(通过)。
对于人源化hu11E6抗体获得以下结果:浓度:5.62mg/mL(使用1.56(mg/mL)-1的A280吸光度系数);内毒素<0.25EU/mL(<0.04EU/mg);并且生物负载<0.2CFU/mL(通过)。
如至图5中所示,抗体制剂未表现出明显聚集。
实施例4:人源化抗体的制造
进行人源化hu1B7和hu11E6抗体的大规模制造。具体地说,使用逆转录病毒转导技术、接着单克隆抗体纯化方法来在CHO细胞中表达人源化hu1B7和hu11E6抗体。鉴别了用于产生每种抗体的克隆和备份克隆。将每种克隆针对表达进行表征,并且验证所得抗体的质量。将上游工艺放大至100L以用于产生hu1B7抗体且放大至250L以用于产生hu11E6抗体。上游工艺利用无血清的、化学成分确定的且可商购细胞培养基和补料。下游工艺利用通过顺序色谱法(即,蛋白质-A、阴离子交换和阳离子交换)进行的三步纯化。该制造方法还包括基于清洁剂的病毒灭活步骤和切向流过滤至在10mg/mL下的PBS制剂缓冲液(pH 7.0)中。将两种抗体制剂通过0.2um过滤器灭菌且批量填充至高密度聚乙烯瓶中。将纯化的制剂在<-35℃下长期储存。人源化hu1B7和hu11E6抗体的产率分别是47和70克。相较于通过标准质粒转染方法产生的CHO细胞制造系,产率高多于一个数量级。
进行一系列生物分析测定以用于所制造抗体的分批分析和稳定性研究。这些方法包括产物相关测试,如A280吸收读取、SDS-PAGE、SE-HPLC、IEF和ELISA活性测定,以及工艺相关测试,如宿主细胞DNA和蛋白质、内毒素、生物负载和支原体的分析。还测量了外观、渗透压和pH。两种单克隆抗体在这些测定中表现出优异特征。
实施例5:人源化抗体的表征
热稳定性测定用于评定人源化hu11E6和hu1B7抗体以及其鼠对应物的稳定性,如图6A至图6D中所示。
进行ELISA测定以测定人源化hu11E6和hu1B7抗体结合百日咳毒素蛋白的能力(参见图7)。具体地说,百日咳毒素蛋白用于包被,而抗小鼠-HRP或抗人Fc-HRP用作第二抗体。TMB(3,3’,5,5’–四甲基联苯胺)用作所述测定的底物。获得以下EC50(nM)数据:
m1B7:0.19±0.01;
hu1B7A:0.23±0.04;
m11E6:2.7±0.7;以及
hu11E6A 1.3±0.2。
如所指示,人源化hu11E6和hu1B7抗体对百日咳毒素蛋白表现出可比得上或优于鼠抗体的高亲和力。
图8示出竞争性ELISA测定的结果,所述测定测定人源化hu1B7和hu11E6抗体的结合亲和力。相较于在合作研究机构(CRO)产生的那些抗体制剂,对在学术研究实验室产生的抗体制剂测定解离常数。对于ELISA,百日咳毒素蛋白用于包被,而抗人Fc-HRP用作第二抗体。TMB(3,3’,5,5’–四甲基联苯胺)用作底物。
获得以下Kd(nM)数据:
研究实验室hu1B7A=1.7±0.2;
CRO hu1B7A 2.6±0.1;
研究实验室hu11E6A 10.7±0.3;以及
CRO hu11E6A 11.3±0.4。
还通过BIAcore测量人源化hu1B7和hu11E6抗体的结合亲和力,并且获得如在表1中所示的以下Kd数据。
表1
进行CHO细胞体外保护测定以比较人源化hu1B7和hu11E6抗体的中和活性。由两个不同的技术人员进行测定(参见图9)。具体地说,所述测定测量所述抗体中和百日咳毒素蛋白的能力。如在图9中所示,人源化和小鼠抗体在中和百日咳毒素蛋白方面是可媲美的。
通过混合人源化11E6和1B7抗体来制备所述抗体的混合物,并且在4℃下储存1分钟、1小时和22小时。使用如先前所述的ELISA测定来评估百日咳毒素蛋白的混合物的结合能力(参见图10)。获得以下EC50(nM)数据:
1分钟=0.12±0.02;
1小时=0.10±0.01;以及
22小时=0.17±0.07。
如由EC50数据所证明,在作为混合物储存时在人源化hu1B7抗体与人源化hu11E6抗体之间不存在将干扰其对百日咳毒素蛋白的结合亲和力的明显不利相互作用。
以下表2总结相较于鼠m1B7抗体,人源化hu1B7抗体的药代动力学(PK)分析。
表2
从PK分析,确定5ug的鼠m1B7抗体完全保护感染百日咳博德特氏杆菌的小鼠,并且具有约210小时的消除半衰期。相比之下,20ug的人源化hu1B7具有约89小时的消除半衰期(参见图11)并且在7天中具有类似的血液浓度。因此,20ug剂量的人源化hu1B7抗体预期以与5ug剂量的鼠m1B7抗体类似的方式保护感染的小鼠。此外,如在图10中所示,人源化11E6抗体具有约128小时的消除半衰期,而两种抗体的混合物具有约76小时的消除半衰期。
进行ELISA测定以测定热量是否影响人源化hu11E6和hu1B7A抗体对百日咳毒素蛋白的结合亲和力(参见图12和13)。如先前所描述进行ELISA测定。具体地说,将50μg/mL的抗体在50℃或在70℃下在PBS中在冰上孵育30分钟,并且在冰上淬灭1分钟。如在图12中所示,人源化hu1B7A抗体在50℃或70℃下加热30分钟之后保持稳定并且不会不可逆转地解折叠。如在图13中所示,人源化hu11E6A抗体在50℃下加热30分钟之后保持稳定,但在70℃下加热之后不可逆转地解折叠。
进行ELISA测定以比较单独人源化hu1B7A或hu11E6A抗体相较于所述两种抗体的混合物的结合亲和力(参见图14)。如先前所描述进行ELISA测定。获得以下EC50(nM)数据:
hu1B7A:0.09±0.01;
hu11E6A:0.61±0.07;以及
hu1B7A与hu11E6A的混合物:0.29±0.07。
实施例6:人源化抗体在治疗小鼠中的百日咳博德特氏杆菌感染中的评估
在小鼠模型中评估了人源化hu1B7和hu11E6抗体在治疗百日咳博德特氏杆菌感染中的功效。
具体地说,将感染百日咳博德特氏杆菌D420菌株的小鼠用人源化hu1B7抗体、人源化hu11E6抗体以及所述两种抗体的混合物进行治疗。随后将感染的小鼠针对其体重和白血细胞计数进行分析。如在图15中所示,用每种人源化抗体单独或组合治疗允许感染的小鼠中比用PBS或用鼠m1B7抗体治疗的那些小鼠更大的体重增加。图16A-16B示出用人源化抗体治疗还在感染后3天和10天时显著减少受感染小鼠的白血细胞计数。
还评定了抗体治疗对细菌肺定殖的作用。具体地说,将小鼠用PBS、P-IVIG、人源化hu1B7抗体、人源化hu11E6抗体或两种抗体的混合物进行治疗。在感染后10天时评估细菌肺定殖。未感染的首次接受试验的小鼠充当基线对照。将受感染小鼠在感染后第10天通过CO2吸入安乐死,并且将呼吸道切除以用于通过在含有40ug/ml头孢氨苄的补充有10%绵羊血(Hemostat Resources)的Regan Lowe琼脂上连续接种来计数。在37℃下5天之后对菌落进行计数。如在图17中所示,用抗体治疗的小鼠相较于未治疗的对照(PBS)或P-IVIG治疗的动物展示细菌定殖的显著降低。对于用单独hu1B7和hu11E6治疗的动物,P<0.05(*);并且对于用hu1B7和11E6的组合治疗的动物,P<0.01(**)。
总之,这些数据支持人源化hu11E6和hu1B7抗体在治疗百日咳博德特氏杆菌感染中的体内功效。
实施例7:人源化抗体在治疗狒狒中的百日咳博德特氏杆菌感染中的评估
在狒狒模型中评估了人源化hu1B7和hu11E6抗体在治疗百日咳博德特氏杆菌感染中的功效。
具体地说,将重量约2-3kg的刚断奶的(6-9月龄)雄性和雌性狒狒(Papio anubus,东非狒狒)通过鼻内施用百日咳博德特氏杆菌D420菌株进行感染并且用人源化hu1B7和人源化hu11E6抗体静脉内治疗。将受感染的狒狒针对疾病的临床病征(例如,咳嗽、重量和温度)、白血细胞技术和/或百日咳博德特氏杆菌的鼻腔携带水平进行分析。
对于百日咳博德特氏杆菌感染,将百日咳博德特氏杆菌菌株D420以109-1010cfu/ml悬浮在PBS中。将1ml经由气管内导管递送至狒狒气管的顶部。将0.5ml经由鼻内导管递送至每个鼻孔的后面。然后将狒狒置于坐姿持续3分钟。对于静脉切开术,经由用蝶形导管静脉穿刺收集<5ml血液并且将血液等分至管中以用于白血细胞测定和血清分离。在整个研究中,将狒狒用肌内注射氯胺酮进行麻醉以用于活动包括抗体输注、百日咳博德特氏杆菌感染、抽血、鼻咽洗液和临床观察。只要可能就将这些活动组合以最小化麻醉剂的使用。
进行了两个研究。在一个中,将三只狒狒各自用6x109CFU的百日咳博德特氏杆菌进行感染。三天之后,将所述动物中的两只用人源化hu1B7和人源化hu11E6抗体进行治疗,并且第三只动物保持未治疗。在感染后三周,未治疗的动物变得垂死且将其安乐死。还将另外两只治疗的动物安乐死。进行了肺切片的组织学评估。在第二研究中,将四只狒狒用4x109CFU的百日咳博德特氏杆菌感染,并且三天之后,将所述动物中的两只用人源化hu1B7和人源化hu11E6抗体两者进行治疗,并且两只动物保持未治疗。经由静脉内注射施用所述抗体,并且各自以20mg/kg的剂量使用。
如在图18A中所示,未治疗的动物发展达到在40,000个细胞/uL以上峰值的白细胞增多。在所述动物中,升高的白细胞计数持续。在感染后三周,所述动物突然变得垂死且将其安乐死。相比之下,治疗的动物中的白细胞计数开始在抗体施用之后两天内减少。所述计数持续下降并且在一周内几乎正常。这些动物保持健康且与未治疗的动物并行杀死。咳嗽计数展示类似的模式(图18B)。对照动物展示从第3天至研究结束咳嗽的快速增加,在5天时达到峰值在超过50次咳嗽/小时。相比之下,两只治疗的动物显示增加的咳嗽达第3天(治疗)。其到第4天时快速下降至零。
通过组织病理学检查评估受感染的狒狒的肺(图19)。在尸体剖检时,未治疗的动物显示具有实变的右肺。所述肺的组织病理学展示严重亚急性至慢性弥散性间质性肺炎,伴随脓肿形成和中度间质纤维化。左肺揭示更中度的间质性肺炎,伴随更少瘢痕形成且无脓肿形成的迹象。还存在中度慢性多病灶组织胸膜炎,伴随脓肿形成区域。相比之下,在实体剖检时,两只治疗的动物的肺是非常正常的。来自一只治疗的动物的右肺的组织病理学切片揭示非常轻微的慢性间质性肺炎,伴随非常轻微的间质纤维化迹象。左肺在外观上是基本上正常的。对于另一治疗的动物,右肺和左肺具有基本上正常的外观,其中唯一发现是支气管相关淋巴组织(BALT)的轻微至中度淋巴样增生。因此,治疗的动物展示严重肺炎的变化,而治疗的动物的肺是正常的或展示非常轻微的肺炎。
评定了受感染的狒狒的白血细胞计数和鼻细菌计数(图20A和20B)。未处理的动物发展达到远高于40,000个细胞/uL的峰值的白细胞增多。在这些动物中,升高的白细胞计数持续并且到第20天时未正常化。相比之下,所述两只处理的动物展示在第3天在抗体治疗时展示升高的白血细胞计数,然而,所述白血细胞计数从未达到在未治疗的动物情况下观察到的水平,并且到第20天时,两只治疗的动物白血细胞计数均返回至正常水平。类似地,鼻洗液中的百日咳博德特氏杆菌细菌细胞计数展示在第3天(治疗)时相似的细菌量。在抗体治疗之后,对于抗体混合物治疗的动物鼻中的细菌水平展示快速下降,而两只对照动物的鼻中的细菌计数到第18天时保持远高于103cfu。
还测量了人源化hu1B7和人源化hu11E6抗体的血清浓度和半衰期。为了测量在静脉内施用20mg/kg的每种抗体之后狒狒血清中人源化1B7和人源化11E6抗体的量,在不同时间点收集血液样品,分离血清,并且血清样品用于抗百日咳毒素(PTx)ELISA中,如先前在实施例4中所描述。具体地说,百日咳毒素蛋白用于包被,而抗人Fc-HRP用作第二抗体。TMB(3,3’,5,5’–四甲基联苯胺)用作所述测定的底物。两只治疗的狒狒用于此分析(即,狒狒#12913和15913)。图21A示出人源化hu1B7和人源化hu11E6抗体的抗体血清浓度,如通过以下等式所计算:
血清浓度=ae-αt+be-βt
图21B示出所述人源化抗体的抗体半衰期。
总之,两种人源化抗体(单独地或组合)减轻小鼠百日咳模型中的重量损失、白细胞增多和肺细菌负载。此外,在狒狒模型中,抗体的组合逆转两只治疗的动物中的疾病病程,从而使它们能够快速恢复正常或接近正常的肺组织学。这些数据支持本发明的人源化抗体作为降低患有百日咳的儿童中的发病率、长期后遗症和死亡率的方式的临床应用。
实施例8:将人源化抗体预防性施用至新生儿
将人源化hu1B7和hu11E6抗体经由肌内注射施用至新生儿以经由被动免疫提供针对百日咳的预防性治疗。由于在生命的头4个月期间百日咳预示着高死亡或严重疾病与长期后遗症的风险,所以在出生时治疗能够在此高风险期和/或直到他们足够大至接收标准百日咳疫苗期间保护儿童。这在发展中国家可能是特别重要的,其中沾染百日咳的风险较高,此疾病每年杀死160,000至300,000名儿童,并且新生儿经在出生时看一次医生。
人源化hu1B7和hu11E6抗体(aka SYN-005)的混合物预期由于其血清半衰期和效力而提供至少四个月的预防。
基于从狒狒研究获得的药代动力学(PK)数据与针对作为对新生儿的预防性治疗施用的其他抗体可获得的数据结合来估计SYN-005的半衰期。具体地说,SYN-005据显示在狒狒中具有11天的β半衰期。
与常规用于预测疫苗功效的世界卫生组织(WHO)的多克隆血清标准相比评定SYN-005的效力。WHO效力是以当量(EU)定量的,并且5EU/ml被认为是人中的保护水平。参见Storsaeter J.等人(1998),Vaccine,16(20):1907-16。具体地说,SYN-005的效力被测定为2EU/ug。此外,在CHO细胞功能测定中,SYN-005的EU显示比WHO多克隆标准的EU效力高大约七倍。具体地,SYN-005中的两种人源化抗体能够中和百日咳毒素,而多克隆环境中的许多PTx结合抗体不会干扰百日咳毒素功能。
因此,SYN-005混合物的保护性血浆水平预期是大于5EU/ml。具体地说,预期SYN-005的40mg/kg肌内剂量将在一个月时提供100-130ug/ml的血清水平且在四个月时提供5ug/ml的血清水平。因为SYN-005具有2EU/ug的效力,所以5ug/ml的血清水平等效于10EU/ml,其是针对预防性治疗的WHO标准所要求的水平的两倍。此外,1EU的SYN-005比1EU的WHO多克隆标准效力高七倍的观察结果提供确保在四个月时正在进行的预防的另外界限。
总之,这些数据表明单剂量的SYN-005将维持高于保护新生儿免于百日咳持续至少四个月所要求的阈值之上的血浆水平。
以引用的方式并入
本文提及的专利文件和科学论文中的每个的全部公开内容出于所有目的以引用的方式并入。
本文所讨论的公布仅为其在本申请的提交日期之前的公开而提供。本文没有任何内容应被解释为承认本发明没有资格先于现有发明的这种公布。
如本文所用,所有标题仅出于组织目的并且并非意图以任何方式限制本公开。任何单独章节的内容可同样适用于所有章节。
等效物
在不脱离本发明的精神或基本特征的情况下,本发明可以其他具体形式来实施。因此,前述实施方案在所有方面都应被视为说明性的,而非是对本文中描述的本发明的限制。
实施方案
实施方案
实施方案1.一种结合百日咳毒素蛋白的人源化1B7抗体,所述人源化1B7抗体包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中所述免疫球蛋白重链可变区包含选自SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6的氨基酸序列;以及所述免疫球蛋白轻链可变区包含选自SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11和SEQ ID NO:12的氨基酸序列。
实施方案2.一种结合百日咳毒素蛋白的人源化1B7抗体,所述人源化1B7抗体包含选自以下各项的免疫球蛋白重链可变区和免疫球蛋白轻链可变区:(a)包含SEQ ID NO:2的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:8的氨基酸序列的免疫球蛋白轻链可变区;(b)包含SEQ ID NO:3的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:9的氨基酸序列的免疫球蛋白轻链可变区;(c)包含SEQ ID NO:4的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:10的氨基酸序列的免疫球蛋白轻链可变区;(d)包含SEQ ID NO:5的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:11的氨基酸序列的免疫球蛋白轻链可变区;以及(e)包含SEQ ID NO:6的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:12的氨基酸序列的免疫球蛋白轻链可变区。
实施方案3.一种结合百日咳毒素蛋白的人源化11E6抗体,所述人源化11E6抗体包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中所述免疫球蛋白重链可变区包含选自SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18的氨基酸序列;以及所述免疫球蛋白轻链可变区包含选自SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23和SEQ ID NO:24的氨基酸序列。
实施方案4.一种结合百日咳毒素蛋白的人源化11E6抗体,所述人源化11E6抗体包含选自以下各项的免疫球蛋白重链可变区和免疫球蛋白轻链可变区:(a)包含SEQ ID NO:14的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:20的氨基酸序列的免疫球蛋白轻链可变区;(b)包含SEQ ID NO:15的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:21的氨基酸序列的免疫球蛋白轻链可变区;(c)包含SEQ ID NO:16的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:22的氨基酸序列的免疫球蛋白轻链可变区;(d)包含SEQ ID NO:17的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:23的氨基酸序列的免疫球蛋白轻链可变区;以及(e)包含SEQ ID NO:18的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:24的氨基酸序列的免疫球蛋白轻链可变区。
实施方案5.如实施方案1或2所述的抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为3nM或更低。
实施方案6.如实施方案3或4所述的抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为12nM或更低。
实施方案7.一种结合百日咳毒素蛋白的人源化1B7抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为3nM或更低。
实施方案8.如实施方案7所述的抗体,其中所述KD是约3nM、或约2nM、或约1nM、或约0.5nM。
实施方案9.一种结合百日咳毒素蛋白的人源化11E6抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为12nM或更低。
实施方案10.如实施方案9所述的抗体,其中所述KD是约12nM、或约10nM、或约8nM、或约6nM、或4nM、或2nM、或约1nM、或约0.5nM。
实施方案11.一种分离的核酸,其包含编码如实施方案1-10中任一项所述的免疫球蛋白重链可变区的核苷酸序列。
实施方案12.一种分离的核酸,其包含编码如实施方案1-10中任一项所述的免疫球蛋白轻链可变区的核苷酸序列。
实施方案13.一种表达载体,其含有如实施方案11所述的核酸。
实施方案14.一种表达载体,其含有如实施方案12所述的核酸。
实施方案15.如实施方案14所述的表达载体,其还包含如实施方案11所述的核酸。
实施方案16.一种宿主细胞,其包含如实施方案13所述的表达载体。
实施方案17.一种宿主细胞,其包含如实施方案14所述的表达载体。
实施方案18.一种宿主细胞,其包含如实施方案15所述的表达载体。
实施方案19.如实施方案17所述的宿主细胞,其还包含如实施方案13所述的表达载体。
实施方案20.一种产生包含免疫球蛋白重链可变区或免疫球蛋白轻链可变区的多肽的方法,所述方法包括:(a)将如实施方案16或17所述的宿主细胞在使得所述宿主细胞表达包含所述免疫球蛋白重链可变区或所述免疫球蛋白轻链可变区的所述多肽的条件下生长;以及(b)纯化包含所述免疫球蛋白重链可变区或所述免疫球蛋白轻链可变区的所述多肽。
实施方案21.一种产生结合百日咳毒素蛋白的抗体的方法,所述方法包括:(a)将如实施方案18或19所述的宿主细胞在使得所述宿主细胞表达包含所述免疫球蛋白重链可变区和/或所述免疫球蛋白轻链可变区的条件下生长,从而产生所述抗体;以及(b)纯化所述抗体。
实施方案22.一种药物组合物,其包含如实施方案1-10中任一项所述的一种或多种抗体和药学上可接受的赋形剂。
实施方案23.如实施方案22所述的药物组合物,其包含如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案24.如实施方案23所述的药物组合物,其中所述组合物被配制为胶体分散系统、大分子复合物、纳米胶囊、微球、珠粒、水包油型乳液、胶束、混合胶束或脂质体。
实施方案25.如实施方案22-24中任一项所述的药物组合物,其中所述组合物被配制用于口服、鼻内、肺部、皮内、经皮、皮下、肌内、腹膜内或静脉内递送。
实施方案26.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者施用如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
实施方案27.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用有效量的如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和有效量的如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案28.如实施方案27所述的方法,其中所述人源化1B7抗体和所述人源化11E6抗体被同时施用至所述患者。
实施方案29.如实施方案27所述的方法,其中所述人源化1B7抗体在将所述人源化11E6抗体施用至所述患者之前施用至所述患者。
实施方案30.如实施方案27所述的方法,其中所述人源化1B7抗体在将所述人源化11E6抗体施用至所述患者之后施用至所述患者。
实施方案31.如实施方案27所述的方法,其中所述人源化1B7抗体和所述人源化11E6抗体的共同施用产生协同作用。
实施方案32.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用如实施方案1-10中任一项所述的至少一种抗体或如实施方案22-25中任一项所述的药物组合物以及抗微生物剂。
实施方案33.如实施方案33所述的方法,其中所述抗微生物剂选自阿奇霉素、克拉霉素、红霉素、三甲氧苄二氨嘧啶-磺胺甲噁唑、罗红霉素、酮内脂、氨苄西林、阿莫西林、四环素、氯霉素、氟喹诺酮以及头孢菌素。
实施方案34.如实施方案26-33中任一项所述的方法,其中所述患者是人。
实施方案35.如实施方案34所述的方法,其中所述人是婴儿。
实施方案36.一种预防先前暴露于百日咳博德特氏杆菌的受试者的百日咳博德特氏杆菌感染的方法,所述方法包括向所述受试者施用有效量的如实施方案1-10中任一项所述的抗体或有效量的如实施方案22-25中任一项所述的药物组合物。
实施方案37.如实施方案26-36中任一项所述的方法,其中所述方法包括降低白血细胞计数。
实施方案38.如实施方案26-37中任一项所述的方法,其中所述方法包括降低咳嗽的持续时间和/或频率。
实施方案39.如实施方案26-38中任一项所述的方法,其中所述方法包括降低鼻咽和/或肺中的百日咳博德特氏杆菌水平。
实施方案40.如实施方案26-39中任一项所述的方法,其中所述百日咳毒素蛋白被中和。
实施方案41.如实施方案40所述的方法,其中所述百日咳毒素蛋白被阻止结合其细胞受体。
实施方案42.如实施方案40所述的方法,其中所述百日咳毒素蛋白被阻止到达细胞胞质。
实施方案43.一种治疗感染副百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者施用有效量的如实施方案1-10中任一项所述的抗体或有效量的如实施方案22-25中任一项所述的药物组合物。
实施方案44.一种治疗感染副百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用有效量的如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和有效量的如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案45.一种预防先前暴露于百日咳博德特氏杆菌的受试者的副百日咳博德特氏杆菌感染的方法,所述方法包括向所述受试者施用有效量的如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
P1实施方案:
实施方案1.一种结合百日咳毒素蛋白的人源化1B7抗体,所述人源化1B7抗体包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中所述免疫球蛋白重链可变区包含选自SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6的氨基酸序列;以及所述免疫球蛋白轻链可变区包含选自SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11和SEQ ID NO:12的氨基酸序列。
实施方案2.一种结合百日咳毒素蛋白的人源化1B7抗体,所述人源化1B7抗体包含选自以下各项的免疫球蛋白重链可变区和免疫球蛋白轻链可变区:(a)包含SEQ ID NO:2的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:8的氨基酸序列的免疫球蛋白轻链可变区;(b)包含SEQ ID NO:3的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:9的氨基酸序列的免疫球蛋白轻链可变区;(c)包含SEQ ID NO:4的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:10的氨基酸序列的免疫球蛋白轻链可变区;(d)包含SEQ ID NO:5的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:11的氨基酸序列的免疫球蛋白轻链可变区;以及(e)包含SEQ ID NO:6的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:12的氨基酸序列的免疫球蛋白轻链可变区。
实施方案3.一种结合百日咳毒素蛋白的人源化11E6抗体,所述人源化11E6抗体包含免疫球蛋白重链可变区和免疫球蛋白轻链可变区,其中所述免疫球蛋白重链可变区包含选自SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17和SEQ ID NO:18的氨基酸序列;并且所述免疫球蛋白轻链可变区包含选自SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23和SEQ ID NO:24的氨基酸序列。
实施方案4.一种结合百日咳毒素蛋白的人源化11E6抗体,所述人源化11E6抗体包含选自以下各项的免疫球蛋白重链可变区和免疫球蛋白轻链可变区:(a)包含SEQ ID NO:14的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:20的氨基酸序列的免疫球蛋白轻链可变区;(b)包含SEQ ID NO:15的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:21的氨基酸序列的免疫球蛋白轻链可变区;(c)包含SEQ ID NO:16的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:22的氨基酸序列的免疫球蛋白轻链可变区;(d)包含SEQ ID NO:17的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:23的氨基酸序列的免疫球蛋白轻链可变区;以及(e)包含SEQ ID NO:18的氨基酸序列的免疫球蛋白重链可变区和包含SEQ ID NO:24的氨基酸序列的免疫球蛋白轻链可变区。
实施方案5.如实施方案1或2所述的抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为3nM或更低。
实施方案6.如实施方案3或4所述的抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为12nM或更低。
实施方案7.一种结合百日咳毒素蛋白的人源化1B7抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为3nM或更低。
实施方案8.如实施方案6所述的抗体,其中所述KD是约3nM、或约2nM、或约1nM、或约0.5nM。
实施方案9.一种结合百日咳毒素蛋白的人源化11E6抗体,其中所述抗体结合所述百日咳毒素蛋白的KD为12nM或更低。
实施方案10.如实施方案9所述的抗体,其中所述KD是约12nM、或约10nM、或约8nM、或约6nM、或4nM、或2nM、或约1nM、或约0.5nM。
实施方案11.一种分离的核酸,其包含编码如实施方案1-10中任一项所述的免疫球蛋白重链可变区的核苷酸序列。
实施方案12.一种分离的核酸,其包含编码如实施方案1-10中任一项所述的免疫球蛋白轻链可变区的核苷酸序列。
实施方案13.一种表达载体,其含有如实施方案11所述的核酸。
实施方案14.一种表达载体,其含有如实施方案12所述的核酸。
实施方案15.如实施方案14所述的表达载体,其还包含如实施方案11所述的核酸。
实施方案16.一种宿主细胞,其包含如实施方案13所述的表达载体。
实施方案17.一种宿主细胞,其包含如实施方案14所述的表达载体。
实施方案18.一种宿主细胞,其包含如实施方案15所述的表达载体。
实施方案19.如实施方案17所述的宿主细胞,其还包含如实施方案13所述的表达载体。
实施方案20.一种产生包含免疫球蛋白重链可变区或免疫球蛋白轻链可变区的多肽的方法,所述方法包括:(a)将如实施方案16或17所述的宿主细胞在使得所述宿主细胞表达包含所述免疫球蛋白重链可变区或所述免疫球蛋白轻链可变区的所述多肽的条件下生长;以及(b)纯化包含所述免疫球蛋白重链可变区或所述免疫球蛋白轻链可变区的所述多肽。
实施方案21.一种产生结合百日咳毒素蛋白的抗体的方法,所述方法包括:(a)将如实施方案18或19所述的宿主细胞在使得所述宿主细胞表达包含所述免疫球蛋白重链可变区和/或所述免疫球蛋白轻链可变区的条件下生长,从而产生所述抗体;以及(b)纯化所述抗体。
实施方案22.一种药物组合物,其包含如实施方案1-10中任一项所述的抗体和药学上可接受的赋形剂。
实施方案23.如实施方案22所述的药物组合物,其包含如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案24.如实施方案23所述的药物组合物,其中所述组合物被配制为胶体分散系统、大分子复合物、纳米胶囊、微球、珠粒、水包油型乳液、胶束、混合胶束或脂质体。
实施方案25.如实施方案22-24中任一项所述的药物组合物,其中所述组合物被配制用于口服、鼻内、肺部、皮内、经皮、皮下、肌内、腹膜内或静脉内递送。
实施方案26.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者施用如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
实施方案27.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案28.如实施方案27所述的方法,其中所述人源化1B7抗体和所述人源化11E6抗体被同时施用至所述患者。
实施方案29.如实施方案27所述的方法,其中所述人源化1B7抗体在将所述人源化11E6抗体施用至所述患者之前施用至所述患者。
实施方案30.如实施方案27所述的方法,其中所述人源化1B7抗体在将所述人源化11E6抗体施用至所述患者之后施用至所述患者。
实施方案31.如实施方案27所述的方法,其中所述人源化1B7抗体和所述人源化11E6抗体的共同施用产生协同作用。
实施方案32.一种治疗感染百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用如实施方案1-10中任一项所述的至少一种抗体或如实施方案22-25中任一项所述的药物组合物以及抗微生物剂。
实施方案33.如实施方案33所述的方法,其中所述抗微生物剂选自阿奇霉素、克拉霉素、红霉素、三甲氧苄二氨嘧啶-磺胺甲噁唑、罗红霉素、酮内脂、氨苄西林、阿莫西林、四环素、氯霉素、氟喹诺酮以及头孢菌素。
实施方案34.如实施方案26-33中任一项所述的方法,其中所述患者是人。
实施方案35.如实施方案34所述的方法,其中所述人是婴儿。
实施方案36.一种预防先前暴露于百日咳博德特氏杆菌的受试者的百日咳博德特氏杆菌感染的方法,所述方法包括向所述受试者施用如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
实施方案37.如实施方案26-36中任一项所述的方法,其中所述方法包括降低白血细胞计数。
实施方案38.如实施方案26-37中任一项所述的方法,其中所述方法包括降低咳嗽的持续时间和/或频率。
实施方案39.如实施方案26-38中任一项所述的方法,其中所述方法包括降低鼻咽和/或肺中的百日咳博德特氏杆菌水平。
实施方案40.如实施方案26-39中任一项所述的方法,其中所述百日咳毒素蛋白被中和。
实施方案41.如实施方案40所述的方法,其中所述百日咳毒素蛋白被阻止结合其细胞受体。
实施方案42.如实施方案40所述的方法,其中所述百日咳毒素蛋白被阻止到达细胞胞质。
实施方案43.一种治疗感染副百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者施用如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
实施方案44.一种治疗感染副百日咳博德特氏杆菌的患者的方法,所述方法包括向所述患者共同施用如实施方案1、2、5、7或8中任一项所述的人源化1B7抗体和如实施方案3、4、6、9或10中任一项所述的人源化11E6抗体。
实施方案45.一种预防先前暴露于百日咳博德特氏杆菌的受试者的副百日咳博德特氏杆菌感染的方法,所述方法包括向所述受试者施用如实施方案1-10中任一项所述的抗体或如实施方案22-25中任一项所述的药物组合物。
实施方案46.一种组合物,其如本文所公开。
实施方案47.如本文所述的任一组合物用于以下中的一种或多种的用途:治疗百日咳和制造用于治疗百日咳的药剂。
- 还没有人留言评论。精彩留言会获得点赞!