用于应用产油酵母从生物质产生脂质的方法与流程
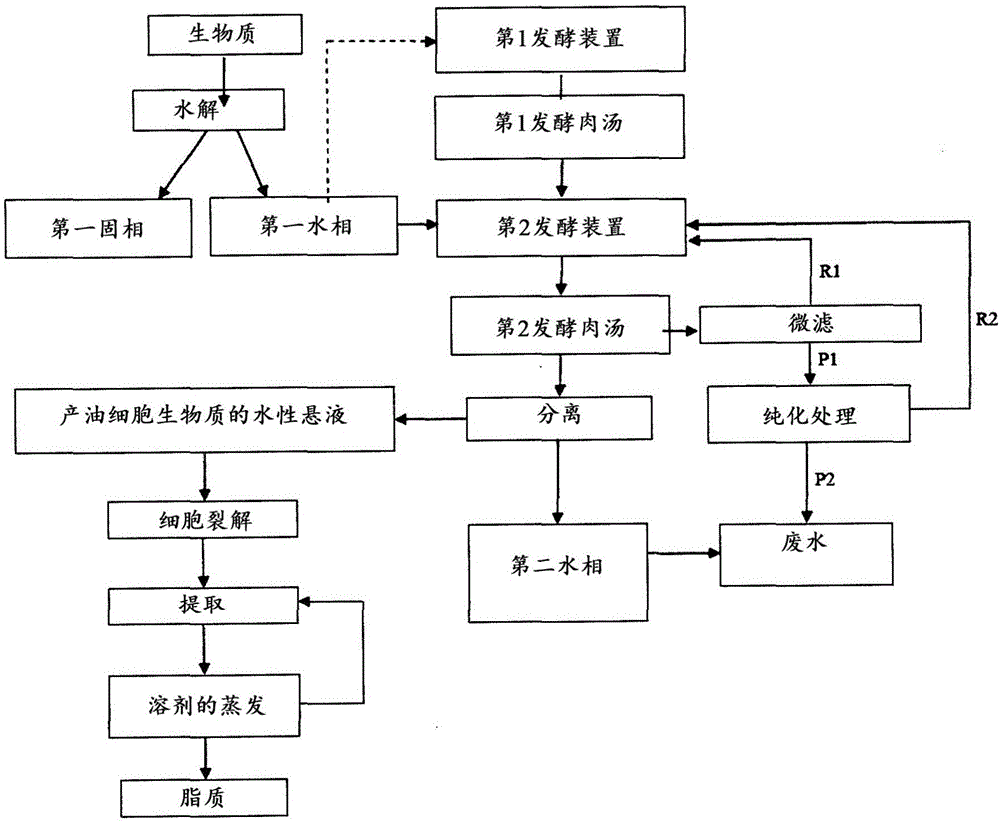
本发明涉及一种用于从包含至少一种多糖的生物质产生脂质的方法。
更特别地,本发明涉及一种用于从包含至少一种多糖的生物质产生脂质的方法,所述方法包括使所述包含至少一种多糖的生物质经历水解,以获得包含第一固相和第一水相的混合物;在第一发酵装置中制备包含至少一种产油微生物的接种物,以获得第一发酵肉汤;将所述第一水相和所述第一发酵肉汤进料至第二发酵装置,以获得第二发酵肉汤;使所述第二发酵肉汤的至少一部分经历微滤,以获得第一滞留物和第一渗透物(permeate);将所述第一滞留物进料至所述第二发酵装置;使所述第一渗透物经历纯化处理,以获得第二渗透物和第二滞留物;将所述第二滞留物进料至所述第二发酵装置;在所述发酵结束时,使所述第二发酵肉汤经历分离,以获得包含脂质的产油细胞生物质的水性悬液和第二水相;其中所述微滤和所述纯化处理在所述发酵期间连续地进行。
如此获得的脂质可有利地用于产生生物燃料,诸如,例如,生物柴油或绿色柴油,该生物燃料可原样使用或与用于机动车辆的其他燃料混合使用。
通常,生物质被定义为可用于能量目的的有机、植物或动物来源的任何物质,例如,作为用于产生生物燃料和/或生物可燃物(biocombustibles)的原料或者产生可被添加至燃料和/或至生物可燃物的组分的原料。因此,生物质可充当可再生能源的来源,作为常规地用于产生燃料和/或可燃物的化石来源的传统原料的替代物。出于该目的,木质纤维素生物质是特别有用的。
从生物质,特别地从木质纤维素生物质产生糖是本领域已知的。
木质纤维素生物质为包含三种主要组分的复杂结构:纤维素、半纤维素和木质素。其相对量依据所使用的生物质的类型而改变。例如,在植物中,所述量依据植物的物种和年龄而变化。
纤维素是木质纤维素生物质的主要成分,并且通常以基于木质纤维素生物质的总重量,范围从按重量计30%至按重量计60%的量存在。纤维素由通过β-1,4-糖苷键连接在一起的葡萄糖分子(大约500个至10000个单元)组成。链之间的氢键的形成导致产生植物纤维强度和韧性的结晶结构域的形成。在自然界中,它仅以纯的形式出现于一年生植物诸如棉花和亚麻中,而在木本植物中它总是伴随着半纤维素和木质素。
通常以基于木质纤维素生物质的总重量,范围从按重量计10%至按重量计40%的量存在的半纤维素呈相对短的(10个至200个分子)且分支的,由具有六个碳原子的糖(葡萄糖、甘露糖、半乳糖)和由具有五个碳原子的糖(木糖、阿拉伯糖)两者形成的混合聚合物的形式。所述植物纤维的一些重要性能归因于半纤维素的存在,其中主要是促进所述植物纤维在水存在时吸入导致它们膨胀的性能。半纤维素还显示出粘合性能,并且因此趋向于粘结或呈现角状物样(horn-like)的稠度,其结果是所述植物纤维变得僵硬且吸收更慢。
木质素通常以基于木质纤维素生物质的总重量,范围从按重量计10%至按重量计30%的量存在。其主要功能是结合多种植物纤维并将多种植物纤维粘结在一起,以便获得植物紧密度和强度,并且它还形成针对昆虫、病原体、损伤和紫外光的保护。它主要用作可燃物,但目前还广泛地在工业中用作用于塑性材料层压板、箱和橡胶制品的分散剂、硬化剂、乳化剂。此外,它也可经化学处理,以产生芳族化合物,诸如可用于药物化学或化妆品和食品工业中的香草醛、丁香醛、对羟基苯甲醛。
为改进用于能量用途的产品中的木质纤维素生物质的转化,使所述木质纤维素生物质经历初步处理以分离木质素并将纤维素和半纤维素水解为简单的糖诸如葡萄糖和木糖是已知的。然后,所述糖可用作在微生物的存在下的发酵过程中的碳的来源,用于产生醇和/或脂质。
例如,国际专利申请WO 2009/108773描述了一种用于预处理木质纤维素生物质的方法,所述方法包括:在第一加压反应器中预处理木质纤维素生物质,其中木质纤维素生物质经历水解;从所述第一加压反应器中排出木质纤维素生物质并将它运送至具有与所述第一加压反应器的排出口连接的第一加压偶联器的加压密封装置;通过将蒸汽注入进所述第一加压反应器保持所述第一加压反应器中的汽相,其中注入的蒸汽向木质纤维素生物质提供热能;在所述第一加压反应器或所述加压密封装置的下游区域洗涤木质纤维素生物质;排出液体,该液体包含从来自所述第一加压反应器或来自所述加压密封装置的木质纤维素生物质中提取的溶解的半纤维素;通过第二加压偶联器将木质纤维素生物质从加压密封装置排出至第二加压反应器,其中木质纤维素生物质被保持在比第一加压反应器的压力高的压力下;在所述第二加压反应器中,通过将蒸汽或水蒸汽注入进所述第二加压反应器中用蒸汽或水蒸汽灌注木质纤维素生物质的细胞;快速释放施加至用水灌注的木质纤维素生物质中的压力,以使在木质纤维素生物质的细胞中的蒸汽喷发并纯化木质纤维素生物质。所述方法使获得可被用于产生醇(例如,乙醇)的糖成为可能。
国际专利申请WO 2012/042544描述了一种包含固体、液体的生物质的组合物,C5糖的量基于阿拉伯聚糖(arabinans)和木聚糖的量,且阿拉伯糖和木糖的单体、二聚体、低聚物和聚合物包含在组合物的液体和固体中,C6糖的量基于葡聚糖的量,包括包含在组合物的液体和固体中的葡聚糖的单体、二聚体、低聚物和聚合物及糠醛,其中组合物被进一步表征为具有至少30%的24小时水解酶可及性。所述组合物通过蒸汽喷发来获得。在酶促水解之后获得的糖可被用于产生乙醇。
国际专利申请WO 2009/063138描述了一种从包含多糖的有机材料产生脂质或脂质混合物的方法,所述多糖选自包括纤维素、半纤维素、淀粉、这些的全部、其混合物或其降解产物或者非淀粉多糖的组,其特征在于,包括:(a)用选自包括以下的组的物质处理有机材料:(i)水、(ii)酸和(iii)碱,以及随后分离获得的沉淀物和滤液,并且使从所述处理获得的沉淀物本身或在水、酸或碱的存在下经历机械或热机械研磨,并分离沉淀物和滤液,且可选地,使沉淀物再次经历一次或更多次的部分(i)、(ii)或(iii)和/或研磨的任一个的处理,以及(b)使产生脂质的微生物与如此获得的滤液或与多种获得的滤液或与沉淀物或与其任何组合以及任选地与有机材料在培养基中接触,从而微生物细胞开始产生脂质,以及(c)回收脂质。通过所述方法获得的脂质可被用于产生生物燃料。
国际专利申请WO 2010/149859描述了一种用于生产脂肪的方法,其特征在于该方法包括以下步骤:在从由单细胞产油过程获得的单细胞团块回收脂肪之前或之后或与从由单细胞产油过程获得的单细胞团块回收脂肪一起,在培养基中,使通过分离获得的液相或剩余细胞团块或其混合物或其任一种级分或任何多种级分与能够产生脂肪的微生物接触,并且允许该微生物产生脂肪,和/或,在培养基中,使从单细胞产油过程获得的单细胞悬液或细胞团块或从所述过程获得的液相或以其他方式获得的微生物细胞悬液、以所述其他方式获得的细胞团块或液相、或以该方式获得的其混合物或一种级分或多种级分与能够产生脂肪的微生物接触,并允许该生物体产生脂肪,以及回收所得的脂肪或使微生物团块经历单细胞产油过程。通过所述方法获得的脂肪可被用于产生生物燃料。
美国专利申请US 2008/0102176描述了一种用于提取植物脂肪的方法,该方法包括:将含纤维素的原料粉化为1-2mm直径的多个颗粒;在1%-2%浓度的硫酸中浸渍颗粒,以使所述颗粒酸化用于增强水解,并将pH值调整至4.5±0.5;从硫酸中取出酸化颗粒,并将纤维素酶和产油酵母依次添加至酸化的颗粒,并且在25℃-30℃的温度和85%-90%的湿度发酵8-9天;将脂族烃作为溶剂添加进发酵产物中以提取脂肪,从而获得提取混合物;并且去除保留在提取混合物中的酸化颗粒,并通过蒸馏分离脂肪与溶剂,以从而获得原料油。优选地,纤维素酶从绿色木霉(Trichoderma viride)获得且产油酵母是粘红酵母(Rhodotorula glutinis)。在酯化之后,获得的脂肪可被转化为生物柴油。
Dai等在公布于“African Journal of Biotechnology”(2007),第6(18)卷,2130-2134页的文章“Biodiesel generation from oleaginous yeast Rhodotorula glutinis with xylose assimilating capacity”中描述了从产油酵母产生生物柴油。在该文章中,木质纤维素生物质被研磨并在硫酸的存在下经历酸解。如此获得的糖被用作在预先选择的粘红酵母菌株(还能够使用戊糖,特别地木糖)的存在下的发酵过程中的碳源,以获得油,该油随后通过索氏提取提取并经历转酯来获得生物柴油。
国际专利申请WO 2010/046051描述了一种用于从包含至少一种多糖的生物质产生脂质的方法,该方法包括:
-在范围从80℃至160℃的温度,在具有C7至C20碳原子,优选地从C9至C15碳原子的至少一种有机酸的水性溶液的存在下,使所述生物质经历酸解,获得包含第一固相和第一水相的第一混合物,
-使所述第一混合物经历酶促水解,获得包含第二固相和第二水相的第二混合物,
-使所述第二水相在至少一种产油酵母的存在下经历发酵,获得包含脂质的产油细胞生物质。
如此获得的脂质可有利地用于产生生物柴油或绿色柴油,该生物柴油或绿色柴油可原样使用或与用于机动车辆的其他燃料混合使用。
国际专利申请WO 2012/052368描述了一种用于从包含至少一种多糖的生物质产生脂质的方法,该方法包括:
-使所述包含至少一种多糖的生物质经历酸解,获得包含第一固相和第一水相的第一混合物;
-在至少一种产油酵母的存在下,将所述第一水相进料至发酵装置,获得包含第一产油细胞生物质的第一发酵肉汤;
-使所述第一固相经历酸解或酶促水解,获得包含第二固相和第二水相的第二混合物;
-在所述第一发酵肉汤的存在下,将所述第二水相进料至所述发酵装置,获得包含第二产油细胞生物质(包含脂质)的第二发酵肉汤;
-使所述第二发酵肉汤的至少一部分经历微滤,获得滞留物和渗透物;
-将所述滞留物进料至所述发酵装置。
如此获得的脂质可有利地用于产生生物柴油或绿色柴油,该生物柴油或绿色柴油可原样使用或与用于机动车辆的其他燃料混合使用。
意大利专利申请MI2012A002249描述了一种用于从包含至少一种多糖的生物质产生脂质的方法,该方法包括:
-使所述包含至少一种多糖的生物质经历水解,以获得包含第一固相和第一水相的混合物;
-在第一发酵装置中制备包含至少一种产油微生物的接种物,以获得第一发酵肉汤;
-将所述第一水相和所述第一发酵肉汤进料至第二发酵装置,以获得第二发酵肉汤;
-使所述第二发酵肉汤经历分离,以获得包含脂质的产油细胞生物质的水性悬液和第二水相;
-使所述第二水相经历反相渗透,以获得渗透物和滞留物;
-将所述滞留物进料至所述第一发酵装置或至所述第二发酵装置,优选地至所述第一发酵装置。
如此获得的脂质可有利地用于产生生物柴油或绿色柴油,该生物柴油或绿色柴油可原样使用或与用于机动车辆的其他燃料混合使用。
由于减少用于从生物质产生脂质的工艺成本有重要意义,特别地如果所述脂质随后被用于产生生物燃料,诸如生物柴油或绿色柴油(因为所述生物燃料正与具有较低成本的化石燃料竞争),能够减少所述成本以及改进脂质产率的新方法的研究仍是最感兴趣的。
因此,本申请人已面临发现用于产生可用于产生生物燃料,诸如生物柴油或绿色柴油的脂质、能够减少工艺成本以及改进脂质产率的方法的问题。
本申请人现已发现从包含至少一种多糖的生物质产生脂质可有利地通过这样的方法实施,所述方法包括使所述包含至少一种多糖的生物质经历水解以获得包含第一固相和第一水相的混合物;在第一发酵装置中制备包含至少一种产油微生物的接种物以获得第一发酵肉汤;将所述第一水相和所述第一发酵肉汤进料至第二发酵装置以获得第二发酵肉汤;使所述第二发酵肉汤的至少一部分经历微滤以获得第一滞留物和第一渗透物;将所述第一滞留物进料至所述第二发酵装置;使所述第一渗透物经历纯化处理以获得第二渗透物和第二滞留物;将所述第二滞留物进料至所述第二发酵装置;在所述发酵结束时,使所述第二发酵肉汤经历分离以获得包含脂质的产油细胞生物质的水性悬液和第二水相;其中所述微滤和所述纯化处理在所述发酵期间连续地进行。
该过程导致许多优势。例如,由于所述微滤和所述纯化处理在所述发酵期间连续地进行,所述方法使以下成为可能:
-保持所述第二发酵肉汤在所述第二发酵装置中的体积恒定,并增加产油细胞生物质在所述第二发酵肉汤中的浓度;
-从所述第二发酵肉汤取一部分水(即第一渗透物)以去除热量(即,在发酵温度的流被取出且低温流被进料至发酵器);
-用于所述发酵的糖溶液比正常的和以更低成本可用的更稀;
-回收在发酵中使用的、被包含在所述第一渗透物中的糖以及其他有机物质和无机物质(例如,硝酸盐、磷酸盐),并将它们再循环至发酵(即,第二滞留物),得到较低的工艺成本;
-使用具有较高含量的可充当在发酵中常规使用的微生物的生长抑制剂的毒性化合物,诸如糠醛(F),5-羟甲基糠醛(HMF)的木质纤维素水解产物(即第一水相),并因此不必特别注意生物质水解方法;
-在所述发酵结束时以较低体积工作;
-获得增加的产率的脂质[例如,大于或等于基于用于发酵使用的糖的总量的25%的脂质产率,所述脂质产率被计算为每克用于发酵使用的糖获得的脂质的克数]。
所述脂质可有利地用于产生生物燃料,诸如,生物柴油或绿色柴油,该生物燃料可原样使用或与用于机动车辆的其他燃料混合使用。
因此,本发明涉及一种用于从包含至少一种多糖的生物质产生脂质的方法,所述方法包括:
-使所述包含至少一种多糖的生物质经历水解,以获得包含第一固相和第一水相的混合物;
-在第一发酵装置中制备包含至少一种产油微生物的接种物,以获得第一发酵肉汤;
-将所述第一水相和所述第一发酵肉汤进料至第二发酵装置,以获得第二发酵肉汤;
-使所述第二发酵肉汤的至少一部分经历微滤,以获得第一滞留物和第一渗透物;
-将所述第一滞留物进料至所述第二发酵装置;
-使所述第一渗透物经历纯化处理,以获得第二渗透物和第二滞留物;
-将所述第二滞留物进料至所述第二发酵装置;
-在所述发酵结束时,使所述第二发酵肉汤经历分离,以获得包含脂质的产油细胞生物质的水性悬液和第二水相;
其中所述微滤和所述纯化处理在所述发酵期间连续地进行。
出于本说明书和以下权利要求书的目的,数值范围的定义总是包括端点,除非另有说明。
出于本说明书和以下权利要求书的目的,术语“包含(comprising)”还包括术语“其基本上由...组成(which essentially consists of)”或“其由...组成(which consists of)”。
在本发明的一个优选的实施方案中,所述多糖可选自纤维素、半纤维素或其混合物。纤维素或纤维素和半纤维素的混合物是特别优选的。
在本发明的一个另外优选的实施方案中,所述包含至少一种多糖的生物质为木质纤维素生物质。如以上陈述的,木质纤维素生物质包含三种组分:半纤维素、纤维素和木质素。
优选地,所述木质纤维素生物质可选自,例如:
-来源于用于能量用途专门栽培的农作物,诸如芒属(miscanthus)、柳枝稷(switchgrass)、芦苇(common reed)的产物,包括来自所述产物或来自它们的加工的剩余物(scrap)、残余物(residue)及废料;
-来源于农产品,诸如乳蓟、银胶菊、玉米、大豆、棉花、亚麻籽、油菜籽、甘蔗、棕榈油的产物,包括来源于所述产物或来自它们的加工的剩余物、残余物及废料;
-来源于林业或造林的产物,包括来自所述产物或来自它们的加工的剩余物、残余物及废料;
-旨在用于人类营养或畜牧的食品和农产品的剩余物;
-来自造纸工业的非化学处理的残余物;
-来自城市固体废弃物(诸如城市植物废弃物、纸)的分类收集的废料;
-藻类,诸如大型藻类或微藻类,特别地大型藻类。
优选地,所述包含至少一种多糖的生物质可选自蓟、银胶菊,包括来自所述蓟或所述银胶菊或来自它们的加工的剩余物、残余物及废料。
在本发明的一个优选的实施方案中,在经历所述水解之前,所述包含至少一种多糖的生物质可经历研磨的初步程序。优选地,所述包含至少一种多糖的生物质可被研磨,以获得具有以下直径的颗粒:范围从0.1mm至10mm,更优选地范围从0.5mm至4mm。具有小于1mm直径的颗粒是特别优选的。
出于本发明的目的,包含至少一种多糖的生物质的水解可通过本领域已知的任何方法来进行。所述方法的非限制性实例为:
-称为“蒸汽喷发”的热处理,随后是酶促水解,如在例如,前述国际专利申请WO 2012/042544中所描述的;
-在稀酸,例如稀硫酸的存在下的处理,随后是酶促水解,如在例如,由Humbrid D.等在“Technical Report Nrel/Tp-5100-47764”(May 2011)中所描述的,;
-在有机酸,例如2-萘磺酸的存在下的处理,随后是酶促水解,如在,例如,前述国际专利申请WO 2010/046051中所描述的。
所述酶促水解可通过本领域已知的方法来进行,如描述于,例如,美国专利US 5,628,830、US 5,916,780、US 6,090,595中的,使用商购可得的酶,诸如例如,单独或混合在一起使用的Celluclast 1.5L(Novozymes)、Econase CE(Rohm Enzymes)、Spezyme(Genecor)、Novozym 188(Novozymes)。
所述水解产生包含固相和水相的混合物。所述混合物经历过滤或离心,以获得第一固相和第一水相。
所述第一固相包含木质素,且所述第一水相包含具有5个至6个碳原子的至少一种糖,更优选地木糖和葡萄糖。
在水解之后获得的糖的量可通过本领域已知的技术,诸如,例如,高效液相色谱法(HPLC)或离子交换层析来确定。
在本发明的一个优选的实施方案中,所述水相可包含:
-大于或等于50g/l,优选地大于或等于100g/l,最多至葡萄糖在所述第一水相中的溶解度极限的量的葡萄糖;
-0g/l至200g/l,优选地10g/l至100g/l的量的木糖;
-0g/l至20g/l,优选地5g/l至10g/l的量的阿拉伯糖;
-0g/l至20g/l,优选地2g/l至10g/l的量的甘露糖;
-0g/l至10g/l,优选地2g/l至8g/l的量的半乳糖;
-0g/l至8g/l,优选地0g/l至5g/l的量的乙酸;
-0g/l至2.5g/l,优选地0.1g/l至1.5g/l的量的糠醛(F);
-0g/l至4.5g/l,优选地0.2g/l至3.5g/l的量的5-羟甲基糠醛(HMF)。
然而,应该注意,根据本发明的方法,使得使用比正常使用的量大得多的量的毒性化合物,即糠醛(F)和5-羟甲基糠醛(HMF)的使用量成为可能,即,使得采用范围从0.1g/l至1.5g/l的量的糠醛(F)和范围从0.2g/l至3.5g/l的量的5-羟甲基糠醛(HMF)成为可能。
为获得所述接种物,除了至少一种产油微生物以外,包含大于或等于40g/l,优选地范围从45g/l至60g/l的量的糖的至少一种水性溶液必须被添加至所述第一发酵装置。
在本发明的一个优选的实施方案中,在所述第一发酵装置中,发酵可在范围从20℃至40℃,优选地范围从25℃至35℃的温度下进行。
在本发明的一个优选的实施方案中,在所述第一发酵装置中,发酵可被进行持续范围从10小时至36小时,优选地范围从12小时至26小时的时间。
在本发明的一个优选的实施方案中,在所述第一发酵装置中,发酵可在范围从4.5至7,优选地范围从5至6.7的pH下进行。为了保持pH在期望的范围内,至少一种无机碱或者至少一种无机酸的水性溶液,可以以诸如获得期望的pH的量被添加至用于发酵的培养基,所述无机碱诸如,例如,氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁或其混合物,优选地氢氧化钾,所述无机酸诸如,例如,磷酸、硫酸、盐酸或其混合物。
应该注意,在根据本发明的方法中,包含大于或等于40g/l,优选地范围从45g/l至60g/l的量的糖的所述水性溶液可以是从水解包含至少一种多糖的生物质获得的、任选地被稀释以具有期望的量的糖的第一水相的等分试样。
当产油微生物已达到大于或等于8g/l,优选地范围从10g/l至25g/l的浓度时,所述第一发酵肉汤按照根据本发明的方法被进料至第二发酵装置。
在本发明的一个优选的实施方案中,在所述第二发酵装置中,发酵可在范围从20℃至40℃,优选地范围从25℃至35℃的温度下进行。
在本发明的一个优选的实施方案中,在所述第二发酵装置中,发酵可被进行持续范围从2天至10天,优选地范围从3天至8天的时间。
在本发明的一个优选的实施方案中,在所述第二发酵装置中,发酵可在范围从4.5至7,优选地范围从5至6.7的pH下进行。为了保持pH在期望的范围内,至少一种无机碱或者至少一种无机酸的水性溶液,可以以诸如获得期望的pH的量被添加至用于发酵的培养基,所述无机碱诸如,例如,氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁或其混合物,优选地氢氧化钾,所述无机酸诸如,例如,磷酸、硫酸、盐酸或其混合物。
在本发明的一个优选的实施方案中,所述微生物可选自产油酵母,诸如,粘红酵母、正红酵母(Rhodotorula gracilis)、禾本红酵母(Rhodotorula graminis)、Lypomices starkeyi、产油油脂酵母(Lypomices lipofer)、三角酵母(Trigonopsis variabilis)、乳酒假丝酵母(Candida kefyr)、弯假丝酵母(Candida curvata)、解脂假丝酵母(Candida lipolytica)、球拟酵母属物种(Torulopsis sp.)、树干毕赤酵母(Pichia stipitis)、Trichosporon cacaoliposimilis、Trichosporon oleaginosus、芽毛孢子菌(Trichosporon pullulans)、Rhodosporidium azoricum、弯曲隐球菌(Cryptococcus curvatus)。
在本发明的一个优选的实施方案中,在所述第二发酵装置中的发酵可在一个或更多个阶段中,以不连续模式(“分批”)、以半连续模式(“分批进料”)、以连续模式、以灌注模式进行。优选地,在所述第二发酵装置中的发酵以不连续模式(“分批”)先进行3小时-10小时,并且随后以灌注模式进行。
出于本说明书和以下权利要求书的目的,术语“灌注模式”意指在发酵期间,在所述第二发酵装置内,所述第二培养肉汤的体积被保持恒定,同时用于发酵使用的培养基的至少一部分被用来源于纯化处理的第二滞留物连续地更换,如此使细胞生物质在其中变成浓缩的成为可能。所述“灌注模式”通过前述的微滤实施,微滤实际上在发酵期间连续进行。
在是本领域已知的装置的所述第一发酵装置和所述第二发酵装置中,发酵在出于该目的常规使用的培养基的存在下进行,该培养基包含,除了糖以外的多种营养素,诸如,例如,氮、磷酸钾、镁、盐、维生素、微量元素。
为了增加脂质产率,可添加玉米浆液体至所述第二发酵装置。
在本发明的一个优选的实施方案中,所述方法还包括将玉米浆液体以范围从2g/l至20g/l,优选地范围从4g/l至18g/l的量添加至所述第二发酵装置。可在所述第一水相进料期间和在所述第一水相进料之后均添加所述玉米浆液体。
在本发明的一个优选的实施方案中,所述微滤可在产油细胞生物质的指数(或对数)生长阶段期间进行。
出于本说明书和以下权利要求书的目的,术语“指数(或对数)生长阶段”意指这样的阶段,在该阶段中在发酵中使用的产油微生物以通过所述产油微生物的遗传特性和通过环境因素(例如,温度、培养基的组成)两者确定的恒定速度(对应于最大繁殖速度)繁殖。例如,对于在下文实例中使用的产油微生物,即Rhodosporidium azoricum RGRDP3,指数生长期范围从3小时至10小时。
在本发明的一个优选的实施方案中,所述微滤可通过具有范围从0.02μm至2.0μm,优选地范围从0.1μm至0.8μm的平均孔体积的膜来进行。
在本发明的一个优选的实施方案中,所述微滤可应用范围从0.05巴至2.5巴,优选地范围从0.1巴至2.2巴的跨膜压力(TMP)来进行。
所述跨膜压力(TMP)按照以下公式来计算:
TMP=0.5*(P1+P2)-P3
其中:
P1=产油细胞生物质的水性悬液对膜的输入侧的压力;
P2=产油细胞生物质的水性悬液在膜的输出侧的压力;
P3=渗透物的压力。
应该注意,出于本发明的目的,所述跨膜压力(TMP)可使用泵,例如蠕动泵来获得,当应用至渗透物输出下游的微滤设备时,泵降低膜的输出侧的压力,产生生成渗透物流量的正跨膜压力(TMP)。
在本发明的一个优选的实施方案中,所述微滤可执行在范围从0.2kg/(m2x h)至70kg/(m2x h),更优选地范围从0.4kg/(m2x h)至50kg/(m2x h)的特定流量(每小时每平方米的微滤的表面的渗透物kg数)来进行。
在本发明的一个优选的实施方案中,所述微滤可在范围从20℃至40℃,优选地范围从25℃至35℃的温度,更优选地在发酵温度下进行。
在本发明的一个优选的实施方案中,所述微滤可通过浸没的或切向配置(“交叉流”)的平板或中空纤维聚合膜或通过浸没的或切向配置(“交叉流”)的或旋转配置(“动态交叉流”)的陶瓷膜来实施。
可用于本发明的目的且商购可得的膜的实例为来自Sartorius的“Microfiltration Cassettes”、来自Tami的Ceram产品、来自Pall的SchumasivTM或产品或者来自Asahi Kasei Corporation的Microza产品。
出于本发明和以下权利要求书的目的,术语“第一滞留物”意指包含来源于所述第二发酵肉汤的至少一部分的微滤的浓缩的产油细胞生物质的水性悬液。
出于本发明和以下权利要求书的目的,术语“第一渗透物”意指包含来自所述第二发酵肉汤的至少一部分的微滤的糖以及其他有机物质和无机物质(例如,硝酸盐、磷酸盐)的水性流。
在本发明的一个优选的实施方案中,所述纯化处理可通过反相渗透或通过蒸发实施。
在本发明的一个优选的实施方案中,所述反相渗透在至少一种聚合膜的存在下进行,所述至少一种聚合膜选自:通常用于脱盐的聚合膜(通常称为“海水膜”或“微咸水膜”)诸如,例如:包含聚酰胺、聚酰亚胺、聚砜、聚醚砜的膜。优选地,所述聚合膜选自包含聚酰胺的聚合膜。
在本发明的一个优选的实施方案中,所述聚合膜可具有范围从15℃至90℃,优选地范围从20℃至80℃,又更优选地范围从20℃至发酵温度的最大操作温度。
在本发明的一个优选的实施方案中,所述聚合膜可具有范围从5巴至80巴,优选地范围从10巴至70巴的最大操作压力。
在本发明的一个优选的实施方案中,所述聚合膜可具有范围从30道尔顿至200道尔顿,优选地范围从40道尔顿至100道尔顿的截留分子量(MWCO)。
在本发明的一个优选的实施方案中,所述聚合膜可选自具有这样的操作pH的那些:所述操作pH与第一渗透物的pH兼容,优选地范围从1至13,更优选地范围从2至11,甚至更优选地范围从3.5至7.5。
可用于本发明的目的且商购可得的聚合膜的实例为来自Dow Chemical的系列SW30、系列BW30或系列BW30LE的DowTM FilmtecTM产品,或者来自General Electric的系列AG的DesalTM产品,或者来自Koch Membrane Systems的产品。
前述的聚合膜可呈平面圆盘、管式膜、螺旋模块膜、薄膜复合(TFC)膜的形式或呈其他有用的形式。
在本发明的一个优选的实施方案中,所述反相渗透可在进料侧(滞留物侧)应用范围从5巴至80巴,更优选地范围从10巴至40巴的压力来进行。
在本发明的一个优选的实施方案中,所述反相渗透可通过在范围从5kg/(m2x h)至80kg/(m2x h),更优选地范围从10kg/(m2x h)至40kg/(m2x h)的特定流量(每小时每平方米的反相渗透膜的表面的渗透物kg数)下工作来进行。
出于本发明和以下权利要求书的目的,术语“第二滞留物”意指来源于所述第一渗透物的糖以及其他有机物质和无机物质(例如,硝酸盐、磷酸盐)被浓缩的水性流。所述糖被浓缩的水性流优选地包含范围从20g/l至110g/l,更优选地范围从30g/l至100g/l的量的糖。
出于本发明和以下权利要求书的目的,术语“第二渗透物”意指来源于所述第一渗透物的水性流。
在本发明的一个优选的实施方案中,所述蒸发可在范围从30℃至100℃的温度下并在根据该温度而变化且等于在水在该温度下蒸发的压力(蒸汽压)的压力下,优选地在范围从0.04巴至1巴的压力下进行。
应该注意,如果纯化处理通过蒸发来实施,获得相当于所述第二渗透物的纯化的相(蒸发相),和相当于所述第二滞留物的浓缩物。
在发酵结束时,使脂解酶(例如,脂肪酶)灭活,所述第二发酵肉汤可经历热处理。所述热处理可在范围从70℃至120℃,优选地范围从75℃至110℃的温度下进行范围从5分钟至3小时,优选地范围从30分钟至2小时的时间。
在发酵结束时,使第二发酵肉汤经历分离,以回收所述包含脂质的产油细胞生物质的水性悬液(所述产油细胞生物质的水性悬液具有浓度大于在所述第二发酵肉汤中的产油细胞生物质的浓度的产油细胞生物质)和所述第二水相(所述第二水相任选地包含悬浮固体,例如,在发酵中使用的产油微生物的细胞,或特别地来源于在该方法中使用的仪器的变质或来自盐的沉淀),所述分离可通过本领域已知的方法,诸如,例如,过滤、压滤、微滤或超滤、离心来实施。
所述第二渗透物可出于被消除的目的经历更进一步的处理,或可被回收并用作根据本发明的方法中的工艺水(例如,作为洗涤水或稀释水)。
出于更进一步浓缩在分离之后获得的包含脂质的产油细胞生物质的水性悬液的目的,在经历回收脂质(即,经历细胞裂解、通过溶剂提取和蒸发溶剂)之前,所述产油细胞生物质的水性悬液可经历离心。所述离心可以以范围从3000rpm至9000rpm,优选地范围从4000rpm至8000rpm的旋转速度进行范围从5分钟至30分钟,优选地范围从15分钟至25分钟的时间。
出于回收脂质的目的,所述包含脂质的产油细胞生物质的水性悬液可经历细胞裂解,所述细胞裂解可通过多种方法实施。所述方法的非限制性实例为:
-热处理,所述热处理可使用处于压力下的高压灭菌器(例如,AU-2型Brignole高压灭菌器,或PA 4575型Parr搅拌反应器)来进行:在范围从100rpm至800rpm,优选地范围从400rpm至600rpm的搅拌下,在范围从2巴至6.5巴,优选地范围从3巴至5.5巴的压力,在范围从100℃至160℃,优选地范围从110℃至150℃的温度下,持续范围从1小时至8小时,优选地范围从1.5小时至4小时的时间,如在例如,前述国际专利申请中所描述的;
-机械处理,所述机械处理可使用高压均质仪(例如,Gea NiroSoavi均质仪模式NS3006L)来进行:在范围从800巴至2000巴,优选地范围从1000巴至1600巴的压力,在范围从10℃至100℃,优选地范围从20℃至80℃的温度下,以范围从5l/h至50l/h,优选地范围从7l/h至40l/h的产油细胞生物质的水性悬液的流速下;
-微波处理,所述微波处理可使用微波装置(例如,MicroSYNTH型Milestone微波装置模式)来进行:在范围从45℃至150℃,优选地范围从50℃至100℃的温度下,持续范围从10分钟至2小时,优选地范围从15分钟至1小时的时间。
在所述细胞裂解结束时,脂质可通过使用,例如,回流提取器提取从获得的耗尽的(exhausted)包含脂质的细胞生物质的水性悬液来回收。
所述提取可在至少一种有机溶剂的存在下进行,所述至少一种有机溶剂可选自:非极性有机溶剂,诸如,例如,异辛烷、正辛烷,或其混合物;烃的混合物,诸如,例如,石脑油或柴油馏分(其可任选地还来源于绿色柴油的生产);极性有机溶剂,诸如,例如,甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、己烷、甲基叔丁基酮、乙基叔丁基醚或其混合物;或者它们的混合物。
所述提取可在范围从20℃至200℃的温度,优选地在所用溶剂的沸点进行。
所述提取可在范围为以下的1倍至6倍,优选地范围为以下的1.5倍至5倍的量的溶剂的存在下进行:从细胞裂解获得的耗尽的包含脂质的产油细胞生物质的水性悬液的水相的体积。
在所述细胞裂解之后获得的耗尽的包含脂质的产油细胞生物质的水性悬液可经历一次或更多次提取。优选地,所述耗尽的包含脂质的产油细胞生物质的水性悬液可经历1次至5次,更优选地1次至3次提取。
在前述提取结束时,获得以下两相:
(i)有机相,包含溶解于溶剂的脂质;
(ii)水相,包含细胞碎片和微量的未分离的脂质。
出于回收脂质的目的,所述有机相(i)经历蒸发,以获得作为残余物的包含脂质的高沸点油(ia)和液相,该液相包含可被再循环至前述提取的溶剂。
根据本发明的方法使回收在范围从40%至99.9%,优选地范围从45%至99%的提取产率的脂质成为可能,所述提取产率基于存在于在发酵之后获得的(干)产油细胞生物质中的脂质的总量来计算。
优选地,以基于脂质的总重量,大于或等于按重量计80%,优选地大于或等于按重量计90%的量包含在所述有机相(i)中的脂质为甘油三酯,更优选地甘油与具有14个至24个碳原子的脂肪酸,诸如棕榈酸、硬脂酸、油酸、α亚油酸的酯。可存在于所述有机相(i)中的其他脂质为:磷脂、甘油单酯、甘油二酯、游离的脂肪酸或其混合物。
在所述第二发酵装置中发酵之后获得的产油细胞生物质中的水性悬液中存在的脂质的总量,以及包含于所述高沸点油(ia)中的脂质的总量可通过本领域已知的方法来确定,本领域已知的方法诸如,例如,使用,例如,由Spinreact S.A./S.A.U.,Ctra Santa Coloma,7–E-17176Sant Esteve de Bas(GI),Spain销售的“总脂质-磺基-磷-香草醛(sulpho-phospho-vanillin)”试剂盒的基于脂质与磷酸和磷酸香草醛(phosphovanillin)的反应的比色方法。关于所述方法的进一步详细内容可在,例如,J.A.Knight等,在“Clinical Chemistry”(1972),第18卷,第3期,199-202页中公布的以下文章“Chemical Basis of the Sulpho-phospho-vanillin Reaction for Estimating Total Serum Lipids”中发现。
包含细胞碎片,特别地包含在使用的产油微生物的细胞膜中的蛋白和多糖的所述水相(ii)可被干燥并被利用为染料,任选地与来源于生物质的水解的木质素一起。
可选地,所述水相(ii)可经历厌氧消化以产生生物气体(biogas),该生物气体可被用于产生电能,该生物气体还可被用来满足根据本发明的方法的能量要求。
可选地,如描述于,例如,国际专利申请WO 2010/069583或WO 2010/069516中的,所述水相(ii)可经历液化以产生生物油(bio-oil)。
通过根据本发明的方法获得的脂质可在具有1个至4个碳原子的至少一种醇,优选地甲醇、乙醇以及至少一种酸性或碱性催化剂的存在下经历酯化,以产生甘油和烷基酯,特别地甲基酯或乙基酯(生物柴油)。
可选地,所述脂质可在至少一种催化剂的存在下经历氢化/脱氧,以产生绿色柴油。氢化/氧化方法是本领域已知的并被描述于,例如,欧洲专利申请1,728,844中。
现将参考前述图1通过实施方案的方式更详细地说明本发明。
图1概括了根据本发明的方法的一个实施方案。出于该目的,包含至少一种多糖的生物质(例如预先研磨的木质纤维素生物质)经历水解(根据本领域已知的前述方法中的一种进行),以获得包含第一水相和含木质素的第一固相的混合物。
所述混合物经历过滤或离心(在图1中未示出),以获得第一固相和第一水相。
在此期间,使用产油微生物(例如,Rhodosporidium azoricum)在第一发酵装置中制备接种物,以获得第一发酵肉汤:应该注意,如以上所述,包含大于或等于40g/l,优选地范围从45g/l至60g/l的量的糖的水性溶液可以是从水解包含至少一种多糖的生物质获得的、任选地被稀释以具有期望的量的糖的第一水相(在图1中由虚线指示)的等分试样。
将所述第一水相和所述第一发酵肉汤进料至存在产油微生物(例如,Rhodosporidium azoricum)的第二发酵装置,以获得第二发酵肉汤。
在发酵期间,所述第二发酵肉汤的至少一部分连续经历微滤,以获得包含糖以及其他有机物质和无机物质(例如,硝酸盐、磷酸盐)的水性流(第一渗透物–P1)和包含浓缩的产油细胞生物质的水性悬液(第一滞留物–R1),所述水性流经历纯化处理(例如,通过反相渗透或蒸发),所述水性悬液被运送至所述第二发酵装置。
从纯化处理获得另外的水性流(第二渗透物–P2)(其被运送用于清除(废水(wastewater))和糖及其他有机物质和无机物质(例如,硝酸盐、磷酸盐)被浓缩的另外的水性流(第二滞留物–R2)(其被运送至所述第二发酵装置)。
所述微滤和所述纯化处理在发酵期间连续地进行。
在发酵结束时,使所述第二发酵肉汤经历分离(例如,通过离心),以获得产油细胞生物质的水性悬液和第二水相。
所述产油细胞生物质的水性悬液经历细胞裂解(根据以上描述的方法的一种进行),在溶剂存在下提取,以及随后蒸发溶剂,以获得脂质,同时所述第二水相被运送用于清除(废水)。
为了更好地理解本发明,并为了将其付诸实践,下文给出其的一些说明性的,非限制性的实施例。
实施例1
在木质纤维素水解产物的组成
在以下实施例中使用的木质纤维素水解产物(即“第一水相”)具有以下组成:葡萄糖(126g/l)、木糖(87.1g/l)、阿拉伯糖(7.5g/l)、甘露糖(2.9g/l)、半乳糖(6.5g/l)、乙酸(4.9g/l)、糠醛(F)(1g/l)、5-羟甲基糠醛(HMF)(3g/l),总糖含量为230g/l。
使用在表1中示出的洗脱梯度,糠醛(F)和5-羟甲基糠醛(HMF)的含量使用来自Merck的装备有光电二极管UV传感器的封端的LichroCART Purospher RP-18(240mm×4mm;5μm)通过高效液相色谱(HPLC),以流量0.8ml/min,温度40℃,以及在水中的0.05%的磷酸流动相(洗脱液A),和以90/10体积/体积比率在水中的0.05%的乙腈+磷酸(洗脱液B)来确定。
表1
糖含量使用装备有Carbopac PA100柱的Dionex层析仪以氢氧化钠和乙酸钠的梯度作为反荷离子通过离子交换层析(HPAE-PAD)来确定。
有机酸,即乙酸的定量确定使用以下实施:与电导率传感器连接的DIONEX BIOLC 4000离子层析仪(PED–“脉冲电化学检测器”),Ice-AS1层析柱(直径:9mm;长度:250mm),AMMS-ICE抑制器(Anion MicroMembrane Suppressor),注射体积50μl,使用0.4mM七氟丁酸的等度洗脱。
实施例2
使用水解产物(Rhodosporidium azoricum)制备接种物
接种物(即第一发酵肉汤)使用在实施例1中描述的木质纤维素水解产物部分(即第一水相)来制备。
出于该目的,用水(78ml)适当稀释以具有50g/l的最终糖浓度的22ml的所述木质纤维素水解产物(即第一水相)被放置于装备有磁力搅拌器的500ml烧瓶中,将以下连续地添加至上述烧瓶:2g/l酵母提取物、1g/l KH2PO、0.05g/l MgSO4·7H2O、0.01g/l NaCl和0.01g/l NaCl:通过添加几滴氢氧化钾(KOH)2.5M使获得的混合物的pH为6。获得的混合物在80℃在高压灭菌器中灭菌45分钟。
在灭菌结束时,使获得的混合物至室温(25℃),并接种Rhodosporidium azoricum RGRDP3的细胞,使其在搅拌(200rpm)下在30℃生长24小时,以获得具有浓度23g/l(干重)的产油细胞生物质的第一发酵肉汤。
实施例3
Rhodosporidium azoricum的发酵(微滤和反相渗透连续进行)
发酵测试在20升发酵器中使用Rhodosporidium azoricum RGRDP3的细胞进行,在以下条件下操作:
-0.78升如在实施例1中描述的木质纤维素水解产物(即第一水相)用水适当稀释以具有30g/l的初始糖浓度;
-2.0g/l的酵母提取物;
-5g/l的玉米浆固体;
-5g/l的(NH4)2SO4;
-6g/l的KH2PO;
-0.03g/l的MgSO4·7H2O;
-0.06g/l的NaCl;
-0.06g/l的CaCl2·2H2O;
-供气:流量等于1l/min;
-温度:30℃;
-当必要时,通过添加几滴氢氧化钾溶液(KOH)5M和硫酸(H2SO4)10%(v/v)使pH等于6;
-以600rpm–900rpm搅拌,用空气流调制,以保持溶解氧(DO2)的浓度超过30%的饱和值;
-初始体积:6升;
-如在实施例2中描述的获得的Rhodosporidium azoricum RGRDP3的接种物(即第一发酵肉汤),用用于发酵的培养基稀释至10%(v/v),以用浓度等于2.3g/l(干重)的产油细胞生物质启动发酵。
发酵以不连续模式(“分批”)先进行6小时,并且随后以灌注模式进行。在这方面,装备有来自Sartorius的“ Microfiltration Cassettes”微滤膜的切向微滤装置经由活塞泵与发酵器连接,出于去除培养基部分(渗透物–P1)和浓缩在所述第二培养肉汤中产生的第二产油细胞生物质(滞留物–R1)的目的,所述膜具有等于0.1m2的膜面积和等于0.45μm的平均孔径。出于该目的,在发酵期间,所述活塞泵连续运转,以在所述微滤装置中以等于144l/h的流速再循环产油细胞生物质和细胞培养基,在以上给出的用于发酵的相同pH和温度条件下进行。如此,所述第二产油细胞生物质被浓缩以获得被连续进料至发酵器(再循环)的滞留物(R1)和被连续进料以反相渗透的渗透物(P1)。渗透物(P1)流速使用安置在来自微滤装置的渗透物(P1)的输出下游的蠕动泵控制在61ml/h至75ml/h的范围内。
在这方面,反相渗透测试使用包含圆柱形钢容器的平膜测试装置来进行,在该圆柱形钢容器的基底上,聚合膜被安装在形成该膜的支撑的过滤多孔隔膜上。装备有搅拌器的容器可被加压至35巴的压力。渗透物(P2)通过膜过滤,并被收集在安置在下面的容器中,同时留在膜上的滞留物(R2)经由安置在所述装置下游的流量控制阀以范围从20ml/h至25ml/h的流速运送至发酵装置。
对于反相渗透,使用来自Dow Chemical的BW30膜,这是基于聚酰胺的薄膜复合(TFC)膜,具有以下特征:
-标称截留分子量(MWCO)=50道尔顿;
-操作pH=2-11;
-最大操作温度=70℃;
-最大操作压力=68巴;
如此,在等于35巴的压力,在500rpm的搅拌下,将渗透物(P1)运送至以上描述的反相渗透装置。
从反相渗透获得第二滞留物(R2),该第二滞留物(R2)包含以等于3的浓缩系数浓缩的糖:开始于等于28g/l的初始糖含量(第一渗透物–P1)至等于84g/l的糖含量(第二滞留物–R2)。
糖含量通过如在实施例1中描述的操作来确定。
所述第二滞留物(R2)还包含浓缩的盐。事实上,第一渗透物(P1)具有分别等于825ppm、3186ppm、273ppm、184ppm、320ppm和1880ppm的钠(Na)、钾(K)、镁(Mg)、钙(Ca)、氯(Cl)和磷(P)含量;同时,第二渗透物(P2)具有8ppm、50ppm、少于2ppm、少于2ppm、25ppm、4ppm的钠(Na)、钾(K)、镁(Mg)、钙(Ca)、氯(Cl)和磷(P)含量,且第二滞留物(R2)具有分别等于2440ppm、9550ppm、820ppm、552pm、960ppm和5640ppm的钠(Na)、钾(K)、镁(Mg)、钙(Ca)、氯(Cl)和磷(P)含量。
盐含量通过电感耦合等离子体质谱(ICP-MS)确定。出于该目的,使用来自Perkin Elmer的ICP-MS ELAN DRCe光谱仪。用于通过前述ICP-MS分析的稀释物依据相关分析物而变化;用于分析的样品使用以按体积计2%的硝酸(HNO3)来酸化。用于校准的标准溶液通过稀释和酸化经验证的1000ppm水性标准溶液来制备。
至发酵器的供应物,换言之第二滞留物(R2)加新鲜水解产物,的流速在整个发酵持续时间使用水平传感器以这样的方式自动地控制,该方式使得在微滤的输出处的渗透物(P1)的体积被补偿,且发酵肉汤的体积在发酵器中保持恒定:所述供应物具有295g/l的浓度的糖,并且如以上陈述的,包含滞留物(R2)和新鲜水解产物,所述新鲜水解产物如在实施例1中描述来获得并如以上描述以1:2的比率来稀释。
将所述流速控制在61ml/h至75ml/h的范围内,以具有范围从22g/h至18g/h的糖的输入量,以满足产油酵母的要求并保持在发酵器中30g/l的浓度。
在100小时之后,在发酵结束时,获得第二发酵肉汤,其具有等于68g/l(干重)的产油细胞生物质的浓度,和等于基于所述产油细胞生物质的干重,按重量计55%(37.4g/l)的总脂质含量,在发酵器内的体积(6l)在整个测试中保持恒定。
总脂质含量通过如以上描述的操作使用“总脂质-磺基-磷-香草醛”试剂盒来确定。糖含量通过如在实施例1中描述的操作来确定。
通过以7000rpm离心20分钟使所述第二发酵肉汤经历分离,以获得1.2kg产油细胞生物质[408g(干重)-等于基于获得的产油细胞生物质的总量,按重量计35%的浓度]。
获得等于基于消耗的底物,0.36g/g的产油细胞生物质的产率(YX/S=每g消耗的底物获得的生物质的g数)和等于基于消耗的底物,0.17g/g的脂质产率(YL/S=每g消耗的底物获得的脂质的g数)。
实施例4
Rhodosporidium azoricum的发酵(微滤和蒸发连续进行)
发酵测试在20升发酵器中使用Rhodosporidium azoricum RGRDP3的细胞进行,在以下条件下操作:
-0.78l如在实施例1中描述的木质纤维素水解产物(即第一水相)用水适当稀释以具有等于30g/l的初始糖浓度;
-2.0g/l的酵母提取物;
-5g/l的玉米浆固体;
-5g/l的(NH4)2SO4;
-6g/l的KH2PO;
-0.03g/l的MgSO4·7H2O;
-0.06g/l的NaCl;
-0.06g/l的CaCl2·2H2O;
-供气:流量等于1l/min;
-当必要时,通过添加几滴氢氧化钾溶液(KOH)5M和硫酸(H2SO4)10%(v/v)使pH等于6;
-温度:30℃;
-以600rpm–900rpm搅拌,用空气流调制,以保持溶解氧(DO2)的浓度超过30%的饱和值;
-初始体积:6升;
-如在实施例2中描述的获得的Rhodosporidium azoricum RGRDP3的接种物(即第一发酵肉汤),用用于发酵的培养基稀释至10%(v/v),以用浓度等于2.3g/l(干重)的产油细胞生物质启动发酵。
发酵以不连续模式(“分批”)先进行6小时,并且随后以灌注模式进行。在这方面,装备有来自Sartorius的“ Microfiltration Cassettes”微滤膜的切向微滤装置经由活塞泵与发酵器连接,出于去除培养基部分(渗透物–P1)和浓缩在所述第二培养肉汤中产生的第二产油细胞生物质(滞留物–R1)的目的,所述膜具有等于0.1m2的膜面积和等于0.45μm的平均孔径。出于该目的,在发酵期间,所述活塞泵连续运转,以在所述微滤装置中以144l/h的流速再循环产油细胞生物质和细胞培养基,在以上给出的用于发酵的相同pH和温度条件下进行。如此,所述第二产油细胞生物质被浓缩以获得被连续进料至发酵器(再循环)的滞留物(R1)和被连续进料以蒸发的渗透物(P1)。渗透物(P1)流速使用安置在来自微滤装置的渗透物(P1)的输出下游的蠕动泵控制在58ml/h至70ml/h的范围内。
在这方面,蒸发测试使用旋转蒸发仪来进行。因此,将渗透物(P1)运送至旋转蒸发仪,且在38℃和在等于147mbar的压力下进行蒸发。
纯化的相(P2)(蒸发相-等同于第二渗透物)在使用含15℃冷水的环路来冷凝,同时将浓缩物(R2)(等同于第二滞留物)通过活塞泵以16ml/h至20ml/h的流速运送至发酵装置。
从蒸发获得浓缩物(R2),该浓缩物(R2)包含以3.5的浓缩系数浓缩的糖:开始于等于28g/l的初始糖含量(第一渗透物–P1)至等于98g/l的糖含量(浓缩物–R2)。
糖含量通过如在实施例1中描述的操作来确定。
所述第二浓缩物(R2)还包含所有的盐:对于证实,在冷凝之后,所述纯化的相(P2)的电导率使用来自Crison的MM40+电导率仪来测量,并且发现其小于0.2mS/cm。
至发酵器的供应物,换言之第二浓缩物(R2)加新鲜水解产物,的流速在整个发酵持续时间使用水平传感器以这样的方式自动地控制,该方式使得在微滤的输出处的渗透物(P1)的体积被补偿,且发酵肉汤的体积在发酵器中保持恒定:所述供应物具有等于313g/l的浓度的糖,并且如以上陈述的,包含滞留物(R2)和新鲜水解产物,所述新鲜水解产物如在实施例1中描述来获得并如以上描述以2:5的比率来稀释。
将所述流速控制在58ml/h至70ml/h的范围内,以具有范围从22g/h至18g/h的糖的输入量,以满足产油酵母的要求并保持在发酵器中30g/l的浓度。
在100小时之后,在发酵结束时,获得第二发酵肉汤,其具有等于67g/l(干重)的产油细胞生物质的浓度,和等于基于所述产油细胞生物质的干重,按重量计56%(37.5g/l)的总脂质含量,在发酵器内的体积(6l)在整个测试中保持恒定。
总脂质含量通过如以上描述的操作使用“总脂质-磺基-磷-香草醛”试剂盒来确定。糖含量通过如在实施例1中描述的操作来确定。
通过以7000rpm离心20分钟使所述第二发酵肉汤经历分离,以获得1.1kg产油细胞生物质[402g(干重)-等于基于获得的产油细胞生物质的总量,按重量计36%的浓度]。
获得等于基于消耗的底物,0.35g/g的产油细胞生物质的产率(YX/S=每g消耗的底物获得的生物质的g数)和等于基于消耗的底物,0.17g/g的脂质产率(YL/S=每g消耗的底物获得的脂质的g数)。
实施例5
通过细胞裂解(热处理)回收脂质
出于该目的,在发酵结束时,1180ml如在实施例3中描述获得的、具有等于68g/l(干重)的产油细胞生物质的浓度的第二发酵肉汤以7000rpm经历离心20分钟,以获得具有等于350g/l(干重)的产油细胞生物质的浓度的产油细胞生物质和980ml耗尽的发酵液(即,第二水相)的200ml水性悬液。
将200ml所述水性悬液放置于0.5l高压灭菌器(PA 4575A型Parr搅拌反应器)中,并伴随以450rpm的搅拌在4.9bar的自发压力下达到140℃的温度,并在这些条件下保持2小时。在该时间之后,将耗尽的产油细胞生物质排出并开始提取过程(实施例8)。
实施例6
通过细胞裂解(机械处理)回收脂质
出于该目的,在发酵结束时,6l如在实施例3中描述获得的、具有等于68g/l(干重)的产油细胞生物质的浓度的第二发酵肉汤以7000rpm经历离心20分钟,以获得具有等于352g/l(干重)的产油细胞生物质的浓度的200ml产油细胞生物质的水性悬液和5.8l耗尽的发酵液(即,第二水相)。
将200ml所述水性悬液在室温,在1500巴的均质化压力下并以约15l/h的流速泵入均质仪(NS3006L型Gea NiroSoavi)中。
在处理结束时,将耗尽的产油细胞生物质排出并开始提取过程(实施例8)。
实施例7
通过细胞裂解(微波处理)回收脂质
出于该目的,在发酵结束时,1180ml如在实施例3中描述获得的、具有等于68g/l(干重)的产油细胞生物质的浓度的第二发酵肉汤以7000rpm经历离心20分钟,以获得具有等于350g/l(干重)的产油细胞生物质的浓度的200ml产油细胞生物质的水性悬液和980ml耗尽的发酵液(即,第二水相)。
将200ml所述水性悬液放置于装备有制冷剂、磁性搅拌棒的300ml玻璃烧瓶中,并且使用微波装置(“MicroSYNTH”型Milestone)达到100℃的温度。将该温度在大气压力下保持恒定持续20分钟。
在处理结束时,将耗尽的产油细胞生物质排出并开始提取过程(实施例8)。
实施例8
通过溶剂提取
出于回收包含在实施例5、6和7中描述的处理之后获得的产油细胞生物质中的脂质的目的,使用多种类型的溶剂或其混合物进行了多种提取测试。
出于该目的,在多种测试中使用如在实施例5、在实施例6或在实施例7中描述获得的200ml耗尽的产油细胞生物质的水性悬液。
在回流提取器中,在为所述水性悬液的2倍体积的溶剂或溶剂混合物的体积存在下,在使用的溶剂或溶剂的混合物的沸点,使所述水性悬液经历两个提取周期,各2小时。
在从所述包含耗尽的产油细胞生物质的水性悬液分离包含溶剂和脂质的有机相之后,并且在使所述有机相经历溶剂(其被循环至提取)蒸馏之后,获得脂质。
表2中示出了,所使用的溶剂和溶剂的混合物、产油细胞生物质经历的处理(实施例6-8-细胞裂解)、提取温度及提取产率。
表2
从提取获得的脂质的提取产率(%)基于存在于发酵之后获得的(干)产油细胞生物质中的脂质的总量给出,使用通过如以上描述操作的“总脂质磺基-磷-香草醛”试剂盒来确定。
- 还没有人留言评论。精彩留言会获得点赞!