用于使多能干细胞分化为心肌细胞的方法与流程
本申请涉及用于使多能干细胞(PSC)分化为心肌细胞的方法。此外,本申请涉及用于使人胚胎干细胞(hESC)和诱导型多能干细胞(iPSC)分化为增殖心肌细胞的方法,该方法基于化学成分确定的培养基诱导的连接步骤。
背景技术:
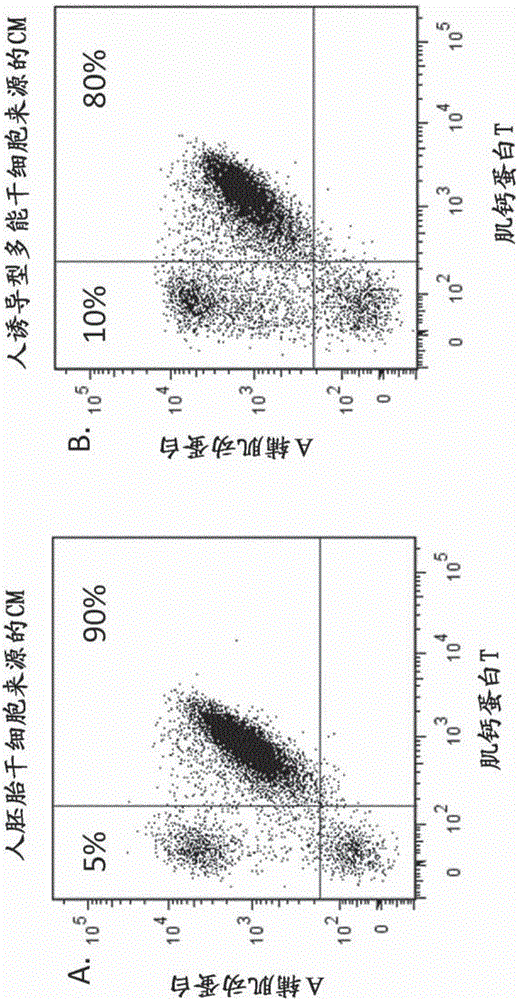
:许多年以来,多种细胞培养系统已用于临床前药物开发。但是,已建立的细胞模型仅部分反映药物相关疾病特异性生理学,因为它们源自致瘤组织或源自转化和无限增殖化细胞。具体而言,因为终末分化的心肌细胞显示具有有限的增殖潜能,所以它们不具有有效产生用于药物开发的细胞模型的能力。因此,存在对可在研究和药物开发中用作可靠的细胞模型的更多疾病相关人细胞类型的需要。人胚胎干细胞(hESC)和诱导型多能干细胞(iPSC)为研究人员提供了产生功能性人细胞类型(如心肌细胞、神经元细胞、胰细胞等)的巨大机会。用于体外分化纯hESC和iPSC来源的人心肌细胞(hESCM)培养物的稳健流程将是强大的工具,不仅增进对早期人心脏发生(cardiogenesis)的理解,还用心肌细胞作为非转化人细胞模型来在药物开发的临床前阶段测试药物功效,及在进入临床之前评估心脏毒性。此外,hESC来源的人心肌细胞为鉴定对心脏再生至关重要的途径打开了机会,并最终导致支持基于干细胞的疗法的临床应用。为了发展用于药物研究和开发的细胞测定模型,这类分化流程需产生理想地满足以下标准的细胞:a)稳健,具有高水平的可重复性;b)产生大量高度纯化的细胞类型;c)可在短时间内分化;d)产生可冷冻的细胞,以保证多种筛选活动的批次一致性;e)提供功能性和生理学相关性用于模拟疾病特异性读出。P.W.Burridge等综述了使多能细胞分化为心肌细胞的现有技术方法(P.Burridge,Keller,Gold,&Wu,2012)。迄今没有一种已知的流程满足以上标准。具体而言,通过已知流程获得的心肌细胞难以冷冻和解冻而不丧失任何功能特性。为了满足这些需要,我们发展了产生大量高度纯化的心肌细胞(至多95%)的新的分化方法。该分化流程是用确定的小分子来在10天的时间跨度内指导向心肌细胞系分化。为了进一步提高其纯度,通过用心肌细胞偏好的条件重新接种(replating)它们来富集心肌细胞。此外,随后可以冷冻心肌细胞,在液氮下保存,并再次解冻。已测试该心肌细胞符合几种用于药物研究和开发的筛选型式。本发明提供与现有技术流程相比在较短时间内和以显著提高的产率使多能干细胞分化为心肌细胞的改进方法。该新方法减轻了从多能干细胞获得拟胚体或小细胞团的必要性,并去除了迄今已知的方法的低可重复性和标准化的主要缺点。此外,高效率允许在药物产业中将这些确定的心肌细胞大规模用于药物发现和安全性评估、用于再生医学应用及用于体外疾病模拟。发明概述1.本文提供用于使多能干细胞分化为心肌细胞的方法,该方法包括步骤:a)提供密度为3-7x105/cm2的多能干细胞;b)在含有下式的化合物的无胰岛素培养基中孵育该细胞:在一个实施方案中,在含0.3-10μM该化合物的无胰岛素培养基中孵育该细胞。在一个实施方案中,步骤b)包括孵育该细胞12-48小时。在一个实施方案中,该方法还包括步骤c)在含Wnt-C59的无胰岛素培养基中孵育该细胞。在一个实施方案中,步骤c)包括在含1-10μMWnt-C59的无胰岛素培养基中孵育该细胞。在一个实施方案中,步骤c)包括孵育该细胞24-72小时。在一个实施方案中,在步骤之间在无胰岛素培养基中孵育该细胞24-48小时。在一个实施方案中,该方法还包括步骤d)在含胰岛素的培养基中孵育该细胞。在一个实施方案中,步骤b)、c)和d)的培养基包含维生素C。在一个实施方案中,该多能干细胞是诱导型多能干细胞。在一个实施方案中,该诱导型多能干细胞是人细胞。在一个实施方案中,该诱导型多能干细胞获自患有由心脏细胞功能异常引起的疾病的个体。在一个实施方案中,提供通过任意以上实施方案的方法获得的心肌细胞。在一个实施方案中,提供通过任意以上实施方案的方法获得的心肌细胞的生物银行(biobank)。在一个实施方案中,通过任意以上实施方案的方法获得的心肌细胞或心肌细胞的生物银行用作由心脏细胞功能障碍引起的疾病的体外模型。在一个实施方案中,提供包含通过任意以上实施方案的方法获得的心肌细胞或心肌细胞的生物银行的治疗组合物。任意以上实施方案可以单独存在或组合存在。附图简述图1:FACS分析鉴定处于分化第14天的高浓度心肌细胞。hESC和iPSC都产生相似的结果。A:人胚胎干细胞来源的心肌细胞。B:人诱导型多能干细胞来源的心肌细胞。图2:多次心肌细胞分化的FACS分析证明流程的稳健性。图3:FACS分析显示纯化方法改善心肌细胞的纯度。A:第14天5.5x105/cm2心肌细胞的60%纯度。B:附加纯化步骤后4.4x105/cm2心肌细胞的98%纯度。图4:免疫荧光染色——共焦显微镜分析显示心肌细胞典型的细胞中的α辅肌动蛋白和肌钙蛋白T条纹模式。绿色(*):α辅肌动蛋白;红色(#):肌钙蛋白;蓝色(+):细胞核。图5:xCELLigent分析——异丙基肾上腺素提高多能干细胞来源的心肌细胞的跳动频率。图6:多能干细胞来源的心肌细胞在分化第14天和第18天解冻后显示高比例的存活心肌细胞数。在每个实验中,冷冻4x106个细胞。发明详述本发明提供与现有技术流程相比,在较短时间内和以显著提高的增殖心肌细胞产率,使多能干细胞分化为心肌细胞的改进方法。本文公开的用于使人胚胎干细胞(hESC)和诱导型多能干细胞(iPSC)分化为确定的心肌细胞的新方法基于化学成分确定的培养基诱导的连接步骤,在起始分化后仅10天(或更早:8天)后产生跳动细胞。在一个实施方案中,提供用于使多能干细胞分化为心肌细胞的方法,该方法包括步骤:a)提供密度为3-7x105细胞/cm2的多能细胞;b)在含有下式的化合物的无胰岛素培养基中孵育该细胞:3-(3-氨基-苯基)-4-(1-甲基-1H-吲哚-3-基)-吡咯-2,5-二酮(CP21)按3-7x105细胞/cm2的密度(即非常高的密度)提供多能干细胞。在一个实施方案中,按5.5x105细胞/cm2的密度提供细胞。令人惊奇地,本方法的发明人发现,按高密度提供细胞提高了分化效率和心肌细胞产率。在一个实施方案中,在以步骤a)起始分化之前,用适宜的缓冲液或培养基洗涤按高密度提供的细胞,以去除任何死细胞。步骤b)的培养基是无胰岛素培养基。步骤b)的早期分化培养基中缺乏胰岛素很重要,因为之前的报道已显示,含有胰岛素的分化培养基阻断心脏发生(Lianu.a.,2013)。为了起始分化,在含有化合物21,(3-(3-氨基-苯基)-4-(1-甲基-1H-吲哚-3-基)-吡咯-2,5-二酮,本文中也称为“化合物21”或“CP21”;参见例如L.Gong等;Bioorganic&MedicinalChemistryLetters20(2010),1693-1696)的无胰岛素培养基中孵育细胞,以激活wnt途径。化合物21诱导心肌细胞分化的最适浓度依赖于附着于细胞容器的多能细胞的细胞密度。在使用不同细胞密度(1.8-11x105/cm2hESC或iPSC)和多种CP21(0-10μM)浓度的几个平行实验中,发现使用5.5x105/cm2的细胞密度和2μM的CP21浓度导致多能干细胞最有效地分化为心肌细胞。高于5μM的CP21浓度显示降低的细胞活率。这是令人惊奇的,因为现有技术流程需要更高浓度的其他Wnt途径调节剂进行有效的分化。在一个实施方案中,分化方法的步骤b)包括在含有0.3-10μMCP21、优选0.5-5μMCP21的培养基中孵育细胞。在一个优选实施方案中,分化方法的步骤b)包括在含有2μMCP21的培养基中孵育细胞。CP21孵育24小时后,细胞显示强烈的细胞死亡。测试多种CP21孵育时间显示,24小时对心脏发生而言最适,更长或更短的孵育时间导致低效的分化。在一个实施方案中,步骤b)包括在含有CP21的无胰岛素培养基中孵育细胞12-48小时,优选18-24小时。在一个优选实施方案中,步骤b)包括在含有CP21的无胰岛素培养基中孵育细胞24小时。在一个实施方案中,步骤b)的培养基包含维生素C。已显示向基础培养基中加入维生素C改善心肌细胞分化(Caou.a.,2012)。因此,在一个实施方案中,步骤b)的培养基是含有CP21和维生素C的无胰岛素培养基。在一个这种实施方案中,培养基包含0.5-5μMCP21和维生素C。在一个实施方案中,该方法进一步包括步骤c)在含有Wnt-C59的无胰岛素培养基中孵育该细胞。Wnt-C59是阻断Wnt信号传导途径的小分子(WO2010101849,2-(4-(2-甲基吡啶-4-基)苯基)-N-(4-(吡啶-3-基)苯基)乙酰胺)。Wnt-C59是非常有效和高选择性的Wnt信号发放拮抗剂。它阻止Porcupine(膜结合O-酰基转移酶)对Wnt蛋白质的棕榈酰基化(palmitylation),从而阻断Wnt蛋白质分泌和活性。使用不同浓度的wnt阻遏物Wnt-C59(1-10μM)导致心肌细胞显著增加。最适浓度鉴定为2μM。在不加入Wnt-C59的情况下,分化不产生心肌细胞。超过5μMWnt-C59的浓度显示增加的细胞死亡。在一个实施方案中,分化方法的步骤c)包括在含有1-10μMWnt-C59的培养基中孵育细胞。在一个优选实施方案中,分化方法的步骤c)包括在含有2μMWnt-C59的培养基中孵育细胞。由于wnt途径高度复杂,测试了其他具有不同作用方式的Wnt抑制剂。抗蠕虫药氯硝柳胺(niclosamide)(Chen等,Biochemistry.2009年11月3日;48(43):10267-74.)促进Frizzled1胞吞作用,下调Dishevelled-2蛋白质,并抑制Wnt3A刺激的β-联蛋白稳定化和LEF/TCF报道活性。扑蛲灵(Pyrvinium)是Wnt信号发放的有效抑制剂,在体外结合所有酪蛋白激酶1(CK1)家族成员并选择性增强酪蛋白激酶1α(CK1α)激酶活性,导致Axin的稳定化和β-联蛋白转换增加(Thorne等,NatChemBiol.2010年11月;6(11):829-36.)。针对其诱导心肌细胞分化的能力测试了抗蠕虫药氯硝柳胺和扑蛲灵。与Wnt-59不同,其他两种Wnt抑制剂都不导致心肌细胞的成功产生。所测试的Wnt抑制剂对多能干细胞分化为心肌细胞的不同功效表明,通过阻断wnt分泌而特异性抑制wnt途径似乎是关键机制。在一个实施方案中,步骤c)包括在含有Wnt-C59的无胰岛素培养基中孵育细胞24-72小时,优选48小时。在一个实施方案中,步骤b)和c)的该无胰岛素培养基是无血清培养基。在一个实施方案中,该无胰岛素培养基是RPMI1680(Gibco)。在一个实施方案中,在每个步骤b)和c)之间在无胰岛素培养基中孵育细胞24小时至48小时,优选48小时。在一个实施方案中,该培养基是无血清培养基。在另一实施方案中,该培养基包含维生素C。在一个实施方案中,在每个步骤b)和c)之间在含有维生素C的无血清、无胰岛素培养基中孵育细胞24小时至48小时,优选48小时。在一个实施方案中,本文所述通过以上任意实施方案使多能细胞分化为心肌细胞的方法还包括步骤d)在含有胰岛素的培养基中孵育细胞。在此后期阶段,胰岛素促进心肌细胞及其心脏前体细胞的增殖。在一个实施方案中,步骤d)包括在含有胰岛素的培养基中孵育细胞36-60小时,优选48小时。在一个实施方案中,该培养基是无血清培养基。在另一实施方案中,该培养基包含维生素C。适合用于扩增步骤d)的培养基是例如DMEM,高葡萄糖+L-谷氨酰胺+丙酮酸和肉碱、牛磺酸、肌酸、BSA、维生素C,或来自CellularDynamicsinternational的iCell心肌细胞维持培养基。优选地,在每个步骤之间更换培养基,例如,例如通过吸取或离心细胞并弃去上清来去除培养基,然后将用于随后的步骤的培养基加至细胞。在一个实施方案中,在加入随后的步骤的培养基之前用适宜的缓冲液或培养基洗涤细胞,以去除任何死细胞。用于洗涤细胞的缓冲液或培养基为本领域已知。适合用于洗涤细胞的缓冲液的一个实例是例如磷酸缓冲盐溶液(PBS)。在一个实施方案中,在允许稳定的生长和/或倍增时间的条件下培养用于分化方法的多能细胞。例如,将细胞培养在多能性培养基中并传代几次。本文所用的“多能性培养基”指任何化学成分确定的培养基,其用于将多能干细胞作为单细胞附着于单层同时保持其多能性,且为本领域公知。在一个实施方案中,该多能性培养基是含有Rho相关卷曲螺旋形成蛋白丝氨酸/苏氨酸激酶(ROCK)家族蛋白激酶的小分子抑制剂(本文中称为ROCK激酶抑制剂)的无血清培养基。在一个实施方案中,该ROCK激酶抑制剂选自1-(5-异喹啉磺酰基)高哌嗪)、N-苄基-2-(嘧啶-4-基氨基)噻唑-4-甲酰胺)和(+)-(R)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己甲酰胺二盐酸盐)。本文所用的ROCK激酶抑制剂的实例是Fasudil(1-(5-异喹啉磺酰基)高哌嗪)、Thiazovivin(N-苄基-2-(嘧啶-4-10基氨基)噻唑-4-甲酰胺)和Y27632((+)-(R)-反式-4-(1-氨乙基)-N-(4-吡啶基)环己甲酰胺二盐酸盐,例如来自Tocrisbioscience的目录号1254)。在一个优选实施方案中,该ROCK激酶抑制剂是Y27632。在一个实施方案中,该多能性培养基是含有2-20μMY27632、优选5-10μMY27632的无血清培养基。在另一实施方案中,该多能性培养基是含有2-20μMFasudil的无血清培养基。在另一实施方案中,该多能性培养基是含有0.2-10μMThiazovivin的无血清培养基。使用本文中所呈现的新方法,现在可能以至多60-98%的产率从多能干细胞分化表达α辅肌动蛋白和肌钙蛋白T的心肌细胞。在一个实施方案中,该方法进一步包括步骤e)重新接种细胞,并在无胰岛素培养基中孵育它们。此步骤进一步提高心肌细胞的纯度。在一个实施方案中,重新接种细胞,并在补充了胎牛血清的无胰岛素培养基中孵育18-32小时,优选24小时。在一个这种实施方案中,该培养基进一步包含ROCK抑制剂。在一个实施方案中,该ROCK抑制剂是Y-27632。通过本文所述方法获得的心肌细胞可以扩增几代,并在冷冻和解冻后保持其功能特性。本文所用的术语“分化”指低分化细胞转变为体细胞,例如多能干细胞转变为心肌细胞的一个或多个步骤。通过本文所述的方法达到多能干细胞向心肌细胞的分化。本文所用的术语“干细胞”指具有自我更新能力的细胞。本文所用的“未分化的干细胞”指具有分化为多种细胞类型的能力的干细胞。如本文所用,本文所用的“多能干细胞”指可以产生多种细胞类型的细胞的干细胞。多能干细胞(PSC)包括人胚胎干细胞(hESC)和人诱导型多能干细胞(hiPSC)。人诱导型多能干细胞可以源自重编程体细胞,例如,通过本领域已知的方法转导四种确定的因子(Sox2、Oct4、Klf4、c-Myc)。人体细胞可以获自健康个体或获自患者。这些供体细胞可以容易地从任意适宜的来源获得。本文优选的是允许分离供体细胞而不在人体上进行侵入性操作的来源,例如人皮肤细胞、血细胞或可从尿液样品获得的细胞。虽然优选人多能干细胞,但该方法也适用于非人多能干细胞,如灵长类、啮齿类(例如大鼠、小鼠、兔)和狗多能干细胞。本文所用的“心肌细胞”是这样的细胞,其至少表达细胞标志肌钙蛋白T(2型肌钙蛋白T(心脏),基因符号TNNT2,EntrezGene:7139,UniProtKB:P45379),且在优选实施方案中还表达细胞标志α辅肌动蛋白(ACTN2辅肌动蛋白,α2,基因符号ACTN2,EntrezGene:88,UniProtKB:P35609)。肌钙蛋白T和/或α辅肌动蛋白的表达可以通过本领域已知的方法,例如通过实施例部分中所述的FACS分析来评估。心肌细胞可以表现自发性周期性收缩活动(“跳动”)。这意味着,在将通过本发明的方法获得的心肌细胞培养在具有适当Ca++浓度和电解质平衡的适宜组织培养环境中时,可以观察到细胞以周期性方式跨细胞的一个轴收缩,然后从收缩释放,而无需向培养基中加入任何附加成分。此外,通过本文公开的方法获得的细胞可以表现心肌细胞的其他特征,如离子通道或适当的电生理学。本文所用的“增殖心肌细胞”是表达α辅肌动蛋白和肌钙蛋白T且通过细胞分裂增殖的细胞。“标志的表达”指某个基因转录为mRNA,且随后通常翻译为在细胞中发挥某种功能的蛋白质(其基因产物)。标志的表达可以通过本领域已知的方法在RNA水平或在蛋白质水平检测和定量。本文优选的是例如通过用结合标志的抗体测试某种蛋白质的存在来在蛋白质水平检测标志的表达。任意以上实施方案可以单独存在或组合存在。在本发明的一个实施方案中,提供用于产生患者特异性或健康个体特异性心肌细胞的方法。为此,用本文所述的方法使获自患者或健康个体的人诱导型多能干细胞(iPSC)分化为心肌细胞。可以通过本领域已知的方法重编程获自患者或健康个体的体细胞为多能干细胞,来获得患者特异性人iPSC。例如,可以通过皮肤活检从需要治疗的个体或从健康个体获得成纤维细胞、角质形成细胞或脂肪细胞,并通过本领域已知的方法重编程为诱导型多能干细胞。适合作为诱导型多能干细胞的来源的其他体细胞是从血液样品获得的白细胞,上皮细胞,或从尿液样品获得的其他细胞。然后可以通过本文所述的方法使患者特异性诱导型多能干细胞分化为患者特异性或健康个体特异性心肌细胞。在本发明的另一方面,提供通过任意前述方法产生的心肌细胞群体。优选地,心肌细胞群体为患者特异性的,即源自从患病个体获得的iPSC。在另一实施方案中,该心肌细胞群体获自健康个体。患者来源的心肌细胞是研究如扩张型心肌病、肥厚型心肌病、限制型心肌病、致心律失常型右室心肌病、冠心病的疾病的病理生理学的疾病相关体外模型。在一个实施方案中,通过此方法获得的心肌细胞用于筛选逆转、抑制或预防由心脏细胞功能障碍引起的疾病(例如心脏肥大、跳动效率降低、心肌细胞条纹错构、钙处理不足)的化合物。优选地,通过本文所述的本发明的方法获得的心肌细胞源自患病个体。在另一实施方案中,通过此方法获得的心肌细胞用于筛选和评价用于治疗心脏病(例如上文提到的那些)的新靶标和化合物。优选地,通过本文所述的本发明的方法获得的心肌细胞源自患有疾病(例如扩张型心肌病、肥厚型心肌病、限制型心肌病、致心律失常型右室心肌病、冠心病)的个体。从患病个体分化心肌细胞是在人背景模式中早期评价药物安全性的唯一机会。在另一实施方案中,通过此方法获得的心肌细胞用作心脏的体外模型。本发明提供高效的方法来提供患者特异性心肌细胞或来自具有适合用于移植的相同HLA类型的健康个体的相容细胞,二者均在无异种条件下衍生。“无异种培养条件”指仅包含人和重组来源的成分的用于附着的培养基和底物。因此,避免了受异种病原体污染的风险,肾细胞可安全地用于再生医学。用本文所述的方法使患者特异性诱导型多能干细胞(iPSC)分化为患者特异性心肌细胞是可容易地进行和重现的产生自体来源的心肌细胞的技术。自体和/或相容细胞在细胞治疗中的使用提供了超过使用非自体细胞的巨大优势,非自体细胞可能经受免疫学排斥。相反,自体细胞不可能引出显著的免疫学反应。在本发明的另一优选方面,设想产生患者特异性心肌细胞的生物银行。在一个实施方案中,产生包含获自健康个体和/或患者的不同心肌细胞群体的生物银行。本文所用的术语“生物银行”指从不同个体或物种采集的生物样品的文库。样品和相关数据的存档汇编旨在用于研究目的,目的是研究与扩张型心肌病、肥厚型心肌病、限制型心肌病、致心律失常型右室心肌病、冠心病相关的疾病。在另一实施方案中,该生物银行用于血管再生医学方法。在另一方面,本发明提供包含通过任意前述方法产生的心肌细胞或包含任意前述细胞群体的治疗组合物。优选地,该治疗组合物进一步包含生理学上相容的溶液,包括例如含5%人血清白蛋白的磷酸缓冲盐溶液。该治疗组合物可以用于治疗、预防或稳定疾病,例如扩张型心肌病、肥厚型心肌病、限制型心肌病、致心律失常型右室心肌病、冠心病。例如,可以通过皮肤活检从需要治疗的个体或从健康个体获得成纤维细胞、角质形成细胞或脂肪细胞,并通过本领域已知的方法("Inductionofpluripotentstemcellsfromadulthumanfibroblastsbydefinedfactors."Takahashi等,2007,Cell131,861-72)重编程为诱导型多能干细胞。适合作为诱导型多能干细胞的来源的其他体细胞是从血液样品获得的白细胞、上皮细胞,或从尿液样品获得的其他细胞。然后通过本文所述的方法使患者特异性诱导型多能干细胞分化为心肌细胞,收集,并引入该个体来治疗病症。通过本发明的方法产生的心肌细胞可以用于替换或辅助患病或受损组织的正常功能。本发明的另一实施方案是心肌细胞的生物银行在治疗与扩张型心肌病、肥厚型心肌病、限制型心肌病、致心律失常型右室心肌病、冠心病相关的疾病中的用途。该生物银行优选包含获自具有几个HLA类型的患者或健康个体的心肌细胞。将从健康供体获得的细胞移植至具有相容HLA类型的需要治疗的个体避免了通常与异源细胞移植相关的排斥反应的问题。通常,通过施用免疫抑制剂或抗排斥药物如环孢霉素来预防或减轻排斥。但是,这类药物具有显著的副作用,例如免疫抑制、致癌特性、肾脏毒性以及非常昂贵。本发明消除或至少显著减少了对抗排斥药物(如环孢霉素、imulan、FK-506、糖皮质激素和雷帕霉素,及其衍生物)的需要。对于本发明的治疗方法,对哺乳动物施用心肌细胞并非旨在限于具体的施用方式、剂量、或给药频率;本发明考虑所有施用方式,包括肌内、静脉内、关节内、病灶内、皮下、或足以提供足以预防或治疗疾病的剂量的任意其他途径。心肌细胞可以以单个剂量或多个剂量对哺乳动物施用。在施用多个剂量时,剂量可以相互间隔例如一周、一个月、一年或十年。在施用细胞之前、期间或之后,也可以使用一种或多种生长因子、激素、白介素、细胞因子、小分子或其他细胞,以进一步使它们偏向特定细胞类型。实施例材料和方法CP21R7:3-(3-氨基-苯基)-4-(1-甲基-1H-吲哚-3-基)-吡咯-2,5-二酮(本文中也称为“化合物21”或“CP21”;参见例如L.Gong等;Bioorganic&MedicinalChemistryLetters20(2010),1693-1696)CP21R7Wnt-C59:2-(4-(2-甲基吡啶-4-基)苯基)-N-(4-(吡啶-3-基)苯基)乙酰胺(CellagenTechnology,目录号C7641-2s,WO2010101849):人ESC:SA001、LOTCA001于2001年3月20日在University和CellartisABArvidWallgrensBacke20,SE-41346瑞典,按照瑞典所有适用法律分离,并由University和UppsalaUniversity的地方研究伦理委员会(LocalResearchEthicsCommittees)批准。胚胎来源:冷冻,来自IVF的剩余物。供体保密性:为了保护供体的隐私和保密,所有与胚胎供体相关的标识都已去除。因此,不能得到关于供体的信息。应指出,捐献未使供体获得任何经济利益。我们获批进行hESC研究和衍生不同细胞系。责任伦理会员会(EthikkommissionbeiderBasel)和联邦公共卫生办公室已批准了我们的研究项目。(Ref-No:R-FP-S-1-0002-0000)。人iPSC:来自SBISystemBiosciences的目录号SC101A-1批号110218-FF/来自LifetechnologiesEpisomalhiPSCLine的目录号A13777。人多能干细胞常规培养在TeSR1培养基(StemcellTechnologies)中的hESC-qualifiedMatrigel(BDBioscience)上。培养物每4-6天用StemProAccutase(Invitrogen)传代。为了提高活率,TeSR1培养基在酶解离之前1小时包含10μMROCK抑制剂。500ml分化培养基RPMI1680+Glutamax481mlGIBCO#61870维生素C(10mg/ml)4mlSigma#A4544(终浓度:80μg/ml)B27-胰岛素(50x)10mlInvitrogen#05-0129SA青霉素/链霉素5mlGIBCO#15140-122(终浓度:50U/ml)500ml扩增培养基RPMI1680+Glutamax481mlGIBCO#61870维生素C(10mg/ml)4mlSigma#A4544(终浓度:80μg/ml)B27+胰岛素(50x)10mlInvitrogen#12587-01青霉素/链霉素5mlGIBCO#15140-122(终浓度:50U/ml)本文中所用的其他试剂和材料:Matrigel(BDBioscience,目录号354277)mTeSR1培养基(StemcellTechnologies,目录号05850)Accutase(InnovativeCellTechnologies,目录号AT-104)Rock抑制剂Y-27632(Millipore,目录号SCM075)RPMI培养基(LifeTechnologies的Gibco,目录号61870)维生素C(Sigma,目录号A4544)补充剂不含胰岛素(LifeTechnologies的Gibco,目录号0050129SA)青霉素-链霉素(LifeTechnologies的Gibco,目录号15070)50xB27加胰岛素不含维生素A(LifeTechnologies的Gibco,目录号12587)0.05%胰蛋白酶/EDTA,1x(LifeTechnologies的Gibco,目录号25300)autoMACS运行缓冲液(Miltenyi,目录号130-091-221)InsidePerm+InsideFix(Miltenyi,InsideStainKit,目录号130-090-477)0.1%明胶(Millipore,Cat.ES-006-B)冻存管(Corning#430659)Mr.Frosty冷冻容器(ThermoScientific#5100-0001)DMSO(Sigma#D2438)胎牛血清(Invitrogen#16000044)Falcon细胞培养皿35x10mm(BD#353001)Falcon细胞培养皿100x20mm(BD#353003)6孔板CorningCostar(Sigma#CLS3516)抗肌节α辅肌动蛋白[EA-53]抗体(Abcam,目录号ab9465)抗心脏肌钙蛋白T抗体(Abcam,目录号ab45932)Alexa488和驴抗小鼠IgG(H+L)(Invitrogen,目录号A21202)Alexa647驴抗兔IgG(H+L)(Invitrogen,目录号A31573)Alexa555驴抗兔IgG(H+L)(Invitrogen,目录号A31572)Hoechst33258,五水合物(bis-Benzimide)(MolecularProbes,目录号H3569)从人胚胎干细胞(hESC)和诱导型多能干细胞(iPSC)分化心肌细胞人胚胎干细胞(hESC)或诱导型多能干细胞(iPSC)在37℃和5%CO2下培养在Matrigel(BDBioscience,目录号354277)包被的56cm2平皿中的10mlmTeSR1培养基(StemcellTechnologies,目录号05850)中。在开始心肌细胞分化之前,传代细胞3-4次,以确保多能干细胞显示稳定的生长和倍增时间。为了繁殖多能干细胞而保持其多能状态,按以下处理hESC或iPSC:用10mlPBS-/-洗涤一次,然后用3mlAccutase(InnovativeCellTechnologies,目录号AT-104)在37℃和5%CO2下孵育2-3分钟,以脱附细胞。用7mlmTeSR1终止Accutase的酶促反应,然后500xg离心细胞3分钟。将细胞重悬在10mlmTeSR1中,并计数。为了进一步培养,将2x106细胞接种在现包被Matrigel的56cm2平皿上。此外,在37℃和5%CO2下在10mlmTeSR1和10μMRock抑制剂Y-27632(Millipore,目录号SCM075)中培养hESC或iPSC。随后,每天更换10mlmTeSR1培养基,培养多能干细胞至80%密度,然后传代。为了成功分化为心肌细胞,用5.5x105/cm2的hESC或iPSC按高密度接种多能干细胞。按上文针对多能干细胞所述进行传代和培养。24小时(1天)后,用180μl/cm2PBS-/-洗涤hESC或iPSC一次,将培养基换为180μl/cm2分化培养基。为了起始多能干细胞向心脏系的分化,培养基包含2μM化合物21(CP21),CP21是糖原合酶激酶3(GSK3β)的小分子高选择性抑制剂。用CP21孵育24小时后(第2天),用上文所述PBS-/-洗涤细胞,并在220μl/cm2分化培养基中培养48小时。48小时后(第4天),用上文所述PBS-/-洗涤细胞,并在含有2μMWnt-C59(CellagenTechnology,目录号C7641-2s,WO2010101849)的220μl/cm2分化培养基中培养48小时,Wnt-C59是阻断wnt分泌的有效的wnt信号发放抑制剂。48小时后(第6天),用上文所述PBS-/-洗涤细胞,并在220μl/cm2分化培养基中培养48小时。48小时后(第8天),用上文所述PBS-/-洗涤细胞,并在含有维生素C、青霉素-链霉素但现在包括加胰岛素而不含维生素A的B27的220μl/cm2RPMI培养基(=扩增培养基)中培养48小时。可见为跳动细胞的第一批心肌细胞在分化的第8天观察到,并进一步增加至第14天。随后每48小时用220μl/cm2扩增培养基进行培养基更换。细胞表征为了测试分化方法的效率,在分化第14天用对心肌细胞特异的抗原通过细胞免疫组织化学和荧光激活细胞分选(FACS)表征心肌细胞。荧光激活细胞分选(FACS)分析用180μl/cm2PBS-/-洗涤细胞,用100μl/cm20.05%1x胰蛋白酶/EDTA(LifeTechnologies的Gibco,目录号25300)在37℃和5%CO2下解离5-10分钟。根据需要,轻轻从培养容器刮下细胞,上下吹吸,随后在37℃和5%CO2下孵育5-10分钟。然后加入三倍扩增培养基和10%胎牛血清(FBS)。然后,通过100μm细胞滤过器过滤细胞,并计数。为了分析,将1x106细胞悬液转入1.5ml管。500xg离心3分钟后,弃上清,用50μlInsideFix(Miltenyi,InsideStainKit,目录号130-090-477)和50μlPBS-/-在室温下避光固定细胞15分钟。然后加入100μlautoMACS运行缓冲液(Miltenyi,目录号130-091-221),并离心。弃上清,用100μlInsidePerm(Miltenyi,InsideStainKit,目录号130-090-477)洗涤细胞,离心,并弃上清。用1:100稀释在InsidePerm中的抗肌节α辅肌动蛋白[EA-53]抗体(Abcam,目录号ab9465)和抗心脏肌钙蛋白T抗体(Abcam,目录号ab45932)4℃孵育细胞1小时。然后用500μl运行缓冲液洗涤细胞,离心,并弃上清。用第二抗体(1:1000于InsidePerm中)在室温下孵育细胞10分钟。使用了以下第二抗体:Alexa488驴抗小鼠IgG(H+L)(Invitrogen,目录号A21202)和Alexa647驴抗兔IgG(H+L)(Invitrogen,目录号A31573)。随后,用500μl运行缓冲液洗涤细胞,离心后,将细胞重悬在500μl运行缓冲液中,并通过荧光激活细胞分选(FACS)系统测量。用不同CP21浓度从人胚胎干细胞(hESC)和诱导型多能干细胞(iPSC)分化心肌细胞用不同CP21浓度重复上述流程。结果显示在下表中:(-)未获得心肌细胞,(+)-(+++):所获得的心肌细胞的量。Cp21浓度μM00.3123510实验I--++++++-实验II--+++++--实验III--+++++--纯化为了提高心肌细胞的纯度,发展了富集步骤。如上文所述,用180μl/cm2PBS-/-洗涤细胞,并用100μl/cm20.05%1x胰蛋白酶/EDTA(LifeTechnologies的Gibco,目录号25300)在37℃和5%CO2下解离5-10分钟。根据需要,轻轻从培养容器刮下细胞,上下吹吸,随后在37℃和5%CO2下孵育5-10分钟。然后加入三倍扩增培养基和10%胎牛血清(FBS)。然后,通过100μm细胞滤过器过滤细胞,并计数。将130μl/cm20.1%明胶(Millipore,目录号ES-006-B)现包被的平板37℃孵育1小时。将2.7x105/cm2细胞接种在180μl/cm2扩增培养基10%胎牛血清(FBS)中。此外,加入10μMRock抑制剂。24小时后,用不含FBS和Rock抑制剂的扩增培养基更换培养基。每48小时更换培养基。在第18-21天,用FACS分析细胞,并按上文所述再次重新以不同型式接种进行以下分析:免疫荧光染色、xCELLigence,以检测跳动节律和化合物在干细胞来源心肌细胞中的致心律失常效应。将细胞转移至符合测定条件的平板型式。使细胞在200μl/cm2扩增培养基加10%胎牛血清(FBS)中附着24小时。此外,加入10μMRock抑制剂。24小时后,更换为不含FBS和Rock抑制剂的220μl/cm2扩增培养基。每48小时更换培养基。心肌细胞的冷冻和解冻在第14天,按上文所述重新接种心肌细胞用于纯化方法。在第18天,按上文所述解离细胞,然后通过FACS分析其α辅肌动蛋白和肌钙蛋白T表达。对含有80%及以上心肌细胞的培养物进行冷冻流程。低于80%心肌细胞的培养物废弃。计数细胞,每个冻存管(cryogenicvial)用1ml含10%DMSO和10μMY-27632的冷FBS冷冻4x106个细胞。细胞500xg离心3分钟,然后小心地重悬在补充了10%DMSO和10μMY-27632的FBS中。将心肌细胞悬液的1ml整分试样装入4℃预冷的冻存管中,并在-80℃冷冻24小时。然后将冻存管保存在液氮中。为了解冻心肌细胞,在37℃水浴中孵育管1-2分钟,小心地将细胞转入10ml扩增培养基加10%胎牛血清中。300xg离心细胞2分钟。然后将沉淀重悬在6ml扩增培养基加10%胎牛血清和10μMY-27632中,接种在0.1%明胶包被的6孔板的3个孔中。24小时后,将细胞更换为220μl/cm2不含FBS和Y-27632的扩增培养基。然后每3天更换培养基,5-7天后将细胞接种在符合测定条件的平板型式中(例如,用于检测心脏条纹错构的测定:96孔型式;用于记录跳动频率的测定:96孔型式)。xCELLigent心肌细胞跳动分析异丙基肾上腺素通过刺激心脏β-1受体来提高心率和心肌收缩力。为了在干细胞来源心肌细胞中检测此致心律失常效应,将7x104/cm2细胞接种在用130μl/cm20.1%明胶37℃包被1小时的特殊E-PlateCardio96(Roche,目录号05232368001)上。按上文所述使细胞附着于平板并恢复2天后,将培养基换为iCell心肌细胞维持培养基(CellularDynamics,目录号CMM-100-120-005)。用xCELLigenceRTCACardioSystem(RocheAppliedScience)测量细胞。接种7天后,用3μM异丙基肾上腺素处理细胞,并直接测量。按12.9ms的分辨率测量每块96孔板。前3分钟不间断测量,随后的24小时每15分钟测量1分钟持续时间。免疫荧光染色对于免疫荧光染色,用4%多聚甲醛在室温下固定细胞15分钟。用PBS-/-洗涤细胞后,用含10%驴血清和0.1%Triton的PBS-/-(封闭缓冲液)在室温下封闭和透化细胞20分钟。然后,用1:100稀释的一抗抗肌节α辅肌动蛋白[EA-53]抗体(Abcam,目录号ab9465)和抗心脏肌钙蛋白T抗体(Abcam,目录号ab45932)在封闭缓冲液中4℃过夜染色细胞。用PBS-/-洗涤细胞,并用1:1000稀释在封闭缓冲液中的二抗Alexa488和驴抗小鼠IgG(H+L)(Invitrogen,目录号A21202)和Alexa555驴抗兔IgG(H+L)(Invitrogen,目录号A31572)在室温下,在封闭缓冲液中染色。几个PBS-/-洗涤步骤后用1:1000稀释在PBS-/-中的Hoechst33258五水合物(bis-Benzimide)(MolecularProbes,目录号H3569)染色细胞核。结果分化后,针对其心肌细胞含量分析细胞。图1显示定量分化第14天的心肌细胞的FACS分析。获得了表征为α辅肌动蛋白和肌钙蛋白T双阳性细胞的平均80-90%心肌细胞。在图1中,一个细胞亚群染色为α辅肌动蛋白单阳性(5-10%)。这指示更不成熟的心肌细胞,由于此原因,此群体未包括在评分中。此结果独立于用hESC(图1A)还是iPSC(图1B)作为多能干细胞的来源。开始于5.5x105/cm2多能干细胞,分化流程产生平均4-5x105/cm2α辅肌动蛋白和肌钙蛋白T阳性心肌细胞。为了证明分化流程的稳健性,我们进行了几次实验,并分析了每个培养物中心肌细胞的含量。图2显示10次独立的实验,显示向心肌细胞的分化效率在95%和40%之间。但是,大多数实验(10次实验中的7次)显示超过75%的心肌细胞含量,这是可接受的比例。产生60%心肌细胞及以上的实验继续进行。低于60%心肌细胞的分化废弃。实验间的变异性最有可能由分化开始时多能干细胞的质量和培养状态引起。为了进一步提高心肌细胞的纯度,建立了附加的纯化步骤。在分化第14天,脱附细胞,并通过FACS分析。图3A显示,培养物计数9x105/cm2细胞在第14天包含60%(5.4x105/cm2)心肌细胞。为使纯化方法成功,α辅肌动蛋白阳性细胞的最小百分比应为60%及以上。重新接种解离的细胞(2.7x105/cm2),并培养在扩增培养基中。7天后,收集细胞,计数4.5x105/cm2细胞,并分析。图3B显示,纯化步骤后,培养物中心肌细胞含量从60%提高至98%,证明通过使用此方法有效地产生了4.4x105/cm2高度富集的心肌细胞。然后,将细胞转移至符合测定条件的培养型式。通过免疫荧光分析心肌细胞进行进一步表征。图4显示使用抗α辅肌动蛋白(绿色)、肌钙蛋白T(红色)的抗体及细胞核特异的Hoechst染料(蓝色)的第27天的心肌细胞免疫荧光染色。所得到的图4中的免疫荧光显示心肌细胞特征性的α辅肌动蛋白和肌钙蛋白T特异性条纹。心脏上β受体的激活诱导心肌细胞中的正性变时作用(positivechronotropiceffect)。为了确认多能干细胞来源的心肌细胞响应β受体激活,用β受体激动剂异丙基肾上腺素孵育心肌细胞,然后用xCELLigence系统分析。图5显示,与未处理的对照相比,用3μM异丙基肾上腺素孵育多能干细胞来源的心肌细胞后,跳动速率从45提高至60次跳动/分钟。此实验进一步证明,通过此分化流程产生的多能干细胞来源的心肌细胞类似于功能性人心肌细胞。由于解冻后低水平的细胞恢复,心肌细胞的冷冻和解冻通常很困难。由于具有大批相同的细胞对测定开发很重要,我们测试了多能干细胞来源的心肌细胞是否可以保存在冰箱中,然后解冻。我们尝试在不同时间(第14、18和32天)冷冻分化的心肌细胞。如图6中可见,在较早分化阶段冷冻的心肌细胞在解冻后显示较高的细胞存活率。但是,在分化第18天纯化后解冻的细胞提供了将细胞用于药物测定的最佳条件。在此阶段,细胞在解冻后显示高得多的纯度,心肌细胞可直接转移至符合测定型式的细胞培养容器上。当解冻在分化第32天冷冻的心肌细胞时,存活率非常低,许多细胞丢失。这是由于处于此阶段的细胞的低增殖速率导致心肌细胞解冻后的低恢复。我们确定,冷冻多能细胞来源的心肌细胞的最适时间是在分化第18天纯化之后。在此阶段,恢复率平均超过85%α辅肌动蛋白和肌钙蛋白T阳性细胞,心肌细胞仍在增殖,提供了将细胞进一步用于测定开发的最适条件。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1