在铜使用下重组蛋白表达的增强的制作方法
该申请基于2014年3月23日提交的61/969,215,并要求其优先权。关于联邦资助的研究或开发的声明:不适用。
技术领域:
自二十世纪八十年代以来,已通过基于分批方法或灌注的细胞培养制得重组蛋白。本发明提供通过铜添加剂的使用而提高的特别是在哺乳动物细胞中的细胞表达。该发明适于许多哺乳动物细胞培养,例如CHO、BHK和人细胞系,特别是CHO,其还适于许多重组蛋白的表达,例如重组因子VIII(rFVIII)、B结构域缺失的rFVIII以及重组因子VII/因子VIIa(rFVII/rFVIIa)。
背景技术:
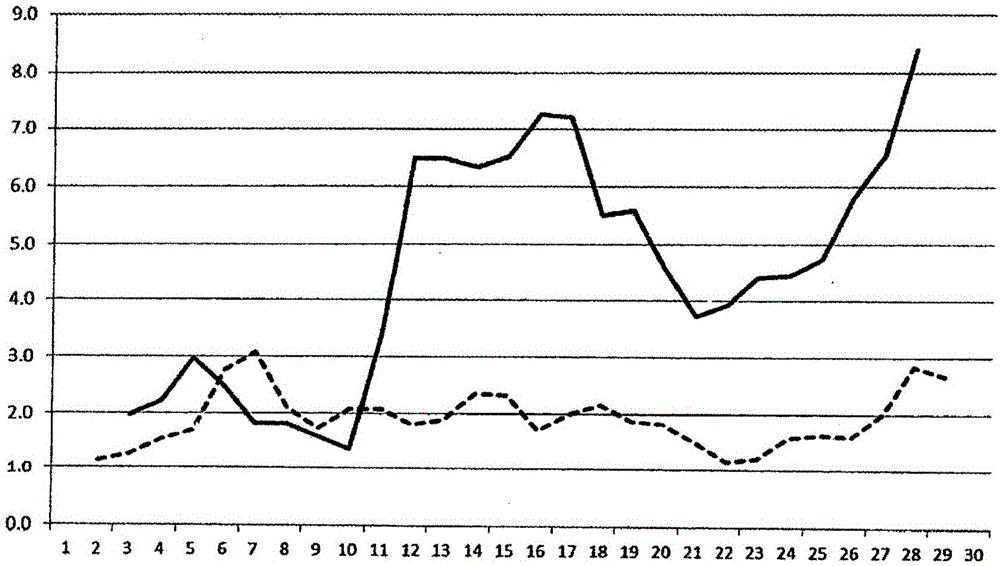
:铜对于细胞生长和存活来说是必不可少的。因为铜的不可或缺的营养价值、用作氧化应激催化剂的化学作用以及其沉淀习性,所以至为重要的是了解、监测并配制铜以用于特定的细胞培养系统和应用中。铜为在体外平衡状态下以还原态(亚铜的)Cu(I)以及氧化态(二价铜的)Cu(II)、铜存在的过渡金属。在其游离形式和某些螯合物中,铜可积极参与氧化还原循环。它氧化大量的重要培养基成分例如半胱氨酸和抗坏血酸盐,以使细胞培养过程最优化。在体外,Cu(I)将与还原态半胱氨酸、谷胱甘肽以及可能的有机巯基物自发地形成复合物。除了形成二价铜-胱氨酸复合物外,Cu(II)还将与其它氨基酸通过它们的α-氨基氮和羧基-氧基团的配位而形成复合物。Cu(II)结合到组氨酸很重要,因为这似乎是涉及Cu(II)从清蛋白迁移到细胞的媒介。在铜可以穿过细胞膜之前,其必须还原为Cu(I)。铜能够通过氧化和沉淀引起半胱氨酸和胱氨酸从细胞培养基中耗损。在体外,半胱氨酸是易溶解的,其几乎仅作为中性氨基酸而存在。半胱氨酸不稳定,在二分子氧存在下经受非酶促自氧化而形成胱氨酸。二价铜的铜促进半胱氨酸到胱氨酸的自氧化。二价铜的铜可以与胱氨酸形成螯合沉淀物。半胱氨酸从细胞培养中的消耗将停止蛋白和谷胱甘肽(重要的还原剂)的合成。还原态谷胱甘肽能够与Cu(I)复合,从而抑制其参与羟基自由基的形成。该相互作用涉及半胱氨酸硫原子。在体内,Cu(I):谷胱甘肽复合物可能通过铜转运体1通道介导进入细胞质的Cu(I)安全迁移至细胞内结合蛋白例如金属硫蛋白。Cu(I):谷胱甘肽复合物的形成是自发非酶促的[Dierick,P.J.(1986),Invitrointeractionoforganiccopper(II)compoundswithsolubleglutathioneS-transferasesfromratliver.Res.Commun.ChemPathol.Pharmacol.51,285-288]。附图说明图1A和图2A示出高铜水平在培养中对重组蛋白表达的影响。在两幅图中,Y-轴表示关于所获得的重组蛋白滴度的归一化数据。虚线表示使用不含额外添加的铜,即仅以基础水平0.087微摩尔的铜自然存在于培养基中的培养基所获得的数据。X-轴表示生物反应器天数。实线表示当添加额外的铜时所获得的蛋白滴度。图1B和图2B示出高铜水平对重组蛋白比产率(specificproductivity)的影响。在两幅图中,Y-轴表示关于重组蛋白比产率的归一化数据,其相对于在X-轴上的生物反应器天数。虚线再次表示使用不含额外添加的铜,即仅以基础水平0.087微摩尔的铜自然存在于培养基中的培养基所获得的数据。实线表示当添加额外的铜时所获得的蛋白比产率。图3A和图3B分别示出对于在培养基中所查出的基础水平的铜和所添加的各种水平的铜(0.315、0.629和1.259微摩尔)来说,相对于生物反应器天数的重组蛋白滴度和重组蛋白比产率。图4是归一化的比产率(qp)相对于渗透克分子浓度和铜浓度的曲面图。详细说明该数据产生于2013年,当时使用基于膜的外部细胞截留装置并使用没有铜增补的培养基来操作过程。用在普通培养基中所查出的16-160纳摩尔的铜水平来进行以(-)铜表示的基础培养。当两个生物反应器收到增补铜的培养基时获得有关铜添加的益处的第一实验证据。铜的添加发生在第十天,并显示出对重组蛋白表达的即刻影响,如在示出蛋白表达急剧增加的图中所证明的那样。但是,可在添加细胞之前将二价铜离子源例如硫酸铜或氯化铜或其它具有相似性质的二价铜盐添加至培养基,其具有相似的结果。图1示出将40.9微摩尔铜添加至培养基的影响。通过在与基础运行相同的条件下重复的生物反应器操作来表明蛋白表达增加4至5倍。约40微摩尔铜以二价铜离子形式的添加似乎给出最优化的结果,但是其它在0.5微摩尔至约10.0微摩尔范围内的添加浓度似乎给出相似的结果。为了更好地了解高水平的铜在初始实验运行中的影响,使用量减少的铜来进行附加运行。图2表示使用7.87微摩尔的铜添加所产生的数据。该数据表明在使用与基础生物反应器都等同的所有其它因素下,7.87微摩尔的添加引起蛋白表达增加3至4倍。进行进一步的生物反应器实验以说明更合理的铜水平对蛋白表达的影响。图3表示通过重复的生物反应器所产生的数据,在通过生物反应器运行的过程中改变铜浓度的水平下操作所述重复的生物反应器。维持所有其它参数都等同于基础运行。该数据表明当与图2中所详细描述的7.87微摩尔铜添加相较而言,0.315、0.63和1.26微摩尔的铜浓度将引起与7.87微摩尔等同的3至4倍增加。图4示出在Z(垂直的)轴上的比产率以及分别在X和Y-轴上的铜浓度和渗透克分子浓度。使用6天、250mL摇瓶、分批细胞培养的模型来产生该数据以确定/说明所添加的铜的效果。比产率还可随着培养基渗透克分子浓度的增加而增加,但是所看到的最好的效果是伴随着铜离子的添加。进行实验的响应曲面设计,其中培养是以0.5e6细胞/mL接种至基础培养基,所述基础培养基增补有氯化铜和或任选的氯化钠以分别将铜水平调节为0.087至3.78微摩尔之间,将渗透克分子浓度调节为270至380毫渗透克分子数(mOsmo)之间。每个因子选定五种不同的水平(0.087、0.787、1.495、2.927和3.78微摩尔铜,以及270、310、350、360、380毫渗透克分子数)。然后每日对培养物取样以测定活细胞浓度,进行6天。在第4-6天进行产物浓度评价。比产率表示为平均化在研究中中心点的比产率(310毫渗透克分子数,1.49微摩尔铜)而被归一化的在分批培养第4和6天之间的平均比产率。如在图4中所示,比产率随着渗透克分子浓度的增加和铜浓度的增加而存在明显的增加。从来自响应曲面设计实验的数据的统计分析来看,铜和渗透克分子浓度两者都显示出对比产率高度显著的效果,P=0.000(任何P<0.05都视为是显著的),但是也在这两者之间存在统计学上显著的相互作用P=0.003,见表1。根据为模型化该数据而开发的方程,比产率在渗透克分子浓度270下随着铜浓度从0.087到3.78微摩尔的增加而从0.134增加到0.355,而在渗透克分子浓度380下从1.2增加到2.15。同样地,比产率在0.087微摩尔铜下随着渗透克分子浓度从270到380的增加而从0.143明显增加到1.22,而在3.78微摩尔铜下从0.355明显增加到2.158。表1项CoefSECoefTP常数1.285620.0305342.1070.000Osmo0.716340.0337221.2450.000Cuppb0.288430.034928.2600.000Osmo*Osmo0.102100.048822.0910.063Cuppb*Cuppb-0.313750.05114-6.1350.0000Osmo*Cuppb0.182230.045534.0020.003表1给出回归模型方程的系数,所述回归模型方程适于作为渗透克分子浓度和铜浓度的函数所收集的比产率数据。如在表1中第一栏所示,方程由一个常数、两个线性项(Osmo,Cuppb)、三个非线性项(Osmo*Osmo,Cuppb*Cuppb,Osmo*Cuppb)组成。“Osmo”项表示培养的渗透克分子浓度,而“Cuppb”表示铜浓度。用于每一项的系数列在第二列(Coef)中,以及那些系数的标准误差列在第三列(SECoef)中。第四列是系数的T统计量,为系数除以系数标准误差的商。T值的量级越大,系数的显著性也越大。第五栏表示用于每一项的p-值,其小于0.05的值被认为表明统计显著性。如可在表1中所见,除了Osmo*Osmo项之外的所有项都具有小于0.05的p-值,因此它们都被认为是显著的。以下示出最终的回归方程。Qp=1.28562+0.71634*Osmo+0.28843*Cuppb+0.10210*Osmo*Osmo-3.1375*Cuppb*Cuppb+0.18223*Osmo*Cuppb发明概括在本文中提供增加哺乳动物细胞的细胞表达方法,其包括将铜添加剂用于细胞培养基。优选将约0.5微摩尔至约10.0微摩尔的铜添加至细胞培养基。0.5微摩尔铜至约10.0微摩尔铜的类似添加提供增加的细胞比产率。特别优选二价铜离子用作铜添加剂。制备系统由增强的细胞培养基和哺乳动物细胞组成。在细胞培养基中使用的哺乳动物细胞优选为CHO、BHK或人哺乳细胞。不稳定的重组蛋白是用于利用基于膜的细胞截留系统以及铜添加剂进行表达的特别好的候选蛋白。该系统利用灌注细胞培养对制备凝固性蛋白是有用的,所述凝固性蛋白选自重组因子VIII、B结构域缺失的重组因子VIII、重组因子IX以及rFVII或rFVIIa。添加增加培养基渗透克分子浓度的其它主体离子如钠和钾进一步增强蛋白表达。优选将所述方法与基于膜的细胞截留系统和灌注细胞培养结合使用。最优选的是将该提高的重组蛋白表达方法应用于增加B-结构域缺失的重组FVIII在哺乳动物细胞中的表达,其中将约0.5至约10.0微摩尔二价铜离子添加至与制备系统一起使用的细胞培养基,所述制备系统由与基于膜的外部细胞截留系统结合使用的灌注细胞培养组成。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1