DNA甲基化状态作为酒精使用和戒酒的生物标志物的制作方法
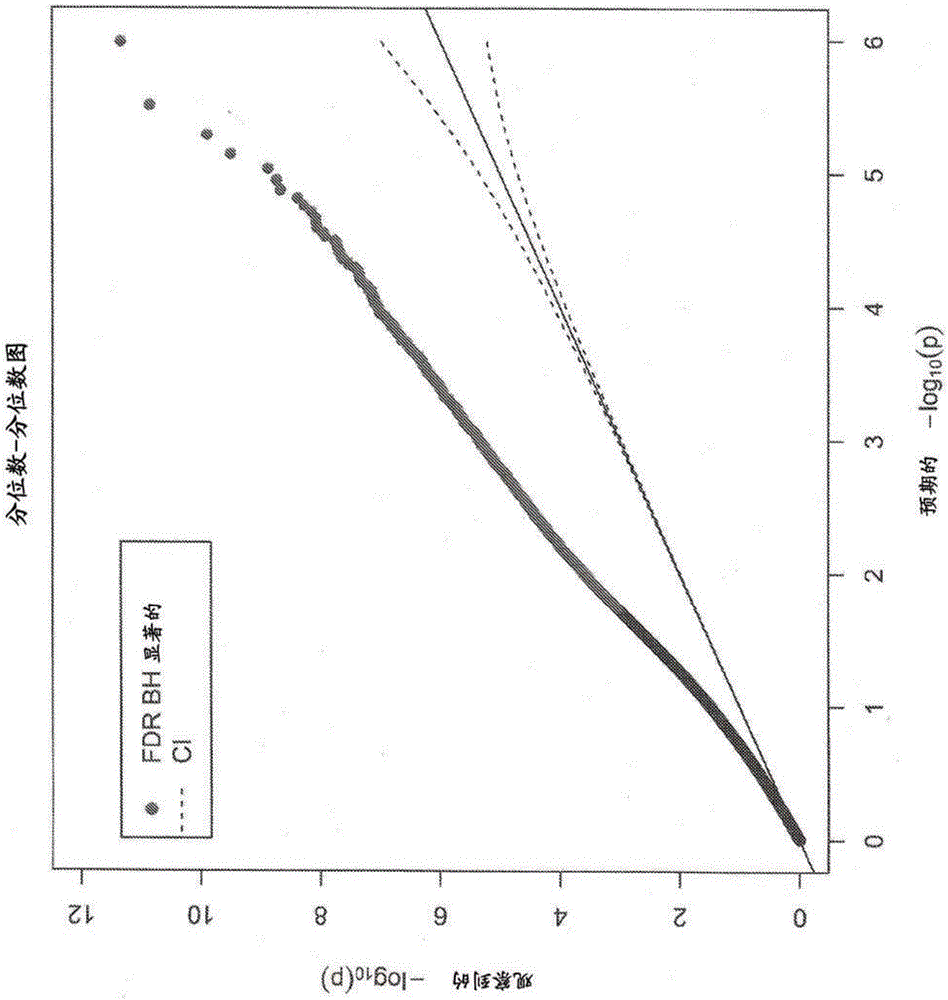
本申请要求于2014年5月30日提交的美国临时申请流水号62/005,408的权益。认为在先申请的此公开公开是本申请的公开内容的一部分(并且通过提及收入本申请的公开内容)。联邦资助的研究或开发本发明是在由国立卫生研究院授予的基金号R43AA022041下在政府支持下做出的。政府对本发明具有某些权利。发明背景酗酒对全世界数以千万计的个体具有深刻的社会经济和个人影响。不幸的是,做出诊断的能力常常受到对自我报告的依赖阻碍,而监测治疗响应的能力受到缺乏强力和可靠的生物标志物挑战。发明概述本公开内容提供了可以用于测定个体是否在使用酒精,和还用于测定个体是否已经停止使用酒精的方法和材料。在一个方面中,提供了测定个体是否使用酒精的方法。此类方法通常包括测定来自所述个体的生物学样品中的至少一种CpG二核苷酸的甲基化状态;并且关联所述至少一种CpG二核苷酸的甲基化状态以测定所述个体是否使用酒精。在一些实施方案中,所述至少一种CpG二核苷酸包含染色体10的位置71389896。例如,染色体10的位置71389896处的脱甲基化指示以前或当前的酒精使用;并且染色体10的位置71389896处的再甲基化指示较少的酒精使用或无酒精使用(例如戒酒)。在一些实施方案中,所述至少一种CpG二核苷酸包含染色体12的位置54677008。例如,染色体12的位置54677008处的脱甲基化指示以前或当前的酒精使用;并且染色体12的位置54677008处的再甲基化指示较少的酒精使用或无酒精使用(例如戒酒)。在一些实施方案中,所述至少一种CpG二核苷酸包含染色体8的位置75262522。例如,染色体8的位置75262522处的脱甲基化指示以前或当前的酒精使用;并且染色体8的位置75262522处的再甲基化指示较少的酒精使用或无酒精使用(例如戒酒)。在一些实施方案中,所述至少一种CpG二核苷酸包含染色体9的位置92137791。例如,染色体9的位置92137791处的脱甲基化指示以前或当前的酒精使用;并且染色体9的位置92137791处的再甲基化指示较少的酒精使用或无酒精使用(例如戒酒)。在一些实施方案中,所述测定步骤包括:在碱性条件下使所述生物学样品中的DNA与亚硫酸氢盐接触以生成经亚硫酸氢盐处理的DNA;任选地,扩增所述经亚硫酸氢盐处理的DNA以生成扩增的经亚硫酸氢盐处理的DNA;使所述经亚硫酸氢盐处理的DNA或扩增的经亚硫酸氢盐处理的DNA与至少一种寡核苷酸接触,所述寡核苷酸与包含所述至少一种CpG二核苷酸的序列互补;并且检测所述至少一种CpG二核苷酸的甲基化状态。在一些实施方案中,所述至少一种寡核苷酸检测所述经亚硫酸氢盐处理的DNA中处于未甲基化状态的所述CpG二核苷酸。在一些实施方案中,所述至少一种寡核苷酸检测所述经亚硫酸氢盐处理的DNA中处于甲基化状态的所述CpG二核苷酸。代表性的生物学样品包括但不限于外周血,淋巴细胞,尿液,唾液和颊细胞。在一些实施方案中,使用经亚硫酸氢盐处理的DNA测定所述至少一种CpG二核苷酸的甲基化状态。在一些实施方案中,此类方法进一步包括自所述个体获得关于所述个体是否是酒精使用者的自我报告数据。在另一个方面中,提供了用于测定个体是否使用酒精的计算机执行的方法。此类方法通常包括获得与所述使用者相关的测量数据,所述测量数据包括一个或多个测量的CpG甲基化状态;基于获得的测量数据生成预测评分;并且基于所述预测评分,提供所述使用者的酒精使用的可能性。在一些实施方案中,此类方法进一步包括测定所述使用者的CpG甲基化状态,其中甲基化状态的变化是酒精使用的指标。在一些实施方案中,此类方法进一步包括基于所述预测评分输出酒精使用的预测水平。在一个方面中,提供了用于测定至少一种CpG二核苷酸的甲基化状态的试剂盒。此类试剂盒通常包含至少一种长度为至少8个核苷酸的第一核酸引物,其与包含至少一种CpG二核苷酸的经亚硫酸氢盐转化的核酸序列互补,其中至少一种第一核酸引物检测甲基化的CpG二核苷酸。在一些实施方案中,所述试剂盒进一步包含至少一种长度为至少8个核苷酸的第二核酸引物,其与包含至少一种CpG二核苷酸的经亚硫酸氢盐转化的核酸序列互补,其中至少一种第二核酸引物检测未甲基化的CpG二核苷酸。在一些实施方案中,第一核酸引物与包含染色体10的位置71389896处的甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体10的位置71389896处的未甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体12的位置54677008处的甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体12的位置54677008处的未甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体8的位置75262522处的甲基化CpG-二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体8的位置75262522处的未甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体9的位置92137791处的甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,第一核酸引物与包含染色体9的位置92137791处的未甲基化CpG二核苷酸的经亚硫酸氢盐转化的序列互补。在一些实施方案中,如本文中描述的试剂盒可以包括长度为至少8个核苷酸的至少第三核酸引物,其与CpG二核苷酸上游的核酸序列互补。在一些实施方案中,如本文中描述的试剂盒可以包括长度为至少8个核苷酸的至少第四核酸引物,其与CpG二核苷酸下游的核酸序列互补。在一些实施方案中,所述至少第三核酸引物与经亚硫酸氢盐转化的核酸序列互补。在一些实施方案中,所述至少第四核酸引物与经亚硫酸氢盐转化的核酸序列互补。在一些实施方案中,所述至少一种第一核酸引物,所述至少一种第二核酸引物,所述至少一种第三核酸引物和/或所述至少一种第四核酸引物包含一个或多个核苷酸类似物。在一些实施方案中,所述至少一种第一核酸引物,所述至少一种第二核酸引物,所述至少一种第三核酸引物和/或所述至少一种第四核酸引物包含一个或多个合成的或非天然的核苷酸。在一些实施方案中,所述试剂盒进一步包括所述至少一种第一核酸引物所结合的固体基质。代表性的固体基质包括但不限于聚合物,玻璃,半导体,纸,金属,凝胶和/或水凝胶。在一些实施方案中,所述固体基质是微阵列或微流体卡。在一些实施方案中,所述试剂盒还包括可检测标记物。在一些实施方案中,此类试剂盒进一步包含用于将一个或多个CpG位置处的甲基化状态的变化与酒精使用相关联的用法说明。除非另有定义,本文中使用的所有技术和科学术语与方法和物质组合物所属领域的普通技术人员的通常理解具有相同的含义。尽管可以在实践或测试方法和物质组合物中使用与本文中描述的材料和方法相似或等同的方法和材料,但是下文描述了合适的方法和材料。另外,材料,方法和例子仅仅是例示性的,而并不意图为限制性的。通过提及完整收录本文中提及的所有出版物、专利申请、专利和其它参考文献。附图简述图1的图显示来自32名病例受试者的DNA的甲基化状态(在时间T1时)与来自33名戒酒对照的DNA的甲基化状态之间的比较的分位数-分位数(QQ)图。图2的图显示在时间T1时来自25名病例受试者的DNA的甲基化状态与在时间T2时来自相同的25名病例受试者的DNA的甲基化状态之间的比较的QQ图。发明详述使用全基因组方法,本公开内容显示,与戒酒对照相比,酒精使用与DNA甲基化的广泛变化有关。本公开内容还显示DNA甲基化的变化具有作为戒酒的功能而恢复的趋势。如此,可以在临床上使用DNA甲基化以评估酒精使用状态和/或监测酒精治疗响应。核酸甲基化和测定核酸的甲基化状态CpG岛是其中CpG序列的频率高于其它区域的DNA区段。术语CpG中的“p”表示连接半胱氨酸(“C”)核苷酸和鸟嘌呤(“G”)核苷酸的磷酸二酯键。CpG岛经常位于启动子周围,并且经常牵涉调节基因(例如,持家基因)的表达。一般地,CpG岛在表达序列时不是甲基化的,并且受到甲基化以抑制表达(或“灭活”基因)。可以使用任何数目的生物学样品,诸如血液,尿液(例如,尿液中所含来自膀胱和/或尿道的细胞),唾液或颊细胞测定基因组DNA中或特定核酸序列(例如,CpG岛)中一个或多个CpG二核苷酸的甲基化状态。在某些实施方案中,可以获得特定的细胞类型,例如淋巴细胞,嗜碱性粒细胞或单核细胞(例如,自血液样品),并且对DNA评估其甲基化状态。熟练技术人员可以使用任何数目的方法确定基因组DNA,CpG岛或一种或多种特定CpG二核苷酸的甲基化状态。用于评估DNA甲基化状态的最常用方法以对DNA的基于亚硫酸氢盐的反应开始(见例如Frommeretal.,1992,PNASUSA,89(5):1827-31)。商业试剂盒可用于亚硫酸氢盐修饰DNA。见例如EpiTectBisulfite或EpiTectPlusBisulfite试剂盒(Qiagen)。在亚硫酸氢盐修饰后,可以扩增核酸。由于用亚硫酸氢盐处理DNA使未甲基化的胞嘧啶核苷酸脱氨基成尿嘧啶,并且由于尿嘧啶与腺苷配对,在随后的PCR扩增过程中,胸苷被掺入到DNA链中未甲基化的胞嘧啶核苷酸的位置。在一些实施方案中,可以使用一种或多种基于核酸的方法测定DNA的甲基化状态。例如,可以使用本领域中常规的重组分子生物学技术对经亚硫酸氢盐处理的DNA的扩增产物进行克隆和直接测序。软件程序可用于帮助测定经亚硫酸氢盐处理的DNA的原始序列(其包括一个或多个核苷酸的甲基化状态)(例如,CpGViewer(Carretal.,2007,Nucl.AcidsRes.,35:e79))。还有,例如,经亚硫酸氢盐处理的DNA的扩增产物可以与一种或多种寡核苷酸杂交,所述寡核苷酸例如对甲基化的、经亚硫酸氢盐处理的DNA序列是特异性的,或对未甲基化的、经亚硫酸氢盐处理的DNA序列是特异性的。在一些实施方案中,可以使用基于非核酸的方法测定DNA的甲基化状态。代表性的基于非核酸的方法依赖于经亚硫酸氢盐处理的DNA的序列特异性切割,然后进行质谱术(例如,MALDI-TOFMS)以测定甲基化比率(甲基CpG/总CpG)(见例如,Ehrichetal.,2005,PNASUSA,102:15785-90)。此类方法是商品化的(例如,MassARRAY定量甲基化分析(Sequenom,SanDiego,CA))。甲基化状态与酒精使用相关的核酸序列已经显示了某些基因组DNA的甲基化状态在使用酒精的个体中有所改变(相对于非使用者)。见例如,Philibertetal.(2008,Am.J.Med.Genet.BNeuropsychiatr.Genet.,147B:565-70);Philibertetal.(2008,Am.J.Med.Genet.BNeuropsychiatr.Genet.,147B:543-9);Philibertetal.(2009,Psychiatr.Genet.,19:91-8);Philibertetal.(2012,FrontGenet.,3:54);以及美国专利No.8,637,652,通过提及将每篇完整收入本文。本公开内容描述了与酒精使用(例如,重度酒精使用)相关的一种或多种CpG岛和/或特定CpG二核苷酸的甲基化状态的别的变化。见例如,表II,其显示了与酒精使用者的甲基化状态同非饮酒者相比的变化最显著有关的前30种探针;和表III,其显示了酒精使用者和非饮酒者之间的前30种差异调节的基因途径。可以在本文中的方法中使用甲基化状态已经与酒精使用相关联的任何一种或多种CpG二核苷酸以测定预测值(例如,代表酒精使用的可能性)。会理解,特别是对于测定酒精使用,评估的CpG二核苷酸(即甲基化状态已经与酒精使用相关联的CpG二核苷酸)越多,预测值会越准确。另外,会领会,一种或多种邻近CpG二核苷酸的甲基化状态可以与具有酒精使用意义的CpG二核苷酸的甲基化状态处于连锁不平衡中(参见例如,Philibertetal.,2009,Am.J.Med.Genet.B.Neuropsychiatr.Genet.,153B:619-28),并且因此,可以在本文中描述的方法中使用那些邻近的CpG二核苷酸(例如,具有酒精使用意义的CpG二核苷酸上游和/或下游约200个核苷酸(例如上游和/或下游约100个核苷酸;上游和/或下游约50个核苷酸;上游和/或下游约25个核苷酸;上游和/或下游约20个核苷酸;上游和/或下游约10个核苷酸;或上游和/或下游约5个核苷酸))的甲基化状态。此外,会领会,在一些情况中,甲基化状态的变化越大(或更显著),酒精使用越大。见例如Philibertetal.,2012,Epigenetics,7:1-8。核酸和与其相关的方法如本文中使用的,核酸可以包括DNA和RNA,并且包括含有一个或多个核苷酸类似物或主链修饰的核酸。核酸可以是单链或双链的,其通常取决于其意图的用途。如本文中使用的,“分离的”核酸分子是下述核酸分子,其不含天然地在衍生分离的核酸分子的生物体的基因组中在所述核酸的一端或两端侧翼的序列(例如通过PCR或限制性内切核酸酶消化生成的cDNA或基因组DNA片段)。一般地,将此类分离的核酸分子导入载体(例如,克隆载体或表达载体)中以方便操作或产生下面更详细讨论的融合核酸分子。另外,分离的核酸分子可以包括工程化的核酸分子,诸如重组或合成的核酸分子。可以使用本领域中常规的技术分离核酸。例如,可以使用任何方法分离核酸,所述方法包括但不限于重组核酸技术和/或聚合酶链式反应(PCR)。通用PCR技术记载于例如PCRPrimer:ALaboratoryManual,Dieffenbach&Dveksler,Eds.,ColdSpringHarborLaboratoryPress,1995中。重组核酸技术包括例如限制酶消化和连接,其可以用于分离核酸。也可以以单个核酸分子或以一系列寡核苷酸化学合成分离的核酸。还提供了含有核酸(例如,编码多肽的核酸)的载体。载体(包括表达载体)是商品化的或者可以是通过本领域中常规的重组DNA技术生成的。含有核酸的载体可以具有与此类核酸可操作连接的表达元件,并且进一步可以包括序列,诸如那些编码选择性标志物(例如抗生素抗性基因)的。含有核酸的载体可以编码嵌合或融合多肽(即,与异源多肽可操作连接的多肽,所述异源多肽可以在所述多肽的N端或C端)。代表性的异源多肽是可以用于纯化所编码的多肽的那些(例如6xHis标签,谷胱甘肽S-转移酶(GST))。表达元件包括指导和调节核酸编码序列的表达的核酸序列。表达元件的一个例子是启动子序列。表达元件还可以包括调控核酸表达的内含子,增强子序列,应答元件或诱导型元件。表达元件可以是细菌,酵母,昆虫,哺乳动物或病毒起源的,并且载体可以含有来自不同起源的元件的组合。如本文中使用的,可操作连接是指启动子或其它表达元件相对于核酸以这样的方式位于载体中,所述方式指导或调节核酸表达(例如符合读码框)。用于将核酸引入宿主细胞(在体内和在体外两者)的许多方法是本领域技术人员公知的,并且包括但不限于电穿孔,磷酸钙沉淀,聚乙二醇(PEG)转化,热休克,脂转染,显微注射和病毒介导的核酸转移。可以将如本文中描述的载体导入宿主细胞中。如本文中使用的,“宿主细胞”是指引入有核酸的特定细胞,并且还包括此类细胞的后代或潜在后代。宿主细胞可以是任何原核或真核细胞。例如,可以在细菌细胞诸如大肠杆菌(E.coli)中,或在昆虫细胞,酵母或哺乳动物细胞(诸如中国仓鼠卵巢细胞(CHO)或COS细胞)中表达核酸。其它合适的宿主细胞是本领域技术人员已知的。可以使用例如计算机程序,诸如OLIGO(MolecularBiologyInsights,Inc.,Cascade,CO)设计用于扩增或杂交的寡核苷酸。当设计要作为扩增引物使用的寡核苷酸时的重要特征包括但不限于便于检测(例如通过电泳)的适当大小的扩增产物,一对引物的成员的相似解链温度,每条引物的长度(即,引物需要长得足以以序列特异性退火并且启动合成,但不能使得保真度在寡核苷酸合成期间降低)。通常,寡核苷酸引物长度为15至30(例如,16、18、20、21、22、23、24、或25)个核苷酸。可以以与扩增引物的设计类似的方式实施设计要作为杂交探针使用的寡核苷酸。在一些实施方案中,可以设计杂交探针以区分含有不同序列(例如多态性或突变,例如经亚硫酸氢盐处理的DNA中的甲基化对非甲基化序列)的靶物。在Sambrook等人(1989,MolecularCloning:ALaboratoryManual,第2版,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY;第7.37-7.57节,第9.47-9.57节,第11.7-11.8节,和第11.45-11.57节)中详细讨论了核酸之间的杂交。Sambrook等人披露了适合于小于约100个核苷酸的寡核苷酸探针的Southern印迹条件(第11.45-11.46节)。可以使用第11.46节中提供的公式计算长度小于100个核苷酸的序列与第二序列之间的Tm。另外,Sambrook等人披露了大于约100个核苷酸的寡核苷酸探针的Southern印迹条件(见第9.47-9.54节)。可以使用Sambrook等人的第9.50-9.51节中提供的公式计算长度大于100个核苷酸的序列与第二序列之间的Tm。预杂交和杂交含有核酸的膜的条件以及清洗含有核酸的膜以除去过量和非特异性结合的探针的条件可以在杂交的严格性中起重要作用。可以在适当时在中度或高度严格性条件下实施此类杂交和清洗。例如,可以通过降低清洗溶液中的盐浓度和/或通过升高实施清洗的温度使清洗条件变得更严格。仅举例来说,高严格性条件通常包括于65℃在0.2XSSC中清洗膜。另外,解读杂交量可以受例如经标记的寡核苷酸探针的比活,探针杂交的模板核酸上的探针结合位点的数目和放射自显影照片或其它检测介质的暴露量影响。本领域普通技术人员会容易地领会,尽管可以使用任何数目的杂交和清洗条件来检查探针核酸分子与固定化的靶核酸的杂交,但更重要的是检查在相同的杂交,清洗和暴露条件下探针与靶核酸的杂交。优选地,靶核酸在同一膜上。如果与一种核酸杂交比与另一种核酸杂交大至少5倍(例如,至少6倍,7倍,8倍,9倍,10倍,20倍,50倍或100倍),那么认为核酸分子与一种核酸杂交,但不与另一种核酸杂交。可以直接在膜上或使用例如PhosphorImager或密度计(MolecularDynamics,Sunnyvale,CA)从放射自显影照片定量杂交量。可以使用百分比序列同一性将核酸序列或多肽序列分别与一种或多种相关核酸序列或多肽序列比较。在计算百分比序列同一性时,比对两种序列,并测定两种序列之间的核苷酸或氨基酸残基的相同匹配的数目。用相同匹配的数目除以比对区域的长度(即,所比对的核苷酸或氨基酸残基的数目),并乘以100以得到百分比序列同一性值。会领会,比对区域的长度可以是两种序列之一或二者的部分,直到最短序列的全长大小。还会领回,单个序列可以与超过一个其它序列比对,并且因此可以在每个比对区域里具有不同的百分比序列同一性值。可以使用计算机程序ClustalW和缺省参数实施两种或更多种序列的比对以测定百分比序列同一性,这允许核酸或多肽序列的比对在其整个长度上实施(全局比对)。Chennaetal.,2003,NucleicAcidsRes.,31(13):3497-500。ClustalW计算询问和一种或多种主题序列之间的最佳匹配,并且比对它们,从而可以测定同一性,相似性和差异。可以将一个或多个残基的缺口插入询问序列,主题序列或这两者中,以最大化序列比对。对于核酸序列的快速成对比对,可以使用缺省参数(即,词大小:2;窗口大小:4;评分方法:百分比;顶部对角线数目:4;和缺口罚分:5);对于多种核酸序列的比对,可以使用以下参数:缺口开放罚分:10.0;缺口延伸罚分:5.0;和权重转换:是。对于多肽序列的快速成对比对,可以使用以下参数:词长:1;窗口大小:5;评分方法:百分比;顶部对角线数:5;和缺口罚分:3。对于多肽序列的多重比对,可以使用以下参数:权重矩阵:blosum;缺口开放罚分:10.0;缺口延伸罚分:0.05;亲水缺口:开启;亲水残基:Gly,Pro,Ser,Asn,Asp,Gln,Glu,Arg和Lys;和残基特异性缺口罚分:开启。ClustalW可以在例如贝勒医学院搜索启动器网站或在欧洲生物信息学研究所网站上在万维网上运行。可以使用例如诱变(例如定点诱变,PCR介导的诱变)或通过化学合成具有变化的核酸分子将此类变化引入核酸编码序列中。此类核酸变化可以导致在一个或多个氨基酸残基处的保守和/或非保守氨基酸替代。“保守氨基酸替代”是其中一种氨基酸残基由具有相似侧链的不同氨基酸残基替换的替代(见例如Dayhoffetal.(1978,inAtlasofProteinSequenceandStructure,5(Suppl.3):345-352),其提供了氨基酸替代的频率表),并且非保守性替代是其中氨基酸残基用没有相似侧链的氨基酸残基替换的替代。可以用合适的寡核苷酸(例如引物)对使用任何数目的扩增技术检测核酸(见例如PCRPrimer:ALaboratoryManual,1995,Dieffenbach&Dveksler,Eds.,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY;以及美国专利No.4,683,195;4,683,202;4,800,159;和4,965,188)。已经开发了对最初的PCR的许多修改,并且可以用于检测核酸。通常使用可检测标记物完成(例如扩增产物,杂交复合物或多肽的)检测。术语“标记物”意图涵盖直接标记物以及间接标记物的使用。可检测标记物包括酶,辅基,荧光材料,发光材料,生物发光材料和放射性材料。制品或试剂盒本公开内容还提供了可以用于测定一种或多种CpG二核苷酸和/或CpG岛的甲基化状态的制品。如本文中提供的制品可以包含用于测定一种或多种CpG二核苷酸和/或CpG岛的甲基化状态的一种或多种寡核苷酸以及合适的包装材料。所述一种或多种寡核苷酸可以检测经亚硫酸氢盐处理的DNA中处于未甲基化状态或甲基化状态的CpG二核苷酸。另外,制品可以包含用于实施本文中公开的方法(例如,经亚硫酸氢盐处理的DNA,扩增,测序,杂交)的试剂(例如,缓冲液,酶,辅因子)。本文中提供的制品还可以含有其上具有用法说明的包装插页或包装标签,所述用法说明关于使用制品内的组分测定生物学样品中的一种或多种CpG二核苷酸和/或一种或多种CpG岛的甲基化状态。依照本发明,可以使用本领域技术内的常规分子生物学,微生物学,生物化学和重组DNA技术。在文献中充分解释此类技术。会在以下实施例中进一步描述本发明,所述实施例不限制权利要求书中描述的方法和物质组合物的范围。实施例实施例1:材料和方法在本研究中使用的所有方案和规程得到爱荷华大学机构审查委员会批准,并且根据请求可以自发明人获得全部细节。自爱荷华大学医院和诊所或爱荷华州的两个酒精治疗中心招募本文中描述的病例受试者。简言之,在医院或酒精治疗中心收治并且实现清醒和缺乏显著的认知损伤两者后,潜在受试者就他们参与当前研究的潜在兴趣而言由机构人员接洽。如果感兴趣,那么将此信息传达给研究组,然后由研究组的成员联系潜在受试者,提供详细信息并且对个体筛选对研究的适合性。入选标准包括同意能力,缺乏显著活性物质使用病症(除了烟草外),缺乏假定影响DNA甲基化的药物,缺乏包括癌症,胃肠病症,糖尿病,慢性阻塞性肺病或严重心脏疾病的医学病症,并且一般地,在其它方面总体一般健康较好。如果不排除并仍愿意参加,那么同意受试者并且启动研究规程。在指标纳入时(时间1或T1)(其可以在收治后长达7天发生),采用“酗酒遗传学半结构评估(Semi-StructuredAssessmentfortheGeneticsofAlcoholism)”,第2版(SSAGA-II;Bucholzetal.,1994,J.Stud.Alcohol,55:149-58)修订版访谈所有病例受试者,包括评估在过去六个月里的物质使用的具体项目。另外,对受试者抽静脉血以提供用于当前研究的生物材料。然后,大约4周后(时间2或T2),再次访谈相同的受试者以评估医学状态的变化,并且抽静脉血。自爱荷华市地区招募对照受试者。研究的入选标准与病例受试者的入选标准相似,并且包括较好的整体总体一般健康,完全截断酒精至少6个月,缺乏假设影响DNA甲基化的药物,和缺乏除烟草外的重大物质。使用与病例受试者相同的仪器进行访谈所有对照受试者,并且抽静脉血以为当前研究提供生物材料。如先前所述(Philibertetal.,2012,Epigenetics,7:1331-8)制备血清和单个核细胞(即淋巴细胞)团粒。作为评估自我报告可靠性的努力的一部分,使用由Abnova(Taiwan)提供的酶联免疫测定(ELISA)试剂盒依照制造商的指导和先前的方案(Philibertetal.,2013,Epigenetics,5:19-26)在血清中评估可替宁(cotinine)和四氢大麻酚水平。使用QiaAmp试剂盒(Qiagen,Germany)依照制造商的指导从淋巴细胞细胞团粒制备DNA。如先前所述(Monicketal.,2012,Am.J.Med.Genet.,PartBNeuropsychiatricGenet.,159:141-51),由明尼苏达大学基因组中心(Minneapolis,MN)使用Illumina(SanDiego,CA)HumanMethylation450Beadchip,使用由制造商规定的方案评估全基因组DNA甲基化。此芯片含有识别至少20216种转录物,潜在转录物或CpG岛的485,577种探针(来自GenomeReferenceConsortium人基因组构件37(GRCh37))。对所得的数据检查完全亚硫酸氢盐转化,并且对使用IlluminaGenomeStudio甲基化模块第3.2版测定的每个靶定CpG残基测定平均β值。然后使用基于PERL的算法清洁所得的数据以除去那些检测p值(观察到的序列代表随机噪声的可能性的指数)大于0.05的β值。然后,除去具有<99.5%完全评估成功的来自阵列的数据。将存活的数据输入MethLAB(Kilaruetal.,2012,Epigenetics,7:225-9)中,并且使用控制芯片和批次变量的标准一般线性模型方法就酒精使用状态而言进行分析。使用假发现率或Bonferroni校正方法(Benjaminietal.,1995,J.RoyalStat.Soc.SeriesB,Method.,57:289-300)为全基因组比较校正所得的p值。基本上,使用全基因组线性回归;在此情况中,是考虑批次和载片共变量的t检验。“批次”是DNA甲基化中的术语,是指就亚硫酸氢盐转化而言的分组(例如,“批次”考虑亚硫酸氢盐转化的程度或其缺乏)。“载片”是指实施杂交的单个芯片或阵列,因为例如载片间可以有相同样品的杂交程度的变化。会理解,考虑批次和载片变化通常导致更大程度的显著性。实施例2:实验结果在表1中描述研究中包括的病例和对照受试者的临床和人口统计学特征。简言之,与爱荷华州人口和归于酒精治疗的患者的总体安排特征一致,受试者趋于在他们的40岁阶段并且主要是白人男性。病例受试者是非常重度的酒精使用者,典型的受试者描述至少在收治前过去的一周平均消耗五分之一伏特加酒或12包啤酒。静脉切开术时间和他们最后一次饮用之间的延迟平均为4天,并且在1和8天之间变化。毫不令人惊讶,病例受试者多有烟草使用病症,他们中的85%是每日吸烟者。他们也倾向于具有更高比率的THC使用,10名受试者具有边缘或显著阳性的羟基-THC水平。在每种和每一种情况中,血清可替宁和THCELISA测试的结果与自我报告数据一致。在为本研究做准备的时间段期间确定的41例时间1(T1)受试者中,仅26人完成了时间2(T2)评估。失败的原因不同。在一些情况中,受试者已经离开治疗并已开始饮酒,而在其它情况中,受试者已经离开治疗,并且无法或不愿意完成评估的第二阶段。表I:研究受试者的临床和人口统计学特征病例受试者对照受试者N=3333年龄45.57.846.77.8种族白人3031非洲裔美国人21西班牙裔01性别男性2525女性88自最后一次饮用后的天数4.01.8自我报告收治前平均每日饮酒消耗过去一周0过去一个月0过去6个月0吸烟状态目前每日271阳性可替宁281大麻使用状态自我报告过去一年中使用110阳性羟基-THC91比较而言,尽管年龄,性别和种族相似,33名对照受试者具有烟草和大麻使用两者的更低的比率。事实上,对照受试者中仅一人是当前的每日吸烟者,并且所有对照受试者否认在过去一年中使用大麻。与来自病例受试者的结果形成对比,观察到血清ELISA测试中的一例差异(即,有一例THC阳性测试)。对95份样品(包括两份淋巴母细胞DNA标准品和一份内部重复)成功获得全基因组甲基化数据(所有探针的>99.5%的测量)。这包括33份对照,T1时的33份病例受试者和T2时的26份病例受试者。内部复制之间的相关性大于0.998。对照和T1和T2时的受试者的平均β值分别为0.4788,0.4800和0.4833。在附录A中给出来自这些实验的结果和本申请中要求保护的CpG残基,区域和基因。附录A中包含的数据提供了Illumina探针ID(其序列是公众可获得的)和所讨论的CpG的身份(以序列信息和定位信息表示)。最后,提供了比较酒精受试者的甲基化与对照的甲基化的t-检验的p值。认为p<0.05是显著的,并且附录A中列出的探针的完整注释文件是公开可获得的。具体地,栏A,“探针名称”:探针的Illumina名称。栏B,“靶区”:该区域的基因组序列;该区域的中心CpG残基以方括号表示(例如[CG])。栏C,“染色体”:其上找到靶区的染色体。栏D,“定位信息”:在GRCH37装配体中找到CpG残基的碱基对;注意由于胞嘧啶和鸟嘌呤核苷酸是互补的,在有义链和反义链两者上找到CpG残基。栏E,“UCSC参考基因名称”:在存在时,公认的基因名称,其中找到CpG残基。栏F,“p值”:比较酒精病例的甲基化与对照的甲基化的t-检验的显著性。在表II中列出了来自32名T1受试者和33名健康戒酒对照的DNA的甲基化状态的比较的30个最显著的结果的列表。总体上,在使用假发现率(FDR)方法的全基因组校正后,总共8636种探针是差异甲基化的,而当使用更保守的Bonferroni校正时,仅56项比较是统计学显著的。比较的QQ图的检查揭示了这些观察到的差异的基础是显著的,正偏移(更大数目的更显著的p值)是明显突出的(图1)。高风险分组(诸如这些病例受试者)中一项常见的关注是共病物质的效应。特别地,这是目前的结果的关注,因为吸烟对DNA甲基化具有深远的影响(见例如Doganetal.,2014,BMCGenomics,15:151),并且33名病例受试者中的27名是积极吸烟者。在这方面,cg05575921(已经显示其与烟草使用强烈相关(见例如Doganetal.,2014,BMCGenomics,15:151))是第31排序探针。然而,总体上,在酒精消耗的信号和吸烟的信号之间没有显著的重叠。在Doganetal.(2014,BMCGenomics,15:151)中就吸烟而言获得全基因组显著性的910种探针中仅22种在本研究中排序在前10,000种最高度相关的探针中。相反,Dogan等人中就吸烟而言的10,000种最高度相关的探针的总体排序为302,264(在485,577中),分布中值为第318,258。因此,甲基化签名在使用酒精的受试者和使用烟草的受试者之间似乎交叠很少。作为分析的下一步,使用GoMinerTM算法(Zeebergetal.,2003,GenomeBiol.,4:R28)分析1000种最显著相关的探针的差异分布。表III中显示的结果展现了牵涉程序性细胞死亡(凋亡)或GTP酶信号传导的途径的最高度相关的探针的显著富集。许多生物标志物研究的主要目的是确定是否可以使用给定的标志物区分病理状态与对照状态,而本研究的次要目的是确定是否可以使用DNA甲基化监测酒精戒瘾。作为该评估的第一步,比较了我们成功获得T1和T2数据两者的25名受试者的全基因组DNA甲基化样式。这25名个体的T1和T2采集之间的平均时间长度为25天。没有单一探针跨越全基因组显著性的阈值,最佳观察到的未校正的p值仅为5x10-6,分析的QQ图展现了显著的负偏移是显著的(图2)。T1和T2的次要分析证明是高度有趣的。由于暴露于乙醇对细胞有压力,并且生物学系统趋于在扰动后恢复至其稳态均值,我们接下来询问对于所鉴定的8636种FDR显著探针,乙醇吸入受试者的哪个甲基化评估(T1或T2)更类似于对照的。值得注意的是,在8636种探针的7360种上(卡方p<0.0001),包括表II中列出的那些探针的所有30种,所有25名受试者的这些CpG残基的平均甲基化在T2采集时间时比其在T1采集时间时更类似于对照受试者。不幸的是,相对于对照均值的平均倒转(version)在每个基因座处是相当适度的,β值的总体变化为约0.005(即0.5%)。实施例3:总结本文中的实验证明了,与不使用酒精的对照相比,酒精使用与显著且广泛的DNA甲基化变化有关。本文中的实验还证明了甲基化变化的程度在约一个月的戒酒后趋于降低。因此,可以使用DNA甲基化签名推断最近的酒精使用状态。本文中报告的结果很可能会影响进行和监测酒精治疗的设置的选择。如在酒精使用的情况中会预期的,由于酒精使用所致的DNA甲基化变化的幅度不如例如在烟草使用的情况中观察到的幅度一样强烈。与吸烟的平均差异(例如,其中cg05575921处的甲基化在长期吸烟者(约60%)和非吸烟者(92%)之间的差异可以超过30%)形成对比,在当前的酒精使用研究中的任何一点时的平均差异趋向是5%至10%左右。要理解,虽然本文中已经结合许多不同方面描述了方法和物质组合物,但是各个方面的前述描述旨在例示而非限制方法和物质组合物的范围。其它方面,优点和修改在所附权利要求书的范围内。公开的是方法和组合物,其可以用于公开的方法和组合物,可以与公开的方法和组合物结合使用,可以用于制备公开的方法和组合物,或者是公开的方法和组合物的产品。本文中公开了这些和其它材料,并且应当理解,公开了这些方法和组合物的组合,子集,相互作用,组等。也就是说,尽管可能没有明确地公开对这些组合物和方法的每个各种单独和集合组合和排列的具体提及,但是在本文中具体涵盖和描述每一个。例如,如果公开和讨论特定物质组合物或特定方法,并且讨论了多种组合物或方法,那么明确涵盖组合物和方法的每种和每一种组合和排列,除非明确相反指示。同样,也明确涵盖和公开了这些的任何子集或组合。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1