仿生流体处理的系统和方法与流程
本申请是基于2014年3月31日提交的题为“仿生流体处理的系统和方法”的美国临时申请号61/972,520并要求其权利,其通过引用全文纳入本文。
关于联邦资助研究/开发的声明
本发明是基于国立卫生研究院提供的1K99HL114719-01A1和HL68130政府资助。政府对本发明享有某些权利。
发明背景
本发明通常涉及流体系统,包括微流体装置、包含这类装置的系统和使用这类装置和系统的方法。更具体地,本发明涉及基于仿生平台产生功能性生物材料、物质或试剂的装置、系统和方法。
血小板(PLT)对于止血、血管发生和先天免疫而言很重要,且当数目降低至低水平时,发生称作血小板减少症的病症,患者处于因出血而死亡的严重风险下。低血小板计数的一些原因包括手术、癌症、癌症治疗、再生障碍性贫血、毒性化学品、醇、病毒、感染、怀孕和特发性免疫血小板减少症。
治疗这类病症的替代PLT通常完全来源于人供体,但存在由其免疫原性导致的严重临床问题和脓毒血症的相关风险。然而,因需要更多PLT输注所导致的不足(以及近似静态的供体池和由于细菌测试和恶化产生的短储藏期)使得健康护理专业人员更难以为其患者提供合适的护理。此外,替代方法(如人工血小板替代品)目前尚不能替代生理血小板产品。
在体内,PLT在图8所示的过程中由祖细胞(称为巨核细胞(MK))生产。在骨髓(BM)中位于血管外,MK将长、分支的细胞结构(proPLT(前血小板))延伸至窦状腺血管内,其中其经历剪切速率并将PLT释放至循环中。虽然已在体外生长了功能性人PLT,但迄今为止的细胞培养方法仅生成约10%proPLT生产且每个人MK生成10-100个PLT。相反地,人体中的几乎所有成年MK都必须各自生产大致1000-10000个PLT以得到循环的PLT的数目。这构成了血小板输注单元离体生产的主要瓶颈。
另外,虽然第二代细胞培养方法对PLT是否的生理驱动提供了进一步的认识,但其无法重建整个BM微环境,对胞外基质(ECM)组成、BM刚性、内皮细胞接触或血管剪切速率具有有限的个体控制;且未能成功地同步化proPLT生产,导致6-8天时间中不均匀的PLT释放。此外,高分辨率活细胞显微镜显示的不具有在生理相关条件下解决proPLT延伸和释放的能力显著阻碍了鉴定PLT生产的细胞骨架结构以促进药物开发和建立血小板减少症的新治疗方法的努力。因此,能够生成临床上显著数目的功能性人PLT的有效、供体不依赖的PLT系统是消除PLT获得和储存相关风险所必需的,并有助于满足日益增长的输注需要。
基于上述考虑,持续而明确地需要利用特定平台的装置、系统和方法,该平台可再生血管生理学以精确地反映影响功能性人血小板的有效生产的过程、机制和条件。这类平台将证明,其高度适用于有效地生成人血小板以用于输注的目的,并且高度适用于建立开发的临床前阶段中的药物相互作用和药物效果。
技术实现要素:
本发明通过提供能够产生生理上准确的模型的系统和方法克服了前述技术的缺陷,该模型复制了体内所见的条件、环境、结构和动态流动。如上所述,可采用这类生理模型来生成功能性人血小板和其他生物材料,其将适于输注处理某些身体状况,如血小板缺乏病症如血小板减少症。本发明产生的生理模型的其他应用可包括药物开发,以及药物和治疗评价。
根据本发明的一个方面,提供了一种仿生微流体系统。该系统包括基材,在基材中形成的第一通道,所述第一通道从第一入口向第一出口沿纵向维度延伸并且沿第一横向维度延伸,和
所述基材中形成的第二通道,所述第二通道从第二入口向第二出口沿纵向维度延伸并且沿第一横向维度延伸,其中所述第一和第二通道基本平行地沿纵向维度延伸并且被沿着第二横向维度延伸的柱分隔。该系统还包括在分隔第一通道和第二通道的柱中形成的一系列孔隙(aperture),其中,该一系列孔隙各自沿着纵向维度的延伸大于沿着第一横向方向和第二横向方向的延伸,并且位于基材的第一部分的近侧并从第一通道延伸至第二通道,以产生在第一通道和第二通道之间通过的流体连通路径。该系统还包括与第一入口连接的第一源,第一源设置为以第一通道流速向第一通道选择性导入至少一种第一生物组合物,和与第二入口连接的第二源,第二源设置为以第二通道流速向第二通道选择性导入至少一种第二生物组合物,其中第一通道流速和第二通道流速产生差,其设置成在通道内生成预定范围内的生理剪切速率。
在本发明的另一个方面中,公开了一种生成血管结构和骨髓中至少一种的生理模型的方法。该方法包括:提供一种仿生微流体系统,该系统包含基材和基材内形成的第一通道,该第一通道从第一入口向第一出口沿纵向维度和第一横向维度延伸。在基材中形成第二通道,第二通道从第二入口向第二出口沿着纵向维度和第一横向维度延伸。在基材中形成第三通道,第三通道从第二入口向第三出口沿纵向维度和第一横向维度延伸,其中第一、第二和第三通道沿着纵向维度基本平行延伸并且沿着第二横向维度延伸。一系列微通道将第一通道连接至第二通道并将第三通道连接至第一通道,其中这一系列微通道在纵向维度上的延伸大于在第一横向方向和第二横向方向上的延伸,并且位于基材的第一部分的近侧,以在基材的第一部分的近侧产生在第一通道和第二通道以及第一通道和第三通道之间通过的流体连通路径。本发明还包括使用第一源以第一通道流速向第一通道中导入第一生物组合物,并使用第二源分别以第二通道流速和第三通道流速向第二通道和第三通道中导入第二生物组合物,以在第一、第二和第三通道流速之间产生差,从而在通道内产生预定范围内的生理剪切速率。该方法还包括收获通过生理剪切速率在微通道近侧生成的目标生物物质。
在本发明的另一个方面中,提供了另一种仿生微流体系统。该系统包括至少一个基材,和在至少一个基材上形成的第一腔室,第一腔室基本沿着纵向维度从第一入口向第一出口延伸。该系统还包括在至少一个基材上形成的第二腔室,第二腔室从第一入口向第一出口沿着纵向维度延伸,其中第一和第二腔室沿着纵向维度基本平行延伸,和沿着横向维度分隔第一和第二腔室的膜,其中该膜产生在第一腔室和第二腔室之间通过的流体流通通道。该系统还包括设置成使用相应入口选择性将至少一种生物组合物导入第一腔室和第二腔室的至少一个源,所述导入以能够在腔室之间生成生理剪切速率的流速进行,该生理剪切速率促进产生多个血小板。
通过以下描述可以清楚地了解本发明的上述和其他方面和优势。在以下说明书中,参照构成说明书的一部分的附图,其中以说明性方式显示了本发明的优选实施方式。这类实施方式不必然代表本发明的全部范围,而是因此对权利要求进行说明并在本文中解释本发明的范围。
附图的简要说明
在后文中将参考附图描述本发明,其中同样的附图标记表示同样的元件。
图1显示了根据本发明的方面的示例性仿生微流体系统的示意图。
图2A显示了用骨髓和血管蛋白质涂覆的,用于复制胞外基质(ECM)组合物的微流体通道的显微图像。
图2B显示了在选择性包埋在藻酸盐凝胶中的微通道中捕集的巨核细胞(MK)的显微图像,其模拟三维ECM组织和生理骨髓(BM)硬度。
图2C显示人脐静脉内皮细胞(HUVEC)的显微图像,其选择性培养在纤维蛋白原包被的第二通道中以生成功能性血管。
图2D显示了用于产生功能性血小板(PLT)的完整系统的图像。
图2E显示根据本发明的方面的所述仿生微流体系统内模拟的剪切速率分布。
图2F显示了多个输注速率下剪切速率随着与第一通道的横向距离的变化的图。
图2G显示了剪切速率随着阻断微通道的数量的变化的图。
图3A显示了显示在0和18小时时培养的MK的直径分布。
图3B显示了静态培养中的MK的显微图像,其显示在纯化后6小时的proPLT生成。
图3C显示了在MK捕获后即刻生理剪切下的proPLT产生的显微图。
图3D显示了对比来自静态培养的那些在生理剪切下获得增加的proPLT生产型MK的图。
图3E显示了生理剪切下的proPLT延伸速率。
图4A显示了挤压通过3μm-宽微通道的MK的显微图。
图4B显示了挤压通过3μm-宽微通道的MK延伸大片段的显微图。
图4C显示了proPLT延伸的显微图像。
图4D显示了沿着proPLT轴在不同位置处的proPLT延伸和切断事件的显微图。
图4E显示了PLT产生周期的显微图。
图4F显示了在生理范围内增加的剪切速率并不增加proPLT延伸速率。
图4G显示了显微图像,其显示经逆转录病毒转染以表达GFP-β1微管蛋白的MK显示出proPLT延伸并且包括在PLT尺寸的末端处形成卷曲的外周微管。
图4H显示5μM Jasplankinolide(Jas,肌动蛋白稳定剂)和1mM赤式-9-(3-[2-羟基壬基](EHNA,胞质动力蛋白抑制剂)抑制剪切诱导的proPLT生产的图。
图4I显示了在生理剪切下药物诱导的对proPLT产生的抑制的显微图。
图5A显示了本发明产生的PLT显示出血液PLT的结构和功能性质的图。
图5B显示了在第4天从培养物分离之后并在输注后2小时从流出物收集时,按照本发明输注到系统中的GPIX+MK的生物标志物表达、正向/侧向散射和相对浓度。
图5C显示了施加剪切位移GPIX+相对于静态培养上清产生更多PLT尺寸的细胞的图。
图5D显示了MK在2小时内转化成PLT的显微图。
图5E是显示施加剪切位移相对于静态培养上清产生更多的PLT尺寸的β1微管蛋白+Hoescht-细胞的示意图,插图显示流出物中游离核的定量。
图5F是显微图像,显示按照本发明产生的PLT在超微结构上类似于血液PLT且含有皮层MT卷曲、开放的小管系统、致密的管状系统、线粒体和特征性分泌颗粒。
图5G是显微图像,其显示了按照本发明产生的PLT和PLT中间体在形态上类似于血液PLT并且显示相当的MT和肌动蛋白表达。
图6A显示了按照本发明产生的hiPSC-PLT显示出血液PLT的结构和功能性质的图。
图6B是显微图像,显示按照本发明的hiPSC-MK在超微结构上类似于原代人MK且含有分成小叶的细胞核、内陷的膜系统、糖原贮积、细胞器和特征性分泌颗粒。
图6C是显微图像,显示静态培养物中的hiPSC-MK在纯化后6小时开始生产proPLT并在18小时达到最大proPLT生产。
图6D是显微图像,显示生理剪切下(约500s-1)的hiPSC-MK在捕获后立即开始生产proPLT,并在培养的最初2个小时内延伸/释放proPLT。
图6E是显示在生理剪切下proPLT生产型hiPSC-MK的百分比在静态培养中显著增加的图。
图6F是显示在生理剪切下的proPLT延伸速率为约19μm/分钟的图。
图6G是显微图像,显示按照本发明产生的hPLT在超微结构上类似于人血液PLT且含有皮层MT卷曲、开放的小管系统、致密的管状系统、线粒体和特征性分泌颗粒。
图6H是显微图像,显示按照本发明产生的hPLT在形态上类似于人血液PLT且显示可比的MT和肌动蛋白表达。
图6I是显微图像,显示按照本发明产生的mPLT形成激活的丝状伪足/板状伪足并在玻璃表面上铺展。
图7显示活细胞显微图像,显示T-DM1通过诱导异常的微管蛋白构架来抑制MK分化并破坏proPLT形成。
图8显示了体内PLT产生的图。
图9显示了根据本发明的方面的另一个示例性仿生微流体系统的示意图。
图10显示了使用图9的系统的PLT产生的示意图。
图11A显示了使用图9的系统中的一个流体流动实施方式比较PLT的示意图。
图11B显示了使用图9的系统中的另一个流体流动实施方式比较PLT的示意图。
图12显示了根据本发明的方面的另一个仿生微流体系统的示意图。
图13是根据本发明的方面显示产生生理模型的过程的步骤的流程图。
发明详述
血小板(PLT)在刺激凝块形成和血管损伤修复中起关键作用。低PLT计数所致出血导致的发病和死亡是许多病症(包括化疗和放疗、外伤、免疫性血小板减少性紫癜(ITP)、器官移植手术、严重烧伤、脓毒血症和遗传紊乱)所面临的一项主要临床问题。虽然其免疫原性和相关风险导致了严重的临床问题,同时具有高需求量和短储藏期导致的库存缺陷,但美国的PLT输注总量仍超过1000万单位/年。
在认识到这种广泛的需求和风险之后,本发明描述了能够复制在生理中存在的条件、环境、结构和动态流动的系统和方法。这种系统和方法可用于生成人类生理学的模型,其然后可用于例如产生功能性人PLT。
PLT生产涉及巨核细胞(MK)的分化,巨核细胞位于骨髓(BM)中的窦状腺血管外并延伸长且分支的细胞结构(命名为proPLT)至循环中,如图8所示。具体地,proPLT包括通过薄胞质桥连接的串联阵列中的PLT尺寸的膨胀。在体内,它们经历血管剪切并起到作为PLT生产的组装线的作用。虽然,proPLT的详细表征仍不完整,但已经在体外和体内都鉴定到这些结构。
PLT从proPLT尖端处连续释放。该机制高度依赖于功能为细胞的分子支柱和主梁的微管蛋白和肌动蛋白丝的复杂网络。微管(MT)束与proPLT轴平行,且proPLT延长受在彼此上滑动的MT驱动。proPLT成熟期间,在MT远端上运输的细胞器和分泌颗粒沿轨道移动,从而被限制于proPLT尖端处。肌动蛋白促进proPLT分支和PLT端部扩增。鼠MK的活细胞显微观察对该理解至关重要,但迄今为止的大多数研究都在体外对静态MK培养物进行。
已将促血小板生成素(TPO)鉴定为MK分化的主要调控因子,且其已被用于在培养物中生产富集的MK群体。在一个参考例中,已证明从生产proPLT的MK中体外生成的人PLT是功能性的。从那以后,已从多个来源分化MK,包括胎肝细胞(FLC)、脐带血干细胞(CBSC)、胚胎干细胞(ESC)和诱导性多能干细胞(iPSC)。然而,目前的2-D和液体MK培养物的数量级不足体内每个MK生成的预测约2000个PLT。最近,已在连续流体流下应用模块化3-D编织聚酯网格以在培养物中从100万个CD34+人脐带血细胞中生成最多6x106个PLT/天。虽然表明可以获得临床上有用的PLT数目,但那些3-D灌注生物反应器没有精确再生BM微环境的流体特性和复合物结构,且其闭合的模块化设计无法观察proPLT生产,难以提供对PLT释放机制的理解。或者,已提出使用3-D聚二甲基硅氧烷(PDMS)生物芯片相邻的ECM包被的基于丝的导管来再生BM窦状腺并在体外研究MK分化和PLT生产。虽然这类装置在成熟期间再现了MK迁移,但其无法适用于高分辨率活细胞显微分析,并无法再生驱动MK分化所需的内皮细胞接触。
虽然已在培养物中研究了MK分化,但对于刺激proPLT生产的条件仍知之甚少,特别是在体内中。MK发现于BM微环境(niche)中,且一些证据暗示BM间质的细胞-细胞、细胞-基质和可溶性因子相互作用参与proPLT形成和PLT释放。实际上,趋化因子SDF-1和生长因子FGF-4将MK招募至窦状腺内皮细胞。胞外基质(ECM)蛋白是BM血管微环境的另一主要组分,且证据表明通过跨膜糖蛋白(GP)受体的信号转导调控proPLT形成、PLT数目和大小(在例如巨血小板综合征、血小板无力症中所见的缺陷)。胶原IV和玻连蛋白促进proPLT生产,其可被针对其偶联整联蛋白受体GPIba的抗体抑制。同样地,纤维蛋白原调控通过GPIIbllla的PLT释放和proPLT形成。虽然这些发现说明了proPLT生产的环境决定因素,但其受限于简化论者(reductionist)方法。因此,整合了BM复杂性的限定因素的新模型是阐明MK至PLT的生理调控所需。
在BM中,proPLT经历100至10000s-1或更具体地500至2500s-1的壁剪切速率。虽然已研究了持续血流对于PLT血栓形成的作用,但令人吃惊的是,剪切力调控PLT释放的机制只受到很少关注。同时,在研究时,实验并不代表真实的生理条件。一些初级研究在ECM包被的载玻片上采用灌注的MK,其选择固定/粘附的MK而不区分ECM接触激活与剪切。或者,在孵育摇床中向心搅动释放的proPLT,其不再现循环层状剪切流,不提供血管剪切速率的精确控制,且不适用于高分辨率活细胞显微观察。虽然存在这些主要限制,但将MK暴露于高剪切速率似乎加速了proPLT生产并在不存在剪切的情况下培养proPLT时释放比流体剪切压力下所维持的更少的PLT。
本发明认识到微流体装置提供了极佳的平台以生成和准确调节动态流体流,并从而模拟血管条件以将化学信号递送至细胞。已证明将微流体网络包埋在装载细胞的水凝胶中支持了通过3D支架的可溶性蛋白的有效对流运输。已生成了活的3D组织接触,其由琼脂糖中包封的肝细胞、使用初级软骨细胞接种的藻酸钙水凝胶和包埋在3D管状聚(乙二醇)水凝胶中的内皮细胞组成。因此,该技术已被应用于开发芯片器官(organs-on-a-chip),包括肝、肾、肠和肺。此外,已使用芯片微血管系统的新进研发成果体外研究心血管生物学和病理生理学。这些研究强调了模拟物理微环境和活器官的天然化学信号以研究细胞和生理发育的重要性。例如,这对于药物介导的PLT生产抑制而言特别重要。由于生产proPLT的MK在BM中位于紧靠血管的外侧,与BM的半固体ECM微环境和循环的流体微环境相互作用,仿生微流体生物芯片可实现模型系统以阐明相关生理机制,如负责药物诱导的血小板减少症的那些。
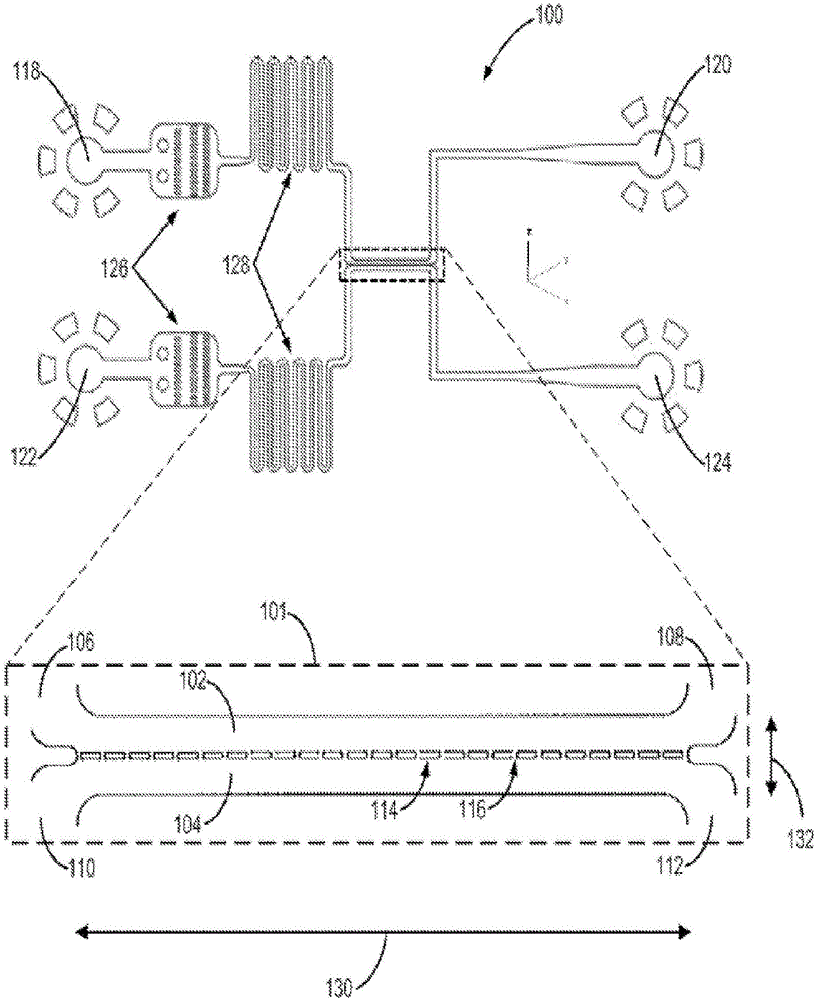
现在参考图1,示意图显示了本发明的多个实施方式所述的仿生系统100的非限制性示例。该系统100包括基材101、第一通道102和第二通道104,各通道经设置以携带任何流体介质流,其传输或由以下组分组成(但不限于此):例如,颗粒、细胞、物质、微粒、材料、组合物等。在一个实施方式中,该系统100和/或基材101可使用细胞惰性硅基有机聚合物(如聚二甲基硅氧烷(PDMS))制备。
该第一通道102包含第一通道入口106和第一通道出口108。类似地,该第二通道104包含第二通道入口110和第二通道出口112。该第一通道102和第二通道104沿基本纵向方向延伸,且具有纵向和横向维度(如同将解释的那样)以实现所需流动曲线、速度或速率,例如生理系统中存在的那样。在一个方面中,描述通道的纵向130和横向132维度的尺寸的范围与解剖学或生理学上的结构、组织、构造或设置(如骨髓和血管中的情况)一致。例如,该纵向130维度的范围可以是1000-30000微米或更具体地1000-3000微米,且该横向132维度的范围可以是100-3000微米或更具体地100-300微米,但也可使用其他数值。在一些方面中,可制备、限定或制造各通道以接收、定位、捕获或容纳例如来自穿过的流体介质的颗粒、细胞、物质、微粒、材料、组合物等。
该装置100还包括分离第一通道102和第二通道104的一系列柱114。柱114的长轴可设置为与通道的纵向130维度基本平行,该一系列柱114延伸约等于通道的纵向130维度的距离。柱114可被一系列间隙或微通道116分隔,该微通道116从第一通道102延伸至第二通道104以建立在这些柱114之间通过的部分流体连通路径。然而,在指代间隙时,术语“微通道”并不隐含表示特定宽度。例如,这些间隙可基本大于或小于微米范围。在一些方面中,柱114和微通道116可具有维度以使颗粒、细胞、物质、微粒、材料、组合物等结合、粘附或受限于大致在柱114和微通道116附近的区域。例如,这些柱114的纵向130和横向132维度的范围可以是1-200微米,而这些微流体116的纵向130维度(由柱114之间的间隙或分离距离所定义)的范围可以是0.1-20微米,但也可使用其他数值。
在一些方面中,可使用与第一入口118偶联的第一源建立第一通道102中的第一介质流,其中第一介质流可通过第一出口120提取。类似地,可使用与第二入口118偶联的第二源建立第二通道102中的第二介质流,其中第二介质流可通过第二出口120提取。然而,由于其间的流体连通可通过第一出口120或第二出口122从第一通道102或第二通道104提取流。在一些构造中,第一出口120或第二出口124或两者可具有排出或捕获使用第一源或第二源或两者建立的流的能力。这种能力也可包括从捕获的流分离所需材料或物质如血小板或凝血细胞的能力。
第一和第二源(图1未显示)可包括设置用于递送受控流或流体压力的任何系统,如微流体泵系统,并且包括任意数量的元件或组件,如流控器、致动器等。可使用源、元件和组件的特定构造,并利用与第一通道102和第二通道104相关的几何维度来控制可持续任何希望或所需时间量的流动速度或流动速率。在一些方面中,可控制第一通道102和第二通道104中的流速以复制在例如骨髓和血管中所见的生理条件。例如,可控制流速以实现足够生成PLT的所需血管剪切速率。
系统100也可包括任何性状或形式的过滤和阻力元件,其根据流方向沿着第一和第二流体介质各自的通道排布。具体地,可设计过滤元件以使其从横向流体介质中捕获或去除任意类型的碎片、灰尘和其他污染物或不希望的材料、元素或颗粒。另外,可能需要阻力元件来控制流动力或减弱流动速率的波动。在一些构造中,如图1所示,过滤元件126可位于第一入口118和第二入口122近侧以立即捕获不需要的污染物。然后,流阻元件128可位于过滤元件126的下游,如图1所示。
在一些实施方式中,可通过用调节血小板产生的蛋白质、肽或骨粉,包括但不限于Cl、CIV、FG、FN、VN、LN、VWF聚-L-赖氨酸、纤维蛋白原、IV型胶原、纤连蛋白、玻连蛋白、层连蛋白、CCL5(RANTES)、S1PR1、SDF-1、和FGF-4、凝胶如琼脂糖、藻酸盐,和基质胶或溶液如PBS、HBS、DMEM EGM或其他介质的任意组合选择性填充第一通道102来离体重建人骨髓(BM)血管微环境。或者,在使用蛋白质微米/纳米冲压(micro/nano-stamping)将生物芯片粘附于表面载片前,或在使用平行微流体流进行微流体装置组装后,可将ECM蛋白直接压制(pattern)在玻璃表面或多孔膜上。输注期间可通过调控微流体流流动速率来调节局部组分浓度,着重于对齐和3-D排布。
在其他实施方式中,可通过在37℃和5%CO2下与内皮细胞培养来选择性包被第二通道104,从而实现重现人BM血管系统。内皮细胞可使用4%甲醛固定,并探测细胞生物标志物以解析细胞定位和构造。可使用荧光或比色介质(如FITC-葡聚糖)或使用珠灌注内皮化BM生物芯片的第二通道104,并通过活细胞显微镜观察以评估样品/细胞/分子扩散和测定血管通透性。
现在参考图9,显示了本发明的多个实施方式所述的仿生系统900的另一个非限制性示例。系统900包括基材902,其中形成与第一或中心通道904,其连同第二和第三通道一起,或侧通道906,其与中心通道904相邻或在其侧边。系统900的各通道可经设置以运载任意流体介质流,其运输或由以下物质组成(但不限于此),例如,颗粒、细胞、物质、微粒、材料、组合物、试剂等。在一些方面中,可使用细胞惰性硅基有机聚合物来构建系统900和/或基材902,如聚二甲基硅氧烷(PDMS)、COP、COC、PC、PS、PMMA、玻璃和/或任何其他合适材料或其组合。在某些构造中,基材902可包括,或组装自使用合适的技术和方法调整和/或组合的可分离、可再密封或可结合组件,例如,基材的第一部分903和第二部分905。
中心通道904和侧通道906沿着纵向方向908基本平行延伸。在一些优选的方面中,限定通道沿着纵向方向908和横向方向910和912的维度可在与生理结构相一致的范围内。此外,也可能需要某些维度来促进细胞、物质、组合物或其他材料在通道内沉积,或维持、调节或复制所需的流体流概况、速度、压力或速率,如与生理系统相关的那些。在一些设计中,中心通道904和侧通道906沿着横向方向910和912的维度不需要相等,如图9所示。例如,所有通道的纵向维度914可在1000至30000微米的范围内,而各通道的横向维度可在10至3000微米的范围内,或更具体地,在10至150微米的范围内。纵向和横向维度的其他值也是可能的。
通道被一般与纵向908平行排布的柱916分隔,并且延伸与通道的纵向维度914基本相等的距离。柱916可包括任意数量的孔隙918,其在通道之间产生部分流体连通路径,该孔隙918根据需要定型、确定尺寸并排布。孔隙918可以是,例如,开口、裂纹、孔、间隙、微通道等,其在中心通道904与第一和/或第二侧通道906各自之间延伸。例如,孔隙918的纵向和横向维度的范围可以是0.1至20微米,虽然也可以是其他值。如图9所示,孔隙918的纵向维度可大于横向维度。在一些优选的设计中,孔隙918一般位于基材的第一部分903的近侧,如图9所示。为此,孔隙918可针对基材的第一部分903延伸。这可使得捕获的MK和/或proPLT,例如,通过有横向流体介质生成的流体压力或压力差压向基材的第一部分903的表面。在基材的第一部分903透明的情况中,可关于对proPLT和PLT产生过程成像来实现改善的分辨率。通过这种方式,孔隙918可经排布、成形和定尺寸以优化产生,或最大化所需生物物质如PLT的产率。
如图9所示,中心通道904包括第一通道入口,或中心通道入口920,和第一通道出口,或中心通道出口922。侧通道906可共用第二通道入口,或侧通道入口924,并且包括分开的第二和第三通道出口,或侧通道出口926。在侧通道入口924的近侧,系统900的各侧通道906包括延伸部分,或端口928。在某些操作模式中,延伸部分,或端口928可对各相应的侧通道906起额外流体入口或出口的作用,为系统900提供增加的灵活性,如下文所述。
系统900还可具有过滤能力,其可采用任何形状或形式,并且设置成捕获或吸收来自横向流体的任何类型的碎片、灰尘和任何其他污染物,同时允许其中含有的细胞、试剂或其他所需材料,如MK流动。在图9所示的非限制性构造中,过滤元件930可位于侧通道入口924的近侧。另外,系统900还可包括流控制能力,其可采用多种形状或形式,并且设计成控制流动力或减弱流动速率的波动。在图9所示的非限制性构造中,流阻元件932可位于道入口920和924的近侧。
如图1所述,可制备通道、柱916和孔隙918,使得颗粒、细胞、物质、微粒、材料、组合物等可结合、粘附或者限于通道内的任何区域或在柱916和孔隙918附近,并且由此允许从孔隙918的近侧区域获得任何所需或目标生物物质。用于预涂覆通道和/或柱916和/或孔隙918的组合物、材料或试剂的非限制性示例可包括但不限于牛血清白蛋白、血纤维蛋白、纤连蛋白、层连蛋白、IV型胶原、I型胶原、聚-L-赖氨酸、玻连蛋白、CCL5、S1PR1、SDF-1、FGF-4、和其他胞外基质蛋白质或调节血小板产生的蛋白质。在一些方面中,这种涂覆可在系统900制造步骤期间,或通过流过通道的流体介质流的后续输注来进行。另外,通道可接种细胞或其他生物组合物和材料,包括但不限于人或非人内皮细胞、间充质细胞、成骨细胞和成纤维细胞。具体地,为了复制或模拟三维胞外基质组织和生理骨髓硬度,可在水凝胶溶液中输注细胞,其随后可聚合。水凝胶溶液可包括,但不限于,藻酸盐、基质胶和琼脂糖,其然后可根据需要选择性包埋在任何通道中。
参考图10,其显示了操作系统900的示例性模式,显示生成所需或目标生物物质,如血液PLT的示例性过程1000。具体地,在步骤1002处通过中心通道入口920提供第一生物材料或组合物。这种生物材料可包括其中含有的用于生成PLT的细胞,如MK。然后,在步骤1004处,生物材料的至少一些部分可粘附至一般处于柱916和孔隙918周围的区域,如上所述。例如,MK可在孔隙918近侧被捕获。在步骤1006处,可利用流速、速度、剪切速率,或通道中的压力差来生成目标生物物质。例如,随着MK横向延伸的proPLT在孔918周围捕获,或过滤通过孔隙918,并随后转化成PLT。在步骤1008处,产生的目标生物物质由流体介质运载并且可从流出物收集并分离用于随后使用。在步骤1010处,可进行收集后处理。例如,步骤1010可包括在FDA-批准的储存介质中透析生物反应器衍生的血小板,如血小板添加同业,如由Haemonetics,COBE Spectra,Trima Accel生产的等等。例如,可使用动态透析系统,例如,可使用通过0.75mm,0.65μ mPES管腔(如斯派实验室(Spectrum Labs)所制)的低剪切的连续流。此外,在步骤1010处的收集后处理包括在人输注之前辐射血小板产品的过程,如FDA所要求的那样。因此,可用可输注到人患者中的介质来替代培养基。
系统900的独特设计特征在于,通过利用所述的入口、出口和延伸部分,或端口928,其作为额外流体入口或出口,可选择性地,并且以双向方式输注介质。即,介质、细胞、或任何材料、组合物或物质可通过正向或反向流体流分开或同时导入任何或全部通道中。因此,除了对2个侧通道906的增加的PLT收获效率以外,例如,系统900也允许独立控制各通道,促进不同操作条件,如介质、细胞、涂覆剂、材料、剪切速率、流体流动方向等的头对头比较。图11A和11B显示了用于产生PLT的示例性流体流实施方式,从而MK可导入中心通道904(图11A)或者,各或两个侧通道906(图11B)。
现在参考图12,显示了本发明的多个实施方式所述的仿生系统1200的另一个非限制性示例。系统1200包括基材1202。例如,可使用细胞惰性硅基有机聚合物来构建基材1202,如聚二甲基硅氧烷(PDMS)、COP、COC、PC、PS、PMMA、玻璃和/或任何其他合适材料或其组合。如图12所示,基材1202包括其中形成的第一腔室1204和第二腔室1206,其中腔室被多孔膜1208分开。
在一些应用中,系统1200可能需要组装或分解,例如,单独制备第一腔室1204、第二腔室1206或多孔膜1208。这样,系统1200可包括第二基材(图12中未显示),其中第一腔室1204在第一基材1202中形成,并且第二腔室1206在第二基材中形成。这样,系统1200可包括允许第一腔室1204和第二1206以可去除方式耦合的其他特征。例如,系统1200可包括促进第一腔室1204、第二腔室1206和多孔膜1208之间的流体密封破裂或恢复的元件或要素。
第一腔室1204和第二腔室1206可以任一所需方式成形并确定大小,根据所需的应用选择纵向和横向维度。例如,为了产生具有所需产率的目标生物物质,如PLT,可优化腔室的维度来控制流速、速度概况、剪切速率、剪切应力或腔室之间的压力差。如图12的实施例所示,第一腔室1204和第二腔室1206可沿着纵向基本平行延伸。例如,腔室可包括范围为1000至30000微米的纵向维度,和范围为10至300微米的横向维度,虽然其他值也是可能的。
在一些构造中,可在第一腔室1204的上表面中纳入开口以允许气体转移进出系统1200。这样,可在第一腔室1204近侧层叠疏水性透气膜以防止物质通过开口逃逸。在这种实施方式中,系统1200然后包括疏水性透气膜、第一腔室1204、多孔膜1208、和第二腔室1206,其任选地使用,例如,可再密封片固定器夹在一起,各腔室在分开的基材中形成,如上所述。
多孔膜1208可以是在第一腔室1204和第二腔室1206之间产生部分流体交流通道的任何元件。例如,多孔膜1208可以是具有设置于其中的孔、孔隙或微通道的网格或薄膜。多孔膜1208可根据具体应用塑成、成形并确定尺寸。例如,可使用材料,如聚碳酸酯材料、PDMS、COP、COC、PC、PS、或PMMA来构建多孔膜1208。另外,多孔膜1208可包括范围为1至100毫米的侧向和横向尺寸,并且厚度范围为0.1至30微米,并且更具体地为8至12微米,虽然其他尺寸也是可能的。在一些设计中,多孔膜1208可在系统1200的单独腔室的尺寸上延伸。具体地,多孔膜1208可经设置以具有大表面积用于捕获所需的生物材料、细胞等,其具有支持多个同时proPLT产生过程的能力,如下所述,因此导致增加的PLT产率。
可选择多孔膜1208的合适孔直径,使得可实现对细胞,如MK的最大捕获。例如,多孔膜1208可具有范围为0.1至20微米,并且更具体直径为5至8微米的孔。在一些方面中,可准备多孔膜1208以包含特定材料、化学物或试剂。例如,多孔膜1208可包括调节血小板产生的肽或蛋白质,如聚-L-赖氨酸、血纤维蛋白、IV型胶原蛋白、纤连蛋白、玻连蛋白、层连蛋白、CCL5(RANTES)、S1PR1、SDF-1、FGF-4等。
如图12所示,第一腔室1204包括入口1210和出口1212,并且类似地,第二腔室1206包括入口1214和出口1216。在一些方面中,可通过相应腔室入口输出使用各种化学物、试剂或材料,使用一个或多个源,或通过在相应基材中孵育单独层来单独准备腔室。在其他方面中,准备可通过第一腔室1204和第二腔室1206的输注来平行进行。即,含有化学物、试剂或材料的流体可通过两个入口导入并通过两个出口收集,使得层状流并不混合。
用于系统1200的化学物、试剂或材料的非限制性示例可包括牛血清白蛋白(例如,1-10%)、纤维蛋白原、纤连蛋白、层连蛋白、IV型胶原、I型胶原、和其他胞外基质蛋白质或调节血小板产生的蛋白质。另外,可用细胞接种一个或两个腔室通过灌输它们通过或使单个层在相关细胞培养物中孵育来复制骨髓和血管组成。这些包括,但不限于,人和小鼠内皮细胞、间充质细胞、成骨细胞和成纤维细胞等。此外,为了对三维胞外基质组织和生理骨髓硬度进行建模,可在水凝胶溶液中输注细胞,该水凝胶溶液包括但不限于,藻酸盐,和琼脂糖,其可在系统120内聚合。
系统1200也可具有过滤能力,其可采用任何形状或形式,并且经设置以捕获或吸收来自横向流体的任何类型的碎片、灰尘和任何其他污染物。在一些方面中,过滤器允许细胞、试剂或其他所需材料,如MK通过。另外,系统1200还可具有流控制能力,其可采用多种形状或形式,并且经设计以控制流动力或减弱流动速率的波动。此外,系统120也可包括设置成建立、维持或排出流过系统1200的任何介质流的任何系统、装置、来源或设备。根据需要,这可包括能够通过以一定流速向系统1200的腔室中导入生物组合物来复制生理条件的一个或多个源,该速率能够在腔室之间在预定范围内生成生理剪切,其中预定范围可以是100s-1至10,000s-1。
如图12所示,可在阵列中组装系统1200的多个拷贝以产生仿生装置或系统,系统1200的各拷贝独立运行或连接至其他拷贝。这种方法可提供使PLT生产过程平行化的方便高效方式。例如,一个系统1200的入口和/或出口可连接至第二系统1200的入口和/或出口等。在一些设计中,可设计入口,使得生物材料如MK可使用一个或多个源随机或者同时导入并分布到各系统1200中。另外,来自各系统1200的出口可连接至单一主通道,其允许从阵列中的各系统1200收集到含有目标生物物质如proPLT和PLT的流出物的单容器中。
例如,对于50毫米×75毫米的多孔膜1208,可在单仿生装置上合并超过160个系统1200。考虑到各系统的孔数为1.2x108左右,这表明各装置能够捕获大概2x1010个细胞,其代表了对于产生足够数量的用于体内(动物和人)测试和输注PLT而言足够高的值。
系统1200包括几个优势,包括用确定的ECM蛋白质特定涂覆位于多孔膜1208上的孔的第一表面,和不用这些蛋白质或用其他ECM蛋白质涂覆孔的第二表面,确保MK可在第一表面上停留接触其感兴趣蛋白质,同时proPLT延伸并且它们释放的PLT互相接触的能力。另外,所述的系统1200设计促进了从不同材料构造的各种多孔膜1208的清洁或交换,并且有不同孔径,根据具体应用的需要。
根据本发明的方面的系统100、900和1200通过复制人生理中的维度、环境和条件来提供复制或重复在人生理中所见的生理条件的平台。例如,经历受控环境和流动条件的由紧密隔开的柱分隔的微流体通道,参考图1所述,提供了复制人BM的实际生理模型。通过控制MK捕获、BM硬度、ECM组成、微通道尺寸、血液动力学血管剪切、和内皮细胞接触,使用系统100、900和1200,可产生功能性PLT。
参考图13,显示了用于产生生理模型的过程1300的步骤,其中模型可包括骨髓和血管结构中的至少一种。在过程模块1302中,可将任意数量的生物组合物导入所述提供的仿生微流体系统中,例如,参考图1、9和12。在一些实施方式中,过程模块1302可包括使用第一源以第一流速向提供的系统的第一通道或腔室中导入第一生物组合物,并且使用第二源以第二流速向提供的系统的腔室或第二通道中导入第二生物组合物。在其他实施方式中,可以第三流速使用第二或第三源向系统的第三通道或腔室中导入第二或第三生物组合物。如上所述,可使用源和流的任意组合用生物组合物准备、处理和/或输注各通道或腔室,其中各生物组合物可包括半固体、固体、液体、细胞等,或其组合。
在过程模块1304中,可控制流速以在通道和腔室之间产生所需的差。在一些方面中,控制这种流速可能在促进产生血小板的与定范围内生成生理剪切速率。例如,这种预定范围可以是100s-1至10,000s-1,并且更具体为500s-1至2500s-1。在一些方面中,可逆转血流的相应方向,如参考图11所述。然后,在过程模块1306中,可从流出物收获产生的目标物质,例如,在提供的仿生微流体系统中设置的微通道的近侧。如上所述,这类目标生物物质可包括血小板。在一些方面中,流出物可在过程模块1306处经过多个加工步骤以从流出物中提取目标生物物质。
下文详细描述了本发明中使用的材料和方法的其他实施例。应理解,实施例仅提供用于说明目的,并非旨在以任何方式限制本发明的范围。事实上,除本文所述和显示的那些以外的各种修饰,如血脑屏障的应用或分隔介质间的分子扩散是可能的。例如,描述了具体实施方式,包括维度、构造、材料、细胞类型、流动介质和流速,制造方法和配方,以及成像、处理和分析方法等。然而,将理解也可使用实施方式并且其仍然落在所附权利要求的范围内。
实施例
微流体装置设计和制造
可使用软性平版印刷来制造微流体装置。如图1的实施例所示,该装置包含含有无源滤器的两个通道(用于捕获气泡和灰尘)以及后续的流体阻碍器(用于减弱操作期间产生的流动速率波动)。这些通道合并到1300微米长、130微米宽和30微米深的矩形区域中,其被相隔3微米的一系列柱(10微米宽和90微米长)分离。为确保细胞培养期间有效的气体交换并支持高分辨率活细胞显微观察,可由与玻璃载玻片结合的细胞惰性硅基有机聚合物构建微流体装置。
使用AutoCAD中的AutoDesk软件来设计需要的2D图案并打印在光刻铬掩模(photolithography chrome mask)上。使用SU-83025光刻胶(麦克罗化学公司(Michrochem),马萨诸塞州牛顿市)旋涂硅晶片(大学晶片公司(University Wafers),马萨诸塞州波士顿)至30微米薄膜厚度(劳瑞尔科技公司(Laurell Technologies),宾夕法尼亚州北威尔士),65℃烘烤1分钟并95℃烘烤5分钟,并通过铬掩模暴露于UV光(约10mJ cm-2)30秒。通过将基材浸入丙二醇单甲醚乙酸酯中7分钟来除去未结合的SU-8光刻胶。将聚二甲基硅氧烷(PDMS)倒在硅晶片的有图案的一侧上、脱气并65℃下交联约12小时。固化后,对PDMS层脱模并使用0.75mm直径活检钻钻出入口和出口孔。通过将PDMS板粘结于玻璃盖片((#1.5,0.17x22x50mm,道康宁公司,比利时瑟内夫)随后用氧气等离子体(PlasmaPrep 2,加拉仪器公司(GaLa Instrumente GmbH),德国巴德施瓦尔巴赫)处理来密封通道。使用配备27号针的1mL注射器(BD公司(Beckton Dickinson),新泽西州富兰克林湖市)经由PE/2导管(科学商品公司(Scientific Commodities),亚利桑那州哈瓦苏湖城)将样品注入微流体装置。通过注射器泵(PHD 2000,哈佛设备公司(Harvard Apparatus),马萨诸塞州霍利斯顿)控制液体的流动速率。
微流体装置操作
使用0.22μm过滤的10%BSA溶液(密理博公司(Millipore),马萨诸塞州比尔里卡)对装置包被30分钟以防止细胞直接接触玻璃。参考图1,使用双注射器微流体泵(哈佛设备公司,马萨诸塞州霍利斯顿)以12.5μL/小时的速率分别在第一入口118和第二入口122中输注原代MK和培养基。当第一出口120关闭时,两种输入溶液都重定向至第二出口124,导致原代MK捕获。
胞外基质组成模型(2D)
通过使用若丹明偶联的纤维蛋白原(1mg/mL)或纤连蛋白(50μg/mL,细胞骨架公司(Cytoskeleon Inc.),科罗拉多州丹佛市)对通道灌注30分钟来使用胞外基质蛋白选择性包被微流体装置。通过两个入口平行灌注样品并通过两个出口收集,使层状流体流不混合。装置使用1x PBS清洗并使用0.22μm过滤的(密理博公司,马萨诸塞州比尔里卡)10%BSA溶液(罗氏公司(Roche),加利福尼亚州南旧金山)包被30分钟以包被任何剩余暴露的玻璃。
BM刚性建模(3D)
将原代MK重悬于培养基中平均分子量为150-250kD的1%无菌藻酸盐(Pronova SLG100,FMC生物聚合物,挪威)中并跨微流体装置(图1中的第一入口118,第二出口124)直至MK被捕获。随后使用1xPBS选择性灌注第二通道以从该通道中除去藻酸盐。为制备均匀的藻酸盐凝胶,将30mM纳米颗粒碳酸钙(mkNANO公司,加拿大)用作钙源并溶解于60mM缓慢水解的D-葡萄糖酸-δ-内酯(西格玛-奥德里奇公司(Sigma-Aldrich),密苏里州圣路易斯),其在溶液中释放钙(参见综述Khavari等,NJP 2013)。沿第二通道灌注碳酸钙悬浮液直至第一通道中保留的藻酸盐溶液聚合(约20分钟)。随后使用1x PBS选择性清洗第二通道并使用培养基替换。为测定藻酸盐凝胶的机械性能,制备0.25%、0.5%、1.0%和2.0%藻酸盐凝胶并在37℃下通过流变学测量其频率依赖的剪切模量(Ares G2TA仪器公司(TA instruments),特拉华州纽卡斯尔)。
窦状腺血管接触建模(3D)
使用上文所述50μg/mL纤连蛋白(细胞骨架公司,科罗拉多州丹佛市)和10%BSA(罗氏公司,加利福尼亚州南旧金山)选择性包被微流体装置,并转移至37℃、5%CO2孵育器中。将EBM培养基中10,000,000HUVEC/mL(隆萨公司(Lonza),瑞士巴塞尔)以12.5uL/小时接种于纤连蛋白包被的通道上并允许其在3小时的时间内粘附于该表面上。使用无细胞EBM培养基替代入口样品并通过通道灌注直至HUVEC实现融合(2-8天)。使用5μM CellTracker Red和1μtg/mL Hoescht 33342(英杰公司(Invitrogen),加利福尼亚州卡尔斯巴德)对细胞染色45分钟,在新鲜培养基中清洗或在4%甲醛中固定并通过共聚焦荧光显微镜观察。
血管剪切速率建模(3D)
使用微流体装置内的流体动力学计算机模型预测施加于MK上的剪切应力。使用有限元方法软件(COMSOL)来求解纳维-斯托克斯(Navier-Stokes)方程。不可压缩流体的稳态纳维-斯托克斯流体方程是:
其中ρ是流体密度,是流动速度,p是压力,μ是流体粘度且是f作用于流体上的体力。在复制微流体装置的精确维度的三维计算机域中对方程(1)求解。假定该装置中的流体具有水的粘度和密度(分别为0.001Pa s和1000kg/m3)。在通道壁处假定没有滑动边界条件。输注流动速率的范围是12.5-200μL/小时。使用三角网格(其在裂纹处更精细)来使域离散化。该模型含有315,317自由度。在251,101和415,309自由度之间发现网格独立性,如同剪切速率之间获得小于10%的差异所确认的那样。使用UMFPACK线性系统解算器获得稳态解。
原代小鼠巨核细胞培养物
小鼠FLC收集自WT CD1小鼠(查尔斯河实验室(Charles River Laboratories),马萨诸塞州威尔明顿)并培养MK。
电子显微分析
使用含1.25%多聚甲醛、0.03%苦味酸、2.5%戊二醛的0.1-M二甲砷酸盐缓冲液(pH 7.4)对巨核细胞输入物和生物反应器流出物固定1小时,使用1%四氧化锇进行后固定,通过一系列醇进行脱水,使用环氧丙烷浸透,并包埋在环氧树脂中。对超薄切片染色并以80kV的加速电压使用Tecnai G2 Spirit BioTwin电子显微镜(俄勒冈州希尔巴罗)检查。使用先进显微镜技术(AMT)2-K带电偶联装置显微镜记录图像,其中使用AMT数字获取和分析软件(先进显微镜技术公司(Advanced Microscopy Techniques),马萨诸塞州丹弗斯市)。
免疫荧光显微分析
纯化并探测巨核细胞、释放的proPLT或生物反应器流出物。将样品与5μM CellTracker Green(英杰公司,加利福尼亚州卡尔斯巴德)孵育45分钟,在新鲜培养基中清洗并通过活细胞荧光显微镜观察,或者在4%甲醛中固定并离心至聚-L-赖氨酸(1μg/mL)包被的玻片上。对于细胞骨架组分的分析,对样品使用0.5%曲通-X-100通透化,并在免疫荧光封闭缓冲液(含0.5g BSA、0.25ml 10%叠氮化钠、5ml FCS的50ml 1×PBS)中封闭过夜,之后进行抗体标记(55)。为描绘微管细胞骨架,将样品与针对小鼠或人β1-微管蛋白的兔多克隆一抗孵育。为描绘肌动蛋白细胞骨架,将样品与Alexa 568鬼笔环肽(英杰公司,加利福尼亚州卡尔斯巴德)孵育。使用1μg/mL Hoescht 33342(英杰公司,加利福尼亚州卡尔斯巴德)标记细胞核。为校正背景荧光和非特异性抗体标记,将载玻片与二抗单独孵育,并相应调节所有图像。使用配备10x(数值孔径,0.30)Plan-Neofluar空气和63x(数值孔径,1.4)Plan-ApoChromat油浸物镜的Zeiss Axiovert 200(卡尔蔡司公司(Carl Zeiss),纽约州索恩伍德)检查样品,并使用CCD照相机(滨松光子学公司(Hamamatsu Photonics),马萨诸塞州波士顿)获取图像。使用Metamorph 7.7.2.0版图像分析软件(分子装置公司(Molecular Devices),美国加利福尼亚州日照谷)和ImageJ 1.47p版软件(NIH,http://rsb.info.nih.gov.ezp-prod1.hul.harvard.edu/ij/)分析图像。
细胞尺寸和多态性测定
对细胞单个地使用阈值进行选择并使用研究者编码的软件(列于下文)在ImageJ中进行高含量胞质面积和周长测量。通过手动观察所有样品来确认分析,并将未正确选择的细胞剔除出分析。从面积测量中计算MK直径以说明非圆形细胞。对各条件计数超过2000个细胞,并对至少三个独立样品进行MK面积和流出物组分的分析。使用成对样品的双尾斯氏t检验建立统计学显著性。误差线代表平均值的标准差。
活细胞显微分析
对于剪切培养物,将MK加载至‘裸’微流体装置(仅BSA包被)上,并在2小时时间内使输注速率逐步倍增,从12.5μL/小时至200μL/小时。对于静态培养物,将分离的MK抽吸至腔体中并培养24小时,该腔体通过将3%BSA包被的玻璃玻片安装在具有1cm孔的10mm培养皿上来形成。将静态和剪切培养物都在37℃和5%CO2下维持并使用配备10x(数值孔径,0.30)Plan-Neofluar空气物镜的Zeiss Axiovert 200(卡尔蔡司公司,纽约州索恩伍德)检查。以2秒(剪切培养物)或20分钟(静态培养物)间隔使用CCD照相机(滨松光子学公司,马萨诸塞州波士顿)获取微分干涉相衬(DIC)图像。使用Metamorph 7.7.2.0版图像分析软件(分子装置公司,美国加利福尼亚州日照谷)和ImageJ软件1.47p版分析图像。对来自至少三个独立样品的超过200个MK手动测定proPLT延伸速率。对于PLT铺展实验,2小时后从微流体装置中收集流出物并抽吸入未包被的静态培养物腔体中,如上文所述。通过重力沉降允许PLT接触玻璃并在5分钟时间内以5秒间隔捕获铺展。
GFP-β1微管蛋白逆转录转染
将Dendra2融合的β1微管蛋白克隆至pMSCV质粒。将HEK 293细胞包装细胞在附加有10%胎牛血清(FBS)的DMEM中培养至30-50%融合。使用pMSCV载体中编码与Dendra2融合的β1微管蛋白、gag/pol和2μg vsvG的DNA质粒进行HEK 293细胞的转染。第二天更换培养基后,将细胞孵育72小时以进行病毒生产。通过0.22μm滤器(密理博公司,马萨诸塞州比尔里卡)过滤上清液并将等分试样储存于-80℃。在培养的第二天,从上文所述胎肝培养物中分离的MK重悬于含有10%FBS、8μg/mL聚凝胺(西格玛公司)和逆转录上清液的DMEM中。将样品转移至6孔板,25℃下800xg离心90分钟并随后在37℃下孵育90分钟。孵育后,通过离心并重悬于含有10%FBS和TPO的新鲜DMEM中来清洗MK。允许MK成熟直至培养的第4天,随后通过BSA梯度分离,如前文所述。
流式细胞术
从静态MK培养物或生物反应器流出物的释放的proPLT组分中收集血小板并在静止状态下检查。使用针对CD42a或CD41/61的FITC偶联的抗体(安福莱特分析公司(Emfret Analytics),德国艾贝尔斯塔特)探测样品并在FACSCalibur流式细胞仪(BD公司)上运行。当PLT通过检测器时通过其特有的正向和侧向散射来进行门选,并在扣除FITC偶联的IgG抗体特异性对照(安福莱特分析公司)后计算其总荧光强度。通过将流出物收集期间的净GP IX+PLT生产除以净GP IX+MK消耗来测定PLT产率,并对至少三个独立样品进行。结果与GP IIbIIIa+细胞相同。
图像分析
使用ImageJ和Adobe Photoshop CS3(Adobe系统公司(Adobe Systems),加利福尼亚州圣何塞)分析Metamorph中获取的数字图像。分界线明确地区分单独的不同图像,或相同图像的单独区域。没有对图像内的特定特征进行增强、遮蔽、移动、移除或导入,且对亮度、对比度和色平衡的调节线性地应用于整个图像。
人BM的微流体装置模型生理特性
为重现生理条件,分别使用纤维蛋白原和纤连蛋白选择性包被各通道以再生血管微环境和BM的ECM组成(如图2A所示)。通过跨微流体装置流动,沿第一通道输注的原代MK在各柱之间被依次捕获并将proPLT延伸至第二通道(如图2B所示),再现了生理proPLT延伸。为对3D ECM组织和生理BM刚性(250Pa)进行建模,在微流体装置中聚合的1%藻酸盐溶液中输注MK,将MK选择性包埋在第一通道内的藻酸盐凝胶中并保留第二通道中的血管流。藻酸盐不抑制proPLT生产,并可控制MK与第二通道的距离。
沿第二通道选择性接种人脐静脉内皮细胞(HUVEC),并生长至融合以生产功能性血管(如图2C所示)。此外,通过10x-150x放大、高分辨率活细胞显微镜监测MK表现,并从流出物中收集释放的PLT。图2D显示完整的系统,显示运行。表征层状流体剪切速率(如图2E所示),并使用两个微流体泵严格控制(一个用于第一通道且一个用于第二通道)。装置内的剪切速率与输注速率呈线性正比例并经调节以跨生理范围(500-2500s-1)。虽然空微通道连接部处的剪切速率随着与第一通道的距离而增加(如图2F所示),但在MK捕获后,流体被重定向至下一个可用的间隙从而使MK在这些位点处持续经历生理(760至780s-1)剪切速率(如图2G所示)。
血管剪切触发proPLT生产、生理延伸和释放
体内BM MK以血液流动的方向延伸proPLT并将PLT、proPLT、大的细胞质片段(prePLT)和甚至整个MK释放至窦状腺血管中,其可在肺微血管床中捕获,或在循环中成熟。为测定生理剪切对PLT生产的影响,在培养第4天分离小鼠胎肝培养物来源(mFLC)的MK并在输注入微流体装置前通过尺寸和多倍性表征(如图3A所示)。
体外生产可输注PLT的主要挑战之一是鉴定触发proPLT生产的因子。在静态条件下,MK在分离后约6小时开始生产proPLT,并在18小时时达到最大proPLT生产(如图3B所示)。相比之下,生理剪切下(如图3C所示,约500s-1)的MK在捕获的数秒内开始生产proPLT,在培养的最初2个小时内达到最大proPLT生产和生物芯片饱和。生理剪切下的MK生成较少、较长的proPLT,其相对于静态培养物的高度支化程度较低。剪切培养中的proPLT均匀地延伸至下通道内并以相对血管通道壁流动的方向排布,再现了生理proPLT生产。生理剪切下生产proPLT的MK百分比是静态培养物的两倍,其比例为约90%(如图3D所示)。
生成用于输注的临床数目的PLT的另一个主要挑战是体外培养以显著低于体内的速率延伸proPLT。在我们的微流体装置中应用生理剪切将proPLT延伸提高至高于静态培养物对照一个数量级(至大约30μm/分钟,如图3E所示),其符合活小鼠中活体显微研究的proPLT延伸速率生理预测并支持增加的体外proPLT生产。
在人和小鼠中的早期组织学研究预测可挤压全MK以及MK片段通过BM血管内血管内皮中的间隙或穿孔以在肺循环床(pulmonary circulatory bed)中捕获。最近在血液中发现了称为prePLT的大PLT中间体,并且将mBM和FLC来源的MK和prePLT静脉输注至小鼠中在体内生成了PLT。在目前的研究中,常规地观察到100um+直径MK挤压通过3μm(如图4A所示)和1.5μm间隙,或延伸大MK片段(如图4B所示),支持血管PLT生产的模型。此外,切断事件(abscission event)通常由高分辨率活细胞显微镜捕获并发生在沿proPLT轴的可变位置处,释放prePLT大小的中间体(3-10μm直径)和PLT(1.5-3μm直径)(如图4C和图4D所示)。每次切断后,所得proPLT末端在尖端形成新的PLT大小的膨胀,其随后被延伸和释放,重复该循环(如图4E所示)。
当剪切速率保持恒定时,proPLT延伸速率在沿轴的不同位置处变化,预测存在一种受调控的细胞骨架驱动的proPLT延长机制(如图4C所示)。在生理范围内提高微流体剪切速率不影响培养物中proPLT延伸速率中值或proPLT延伸速率的分布(如图4F所示),且经逆转录病毒转染以表达GFP-β1的MK中的proPLT凸出由外周微管(MT)组成,该外周微管在PLT尺寸的末端处形成螺旋(如图4G所示)。proPLT达到超过5mm的长度并在体外耐受最高1000s-1的剪切力;其从活体显微观察中重现了proPLT生产的生理示例,并显示剪切未导致切断事件。为确认剪切诱导的proPLT延伸是细胞骨架驱动的,在微流体装置中进行输注之前,将MK与5μM Jasplankinolide(Jas,肌动蛋白稳定剂)或1mM赤式-9-(3-[2-羟基壬基](EHNA,胞质动力蛋白抑制剂)孵育。在静态和生理剪切条件下,Jas和EHNA都抑制剪切诱导的proPLT生产(如图4H和图4I所示)和PLT释放。
衍生的PLT表现血液PLT的结构和功能性质
PLT是直径为约1-3μm的无核盘状细胞,其在表面上表达生物标志物GP IX和IIbIIIa,并且以环绕基于肌动蛋白的细胞骨架网络的6-8个MT的皮质MT螺旋为特征。为确定PLT产率,培养第四天在我们的微流体装置中进行输注之前紧接通过流式细胞术测量糖蛋白(GP)IX+mFLC-MK的相对浓度和正向/侧向散射和生物标志物表达(如图5A所示)。在输注后2小时收集流出物并与mFLC-MK输入物比较(如图5B所示)。输入的MK和流出的PLT都在其表面上表达GP IX和IIbIIIa,并显示特征性正向/侧向散射。在相对于培养第五天分离的静态培养物上清液,剪切的应用使得流出物的细胞组成朝向更多PLT尺寸的GPIX+细胞变化(如图5C所示)。85±1%的MK在2小时内转化为PLT,其符合我们的proPLT生产百分比的定量(图3D)并与静态培养物相比显著改进(图5D)。在我们的微流体装置中在2小时内持续输注约500s-1剪切生成了约21个PLT/MK并形成超过现有培养方法的PLT生产速率,现有培养方法在长得多的时间(6-8天)内生成类似的PLT数目。
为定量我们的产品的形态组成(morphological composition),对来自我们的微流体装置的流出物探测β1微管蛋白(PLT特异性微管蛋白同种型)和Hoescht(细胞核染料),并通过免疫荧光显微镜进行分析。根据其形态和尺寸拣选细胞,并将其与静态MK培养物上清液比较。剪切的应用使得流出物的细胞组成朝向更多PLT尺寸的B1微管蛋白+Hoescht细胞变化(如图5E所示),其符合流式细胞术数据(图5C)并形成在组成上更类似于全血中PLT中间体的分布的产物。流出物中游离细胞核的定量确认了相对于静态培养物增加的微流体装置介导的PLT生产并确定PLT产率为约20±12个PLT/MK,其符合流式细胞术数据。
静止的PLT含有特征性的表面膜内陷(其形成开放的小管系统),闭合的残留内质网的通道网络(其形成致密的微管系统),细胞器,特化的分泌颗粒,并且在与玻璃接触激活后会变平/铺展。微流体装置生成的PLT无法通过薄片透射电子显微镜在超微结构上与小鼠血液PLT区分开;并且含有皮层MT螺旋、开放的小管系统、致密的微管系统、线粒体、α颗粒和致密颗粒(如图5F所示)。微流体装置生成的PLT和PLT中间体通过免疫荧光显微镜显示与小鼠血液PLT相比可比的MT和肌动蛋白组成(如图5G所示),并在与玻璃接触激活后正常铺展,形成丝状伪足和板状伪足。
将微流体装置应用于人PLT生产
为生成人PLT,使用hiPSC衍生的MK代替我们的微流体装置中的mFLC-MK,其提供了实际上用于输注的无限制MK来源。hiPSC-MK在培养第15天分离,前提是其达到20-60μm的最大直径(如图6A所示),并且在超微结构上类似于原代人MK(如图6B所示)。在静态培养物下,hiPSC-MK在分离后约6小时开始生产proPLT,并在18小时时达到最大proPLT生产(如图6C所示)。相比之下,生理剪切下(约500s-1)的hiPSC-MK在捕获后立即开始生产proPLT,并在培养的最初2个小时内延伸/释放proPLT(如图6D所示)。剪切下的生产proPLT的hiPSC-MK的百分比增加至约90%,显著超过静态培养物(约10%)(如图6E所示)。
proPLT延伸速率略低于mFLC-MK对照(约19μm/分钟对比30μm/分钟)(如图6F所示)且更接近生理对照。微流体装置生成的PLT显示正向和侧向散射,和人血液PLT的表面生物标志物表达特征,其无法通过薄片透射电子显微镜在超微结构上与人血液PLT区分开(如图6G所示),通过免疫荧光显微镜显示与人血液PLT相比可比的MT和肌动蛋白表达(如图6H所示),在与玻璃接触激活后正常铺展,并形成丝状伪足和板状伪足(如图6I所示)。总之,这些结果显示可将hiPSC-MK应用于我们的仿生微流体装置以生成潜在无限数目的功能性人PLT。
将微流体装置应用于药物开发
血小板减少症会突然并通常无意间发生,潜在地导致大量出血和死亡。已证明抗体和细胞介导的免疫应答导致血小板减少症。此外,血小板减少症可由多种药物触发,包括癌症药物,例如达沙替尼。动物模型通常是人中药物安全性和功效的较差预测物,而临床研究是耗时、昂贵且潜在有害的。设计为模拟人BM的微流体装置代表了具有重大临床重要性的创新领域,提供有效和实际的平台来研究多种药物对于BM和MK生物学的影响。
通常通过使用流式细胞术的输注研究来测量PLT存活率和清除率。然而,proPLT生产的速率和程度的定量不适用于该方法,且需要直接观察以确定血小板生成在哪个阶段受到影响。相反地,本发明的微流体系统的应用提供了以研究药物对PLT生产的影响的重要平台,这会促进鉴定PLT生产的新调控因子并阐明临床上重要的药物诱导的血小板减少症的机制。
作为概念验证,使用了高含量活细胞显微镜来鉴定曲妥珠单抗安木坦兴(trastuzumab emtansine,T-DM1)表达GFP·Pl微管蛋白(活细胞显微术)影响PLT生产的机制,该T-DM1是一种目前用于乳腺癌的临床研发中的抗体药物偶联物。这些研究表明T-DM1通过诱导异常的微管蛋白组织来抑制MK分化并破坏proPLT形成(如图7所示)。确定治疗剂(如T-DM1)影响MK成熟和proPLT生产的通路可产生体内调控PLT生产和控制药物诱导的血小板减少症的策略。
本发明的方法利用一种全新的微流体设计来离体再现人BM和血管生理学,并生成用于输注的功能性人PLT的替代性来源。虽然临床上想要满足日益增长的输注需要并规避目前与血小板获取和储存相关的风险,但用于治疗应用的供体非依赖性PLT的研发过程中一直存在两个主要的数量障碍:(1)生成足够数目(约3x108)的人MK以支持一个PLT输注单元(约3x1011个PLT)的生产,以及(2)每个MK生成生理数目的功能性人PLT(约103-104)。人胚胎干细胞培养物(hESC)和更近期的人诱导多潜能干细胞培养物(hiPSC)的开发提供了潜在无限的祖细胞来源,其可在体外分化为人MK以解决第一个数量障碍。实际上,由于PLT是无核的,可在输注前辐照PLT微流体装置来源的单元,解决了来源于hESC或hiPSC的细胞产品可能是致癌或致畸形的问题。
研究PLT生产的环境驱动因子的尝试受到简化论者方法的限制,且2D液体培养物的主要限制是其无法形成3D BM组成和硬度、proPLT延伸的定向和静脉内皮的接近度(proximity)。同样地,虽然进入窦状腺血管的生产proPLT的MK经历500至2500s-1的壁剪切速率,通过在ECM包被的载玻片上输注MK来塑造血管流的尝试选择了固定/粘合的MK,并且无法区分ECM接触激活与剪切。或者,在孵育摇床中向心搅动释放的proPLT,其不再现BM血管中的层状剪切流,不提供血管剪切速率的精确控制,且不适用于高分辨率活细胞显微观察。然而,虽然存在这些限制,但将MK暴露于高剪切速率(1800s-1)加速了proPLT生产,并且与在约0.5Pa流体剪切压力下维持2小时的proPLT相比,不存在剪切的情况下培养的proPLT释放更少的PLT。此外,多光子活体显微技术的最新进展提供了提高的体内proPLT生产分辨率并确认血管流对于proPLT延伸和PLT释放的重要性。虽然这些研究提供了体内proPLT生产的生理学上精确的示例,但微环境的受限的控制和较差的分辨率阻止了BM微环境如何帮助PLT释放的进一步研究。
证明细胞-细胞接触、胞外基质(ECM)组成和硬度、血管剪切速率、pO2/pH、可溶性因子相互作用和温度有助于proPLT形成和PLT释放的越来越多的证据表明,在3D微流体培养形态内再生BM和血管微环境是实现临床上重要的功能性人PLT数目所必需的。实际上,已在连续流体流下应用模块化3D编织聚酯网格以在培养物中从1x106个CD34+人脐带血细胞中生成最多6x106个PLT/天。虽然表明可以获得临床上有用的培养物来源的人PLT数目,但那些3D灌注生物反应器没有精确地再生BM微环境的流体特性和复合物结构,且其闭合的模块化设计无法直接观察proPLT生产,难以提供对PLT释放机制的理解。或者,已提出使用3D PDMS生物芯片相邻的ECM包被的基于丝的导管来再生BM窦状腺并在体外研究MK分化和PLT生产。虽然能够在成熟期间再现了MK迁移,但该设计无法适用于高分辨率活细胞显微分析,并无法再生驱动MK分化所需的内皮细胞接触。
相比之下,本发明的微流体装置设计提供了完整解决方案,允许PLT释放时间的显著改进和总PLT产率的增加。此外,在微流体装置内应用血管剪切速率诱导proPLT生产并再现生理proPLT延伸和释放。此外,在生理流动条件下,MK能够挤压通过小间隙以进入循环并释放prePLT中间体。在本发明的微流体装置中持续输注MK生成的产物达到了生理PLT浓度并表现血液PLT的结构和功能性质。最后,PLT微流体装置可应用于人MK培养物以生产功能性人PLT。虽然每个MK的PLT产率低于理论预测值,但MK培养物将大MK片段(prePLT、proPLT)以及MK自身常规性释放至流出物通道内的观察表明,实际的PLT数目依赖于在支持性微环境(如肺和循环血液)中PLT中间体向PLT的进一步分化。实际上,在将mFLC来源的proPLT输注至小鼠时,其在12-24小时的时间内被迅速转化为PLT。有趣的是,虽然该研究中CMFDA标记的PLT在血液中容易检测,但prePLT中间体并非如此,表明其可能在肺的微循环中捕获。同样地,在将mFLC和BM来源的MK输注至小鼠中时,其几乎都定位至肺并在最初的两个小时内释放PLT。在这两种情况下,几乎可以确定血管剪切速率、血液中的可溶因子相互作用和内皮细胞接触调控该过程,且对这些组织中的局部微环境如何帮助末端PLT生产进行检验保证了进一步研究。
通过在单个微流体系统中合并BM生理学的主要元素(包括3D ECM组成和硬度、细胞-细胞接触、血管剪切速率、pO2/pH、可溶性因子相互作用和温度),本发明的方法提供了前所未见的对离体微环境的控制和用于药物开发的仿生平台。此外,高分辨率活细胞显微镜的支持允许在培养期间直接观察细胞并对较差表征的生理过程提供了窗口。最后,通过镜像复制(mirror)中央通道各侧上的流出物通道、延长装置以支持较多数目的柱并将多个单元平行定位在较大的微流体装置基质内,可容易地扩大微流体装置设计的规模。在较长的装置中持续收获hiPSC-MK可导致临床上重要的PLT数量以进行例如PLT功能的传统集合度测定,以及在免疫抑制的小鼠中进行体内异源-输注研究以测量PLT计数的增加,每次研究需要约108个PLT。
总之,本发明显示了一种系统和方法以再现人BM和窦状腺血管,用于在适用于高分辨率成像的方法中生成人血小板。本发明的仿生微流体系统可使用PDMS、玻璃和任何其他合适材料制造,并且包括多个微流体通道和腔室构造,其设计为模拟实际生理条件,如流速、剪切速率、压力差等。那样,可用ECM和人内皮细胞,以及其他与生理系统一致的生物试剂或材料选择性涂覆本文所述的微流体系统的通道或腔室。在所述的一些操作形式中,可依次捕获沿着本文详述的微流体系统的不同通道输注的圆形或proPLT生产型MK,并且使血小板产生proPLT延伸到随后释放PLT来收获的相邻通道中。可通过可控的生理剪切速率和调节的微环境来刺激或优化这种过程,并且可从流出物中收集进入流体流的释放的PLT,该过程能够使用例如高分辨率显微术来观察。
上文所述多种构造仅是示例而不旨在限制本发明的范围。本文所述各种构造的变化形式对于本领域普通技术人员而言显而易见,这类变化形式在本发明的范围内。具体而言,可选择一个或多个上述构造的特征以建立替代性构造,其包含上文未明确描述的特征子组合。此外,可选择并合并一个或多个上述构造的特征以建立替代性构造,其包含上文未明确描述的特征组合。在通读本发明后,适用于这类组合和子组合的特征对本领域技术人员而言显而易见。本文和权利要求中所述主题旨在覆盖和包括技术中的所有适当变化。
- 还没有人留言评论。精彩留言会获得点赞!