用于检测和表征微生物的方法与流程
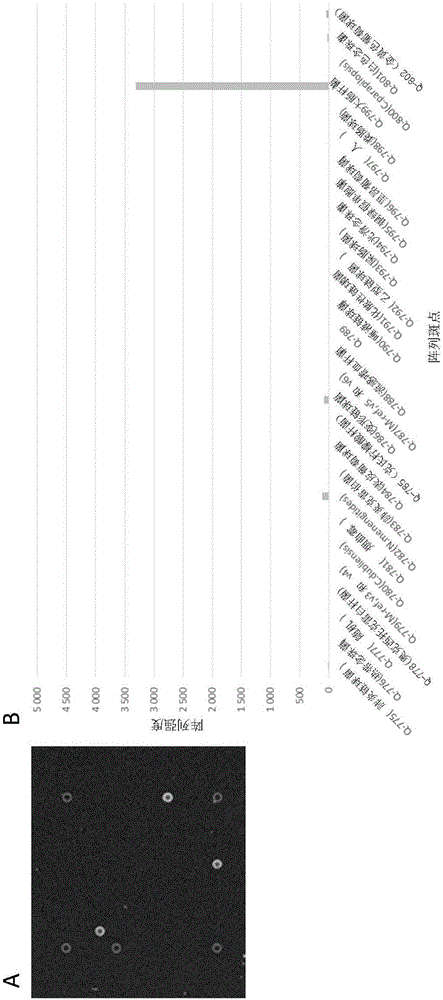
本发明涉及用于检测和表征临床样品中的微生物的方法。更具体地,本发明提供用于微生物的组合检测和表征的快速分子测试方法,其允许样品的持续培养用于进一步的测试。
背景技术:
:微生物感染代表一类主要的具有重大临床和经济意义的人和动物疾病。尽管多个种类和类型的抗微生物剂可用来治疗和/或预防微生物感染,但是抗微生物剂耐药性(antimicrobialresistance)在现代医学中是一个巨大且日益严重的问题。多种微生物病原体的抗微生物剂耐药性株的数量在过去20年中已激增,并且微生物持续对日益增多数量的抗微生物剂(特别是抗生素)种类发展耐药性。随着耐药性机制传播至更多有机体,与抗微生物剂耐药性相关的公众健康影响和成本在未来的几年中将快速增加。在处理微生物感染的情况下,因此可能是期望的并且确实是重要的是具有关于感染微生物的特性及其抗微生物剂敏感性分布的信息,以同时确保有效治疗以及减少使用不必要或无效的抗生素,并且由此有助于控制抗生素(或者更通常地抗微生物剂)耐药性的传播。这在其中快速有效治疗是至关重要的严重或威胁生命的感染的情况中尤其如此。脓毒症(败血症,sepsis),其是一种由严重感染引起的潜在致命性全身炎症,在美国是最昂贵的病症并且是住院费用的推动者,占总的国家住院费用的5%。如果没有正确治疗,对于严重脓毒症,死亡率每小时增加7%,并且升高的引起抗微生物剂耐药性脓毒症株的盛行率使得对于脓毒症的正确治疗的预测日益困难。用于诊断引起脓毒症的微生物的当前黄金标准基于表型和生物化学鉴别技术,其要求分离和培养感染性微生物的纯培养物。可能花费若干天来进行微生物鉴别(ID)和抗生素敏感性(AST)试验以鉴别感染并且确定抗微生物剂耐药性微生物的敏感性分布。当前的临床实践要求基于临床症状在怀疑脓毒症的1小时内用广谱抗生素治疗。第二次给药在6-8小时内并且这种施用每第六至第八小时继续直至鉴别出该微生物及其抗生素敏感性(ID/AST)的鉴别。由于脓毒症是致死性病症,所以如果患者经历临床反应,医师则不愿意将治疗初始地从广谱抗生素改变,直至微生物感染的特性被确定并且确立抗微生物剂敏感性。这又导致不必要地高度使用广谱抗生素,又促进在微生物之中的抗微生物剂耐药性的上升。传统测试方法利用浊度测量或纸片扩散来评估抗微生物剂对微生物生长影响,以及传统生物化学和微生物学技术来鉴别微生物。由于需要延长的孵育期以允许微生物生长所致,这些技术可能花费若干天来鉴别和表征临床样品中的微生物。因此对于可以快速鉴别微生物并且确定抗微生物剂耐药性微生物的抗微生物剂敏感性的技术存在需要,并且近年来已开发了减少样品收集和诊断之间的时间的多种不同技术。绕过需要长的孵育期的富集临床样品中的微生物的方法描述于US8,481,265;微生物细胞可以通过非微生物细胞的选择性溶解而从临床样品富集,富集样品中的微生物细胞的浓度并且绕过在测试样品之前需要长时间的孵育。快速微生物鉴别的方法描述于US2010/0124763。其中微生物培养物被富集并且利用光谱法鉴别微生物。利用流式细胞仪(Broeren等人2013ClinMicrobiolInfect19,286-291)和自动化显微镜(Price等人2014JMM.9850-59)的快速敏感性测试技术已被开发以减少在敏感性被确定之前对于孵育所需的时间。微生物DNA的定量PCR也已被用作用于微生物生长的量度以确定抗微生物剂敏感性,如在US5,789,173中描述的。组合的微生物鉴别和敏感性测试方法也已被开发。描述于US2005/0095665A1中的是这样的一种系统,其中多组选取的生长培养基以及显色和荧光底物联合以自动微滴定孔形式的微生物生长的浊度测量使用以鉴别微生物并确定抗微生物剂敏感性。自动化显微镜方法也已被开发(Metzger等人2014DiagnosticMicrobiologyandInfectiousDisease79160-165)。BDPhoenixTM系统还允许用于快速同时鉴别和表征微生物,并且利用各种各样的显色和荧光底物来鉴别样品中的微生物以及减小微生物生长以确定样品中的微生物的抗微生物剂敏感性。用于微生物鉴别的分子方法已被开发,其中不是生长和测试微生物的性质,而是使用探针来检测微生物细胞之中或之上的核酸或蛋白标记物,所述标记物可以鉴别该微生物。已经开发了大量的用于鉴别不同微生物的这样的分子试验,并且事实上分子试验还存在用于鉴别与特定抗微生物剂的耐药性标记物相关的多种遗传变体或遗传特征。然而,虽然开发了这样的用于鉴别和表征微生物的新技术,但是临床医师关于仅依赖于它们相对于传统培养和表型/生物化学方法的使用仍然保持谨慎,并且这样的传统方法迄今在许多临床实验室仍然是骨干。特别是关于分子试验,由于可用的探针可能不会检测所有可能的潜在病原体的观念(并且因此感觉缺乏分子试验的“完整性”)所致,许多临床医师不愿意仅依赖于这些并且仅将它们视为补充试验。因此当前的临床实践是用分子测试方法来补充传统培养方法从而诊断传染性疾病。尽管这些传统方法还缺乏完整性,但是它们确立的使用使得它们成为用于诊断传染性疾病的当前黄金标准。因此当前临床实践需要从患者收集双份临床样品以便分子和传统试验都可以平行地进行。这可能导致逻辑和人员问题,因为需要另外的职员来收集和处理样品,并且可能导致在患者体内传染性疾病的诊断和治疗方面的不可接受的延迟。这还带来由于来自提取临床样品的污染的高风险所致的另外的假阳性诊断的风险。这在一些情况下可能导致分子试验被预知,尽管事实是它们可能潜在地导致较早鉴别和诊断。技术实现要素:本发明寻求解决这些问题,并且特别是提供改进的工作流程,其适应于使用同一临床样品的分子和传统测试方法二者。因此本发明提供一种用于检测和表征临床样品中的微生物的方法,其中同一个临床样品可用于分子测试和快速抗微生物剂敏感性试验(AST),以及用于传统培养方法,其消除了对于要获取双份临床样品的需要。事实上,所述方法被设计成在培养样品以允许在发生分子试验的时间期间微生物生长的同时,如果分子试验导致鉴别,则传统或常规试验的进行可以是不必要的-分子ID和与快速AST试验联合的耐药性试验可以是足够的,由此消除对于任何进一步(常规或传统)的基于培养物的试验的需要。尽管如此,所述方法对于同一样品允许在需要这样的试验的情况下保持为培养,或者实际上以允许这样的另外试验在任何情形下进行,作为结果的确认或备份。这导致比常规方法更快的诊断,并且可以导致患者的更快治疗以及不必要治疗的更快淘汰(out-phasing)。如果分子测试不足以鉴别微生物,则进一步的常规试验可以使用同一样品进行。对问题的这种优雅方案之前没有被理解或提出。本发明的一个关键特征在于,从患者提取单个样品-此单个样品可以在进行根据本发明的分子试验和AST的同时被放入并保持为培养。然而,不是必须的是,仅制备和孵育(培养)单个培养物。有可能的是,可以建立单个初始培养物(例如,单个培养器皿可以用临床样品接种)并且由此可以建立一个或多个继代培养物,并且初始培养物的继代培养物可以用于根据本发明的分子和AST试验。该初始原代培养物在需要或期望进一步试验的情况下可以保持(即保持为培养)。因此,在一方面,本发明提供一种用于检测和表征临床样品中的微生物,特别是在临床样品中可能存在的微生物的方法,所述方法包括:a)将临床样品引入至含有培养基的第一培养器皿;b(i))任选地在所述第一培养器皿中预培养所述临床样品;b(ii)任选地从所述第一培养器皿移出临床样品/培养基混合物或在预培养的情况下临床样品培养物的部分,并将所述部分引入至含有培养基的第二培养器皿,并且任选地在所述第二培养器皿中预培养所述部分;c)从所述第一和/或第二培养器皿移出试验等分试样,并在所述第一和/或第二培养器皿中培养或继续培养所述临床样品和/或部分;d)从所述试验等分试样分离DNA;e)在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述核酸试验使用以下各项进行:i)用于微生物鉴别的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii)用于抗微生物剂耐药性标记物检测的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记物的核苷酸序列;并且检测所述探针和/或引物是否已杂交至所述DNA和/或所述引物是否已被延伸(例如已发生扩增反应);以及f)如果在步骤(e)鉴别出微生物,则在来自步骤(c)的所述经过培养的临床样品和/或部分上进行抗微生物剂敏感性试验,其中在所述抗微生物剂敏感性试验中的微生物生长通过评估生长或用于生长的标记物进行监测,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由在步骤(e)中检测出的微生物的身份和抗微生物剂耐药性标记物确定,并且任选地在所述第一和/或第二培养器皿中继续培养所述临床样品和/或部分,或g)如果在步骤(e)中没有鉴别出微生物株,则进一步培养所述临床样品和/或部分以使进一步的微生物鉴别和抗微生物剂敏感性试验能够进行,从而鉴别所述微生物并且确定其抗微生物剂耐药性分布。将看到,本发明的方法依赖于建立临床样品的培养物,这最终将使得基于培养物的常规鉴别和敏感性试验能够进行,而同时移出培养物的等分试样(或部分)以使得首先分子试验并且其次快速AST能够进行,这可以有利地消除对于常规试验的需要。因此,所述方法通过进行该分子试验(步骤(e))和任选地还进行步骤(f)的AST的同时培养临床样品而允许分子试验进行的同时保留将同一临床样品用于进一步的常规试验的选择。这可以是单个培养物(例如继续孵育临床样品)或可以建立另外的培养物,例如其可以用来提供用于测试的等分试样同时使第一或初始培养物保持为培养(即继续被培养)。事实上通过在步骤(e)的分子试验期间,并且任选地还在步骤(f)期间继续培养样品或部分,对于另外的(例如常规)试验所需的培养与步骤(e)和(f)的分子试验和AST试验平行地进行而生效。因此,所述方法的步骤(f)在某些实施方案中可以表述为在来自步骤(c)的经过培养的临床样品或部分的另外等分试样上进行抗微生物剂敏感性试验。尽管使用单个培养系统,至少直到这样的当阴性或不确定的结果从分子试验获得时的时间,建立和保持单个初始(即“第一级”)培养物可以提供简单且方便的工作流程,但是在一些情况下可能期望具有灵活性以使用不同的培养系统,这可以通过建立初始第一级培养物的继代培养物(例如第二级培养物)实现。如在以下更详细地解释的,例如,在建立第二级培养物之后,可以将第一级培养物移至不同的培养系统,例如移至常规培养箱,并且第二级培养物可以在用于本发明的分子试验和快速AST试验的专用培养系统(例如仪器)中培养(或更特别地保持或继续)。因此,在一个特别方面,本发明的方法包括:a)将临床样品引入至含有培养基的培养器皿;b)任选地在所述培养器皿中预培养所述临床样品;c)从所述培养器皿移出试验等分试样,并在所述培养器皿中培养或继续培养所述临床样品;d)从所述试验等分试样分离DNA;e)在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述核酸试验使用以下各项进行:i)用于微生物鉴别的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii)用于抗微生物剂耐药性标记物检测的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记物的核苷酸序列;并且检测所述探针和/或引物是否已杂交至所述DNA和/或所述引物是否已被延伸(例如已发生扩增反应);以及f)如果在步骤(e)中鉴别出微生物,则在来自步骤(c)的所述经过培养的临床样品上进行抗微生物剂敏感性试验,其中在所述抗微生物剂敏感性试验中的微生物生长通过评估生长或用于生长的标记物进行监测,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由在步骤(e)中检测出的微生物的身份和抗微生物剂耐药性标记物确定,并且任选地在所述培养器皿中继续培养所述临床样品;或g)如果在步骤(e)中没有鉴别出微生物株,则进一步培养所述临床样品以使进一步的微生物鉴别和抗微生物剂敏感性试验能够进行,从而鉴别所述微生物并且确定其抗微生物剂耐药性分布。如上所述,在一个另外的方面,可以从临床样品建立另外的培养物。在一个这样的实施方案中,临床样品可以被引入到含有培养基的第一培养器皿,并且立即地或在任选的预培养期之后,可以移出第一培养器皿的内容物的部分(即第一培养器皿中的临床样品/培养基混合物或临床样品的培养物的部分)并且用来接种第二培养器皿。如以上提及的和以下进一步解释的,可以提供专用仪器或装置以进行本发明的方法,并且如果期望或需要,其可以与用于进行常规试验的常规培养系统或仪器一起使用(例如来自BectonDickinson或Biomerieux的培养箱)。这样的专用仪器/装置可以设计成接收含有临床样品的第一培养器皿,以及从第一培养器皿移出部分并将其引入到第二培养器皿中。这可以允许含有临床样品和培养基的第一培养器皿(例如血液培养瓶)经由常规方式被放入用于测试的另外的培养系统(例如孵育器)中,而临床样品/培养基混合物的所述部分或由其获得的临床样品培养物保持在本发明的装置中用于培养(包括任选的预培养)以及AST和ID测试。因此,本发明的方法可以包括:a)将临床样品引入至含有培养基的第一培养器皿;b(i))任选地在所述第一培养器皿中预培养所述临床样品;b(ii))从所述第一培养器皿移出所述临床样品/培养基混合物或者在预培养的情况下所述临床样品培养物的部分,并将所述部分引入至含有培养基的第二培养器皿并且任选地在所述第二培养器皿中预培养所述部分;c)从所述第二培养器皿移出试验等分试样,并在所述第二培养器皿中培养或继续培养所述部分;d)从所述试验等分试样分离DNA;e)在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述核酸试验使用以下各项进行:i)用于微生物鉴别的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii)用于抗微生物剂耐药性标记物检测的一种或多种核酸探针和/或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记物的核苷酸序列;并且检测所述探针和/或引物是否已杂交至所述DNA和/或所述引物是否已被延伸(例如已发生扩增反应);以及f)如果在步骤(e)中鉴别出微生物,则在来自步骤(e)的所述经过培养的部分上进行抗微生物剂敏感性试验,其中在所述抗微生物剂敏感性试验中的微生物生长通过评估生长或用于生长的标记物进行监测,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由在步骤(e)中检测出的微生物的身份和抗微生物剂耐药性标记物确定,并且任选地在所述第二培养器皿中继续培养所述部分,或g)如果在步骤(e)中没有鉴别出微生物株,则进一步培养所述临床样品和/或部分以使进一步的微生物鉴别和抗微生物剂敏感性试验能够进行从而鉴别微生物并且确定其抗微生物剂耐药性分布。事实上,在本发明的任一个实施方案中,另外的ID和/或AST试验,无论是否是常规的,可以在培养的样品或部分上进行,而不论是否在步骤(e)中获得阳性鉴别结果。因此所述方法允许临床样品或部分的培养发生以使得用于另外的鉴别和/或AST试验可以进行,例如简单地提供另外的结果,例如作为备份或确认。在另一个的实施方案中,另外的(例如常规)试验可以进行,无论是否有来自步骤(e)的ID试验和/或步骤(f)的AST试验的阳性结果。在一个优选方面,继续临床样品(即第一培养器皿的临床样品)的培养以使进一步的微生物鉴别和抗微生物剂敏感性试验能够进行。将进一步理解的是,步骤(e)和/或(f)的试验可以重复或进行一次或多次,也就是说等分试样可以从第一或第二培养物移出一次或多次,例如以一定时间间隔,以进行步骤(f)的核酸试验一次或多次(例如两次或更多次,例如2或3次)。任选地,步骤(f)的AST试验也可以进行多于一次,如果这是期望的。如上所述,在培养器皿中的临床样品的培养可以继续,而步骤(f)的AST试验正在进行,并且任选地还在该试验已经进行之后。因此存在重复AST试验或继续培养以允许常规测试的可能性。如从上下文明显的是,在第一或第二培养器皿中的临床样品/培养基混合物或从其移出的部分的等分试样简单地是部分,即培养器皿内容物的部分或成分。所述等分试样可以移出并且直接用于步骤(e)的核酸试验,(即在步骤(d)中从试验等分试样分离DNA之后),或在步骤(f)的AST试验中,或其可以在进行步骤(d)/(e)和/或步骤(f)的试验之前进行一段时间的培养。此外,从第一或第二培养器皿移出的试验等分试样可以分成继代等分试样或等分试样成分,或者继代等分试样或成分可以从其移出,其可以进行测试或进一步培养。移出的试验等分试样或等分试样成分的这种培养可以与培养器皿中的临床样品的培养或继续培养分开或独立地进行。在培养器皿中培养临床样品的步骤或从第一培养器皿移出的部分的步骤,或实际上培养试验等分试样/等分试样成分的步骤,可以以任何方便或所需的方式进行,如在以下更详细地描述的。在这方面,用于例如诊断或微生物检测目的的培养临床样品的培养设备是已知的并且可以使用。不同的培养设备或培养系统可以用于培养器皿(例如第一和第二培养器皿)的单独培养,和/或任何移出的试验等分试样/等分试样成分的单独培养和/或用于在AST试验期间所需的培养。此外,如以上提及的和在以下更详细地描述的,根据本发明还设想提供用于进行如本文中描述的微生物检测和表征方法的设备或装置。这样的装置或系统可以包括用于培养培养器皿的设备或工具。因此所述方法的多个培养步骤,包括第一和/或第二培养器皿的培养/连续培养,任选的在移出试验等分试样(例如第一试验等分试样)之前的第一和/或第二培养器皿的预培养,试验等分试样或等分试样成分的培养,或事实上还有在步骤(f)的AST试验期间的培养可以在相同或不同培养系统或培养设备中进行。培养器皿可以转移至不同培养系统/设备,例如如果有来自步骤(e)的鉴定试验的阴性结果。培养器皿(例如第一和/或第二培养器皿)的表面在被放入培养设备之前(例如在临床样品或部分已被引入培养器皿之后)可以被清洁或净化。因此例如,在一个实施方案中,培养器皿(例如第一培养器皿)可以在一个系统中培养同时正进行任选的预培养,和测试步骤。如果步骤(e)的鉴别试验是阴性的和/或不确定的,或者如果步骤(f)的AST试验是阴性的、不确定的或不完全的,则培养器皿然后可以转移至另外或分开的培养系统,例如以使常规的鉴别试验和/或AST试验能够进行。例如,这样的另外或分开的培养系统可以是常规培养箱,或者另外的自动化微生物测试/检测系统(例如诊断系统)。通过代表性实例的方式,在所述方法的一个实施方案中,将从试验对象收集的临床样品引入到培养器皿(这可以视为第一培养器皿)(步骤(a))。在任何培养发生之前,将试验等分试样移出(步骤(c)),并进行步骤(d)和(e)。在此期间期间,对培养器皿进行培养。如果步骤(e)的鉴别试验得到阳性结果,则从培养器皿移出另外等分试样并进行步骤(f)的AST。如果步骤(e)中的鉴别试验是阴性的,则使含有临床样品的培养器皿进行另外的培养,例如在分开的系统中。在第二实施方案中,所述方法如上所述进行,但是具有在步骤(c)中的移出试验等分试样之前的预培养的步骤。在第三实施方案中,从培养器皿移出试验等分试样(如上的步骤(c)),并且使来自该等分试样的成分进行步骤(d)和(e)(核酸分离和检测)。在此时间期间,使另外等分试样成分或所述试验等分试样的剩余部分进行培养,如同由其移出试验等分试样的培养器皿。分开的等分试样/等分试验成分和培养器皿的这种培养可以在相同或不同系统中发生。如果步骤(e)的鉴别试验得到阳性结果,则使经过培养的另外等分试样成分/剩余等分试样进行步骤(f)的AST。如果步骤(e)中的鉴别试验是阴性的,则使含有临床样品的培养器皿进行另外的培养,例如在分开的系统中。在第四实施方案中,从第一培养器皿(无论是在预培养期之前或之后)移出部分并引入到含有培养基的第二培养器皿中。从第二培养器皿移出试验等分试样(步骤(c),并进行步骤(d)和(e)。在此时间期间,培养第二培养器皿。如果步骤(e)的鉴别试验得到阳性结果,则从第二培养器皿移出另外的等分试样并进行步骤(f)的AST。如果步骤(e)中的鉴别试验是阴性的,则使含有样品等分试样的第二培养器皿进行另外的培养。在另一个实施方案中,第一培养器皿可以另外地或替代地进行另外的培养,例如在分开的系统中。在另一个实施方案中,以上描述的第一、第二、第三和/或第四代表性实施方案可以包括继续培养含有临床样品的培养器皿,而不管在步骤(e)中获得阳性或阴性鉴别结果。以这种方式,可以从样品获得另外的结果。因此将看到,在某些优选实施方案中,在没有临床样品的任何培养的情况下发生分子测试(即步骤(e)的核酸测试)。在如当今实施的许多微生物测试程序中,一旦在微生物培养中已有阳性结果,即一旦已检测到微生物生长(阳性培养试验),则进行鉴别试验(无论是通过常规生物化学试验还是通过分子试验)。因此,例如,经血液或其他样品引入至培养器皿(例如血液培养瓶),并将此进行培养。将培养系统进行设计或选择以指示(什么时候)已出现微生物生长,例如通过包括产生依赖于微生物生长的信号(例如由于pH变化,或底物的转化/消耗,或产生微生物代谢产物等)的指示物质或简单地通过任何手段检测微生物生长。当/如果出现足够的微生物生长从而生成信号/给出可检测的生长时,则这指示在培养/微生物检测方面的“阳性”结果(即在临床样品中存在微生物的生长,尽管在这个阶段还不知晓该微生物的身份是什么)。在此阶段,通常进行鉴别和/或AST试验。微生物生长可能会花费几小时例如6、8、10或12小时以上来进行。本发明具有这样的优势,即不必需等待直至在这样的培养试验中已获得阳性结果,意味着微生物鉴别可以更快速地获得。步骤(b)允许在分子测试之前的任选预培养步骤。这可以持续比对于阳性培养试验所需更短的时间期。因此,在一个代表性实施方案中,步骤(d)和(e)在有阳性培养试验结果之前发生。在另一个实施方案中,步骤(d)和(e)首先在获得阳性培养结果之前(或在获得阳性培养结果所需的时间之前)进行,并且可以在阳性培养结果(或对于阳性结果所需的时间期)之后重复。换句话说,在一个优选实施方案中,在有阳性培养结果之前,或更特别地在对于要获得阳性培养结果所需的时间之前,进行至少一组核酸试验(步骤(e))。在另一个代表性实施方案中,步骤(f)(AST步骤)也可以在培养试验中获得阳性结果或可获得的阳性结果之前进行。然而,根据本发明的方法不排除在阳性培养结果之后进行测试步骤(e)和(f),例如从而在阳性试验结果之后在步骤(c)中移出试验等分试样。在这样的情况下,可以看到预培养步骤(b)可以涉及培养培养器皿直至获得阳性培养试验结果或者直至诸如将预期阳性培养试验结果的时间。关于步骤(e)的核酸试验,在一个优选实施方案中,使用第一组核酸探针,其特异性地杂交至作为微生物的认同式的核酸序列,和第二组探针,其特异性地杂交至代表遗传抗微生物剂耐药性标记物的核苷酸序列。在这样的实施方案中,可以涉及探针杂交的检测,或者可以通过探针扩增发生。因此探针杂交的检测可以通过检测探针扩增进行。因此,本发明的方法可以在步骤(e)中包括使用用于探针的一种或多种扩增引物,其是设计或选择用于已杂交至其靶核苷酸序列的探针的扩增引物。如在以下更详细地描述的,在某些优选实施方案中,如果探针已杂交至其靶核苷酸序列,则可以将其设计成被连接,例如设计用来使探针环化的连接反应。因此探针连接是存在靶序列的指示。连接的(例如环化的)探针可以通过连接的探针的扩增,例如通过使用该连接的探针作为模板产生扩增产物(例如,环化的探针可以是用于RCA反应的模板)检测,并且扩增产物可以直接地检测或通过使用杂交至该扩增产物的检测探针检测。如以下进一步描述的,步骤(f)的AST试验可以以任何方便或所需的方式进行。因此,微生物生长可以在不同抗微生物剂(例如抗生素)和/或量或浓度的抗微生物剂(例如抗生素)存在下进行评估(或确定)。生长可以直接进行评估或者通过评估(确定)标记物生长进行评估。因此,微生物生长可以通过确定样品中存在的微生物细胞物质(即微生物生物质)的量,特别地通过对此直接评估或确定而进行评估。在一个优选实施方案中,这通过肉眼地,并且尤其通过成像确定微生物生物质的量而实现。特别地,可以获得2-D图像并进行评估。因此在一个优选实施方案中,可以确定微生物生物质的面积(更特别地,例如在一个图像中,在所考察的视野中微生物生物质的面积)。微生物生长可以通过确定样品中存在的微生物细胞物质(即微生物生物质)的量(这里,具体地,在设置用于AST试验的试验微生物培养中),特别地通过对此直接评估或确定而进行评估。在一个优选实施方案中,这通过肉眼地,并且尤其通过成像确定微生物生物质的量实现。特别地,可以获得与光轴垂直地对齐(这里称为xy-对齐)的2-D图像并进行评估。试样的特定面积在单个xy-对齐图像中覆盖,其尺寸依赖于成像设备的光学性能。对于xy-空间的每个位置,沿着光轴或z轴以不同间隔可以收集一个或多个2D图像。因此,可以产生一系列或一堆2D图像,提供样品体积的3D信息。从样品提取3D信息的备选方法是由Unisensor采用的方法(参见例如US8780181),其中光轴相对于xy-平面倾斜,并且样品或检测器沿着x或y平面移动。这里,除了xy空间之外,还获取具有延伸入z空间的一系列图像。通过图像数据的随后转换,利用此方法还可以获得与xy平面垂直地对齐的2D图像栈。在提取后,在2D图像栈中固有的3D信息可以用来评估/推断/推导在所分析体积中存在的总细胞质量。在一个优选实施方案中,通过例如z-栈投影成一个2-D图像,2-D图像可以由3-D信息生成。然后可以使用所得的2-D图像进行分析。然后微生物生物质的面积可以作为指示所考察的视野中,例如在投影的2D图像中,的微生物生物质的光学密度的面积来确定。这样的方法在本领域是常例并且可以增加灵敏度,并且用于亮场图像的用于此的算法可以在公众可得软件来自MIT,USA的Cellprofiler中找到。类似的分析可以对于荧光图像进行,并且存在用于此的许多备选算法,例如在Cellprofiler中,以及在大多数商用图像分析系统中。在另一个实施方案中,登记在伸展横跨xy空间中的每个位置的z空间中的强度变化,指示特定位置中的微生物质量。在整个xy空间上积分,这得到总微生物体积的量度。用于此程序的算法还存在于平常可用的图像分析软件,例如在免费软件Cellprofiler中。更通常地,微生物生长可以通过确定微生物和/或微生物集落或聚集体的量和/或数目和/或大小进行评估。如将在以下更详细地讨论的,在某些优选实施方案中,微生物生长通过成像评估(确定),或可选地通过使微生物可视化表达。因此,微生物细胞,其可以包括细胞的聚集体或丛(簇),或微生物集落,可以可视化或成像作为确定(或评估或监测)生长的手段。这可以包括计数细胞或集落,但不限于这样的方法并且包括肉眼地评估微生物生长的量的任何手段,通过评估(或确定)微生物细胞、集落或聚集体的大小、面积、形状、形态和/或数目(术语“聚集体”包括物理近似的细胞的任何集合,例如丛或簇;这可以包括细胞的非克隆丛/簇,其已聚集或粘在一起(例如已变得聚集的相邻细胞)以及克隆集落)。用于测量微生物生长的参数可以但不需要根据微生物的身份(在步骤(e)中确定)和步骤(f)中使用的抗微生物剂变化。实际上,取决于使用的有机体和抗微生物剂,细胞的形态或生长模式可能受影响,并且这可以从“正常”或“典型”形态或生长模式改变或变化,例如在没有抗微生物剂的情况下。尽管一些AST生长监测方法可以依赖于检测这样的变化,但是根据本发明不是必须考虑这样的变化并且微生物生长或生物质的量(例如面积)可以与形态和/或生长模式无关地确定。因此可以使用同样的生长监测方法,而不管所使用的微生物细胞和/或抗微生物剂。用于进行AST试验的方法在以下进一步描述。有利地,在步骤(e)中的阳性结果之后,临床样品(例如试验等分试样)可以直接用于AST试验。临床样品/部分/试验等分试样/等分试样成分等将会在已进行步骤(d)和步骤(e)的时间期间进行了培养,并且在步骤(f)之前不需要进行任何进一步的继代培养。实际上,在有利的实施方案中,没有进一步的继代培养步骤。特别地,没有在另外的培养基或培养器皿中的继代培养步骤。更特别地,没有继代培养的步骤以在AST之前获得微生物的纯培养物。这意味着可以进行更快速的AST试验。有利地,进行快速AST试验。因此,在一个优选实施方案中,步骤(f)的AST试验可以在8、7或6小时以下,例如在4或5小时以下给出结果。在AST试验中微生物生长的监测或评估可以通过在一段时间期(多至6、5、6、7或8小时)内连续地或以时间间隔监测生长或通过比较在AST生长培养启动时的生长与在后一个时间点(例如,在多至4、5、6、7或8小时)的生长,或实际上比较在两个以上不同时间点的生长而进行。在优选实施方案中,微生物生长在多于一个时间点,即在至少两个时间点确定。本发明的方法可以用于检测和表征任何微生物。一般来讲,关注临床相关微生物。如本文中使用的,术语微生物涵盖可以落在“微生物”类别的任何微生物。尽管不是必需如此,但是微生物可以是单细胞的,或者可以具有单细胞生命阶段。微生物可以是原核的或真核的,并且通常将包括细菌、古生菌、真菌、藻类和原生生物,主要包括原生动物。特别感兴趣的是细菌,其可以是革兰氏阳性或革兰氏阴性的或革烂氏不确定的货革兰氏非响应性的,以及真菌。特别地,临床相关的细菌属包括葡萄球菌属(Staphylococcu)(包括凝固酶阴性葡萄球菌属Staphylococcus)、梭菌属(Clostridium)、埃希氏菌属(Escherichia)、沙门氏菌(Salmonella)、假单胞菌属(Pseudomonas)、丙酸杆菌属(Propionibacterium)、芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、军团杆菌属(Legionella)、分枝杆菌属(Mycobacterium)、微球菌属(Micrococcus)、梭杆菌属(Fusobacterium)、莫拉氏菌属(Moraxella)、变形菌属(Proteus)、埃希氏菌属(Escherichia)、克雷伯菌属(Klebsiella)、不动杆菌属(Acinetobacter)、伯克氏菌属(Burkholderia)、肠球菌属(Entercoccus)、肠杆菌属(Enterobacter)、枸橼酸杆菌(Citrobacter)、嗜血杆菌属(Haemophilus)、奈瑟氏菌属(Neisseria)、沙雷氏菌属(Serratia)、链球菌属(Streptococcus)(包括α-溶血性链球菌和β-溶血性链球菌)、变形细菌属(Bacteriodes)、耶尔森氏菌属(Yersinia)和螺菌属(Stenotrophomas),并且实际上任何其他肠道菌或大肠型细菌。β-溶血性链球菌将包括A组、B组、C组、D组、E组、F组、G组和H组链球菌。革兰氏阳性菌的非限制性实例包括金黄色葡萄球菌(Staphylococcusaureus)、溶血性葡萄球菌(Staphylococcushaemolyticus)、表皮葡萄球菌(Staphylococcusepidermidis)、腐生性葡萄球菌(Staphylococcussaprophyticus)、里昂葡萄球菌(Staphylococcuslugdunensis)、schleiferei葡萄球菌(Staphylococcusschleiferei)、山羊葡萄球菌(Staphylococcuscaprae)、肺炎葡萄球菌(Staphylococcuspneumoniae)、无乳葡萄球菌(Staphylococcusagalactiae)、酿脓葡萄球菌(Staphylococcuspyogenes)、唾液葡萄球菌(Staphylococcussalivarius)、血液葡萄球菌(Staphylococcussanguinis)、咽峡炎链球菌(Staphylococcusanginosus)、肺炎葡萄球菌(Streptococcuspneumoniae)、酿脓葡萄球菌(Streptococcuspyogenes)、缓症链球菌(Streptococcusmitis)、无乳链球菌(Streptococcusagalactiae)、咽峡炎链球菌(Streptococcusanginosus)、马肠链球菌(Streptococcusequinus)、牛链球菌(Streptococcusbovis)、产气荚膜梭状芽胞杆菌(Clostridiumperfringens)、粪肠球菌(Enterococcusfaecalis)和屎肠球菌(Enterococcusfaecium)。革兰氏阴性菌的非限制性实例包括大肠埃希氏菌(Escherichiacoli)、邦戈尔沙门菌(Salmonellabongori)、肠道沙门氏菌(Salmonellaenterica)、克氏柠檬酸杆菌(Citrobacterkoseri)、弗氏柠檬酸菌(Citrobacterfreundii)、肺炎克雷伯氏菌(Klebsiellapneumoniae)、奥克西托克雷白杆菌(Klebsiellaoxytoca)、绿脓假单胞菌(Pseudomonasaeruginosa)、流感嗜血杆菌(Haemophilusinfluenzae)、脑膜炎奈瑟氏菌(Neisseriameningitidis)、阴沟肠杆菌(Enterobactercloacae)、产气肠杆菌(Enterobacteraerogenes)、粘质沙雷氏菌(Serratiamarcescens)、嗜麦芽窄食单胞菌(Stenotrophomonasmaltophilia)、摩氏摩根氏菌(Morganellamorganii)、脆弱类杆菌(Bacteriodesfragilis)、鲍氏不动杆菌(Acinetobacterbaumannii)和奇异变形杆菌(Proteusmirabilis)。临床相关真菌可以包括酵母,特别是念珠菌属(Candida),以及以下属的真菌:曲霉属(Aspergillus)、镰刀霉(Fusarium)、青霉属(Penicilium)、肺囊虫(Pneumocystis)、隐球菌属(Cryptococcus)、球孢子菌属(Coccidiodes)、马拉色菌属(Malassezia)、毛孢子菌属(Trichosporon)、枝顶孢属(Acremonium)、根霉属(Rhizopus)、毛霉属(Mucor)和犁头霉属(Absidia)。特别感兴趣的是念珠菌属(Candida)和曲霉属(Aspergillus)。真菌的非限制性实例包括烟曲霉(Aspergillusfumigatus)、白念珠菌(Candidaalbicans)、热带念珠菌(Candidatropicalis)、光滑念珠菌(Candidaglabrata)、Candidadubliensis、近平滑念珠菌(Candidaparapsilosis)和克鲁斯氏念珠菌(Candidakrusei)。术语“检测”广义地是指确定微生物存在或不存在的任何手段。因此“检测”可以包括以任何方式或形式确定、评估或测量微生物是否存在-其可以包括定性、定量或半定量确定。术语“表征”广义地意指确定关于微生物的性质和/或性能的信息的任何手段,并且特别地包括鉴别微生物。更特别地微生物可以依据至少其属,并且优选地其种被鉴别。在一些情况下甚至在株水平的鉴别可以是可能。本发明的方法还允许微生物依据确定它对于给出的抗微生物剂是否是敏感的或预期是敏感的、或它是否对任何抗微生物剂表现出耐药性或预期是耐药性的(例如确定其抗微生物剂敏感性分布)进行表征。这可以通过测试分子耐药性标记物(即与一种或多种抗微生物剂或多类抗微生物剂的耐药性相关或其指示的遗传变体或特定遗传序列)的存在进行。这样的分子试验当然确凿地确定该微生物是敏感的并且这通过步骤(f)的AST试验进行,其中直接测试抗微生物剂对微生物生长的作用。术语“裂解”意指细胞的破裂。特别地,使细胞破裂以释放细胞内容物,特别地包括核酸。这可以通过任何手段实现,如本领域已知的大量手段,例如通过损害其整体性导致细胞组分的部分或全部释放到周围溶液中的病毒、酶、机械、电、化学、热、冷或渗透机制。临床样品可以是可以从试验对象获得的任何临床样品,试验对象通常将是人患者但可以是任何人或动物(通常是哺乳动物)受试者。因此它可以是身体组织、细胞或流体的任何样品,或来源于身体的任何样品例如拭子、清洗液、吸出物或漂洗液等。合适的临床样品包括但不限于血液、血清、血浆、血液成分、关节液、尿液、精液、唾液、粪便、脑脊髓液、胃内容物、阴道分泌物、粘液、组织活检样品、组织匀浆、骨髓穿刺液、骨匀浆、痰、吸出物、伤口渗出液、拭子或拭子漂洗液例如鼻咽拭子、其它体液等。在一个优选实施方案中,临床样品是血液样品或血液来源样品,例如血清或血浆或血液成分。微生物可以是任何微生物,特别地任何致病微生物或引起身体中的感染的任何微生物,并且因此所述方法可以用于检测或诊断在试验受试者的身体的任何部分之中或之上的微生物感染(即任何微生物感染)的情形并且临床样品的性质可以相应地确定,例如根据感染或疑似感染的症状呈现,或受试者的总体临床状况。尽管涵盖了任何微生物感染,但是本发明的方法特别可用于检测或诊断脓毒症,或其中怀疑有脓毒症的情形。因此临床样品可以来自患有或怀疑患有脓毒症或处于脓毒症风险的受试者。在这样的情况下,样品通常是血液或血液来源的样品。典型地,样品将是血液。在所述方法的第一步(步骤(a))中,将样品引入至包含培养基的培养器皿。这是可以根据本领域熟知的标准程序实施且在文献中广泛描述的标准步骤。培养器皿可以包括适用于微生物细胞培养的任何器皿或容器,例如盘、孔、试管、小瓶、烧瓶等。方便地,在样品是血液或血液来源样品的情况下,培养器皿是血液培养瓶,例如BacT/ALERT(Biomerieux)血液培养瓶、Bactec血液培养瓶(BectonDickinson)或VersaTrek血液培养瓶(ThermoFisher),或实际上已知的用于血液取样,特别用于培养以检测微生物的目的的任何试管、烧瓶或小瓶。方便地,培养器皿可以提供有已容纳在其中的培养基。然而,培养基可以单独地提供并在已添加临床样品之前、同时或之后引入到培养器皿中。培养基可以是任何合适培养基并且可以根据临床样品和/或怀疑微生物的性质、和/或受试者的临床状况等选择。适用于这样的用途的许多不同微生物培养基是已知的。典型地培养基可以含有足够的营养成分以促进微生物的快速生长,如在本领域已知的。在许多情况下,恰当培养基是包含介质如胰蛋白胨大豆肉汤、Columbia肉汤、脑心浸剂肉汤、Brucella肉汤以及本领域已知的通用目的的生长培养基的复合生长培养基,并且可以包括添加特定生长因子或补充物。培养基可以已多种形式得到,包括液体、固体和悬浮液等,并且可以使用这些之中的任一种,但方便地所述培养基将是液体培养基。在培养器皿已准备使用血液培养瓶的情况下,如上所述,这些器皿可以含有尤其改性的规定培养基以允许宽范围的微生物生长。典型地由制造商在血液培养瓶中提供的培养基将含有中和在取自试验受试者的临床样品中存在的任何抗生素的存在的试剂或添加剂。可以使用含有或不含有这样的中和剂的烧瓶,并且如果期望,中和剂可以添加至培养器皿。如上所述,用于步骤(e)的鉴别试验的第一试验等分试样可以在样品与培养器皿中的培养基接触之后立即或基本上立即移出,无论来自第一或第二培养器皿(例如在混合样品和培养基之后)。这可以例如在将样品引入至培养器皿的10、15、20或30分钟内,或者可以更长,例如在1、2或3小时内,这取决于临床情形。步骤(b)是任选的在培养器皿中预培养临床样品(或被引入第二培养器皿中的来自第一培养器皿的部分)的步骤,其在发生分子测试之前允许样品中存在的任何微生物生长(即成倍地)。这是否进行可以取决于样品的性质、怀疑的感染、受试者的临床状态等。例如,在尿液样品的情况下,预期大量的微生物细胞存在于样品中并且因此可能不需要预培养步骤,然而,在例如血液样品的情况下,细胞的数目通常预期较少并且预培养步骤可能有利于增加可用于分子测试的微生物细胞的数目,或者有利于回收微生物DNA等。这也可以取决于用于微生物鉴别和耐药性标记物检测的分子试验(即探针)的性质以及核酸试验的灵敏性和/或特异性。预培养通常涉及在有益于或适合于微生物生长的条件下孵育培养器皿,例如在特定温度(例如,在20至40℃或25至40℃的温度,例如25至37℃或30至35℃)。取决于器皿的性质、培养基、怀疑的微生物、临床状况等,器皿可以搅拌或旋转、摇晃等。预培养可以发生持续任何合适或所需时间期,但为了使方法加速,将优选持续少于8小时或少于6小时的时间期。例如,在开始测试之前,或更特别地在步骤(c)中的移出试验等分试样之前,预培养可以发生持续多至1、2、3、4、5或6小时。可选地,预培养可以发生持续少于1小时。预培养也可以发生持续多于6小时,例如持续7、8或9小时,或多于9小时,例如多至10或12小时,或甚至更长,但为了提供快速方法,通常将其保持为最小,并且优选多至6小时或更特别地多至4或3小时的短预培养期。如上所述,预培养可以发生持续比看到阳性培养结果所需更短的时间期,或者它可以发生直至获得阳性培养结果。在步骤(c)中的试验等分试样的移出可以通过任何方便手段发生,取决于培养器皿的性质和其如何被孵育。例如,在血液培养瓶的情况下,等分试样可以简单地使用针头和注射器取出。根据正常临床和微生物学实践,可以采取多个步骤以避免或限制污染,例如这可以在无菌条件下进行。例如,可以对培养器皿如血液培养瓶的隔膜进行清洁或去污染,优选地在取出等分试样之前和/或取出等分试样之后。在一个方便的实施方案中,用于移出试验等分试样的手段例如,针头,和任选地注射器)可以以一次使用形式提供,即作为消耗品。换句话说,其可以是可抛弃的并且不再次使用。在继续培养的同时移出试验等分试样的步骤(c)可以进行多于一次。实际上,对于进行步骤(e)的分子试验和步骤(f)的AST试验,通常将取两个分开的等分试样,并且在每种情况下继续培养。然而,如以上提及的,提取用于进行分子试验的等分试样的部分可以保留并培养。此部分可以用于重复的分子试验(例如在第二时间点)和/或可以用于AST试验。然而,也可以提取用于重复分子试验的分开的等分试样,例如以隔开的时间间隔。因此分子试验(步骤(e))可以进行多于一次。在一个这样的实施方案中,等分试样可以在步骤(a)之后直接移出用于在预培养步骤(b)之前要进行的初始分子试验。如果初始分子试验是阴性的或不是充分确定性的,例如,在预培养期之后可以移出第二等分试样以实施第二分子试验。因此,在一个实施方案中,本发明的方法可以包括以下步骤:i)将临床样品引入至含有培养基的培养器皿;ii)从所述培养器皿移出试验等分试样,iii)从所述试验等分试样分离DNA并如以上步骤(e)中所述进行核酸试验;iv)在步骤(iii)正进行的同时,培养所述培养器皿中的所述临床样品;v)从所述培养器皿移出另外的试验等分试样,并继续培养在所述培养器皿中的所述临床样品;vi)从所述另外的试验等分试样分离DNA并如以上步骤(e)中所述进行核酸试验;如果此第二(或任何另外的)分子试验是阴性的,则所述方法可以进行至步骤(g)。因此,培养器皿的培养可以继续以允许进一步的试验可以进行。为了使步骤(e)的分子核酸试验能够进行,将DNA从移出的等分试样或等分试样成分分离(在步骤(d)中)。当然将理解的是,需要微生物DNA用于分子试验并且取决于临床样品的性质,可以有相当大量的来自试验受试者的细胞存在,这可能在分离或后续测试中变复杂或形成干扰。更特别地,在临床样品中在试验受试者的细胞中存在的非微生物DNA例如人DNA可能使得微生物DNA的检测和测试困难,特别是在其中存在比微生物细胞多得多的血液细胞(特别白血细胞)的样品如血液的情况下。因此,可能期望从试验等分试样选择性地分离或富集微生物DNA。实际上,所述方法可以任选地包括在试验等分试样中或从试验等分试样分离或富集微生物或微生物细胞的步骤,例如在分离DNA或分离微生物DNA的步骤之前或同时。用于富集样品中的微生物的合适方法可以包括裂解在等分试样中存在的任何非微生物细胞,或从等分试样选择性地移出微生物细胞(即从等分试样主动或被动选择微生物细胞)。用于进行此的方法在本领域是已知的。用于选择性地裂解非微生物细胞以选择性地富集样品中的微生物的方法,其不依赖于知晓微生物的身份,例如描述于US2013/0171615、US2012/0231446、US2010/0184210、US7893251和US8481265,并且用于从样品选择性地移出真核细胞的方法描述于US2005/0202487。用于分离DNA的方法在本领域是已知的,并且可以使用已知且描述的多种不同方法中的任一种。一般来讲,这些涉及裂解细胞,其可以通过多种手段和方式进行,和回收释放的DNA,同样用于此的多种手段和程序是已知的和可得的,并且可以使用这些之中的任一种。裂解步骤可以取决于怀疑的微生物的性质,尽管通常许多程序可以裂解微生物。如以上提及的,取决于样品的性质,优选地此步骤涉及分离微生物DNA,更特别地选择性地分离或富集微生物DNA。这通常可以通过选择性地裂解样品中的试验受试者细胞,同时保持微生物细胞完整而进行。许多程序,并且实际上试剂盒是已知的和可得的,其可以实现此,例如来自Molzym(德国)。例如,在没有裂解等分试样中存在的微生物细胞的情况下,人细胞,例如人血细胞可以容易地被裂解。这同样适用于可能存在的其它人或哺乳动物细胞,取决于样品。在血液或血液来源样品的情况下,优选分离并且特别地选择性分离微生物DNA。因此,来源于待试验受试者且试验等分试样中存在的临床样品中的任何细胞可以使用不裂解微生物细胞的裂解条件进行裂解。例如,恰当裂解试剂,例如裂解缓冲液,可以添加至试验等分试样。在此第一裂解步骤中释放的DNA,或更通常是核酸,例如通过降解(例如DNA-降解酶,例如DNA酶)和/或通过可以从样品分离或移出DNA或核酸和/或分离任何未裂解的微生物细胞的任何方法,例如诸如过滤、柱分离、沉淀、离心等的分离方法可以移出,尽管在一个实施方案中,所述方法的优选特征在于它不包括离心。因此,在一个实施方案中,DNA分离的步骤不包括离心,并且实际上在另一个优先实施方案中,所述方法作为整体不包括离心。在这些步骤中使用的任何酶、特别地任何DNA-降解酶可以被失活或移出,例如通过加热或通过添加另外的蛋白降解酶。接下来,保留在或来自处理后的等分试样(例如来自第一裂解步骤的裂解产物)的微生物细胞接着通过引入裂解条件进行裂解,例如添加用于裂解微生物细胞的恰当裂解试剂(裂解缓冲液)。许多这样的缓冲液在本领域是已知的和/或商购可得,例如来自Molzym(德国)。然后可以回收在第二微生物裂解步骤中释放的微生物DNA,例如从反应混合物(裂解产物)分离。如上,用于此的许多技术可得并且可以使用这些中的任一种。在一个优选实施方案中,此步骤不包括离心。然后使回收的DNA或回收的微生物DNA进行步骤(e)的分子试验。在进行步骤(e)的的分子核酸试验之前,可能期望使从试验等分试样分离或富集的双链DNA,特别地微生物DNA变性。此外,可能有利或期望(但不必需)的是在进行步骤(e)的分子试验之前使DNA片段化。这样的步骤可以通过本领域已知的常规方法实现,例如片段化可以通过热或通过酶降解方法,例如使用限制性或其它核酸内切酶机械地实现。基本地,分子试验使用核酸探针或引物,其被设计成杂交至特定微生物核酸序列或能够选择性地扩增特定微生物序列,并且基于它们是否杂交或延伸(例如成功地启动扩增反应),其可以用来检测是否存在特定微生物以及它是否含有遗传抗微生物剂耐药性标记物。这样的核酸试验,以及用于它们的杂交探针或引物在本领域是已知的并且描述于文献。杂交探针将包含能够杂交至所需或所选靶序列,优选地特异性地杂交的核苷酸序列。因此,它可以包含与靶序列互补的序列。不要求绝对或100%互补性,只要所述探针在非靶核苷酸序列存在下能够特异性地杂交至靶序列。通过检测杂交,可以检测是否存在靶序列,并且使用用于检测核酸探针的杂交的不同模式的许多杂交测定形式是已知的并且可以使用。一般来讲,步骤(e)的检测可以通过检测杂交探针发生。如以上讨论的,杂交探针的检测可以包括或涉及扩增该杂交探针。因此,除了杂交探针,可以提供一种或多种用于该杂交探针的扩增引物。在本发明的情况下,靶序列首先(在步骤(e)(i))是微生物的核苷酸序列认同式,即是特定微生物的特性,例如属、种或株的特性并且可以用作用于鉴别该微生物的基础的核苷酸序列。因此,认同式核苷酸序列可以相应地被视为给定特定微生物的基序或标签,或序列特性。典型地它可以是对于该微生物是独特的(在属、种或株水平)的序列。大量这样的认同式序列已被鉴别和报道,并且可以使用这些中的任一个。例如,靶序列可以是来自16srRNA基因的核酸序列。可选地将是常规事情的是鉴别这样的基序/标签/认同式序列,例如使用生物信息工具来分析微生物基因组序列,以及基于这些设计恰当杂交探针,包含能够杂交至所鉴别序列的序列。可选地,不是使用杂交探针,可以使用一种或多种引物,并且可以使用基于引物的方法,例如基于聚合酶引物延伸的方法,来检测和鉴别微生物。典型地,这将是扩增方法,最常见地PCR,但可以使用其它扩增方法或引物延伸方法,包括例如LCR、NASBA、MDA等。引物或引物组可以杂交至认同式核苷酸序列,或它(它们)可以以使得认同式序列可以被扩增的方式(例如使其连接(flank))进行杂交。术语“扩增的”在此上下文(也参见以上)中广义地用来意指提供认同式或标记物序列的拷贝(包括互补拷贝)的任何方法,并且包括简单引物延伸反应,和线性以及指数扩增。对于PCR,引物对将用于各个微生物认同式序列。更简单地说,用于本发明的杂交探针或引物可以对于以下各项是特异性的:(i)作为微生物的认同式的核苷酸序列或(ii)代表遗传抗微生物剂耐药性标记物的核苷酸序列。因此,可选地定义的,在如上提出的本发明的方法中,步骤(e)可以表述为以下:e)在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述核酸试验使用以下各项进行:i)用于微生物鉴别的一种或多种核酸探针和/或引物,各个所述探针和/或引物对于作为给定微生物的认同式的核苷酸序列是特异性的;和ii)用于抗微生物剂耐药性标记物检测的一种或多种核酸探针和/或引物,各个所述探针和/或引物对于代表遗传抗微生物剂耐药性标记物的核苷酸序列是特异性的;并且检测所述探针或引物是否已杂交至所述DNA和/或所述引物是否已延伸(例如已发生扩增反应)。如上所述,检测步骤可以包括或涉及在探针已杂交至其靶核苷酸序列之后使其扩增。如在以下更详细描述的,扩增可以设计成依赖于杂交。因此,可以仅扩增已杂交的探针。以这种方式,可以组装和/或构建杂交探针或引物组或群组,其能够杂交至或扩增所选微生物的核酸,并由此检测该微生物是否存在于试验等分试样(并由此样品)中。通过检测存在哪一种微生物(即哪一种鉴别探针杂交或哪一种引物/引物组被延伸或启动扩增反应),可以鉴别在样品中存在哪一种微生物。通过举例的方式,用于微生物鉴别的杂交探针或引物可以包含各自能够特异性地鉴别所选微生物组(例如主要或最常见的已知脓毒症病原体)中的探针或引物。例如以上提供的具体细菌和真菌物种的列表代表大约95%的最常见脓毒症病原体,并且可以构成根据本发明的代表性微生物群组。因此,在步骤(e)(i)中,鉴别探针和/或引物(或引物组)的多样性将有利地被使用。多样性在本文中广义地定义为两倍以上,或更特别地,3、4、5、6、7、8、9、10、15、20、30、40、50、60、70、80、100、200、300、400或500倍以上。以及用于鉴别的多种不同微生物,可以使用不同的探针或引物/引物组用于要检测的给定微生物,例如2、3、4或5种探针或引物或更多/靶标微生物。由于微生物群组可以包括至少10、15、20、25、30、40、50种以上(例如多至60、70、80、90或100种微生物),所以典型地将使用至少30个以上的群组或组,例如50、70、80、100、200、300、400或500个以上的鉴别探针或引物(或引物组)。根据本领域已知的程序,基于探针或引物的核酸试验可以使用多倍的成千或许多的几十个或几千个探针或引物,并且这样的程序由本发明涵盖。其次,在所述方法的步骤(e)(ii)中,用于杂交探针或引物的靶序列是作为抗微生物剂耐药性标记物的核苷酸序列。在现有技术中已经鉴别和报道了大量这样的标记物,并且已经设计了用于检测它们的杂交探针/引物。可以使用这些中的任一个或者可选地可以基于这样的被鉴别出的标记物序列设计另外的探针或引物。此外,另外的标记物序列可以通过常规筛选方法鉴别。抗微生物剂耐药性标记物可以是编码耐药性机制的组分例如酶或修饰蛋白的核苷酸序列,或者它可以简单地是已被鉴别出与对于抗微生物剂的耐药性相关的核苷酸序列或序列变体。通过举例的方式,β-内酰胺酶代表针对用于细菌的抗生素的耐药性的重要机制并且负责对于某些抗生素类的耐药性。出现能够形成扩展谱β-内酰胺酶的细菌(ESBL-形成菌)。ESBL代表快速发展耐药性问题的近期实例。已报道了能够鉴别高度多样的β-内酰胺酶的探针(Barisic等人,2013,DiagnosticMicrobiology&InfectiousDisease,77(2),118-125)。其它已知的遗传性耐药性标记物包括mecA、mecC、vanA、vanB、CTX-M、KPC、VIM、NDM和OXA-48。环丙沙星耐药性突变已经例如在耐抗生素的图莱里杆菌(F.tularensis)、炭疽芽孢杆菌(B.anthracis)和鼠疫耶氏菌(Y.pestis)中鉴别出来,并且是可得的。杂交探针可以采取多种形式,并且以其最简单的包括能够杂交至靶序列的核苷酸序列和通过它们可以直接或间接检测的另外的序列或部分。因此,这样的探针可以具有直接或间接可检测的标记,例如用分光光度法(例如荧光地)可检测标记,或可以参与给出信号或产生信号的反应的报告分子或部分,例如酶或酶底物或辅因子,或者其可以是亲和性标签,通过该标签探针可以被选择性地标记或在杂交反应之后被选择性地分离或分开。不同形式的标记或被标记的核酸探针是广泛已知的和报道的,例如分子信标和其它基于FRET的探针。然而,不是借助于在探针之中或之上提供的标记或报告子部分来直接检测杂交的探针的存在,可以间接地检测所述探针,例如通过检测该探针的扩增产物。不同的杂交探针形式是已知的并且可以使用这些之中的任一种,例如分子倒置探针、蝎形探针和扣锁探针。分子倒置探针和扣锁探针例如被设计成在杂交至它们的靶序列后通过连接被环化,并且所得的环化探针可以通过扩增例如通过RCA检测。扣锁探针代表根据本发明的优选类型的杂交探针。扣锁探针最初描述于1994(Nilsson等人,1994,Science,265,2085-2088)并且自那时起已被开发和广泛用于检测多种核苷酸序列,并且实际上更广泛地用作宽范围分子的测定中的报告子(参见例如EP0745140、EP0964704、EP0951565和Hardenbol等人2003.Nat.Biotechnol.21,673-678)。扣锁探针在其5’和3’末端包含可以杂交至靶核苷酸序列的序列。在一个实施方案中,扣锁探针的5’和3’末端可以杂交至所述核苷酸序列以使得它们彼此直接相邻。在另一个实施方案中,扣锁探针的5’和3’末端可以杂交至所述核苷酸序列以使得它们彼此不是直接相邻并且介于其间的间隙可以通过被杂交的3’末端的聚合酶延伸或通过间隙填充寡核苷酸而被填充。然后将所述末端连接在一起以形成可以随后方便地通过基于滚环扩增(RCA)的方法进行检测的核酸环。双重识别(两个靶杂交区)以及对于连接的要求意味着扣锁探针是高度特异性的并且良好适于检测在复杂基因组背景中的独特序列。单分子环化方法和环化的探针的基于RCA的检测都将它们自己良好地适应于多重检测,并且大量的探针可以组合使用并且在没有干扰问题的情况下一起扩增。然而,尽管RCA是优选的用于检测环化的扣锁探针的方法,但是本发明不限于此并且可以使用其它扩增方法,包括例如PCR,或其它检测方法,例如基于选择性地检测与线性相对的环形核酸。适用于RCA的链置换聚合酶是已知的,例如Φ-29聚合酶。环化的扣锁探针通过RCA的扩增导致形成多联RCA产物,其包含扣锁探针序列的互补序列的几百个重复。在本发明的一个实施方案中,RCA产物可以通过荧光标记的检测寡核苷酸的杂交进行检测。由于RCA反应是线性的,并且因此具有慢的扩增能力,所以已经开发了大量方法,其可以增强扩增并增大来自RCA反应的信号,包括例如高度支化的RCA方法,如由Lizardi描述的(US6,183,960和US6,143,495)。可以使用这些中的任一种。RCA产物也可以通过PCR进一步扩增,或者实际上可以使用核酸扩增的任何其它方法或任何信号扩增方法。用于增强RCA扩增的特别有用的方法是环至环扩增(C2CA)。这描述于Dahl等人,2004,PNASUSA,101,4548-4553和WO03/012199。C2CA涉及将来自第一RCA反应的多联滚环扩增产物(RCP)裂解成单体(例如各自对应于多联体的串联重复,即环化的扣锁探针的互补拷贝),然后使单体再环化,各自进入可以在进一步的RCA反应(即另一轮的RCA)中用作模板的另外的环中。这可以重复一次或多次。重复RCA导致信号的放大。RCP的裂解可以通过将寡核苷酸杂交至在RCA产物的各个重复(单体)中存在的序列(限制性位点序列)以形成双链限制性裂解或识别位点并用限制性酶裂解以将产物裂解成单体而实现。相同的寡核苷酸,例如以过量添加的,可以用作用于通过裂解释放的单体的环化的连接模板。在裂解以释放单链单体之后可以包括变性步骤,其可用于杂交至过量的未裂解或添加的寡核苷酸。C2CA反应的更改描述于我们的于2013年11月29日提交的申请号1321123.0的一同待审申请的申请英国专利申请,通过引用结合于此。在此改变的C2CA程序中,第二或任何随后轮的RCA的效率通过以下得到提高:即减小环化单体的尺寸,使得用于第二轮RCA的环形模板相比于第一RCA模板(这里是环化的扣锁探针)在尺寸方面被减小,并由此可以增大第二(和随后的)RCA反应的速度。裂解RCP以使释放的单体在尺寸上被减小或者用于其它方式实现单体尺寸减小的步骤的多种手段描述于该一同待审的申请。通过进行第二RCA反应来放大来自RCA反应的信号的其它方式也已有报道并且可以使用这些中的任一种。一种这样的方法是在WO2014/076209中描述的所谓的OlinkAB的超级RCA(sRCA)方法。在此程序中,进行第二RCA反应,其依赖于第二RCA反应,但是其不扩增第一RCA产物。第二RCA产物保持物理地连接至第一RCA产物,以便来自第二RCA产物的信号被定位至第一RCA产物。通过利用被杂交(直接或间接地)至第一RCA产物以扩增第二RCA模板环的RCA引物,第二RCA产物可以通过延伸所述RCA引物产生,依据引物的杂交,该RCA引物被杂交,并且因此连接至第一RCA产物。由于第一RCA产物是包含用于第一RCA反应的模板环的串联重复互补拷贝的多联体,所以用于第二RCA的RCA引物将结合至其关联引物结合序列的重复拷贝,其在整个第一RCA产物中被重复。换句话说,第一RCA产物将包含用于第二RCA的RCA引物的重复结合位点,一个在串联重复(多联体的"单体")的每一个中。各个这样的引物可以启动第二RCA反应,导致增加的(多于线性的)扩增。RCA或C2CA反应的RCP可以直接检测,如所指出的,例如借助于被标记的检测寡核苷酸,其可以杂交至在RCP中的串联重复中的序列或通过将被标记的核苷酸结合到RCP中,或从RCP释放的单体可以被检测。作为极长的核酸多联体(典型地包含500-1000个模板环序列的拷贝)的RCP分解成DNA的随机卷绕的无定形“团”或球,其可以容易地被检测,并且实际上可视化。因此这样的团可以用显微镜或通过任何其它方便手段成像或检测,从而检测(间接地)扣锁探针与其靶标的杂交(以及它们随后通过RCA/C2CA的连接和检测)。还存在检测RCP的其它手段,例如通过流式细胞仪或通过在固体载体上捕获RCP并借助于被标记的检测寡核苷酸或其它标记手段,例如结合的被标记寡核苷酸或核酸染色或染料等对其进行检测。RCP团的检测提供扩增的单分子检测(ASMD)的方便手段,这样的基于C2CA和计数RCP团以检测细菌和孢子的方法的使用由Goransson等人,2012PLOSone,7(2),e31068描述,并且这样的方法可以根据本发明使用。在RCP团中的标记的浓缩或富集意味着相比于周围溶液,在该团中存在高浓度的标记。这消除了对于洗涤的需要并且使得同源方法能够被使用-反应产物可以在流动池中容易地检测,例如由Jarvius等人,2006,NatureMethods,3,725-727描述。可选地,不是检测RCP多联体本身,RCP可以裂解成单体并且可以检测单体。同样这可以借助于直接结合到单体中的标记或通过将检测寡核苷酸杂交至单体,例如如上所述或根据本领域已知的原理。例如,单体可以结合到微阵列上并且阵列结合(杂交)的单体可以通过被标记的检测寡核苷酸的杂交进行检测。因此,可以提供这样的阵列,其带有(例如通过沉积到其上)能够结合(杂交)至RCP单体的寡核苷酸。阵列寡核苷酸可以设计成与RCP单体互补并且可以经由胺、硫醇或环氧基团或者通过任何已知的偶联化学而共价偶联至阵列底物,或者可以利用已知技术例如光刻法在阵列上原位合成它们。这样的阵列然后可以同样根据本领域熟知的方法进行扫描或成像并分析。因此,通过检测特定RCP单体是否已杂交至阵列,可以检测特定扣锁探针是否杂交至其靶标并且因此连接并扩增。因此,在本发明的某些实施方案中,可以使用基于固体相的方法。固体载体可以用来实施所述方法多个阶段或步骤。例如,以及或对以上讨论的RCP单体的可能阵列检测的可选,固体相可以用于所述方法的早期步骤。在一个这样的实施方案中,来自从用于分子测试的试验等分试样分离的DNA或其中的靶标DNA可以固定在固体载体上。因此,可以包含作为用于要在步骤(e)中实施的分子试验的靶标的核苷酸序列的DNA片段或DNA分子,例如在分子测试之前或与其同时,可以使用捕获探针从步骤(d)的分离的DNA选择性地捕获。可以使用捕获探针,其杂交至靶标DNA(在不同于杂交位点的位点,用于核酸鉴别和耐药性检测探针或引物)。捕获探针可以添加至分离的或富集的DNA,例如在所述鉴别和耐药性检测探针或引物之前或同时。捕获探针可以利用用于固定化的工具固定或提供有用于固定化的工具,以使它们可以在结合至靶标DNA之后被固定。这样的用于固定化的工具可以包括例如能够结合至其关联结合伴侣(提供在固体载体上)的亲和性分子。通过代表性实例的方式,捕获探针可以是生物素化的,用于结合至链霉亲和素或抗生物蛋白(或其变体),其偶联至固体载体。如本领域已知的,可以使用任何方便的固体载体。例如,固体载体可以包括微阵列、印迹膜、凝胶、显微镜载玻片、孔、试管或其它容器或器皿,或者珠或粒子,例如玻璃、聚合物、塑料或磁性珠或粒子。靶标DNA分子可以可选地直接固定在固体载体上。因此在本发明的一个优选实施方案中,靶标DNA分子可以固定在经由生物素化的捕获寡核苷酸缀合至链霉亲和素的固体载体上。在本发明的一个可选实施方案中,靶标DNA分子可以是生物素化的并固定在缀合至链霉亲和素的固体载体上。在进行步骤(e)的分子试验的同时,含有临床样品的培养器皿保持在培养(如果进行预培养步骤)或者使其进行培养步骤(步骤(c))。如以上指出的,培养简单地涉及在适合于或有益于微生物生长的条件下孵育培养器皿。因此这个步骤可以如以上对于预培养指出的那样进行。这个步骤意味着如果从步骤(e)的分子试验没有获得阳性微生物鉴别,则样品可用于基于常规表型和/或生物化学试验的基于传统培养的鉴别,或实际上通过任何其它手段用于进一步的ID测试-这些试验不被延迟,因为培养正在进行,并且不需要提取另外的临床样品或开始另外的培养。实际上在此时,如果在步骤(e)中没有鉴别出微生物,则培养如本来那样继续,或者培养器皿可以转移至另一个培养系统(例如设计用于微生物鉴别和任选地还用于抗微生物剂敏感性测试的自动化培养系统或箱)。在适当的培养期之后,可以进行这样的进一步ID试验以及敏感性试验,后者例如通过常规AST测试手段,例如通过浊度计评估的肉汤稀释培养或纸片扩散试验以确定MIC。如果在试验等分试样中鉴别出微生物,则在步骤(c)中已被保持培养的经过培养的临床样品上进行抗微生物剂敏感性试验。方便地,这可以涉及从培养器皿抽取或移出另外的(例如第二或随后的,取决于已取出多少等分试样用于分子测试)等分试样,并在此上进行AST测试。所述方法还可以包括在此阶段的富集用于微生物的等分试样或经过培养的临床样品的另外步骤。适用于此的程序在上文讨论,并且可以包括从等分试样/培养样品移出或分离非微生物细胞(即试验受试者细胞)。在一个实施方案中,微生物细胞可以例如通过过滤分离。用于AST测试的识别和规定条件存在,并且可以遵照以便可以获得易于可比较的结果,其比得上或可以与在其他实验室中进行的试验进行比较。这可能涉及例如使用规定的培养基和培养条件。因此,在开始抗微生物剂敏感性试验之前,用于AST测试的另外的被移出的等分试样(或等分试样成分/剩余部分等),或来自其的分离的或富集的微生物,可以转移到用于微生物培养的合适培养基,例如Mueller-Hinton培养基(MH-培养基)。微生物可以在各种各样的抗微生物剂存在下生长以确定它们对于给出的抗微生物剂的敏感性。根据本发明,基于微生物的身份,以及基于在微生物内鉴别出的任何遗传抗微生物剂耐药性标记物的性质来选择抗微生物剂。抗微生物剂以及要使用的量,也可以根据当前临床实践,例如根据当前在实践中使用的哪一种抗微生物剂来处理所鉴别出的微生物来选择,以便可以评估微生物对所选择的当前接受的或识别的抗微生物剂处理的敏感性。因此抗微生物剂可以基于已知对于所鉴别出的微生物有效的那些,或当前在实践中用来处理微生物的那些进行选择,并且排除基于耐药性标记物的存在可以预期对其具有耐药性的任何试剂,或者这样的试剂可以被包括并且使用的量可以进行选择以允许确定可以是有效的抗微生物剂的量或浓度,而不管耐药性标记物的存在。将抗微生物剂添加至生长培养基至最终浓度或量的范围。在本发明的一个优选实施方案中,可以进行抗微生物剂的系列稀释。在AST试验中生长或培养样品/来自其的微生物的步骤可以通过任何已知或方便的手段发生。可以使用固体或液体相培养。因此,例如,在一个优选实施方案中,样品/微生物可以在含有抗微生物剂的板或其它固体培养基之上或之中培养并且微生物生长可以通过使微生物可视化(例如成像)(即使板等成像)来确定。因此,使培养物可视化或对其进行直接成像作为监测或评估生长的手段。相应地,在一个优选实施方案中,直接分析培养物以监测/评估生长。例如,培养物可以在板的孔中生长并且这些孔可以被成像。可选地,样品(或等分试样)可以以时间间隔或在不同时间点从培养物移出(或取出),并且被移出的样品(等分试样)可以对于微生物生长进行分析。这可以通过任何手段进行,包括例如借助于分子试验,例如基于核酸的试验。因此可以使用检测探针和/或引物,其结合至微生物细胞或结合至从微生物细胞释放或分离的组分。这可以包括例如如上对于步骤(e)的鉴别试验所描述的核酸探针或引物。在其它实施方案中,微生物细胞可以直接检测,例如通过染色,如在以下更详细地描述的。除了其中允许微生物在没有任何抗微生物剂下生长的阳性对照之外,每个抗微生物剂优选以至少一个浓度使用。例如,使用抗微生物剂的2、3、4、5、6、7或8个以上浓度。以稀释系列使用的浓度在相应浓度之间可以相差两倍。术语抗微生物剂包括杀灭微生物或抑制其生长的任何试剂。本发明的抗微生物剂可以特别地包括抗生素和抗真菌剂。抗微生物剂可以是杀微生物的或抑制微生物的。多种不同种类的抗生物是已知的,包括针对真菌或特别地多组真菌有活性的抗生素,并且可以使用这些中的任一种或全部。抗生素可以包括β内酰胺抗生素、头孢菌素、多粘菌素、利福霉素、闰年霉素、喹诺酮、磺胺类、大环内酯类、林可酰胺类、四环素类、氨基糖苷类、环脂肽类、甘氨环素类、恶唑啉酮类、闰年霉素或碳培南类(carbapenams)。本发明的优选抗真菌剂可以包括多烯类、咪唑类、三唑类和噻唑类、烯丙基胺类或棘白菌素类。因此,抗微生物剂敏感性可以通过培养被移出的等分试样(或等分试样成分等)或来自步骤(c)的经过培养的临床样品,或由其分离或富集的微生物,并在一系列时间点上分析AST培养物而确定。对于以上的培养步骤,用于AST的培养可以在促进微生物生长的任何温度发生,例如在约20℃至40℃之间,或20至37℃,优选地在约25℃至37℃之间,更优选地在约30℃至37℃之间或30至35℃。在一个实施方案中,AST培养物可以在约35℃培养。AST培养物可以在多个时间点进行分析以监测微生物生长。例如,在开始培养后的时间点0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时分析。培养物可以在开始培养后立即(其中t=0)进行分析。培养物也可以在开始培养之后超过24小时的时间期进行分析。典型地,培养物可以在开始培养后的0、1、2、3、4、6和24小时分析。然而,在以下实施例中获得和报告的结果显示,短的孵育时间可以足以用于检测不同的微生物生长例如4小时。因此,也可以使用较短的多至8、7、6、5、4、3或2小时的总孵育时间,例如每小时或每2小时或90分钟进行分析。如上所述,培养物通常在两个以上时间点进行分析,例如在多至培养的4、5或6小时的两个以上时间点。本发明要求在抗微生物剂敏感性试验期间监测微生物生长。用于监测微生物生长的许多方法是已知的并且用于AST试验,例如包括浊度测量、色度确定、光检测、光散射、pH测量、分光测量和荧光检测。可以使用这些中的任一种。然而,根据本发明的一个优选实施方案,生长可以通过成像方法确定或评估样品中的微生物细胞的数目和/或量和/或尺寸和/或面积来进行检测和评估,如上所述,微生物细胞可以包括在集落和/或聚集体中的细胞。这可以通过已知用于测量或检测微生物的任何方法,通过评估或确定在抗微生物剂存在下生长之前和/或之后样品中存在的微生物的数目或量而实现。这样的确定可以涉及确定微生物细胞、聚集体和/或集落的数目和/或尺寸。同样,用于此的技术是已知的和可得的。因此,生长可以通过随时间监测样品中微生物和/或微生物细胞和/或集落和/或聚集体的数目和/或量和/或尺寸而测量。这可以直接或间接进行测量。样品中微生物的数目或量可以直接通过血球计、流式细胞仪或自动化显微镜进行测量。微生物可以在检测之前被固定和/或渗透。可选地,微生物开在体内条件下进行检测。用于通过使用流式细胞仪的细菌细胞计数监测的AST测试的方法描述于Broeren等人,2013,Clin.Microbiol.Infect.19.286-291。其中细菌生长并通过多通道流体盒中自动化显微镜计数的用于进行AST试验的方法由Price等人2014,J.Microbiol.Met.98,50-58和由Metzger等人,2014.J.Microbiol.Met.79,160-165,并且由AccelerateDiagnostics(参见例如WO2014/040088A1、US2014/0278136A1和US8,460,887B2)描述。在这些方法中,细菌在表面上固定并生长,并且通过在两个以上时间点对该表面成像来评估个体细菌和/或集落的存活力和/或生长(包括测量集落生长)。这样的方法可以根据本发明使用。已知的其它方法如由Fredborg等人,JClinMicrobiol.2013Jul;51(7):2047-53,和由Unisensor(US8780181)描述,其中使用亮场显微镜将细菌在溶液中成像,通过提取该溶液的一系列堆叠图像(物平面),并对样品中存在的细菌进行计数。尽管可以使用基于利用成像来监测微生物生长的任何方法,但是本发明的方法优选地不依赖于对个体细胞进行计数或依赖于监测个体细胞或集落的生长(例如依赖于监测个体细胞或集落在尺寸方面的增加,例如根据AccelerateDiagnosticsInc.的方法)。因此,本发明不限于(并且在优选实施方案中不涉及)使用固定位置用于对AST培养物或AST培养样品进行成像。相反,根据本发明优选监测AST培养物或培养样品中的细胞的大部分生长,例如通过对视野中的大部分细胞进行成像。视野中的微生物细胞物质(生物质)的量(例如面积)可以通过成像确定。细胞/微生物生物质可以直接检测(例如通过显微镜或照相机等),例如使用亮场显微镜,或者微生物细胞可以被染色用于检测,例如通过在预定或要求的生长时间期之后将染料添加至AST培养物或培养样品。在另一个特别实施方案中,AST培养物或培养样品可以直接成像或可视化,而使微生物细胞固定化,例如无需施加力如电泳以使细胞定位至用于成像的检测位置或表面。在这样的成像方法中,可以应用算法来根据本领域已知的方法和原理从图像确定微生物生长的量。因此,基于图像中微生物细胞物质/生物质的数目、尺寸和/或面积(例如图像/视野中的所有微生物细胞物质,例如被成像的总细胞物质,的量),统计学方法可以应用至微生物细胞的图像。基于在培养物中存在的微生物和抗微生物剂的身份,可以撰写算法以考虑不同生长模式和/或形态。这样的计数或成像方法允许在AST试验中微生物的数字表型分析。已获得数据,其显示这样的数字表型确定得到与参照技术(微量肉汤稀释法)类似的MIC值。使用这样的方法的特别优点在于,抗微生物剂敏感性测试可以在包含宽范围的微生物的浓度或量的样品上进行,并且在进行抗微生物剂敏感性测试之前不必需使用标准化微生物滴定。本发明的一个有用特征是使用不同浓度的微生物的能力。包含至少103CFU/ml的样品可以用于样品的方法,例如可以使用包含至少104、105、106、107、108或109CFU/ml的样品。可选地,可以使用包含低于103CFU/ml,例如至少102CFU/ml的样品。在本发明的方法中,也可以使用包含低于102CFU/ml的样品。在本发明的一个实施方案中,微生物可以通过在确定样品中的微生物的数目或量之前添加对微生物染色的标记物(即染色剂或染料),或通过利用微生物内在性质的方法如例如相位对比或本领域已知的用于定量样品中细菌的数目的任何其它方法进行检测。合适的染色剂可以包括有色或荧光染料,例如革兰氏染色或用于肽聚糖或DNA燃烧的其它染色,作为使微生物可视化的手段。在本发明的一个特别实施方案中,微生物内的DNA可以使用DyeCycleTM染色。其它DNA染色剂是熟知的和可得的。实际上在本领域可得用于对细菌染色的染色剂的数目巨大并且大量的这样的染色剂已被记载,包括在标准参考文本中,并且商购可得,例如自LifeTechnologies。通过染色对微生物的直接标记易于进行、方便和成本有效,并且因此代表优选的实施方案。因此,例如,微生物可以在微滴定板的孔中生长用于AST试验,并且生长期结束,可以添加染料或染色剂并且板孔可以被成像,并通过确定微生物细胞、聚集体或集落的数目和/或尺寸,例如通过计数或成像,而对微生物的数目或量进行评估。可选地,使用流式细胞仪或类似类型的仪器,例如来自Q-lineaAB(瑞典)的Aquila400仪器,例如如申请号为61/979319的美国专利申请号所述,可以对微生物进行计数。在一个可选实施方案中,微生物可以经由该微生物内或上的生物学特征特异性地标记。“生物学特征”可以例如是微生物之中或之上的分子,例如在细胞表面上表达或定位的蛋白或其他生物分子。例如,标记,例如有色或荧光标记,可以偶联至特异性地结合至特定生物学特征的蛋白或其它亲和性结合分子。在一个实施方案中,所述蛋白可以是凝集素、亲合体或抗体,或抗体片段。以这种方式标记的微生物可以如之前描述的进行检测例如计数。在另一个实施方案中,邻近探针可以用来检测微生物内或上的特定生物学特征。在本发明的另一个可选实施方案中,微生物可以使用以上讨论(用于分子试验)的扣锁探针和基于RCA的被扩增单个分子检测(ASMD)方法检测和计数。这样的方法使得单个微生物细胞能够被检测和计数。因此,微生物可以通过扣锁探针的结合进行检测并且样品中的微生物的数目可以间接地通过经由被环化的扣锁探针的RCA产生的被扩增的信号进行测量。各个RCA产物(团)可以是单个微生物的指示。微生物可以裂解并且可以使用扣锁探针,其被设计成杂交至微生物的一个或多个核苷酸序列。这可以包括如上讨论的分离DNA的步骤,并且优选地选择性地分离或富集微生物DNA的步骤,同样如上所讨论的。由于在AST试验中培养物通常没有初始临床样品培养步骤中复杂,所以可以使用简化的用于分离或富集微生物DNA的方案,涉及例如过滤以分离微生物和微生物细胞裂解或简单地直接微生物细胞裂解。可选地,可以使用亲和性结合分子,其结合至在微生物上存在或被裂解的微生物内的一个或多个分子,这样的亲和性探针具有扣锁探针可以杂交至其的核酸标记或标签,即与免疫RCA检测程序类似。类似地可以使用邻近探针以结合至微生物之中或之上的靶标,并且邻近探针的核酸结构域可以用来作为扣锁探针的连接的模板并且任选地还启动其通过RCA的扩增。用于此的程序是广泛已知的并且描述于文献。如上C2CA可以用于信号扩增。样品中的微生物的数目因此可以通过计数团的数目进行估算,所述团可以如以上样品内的‘团’所述进行标记例如荧光标记。这因此提供获得数字表型敏感性读出的另一种方便手段。一般来讲在进行AST试验中有利的是处于试验的微生物培养物是纯的,即存在单个微生物。因此,在一个优选实施方案中,在步骤(f),如果在步骤(e)的核酸试验中鉴别出了单个微生物,则进行AST试验。即,如果确定临床样品仅含有单个微生物,则进行步骤(f)的AST试验。这确保在AST试验中可以仅使用纯培养物。因此,在某些实施方案中,如果鉴别出了两种以上微生物,则不进行步骤(f)的AST步骤并且所述方法如在步骤(g)那样继续。然而,这不是必要特征,并且有可能使用基于可视化或成像的微生物检测方法来进行AST试验,例如如由AccelerateDiagnostics提供的方法,其使用在表面上而不是在溶液中的细菌的成像,或者实际上其中被标记的微生物在流体系统,例如如上讨论的Price等人2014,J.Microbiol.Met.98,50-58和Metzger等人,2014.J.Microbiol.Met.79,160-165的基于自动化显微镜流体盒的系统中进行检测的方法。任何逐个细胞检测和鉴别方法可以用于含有多于一种微生物的样品的AST测试。方便地本发明的方法可以自动化。任何一个或多个步骤可以自动化,优选地步骤(a)至(f)的任一个或所有步骤可以自动化。以上讨论的多个特定或优选步骤使得它们本身良好适合于自动化,例如优选的用于分子测试和/或AST测试的基于扣锁探针的ASMD方法和微生物/集落计数方法。自动化培养方法已被开发,包括用于微生物鉴别和/或AST测试的血液培养方法,并且可以根据本发明使用或适于使用。自动化将提供速度的优势和操作的便利以及复用能力,这是在临床实验室环境中很重要并且尤其在脓毒症的诊断中很重要。从另一方面看,本发明提供用于检测和表征临床样品中的微生物的微生物检测装置,所述装置包括:含有培养基并且被布置成容纳所述临床样品的第一培养器皿;任选地含有培养基的第二培养器皿;任选地部分移出装置,其用于移出所述第一培养器皿的内容物的部分并将所述部分转移至所述第二培养器皿;其中所述第一培养器皿用于培养所述临床样品;并且其中所述第二培养器皿被布置成接收作为所述第一培养器皿的所述内容物的所述部分的临床样品/培养基混合物或临床样品培养物,并且被布置成培养所述部分,所述装置还包括:试验等分试样提取装置,其用于移出第一和/或第二培养器皿的内容物的部分以用作试验等分试样;和DNA测试装置,其用于从所述试验等分试样分离DNA,并且在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述DNA测试装置被布置成利用以下各项进行所述核酸试验:i.用于微生物鉴别的一种或多种核酸探针或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii.用于抗微生物剂耐药性标记物检测的一种或多种核酸探针或引物,所述探针或引物能够杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记的核苷酸序列;并且检测所述探针或引物是否已杂交至所述DNA和/或所述引物是否已参与扩增反应;其中所述微生物检测装置被布置成使得:如果通过所述DNA测试装置鉴别出所给定的微生物,则将在提取所述试验等分试样之后通过培养由所述第一和/或第二培养器皿生产的经过培养临床样品和/或经过培养部分转至抗微生物剂敏感性试验装置,用于通过评估生长或用于生长的标记物监测微生物生长而在所述经过培养的临床样品和/或经过培养部分上进行抗微生物剂敏感性试验,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由通过所述DNA测试装置检测的所述微生物的身份和抗微生物剂耐药性标记物确定;并且如果通过所述DNA测试装置没有鉴别出所给定的微生物,则所述微生物检测装置在所述第一和/或第二培养器皿中进一步培养所述临床样品和/或经过培养的部分以使进一步的微生物鉴别和抗微生物剂敏感性试验按顺序在另外的培养之后能够进行,从而鉴别出所述微生物并且确定其抗微生物剂耐药性分布。从另一方面看,本发明提供用于检测和表征临床样品中的微生物的微生物检测装置,所述装置包括:含有培养基并且被布置成容纳所述临床样品的培养器皿;试验等分试样提取装置用于移出所述培养器皿的内容物的部分以用作试验等分试样;其中所述培养器皿用于在提取所述试验等分试样之后,并且任选地在提取所述试验等分试样之前,培养所述临床样品;DNA测试装置,其用于从所述试验等分试样分离DNA,并且在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述DNA测试装置被布置成利用以下各项进行所述核酸试验:i.用于微生物鉴别的一种或多种核酸探针或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii.用于抗微生物剂耐药性标记物检测的一种或多种核酸探针或引物,所述探针或引物能够杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记的核苷酸序列;并且检测所述探针或引物是否已杂交至所述DNA和/或所述引物是否已参与扩增反应;其中所述微生物检测装置被布置成使得:如果通过所述DNA测试装置鉴别出所给定的微生物,则将在提取所述试验等分试样之后通过培养由所述培养器皿产生的经过培养的临床样品转至抗微生物剂敏感性试验装置用于通过评估生长或用于生长的标记物来监测微生物生长而在所述经过培养的临床样品上进行抗微生物剂敏感性试验,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由通过所述DNA测试装置检测的所述微生物的身份和抗微生物剂耐药性标记物确定;并且如果通过所述DNA测试装置没有鉴别出所给定的微生物,则所述微生物检测装置在所述培养器皿中进一步培养所述临床样品以使进一步的微生物鉴别和抗微生物剂敏感性试验按顺序在另外的培养之后能够进行,从而鉴别所述微生物并且确定其抗微生物剂耐药性分布。从另一个方面看,本发明提供用于检测和表征临床样品中的微生物的微生物检测装置,所述装置包括:含有培养基并且被布置成容纳所述临床样品的第一培养器皿;含有培养基的第二培养器皿;部分移出装置,其用于移出所述第一培养器皿的内容物的部分并将所述部分转移至所述第二培养器皿;其中所述第一培养器皿用于培养所述临床样品;并且其中所述第二培养器皿被布置成接收作为所述第一培养器皿的内容物的所述部分的临床样品/培养基混合物或临床样品培养物,并且被布置成培养所述部分;所述装置还包括:试验等分试样提取装置,其用于移出所述第二培养器皿的内容物的部分以用作试验等分试样;和DNA测试装置,其用于从所述试验等分试样分离DNA,并且在所述DNA上进行核酸试验以鉴别微生物以及检测在所述微生物中存在或不存在一种或多种遗传抗微生物剂耐药性标记物,其中所述DNA测试装置被布置成利用以下各项进行所述核酸试验:i.用于微生物鉴别的一种或多种核酸探针或引物,所述探针或引物能够特异性地杂交至或所述引物能够选择性地扩增作为给定微生物的认同式的核苷酸序列;和ii.用于抗微生物剂耐药性标记物检测的一种或多种核酸探针或引物,所述探针或引物能够杂交至或所述引物能够选择性地扩增代表遗传抗微生物剂耐药性标记的核苷酸序列;并且检测所述探针或引物是否已杂交至所述DNA和/或所述引物是否已参与扩增反应;其中所述微生物检测装置被布置成使得:如果通过所述DNA测试装置鉴别出所给定的微生物,则将在提取所述试验等分试样之后通过培养由所述第二培养器皿产生的经过培养的部分转至抗微生物剂敏感性试验装置,用于通过评估生长或用于生长的标记物监测微生物生长而在所述经过培养的部分上进行抗微生物剂敏感性试验,并且其中在所述抗微生物剂敏感性试验中使用的抗微生物剂的类型和浓度由通过所述DNA测试装置检测的所述微生物的身份和抗微生物剂耐药性标记物确定;并且如果通过所述DNA测试装置没有鉴别出所给定的微生物,则所述微生物检测装置在所述第一和/或第二培养器皿中进一步培养所述临床样品和/或经过培养的部分以使进一步的微生物鉴别和抗微生物剂敏感性试验按顺序在另外的培养之后能够进行,从而鉴别所述微生物并且确定其抗微生物剂耐药性分布。在前述三个方面的每一个中,微生物检测装置可以布置成进行以上提出的任何或全部的所述方法步骤和优选/任选的步骤。因此,DNA测试装置可以布置成实施以上所述的任何或全部的DNA测试步骤,并且抗微生物剂敏感性试验装置可以布置成实施以上所述的任何或全部的抗微生物剂敏感性测试步骤。所述设备可以包括用于确定样品中存在的微生物细胞物质(即微生物生物质)的量的工具,特别地通过直接评估或确定此的工具。这可以通过视觉地并且尤其通过成像确定微生物生物质的量实现。因此,所述设备可以包括用于获得2D图像的成像工具(例如显微镜和任选的照相机)。所述设备可以包括用于处理图像以确定微生物细胞物质的量的处理器。所述处理器可以配置成确定微生物生物质的面积(更特别地在所考察的视野例如图像中的微生物生物质的面积)。更通常地,成像工具和处理器可以配置成确定微生物和/或微生物集落或聚集体的量和/或数目和/或尺寸。这可以包括对细胞或集落进行计数,但不限于这样的方法并且包括通过评估(或确定)微生物细胞、集落或聚集体的尺寸、面积、形状、形态和/或数目来视觉地评估微生物生长的量的任何工具(术语“聚集体”包括物理上邻近的细胞的任何集合例如丛或簇;这可以包括已经聚集或粘在一起的细胞的非克隆丛/簇(例如已聚集的相邻细胞)以及克隆集落。用来测量微生物生长的参数可以(但不需要)根据微生物的身份(在步骤(e)中确定)和步骤(f)中使用的抗微生物剂变化。实际上,取决于有机体和所使用的抗微生物剂,细胞的形态或生长模式可能受影响,并且这可以从“正常”或“典型”的形态或生长模式(例如在没有抗微生物剂存在下)改变或变化。尽管一些AST生长监测方法可以取决于检测这样的变化,但是根据本发明不是必须考虑这样的变化并且可以确定微生物生长或生物质的量(例如面积),而与形态和/或生长模式无关。因此可以使用同样的生长监测方法,而不管微生物细胞和/或所使用的抗微生物剂。培养基可以在装置运行之前添加至第一和/或第二培养器皿,或当供应时第一和/或第二培养器皿用培养基填充。典型地第一和/或第二培养器皿将是消耗品。在临床样品在微生物检测装置中时其可以添加至第一培养器皿,或在将器皿插入到微生物检测装置中之前其可以添加至在装置外部的器皿。第一培养器皿可以布置成接收临床样品,并且这可以在将培养基引入到培养器皿中之前、之后或同时出现。第一和/或第二培养器皿可以是用于处理感兴趣的临床样品的任何合适类型的器皿。在一个实例中,临床样品是血液样品。对于血液样品,血液可以从患者抽入到在微生物检测装置外部的培养器皿中,然后可以将含有该样品和培养基的第一培养器皿插入到微生物检测装置中。临床样品或部分在第一和/或第二培养器皿中的进一步培养可以在如早期测试步骤那样在设备的相同构件中出现,或可选地第一和/或第二培养器皿可以转至分开的设备,其中微生物检测装置因此包括多个分开的部件。在后一种情况下,第一和/或第二培养器皿可以在提取期间以使得其可以在另一个专用设备中的进一步培养步骤的期间被培养的方式处理,这可以有利地是已在所讨论设施(其可以例如是医院)处的恰当位置的设备。因此,使得第一和/或第二培养器皿可用于继续培养并且这可以在与之前步骤的相同设备内部或该设备外部并且在所述装置的另一个分开的部件中。附图说明本发明现在将参考以下附图在以下实施例中更详细地描述,其中:图1在(A)中示出了用于检测样品中的微生物的样品微阵列组,并且在(B)中示出了对于一系列微生物产生的信号的荧光强度。在图1A中,在图像的四个角落处和左手边中间的斑点是用于图像比对的参考斑点。三个较亮的斑点指示对大肠杆菌(E.coli)特异性的核苷酸序列使用本发明的检测方法在样品中被检测。图1B显示当使用对大肠杆菌特异性的探针时对于一系列不同微生物产生的信号,并且指示本发明的方法能够检测样品中特定微生物-在此情况下为大肠杆菌的存在。图2显示相对于在没有环丙沙星存在下生长的阳性对照样品,在补充有在一系列不同浓度的环丙沙星的MH肉汤中生长的细菌的相对生长。细胞用DyeCycleTM橙色染色剂染色并通过自动化显微镜计数。图3显示相对于在没有任何抗生素存在下生长的阳性对照样品,在补充有大量不同抗生素(各自处于一系列不同浓度)的MH肉汤中生长的细菌的相对生长(A-头孢噻肟,B-环丙沙星,C-庆大霉素,D-美罗培南,E-头孢他啶,F-哌拉西林+他佐巴坦)。细胞用DyeCycleTM橙色染色剂染色并通过Aquila400计数。这些数据表明,不同生长可以在4小时内检测。在4、6和24小时以及一系列截止值对各个抗生素计算MIC值。图4在(A)中示出了对于样品内的细菌的扩增单个分子检测(ASMD)以确定微生物的抗生素敏感性所需的工作流程,并且在(B)中显示相对于在没有任一抗生素存在下生长的阳性对照样品,在补充有环丙沙星或头孢噻肟的MH肉汤中生长的细菌的不同生长。在图4B中,指示特异性微生物DNA序列的存在的RCA产物通过ASMD检测,并通过Aquila400计数。图5使出了用于检测在探针设计中使用的特异性微生物DNA序列的方案。与微生物DNA的区域互补的生物素化的捕获寡核苷酸结合靶标DNA片段并且将其固定到固体相上。扣锁探针,其包含两个靶标-互补部分(5’/3’-臂)和具有用于检测的位点的骨架(DO-一般性的),限制消化和启动(RO-一般性的),以及阵列寡核苷酸杂交(AO-独特的),经由其互补的5’和3’末端序列结合至其靶标,并且可以在RCA扩增和C2CA反应之前连接到环中。具体实施方式实施例实施例1-血液培养和通过分子试验的微生物鉴别和表征.将利用针头穿过隔膜用500μl的大肠杆菌细菌悬浮液刺激(spike)以得到103CFU/ml的浓度的血液添加至BacT/ALERTFA+(Biomerieux)血液培养瓶。对于预培养,我们使用来自GrantInstruments(Grant-bioPTR-35)的自己设计的多旋转器,其被重新设计成血液培养瓶(BCF)搅拌器。样品在35℃孵育4小时。使用注射器吸出5ml的样品,相当于1ml的全血。细菌DNA的富集通过来自Molzym(德国)的方法在不需要离心的情况下实施。通过将800μlES添加至160μlMolDNAase制备裂解缓冲液。通过抽吸6x混合并将所有的MolDNAase溶液添加至12800μl裂解缓冲液,接着通过抽吸6x混合。制备蛋白酶K。将1000μlES添加至400μl蛋白酶K并通过抽吸6x混合。裂解将从BCF抽取的5ml样品添加至4300μl裂解-MolDNAasr缓冲液并通过抽吸8x混合。在45℃孵育10min。使MolDNAase失活并将350μl蛋白酶K添加至裂解产物并通过抽吸8x混合。在45℃孵育10min。样品捕获至柱并洗涤3个循环将605μl裂解产物添加至过滤柱(Molzym,Germany),施加15秒真空。将500μlRS添加至过滤柱并施加15秒真空。将605μl裂解产物添加至过滤柱(Molzym,Germany),施加30秒真空。将500μlRS添加至过滤柱并施加15秒真空。将605μl裂解产物添加至过滤柱(Molzym,Germany),施加45秒真空。将500μlRS添加至过滤柱并施加15秒真空。在样品添加后继续利用45秒真空直至已添加所有的样品。如果需要,如果过滤器在过滤期间变得堵塞,可以使用多于一个过滤器以过滤裂解产物。制备用于微生物的裂解缓冲液将5.6μlβ-巯基乙醇添加至600μlRL并通过抽吸6x混合,将所有预混合的BM-RL添加至80μlBugLysis并通过抽吸6x混合。微生物的裂解将170μl所制备的裂解混合物添加至柱并施加真空持续200ms。在45℃孵育10min。将280μl所制备的蛋白酶K-溶液添加中520μl缓冲液RP。通过抽吸6x混合。将200μlPK-RP添加至柱。施加真空持续200ms。在45℃孵育10min。微生物DNA与柱的结合将柱移至小室调节模块(roomtemperedblock)。等待2分钟。将500μlCSAB添加至柱。施加真空持续2s。洗涤1将500μlWB添加至柱。施加真空持续2s。洗涤2将500μlWS添加至柱。施加真空持续2s。膜的干燥施加真空持续10min洗脱将200μlET添加至柱施加真空持续200ms。在室温孵育至少5min施加真空持续1min重复一次以形成两次洗脱。通过在等人,2012(supra)中的方法在所富集的细菌DNA样品上实施分子试验。在细菌的分子鉴别过程期间,剩余的血液样品保持在搅拌器下。扣锁探针和靶捕获探针从IntegratedDNATechnologies(Munich,Germany)订购。所述探针设计成检测在经由生物信息工具选择的各个细菌中的独特基序。与靶标DNA的捕获探针的杂交和扣锁探针的连接同时进行,并且通过在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣锁探针、50nM捕获探针、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃孵育片段化和变性的基因组DNA持续5min而实现。靶标DNA连同经过反应的扣锁探针经由生物素化的捕获探针被捕获在磁性粒子上。这通过将50μgDynabeadsMyOneTM链霉亲和素T1珠(Invitrogen)添加至杂交/连接反应并在室温将样品孵育3min而实现。过量的探针通过用100μl含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐温-20的洗涤缓冲液洗涤一次而消除。进行过量的线性扣锁探针的消除,因为这些可能以其它方式负面地干扰随后的RCA反应。经过反应的探针通过C2CA扩增,这包括从RCA开始的系列酶促反应。通过添加20μl的含有1×phi29DNA聚合酶缓冲液(Fermentas,Lithuania;33mMTris-乙酸盐(pH7.9,在37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)吐温-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的连接混合物起动RCA反应。将反应在37℃孵育11min,并在65℃失活1min。通过添加3单位的AluI(NewEnglandBiolabs)、600nM重复寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶缓冲液中),将RCA产物在37℃消化1min,并将反应在65℃终止1min。通过添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA连接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶缓冲液中)的混合物至50μl的最终体积,进行连接、扩增和标记反应。将反应在37℃孵育7min,并在65℃终止1min。将以上重复一次。在最后的RCA之后,将产物再次消化成单体。现在RCP准备用于分析。将消化的样品转移至微阵列,在55℃孵育30分钟接着在室温用1xSSC洗涤。然后杂交的RCA单体经由在2xSSC中的10nM浓度的检测器寡核苷酸在55℃杂交30分钟进行标记,在室温在1xSSC中洗涤两次并旋干。然后将阵列在阵列扫描仪中进行扫描并且结果使用图像分析软件分析如下。对阵列图像进行评价以检测对应于一个或若干病原体的斑点。亮斑点对应于所检测的病原体,每个病原体具有三个斑点的冗余。此外,阵列具有用于图像比对的参考斑点(其总是亮的),和方案参考斑点,其如果是亮的则验证分子方案的个别步骤成功。分析分成以下步骤:1.检测参考斑点并将图像进行相应地比对。2.测量斑点强度和背景并计算背景校正值。3.测量的强度对病原体特定背景进行补偿,如例如来自对应于其它病原体的探针组的DNA的非特异性结合。4.使用阵列强度数据来提供关于病原体id的答案和质量值a.当计算ID答案时,算法考虑对应于特定病原体的所有重复斑点的强度值。b.ID答案可以是定性的(报告存在病原体),和/或定量的(报告样品中存在的病原体的量的指示)c.评价方案参考斑点以验证分子方案成功。5.收集结果并且可以转移至下游AST分析和/或在结果报告中汇报。结果包括:a.所检测病原体的IDb.对于每个所检测的病原体的半定量值c.指示分子方案的成功率的定性值。样品阵列图像示于图1A。沿着板的边缘的五个斑点是参考斑点并且用于图像比对。较亮的斑点指示所检测的病原体(大肠杆菌)。图1B显示对于大肠杆菌特异性地产生荧光信号。实施例2-在实施例1的血液培养物上的AST测试.将5ml来自血液培养瓶中的剩余样品,其在分子分型期间继续处于培养条件下,从烧瓶取出。所取出的样品对细菌进行富集并且同时改变培养基,在这种情况下变为Mueller-Hinton培养基(MH-培养基)。经由通过0.2μm滤器的过滤回收大肠杆菌,然后将回收的细菌重新悬浮在MH-培养基中。将63μl该细菌悬浮液的等分试样转移至在微滴定板中的所选孔。每个孔具有不同浓度的抗生素以及不同的抗生素。由于在实施例1中鉴别出的微生物在这种情况下是大肠杆菌,所以选择以下抗生素用于抗微生物剂敏感性测试:环丙沙星,哌拉西林+他佐巴坦,头孢噻肟,头孢他啶,美罗培南和庆大霉素。基于已知的临床MIC值,对每种抗生素制备一系列六个不同的浓度。含有MH肉汤但不含抗生素的第七个孔用作阳性对照。将微滴定板在35℃孵育4小时,然后对板读数。将7μl10μMDyeCycleTM橙色染色剂(MolecularLifeTechnologies)添加至各个孔并在37℃孵育30min。对各个微滴定板孔成像并对细菌的数目进行计数。使用相对于阳性对照的差别生长来确定细菌的MIC值。对于环丙沙星的结果示于图2。实施例3-利用在流式细胞仪类型仪器(Aquila400,Q-lineaAB,Sweden)中的个体细菌的计数来确定AST分布.细菌在如实施例1中描述的血液培养中生长。将5ml来自血液培养瓶中的剩余样品,其在分子分型期间继续处于培养条件下,从烧瓶取出。将样品对细菌进行富集并且同时改变培养基,在这种情况下变为Mueller-Hinton培养基(MH-培养基)。经由通过0.2μm滤器的过滤回收大肠杆菌,并将回收的细菌重新悬浮在MH-培养基中至在MüllerHinton肉汤中的大约108CFU/ml的浓度,然后在MüllerHinton肉汤中稀释至大约106CFU/ml。在10x试验浓度的MüllerHinton肉汤中以一系列2:1系列稀释制备抗生素溶液。基于细菌的身份和抗生素选取抗生素浓度的范围。由于在实施例1中鉴别出的微生物在这种情况下是大肠杆菌,所以选择以下抗生素用于抗微生物剂敏感性试验:环丙沙星,哌拉西林+他佐巴坦,头孢噻肟,头孢他啶,美罗培南和庆大霉素。基于已知的临床MIC值,选择一系列八个不同的浓度。制备含有100μl处于八个不同浓度的抗生素溶液和800μlMüllerHinton肉汤的八个样品试管。一个另外的试管含有900μlMüllerHinton肉汤但不含有抗生物作为阳性对照。将100μl细菌悬浮液(106CFU/ml)添加至所有九个试管。制备包含1000μlMüllerHinton肉汤(即没有细菌)的阴性对照样品作为阴性对照。将所有试管在35℃孵育并在0、4、6和24小时之后提取样品。如实施例2中制备细菌样品用于计数。利用在Aquila400仪器(Q-lineaAB,Sweden)中个体细菌的基于流式细胞仪的计数来确定细菌AST分布。使用alexa488激光器来进行Aquila400分析。从在不同时间点进行的分析明显的是,4小时足以用于检测在不同浓度的抗生素下的差异性细菌生长并由此确定抗生素敏感性。在文献中已显示更短时间,所以这不是出乎意料的。对于各种抗生素,相对于阳性对照样品的差异性细菌生长示于图3。在不同时间点和截止值对于各种抗生素的MIC值基于该差异性细菌生长进行计算。通过此方法获得的值有利地与之前报道的临床MIC值进行比较并在以下显示。结果显示通过对个体细菌计数代替对测量求平均值获得了优异的精度和灵敏度。头孢噻肟利用Macrobroth稀释的MIC为0.125μg/ml并且另一个实验室已利用E-检验确定MIC至≤0.5μg/ml。截止值4小时6小时24小时5%-0,060,12510%-0,060,12515%0,060,030,0620%0,060,030,06环丙沙星利用Macrobroth稀释的MIC为0.016μg/ml并且另一个实验室已利用E-检验确定MIC至≤0.03μg/ml。截止值4小时6小时24小时5%0,0160,0080,00810%0,0080,0080,00815%0,0080,0080,00820%0,0080,0040,008庆大霉素利用Macrobroth稀释的MIC为0.5-1μg/ml并且另一个实验室已利用E-检验确定MIC至1μg/ml。截止值4小时6小时24小时5%10,5110%0,50,5115%0,50,5120%0,50,51美罗培南利用Macrobroth稀释的MIC为0.25-0.5μg/ml并且另一个实验室已利用E-检验确定MIC至≤0.25μg/ml。利用Macrobroth稀释和利用Aquila400估算的MIC太高,因为使用了原来的抗生素储液。截至值4小时6小时24小时5%--0,510%--0,515%-0,50,2520%0,50,250,125头孢他啶利用Macrobroth稀释的MIC为0.25μg/ml并且另一个实验室已利用E-检验确定MIC至≤0.5μg/ml。截止值4小时6小时24小时5%0,250,1250,2510%0,250,1250,2515%0,1250,1250,2520%0,1250,1250,25哌拉西林和他佐巴坦利用Macrobroth稀释的MIC为4-8μg/ml并且另一个实验室已利用E-检验确定MIC至2μg/ml。截止值4小时6小时24小时5%44410%44415%44420%422实施例4-通过使用扣锁探针和C2CA扩增的AST利用AST确定的方法.如实施例1所述,建立利用大肠杆菌刺激的血液培养物并进行分子分型。将5ml来自血液培养瓶中的剩余样品,其在分子分型期间继续处于培养条件下,从烧瓶取出,并将样品对细菌进行富集并且如实施例2变成MH-培养基。将63μl等分试样转移至在微滴定板中的所选孔。每个孔具有不同浓度的抗生素以及不同的抗生素。在一个微滴定板中,放入12种不同的抗生素,各自处于四个不同浓度以及一个空白,即没有抗生素。在微滴定板中4小时生长之后,使每个孔进行细菌裂解以释放细菌DNA。利用扩增的单个分子检测(ASMD,其中提取来自病原体的DNA,接着对扩增产物进行数字计数,而不是通过直接标记细菌,进行抗生素敏感性测试。通过在等人,2012中的方法,在细菌DNA样品上实施分子检测试验。扣锁探针和靶标捕获探针从IntegratedDNATechnologies(Munich,Germany)订购。将所述探针设计成检测经由生物信息工具选择的各个细菌中的独特基序。同时进行至靶标DNA的捕获探针的杂交和扣锁探针的连接,并且通过在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣锁探针、50nM捕获探针、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃孵育片段化和变性的基因组DNA持续5min而实现。靶标DNA连同经过反应的扣锁探针经由生物素化的捕获探针被捕获在磁性粒子上。这通过将50μgDynabeadsMyOneTM链霉亲和素T1珠(Invitrogen)添加至杂交/连接反应并将样品在室温孵育3min而实现。过量的探针通过利用100μl含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐温-20的洗涤缓冲液洗涤一次而消除。过量的线性扣锁探针的消除是必需的,因为这些将以其它方式负面地干扰随后的RCA反应。经过反应的探针通过C2CA扩增,其包括以RCA开始的系列酶促反应。通过添加20μl含有1×phi29DNA聚合酶缓冲液(Fermentas,Lithuania;33mMTris-乙酸盐(pH7.9在37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)Tween-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的连接混合物,起动RCA反应。将反应在37℃孵育11min,并在65℃失活1min。通过添加3单位的AluI(NewEnglandBiolabs)、600nM重复寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶缓冲液中),将RCA产物在37℃消化1min,并将反应在65℃终止1min。通过添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA连接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶缓冲液中)的混合物至50μl的最终体积,进行连接、扩增和标记反应。将反应在37℃孵育7min,并在65℃终止1min。将以上重复一次。在最后的RCA反应之后,将与RCP互补的荧光标记的寡核苷酸以各自5nM的浓度添加。将反应65℃孵育2分钟,接着在37℃孵育5分钟并允许冷却。然后将样品注入Aquila400,(美国专利申请号61/979319)并如Jarvius等人,2006(JarviusJ.,等人,NatureMethods3,725-727(2006)中所述记录RCP产物的数目。对于在各个浓度的环丙沙星和头孢噻肟下生长的细菌样品所检测到的RCP产物的数目示于图4。利用此数据来估算对于各个抗生素的MIC浓度。实施例5-用于探针设计的策略.病原体的鉴别多重地进行。为此,各个所包括的病原体具有多至三个的用来找出靶标DNA的特异性捕获寡核苷酸。各个病原体还具有多至三个的杂交至相应捕获寡核苷酸附近的靶标的特异性扣锁探针。用于设计ASMD探针组的过程可以分成两个主要步骤:寻找最佳靶标区和涉及探针序列。以下是设计过程的进一步分解:寻找基因组靶标–从基因组数据库(例如NCBI)获取微生物基因组序列–将基因组序列划分成靶标和背景组。-如果多于一个靶标基因组,则寻找对于所有共通的序列。-应用滤器组以移出低复杂度候选(均聚物,高/低%-GC,重复等)-背景过滤:抛弃与背景划分中的基因组具有高序列相似性的候选。-报告接受的候选。制备探针-加载将对其设计探针的基因组靶标(在以上步骤中选择的)-选择设置(探针长度,熔融温度,杂/均二聚体滤器,连接滤器等)-寻找最佳探针序列。-提供通过的候选和短的设计概要。用于过滤和识别基因组DNA靶标的探针如图5所示构成。捕获探针将靶标片段带到固体相上,然后所述扣锁结合至其靶标,连接到环中并在随后的C2CA反应中扩增。所述扣锁具有两个靶标互补部分(5’/3’-臂)和具有用于检测的位点(一般性的)、限制性消化和启动(一般性的)和阵列寡核苷酸杂交位点(独特的)的骨架。骨架部分在图5中称为DO、RO和AO。捕获寡核苷酸由靶标互补部分、CT-接头和用于连接至固体相的生物素构成。实施例6-血液培养物和临床样品通过分子试验的微生物鉴别.将来自怀疑有脓毒症的在ICU的患者的血液抽入到Bactec(BectonDickinson)血液培养瓶中并在血液培养箱中培养。在孵育四小时之后,正好在烧瓶已指示在血液培养箱中阳性之前,取出样品并用于分子试验。使用注射器吸出5ml的样品,并如实施例1中所述提取潜在的病原体DNA。通过在等人,2012(supra)中的方法,在所富集的细菌DNA样品上实施分子试验。扣锁探针和靶标捕获探针从IntegratedDNATechnologies(Munich,Germany)订购。所述探针设计成检测经由内部开发的生物信息工具选择的各个细菌中的独特基序。同时地进行至靶标DNA的捕获探针的杂交和扣锁探针的连接,并且通过在20mMTris-HCl(pH8.3)、25mMKCl、10mMMgCl2、0.5mMNAD、0.01%X-100、100nM扣锁探针、50nM捕获探针、0.2μg/μlBSA(NewEnglandBiolabs,MA,USA)和250mU/μlAmpligase(EpicentreBiotechnologies,WI,USA)中在55℃将片段化和变性的基因组DNA孵育5min而实现。靶标DNA连同经过反应的扣锁探针经由生物素化的捕获探针被捕获到磁性粒子上。这通过将50μgDynabeadsMyOneTM链霉亲和素T1珠(Invitrogen)添加至杂交/连接反应并将样品在室温孵育3min而实现。过量的探针通过利用含有5mMTris-HCl(pH7.5)、5mMEDTA、1MNaCl和0.1%吐温-20的(100μl)洗涤缓冲液洗涤(一次)而消除。进行过量的线性扣锁探针的消除,因为这些会以其它方式负面地干扰随后的RCA反应。经过反应的探针通过C2CA扩增,其包括以RCA开始的系列酶促反应。通过添加20μl含有1×phi29DNA聚合酶缓冲液(Fermentas,Lithuania;33mMTris-乙酸盐(pH7.9at37℃)、10mM乙酸Mg、66mM乙酸K、0.1%(v/v)吐温-20、1mMDTT)、100μMdNTPs、0.2μg/μlBSA、25nM引物和100mU/μlphi29DNA聚合酶的连接混合物启动RCA反应。将反应在37℃孵育11min,并在65℃失活1min。通过添加3单位的AluI(NewEnglandBiolabs)、600nM重复寡核苷酸、0.2μg/μlBSA(在1×phi29DNA聚合酶缓冲液中),将RCA产物在37℃消化1min,并将反应在65℃终止1min。通过添加含有1.36mMATP、100μMdNTPs、0.2μg/μlBSA、28mU/μlT4DNA连接酶和120mU/μlphi29DNA聚合酶(在1×phi29DNA聚合酶缓冲液中)的混合物至50μl的最终体积,进行连接、扩增和标记反应。将反应在37℃孵育7min,并在65℃终止1min。将以上重复一次。在最后的RCA之后,将产物再次消化成单体。现在RCP准备用于分析。将消化的样品转移至含有微阵列的器皿,在55℃孵育30分钟,接着在室温利用1xSSC洗涤。然后经过杂交的RCA单体经由在2xSSC中的10nM浓度的检测器寡核苷酸在55℃杂交30分钟进行标记,在室温在1xSSC中洗涤两次并旋干。然后将阵列在阵列扫描器中进行扫描并利用图像分析软件分析结果。所显示的数据已进行了归一化并且仅是高于背景的来自背景的标准偏差的3倍的数据归类为真实信号。来自10个临床样品加上一个刺激样品的数据示于图6。刺激的样品用大肠杆菌刺激入具有来自阴性样品的血液的血液培养瓶中。如果原始量为10CFU大肠杆菌/ml血液进入BCF中然后生长四小时,则刺激入的细菌的量对应于本应存在的量。发现临床样品中的八个通过血液培养是阴性的,并且发现两个通过血液培养是阳性的。阳性样品随后使用标准技术被鉴别为一个大肠杆菌和一个肺炎链球菌(S.pneumoniae)。对于每个样品,仅获得的阳性信号来自预期的阵列特征。在此测定中,发现临床样品中的一个含有大肠杆菌,并且发现临床样品中的一个含有肺炎链球菌。刺激的样品还被确认含有大肠杆菌。在后来使用传统确认测定被确认是阴性的样品的任一个中,都没有看到高于背景的信号(定义为在阴性样品组中平均信号的标准偏差的3倍)。对于大肠杆菌,两个阵列特征/样品(Q1101和Q799)产生信号,这是因为在此实验中使用了都检测大肠杆菌但报告关于不同阵列特征的两种不同的探针系统。实施例7-在从血液培养瓶取出等分试样之后至阳性的时间10组的血液培养瓶用细菌刺激。5组用500CFU/ml血液刺激并且5组用50.000CFU/ml血液刺激。每个血液培养瓶(具有30ml血液培养基)取出来自健康供体的10ml血液以提供40ml/培养瓶的总体积。在将血液培养瓶放入血液培养箱之前,取出5ml的等分试样。每30分钟,我们控制血液培养瓶是否已在血液培养箱中指示阳性。至阳性的时间(TTP)示于图7,并且在所述组之间没有发现显著不同。在培养之前已取出等分试样的烧瓶和没有取出等分试样的烧瓶之间没有发现显著差异。实施例8-从血液培养瓶的等分试样的无菌取样.将分成三组(每组8个)的24个血液培养瓶(BCF)如指示进行处理:第1组:利用针头刺穿隔膜第2组:在用针头刺穿之前具有在隔膜上擦拭的大肠杆菌的10^8CFU/ml肉汤第3组:没有刺穿隔膜用于各个BCF使用无菌一次性使用针头。将BCF放入血液培养箱中并允许静置五天。在第1组或第3组BCF中的任一个中都没有指示生长。在第2组中的八个BCF中的一个在五天内变为阳性,表明如果小瓶被重度污染,在提取等分试样之前对于隔膜去污染的潜在需要(参见表1)。表1当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1